La homeostasis del potasio se logra ajustando la ingesta con la excreción y asegurando una distribución adecuada entre los compartimientos líquidos extra e intracelular. Aproximadamente el 2% del potasio corporal total se encuentra en el líquido extracelular mientras que el 98% del potasio intercambiable se encuentra en el compartimento intracelular, estableciendo el potencial de membrana plasmática en reposo de las células. El riñón es el principal responsable del manteniendo del contenido de potasio corporal total, con intercambio del potasio entre compartimentos reduciendo la fluctuación (por ejemplo, la insulina posprandial desplaza el potasio de la dieta a las células aumentando la actividad de la Na-K-adenosina trifosfatasa [ATPasa] hasta que el riñón excreta la carga de potasio) [1] [2].
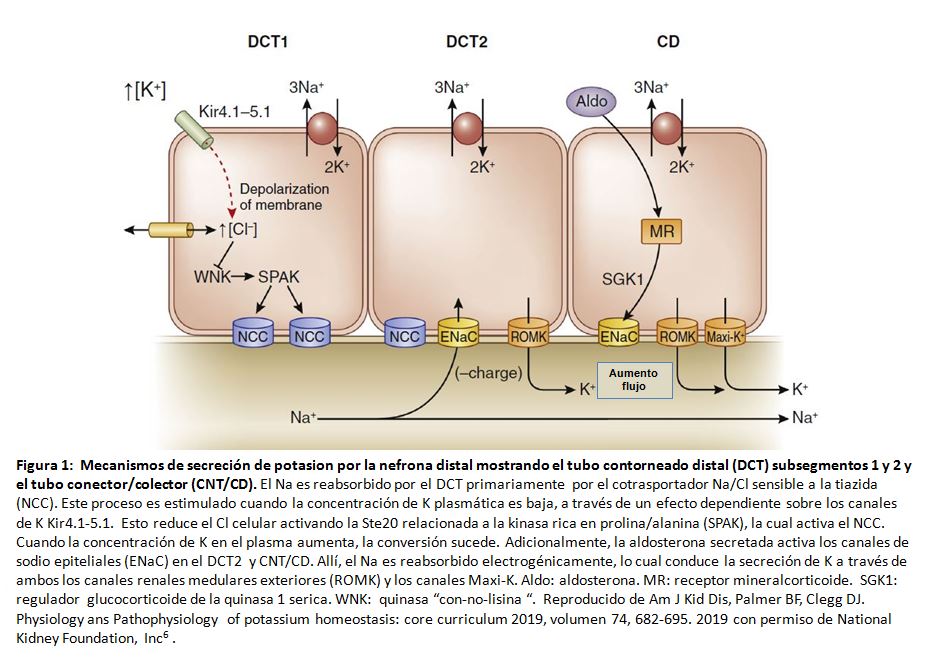
Manejo de potasio por el riñón.Aproximadamente el 90% del potasio filtrado se reabsorbe a lo largo del túbulo proximal y asa ascendente de Henle, independiente de la ingesta de potasio [3]. La excreción urinaria de potasio resulta principalmente de la secreción de potasio a lo largo de la nefrona distal sensible a la aldosterona [4]. La secreción tubular de potasio está mediada por 2 tipos de canales apicales de potasio (Figura 1) [5] [6]. El voltaje de la luz electronegativo se genera en gran medida por la reabsorción de sodio a través de los canales epiteliales de sodio localizados en la membrana apical. La aldosterona estimula actividad del canal epitelial de sodio a través de los receptores de mineralocorticoides, que aumentan tanto el número de canales como la probabilidad de apertura [7].
Los principales determinantes de la excreción de potasio son factores que regulan la secreción de potasio a lo largo de la nefrona distal sensible a la aldosterona e incluyen: suministro luminal de sodio y flujo, concentración de potasio en plasma, aldosterona circulante y arginina vasopresina, y estado ácido-base [8]. Una fracción de secreción cortical renal de potasio se reabsorbe, principalmente en la médula; la deficiencia de potasio aumenta la reabsorción de potasio. Las bombas responsables de la absorción de potasio (H, K-ATPasas) también son estimuladas por la aldosterona u otros mineralocorticoides. La elevación del potasio plasmático facilita la excreción de potasio incluso cuando la concentración de aldosterona se mantiene constante [9].
La aldosterona activa los canales de sodio epiteliales [10] y conduce a una retención de sodio y también a una reducción de la concentración plasmática de potasio, y al menos durante la infusión exógena, esto refleja predominantemente una entrada de potasio en las células [11]. Cuando la secreción de aldosterona es estimulada por depleción del volumen de líquido extracelular ,típicamente mediado por angiotensina II, la disminución de la llegada de sodio al túbulo contorneado distal y al conducto colector previene la pérdida de potasio, a pesar de la secreción estimulada [12]. En contraste, cuando la secreción de aldosterona en plasma está mediada por aumento la concentración de potasio en plasma, juega un papel crítico en defensa contra la hipercalemia a través de los efectos renales y extrarrenales [9].
Trabajos recientes han descrito ritmos circadianos [13] [14] [15] [16] y dimorfismo sexual [17] [18] [19] (resumido en Palmer y Clegg [6]) afectando el manejo tubular y un canal BK colónico sensible a la aldosterona [20] [21] [22] [23] [24] [25] [26] [27] [28]; si estos hallazgos conducirán a mejores oportunidades para la individualización de la atención o posible nuevos objetivos farmacológicos aún no están definidos.
El interruptor de potasio.El síndrome de Gitelman y el Pseudohipoaldosteronismo tipo 2 ayudaron a identificar un papel previamente no reconocido para el túbulo contorneado distal modulando la excreción renal de potasio. En la primera, la disfunción del cotransportador de NaCl sensible a tiazidas conduce a la pérdida masiva de potasio y la hipocalemia [29]. Y en la segunda ,una mayor actividad de cotransportador de NaCl conduce a retención de potasio e hipercalemia [30] [31]. La concentración plasmática de potasio es un factor predominante que regula la actividad de cotransportador de NaCl sensible a tiazidas [32] y también controla la secreción de aldosterona [33]. Los efectos de la concentración plasmática de potasio en la secreción distal de potasio son amplificados por efectos a lo largo del túbulo proximal y el asa de Henle, modulando así la excreción de potasio. Juntas, estas ideas han resuelto en gran medida la "paradoja de la aldosterona" [34] [35], la observación de que una sola hormona, la aldosterona, puede mediar la retención de sodio en algunas situaciones y la excreción de potasio en otras. En otras palabras, la hipercalemia estimula la secreción de potasio sin retención de sodio, y en la depleción de volumen, el sodio es retenido pero el potasio no se pierde.
La aldosterona también activa el transporte de sodio y el potasio a lo largo de la nefrona distal sensible a la aldosterona fosforilando los receptores de mineralocorticoides en las células intercaladas, lo que reduce su actividad. Bajo estas condiciones, la aldosterona estimula la reabsorción electrogénica de sodio y, por lo tanto, la secreción de potasio en las células principales [36]. En contraste, cuando se estimula la aldosterona en el contexto de depleción de volumen de líquido extracelular, la angiotensina II defosforila los receptores de mineralocorticoides en las células intercaladas, permitiendo que la aldosterona active las bombas protón apical (H-ATPase y H, K-ATPases) y el intercambiador de cloruro / bicarbonato, pendrin. Esto proporciona un camino para la absorción electroneutral de cloruro de sodio, previniendo la pérdida excesiva de potasio [37].
Efectos diuréticosLos diuréticos de asa y túbulo contorneado distal causan pérdida de potasio. Los diuréticos que actúan sobre el túbulo contorneado distal son más potentes, causando una kaliuresis inicial al aumentar el flujo distal y suministro de sodio. Este efecto disminuye con el uso crónico y la hipocalemia está estrechamente relacionada con la elevación en la concentración de aldosterona [38], con reducción típica de la concentración de potasio en plasma de solo 0.2 mmol / L [39]. La hipercalemia puede resultar de diuréticos ahorradores de potasio que inhiben la actividad del canal de sodio epitelial en la parte sensible a la aldosterona de la nefrona distal, especialmente con la edad avanzada, riñón con afectación renal o administración conjunta de otras drogas [40].
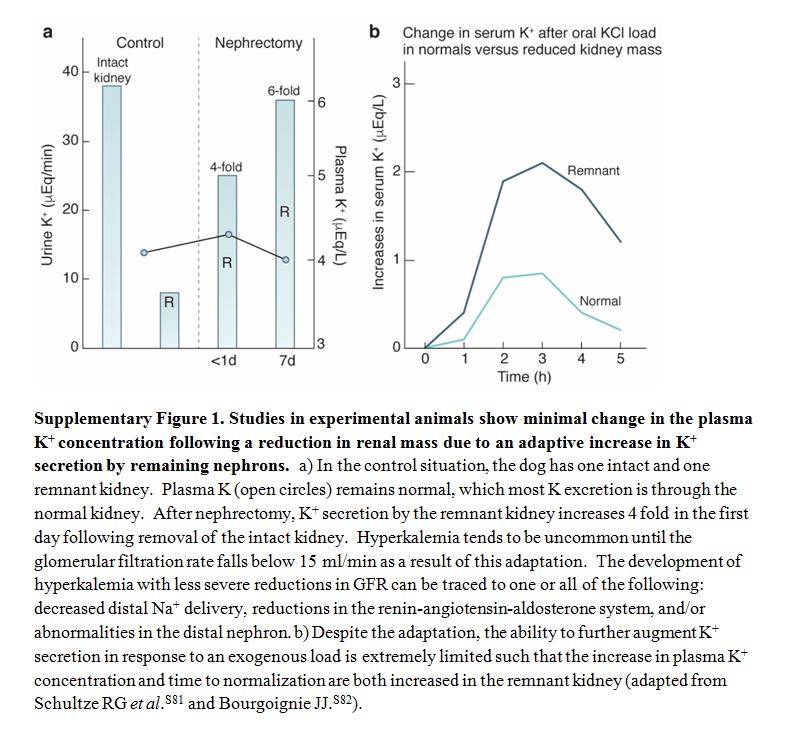
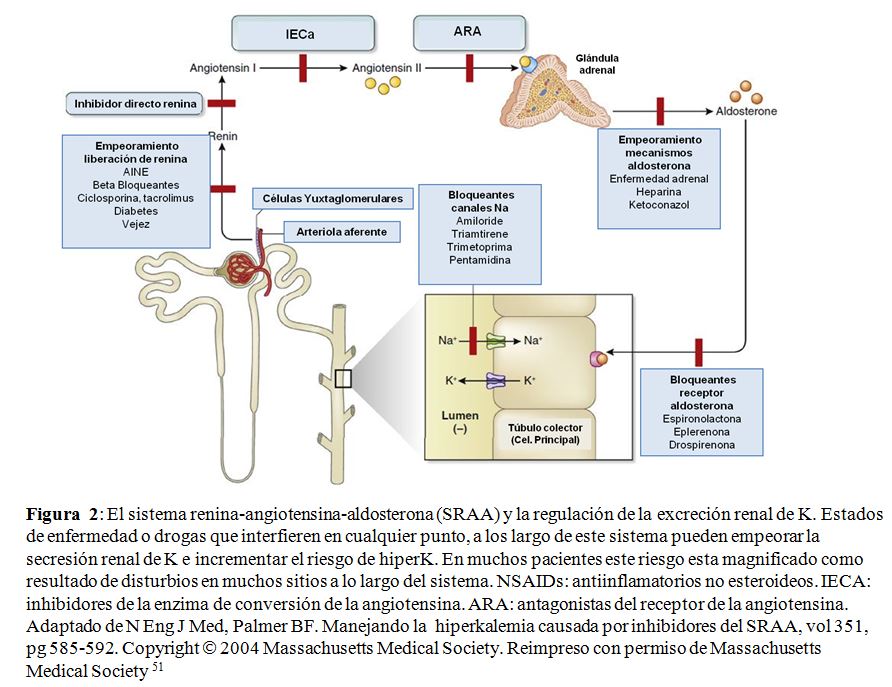
Homeostasis de potasio en la enfermedad renal crónica.La hipercalemia es poco frecuente cuando la tasa de filtración glomerular (TFG) es mayor de 60 ml / min por 1.73 m2 y aumenta la prevalencia con TFG inferior [41] [42] [43]. La hipercalemia en personas con TFG preservada es menos frecuente y se asocia más comúnmente con seudohipercalemia, aumentos transitorios de potasio causado por el desplazamiento celular y el deterioro de la excreción de potasio inducido por fármacos [44]. La homeostasis en situaciones con baja población nefronal resulta de un aumento adaptativo en la secreción de potasio en las nefronas restantes, 45 que se cree que es similar a lo que ocurre en personas sanas sometidas a alto consumo de potasio en la dieta. La carga crónica de potasio aumenta la capacidad secretora de la nefrona distal para que la excreción renal de potasio aumente significativamente para cualquier concentración plasmática de potasio. El aumento de la secreción de potasio bajo estas condiciones ocurre en asociación con cambios estructurales caracterizados por hipertrofia celular, aumento de la densidad mitocondrial y proliferación de la membrana basolateral en las células de la nefrona distal y las células principales del conducto colector [46]. El aumento del potasio sérico y los mineralocorticoides inician independientemente la amplificación proceso, que se acompaña de un aumento en la actividad de Na-K-ATPasa. La pérdida de masa renal también conduce a un aumento en el flujo y distribución de sodio y reabsorción de sodio en el tubo colector en las nefronas restantes [47]. El aumento de la entrada de sodio apical proporciona un efecto estimulante adicional sobre la actividad Na-K-ATPasa. A pesar de esta adaptación, la capacidad de aumentar la secreción de potasio en respuesta a una carga exógena es limitada y la hipercalemia puede resultar incluso con aumentos modestos en ingesta de potasio (Figura complementaria S1) (Figura 7) [48] [49]. Cuando TFG es Cuando < 15 ml / min por 1.73 m2, pequeñas pérdidas de la función renal requieren aumentos progresivamente más pronunciados de la concentración de potasio en suero para mantener el equilibrio total de potasio en el cuerpo. Por encima de ese umbral, se desarrolla hipercalemia debido a la disminución del suministro distal de sodio (como en personas con insuficiencia cardíaca descompensada), reducciones en la actividad mineralocorticoide (como en el hipoaldosteronismo hiporeninémico en personas con diabetes), o función anormal del túbulo colector (como en personas con enfermedad renal tubulointersticial [44] [50] [51] (Figura 2).
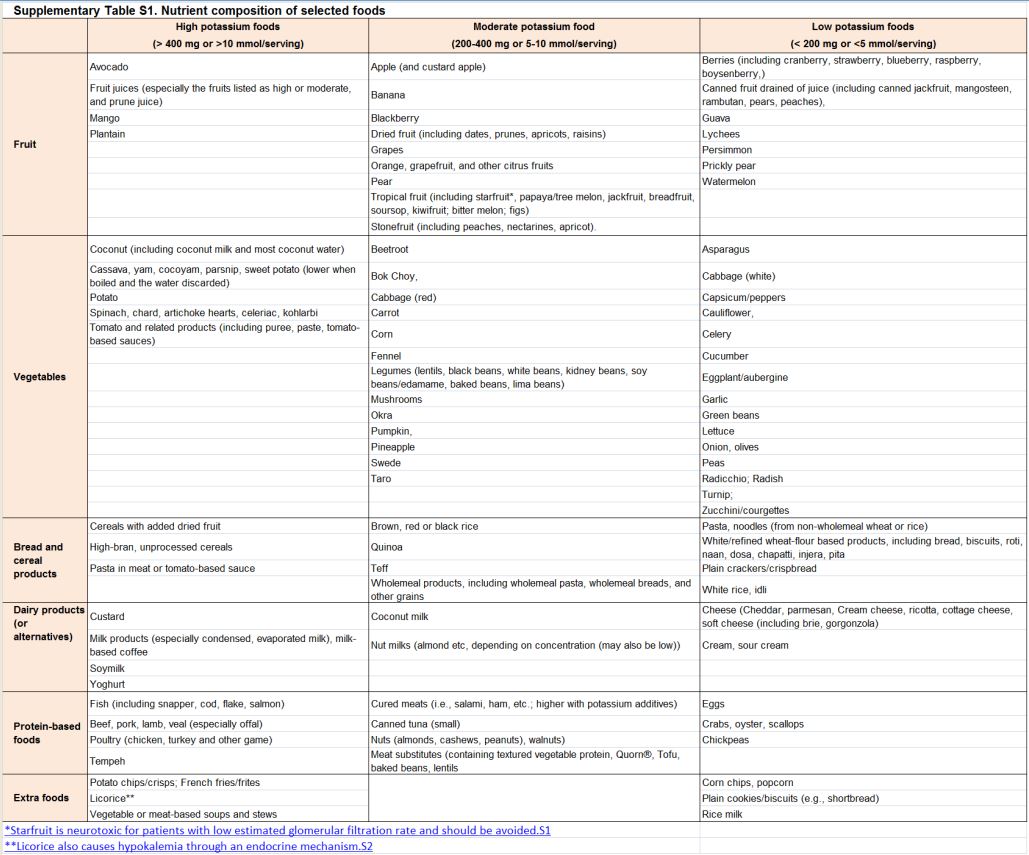
Ingesta de potasio y resultados en salud y enfermedad Fuentes dietéticas y medición de la ingesta de potasio.Frutas y verduras, la carne, las aves y el pescado son importantes fuentes de potasio (Tabla complementaria S1) (Tabla 7). Los patrones de alimentos asociados con la ingesta de potasio y las fuentes de potasio en la dieta varían en todo el mundo [52] [53]; el estimado diario de la ingesta de potasio oscila entre aproximadamente 52 mmol (2,1 g) en China, 68 mmol (2.6 g) en los Estados Unidos, a 125 mmol (4,8 g) en España [53] [54] [55]. Las dietas ricas en potasio son generalmente consistentes con patrones dietéticos considerados saludables; una típica dieta mediterránea puede proporcionar hasta 155 mmol/d (6 g/d) de potasio, mientras que un enfoque dietético para control de hipertensión (DASH) contribuiría hasta 120 mmol/d (4,7 g/d) [56].
La biodisponibilidad del potasio en la dieta está influenciada por el consumo de otros nutrientes que afectan el metabolismo del potasio (la ingesta de carne conduce a la producción neta de ácido, pero la ingesta de frutas y verduras conduce a una producción neta de base) junto a otros nutrientes como vitaminas, antioxidantes, carbohidratos y fibra. En comparación con carne con alto contenido de potasio, frutas y verduras con alto contenido de potasio, pueden promover la entrada intracelular de potasio y excreción de potasio en heces al aumentar el volumen fecal a través de la fibra dietética [57]. Los sustitutos de la sal, aditivos alimentarios y conservantes son importantes fuentes ocultas de potasio que contribuyen significativamente a la ingesta diaria total (p. ej., los conservantes de potasio en la carne preparada pueden agregar 300-575 mg de potasio por 100 g de ingesta) [58] [59] [60]. El uso de cloruro de potasio en la sustitución de sal está aumentando, en parte como resultado de las campañas de salud pública internacional para reducir el consumo de sodio. Típicamente el 20% de la sal se reemplaza por cloruro de potasio, agregando aproximadamente 12 mmol/d (0,45 g/d) a la ingesta habitual [61]. La seguridad de la sustitución, particularmente en etapas más avanzadas de enfermedad renal crónica (ERC), requiere mayor investigación.
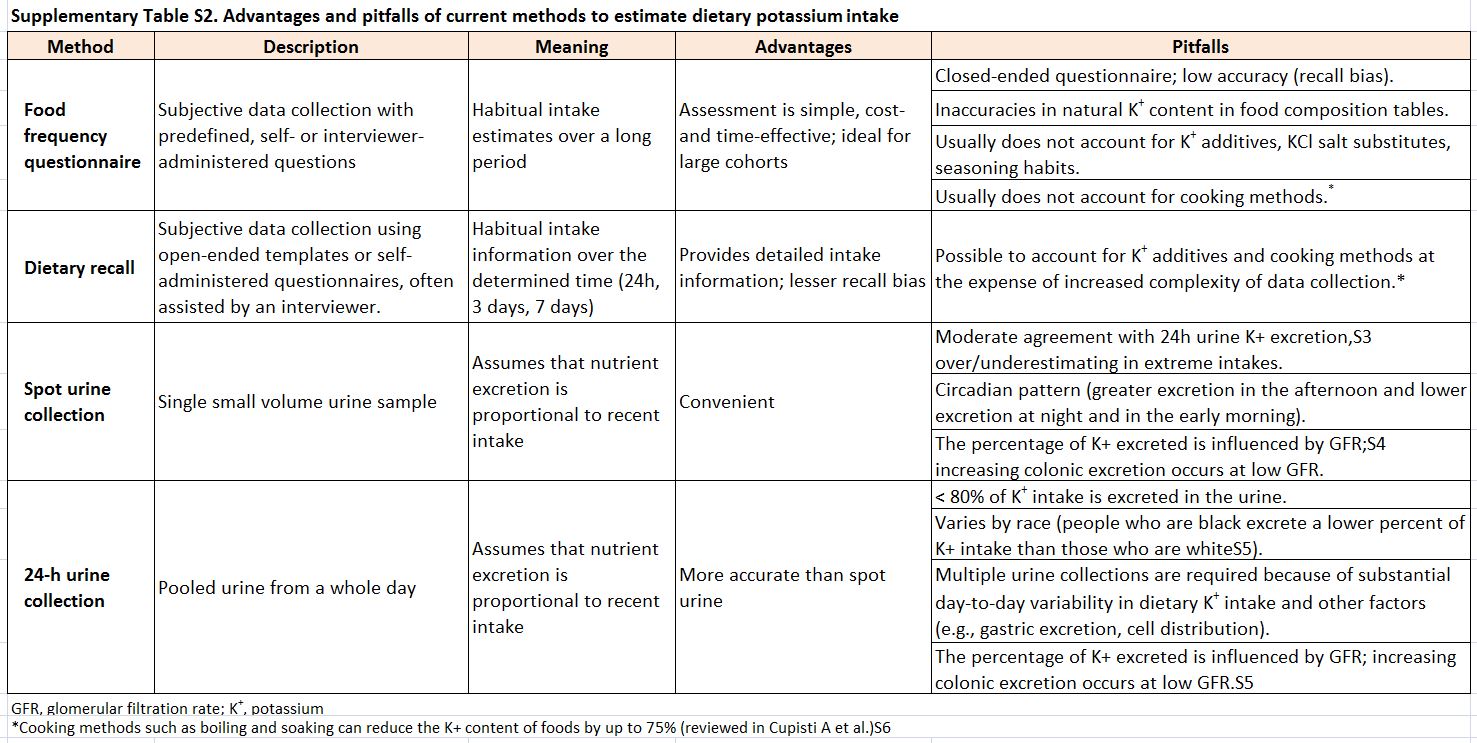
La (Tabla complementaria S2) (Tabla 8) describe las ventajas y errores de los métodos disponibles para estimar el potasio en la dieta.
Potasio en la dieta en la población general.Un reciente metaanálisis de 22 ensayos clínicos y 11 estudios de cohortes en la población general concluyó que el aumento de potasio en la ingesta redujo la presión arterial sistólica en 3.5 mm Hg (95% intervalo de confianza [IC]: 1.8-5.2) y la presión diastólica 2.0 mm Hg (IC 95%: 0.9-3.1), 62 principalmente en pacientes adultos con hipertensión y sin una relación clara de dosis-respuesta [63] [64]. Los metanálisis de los ensayos de suplementación con potasio versus placebo informan un resultado consistente en reducción del riesgo de accidente cerebrovascular (cociente de riesgos, 0,76; IC del 95%: 0.66-0.89) [65] [66] pero no enfermedad cardiovascular o coronaria [62].
Potasio en la dieta en personas con ERC.Para prevenir la hipercalemia en pacientes con ERC avanzada y etapa final de enfermedad renal que se someten a hemodiálisis, las pautas basadas en opiniones recomiendan una dieta baja en potasio (Tabla complementaria S3) (Tabla 9). Esta práctica está muy extendida y los estudios que evalúan el cumplimiento de las recomendaciones dietéticas en los pacientes sometidos a hemodiálisis informan constantemente de la baja ingesta de potasio con la correspondiente baja ingesta de frutas, verduras y otros compuestos derivados de plantas (por ejemplo, fibra, vitamina C y carotenoides) [67] [68]. Sin embargo, estudios observacionales en personas con ERC o ERC en fase terminal informan asociaciones débiles entre la ingesta de potasio en la dieta y la concentración sérica de potasio [69] [70] [71] [72] desafiando la creencia de que la cantidad del potasio consumido influye fuertemente en la concentración de potasio.
En un estudio de equilibrio en 1990 sobre personas sanas, la carga de potasio (400 mmol / d) aumentó la excreción de potasio en 3.7 veces en 24 horas (que rápidamente volvió a la línea de base cuando se interrumpió la suplementación) con 1.1 veces de aumento de potasio en plasma [73]. Se han observado efectos similares en metanálisis de ensayos de suplementos de potasio en los que la diferencia de medias ponderada excreción de potasio en orina fue de 46 mmol / d (IC 95%: 38-54) pero el aumento correspondiente en el potasio sérico fue de 0.14 mmol/L (IC 95%: 0.09-0.19) [74]. Los estudios comparables en pacientes con ERC son escasos. En la década de 1940, los estudios en 15 personas con ERC que consumieron de 2 a 5 g de sales de potasio mostraron alteración del aclaramiento renal de potasio y potasio circulante elevado [75] [76] que conduce a la precaución en el uso de diuréticos ahorradores de potasio, inhibidores de la enzima convertidora de angiotensina y bloqueantes del receptor de angiotensina en pacientes con ERC avanzada. En otro estudio de pacientes sometidos a hemodiálisis, una ingesta oral de 0.25 mmol / kg de cloruro de potasio aumentó el potasio sérico en 0.4 mmol/L a las 3 horas [77]. En la ERC se producen múltiples mecanismos compensatorios para mantener la homeostasis del potasio, incluida la disposición intracelular del potasio de la dieta [78] (p. ej., amortiguación extrarrenal influenciada por el equilibrio ácido [79] secreción de insulina[80] [particularmente cuando está acompañado de carbohidratos y azúcar concomitantes [77] y aumento de la excreción en colon [20] (atribuido al aumento del número de canales de potasio de gran conductancia en células epiteliales del colon) [20] [81]. Todos los informes mencionados anteriormente utilizan dosis de suplementos de potasio que exceden las diferencias que generalmente se logran con la dieta.
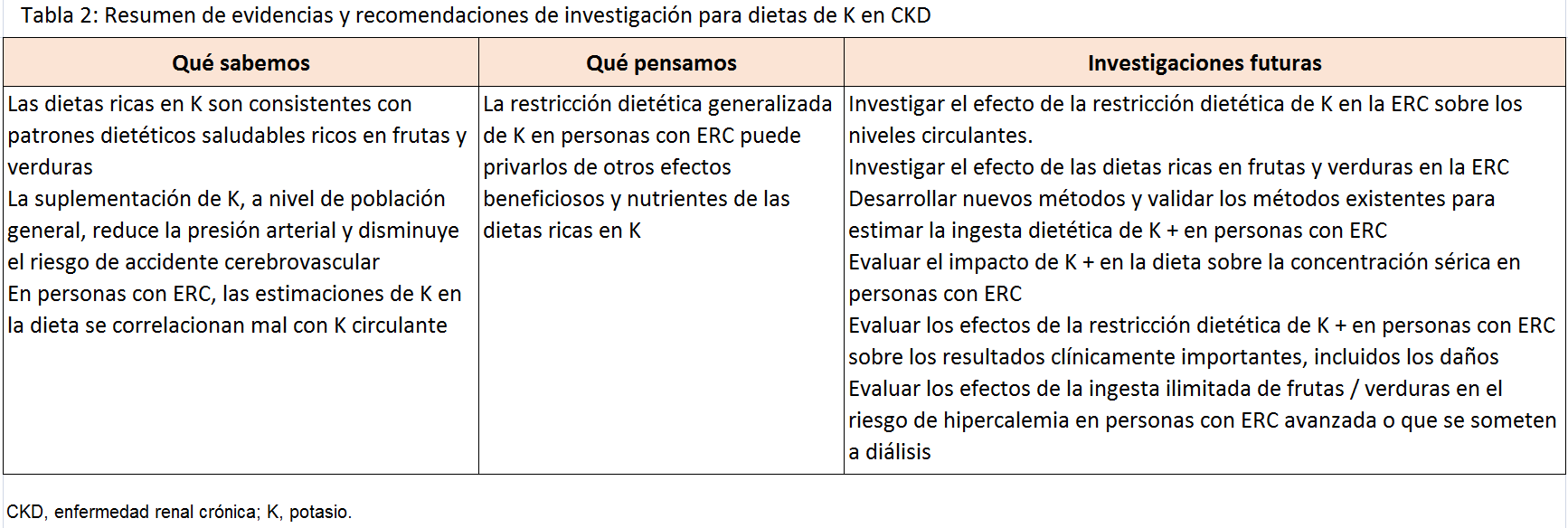
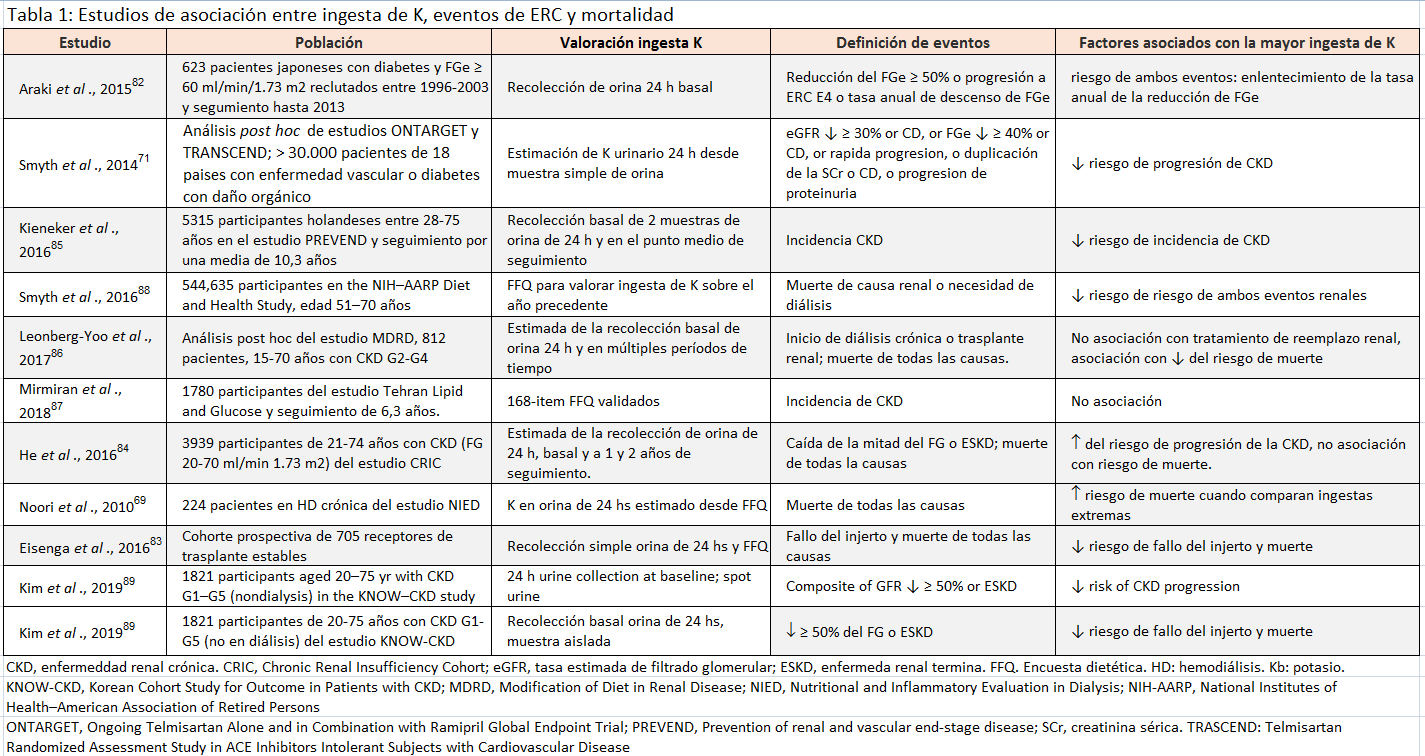
Múltiples informes observacionales en diferentes grados de ERC exploran la asociación entre la ingesta de potasio en la dieta y resultados que son importantes para los pacientes (Tabla 1) [69] [71] [82] [83] [84] [85] [86] [87] [88] [89]. En la mayoría de ellos, el alto consumo de potasio se asoció con un menor riesgo de muerte o progresión de la enfermedad renal.
No está claro si las asociaciones observadas se explican por la ingesta de potasio o porque el potasio sea marcador del elevado consumo de vegetales [90] [91] [92] o patrones de alimentación específicos [93] [94] [95], ya que ambos se han asociado con mejores resultados en personas con y sin enfermedad renal. Estudios observacionales en pacientes con ERC [96], en receptores de trasplante renal [97] y en pacientes sometidos a hemodiálisis [98], se ha asociado una ingesta de vegetales elevada con menor mortalidad cardiovascular. No fueron reportadas las concentraciones de potasio ni la incidencia de hipercaliemia
Pocos ensayos han evaluado el impacto de la modificación de potasio en la dieta en personas con ERC. Un reciente ensayo controlado aleatorio de 42 pacientes con ERC G3a-G4 comparó el consejo dietético centrado en la restricción de potasio (con poliestirenosulfonato de sodio si no se alcanzó el potasio en suero < 4,5 mmolL) con asesoramiento nutricional general durante 24 meses; se observaron reducciones significativas en la puntuación de neuropatía con la restricción de potasio [99]. Otro ensayo controlado aleatorio de pacientes con ERC G4, hipertensión pero sin diabetes, comparó frutas y verduras ricas en alcalinos con bicarbonato de sodio durante 1 año, sin observar cambios en el potasio sérico o episodios de hiperpotasemia [100]. Finalmente, 2 estudios piloto que investigan la seguridad y la aceptabilidad de una dieta DASH en pacientes con ERC G3-G3b no informaron cambios en el potasio plasmático y ningún evento adverso de hipercalemia después de 2 semanas [101] y 5 semanas. Si la suplementación con potasio condiciona renoprotección está siendo examinado en el estudio "K en ERC" [72].
No hay una evidencia directa en apoyo de la recomendación actual para restringir el potasio en la dieta en pacientes con ERC; sin embargo, tampoco encontramos evidencia de que el aumento de la ingesta de potasio o la liberalización de las restricciones de potasio, en pacientes con ERC avanzada sea seguro. Mientras reconocemos que la restricción de potasio en la dieta es una estrategia válida para tratar la hipercalemia aguda, planteamos la hipótesis de que la restricción de potasio como estrategia general para prevenir la hipercalemia en personas con ERC puede privar a los pacientes de los efectos beneficiosos asociados con las dietas ricas en potasio.
Recomendamos que se realicen ensayos intervencionistas para clarificar unos consejos óptimos de potasio en la dieta para pacientes con ERC (Tabla 2). En ausencia de este trabajo, sugerimos desarrollar material educativo que muestre el contenido de potasio en alimentos, que promuevan alimentos bajos en potasio a base de vegetales para usar cuando los médicos crean que cambiar los alimentos ricos en potasio está clínicamente indicado, con énfasis en un patrón dietético saludable general como la dieta mediterránea y el índice de alimentación saludable.
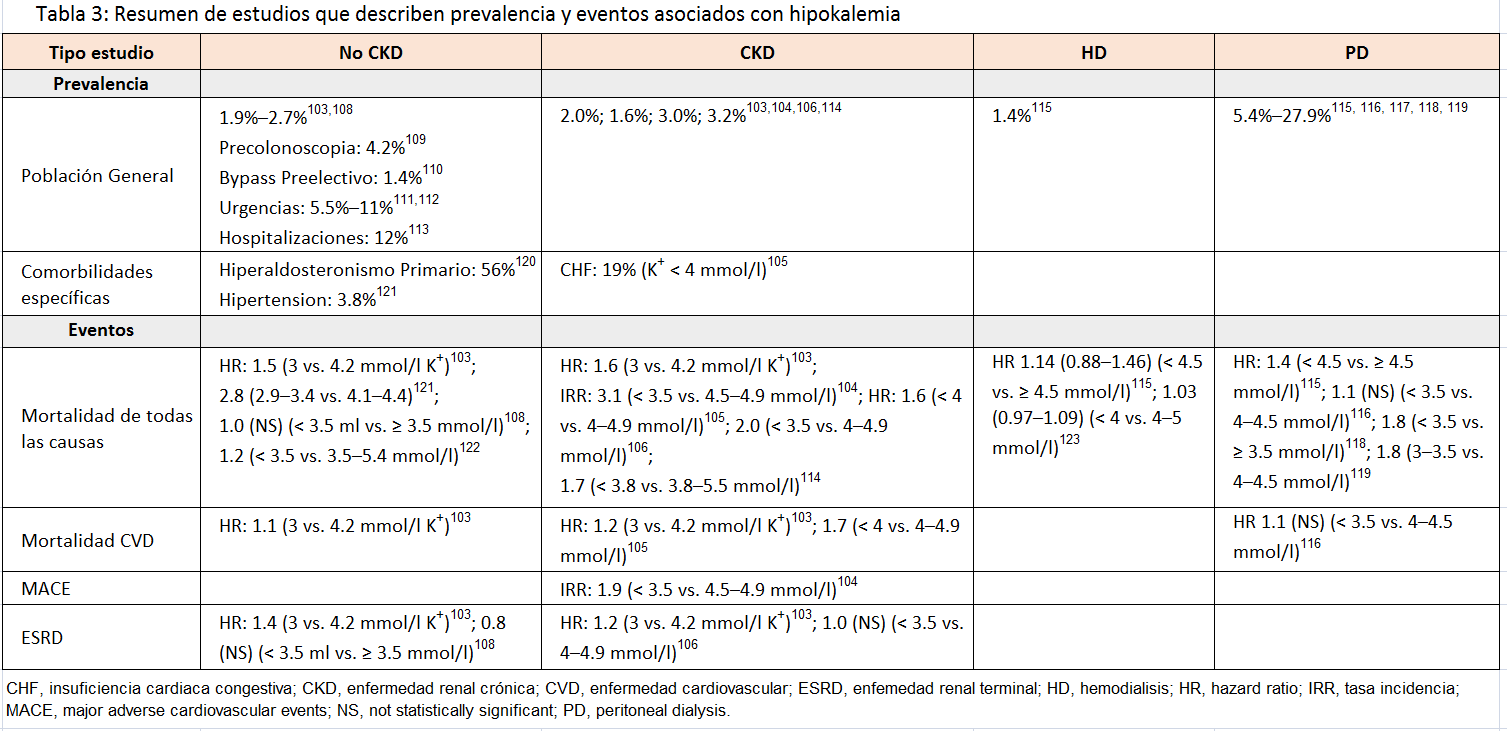
HipopotasemiaLa hipopotasemia, definida como una concentración de potasio <3,5 mmol/l, afecta aproximadamente del 1% al 3% de la población general y con ERC, y su prevalencia e importancia clínica son poco reconocidas (Tabla 3) [103] [104] [105] [106] [107] [108] [109] [110] [111] [112] [113] [114] [115] [116] [117] [118] [119] [120] [121] [122] [123]. Así, los pacientes en diálisis a los que generalmente se les atribuye un alto riesgo de hiperpotasemia, también pueden tener hipocalemia, con una prevalencia estimada del 1% al 2% entre los que reciben tratamiento con hemodiálisis y que puede llegar al 5%¿22% entre los tratados con diálisis peritoneal, aunque esta tasa varía según el país [115] [116] [117] [124].
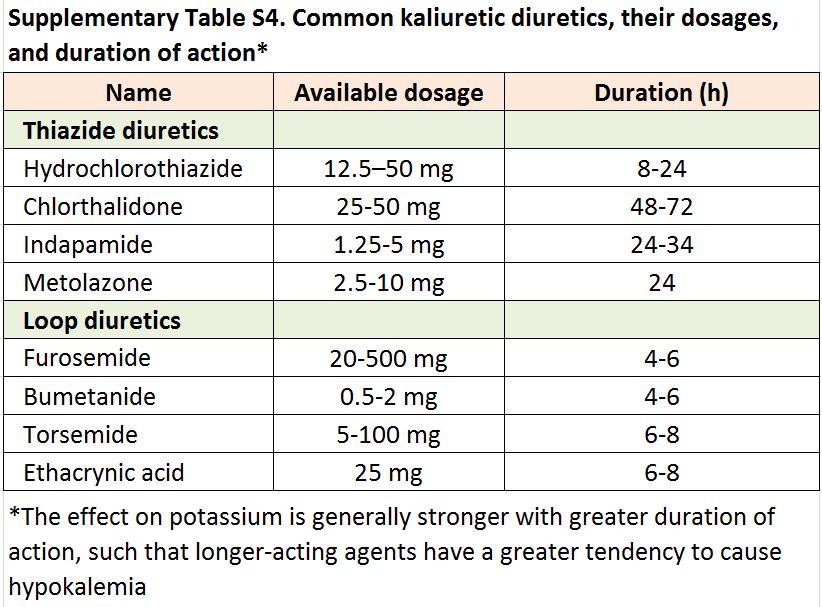
La pérdida renal de potasio como consecuencia del uso de fármacos es una causa común de hipopotasemia en adultos (Tabla complementaria S4) (Tabla 10) [125] [126] [127] [128] [129] [130] especialmente con tiacidas, que aumentan el riesgo de hipopotasemia 5 veces [131]. Otros diagnósticos comunes incluyen la hipertensión minerolocorticoide-dependiente, las tubulopatías y las pérdidas gastrointestinales [132] [133]. Casi una cuarta parte de los pacientes de alto riesgo presentan hipopotasemia después de la preparación intestinal para una colonoscopia [109]. En pacientes en diálisis, las causas más habituales son el uso de concentraciones bajas de potasio en el líquido de diálisis, la restricción dietética de potasio y la desnutrición [117] [118] [123].
En la hipopotasemia aguda grave, se estima que del 25% al 66% pueden presentar cambios en el electrocardiograma (ECG), como una onda U y arritmias ventriculares [111] [112] [134] [135]. El riesgo de mortalidad asociado con hipocalemia puede ser mayor que el asociado con hiperpotasemia, incluso en pacientes con ERC y en diálisis [103] [104] [114] [116] [119] [121]; sin embargo, los estudios que relacionan hipocalemia con resultados adversos son observacionales y con variables de confusión no-controlada [105] [108] [114] [136].
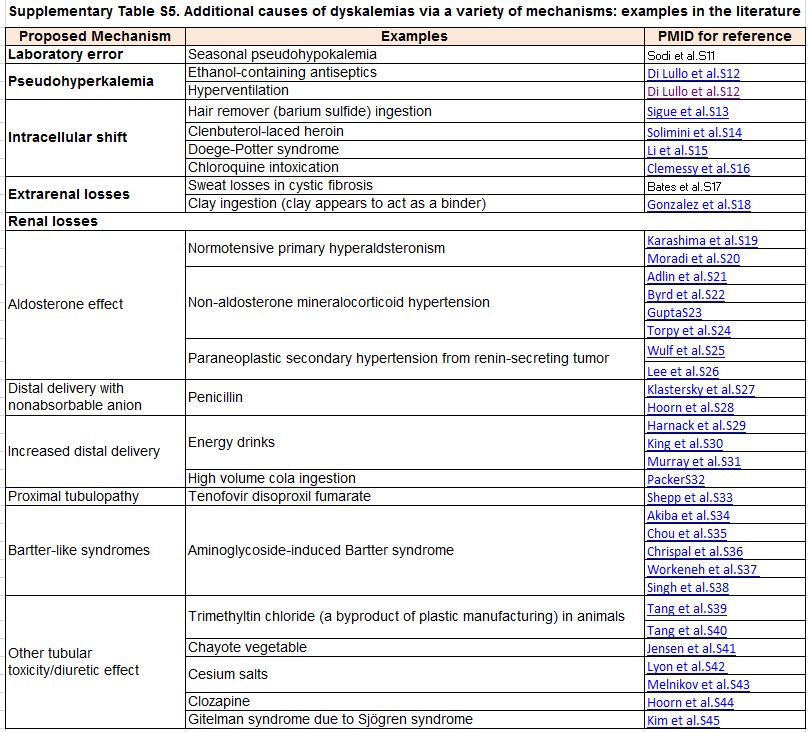
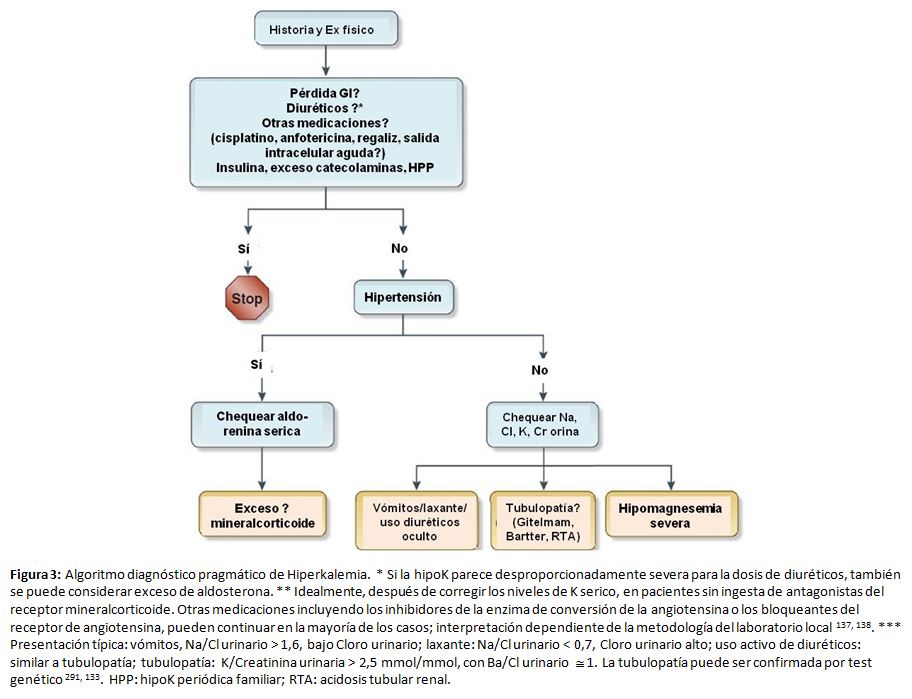
Sugerimos un enfoque novedoso y práctico para hipopotasemia, identificando las causas más comunes (Figura 3) [29] [133] [137] [138]. Mediante la historia clínica y la exploración física se puede diagnosticar la hipopotasemia provocada por medicamentos o la relacionada con pérdidas por el tracto gastrointestinal. La presencia de hipopotasemia con hipertensión y FG normal debería hacer sospechar un hiperaldosteronismo; en esos casos el cociente renina:aldosterona en sangre puede ser diagnóstico [139]. Para las pruebas bioquímicas iniciales, sugerimos que se suspendan solo los antagonistas de los receptores de mineralocorticoides; sin embargo, en pacientes con un alta probabilidad de hiperaldosteronismo antes del test y los que tengan resultados dudosos del cociente renina:aldosterona, la prueba del cociente renina:aldosterona debe repetirse o hacerse después de suspender los diuréticos y inhibidores del sistema renina-angiotensina-aldosterona (SRAA) [140]. Esta estrategia puede conducir al diagnóstico de un adenoma suprarrenal tratable de forma quirúrgica [137] [138] [141]. Es importante, conocer que la interpretación del cociente renina:aldosterona depende de los métodos de cada laboratorio, incluido el límite inferior de detección de renina. En pacientes normotensos sin causa evidente de hipopotasemia, la medición en una muestra de orina de la concentración de sodio y cloro ayuda a diferenciar una tubulopatía de causas subrepticias [133] y las tubulopatías hereditarias pueden confirmarse con pruebas genéticas [142]. Cuando no se encuentra una explicación clínica, se ha sugerido medir potasio en orina, particularmente la proporción concentración de potasio y creatinina [143] [144] [145] aunque la evidencia reciente sugiere que esta medida tiene una alta variabilidad intraindividual y falta de especificidad [146] [147]. El gradiente de potasio transtubular, propuesto como herramienta diagnóstica, tiene demasiadas limitaciones para su recomendación [133] [145] [148] [149]. En la (Tabla complementaria S5) (Tabla 11), se resumen etiologías raras.
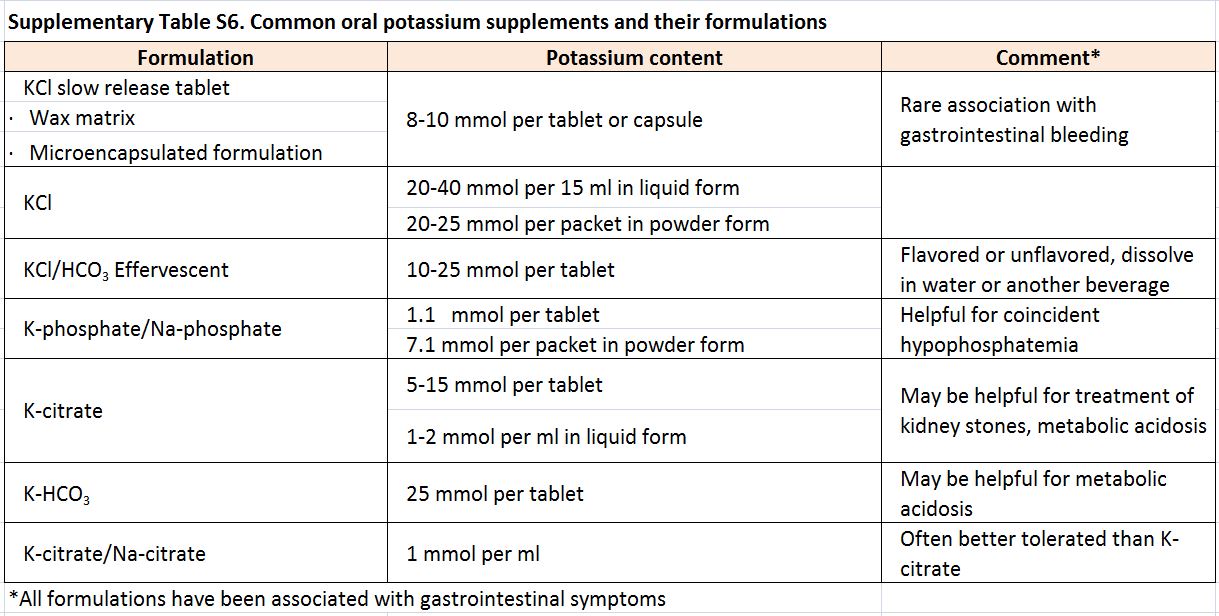
El tratamiento de la hipopotasemia tiene como objetivo prevenir las complicaciones a corto y largo plazo sin precipitar hiperpotasemia [113] [150]. Múltiples estudios observacionales sugieren que el rango óptimo de potasio es de 4 a 5 mmol/l, [103] [105] [110] [115] [119] pero no se ha definido el umbral de concentración de potasio para iniciar el tratamiento, aplazar procedimientos electivos y derivar al servicio de urgencias. Si se trata de una forma aguda, las decisiones generalmente dependen de la gravedad de la hipocalemia y de la presencia de síntomas o anomalías en el ECG [134]. En un paciente con hipopotasemia grave y parálisis, es importante distinguir una parálisis periódica hipopotasémica de otras causas de hipocalemia, por el riesgo posterapéutico de hiperpotasaemia y recaída en el primer caso [144]. Si la hipocalemia es el reflejo de un déficit de potasio, cada bajada de 0,3 mmol/l de potasio sérico corresponde a un déficit corporal de aproximadamente 100 mmol de potasio [134]. Los suplementos orales son seguros y generalmente se prefieren al aporte intravenoso si la situación no es crítica [74]. Sin embargo, la mayoría de las presentaciones orales tienen un contenido de potasio relativamente bajo (Tabla suplementaria S6) (Tabla 12), y es necesaria una monitorización seriada [122] [151]. El cloruro potásico intravenoso a una velocidad de hasta 20 mmol/h puede ser una alternativa segura en personas con hipopotasemia severa y cuando la ingesta oral no sea posible; es necesario tener en cuenta que altas concentraciones de cloruro de potasio por via periférica puede causar dolor o esclerosis [150] [152]. El tratamiento con potasio puede aumentar la concentración de sodio en el suero [153] y por lo tanto se requiere precaución en la corrección de la hipopotasemia en pacientes con hiponatremia concomitante grave.
Las estrategias para tratar la hipopotasemia crónica deben ser adoptados según la causa subyacente (por ejemplo, la interrupción de los diuréticos si existen terapias alternativas). El aporte crónico de potasio puede ser caro, mal tolerado y precisar un alto número de comprimidos. La iniciación de los inhibidores de SRAA es una alternativa, ya que como antagonistas de los receptores de mineralocorticoides/diuréticos ahorradores de potasio, son en general más eficaces y posiblemente mejor tolerados que los suplementos de potasio [154] [155] [156] [157] [158] [159]. La hipomagnesemia concomitante probablemente no se diagnostica lo suficiente, pero es importante para corregir la hipocalemia [160] [161].
La localización y eliminación de un adenoma productor de aldosterona, en pacientes con hiperaldosteronismo primario, corregirá la hipocalemia y puede mejorar los resultados cardiovasculares [120]. El manejo de las tubulopatías puede ser complejo y la hipocalemia puede no ser completamente corregible [162]. En pacientes en hemodiálisis con hipocalemia, la espironolactona se ha mostrado eficaz [163] [164] En cambio, la inhibición del SRAA en pacientes que reciben diálisis peritoneal puede tener poco efecto sobre la concentración de potasio [165]. También debe considerarse aumentar el potasio en la dieta [151] [166].
Debido a limitaciones de tiempo, el manejo de la hipopotasemia en urgencias no se abordó en la conferencia. Sin embargo, la evidencia actual y las futuras prioridades de investigación en esta área están incluidas en la (Tabla 4).
Hiperpotasemia agudaDefinimos la hiperpotasemia como aguda cuando el potasio está por encima del límite superior de la normalidad, sin que sepamos que pudiera ser crónico. La hiperpotasemia aguda es un hallazgo relativamente frecuente en el servicio de urgencias. En los Estados Unidos, la prevalencia de potasio > 5 mmol/l fue 3,6% [112], mientras que en Suiza la prevalencia de potasio > 4,5 mmol/l, el límite superior de normalidad fue 8,8% [167].
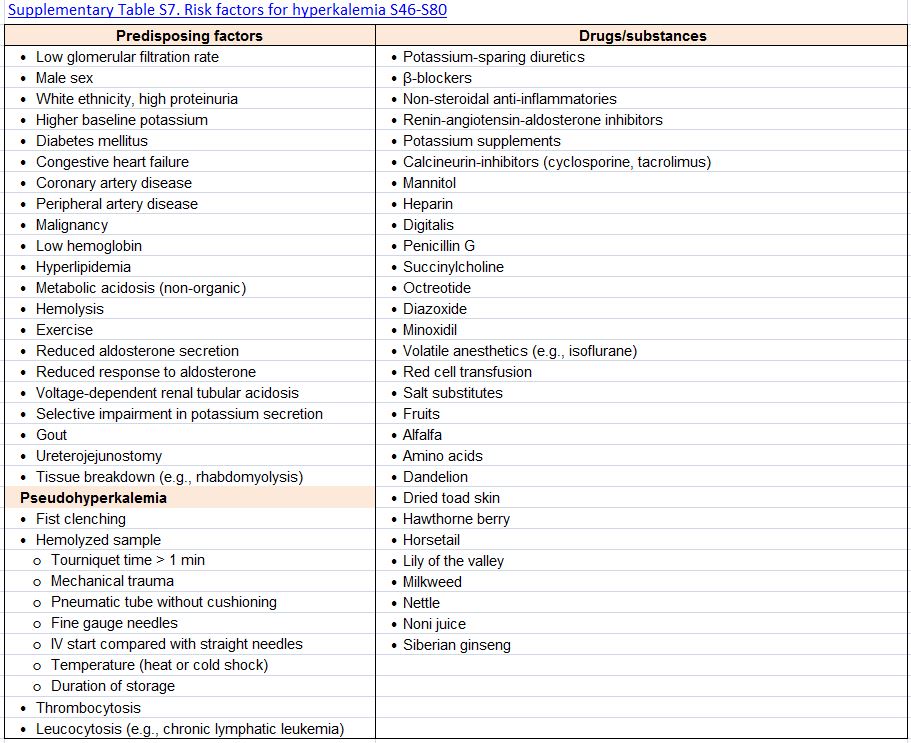
Factores de riesgo.Los factores asociados con una mayor probabilidad de desarrollo de la hipercalemia se resumen en la (Tabla complementaria S7) (Tabla 13). La ERC, ya en los estadios G3a y G3b, está entre los predictores más importantes de hiperpotasemia [103] [126] [168] [169] [170] [171]. Los diuréticos ahorradores de potasio y los inhibidores del SRAA son los fármacos más frecuentemente asociados con hipercalemia.
Diagnóstico.La medición en suero o plasma es válida; los artículos de investigación deben indicar claramente qué método se utilizó (en suero el potasio es 0,1-0,7 mmol/l más alto) [172] [173] [174]. Los dispositivos que trabajan en el punto de atención (point of care) tienen precisión y exactitud limitadas, [175] [176] [177] [178] lo que debería limitar su uso generalizado; sin embargo, algunos dispositivos han demostrado ser lo suficientemente precisos, con diferencias medias de 0,1 a 0,5 mmol/l en comparación con las medidas de laboratorio, pudiendo ser útiles en situaciones agudas [177] [180]. Se puede encontrar una concentración de potasio falsamente elevada por: extracción de la muestra con el puño excesivamente apretado, traumatismo mecánico, uso de torniquete >1 minuto, coagulación de la sangre, aumento de glóbulos blancos o de plaquetas [181] [182] [183].
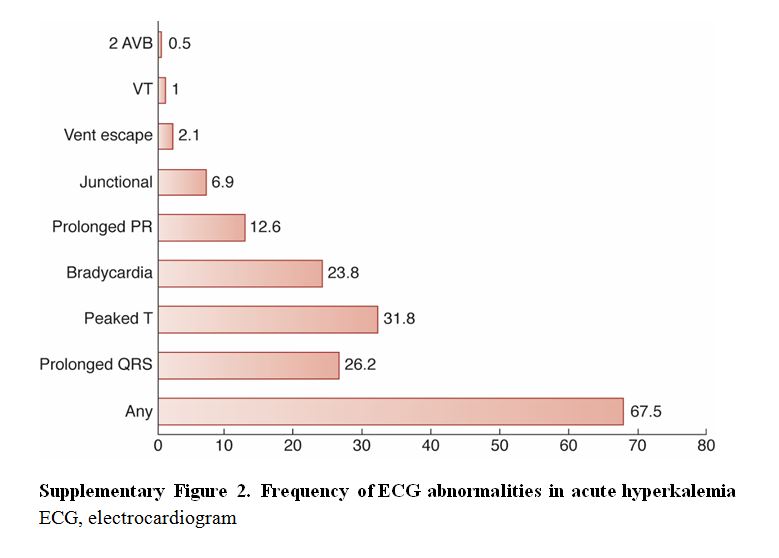
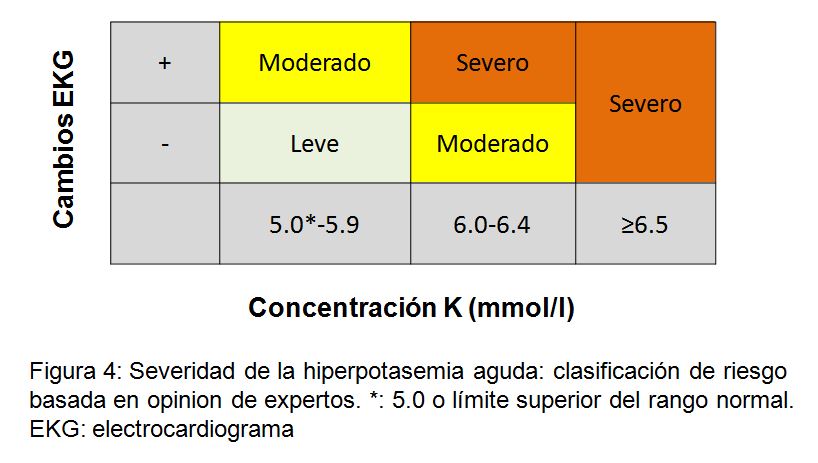
Se han descrito manifestaciones electrocardiográficas de hipercalemia aguda relacionadas con la concentración de potasio [188] [189]. Se considera que la secuencia es: ondas T picudas, prolongación del intervalo PR, ensanchamiento progresivo del complejo QRS, ondas sinusoidales, fibrilación ventricular y asistolia. El cambio más común es la presencia de las ondas T picudas, seguido de prolongación del QRS [187] [190] (Figura complementaria S2) (Figura 8). También se describen bloqueos de conducción. Un estudio retrospectivo con 188 pacientes encontró que la bradicardia (riesgo relativo: 12,3), los ritmos de la unión (riesgo relativo: 7,5) y el ensanchamiento del QRS (riesgo relativo: 4,7), se asociaban con resultados adversos, aunque no fue así con las ondas T picudas [191]. Por esta razón, sugerimos clasificar la hipercalemia como leve, moderada o grave basado en la concentración de potasio y la presencia o ausencia de cambios en el ECG (Figura 4). Sin embargo, se han descrito ECG normales en pacientes con hipercalemia crónica grave [192] y no se sabe si los cambios del ECG son lo suficientemente sensibles para predecir o no una arritmia potencialmente letal.
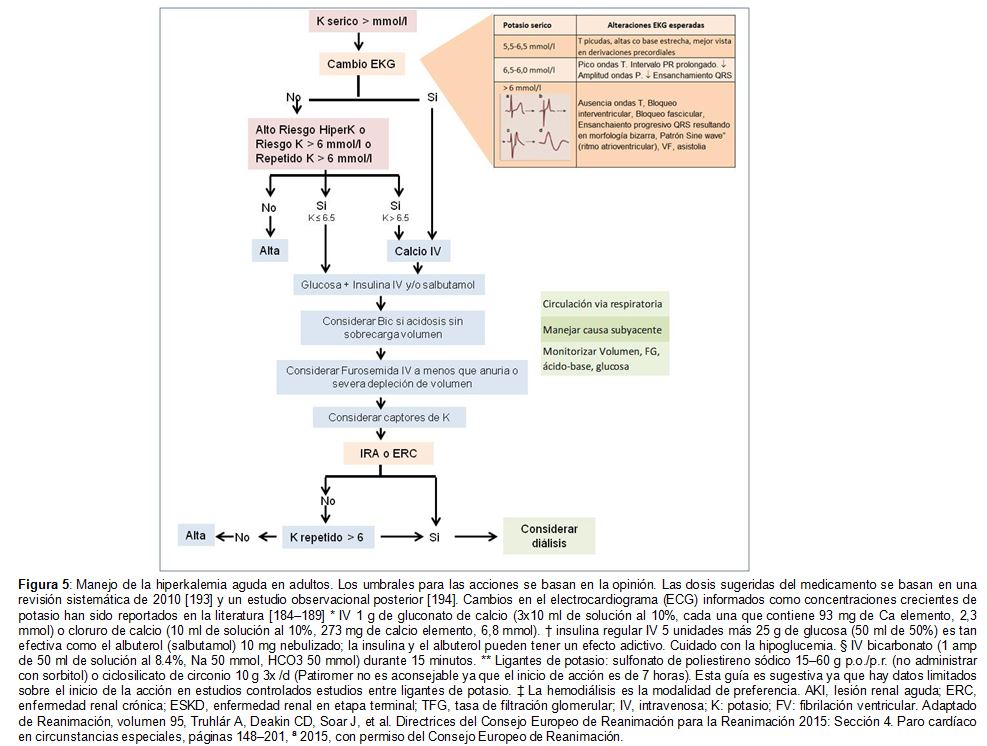
Manejo.Sugerimos que los pacientes ambulatorios con hiperpotasemia aguda que tengan una concentración de potasio > 6,0 mmol/L, o cualquier cambio nuevo en el ECG, deben remitirse a un centro donde pueda realizarse monitorización cardiaca, generalmente un servicio de urgencias [184]. Basamos nuestras sugerencias (Figura 5) [184] [185] [186] [187] [188] [189] [193] [194] [195] en la evidencia disponible, pero hay que tener en cuenta que la mayor parte de la misma se generó con muestras de rutina de pacientes estables con hipercalemia previa a la diálisis y que nuestro algoritmo de síntesis no ha sido aún aceptado. Recomendamos monitorizar los signos vitales, monitorización cardíaca continua y realizar un ECG de 12 derivaciones [184]. Sugerimos repetir la medición de potasio para descartar pseudohiperpotasemia, o si hay hemólisis, basarse en el juicio clínico y la presencia de cambios en el ECG, sopesando la importancia de la verificación frente a la posibilidad de retrasar el tratamiento.
En pacientes hiperpotasémicos con cambios en el ECG, sugerimos la administración de sales de calcio (1000-3000 mg de gluconato de calcio o 1000 mg de cloruro de calcio) [195]. Se puede repetir la dosis si el ECG no se ha modificado 5 minutos más tarde o si los cambios reaparecen. Preferimos el uso de gluconato a cloruro de calcio porque este último puede provocar necrosis de la piel [196]. Sugerimos la administración intravenosa de insulina y glucosa para llevar el potasio dentro de la célula [195]. La administración de 5 unidades de la insulina regular parece ser tan efectiva para reducir la concentración de potasio concentración como la administración de 10 unidades, aunque la evidencia es limitada; la aparición de hipoglucemia es una complicación potencial [197] [198] Además, o como alternativa a la insulina-glucosa, sugerimos la administración de beta-agonistas [195] Usar 10 mg de salbutamol nebulizado reduce significativamente el potasio con un efecto máximo 120 minutos después de su administración (90 minutos con 20 mg) [197] Como efectos adversos están descritos el aumento de la frecuencia cardíaca, temblores, palpitaciones y ansiedad leve [193] El uso concomitante de insulina-glucosa y salbutamol es factible, aditivo y recomendado internacionalmente [199] [200]. En pacientes con acidosis metabólica concomitante, se puede considerar el bicarbonato sódico, aunque los datos sobre su eficacia son contradictorios [201] [202].
Posteriormente, se pueden usar resinas de intercambio de potasio y diuréticos de asa, sobre cuya efectividad no hay evidencia en el contexto agudo. Durante el tratamiento de la hiperpotasemia aguda, se sugiere realizar reevaluaciones frecuentes de potasio, glucosa (en casos de administración de insulina) y ECG. Se debe buscar la causa subyacente de la hiperpotasemia aguda. Sugerimos considerar tratamiento con diálisis en los casos que exista una elevación persistente de la concentración de potasio por encima de 6 mmol/l o los cambios ECG que no respondan al manejo médico.
La (Tabla 5) muestra las áreas de investigación recomendadas [99].
Hiperpotasemia crónicaLa definición de hipercalemia generalmente se basa en la distribución de los valores de potasio en la población general. A pesar de la validez de este enfoque, una definición basada en el pronóstico [203] reflejaría mejor la asociación entre concentración y eventos adversos: el riesgo aumenta de forma continua en relación a la mayor concentración de potasio, y la ERC modifica tanto la distribución de la concentración de potasio [103] como el riesgo asociado [169] [204] [205] [206] [207] La incorporación de factores de riesgo [103] [126] [204] en los modelos de predicción podrían ayudar a una mejor estratificación del riesgo individual [168] [208] No hay consenso sobre la magnitud, duración y frecuencia de valores elevados de potasio que definen la cronicidad.
Estrategias de monitorización y métodos de medición.La hiperpotasemia crónica suele ser asintomática y es más probable que se detecte en pacientes que se realizan determinaciones más frecuentes [126], lo que puede representar un sesgo de confusión por indicación. Basándose en la opinión de expertos, en pacientes con riesgo de hipercalemia, varias guías recomiendan medir la concentración de potasio antes y de 1 a 2 semanas después del inicio fármacos inhibidores del SRAA [209] [210]. Sin embargo, los datos poblacionales muestran que el cumplimiento de estas pautas es limitado [168] [211].
Importancia clínica de la hiperpotasemia crónica.El desarrollo de hipercalemia se asocia con un mayor riesgo de eventos adversos. Esta asociación se ha descrito en numerosos estudios observacionales, que muestran consistentemente una relación en forma de U entre el potasio sérico y la mortalidad [103] [169] [205]. La plausibilidad de que la asociación sea causal se fundamenta en el papel electrofisiológico del potasio y las conocidas alteraciones cardíacas que provocan las concentraciones altas y bajas de potasio; sin embargo, la confusión no-controlada también puede jugar un papel importante, de modo que trastornos fisiológicos graves producirían también cambios muy importantes en el potasio.
Debido a la posibilidad de que la hiperpotasemia cause arritmias mortales, su detección de antes de realizar un procedimiento puede provocar retrasos y cancelaciones de estos. Uno estudio observó una tendencia no significativa hacia el aumento de reanimaciones cardiopulmonares y muerte en (los muy pocos) pacientes sometidos a intervenciones quirúrgicas con un concentración sérica de potasio preoperatoria > 5,3 mmol/l [110] y en pacientes en diálisis, una concentración sérica preoperatoria de potasio > 5,5 mmol/l se asoció con mayor riesgo de eventos cardiovasculares mayores [212]. No fuimos capaces de encontrar ningún estudio que examinara el impacto de corregir la hiperpotasemia preoperatoria.
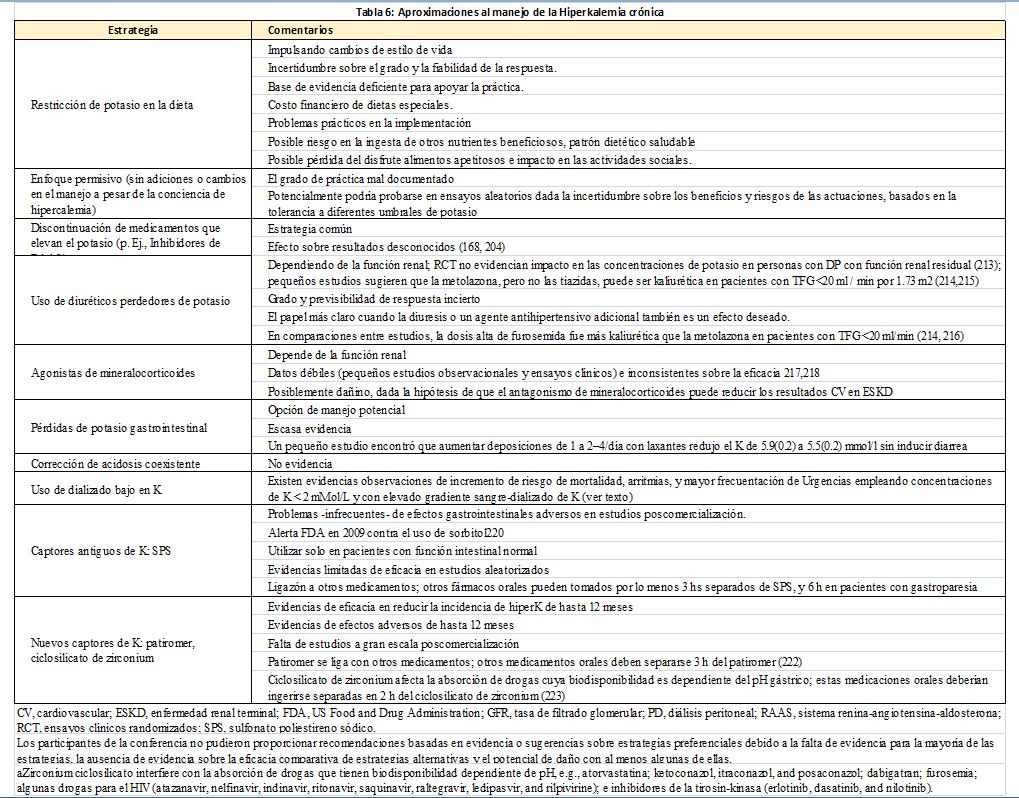
Riesgos y beneficios de las terapias antihiperpotasemia.Las opciones terapéuticas se resumen en la (Tabla 6) [168] [204] [213] [214] [215] [216] [217] [218] [219] [220] [221] [222] [223] [224]. A las personas con ERC avanzada y terminal que presentan concentraciones elevadas de potasio habitualmente se les recomienda seguir dietas bajas en potasio. Sin embargo, la evidencia aleatorizada sobre si este abordaje es efectivo es insuficiente y por tanto necesaria. Una consecuencia no deseada de este consejo puede ser una dieta de peor calidad, lo que debería ser específicamente estudiado en un ensayo de intervención dietética, junto con la satisfacción con dicha dieta, la experiencia del paciente, los costos, la interferencia en la enfermedad, y los efectos secundarios abdominales.
El concepto de que la hiperpotasemia crónica puede mejorarse en personas con FG normal o reducido está avalado por estudios randomizados, de hasta 1 año de duración para los agentes más nuevos, patiromer y ciclosilicato de sodio y circonio, con menos evidencia en estudios a corto plazo (hasta una semana) para poliestireno sulfonato de sodio (PSS) [225] [226] [227] [228] [229] [230] La evidencia sobre la eficacia y seguridad de estos agentes en personas con enfermedad renal en fase terminal es limitada [227] [229]. Los eventos adversos comunicados que son relativamente comunes y potencialmente relevantes desde el punto de vista clínico con patiromer son estreñimiento e hipomagnesemia, y mientras que el ciclosilicato de sodio y circonio puede inducir edema [231]. Los eventos adversos del PSS están menos claros, aunque existe preocupación sobre su asociación con patologías poco frecuentes pero graves como la necrosis intestinal cuando se administra con sorbitol, lo que provocó una alerta de la Food and Drugs Administration en 2009 y la retirada de presentaciones que incluyeran sorbitol al 70% [220] [231]. Un estudio posterior, retrospectivo realizado en un único centro con alrededor de 125.000 pacientes encontró una baja tasa de incidencia de necrosis colónica que no fue diferente, de forma estadísticamente significativa, en las personas que habían recibido o no PSS (0,14% en pacientes que habían recibido PSS y 0,07% en pacientes que no lo habían recibido; RR 2,1; IC 95%: 0,7-6,5) [232] En un estudio de cohorte PSM (pareamiento por puntaje de propensión o Propensity score matching) con 28000 usuarios de PSS entre 2003 y 2015, la prescripción ambulatoria de PSS se asoció con una mayor hospitalización por eventos adversos gastrointestinales (19 por 10000 en los 30 días posteriores a la prescripción, en comparación con 9 por 10000 en controles) [233], esto fue confirmado en una cohorte de un registro nacional similar [234]. Después de la publicación de estos trabajos, algunos han recomendado no utilizar PSS [235] Aunque estos estudios no son aleatorizados y no se puede excluir factores de confusión residual, las bajas tasas absolutas (7-10 por 10000) significan que es poco probable que exista evidencia aleatorizada que pueda excluir o confirmar estos datos; igualmente, datos a gran escala de estudios post-comercialización de los fármacos nuevos no estarán disponibles por algún tiempo. Sugerimos que es prioritario poder evidenciar definitivamente mediante estudios aleatorizados si el control del potasio mejora los eventos clínicamente significativos para estimar la tolerancia al riesgo de eventos raros aunque graves.
Los datos también son limitados en cuanto a los indicadores de seguridad, incluyendo la frecuencia de bajas concentraciones de potasio y magnesio, edema y eventos clínicos potencialmente asociados. Las interacciones farmacológicas son comunes, debido a la unión directa (patiromer y PSS) y la alteración del pH gástrico (ciclosilicato de sodio y circonio), lo que resulta en una recomendación del fabricante de tomar todos los otros medicamentos orales al menos 3 horas antes o después de patiromer [222] y PSS [236] y al menos 2 horas antes o después del ciclosilicato de sodio y circonio para fármacos cuya a absorción depende del pH gástrico (p. ej., atorvastatina, antifúngicos azólicos, dabigatrán, furosemida, inhibidores de la proteasa e inhibidores de la tirosina quinasa) [223] [237]. Esto plantea un desafío práctico, particularmente para aquellos que toman medicamentos esenciales como las drogas inmunosupresoras.
La mejoría en el control de potasio podría conducir a un aumento uso de inhibidores de SRAA en pacientes con una indicación basada en la evidencia. En las cohortes observacionales, la hiperpotasemia se asocia con la reducción o el cese de los inhibidores del SRAA [43] [168] [204] [238] [239], mientras que un pequeño análisis exploratorio de 107 personas con ERC que recibían inhibidores de SRAA e hiperpotasemia controlada con patiromer, encontró que solo el 44% de los asignados aleatoriamente a suspender patiromer continuaron con los inhibidores de SRAA en comparación con el 94% de los asignados al azar a continuar con patiromer [240]. En un estudio no controlado sobre el uso de ciclosilicato de sodio y circonio en 746 pacientes con hiperpotasemia, el 38% de los participantes suspendieron el medicamento por razones del paciente o protocolo. De los que completaron 12 meses, el potasio final fue <5,1 mmol/l en el 87%; 87% de los que tomaban inhibidores de SRAA continuaron con la terapia o aumentaron su dosis [241]. Los resultados del ensayo AMBER mostraron que en pacientes con hipertensión resistente y ERC avanzada (25 a 45 ml/min por 1,73 m2), el uso concomitante de patiromer, en comparación con placebo, resultó en una mayor proporción de pacientes usando espironolactona a las 12 semanas [242].
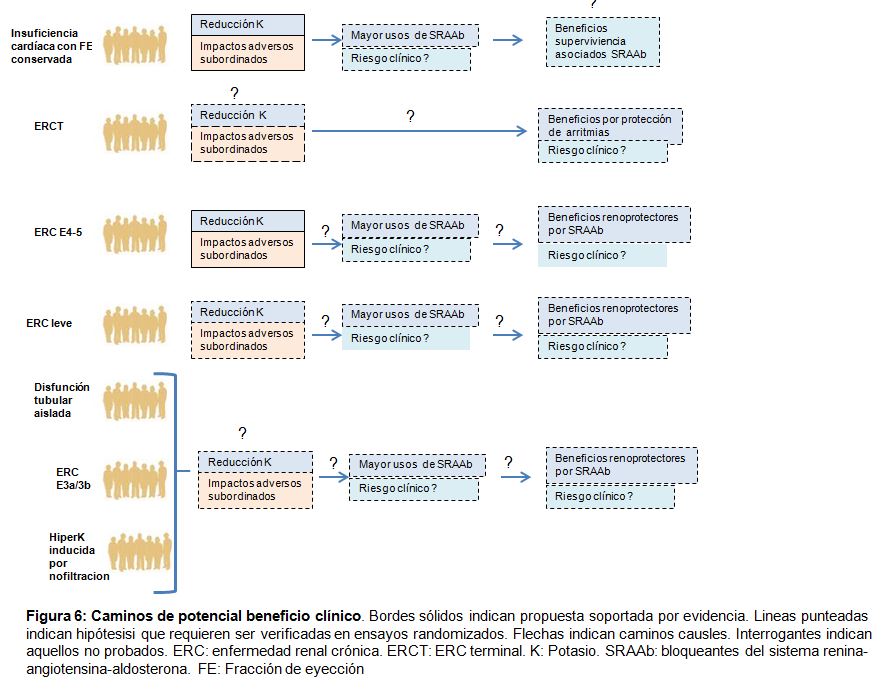
La inhibición de SRAA mejora claramente los resultados en pacientes con insuficiencia cardíaca y fracción de eyección reducida[238] y en pacientes con enfermedad renal proteinúrica, incluyendo la diabetes [243], aunque su papel en la ERC avanzada está menos aclarado y basado en la evidencia de un solo ensayo de 224 participantes con CKD proteinúrica G4 [244] Consideramos que es esencial probar si las estrategias para reducir el riesgo de hiperpotasemia (por ejemplo, examinar si las indicaciones clínicas para la inhibición de SRAA existentes o ampliadas) mejoran los resultados importantes para el paciente (Figura 6).
Más información sobre el papel de la inhibición de SRAA en la ERC avanzada vendrá del estudio STOP-ACEi que se está realizando en el Reino Unido, y que estudiará 410 participantes con ERC G4-G5 en tratamiento con inhibidores de SRAA, aleatorizándolos a continuar o detener la inhibición de SRAA [245].
Entre las personas con enfermedad renal crónica en fase terminal, en estudios observacionales el uso de líquido de diálisis bajo en potasio (1-1,5 mmol/l) se asocia con mortalidad [246] y arritmias [123]; el mayor gradiente de potasio entre el suero y el líquido de diálisis se asocia con la mortalidad y atención en urgencias [247]; y postdiálisis, la hipocalemia se asocia con mortalidad [248].
Las áreas de investigación adicional sobre la hiperpotasemia crónica se muestran en la (Tabla 5).
ConclusiónResumimos aquí las evidencias y las controversias en la fisiología, identificación y manejo de los trastornos del potasio en el contexto de enfermedades renales y esperamos que este informe sirva como referencia útil y describa las prioridades de investigación que fortalecerán aún más la base de evidencia en esta área.
APÉNDICEOtros participantes de la conferencia
Gloria E. Ashuntantang, Cameroon; Stephan J.L. Bakker, The Netherlands; George L. Bakris, USA; Sunil Bhandari, UK; Emmanuel A. Burdmann, Brazil; Katrina L. Campbell, Australia; David M. Charytan, USA; Deborah J. Clegg, USA; Lilian Cuppari, Brazil; David Goldsmith, UK; Stein I. Hallan, Norway; Jiang He, USA; Charles A. Herzog, USA; Melanie P. Hoenig, USA; Ewout J. Hoorn, The Netherlands; Jens Georg Leipziger, Denmark; Amanda K. Leonberg-Yoo, USA; Edgar V. Lerma, USA; Jose Ernesto Lopez-Almaraz, Mexico; Jolanta Ma¿yszko, Poland; Johannes F.E. Mann, Germany; Matti Marklund, Australia; Alicia A. McDonough, USA; Masahiko Nagahama, Japan; Sankar D. Navaneethan, USA; Bertram Pitt, USA; Oleh M. Pochynyuk, USA; Thyago Proença de Moraes, Brazil; Zubaid Rafique, USA; Bruce M. Robinson, USA; Simon D. Roger, Australia; Patrick Rossignol, France; Adam J. Singer, USA; Andrew Smyth, Ireland; Manish M. Sood, Canada; Michael Walsh, Canada; Matthew R. Weir, USA; and Charles S. Wingo, USA.
AGRADECIMIENTOSLa conferencia fue patrocinada por KDIGO y patrocinada en parte por subenciones educacionales no restrictivas de AstraZeneca, Bayer HealthCare, Boehringer Ingelheim, Fresenius Medical Care, Relypsa, and Vifor Fresenius Medical Care Renal Pharma.
MATERIAL SUPLEMENTARIO Tablas y Figuras Suplementarias en InglésFigura S1. Los experimentales estudios en animales muestran un cambio mínimo en la concentración plasmática de K después de la reducción en la masa renal debido a un aumento adaptativo en la secreción de K por las nefronas restantes.
Figura S2. Frecuencia de anomalías electrocardiográficas la hiperpotasemia aguda.
Tabla S1. Composición de nutrientes de alimentos seleccionados.
Tabla S2. Ventajas y dificultades de los métodos actuales para estimar ingesta de potasio en la dieta.
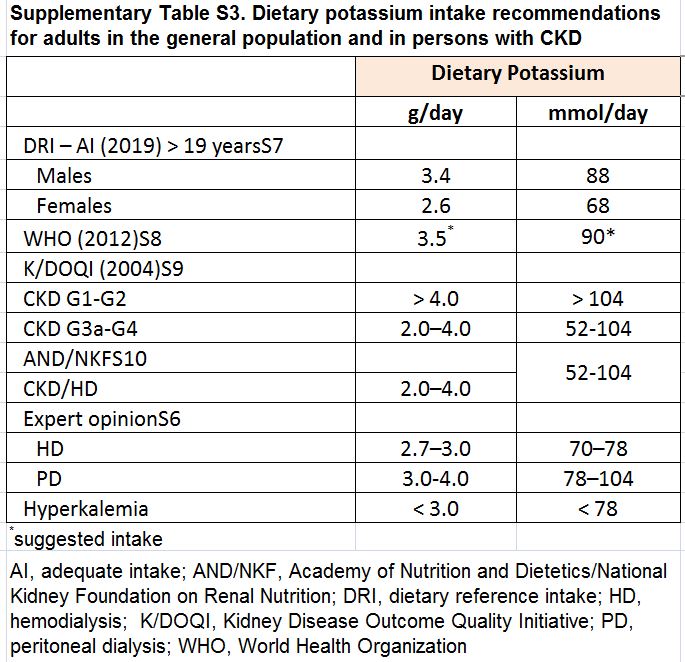
Tabla S3. Recomendaciones de ingesta de potasio en la dieta para adultos en la población general y en personas con ERC.
Tabla S4. Diuréticos potasiúricos comunes, sus dosis y duración de acción.
Tabla S5. Causas adicionales de alteraciones del potasio través de una variedad de mecanismos: ejemplos interesantes en la literatura.
Tabla S6. Suplementos orales comunes de potasio y sus formulaciones
Tabla S7. Factores de riesgo de hipercalemia.
Referencias SuplementariasS1. Aranguren C, Vergara C, Rosselli D. Toxicity of star fruit (Averrhoa carambola) in renal patients: A systematic review of the literature. Saudi J Kidney Dis Transpl 2017; 28: 709-715.
S2. Penninkilampi R, Eslick EM, Eslick GD. The association between consistent licorice ingestion, hypertension and hypokalaemia: a systematic review and meta-analysis. J Hum Hypertens 2017; 31: 699-707.
S3. O'Donnell M, Mente A, Rangarajan S, et al. Urinary sodium and potassium excretion, mortality, and cardiovascular events. N Engl J Med 2014; 371: 612-623.
S4. van Ypersele de Strihou C. Potassium homeostasis in renal failure. Kidney Int 1977; 11: 491-504.
S5. Turban S, Miller ER, 3rd, Ange B, et al. Racial differences in urinary potassium excretion. J Am Soc Nephrol 2008; 19: 1396-1402.
S6. Cupisti A, Kovesdy CP, D'Alessandro C, et al. Dietary Approach to Recurrent or Chronic Hyperkalaemia in Patients with Decreased Kidney Function. Nutrients 2018; 10: pii E261.
S7. National Academies of Sciences, Engineering, and Medicine 2019. Dietary Reference Intakes for sodium and potassium. Washington, DC: The National Academies Press. https://doi.org/10.17226/25353.
S8. World Health Organization. Guideline: Potassium intake for adults and children. 2012.
S9. Kidney Disease Outcomes Quality I. K/DOQI clinical practice guidelines on hypertension and antihypertensive agents in chronic kidney disease. Am J Kidney Dis 2004; 43: S1-290.
S10. Beto JA, Ramirez WE, Bansal VK. Medical nutrition therapy in adults with chronic kidney disease: integrating evidence and consensus into practice for the generalist registered dietitian nutritionist. J Acad Nutr Diet 2014; 114: 1077-1087.
S11. Sodi R, Davison AS, Holmes E, et al. The phenomenon of seasonal pseudohypokalemia: effects of ambient temperature, plasma glucose and role for sodium-potassium-exchanging-ATPase. Clin Biochem 2009; 42: 813-818.
S12. Di Lullo L, Ronco C, Granata A, et al. Chronic Hyperkalemia in Cardiorenal Patients: Risk Factors, Diagnosis, and New Treatment Options. Cardiorenal Med 2019; 9: 8-21.
S13. Sigue G, Gamble L, Pelitere M, et al. From profound hypokalemia to life-threatening hyperkalemia: a case of barium sulfide poisoning. Arch Intern Med 2000; 160: 548-551.
S14. Solimini R, Rotolo MC, Pellegrini M, et al. Adulteration Practices of Psychoactive Illicit Drugs: An Updated Review. Curr Pharm Biotechnol 2017; 18: 524-530.
S15. Li Z, Wang J, Zhu Q, et al. Huge solitary fibrous tumor of the pleura with hypoglycemia and hypokalemia: a case report. Ann Thorac Cardiovasc Surg 2014; 20: 165-168.
S16. Clemessy JL, Favier C, Borron SW, et al. Hypokalaemia related to acute chloroquine ingestion. Lancet 1995; 346: 877-880.
S17. Bates CM, Baum M, Quigley R. Cystic fibrosis presenting with hypokalemia and metabolic alkalosis in a previously healthy adolescent. J Am Soc Nephrol 1997; 8: 352-355.
S18. Gonzalez JJ, Owens W, Ungaro PC, et al. Clay ingestion: a rare cause of hypokalemia. Ann Intern Med 1982; 97: 65-66.
S19. Karashima S, Kometani M, Tsujiguchi H, et al. Prevalence of primary aldosteronism without hypertension in the general population: Results in Shika study. Clin Exp Hypertens 2018; 40: 118-125.
S20. Moradi S, Shafiepour M, Amirbaigloo A. A Woman with Normotensive Primary Hyperaldosteronism. Acta Med Iran 2016; 54: 156-158.
S21. Adlin EV, Braitman LE, Vasan RS. Bimodal aldosterone distribution in low-renin hypertension. Am J Hypertens 2013; 26: 1076-1085.
S22. Byrd JB, Brook RD. A critical review of the evidence supporting aldosterone in the etiology and its blockade in the treatment of obesity-associated hypertension. J Hum Hypertens 2014; 28: 3-9.
S23. Gupta V. Mineralocorticoid hypertension. Indian J Endocrinol Metab 2011; 15 Suppl 4: S298-312.
S24. Torpy DJ, Stratakis CA, Chrousos GP. Hyper- and hypoaldosteronism. Vitam Horm 1999; 57: 177-216.
S25. Wulf GG, Jahns-Streubel G, Strutz F, et al. Paraneoplastic hypokalemia in acute myeloid leukemia: a case of renin activity in AML blast cells. Ann Hematol 1996; 73: 139-141.
S26. Lee HJ, Hyun JS, Jang HS, et al. Paraneoplastic secondary hypertension due to a renin-secreting desmoplastic small round cell tumor: A case report. Oncol Lett 2014; 8: 1986-1992.
S27. Klastersky J, Vanderklen B, Daneau D, et al. Carbenicillin and hypokalemia. Ann Intern Med 1973; 78: 774-775.
S28. Hoorn EJ, Zietse R. Severe hypokalaemia caused by flucloxacillin. J Antimicrob Chemother 2008; 61: 1396-1398.
S29. Harnack L, Stang J, Story M. Soft drink consumption among US children and adolescents: nutritional consequences. J Am Diet Assoc 1999; 99: 436-441.
S30. King NA, Appleton K, Rogers PJ, et al. Effects of sweetness and energy in drinks on food intake following exercise. Physiol Behav 1999; 66: 375-379.
S31. Murray R, Bartoli W, Stofan J, et al. A comparison of the gastric emptying characteristics of selected sports drinks. Int J Sport Nutr 1999; 9: 263-274.
S32. Packer CD. Chronic hypokalemia due to excessive cola consumption: a case report. Cases J 2008; 1: 32.
S33. Shepp DH, Curtis S, Rooney JF. Causes and consequences of hypokalemia in patients on tenofovir disoproxil fumarate. AIDS 2007; 21: 1479-1481.
S34. Akiba R, Osanai T, Matumura H, et al. [A case of Bartter's syndrome-like disorder after internal iliac artery infusion of cisplatin and adriamycin]. Nihon Naika Gakkai Zasshi 1989; 78: 595-596.
S35. Chou CL, Chen YH, Chau T, et al. Acquired bartter-like syndrome associated with gentamicin administration. Am J Med Sci 2005; 329: 144-149.
S36. Chrispal A, Boorugu H, Prabhakar AT, et al. Amikacin-induced type 5 Bartter-like syndrome with severe hypocalcemia. J Postgrad Med 2009; 55: 208-210.
S37. Workeneh B, Sangsiraprapha W, Addison D, et al. A novel case of persistent Bartters-like syndrome associated with gentamicin exposure. Saudi J Kidney Dis Transpl 2013; 24: 144-146.
S38. Singh J, Patel ML, Gupta KK, et al. Acquired Bartter syndrome following gentamicin therapy. Indian J Nephrol 2016; 26: 461-463.
S39. Tang XJ, Lai GC, Huang JX, et al. Studies on hypokalemia induced by trimethyltin chloride. Biomed Environ Sci 2002; 15: 16-24.
S40. Tang X, Yang X, Lai G, et al. Mechanism underlying hypokalemia induced by trimethyltin chloride: Inhibition of H+/K+-ATPase in renal intercalated cells. Toxicology 2010; 271: 45-50.
S41. Jensen LP, Lai AR. Chayote (Sechium edule) causing hypokalemia in pregnancy. Am J Obstet Gynecol 1986; 155: 1048-1049.
S42. Lyon AW, Mayhew WJ. Cesium toxicity: a case of self-treatment by alternate therapy gone awry. Ther Drug Monit 2003; 25: 114-116.
S43. Melnikov P, Zanoni LZ. Clinical effects of cesium intake. Biol Trace Elem Res 2010; 135: 1-9.
S44. Hoorn EJ, van der Poel MF. Hypokalemic hypertension related to clozapine: a case report. J Clin Psychopharmacol 2014; 34: 390-392.
S45. Kim YK, Song HC, Kim WY, et al. Acquired Gitelman syndrome in a patient with primary Sjogren syndrome. Am J Kidney Dis 2008; 52: 1163-1167.
S46. Adrogue HJ, Madias NE. Changes in plasma potassium concentration during acute acid-base disturbances. Am J Med 1981; 71: 456-467.
S47. Aronson PS, Giebisch G. Effects of pH on potassium: new explanations for old observations. J Am Soc Nephrol 2011; 22: 1981-1989.
S48. Bandak G, Sang Y, Gasparini A, et al. Hyperkalemia After Initiating Renin-Angiotensin System Blockade: The Stockholm Creatinine Measurements (SCREAM) Project. J Am Heart Assoc 2017; 6.
S49. Bastani B, Underhill D, Chu N, et al. Preservation of intercalated cell H(+)-ATPase in two patients with lupus nephritis and hyperkalemic distal renal tubular acidosis. J Am Soc Nephrol 1997; 8: 1109-1117.
S50. Batlle D, Itsarayoungyuen K, Arruda JA, et al. Hyperkalemic hyperchloremic metabolic acidosis in sickle cell hemoglobinopathies. Am J Med 1982; 72: 188-192.
S51. Batlle DC, Arruda JA, Kurtzman NA. Hyperkalemic distal renal tubular acidosis associated with obstructive uropathy. N Engl J Med 1981; 304: 373-380.
S52. Birch AA, Jr., Mitchell GD, Playford GA, et al. Changes in serum potassium response to succinylcholine following trauma. JAMA 1969; 210: 490-493.
S53. Bushinsky DA, Gennari FJ. Life-threatening hyperkalemia induced by arginine. Ann Intern Med 1978; 89: 632-634.
S54. DeFronzo RA, Cooke CR, Goldberg M, et al. Impaired renal tubular potassium secretion in systemic lupus erythematosus. Ann Intern Med 1977; 86: 268-271.
S55. DeFronzo RA, Goldberg M, Cooke CR, et al. Investigations into the mechanisms of hyperkalemia following renal transplantation. Kidney Int 1977; 11: 357-365.
S56. DeFronzo RA, Sherwin RS, Dillingham M, et al. Influence of basal insulin and glucagon secretion on potassium and sodium metabolism. Studies with somatostatin in normal dogs and in normal and diabetic human beings. J Clin Invest 1978; 61: 472-479.
S57. DeFronzo RA, Taufield PA, Black H, et al. Impaired renal tubular potassium secretion in sickle cell disease. Ann Intern Med 1979; 90: 310-316.
S58. Desai AS, Liu J, Pfeffer MA, et al. Incident Hyperkalemia, Hypokalemia, and Clinical Outcomes During Spironolactone Treatment of Heart Failure With Preserved Ejection Fraction: Analysis of the TOPCAT Trial. J Card Fail 2018; 24: 313-320.
S59. Don BR, Sebastian A, Cheitlin M, et al. Pseudohyperkalemia caused by fist clenching during phlebotomy. N Engl J Med 1990; 322: 1290-1292.
S60. Fulop M. Serum potassium in lactic acidosis and ketoacidosis. N Engl J Med 1979; 300: 1087-1089.
S61. Graber M, Subramani K, Corish D, et al. Thrombocytosis elevates serum potassium. Am J Kidney Dis 1988; 12: 116-120.
S62. Jain N, Kotla S, Little BB, et al. Predictors of hyperkalemia and death in patients with cardiac and renal disease. Am J Cardiol 2012; 109: 1510-1513.
S63. Lee HK, Brough TJ, Curtis MB, et al. Pseudohyperkalemia--is serum or whole blood a better specimen type than plasma? Clin Chim Acta 2008; 396: 95-96.
S64. Luke RG, Allison ME, Davidson JF, et al. Hyperkalemia and renal tubular acidosis due to renal amyloidosis. Ann Intern Med 1969; 70: 1211-1217.
S65. Muzzarelli S, Maeder MT, Toggweiler S, et al. Frequency and predictors of hyperkalemia in patients =60 years of age with heart failure undergoing intense medical therapy. Am J Cardiol 2012; 109: 693-698.
S66. Rosano GMC, Tamargo J, Kjeldsen KP, et al. Expert consensus document on the management of hyperkalaemia in patients with cardiovascular disease treated with renin angiotensin aldosterone system inhibitors: coordinated by the Working Group on Cardiovascular Pharmacotherapy of the European Society of Cardiology. Eur Heart J Cardiovasc Pharmacother 2018; 4: 180-188.
S67. Saito Y, Yamamoto H, Nakajima H, et al. Incidence of and risk factors for newly diagnosed hyperkalemia after hospital discharge in non-dialysis-dependent CKD patients treated with RAS inhibitors. PLoS One 2017; 12: e0184402.
S68. Smellie WS. Spurious hyperkalaemia. BMJ 2007; 334: 693-695.
S69. Struthers AD, Quigley C, Brown MJ. Rapid changes in plasma potassium during a game of squash. Clin Sci (Lond) 1988; 74: 397-401.
S70. Turgutalp K, Bardak S, Helvaci I, et al. Community-acquired hyperkalemia in elderly patients: risk factors and clinical outcomes. Ren Fail 2016; 38: 1405-1412.
S71. Vukadinovic D, Lavall D, Vukadinovic AN, et al. True rate of mineralocorticoid receptor antagonists-related hyperkalemia in placebo-controlled trials: A meta-analysis. Am Heart J 2017; 188: 99-108.
S72. Rose B, Post TW. Clinical Physiology of Acid-Base and Electrolyte Disorders, 5th ed., 2001. New York: McGraw-Hill.
S73. Kovesdy CP, Matsushita K, Sang Y, et al. Serum potassium and adverse outcomes across the range of kidney function: a CKD Prognosis Consortium meta-analysis. Eur Heart J 2018; 39: 1535-1542.
S74. Heerspink HJ, Gao P, de Zeeuw D, et al. The effect of ramipril and telmisartan on serum potassium and its association with cardiovascular and renal events: results from the ONTARGET trial. Eur J Prev Cardiol 2014; 21: 299-309.
S75. Farber SJ, Pellegrino ED, Conan NJ, et al. Observations on the plasma potassium level of man. Am J Med Sci 1951; 221: 678-687.
S76. Saleem S, Mani V, Chadwick MA, et al. A prospective study of causes of haemolysis during venepuncture: tourniquet time should be kept to a minimum. Ann Clin Biochem 2009; 46: 244-246.
S77. Yucel D, Dalva K. Effect of in vitro hemolysis on 25 common biochemical tests. Clin Chem 1992; 38: 575-577.
S78. Heireman L, Van Geel P, Musger L, et al. Causes, consequences and management of sample hemolysis in the clinical laboratory. Clin Biochem 2017; 50: 1317-1322.
S79. Lippi G, Fontana R, Avanzini P, et al. Influence of mechanical trauma of blood and hemolysis on PFA-100 testing. Blood Coagul Fibrinolysis 2012; 23: 82-86.
S80. Heyer NJ, Derzon JH, Winges L, et al. Effectiveness of practices to reduce blood sample hemolysis in EDs: a laboratory medicine best practices systematic review and meta-analysis. Clin Biochem 2012; 45: 1012-1032.
S81. Schultze RG, Taggart DD, Shapiro H, et al. On the adaptation in potassium excretion associated with nephron reduction in the dog. J Clin Invest 1971; 50: 1061-1068.
S82. Bourgoignie JJ, Kaplan M, Pincus J, et al. Renal handling of potassium in dogs with chronic renal insufficiency. Kidney Int 1981; 20: 482-490.