Controversias sobre el óptimo manejo de la anemia (2021)
RESUMEN
En la enfermedad renal crónica, la anemia y las alteraciones de la homeostasis del hierro son prevalentes y se asocian con importantes consecuencias adversas. En 2012 KDIGO publicó una guía de anemia para el diagnóstico, la evaluación y el tratamiento de la anemia en la enfermedad renal crónica. Desde entonces, han aparecido nuevos datos derivados de la investigación básica, estudios epidemiológicos y ensayos aleatorios que justifican un reexamen de las recomendaciones anteriores. Por lo tanto, en 2019, KDIGO decidió convocar 2 conferencias de controversias para revisar la evidencia más reciente, explorar nuevas y permanentes controversias, evaluar eventuales cambios en la guía de anemia KDIGO y proponer una agenda de investigación. La primera conferencia, descrita aquí, se centró principalmente en cuestiones relacionadas con el hierro, incluida la contribución de la homeostasis alterada del hierro a la anemia de la enfermedad renal crónica, retos diagnósticos, tratamientos con hierro actuales y emergentes, objetivos del tratamiento y resultados en pacientes. La segunda conferencia discutirá temas más específicamente relacionados con agentes estimulantes de la eritropoyesis, incluyendo epoetinas y factores inhibidores de la propil hidroxilasa inducidos por la hipoxia. Aquí proporcionamos una descripción concisa de los puntos de consenso y controversias resultantes de la primera conferencia y priorizamos las preguntas clave que es preciso responder para futuras investigaciones
Kidney International (2021) 99, 1280–1295; https://doi.org/10.1016/ j.kint.2021.03.020
Correspondencia: Jodie L. Babitt, Massachusetts General Hospital, 185 Cambridge St., CPZN-8208, Boston, Massachusetts 02114, USA. E-mail: Babitt.jodiemgh.harvard.edu; or Tilman B. Drüeke, Inserm Unit 1018, Team 5, CESP, Hôpital Paul Brousse, 16 Avenue Paul Vaillant, Couturier, 94807 Villejuif Cedex, France. E-mail: tilman.drueke&inserm.fr 17See Appendix for list of other Conference Participants. Received 30 December 2020; revised 2 March 2021; accepted 9 March 2021; published online 8 April 2021
PALABRAS CLAVE : anemia; enfermedad renal crónica; diálisis; factores estimulantes de la eritropoyesis; eritropoyetina; hepcidina; factores inhibidores de la propil hidroxilasa inducidos por la hipoxia; hierro; deficiencia de hierro.
Copyright 2021, Kidney Disease: Improving Global Outcomes (KDIGO). Published by Elsevier, Inc., on behalf of the International Society of Nephrology. This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/)
La anemia y la deficiencia de hierro son prevalentes en pacientes con enfermedad renal crónica (ERC) [1] [2] [3] [4] [5] [6] y se asocian con mala evolución [7] [8] [9] [10] [11] [12] [13] [14] [15]. La guía de anemia de 2012 Kidney Disease: Improving Global Outcomes (KDIGO) proporciona recomendaciones sobre el diagnóstico y tratamiento de la anemia en la ERC, incluido el uso de agentes de hierro, agentes estimulantes de la eritropoyesis (AEE) y transfusiones de glóbulos rojos [16]. En muchos países, la práctica clínica se ha desplazado hacia un uso reducido de AEE y un aumento de los suplementos de hierro [21] [22] [23] [24] [25] [26]. Los siguientes 8 años han producido una gran cantidad de nuevos datos de ensayos clínicos y biológicos, incluida la aparición de nuevos agentes de hierro y otros tratamientos nuevos para la anemia, que invitan a una reevaluación de la guía de 2012. En diciembre de 2019, KDIGO celebró la primera de dos conferencias de controversias sobre el manejo óptimo de la anemia enfocadas en el hierro, para analizar críticamente las últimas evidencias, evaluar la necesidad de actualizar la guía e identificar incógnitas para investigaciones futuras. La segunda conferencia, programada para 2021, abordará los AEE y los nuevos tratamientos de la anemia, incluidos los factores inducidos por la hipoxia-inhibidores de la prolil hidroxilasa (HIF-PHI), después de que estén disponibles resultados a largo plazo de los estudios en curso.
ETIOLOGÍA, DIAGNÓSTICO Y PREVALENCIA DE DEFICIENCIA DE HIERRO Y ANEMIA EN ERC
Nuevos conocimientos sobre la homeostasis del hierro y la anemia en la ERC
El hierro es un componente esencial de la hemoglobina para la eritropoyesis. La ERC se asocia con varias alteraciones en la homeostasis del hierro que dan como resultado un suministro inadecuado, que se clasifica en términos generales como deficiencia absoluta y deficiencia funcional de hierro. La deficiencia absoluta de hierro es un déficit de hierro corporal total que se manifiesta con cantidades reducidas de hierro circulante y almacenado. La deficiencia funcional de hierro se ha definido como una deficiencia de hierro circulante que limita la eritropoyesis a pesar de que las reservas corporales de hierro son normales o elevadas. La distinción entre deficiencia de hierro absoluta y funcional es importante para determinar la etiología de la anemia y el enfoque terapéutico óptimo.
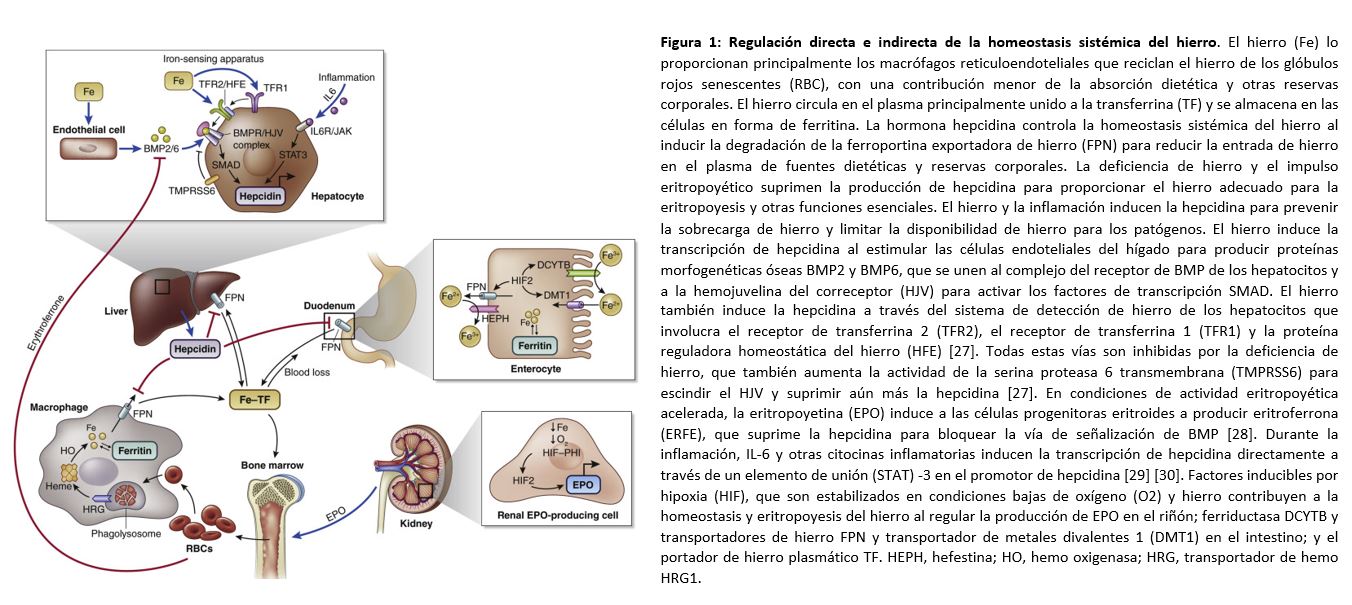
En las últimas dos décadas, han habido nuevos hallazgos sobre la regulación de la homeostasis sistémica y la fisiopatología de la deficiencia de hierro, tanto absoluta como funcional, en la ERC, incluidos los descubrimientos del eje de la hepcidina-ferroportina, la eritroferrona y la función de los HIFs (Figura 1) [27] [28] [29] [30]. La ERC avanzada se asocia con un balance de hierro negativo debido a una ingesta dietética reducida, una absorción enteral alterada y un aumento de las pérdidas [31]. La deficiencia funcional de hierro es multifactorial, debido en parte al exceso de hepcidina (como consecuencia de la inflamación, la disminución del aclaramiento renal y la reducción de la producción de eritropoyetina (EPO)), lo que lleva al secuestro de hierro en los macrófagos [32]. Los AEE también pueden contribuir a la deficiencia funcional de hierro al provocar una demanda importante, que excede cinéticamente al suministro de hierro. Otros factores que contribuyen a la anemia de la ERC incluyen la producción reducida de EPO, la respuesta deficiente de la médula ósea, la supervivencia acortada de los hematíes y la supresión directa de la médula ósea.
Definiciones y diagnóstico del déficit de hierro y la anemia: hacia una mayor precisión
Las definiciones y el diagnóstico del déficit de hierro y la anemia en la ERC se basan históricamente en 3 parámetros: hemoglobina (Hb), saturación de transferrina sérica (TSAT), ue es un indicador del hierro circulante y ferritina sérica, que es un indicador del hierro almacenado. En la ERC, el déficit absoluto de hierro se ha definido si: TSAT < 20% y ferritina < 100 mg/l en pacientes que no están en hemodiálisis (NDCKD) o < 200 mg/l en pacientes en hemodiálisis (HDCKD). El déficit funcional de hierro se ha definido como TSAT < 20% y ferritina > 100 mg/l en pacientes NDCKD o > 200 mg/l en pacientes HDCKD [16] [33] [34] [35] [36]. Sin embargo, estos términos y definiciones se han sometido a escrutinio y discusión [37] [38]. Los participantes de la conferencia acordaron que los parámetros utilizados actualmente no son fiables para estimar las reservas corporales de hierro o predecir la respuesta a la terapia. Además, podría ser de utilidad clínica distinguir de forma más precisa subgrupos de "déficit funcional de hierro" debido a la inflamación/secuestro de hierro mediado por hepcidina versus déficit de hierro cinético por eritropoyesis masiva estimulada por AEE, para plantear el tratamiento óptimo. Estas áreas fueron identificadas de alta prioridad para la futura investigación (Tabla 1).
El desarrollo y adopción de nuevas pruebas para diagnosticar con más precisión el déficit de hierro, tanto absoluto como funcional, y para monitorizar la respuesta al tratamiento, es otra área de investigación de alta prioridad. Se han desarrollado varios parámetros de los glóbulos rojos que ahora están disponibles en múltiples analizadores de hematología, incluido el contenido de Hb reticulocitaria y el porcentaje de glóbulos rojos hipocrómicos [39] [40]. La Hb reticulocitaria indica si el hierro se incorpora a los reticulocitos 3-4 días después de comenzar la administración de hierro y, por lo tanto, sirve como un parámetro funcional que puede ser útil para guiar el tratamiento con hierro y con AEE [41] [42] [43] [44] [45]. El porcentaje de glóbulos rojos hipocrómicos refleja la disponibilidad de hierro en los 2-3 meses anteriores, convirtiéndose en un parámetro funcional sensible a largo plazo.
Sin embargo, el uso clínico generalizado de ambos parámetros está limitado por la ausencia de unos límites clínicos universales. La necesidad de muestras de sangre fresca también limita el uso del porcentaje de glóbulos rojos hipocrómicos [46]. Parámetros para evaluar otras consecuencias funcionales del déficit de hierro o su corrección, por ejemplo, en el músculo esquelético y el corazón, podrían ser útiles, pero no están disponibles. La hepcidina no ha demostrado ser un marcador fiable para distinguir el déficit de hierro funcional del absoluto o para determinar la capacidad de respuesta a AEE en pacientes con ERC [32]. Otros métodos diagnósticos relacionados con nuevos conocimientos mecanicistas, por ejemplo, la concentración de eritroferrona, se están investigando todavía.
Déficit de hierro y anemia en la ERC
Los datos de varios países muestran que la anemia y el déficit de hierro siguen siendo muy prevalentes en pacientes con ERC. En pacientes con NDCKD, varios estudios (US Veteran study, REport of COmorbidities in non-Dialysis Renal Disease Population in Italy (RECORD-IT) y Chronic Kidney Disease Outcomes and Practice Patterns Study (CKDoppS)) encuentran que entre el 21% y el 62% de los pacientes tienen anemia, definida como Hb < 12 g/dl en mujeres y < 13,5 g/dl en hombres, con una prevalencia creciente en la ERC más avanzada [47] [48] [49]. Además, entre el 15% y el 72,8% tienen ferritina < 100 mg/l o TSAT < 20%, y entre el 8-20% tienen ambos parámetros por debajo del umbral [3] [47] [48] [50] [51]. Para los pacientes HDCKD, los datos del Sistema de Datos Renales de Estados Unidos (USRDS) [52] muestran que 64,5%, 14,4% y 6,6% tienen concentraciones de Hb entre 10-12 g/dl, 9 y 10 g/dl o menos de 9 g/dl, respectivamente. Es más, el 15,8% tiene TSAT < 20% y el 4,9% tiene ferritina < 200 mg/l [53]. Los datos de un registro japonés muestran que el 36,3%, 60,2% y 28,0% de los pacientes con HDCKD tienen TSAT < 20%, ferritina < 100 mg/l, o ambos, respectivamente [54]. En pacientes en diálisis peritoneal, la prevalencia de anemia por déficit de hierro está en el rango de 16% a 23% [55]. Estas observaciones pueden reflejar una mala adherencia a las prescripciones de hierro oral en NDCKD y diálisis peritoneal, así como inercia terapéutica, es decir, falta de prescripciones adecuadas de hierro o AEE, a pesar de concentraciones bajas de Hb y/o déficit de hierro.
HIERRO, ANEMIA Y RESULTADOS EN LA ERC
Los datos observacionales indican que la anemia está asociada con resultados adversos en todos los estadios de la ERC [7] [15] [56] e insuficiencia cardíaca congestiva [57]. En la ERC, la anemia se asocia con un mayor riesgo de hospitalizaciones, enfermedades cardiovasculares, deterioro cognitivo y mortalidad [58]. Además, la TSAT < 20% también se asocia con hospitalizaciones cardiovasculares y mortalidad [49] [54] [59]. Sin embargo, dada la asociación de anemia y déficit de hierro con otras comorbilidades, el riesgo independiente de la concentración de Hb y / o hierro no se conoce.
Beneficios de la administración de hierro en la ERC
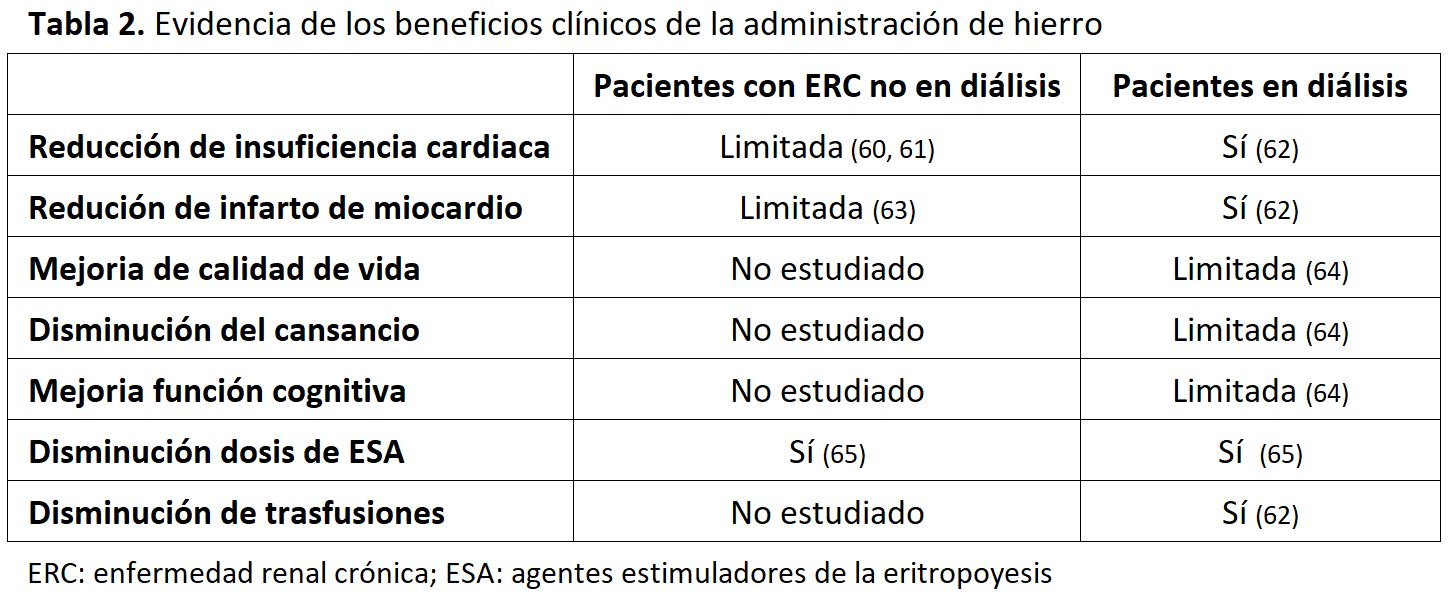
En pacientes con ERC, los datos sobre los beneficios de la administración de hierro son limitados (Tabla 2) [60] [61] [62] [63] [64] [65]. Los resultados del estudio PIVOTAL (Proactive IV Iron Therapy in Haemodialysis Patients), un ensayo controlado aleatorio (ECA) de más de 2000 pacientes con HDCKD, indican que la administración mensual proactiva de 400 mg de hierro intravenoso (i.v.) en pacientes con ferritina sérica < 700 mg/l y TSAT < 40% disminuye el uso de AEE y reduce el riesgo combinado de muerte por todas las causas, infarto de miocardio no-fatal, accidente cerebrovascular no-fatal y hospitalización por insuficiencia cardíaca en comparación con dosis bajas i.v. hierro administrado si la ferritina es < 200 mg/l o TSAT < 20% [62].
En pacientes con insuficiencia cardíaca con fracción de eyección reducida y deficiencia de hierro, múltiples ensayos clínicos (RCT) muestran que el hierro i.v. tiene beneficios en términos de objetivos finales intermedios (prueba de caminar 6 minutos, calidad de vida, clase funcional NYHA) y hospitalización [60] [61] [66]. Dentro de los estudios de insuficiencia cardíaca, aquellos con ERC tuvieron beneficios similares en los análisis de subgrupos [60] [61]. Los resultados del metanálisis también sugieren que el hierro i.v. reduce el riesgo combinado de recurrencia cardiovascular u hospitalizaciones por insuficiencia cardíaca y mortalidad en pacientes con insuficiencia cardíaca [67]. En particular, los beneficios de la administración de hierro en los pacientes con insuficiencia cardíaca parecen ser independientes de la Hb [60] [61].
Además, la deficiencia de hierro sin anemia puede ser clínicamente relevante en otros contextos [68] [69], aunque disponemos de datos limitados en la ERC [14]. Comprender el impacto clínico de la deficiencia de hierro y su corrección, independientemente de la anemia, es un área de investigación de alta prioridad para futuros estudios en pacientes con ERC (Tabla 1).
Riesgos de la administración de hierro en la ERC
Dado que el hierro es esencial para casi todos los microorganismos infecciosos, existe la preocupación de que la administración de hierro pueda aumentar el riesgo de infección [70] [71] [72]. El hierro también puede promover el estrés oxidativo participando en la reacción de Fenton [73]. Algunos autores sugieren que este mecanismo puede contribuir potencialmente a aumentar el riesgo de enfermedad cardiovascular, la velocidad de progresión de la ERC y otros daños orgánicos en pacientes con ERC [31]. El hierro no unido a transferrina puede ser particularmente importante como factor de riesgo para ciertos patógenos, particularmente bacterias gramnegativas y otras bacterias siderófilas [70] [71]. La concentración de hierro plasmático lábil, un componente del hierro no unido a transferrina, también puede ser indicativo de sobrecarga de hierro clínicamente significativa [74]. Sin embargo, los ensayos de laboratorio validados para la determinación de hierro no unido a transferrina y hierro plasmático lábil no están aún accesibles en clínica y requerirían la estandarización del ensayo, el consenso sobre valores de referencia y estudios de resultados clínicos para determinar formatos de ensayo clínicamente relevantes y umbrales tóxicos antes de la introducción en la práctica clínica [75] [76]. Además, los datos en pacientes con hemocromatosis hereditaria sugieren que el daño toxico a los órganos requiere una exposición prolongada a niveles elevados de IST y hierro plasmático lábil [77].
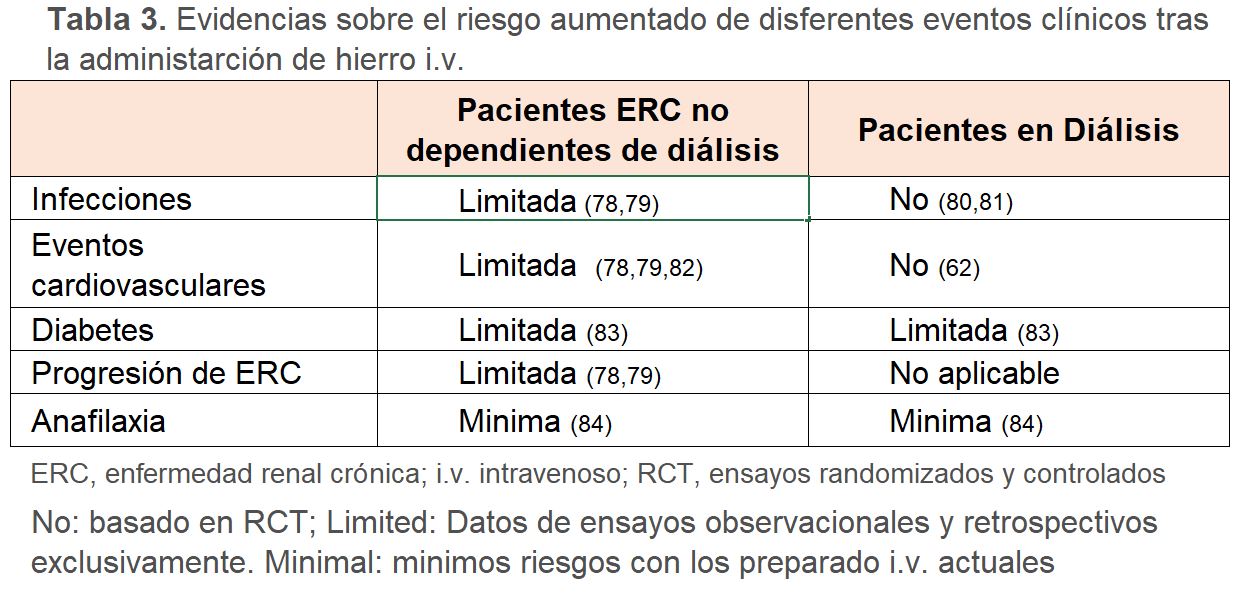
Los datos de ensayos clínicos ahora se están acumulando para evaluar mejor los riesgos de la administración de hierro en pacientes con ERC (Tabla 3) [78] [79] [80] [81] [82] [83] [84]. Según el estudio PIVOTAL, los pacientes en HDCKD del brazo de dosis alta de hierro i.v. tuvieron una menor incidencia de evento clínico agregado (mortalidad y/o eventos CV) en comparación con el brazo de dosis baja de hierro i.v. [62]. Además, las tasas de infección fueron similares en ambos brazos [81]. Asimismo, aunque los pacientes que se dializaban a través de un catéter tuvieron tasas de infección más altas que las que se dializaban a través de una fístula, el hierro i.v. no influyó en este resultado [81]. Un metaanálisis de estudios epidemiológicos y ensayos clínicos previos tampoco respalda un mayor riesgo de infección o eventos cardiovasculares asociados al uso de hierro i.v. [80], aunque esta conclusión está limitada por un número reducido de participantes y eventos y por la heterogeneidad estadística [85]. En general, estos datos son tranquilizadores con respecto a la seguridad del hierro i.v. del brazo administrado en dosis alta del PIVOTAL.
Sin embargo, los datos de estudios observacionales retrospectivos sugieren que una administración más intensa de hierro i.v. (mayor que en PIVOTAL) pudiera estar asociado con un mayor riesgo de mortalidad e infecciones [86].También se ha informado de un mayor riesgo de mortalidad relacionada con infecciones en pacientes en HDCKD por catéter que reciben dosis en bolo frente a dosis de mantenimiento [87]. Los datos con respecto a si la administración de hierro i.v. en dosis alta aumenta los riesgos de infección o evento CV en pacientes NDCKD son contradictorios.
Por ello, debemos ser cautelosos y no recomendar estrategias agresivas de hierro i.v. para los pacientes con NDCKD hasta no disponer de resultados de más ensayos clínicos específicos en este área [78] [79] [82]. Es más, los participantes en la conferencia continúan recomendando suspender la administración de hierro i.v. durante infecciones activas, ya que este perfil de pacientes infectados fue excluido de los ensayos clínicos actualmente disponibles. Los estudios sobre los efectos de dosis altas de hierro i.v. en pacientes infectados (incluyendo tipos específicos como p.e. bacterias gram negativas) sobre la mortalidad constituyen un área de investigación prioritaria en el futuro (Tabla 1).
Hierro, anemia y alteraciones del metabolismo óseo mineral asociadas a la ERC
El hierro, la inflamación y la eritropoyesis desempeñan un papel fundamental en la regulación del factor de crecimiento de fibroblastos 23 (FGF23), que juega un papel en las alteraciones óseo-mineral asociadas a la ERC [88] [89]. En la ausencia de ERC, el déficit de hierro, la administración de AEE y la inflamación, aumentan los niveles de FGF23 terminal (cFGF23) aumentando simultáneamente la transcripción y la escisión de FGF23, mientras que los niveles de FGF23 intacto biológicamente activo (iFGF23) permanecen prácticamente sin cambios. Sin embargo, en la ERC, donde la escisión de FGF23 está alterada, la deficiencia de hierro, los AEE y la inflamación aumentan el iFGF23. Las cantidades relativas de iFGF23 y cFGF23 circulantes se ven afectadas no sólo por el estado del hierro, la inflamación, el uso de AEE y la presencia de ERC, sino también por la formulación de hierro administrada (Tabla 4) [90] [91] [92] [93] [94] [95] [96] [97].
De hecho, ciertos preparados de hierro i.v aumentan el iFGF23 a través de mecanismos que parecen estar relacionados con la capa de carbohidratos [91] [92] [93] [94] [95] [96] [97] [98]. Por el contrario, el citrato férrico, al funcionar como un quelante de fosfato, puede disminuir los niveles de cFGF23 e iFGF23 [99] [100]. Estos efectos pueden ser importantes no solo para las alteraciones óseo-mineral asociadas a la ERC, sino también para los efectos cardiovasculares y de mortalidad que están fuertemente asociados con el exceso de FGF23, [101] [102] [103] aunque el papel causal del exceso de FGF23 per sé en la enfermedad cardiovascular sigue siendo un tema de debate [104]. Se necesitan estudios futuros para definir mejor el impacto de la deficiencia de hierro, la anemia, la terapia con hierro y los AEE en la enfermedad óseo-mineral de la ERC y sus resultados adversos asociados. Estos estudios también deben tener en cuenta el carácter bidireccional de estas relaciones, ya que el FGF23 también está implicado como regulador de la eritropoyesis, el metabolismo del hierro y la inflamación sistémica [105] [106] [107] [108].
Hierro, respuesta inmune y microbiota
Se reconoce cada vez más que el hierro tiene un impacto en la inmunidad del huésped al alterar la proliferación y diferenciación de las células inmunitarias y al regular directamente la formación de citocinas y los mecanismos efectores inmunes antimicrobianos [109]. Estos efectos no solo pueden influir en el riesgo de infección como se discutió anteriormente, sino que también pueden tener otras consecuencias para la salud, incluyendo una respuesta potencialmente disminuida a la vacunación en caso de deficiencia de hierro [110] [111] [112]. Además, la suplementación con hierro oral puede alterar la microbiota intestinal y el metabolismo intestinal y sistémico, lo que puede afectar la salud intestinal, la inmunidad del huésped y tener otras consecuencias sistémicas para la salud [109]. Son necesarios estudios futuros para abordar estos problemas de una manera más detallada en pacientes con ERC.
Diseño de ensayos clínicos futuros
En la actualidad, solo el estudio PIVOTAL ha tenido un tamaño de muestra y una duración suficientes para permitir conclusiones estadísticamente válidas con respecto a los efectos de la administración de hierro en los resultados clínicos en pacientes con HDCKD. Se necesitan estudios similares en pacientes con NDCKD y estudios con diferentes objetivos de tratamiento y preparaciones de hierro en pacientes con HDCKD y NDCKD (Tabla 1). Futuros ensayos clínicos controlados y randomizados serán beneficiosos para desarrollar herramientas mejoradas y validadas que puedan determinar los objetivos óptimos de la corrección de la anemia de forma individualizada, medir la calidad de vida informada por los pacientes y evaluar los resultados clínicos concretos (Tabla 1). Estas herramientas deben ser fáciles de incluir en los ensayos y útiles en la práctica clínica. Podrían incluir dispositivos de salud portátiles (rastreadores de teléfonos), escalas de salud y test al caminar, destinadas a examinar las mejoras en el bienestar general. Muchas preguntas podrían abordarse a través del diseño de ensayos clínicos adaptados, que permitan modificaciones, planificadas en función de los datos de los ensayos recopilados. Estos enfoques adaptados podrían tener varias ventajas: (i) eficiencia estadística, especialmente con diseño secuencial y modificación adaptativa del tamaño de la muestra; (ii) un proceso para la finalización temprana del estudio, reduciendo así la exposición del paciente al riesgo asociado a la intervención; (iii) una mejor comprensión de los efectos de los fármacos en los subgrupos seleccionados; y (iv) receptividad de las partes interesadas tanto los patrocinadores como los pacientes.
USO DE SUPLEMENTOS DE HIERRO EN EL MANEJO DE LA ANEMIA DE LA ERC
Hierro oral
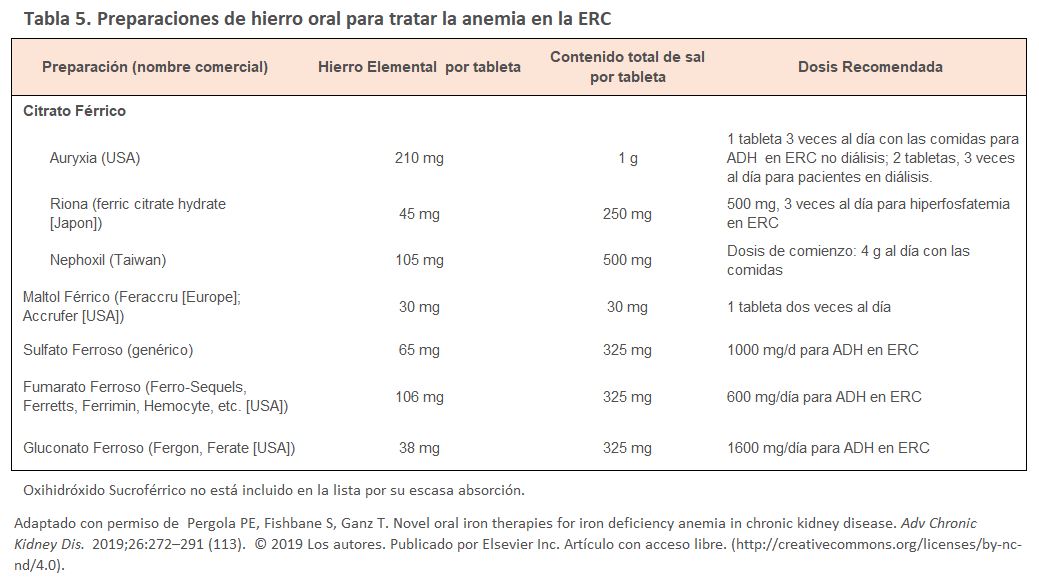
Los compuestos de hierro orales disponibles en la actualidad (Tabla 5) [113] tienen una eficacia variable para aumentar la Hb, la ferritina y la TSAT, y para reducir el uso de AEE y trasfusiones de sangre [65] [114] [115]. Los inconvenientes del hierro oral incluyen su menor eficacia en comparación con la ferroterapia i.v. [65] [115], la intolerancia gastrointestinal, la pobre absorción gastrointestinal debida a niveles elevados de hepcidina y posibles cambios en el microbioma (ver arriba) [109]. Sin embargo, la ferroterapia oral no es invasiva, evita complicaciones en el lugar de la inyección, no pone en peligro el capital venoso para la creación de fístulas arteriovenosas, no se ha asociado con reacciones de hipersensibilidad o aumento de las tasas de infección y no tiene efectos directos para inducir FGF23.
Las nuevas formulaciones de hierro oral pueden ofrecer algunas ventajas respecto a las formulaciones de hierro oral previamente disponibles en términos de eficacia y tolerabilidad, pero esta es un área poco estudiada. En pacientes con NDCKD (no diabéticos), se ha demostrado que el citrato férrico aumenta el IST, la ferritina y la Hb, asociado a una disminución del fosfato sérico y de los niveles de FGF23, así como de las necesidades de hierro i.v y de AEE [82] [100]. La evidencia preliminar de un solo ensayo sugiere que el citrato férrico reduce las tasas de hospitalización y muerte en comparación con el tratamiento estándar [100]. El hierro liposomal evita el contacto directo del hierro con la mucosa intestinal y evita el bloqueo del eje hepcidina-ferroportina intestinal a través de un mecanismo de captación diferente en las células M intestinales [113] [114] [115]]116]. En un pequeño ensayo clínico, el hierro liposomal aumentó la Hb en pacientes con NDCKD [116], aunque se necesitan ensayos clínicos más amplios que lo confirmen. Se han designado como áreas de investigación de alta prioridad la realización de ensayos clínicos futuros que investiguen los beneficios y riesgos de los nuevos compuestos de hierro oral en comparación con los compuestos clásicos o preparaciones de hierro i.v., y de las estrategias de dosificación óptimas (Tabla 1). En pacientes sin ERC, la administración oral de hierro en dosis única en días alternos versus cada día aumenta la absorción fraccional de hierro al limitar el impacto de la inducción de hepcidina mediada por hierro [117]. Deberían realizarse ensayos similares en pacientes con ERC (Tabla 1).
Hierro intravenoso
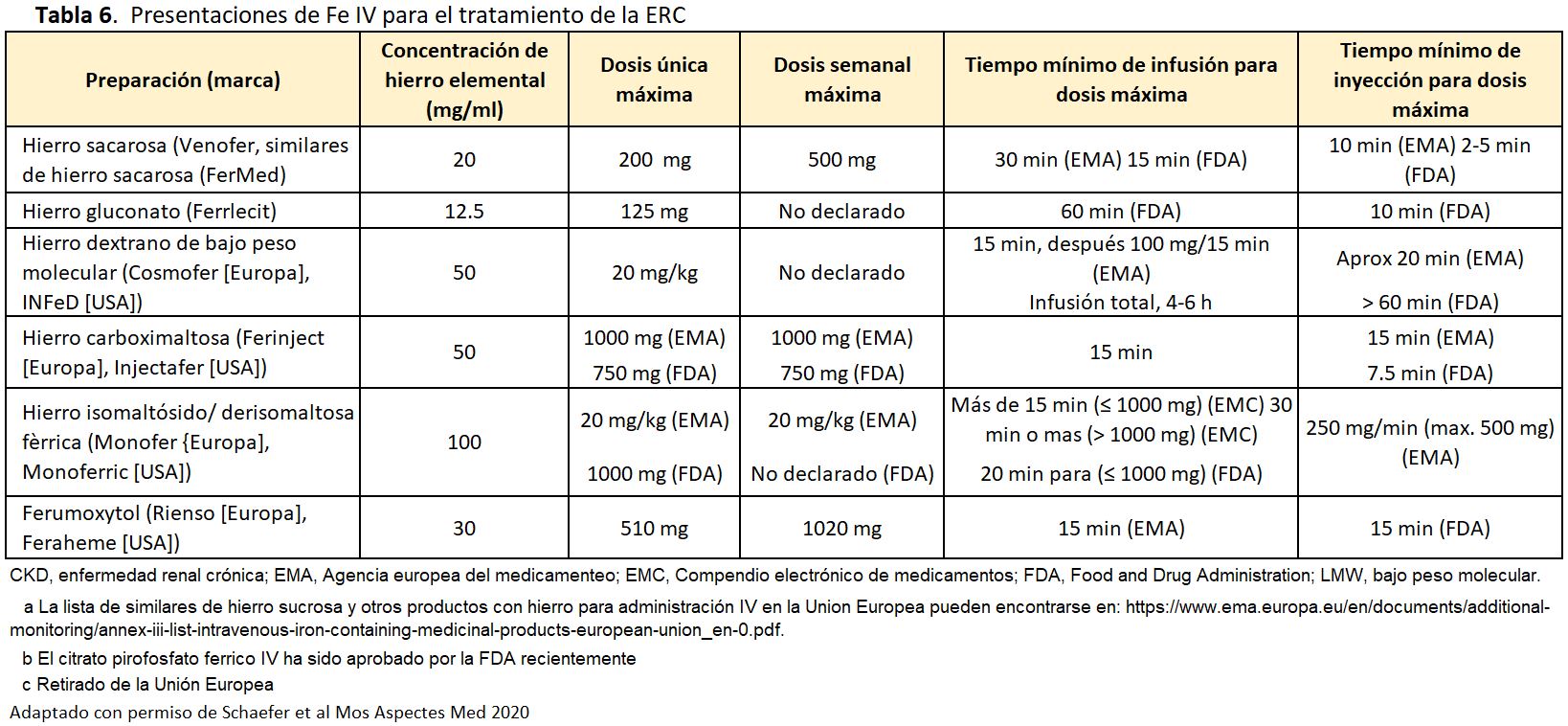
Las preparaciones (nanopartículas) de hierro i.v. están formadas por un núcleo de oxihidróxido / óxido de Fe3+ (Tabla 6) [118] recubierto con una capa de carbohidratos que determina funcionalidades específicas [119]. La evidencia disponible de ensayos clínicos [63] [113] [120] [121] [122] sugiere que las formulaciones de hierro i.v. tienen una eficacia comparable en la mejora de la Hb, ferritina e IST, y en reducir el uso de AEE o las transfusiones de sangre, aunque los similares de hierro sacarosa pueden tener una eficacia y seguridad menores comparados con el hierro sacarosa original [123] [124] [125]. Sin embargo, estos datos son limitados. El hierro i.v. tiene un buen perfil de seguridad global [65] [80] [115], aunque existen algunas diferencias de seguridad entre formulaciones. En particular, ciertas formulaciones i.v. confieren un mayor riesgo de hipofosfatemia,incluyendo el hierro carboximaltosa [90] [98] [126] [127] [128], el óxido de hierro sacarado [92], y el hierro polimaltosa [93], debido a su capacidad para inducir FGF23 (ver arriba). Aunque este riesgo se atenúa en pacientes con ERC más avanzada, se recomienda precaución en los receptores de trasplante de riñón y NDCKD. Además, se recomienda la medición del fosfato sérico en pacientes que reciben dosis repetidas o en pacientes sintomáticos que reciben la dosis pertinente de Fe i.v.. En general, la aparición de anafilaxia tras la administración de Fe i.v. es muy rara, pero se han descrito varios niveles de riesgo según las diferentes formulaciones de hierro i.v. [84].El riesgo de aparición de proteinuria [129] o marcadores de nefrotoxicidad puede variar dependiendo de la formulación de Fe i.v., pero los datos disponibles en pacientes con NDCKD sugieren que la administración de Fe i.v. no tiene un impacto negativo sobre la función renal (Tabla 3) [78] [130].
Las áreas prioritarias de investigación futura incluyen más ensayos clínicos aleatorizados en los que se comparen una frente a otra las distintas formulaciones de Fe i.v. para confirmar una eficacia similar entre ellas y para comprender mejor las diferencias de seguridad, así como estudios específicos de biodistribución y biodisponibilidad (Tabla 1).
Administración de hierro a través de dializado
El citrato de pirofosfato férrico es una sal de hierro soluble en agua que se administra a través de dializado o i.v. [131] [132]. A diferencia de otros hierros i.v. que son absorbidos por los macrófagos reticuloendoteliales para liberalizar el hierro, el citrato de pirofosfato férrico libera hierro directamente a la transferrina circulante [133]. Ensayos aleatorizados fase 2 y 3 han demostrado que el citrato de pirofosfato férrico mantiene los niveles de Hb sin un aumento excesivo de las reservas de hierro, junto con una disminución en las necesidades de agentes estimulantes de la eritropoyesis (AEE) [134] [135].
Sin embargo, no se ha demostrado si el citrato de pirofosfato férrico tiene un perfil de seguridad superior en comparación con la administración de hierro oral o intravenoso.
Objetivos y estrategias de tratamiento óptimos
Una de las principales estrategias para controlar la anemia es mantener niveles adecuados de IST y ferritina. La guía de anemia de KDIGO 2012 recomienda una prueba de administración de hierro i.v. en pacientes HDCKD (o una prueba de 1 a 3 meses con hierro oral para pacientes con NDCKD) si se desea un aumento en la Hb o una disminución en la dosis de AEE y el IST es ≤ 30% y la ferritina es ≤ 500 mcg/l [16].
La terapia continua con hierro debe basarse en una evaluación integrada de las respuestas de Hb, las pruebas del metabolismo férrico, la tasa de dosis/respuesta de AEE, las pérdidas sanguíneas durante la evolución y el estado clínico, aunque los datos disponibles en la actualidad son insuficientes para recomendar estrategias de administración y dosificación de hierro i.v. a largo plazo. Es importante destacar que estas recomendaciones de objetivos de tratamiento se basaron en gran medida en datos de estudios observacionales.
Existen nuevos datos a partir de ensayos aleatorizados que proporcionan evidencias firmes y un mayor ajuste a las recomendaciones de la guía de 2012. En el caso de pacientes con NDCKD, el estudio FIND-CKD indicó que la administración de hierro i.v. para conseguir una ferritina objetivo de 400 a 600 mcg/l fue superior al hierro i.v. pautado para conseguir una ferritina objetivo de 100 a 200 mcg/l o hierro oral para conseguir un aumento de Hb < 1 g/dl [136]. Sin embargo, no se evaluaron los eventos “duros” (directamente medibles y clínicamente relevantes: mortalidad, etc…) en los nuevos análisis [136].
Para los pacientes en hemodiálisis, el estudio PIVOTAL mostró que la actitud proactiva de administración de Fe i.v. administrado a menos que la ferritina sérica fuera > 700 mcg/l o el IST >40% fue superior a la estrategia de administración reactiva de Fe i.v. donde se pautaba Fe i.v. solo cuando el IST fuera < 20 % y la ferritina < 200 mcg/l, indicando que esta última estrategia debe evitarse [62].
Sin embargo, sigue siendo incierto si las estrategias de objetivos intermedios podrían ser suficientes o incluso óptimas. Además, se desconoce el límite superior del IST y de la ferritina en términos de seguridad, reducción de la dosis de AEE y los resultados o eventos duros de los pacientes. Estas preguntas deben abordarse en futuros estudios prospectivos aleatorizados tanto en pacientes con NDCKD como con HDCKD (Tabla 1).
Otras áreas poco estudiadas incluyen el algoritmo de tratamiento óptimo para el uso de la terapia con hierro en relación con la utilización de AEE [137]. Existe evidencia de que los objetivos de tratamiento óptimos pueden diferir en los diferentes países del mundo. Por ejemplo, los pacientes japoneses con HDCKD logran resultados similares con niveles medios de ferritina, mucho más bajos que los pacientes con HDCKD en los Estados Unidos y Europa, posiblemente relacionados con niveles más bajos de proteína C reactiva [138] [139]. Por lo tanto, otra área de investigación prioritaria es la terapia centrada en el paciente para adaptar mejor las decisiones de tratamiento en función de las características individuales del paciente (p. ej., fenotipo y genotipo) y no solo en los valores de Hb e IST de la población (Tabla 1).
EL IMPACTO DE LOS AEE Y LOS NUEVOS AGENTES TERAPÉUTICOS EN EL CONTROL DE LA HEMOGLOBINA, EL ESTADO DEL METABOLISMO FÉRRICO Y LAS NECESIDADES DE SUPLEMENTACIÓN DE HIERRO
Hierro y tratamiento con AEE
Los AEE aumentan las necesidades de hierro y disminuyen los distintos parámetros del metabolismo férrico, incluyendo hierro sérico, IST y ferritina. Los AEE también suprimen la hepcidina al inducir eritropoyesis y la eritroferrona, aumentando la disponibilidad de hierro desde las reservas de macrófagos y a partir de las fuentes dietéticas (Figura 1). La estimulación intensa con AEE puede desenmascarar o contribuir al déficit de hierro al provocar una fuerte demanda de hierro que supera el suministro del mismo. Esto puede ocurrir incluso si existen reservas adecuadas de hierro, particularmente en el contexto de una inflamación, que induce la síntesis de hepcidina y limita la liberación de hierro almacenado. Por tanto, la respuesta a los AEE se ve afectada por el estado del hierro y el grado de inflamación, que también inhibe la eritropoyesis a través de otros mecanismos [140] [141] [142].
Nuevas futuras terapias
Los HIF-PHI son pequeñas moléculas inhibidoras de las dioxigenasas (PHD1, PHD2 y PHD3) del dominio prolil-4-hidroxilasa (PHD), que detectan el oxígeno y el hierro y controlan la actividad de los HIF [143]. Los HIF son heterodímeros y actúan como factor de transcripción constituidos por una subunidad β y tres subunidades α reguladas por el oxígeno y el hierro (HIF-1 α, HIF-2 α o HIF-3α). En presencia de oxígeno y hierro, las subunidades de HIF-α se hidroxilan rápidamente por los PHD, lo que lleva a su degradación. Cuando el oxígeno y el hierro son deficitarios, los HIF se estabilizan para regular los procesos biológicos que facilitan el transporte y la entrega de oxígeno y hierro para mejorar la supervivencia celular, incluidos los genes involucrados en la angiogénesis, la glucólisis anaeróbica, el metabolismo mitocondrial y de ácidos grasos, la diferenciación y motilidad celular, la eritropoyesis y el metabolismo del hierro [144].
Los HIF-PHI inhiben la degradación de las subunidades HIF-α independientemente de los niveles de oxígeno y hierro, lo que da como resultado una mayor expresión de genes regulados por HIF, como EPO y genes implicados en la captación y transporte de hierro, por ejemplo, divalente por ejemplo, el transportador de metal divalente 1, citocromo B duodenal, ferroportina y transferrina [145] [146]. HIF-2 es particularmente importante en la regulación de los genes de la eritropoyesis y en el metabolismo del hierro (Figura 1).
Efectos sobre la eritropoyesis.
Los HIF-PHI estimulan la producción endógena de EPO en el riñón y en el hígado y pueden ejercer otros efectos que favorecen la eritropoyesis en la médula ósea [147]. Los resultados de los ensayos clínicos fase 2 y 3 en pacientes con ERC publicados recientemente, han demostrado que los HIF-PHI son eficaces para corregir y mantener estables los niveles de Hb [148] [149] [150] [151] [152] [153] [154] [155] [156]. Otro dato destacable que se ha descrito en los pacientes tratados con los HIF-PHI, es que se objetivan niveles plasmáticos de EPO más bajos que en los pacientes que reciben tratamiento con los AEEs tradicionales administrados por vía i.v. [151] [157]. La determinación de niveles en plasma de EPO más bajos puede suponer un importante beneficio clínico, ya que las dosis altas de AEEs en pacientes con ERC se ha asociado con un aumento del riesgo de morbimortalidad [158] [159]. Los resultados de varios estudios fase 3, realizados en pacientes con HDCKD en Asia, han demostrado la no inferioridad de los HIF-PHI en comparación con los AEEs tradicionales [150] [160] [161], pero aún es necesario esperar a los ensayos de seguridad para poder valorar la eficacia global y cardiovascular de este grupo de fármacos. Se prevé revisar todos estos datos en la conferencia de controversias de las KDIGO sobre nuevas terapias para el tratamiento de la anemia de los pacientes con ERC, prevista para este mismo año 2021.
Impacto en el metabolismo del hierro.
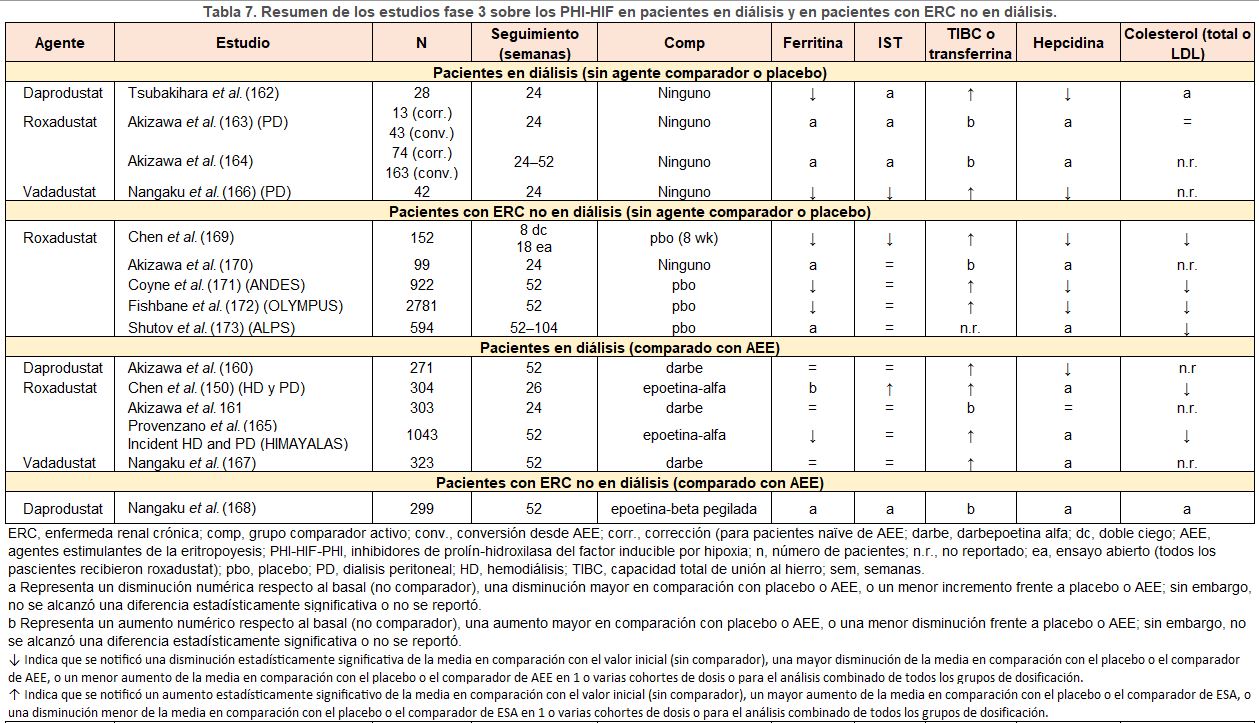
Se ha descrito que el efecto de los HIF-PHs en la homeostasis del hierro es principalmente por 2 mecanismos: (i) disminución de la producción de hepcidina en el hígado y (ii) aumento de la transcripción de genes que promueven la absorción intestinal y el transporte del hierro (Figura 1) [145]. La administración oral de HIF-PHI a los pacientes con ERC se ha asociado a una disminución de los niveles plasmáticos de hepcidina en comparación con los que recibieron placebo en los ensayos clínicos de fase 2 y 3 (Tabla 7) [150] [160] [161] [162] [163] [164] [165] [166] [167] [168] [169] [170] [171] [172] [173]. Varios estudios llevados a cabo, entre los que destacan estudios genéticos, estudios basados en cultivos celulares, así como estudios con anticuerpos neutralizantes de EPO, han proporcionado pruebas de que la hepcidina no es un objetivo transcripcional directo de HIF. En cambio, la activación sistémica o hepática específica de HIF suprime la hepcidina indirectamente a través de efectos dependientes de EPO en la eritropoyesis [174] [175] [176], que es el mismo mecanismo de acción para la supresión de hepcidina que los AEEs tradicionales. Son pocos los ensayos que han comparado los efectos sobre los niveles plasmáticos de hepcidina entre los pacientes a los que se les administra HIF-PHI y los que reciben los AEE tradicionales (Tabla 7). Estos estudios además tienen varias limitaciones, por lo que se requiere interpretarlos con precaución. Se necesitan más datos para poder definir si los HIF-PHI y los AEE son diferentes en cuanto a la capacidad para suprimir la liberación de hepcidina, y para conocer cuáles son los mecanismos moleculares responsables.
El papel de los fármacos HIF-PHI en la cinética del hierro en pacientes con ERC todavía no es bien conocido, los datos publicados son limitados para poder dar conclusiones definitivas (Tabla 7), aunque en el momento actual, conocer cómo influyen en esta cinética, es prioritario (Tabla 1). Aunque los resultados obtenidos de los estudios fase 2 y fase 3 sugiere que los HIF-PHIpueden reducir la necesidad de administrar suplementos de hierro i.v. [150] [162] [169] [177] [178] [179] [180] el grado en el que esto ocurre, especialmente en pacientes que están inflamados, sigue sin estar claro y es necesario establecerlo con futuros estudios. Queda también pendiente establecer hasta qué niveles de hierro es necesaria reponerlos y qué parámetros de laboratorio deben determinarse antes de iniciar de forma segura el tratamiento con los HIF-PHI. Las recientes recomendaciones de la Asian Pacific Society of Nephrology enfatizan en la importancia de evitar la reducción excesiva de los niveles de hierro sérico por HIF-PHI para minimizar el riesgo de efectos adversos asociados [181].
Otras áreas pendientes de resolver.
Existen otras áreas de investigación respecto a los mecanismos de acción de los HIF-PHI pendientes de resolver, y que en el momento actual, son una prioridad (Tabla 1). En particular, dado que los HIF regulan una gran cantidad de genes, no solo con efectos en la eritropoyesis, es muy importante conocer qué efectos no eritropoyéticos tienen y si estos son beneficiosos o pueden ser deletéreos [182]. Se sabe que algunos de los HIF-PHI reducen los triglicéridos séricos, el colesterol total y los niveles de lipoproteínas de baja densidad, en parte debido a un aumento en la degradación de la HMG-CoA reductasa, mediado por HIF [183] [184]. Algunos estudios preclínicos sugieren que los HIF-PHI disminuyen la presión arterial en modelos animales de ERC [185], pero este dato no ha sido corroborado aún en los ensayos clínicos. Otros beneficios observados en modelos animales son potenciales efectos antiinflamatorios mediados por HIF [186] [187], protección contra lesiones isquémicas y reducción de la progresión de la ERC [188]. Aunque los datos obtenidos de los estudios clínicos fases 2 y 3 han sugerido que los HIF-PHI pueden ser eficaces en pacientes con ERC independientemente del nivel basal de proteína C reactiva (Tabla 7) [150] [157] [177] [178] [189], es importante tener en cuenta que los pacientes muy inflamados fueron excluidos de la mayoría de estos ensayos. Entre las áreas de preocupación con respecto a los HIF-PHI se incluyen los posibles efectos en promover el desarrollo y crecimiento de tumores, el riesgo de desarrollar hipertensión arterial pulmonar [190] [191] [192] [193] [194], el posible efecto promotor del crecimiento de los quistes en pacientes con enfermedad renal poliquística [195], los efectos proangiogénicos en pacientes con retinopatías [196], el aumento de las calcificaciones vasculares [197] y el riesgo de alteraciones en el desarrollo embrionario y fetal.
Cabe destacar que hay varios HIF-PHI que se encuentran en desarrollo clínico avanzado (daprodustat, desidustat, enarodustat, molidustat, roxadustat, vadadustat), varios de ellos ya están comercializados en Asia.
Aunque todos los fármacos del grupo HIF-PHI son inhibidores potentes de PHD1, PHD2 y PHD3 y estabilizan tanto HIF-1α como HIF-2 α [198], existen diferencias tanto en la farmacocinética como en la farmacodinamia, así como en la dosificación y en la vida media. También se sabe que hay diferencias en el grado de activación génica regulada por HIF. Todas estas áreas están aún pendientes de definir y se evaluaran en profundidad en la conferencia de controversias de KDIGO programado para este mismo año 2021.
Otras estrategias terapéuticas nuevas
Actualmente están en discusión nuevas estrategias para el tratamiento de la anemia relacionada con la ERC que están en fase de investigación. Estas nuevas estrategias incluyen a los inhibidores de la producción de hepcidina o de su acción, que están en etapas de desarrollo a nivel preclínico y clínico (Tabla complementaria S1). Otras terapias que se están evaluando como alternativas para el tratamiento de la anemia renal, actualmente se utilizan o están siendo investigadas para el tratamiento de otras enfermedades como por ejemplo, los anticuerpos específicos de interleucina-6, otros productos biológicos antiinflamatorios y aquellos fármacos que actúan como “trampas” del ligando del receptor de activina [199] [200] [201] [202].La combinación de varios enfoques terapéuticos y el desarrollo de opciones de diseñar un tratamiento individualizado para la anemia renal se han reconocido como áreas importantes de investigación (Tabla 1). Por apuntar a múltiples procesos patógenos subyacentes simultáneamente, las terapias combinadas tendrían potencial para crear terapias individualizadas, minimizando costos y efectos colaterales y mejorando posiblemente la calidad de vida de los pacientes. Sin embargo, la combinación de varias terapias también podría aumentar el número de pastillas que se deben tomar, y por tanto aumentar el riesgo de eventos adversos.
En esta reunión se ha enfatizado en el hecho de que las nuevas estrategias terapéuticas para la anemia renal requieren que se realice una reevaluación de la estrategia de suplementación con hierro y también de los parámetros clínicos y de laboratorio que se deben determinar antes del inicio y para adecuado seguimiento del tratamiento.
Poblaciones especiales con enfermedad renal crónica
En algunas poblaciones, el tratamiento con hierro merece consideraciones específicas (Tabla complementaria S2). La seguridad y eficacia de los tratamientos para la anemia en niños con ERC es un área poco estudiada. La ausencia de ensayos clínicos aleatorizados que estudien los efectos de los AEE y el hierro sobre eventos serios en pacientes pediátricos anémicos con ERC plantea dudas sobre si el manejo actual de la anemia y de suplementación de hierro es apropiado. Los resultados de pequeños estudios abiertos y retrospectivos sugieren que los nuevos agentes de hierro, incluidos pirofosfato y citrato férricos, puede ser eficaz en los niños [131] [203], pero se requieren más datos para confirmar estos hallazgos. Las investigaciones clínicas sobre HIF-PHI en pacientes pediátricos con ERC aún no están disponibles, pero están previstas [204]. Se planteó preocupación a propósito de los posibles efectos adversos de la activación sistémica de HIF en el desarrollo embrionario y fetal, así como en el desarrollo y crecimiento en los niños.
En particular, los efectos reductores del colesterol que se han comunicado con algunos HIF-PHI pueden afectar al desarrollo del sistema nervioso y mielinización. Además, los modelos de ratón han mostrado efectos adversos de la activación genética de HIF sobre el crecimiento y desarrollo del hueso y del cartílago [205] [206]. Sin embargo, es difícil extrapolar los hallazgos de modelos genéticos en ratones y hacer predicciones sobre los efectos de la estabilización farmacológica de HIF en niños con ERC.
CONCLUSIONES
Los participantes de la conferencia estuvieron de acuerdo en que existe nueva información extraída de los nuevos ensayos clínicos aleatorizados prospectivos y nuevos tratamientos para justificar la convocatoria de un nuevo grupo de trabajo para revisar las guías de anemia KDIGO 2012.
También hubo consenso en que hay muchas áreas donde se necesita mucha más investigación. En particular, los parámetros actualmente utilizados de Hb, IST y ferritina sérica que no son fiables para estimar los depósitos de hierro corporales o predecir la respuesta al tratamiento. Además, los límites óptimos, los objetivos y estrategias de tratamiento para la anemia son todavía desconocidos y no se han personalizado para un estado específico de enfermedad, para la edad, sexo o en el contexto de otras comorbilidades.
La necesidad de incrementar la complejidad y especificidad de los objetivos de tratamiento para los pacientes están en consonancia con la tendencia a individualizar la terapia en todas las especialidades. Será importante para estudios futuros el desarrollo y validación de herramientas perfeccionadas para determinar objetivos de corrección de anemia óptimos e individualizados, la medición de la calidad de vida informada por el paciente y la evaluación de eventos serios. Aunque se ha predicho que la familia de agentes HIF-PHI beneficia el metabolismo del hierro, los datos de estudios clínicos que corroboran sus propiedades ferrocinéticas predichas en pacientes con ERC todavía no están claramente establecidos y son de alta prioridad.
APÉNDICE
Otros participantes de la conferencia
Ali K. Abu-Alfa, Lebanon; Baris Afsar, Turkey; Amy Barton Pai, USA; Anatole Besarab, USA; Geraldine Biddle Moore, USA; Nicole Casadevall, France; Aleix Cases, Spain; Angel de Francisco, Spain; Kai-Uwe Eckardt, Germany; Steven Fishbane, USA; Linda F. Fried, USA; Tomas Ganz, USA; Yelena Z. Ginzburg, USA; Rafael Gómez, Colombia; Lawrence T. Goodnough, USA; Takayuki Hamano, Japan; Mark R. Hanudel, USA; Chuan-Ming Hao, China; Kunitoshi Iseki, Japan; Joachim H. Ix, USA; Kirsten L. Johansen, USA; Markus Ketteler, Germany; Csaba P. Kovesdy, USA; David E. Leaf, USA; Iain C. Macdougall, UK; Ziad A. Massy, France; Lawrence P. McMahon, Australia; Roberto Minutolo, Italy; Takeshi Nakanishi, Japan; Elizabeta Nemeth, USA; Gregorio T. Obrador, Mexico; Patrick S. Parfrey, Canada; Hyeong-Cheon Park, Korea; Roberto Pecoits-Filho, USA; Bruce M. Robinson, USA; Simon D. Roger, Australia; Yatrik M. Shah, USA; Bruce S. Spinowitz, USA; Tetsuhiro Tanaka, Japan; Yusuke Tsukamoto, Japan; Kriang Tungsanga, Thailand; Carl P. Walther, USA; Angela Yee-Moon Wang, Hong Kong, SAR, China; and Myles Wolf, USA
DISCLOSURE
JLB ha declarado recibir honorarios de consultoría de Disc Medicine e Incyte Corporation; propiedad de capital de Ferrumax Pharmaceuticals; apoyo a la investigación de los Institutos Nacionales de Salud (subvención RO1-DK087727) y la beca de investigación de Patricia y Scott Eston del Hospital General de Massachusetts ; y regalías de patentes de propiedad intelectual perteneciente al Massachusetts Hospital general que es licencia de Ferrumax Pharmaceuticals sobre terapias dirigidas a BMP y HJV para trastornos del hierro. MFE ha declarado recibir honorarios de consultoría de Vifor Pharma; servir en la n la Junta Asesora de Cablon Medical; y participar en agencias de oradores de Vifor Pharma. VHH ha declarado recibir honorarios de consultoría de Akebia Therapeutics, AstraZeneca, FibroGen, Incyte Corporation y Rockwell Medical. AVK ha declarado recibir honorarios de consultoría de Rockwell Medical. AL ha declarado recibir honorarios de consultoría de AstraZeneca y apoyo a la investigación de AstraZeneca. FL ha declarado recibir honorarios de consultoría de Amgen y AstraZeneca, y participar en agencias de oradores de Amgen, AstraZeneca y Roche. JM ha declarado recibir honorarios de consultoría de AstraZeneca y participar en agencias de oradores de Bayer Healthcare. DWS ha declarado recibir honorarios de consultoría de Silence Therapeutics. MJ ha declarado recibir honorarios de consultoría de Astellas, AstraZeneca, Boehringer Ingelheim, Fresenius Medical Care Asia Pacífic, Mundipharma y Vifor Fresenius Medical Care; y participar en agencias de oradores de Astellas, AstraZeneca, Mundipharma, y Vifor Fresenius Medical Care; y recibir apoyo para la investigación de Amgen y el apoyo a la investigación futura de AstraZeneca. WCW ha declarado recibir honorarios de consultoría de Akebia / Otsuka, AstraZeneca, Bayer Healthcare, Janssen, Merck, Reata y Relypsa; futuros honorarios de consultoría de Boehringer Ingelheim; y apoyo a la investigación de los Institutos Nacionales de Salud. TBD ha declarado recibir honorarios de consultoría de Astellas, GlaxoSmithKline y KfH Stiftung; y futuros honorarios de consultoría de Astellas. Todos los demás autores declararon no tener conflicto de interés alguno.
AGRADECIMIENTOS
Esta conferencia fue patrocinada por KDIGO y apoyada en parte por becas educativas sin restricciones de Akebia Therapeutics, AMAG Pharmaceuticals, Amgen, Astellas, AstraZeneca, Boehringer Ingelheim, FibroGen, GlaxoSmithKline, Mitsubishi Tanabe Pharma Group, Pharmacosmos, Roche, Rockwell Medical, Torii Pharmaceutical, and Vifor Fresenius Medical Care Renal Pharma.
MATERIAL SUPLEMENTARIO
Archivo complementario (PDF)
Tabla S1. Inhibidores de hepcidina en desarrollo.
Tabla S2. Consideraciones especiales en poblaciones específicas con ERC.
Estas tablas no deben traducirse yo creo. Están al final del PDF pinchando en el apartado de Supplementary File (PDF) pero no veo como hacer el click desde NAD.
Referencias complementarias.
La agenda de la conferencia, preguntas de discusión y las presentaciones de la sesión plenaria están disponibles en el sitio web de KDIGO: https://kdigo.org/conferencias / controversias-conferencia-sobre-manejo-óptimo-de-anemia-en-ckd /.