Daño renal y neoplasias de órganos sólidos. Manejo del cáncer renal (2020)
Resumen
La asociación entre enfermedad renal y cáncer es multifacética y compleja. Las personas con enfermedad renal crónica (ERC) tienen una mayor incidencia de cáncer, y tanto el cáncer como los tratamientos contra el cáncer pueden causar alteraciones de la función renal. Las complicaciones renales en el contexto de una enfermedad maligna pueden empeorar los resultados del paciente y disminuir la idoneidad de los tratamientos contra el cáncer. Además, el panorama del tratamiento oncológico está cambiando rápidamente y los datos sobre la tolerancia de nuevas terapias en pacientes con ERC están frecuentemente ausentes. El cuidado de los pacientes oncológicos se ha hecho más especializado e interdisciplinario, requiriendo actualmente la colaboración entre especialistas en nefrología, medicina, oncología, cuidados intensivos, farmacología / farmacia clínica, y cuidados paliativos, además de cirujanos y urólogos. Con la finalidad de identificar los problemas claves en nefrología relacionados con pacientes con enfermedad maligna, KDIGO (Kidney Disease: Improving Global Outcomes) convocó un panel global de clínicos multidisciplinarios y científicos con experiencia a una conferencia de controversias sobre onconefrología en diciembre de 2018. Este informe cubre preguntas relacionadas con insuficiencia renal y procesos malignos de órganos sólidos así como el manejo y tratamiento del cáncer renal. Se describen lagunas de conocimiento, áreas de controversia y prioridades de investigación
Introducción
La enfermedad renal y el cáncer tienen una asociación multifacética. Las personas con enfermedad renal crónica (ERC) tienen una mayor incidencia de cáncer en relación con los pacientes sin ERC [1] [2]. Además, tanto el cáncer como los tratamientos contra el cáncer pueden causar insuficiencia renal, tanto aguda (IRA ó AKI) como crónica (ERC). Los problemas renales en el contexto de malignidad pueden empeorar los resultados del paciente y disminuir la adecuación de los tratamientos contra el cáncer. Pacientes cuyo cáncer es potencialmente curable pueden experimentar fallo multiorgánico que requieren cuidados intensivos y tratamiento de reemplazo renal. En algunos países, la mejora de la mortalidad por cáncer debido a una mayor eficacia del tratamiento ha dado lugar a una población creciente de pacientes con cáncer que sobreviven [3] y que tienen un mayor riesgo de nefropatía. Finalmente, el proceso maligno avanzado complicado con enfermedad multiorgánica plantea preguntas relacionadas con la idoneidad de un tratamiento agresivo versus paliativo.
La compleja relación entre la enfermedad renal y el cáncer se ve confundida por un panorama de tratamientos que cambian rápidamente. El cuidado de los pacientes oncológicos se ha vuelto más especializado e interdisciplinario, y actualmente, requiere colaboración entre los especialistas en nefrología, oncología médica, cuidados intensivos, farmacología / farmacia clínica y paliativos, además de cirujanos y urólogos. Para identificar los problemas relevantes clave en el manejo en nefrología de los pacientes con procesos malignos, KDIGO (Kidney Disease: Improving Global Outcomes) convocó un panel global de clínicos multidisciplinarios y científicos con experiencia a una conferencia de controversias sobre onconefrología en Milán, Italia, en diciembre de 2018. El informe cubre cuestiones relacionadas con la insuficiencia renal y enfermedades malignas de órganos sólidos, así como el manejo y tratamiento del cáncer de riñón. Se describen lagunas de conocimiento, áreas de controversia y prioridades de investigación.
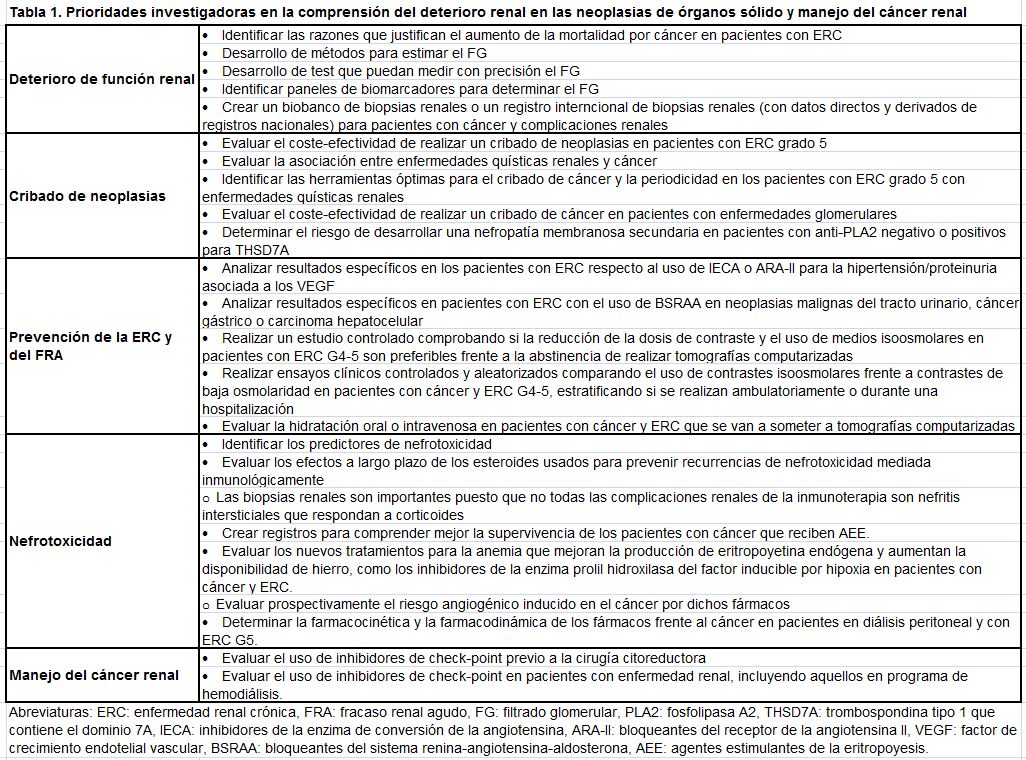
DETERIORO RENAL Y PROCESOS MALIGNOS DE ÓRGANOS SÓLIDOS
La ERC es muy prevalente en pacientes con cáncer; se estima que la prevalencia de tasa de filtrado glomerular estimada (eGFR) 60 ml / min /1,73 m2 en pacientes con cáncer es de 12 a 25% [4] [5] [6] [7] [8] [9]. Ciertos cánceres, como el carcinoma de células renales (CCR) [7] [10] y el cáncer de vejiga [11], tienen una mayor prevalencia de ERC que otros. La presencia de ERC empeora las tasas de supervivencia de pacientes con cáncer [5] [8] [12] [13] [14]. Los pacientes con ERC G5 tienen una mayor riesgo de ciertos tipos de cánceres: riñón, vejiga y cánceres asociados a infecciones asociadas como lengua, hígado y cuello uterino [15] [16] [17] [18] [19]. En hombres, la ERC G3 o superior se ha asociado con un aumento del riesgo de cáncer del tracto urinario [20]. Se desconoce por qué los pacientes con ERC tienen una mayor mortalidad relacionada con el cáncer en relación a quienes no tienen ERC (Tabla 1) [21] [22].
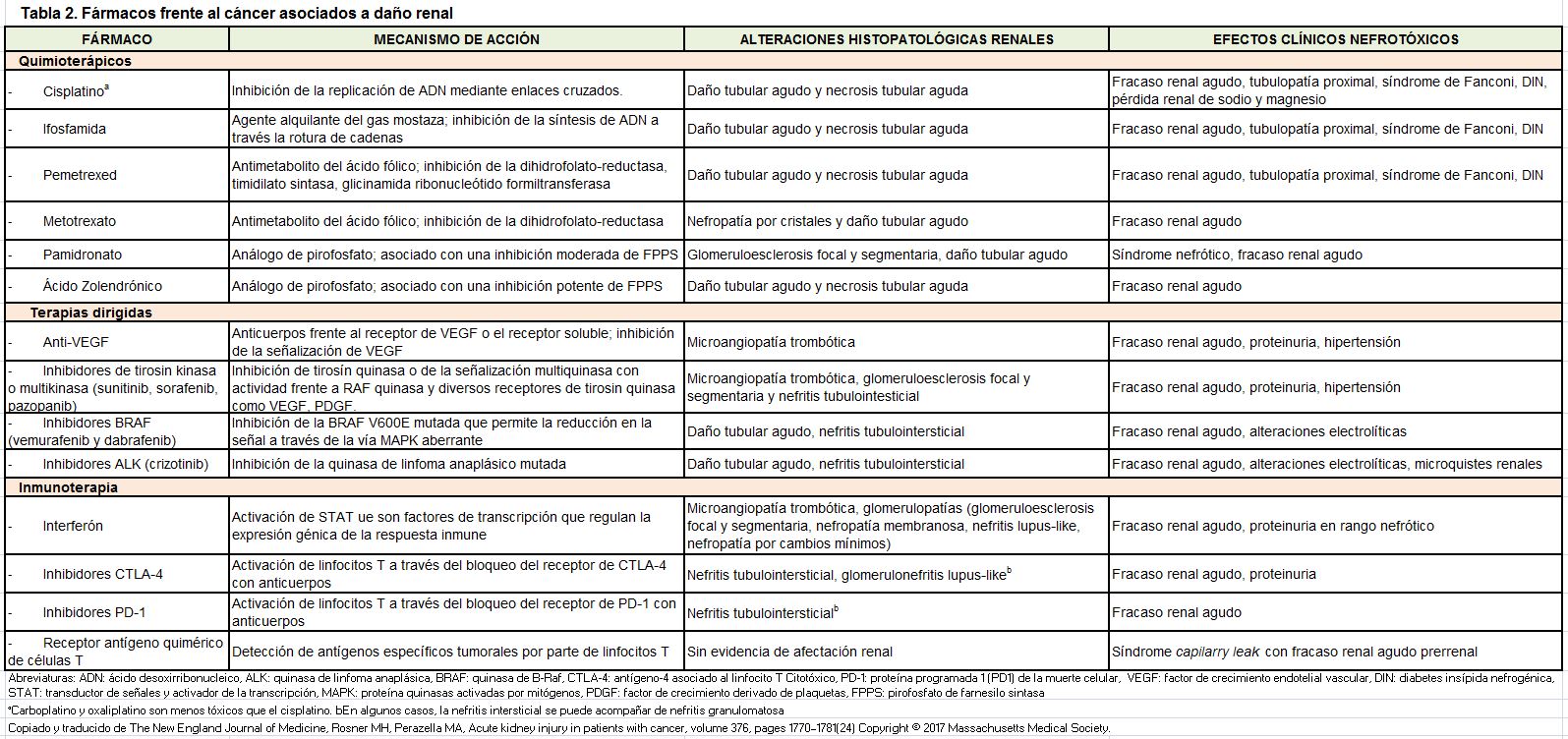
Las causas y mecanismos fisiopatológicos de la IRA (AKI) y la ERC en cánceres sólidos pueden ser prerrenales (por ejemplo, depleción de volumen, hipotensión, compresión vascular, caquexia por cáncer), renal (p. ej., enfermedades glomerulares, enfermedad tubulointersticial o renovascular) y posrrenal (p. ej., obstrucción importante, retención urinaria, nefrolitiasis) [23] [24]. Los tratamientos más comunes del cáncer que pueden inducir IRA (AKI) se enumeran en la (Tabla 2) [21].
Las causas y mecanismos fisiopatológicos de la IRA (AKI) y la ERC en cánceres sólidos pueden ser prerrenales (por ejemplo, depleción de volumen, hipotensión, compresión vascular, caquexia por cáncer), renal (p. ej., enfermedades glomerulares, enfermedad tubulointersticial o renovascular) y posrrenal (p. ej., obstrucción importante, retención urinaria, nefrolitiasis) [23] [24]. Los tratamientos más comunes del cáncer que pueden inducir IRA (AKI) se enumeran en la (Tabla 2) [21].
Evaluación de la función renal
La medición precisa del filtrado glomerular (FG) es fundamental a la hora de decidir el tratamiento y dosificación de fármacos y control de la función renal. Desafortunadamente, todas las fórmulas disponibles pueden subestimar o sobreestimar el FG [25]. Además, la presencia de sarcopenia causa inexactitudes en la estimación del FG. Diferentes ecuaciones basadas en la creatinina plasmática se utilizan para estimar el FG en pacientes con cáncer: la fórmula de Cockcroft-Gault, la MDRD (modificación de la dieta en enfermedad renal) y la CKD-EPI (ecuación de colaboración epidemiológica de la enfermedad renal). Sin embargo, estos modelos para la estimación del FG fueron desarrollados principalmente en poblaciones sin cáncer, y su utilidad en el entorno oncológico es incierta. Recientemente, un gran estudio de Janowitz y cols. demostró que la ecuación CKD-EPI ajustada por área de superficie corporal fue la más precisa y menos sesgada en pacientes con cáncer según la comparación con el aclaramiento radioisotópico con ácido etilendiaminotetraacético cromo-51 [26]. La calculadora de FG en línea está disponible en http: //tavarelab.cruk. cam.ac.uk/JanowitzWilliamsGFR/
El grupo de trabajo de la conferencia acordó que la ecuación CKD-EPI [27] es el mejor enfoque actual para dosificar tratamientos quimioterápicos en pacientes con ERC. Las ecuaciones basadas en cistatina C pueden conferir una mayor precisión al predecir la eliminación de fármacos por vía renal [28]; sin embargo, con tratamientos oncológicos diana, la proteólisis mediada por catepsina D puede reducir la cistatina C independientemente de la función renal. Por lo tanto, no se recomienda el uso universal de ecuaciones basadas en cistatina C [29]. El uso de la fórmula de Cockcroft-Gault para determinar la dosificación de agentes quimioterápicos es problemático porque puede subestimar el aclaramiento de creatinina, lo que lleva a reducciones inapropiadas de la dosis de los tratamientos contra el cáncer [30]. Se necesitan métodos para estimar el FG, al igual que pruebas que puedan medir rápidamente el FG [31] [32].
Aplicabilidad y eficacia de varios diagnósticos en el entorno de onconefrología
Investigaciones renales en pacientes con neoplasias malignas de órganos sólidos
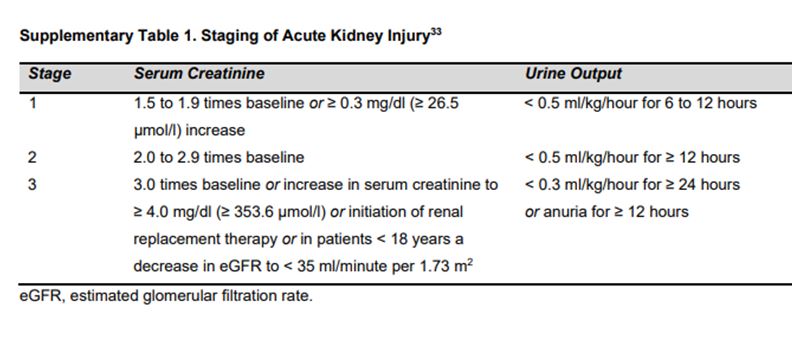
Para los pacientes con malignidad de órganos sólidos, la clave de las investigaciones renales en el momento del diagnóstico son una evaluación de la función renal, comorbilidades, equilibrio ácido-base y electrolítico así como análisis de orina. La ecografía renal es útil en pacientes con cáncer que desarrollan IRA, a menos que los riñones ya hayan ha sido evaluados adecuadamente con otras imágenes radiológicas. En candidatos a nefrectomía, la gammagrafía renal se puede utilizar para evaluar la función de un solo riñón, o puede apoyar la elección de cirugía radical versus parcial en el carcinoma renal. Durante el tratamiento oncológico, para pacientes con o sin IRA, las investigaciones renales incluirían las pruebas de seguimiento habituales según el tipo de cáncer y tratamientos. Para pacientes en quienes se está desarrollando IRA (Tabla complementaria S1) es la (Tabla 3) [33]. Las evaluaciones renales clave son similares a los sugeridos en el diagnóstico de cáncer, con la adición de la proporción de proteína / creatinina en una muestra aislada de orina. Durante el seguimiento tras tratamiento oncológico las consultas de nefrología están indicadas si los pacientes muestran cambios en la función renal o aumento de la proteinuria.
Detección de cáncer en pacientes en diálisis.
La detección de cáncer en el entorno de la insuficiencia renal puede ser rentable si la esperada supervivencia es lo suficientemente larga o el paciente es un candidato a trasplante. Por el contrario, el cribado integral en pacientes con una esperanza de vida limitada puede no ser beneficioso [34]. Por lo tanto, las decisiones sobre el cribado del cáncer en pacientes con ERC G5 deben hacerse de forma individual, tomando en cuenta la supervivencia esperada, los factores de riesgo y la situación con respecto al trasplante.
Detección de cáncer en pacientes con glomerulonefritis. En todos los pacientes con nefropatía membranosa, particularmente aquellos mayores de 60 años, debe considerarse la detección de cáncer siguiendo las pautas apropiadas para la edad. En pacientes con nefropatía membranosa con características de nefropatía membranosa secundaria en la biopsia renal (depósitos subendoteliales o mesangiales, > 8 leucocitos por glomérulo, subtipo no IgG-4) deben ser examinados más intensamente para malignidad subyacente [35]. Aquellos pacientes con enfermedad de cambios mínimos que tienen anemia inexplicable, proteína sérica anormal electroforesis, hepatoesplenomegalia o linfadenopatía deben cribarse para enfermedad maligna, especialmente el linfoma de Hodgkin [36].
Biopsia renal en pacientes con cáncer y alteraciones urinarias
La biopsia renal se debe considerar en los pacientes con cáncer y desarrollo de proteinuria de novo (definida como más de 1 gramo al día según el panel de expertos de la conferencia) o en aquellos con deterioro de la función renal, siempre que el diagnóstico no se justifique por otra etiología y pueda cambiar el manejo clínico. Se debe evitar la realización de biopsias renales en pacientes con mal pronóstico, sobre todo si la expectativa de mejoría vital tras un diagnóstico es inferior a la supervivencia del paciente.
En pacientes con cáncer renal a los que se va a realizar una cirugía, se recomienda examinar el riñón contralateral en busca de una patología subyacente [37] [38]. La indicación de biopsia renal en los pacientes que sobreviven a un cáncer y que gozan de un buen pronóstico sin datos de neoplasia activa, debe ser la misma que en la población general. Sin embargo, la realización de una biopsia renal y, especialmente, de una re-biopsia se debe valorar para identificar las consecuencias de los diferentes tratamientos sistémicos, así como los efectos de toxicidad inducida por radioterapia [38] [39].
Hasta la fecha, se han realizado muy pocas biopsias renales en pacientes con cáncer y complicaciones renales. De hecho, la puesta en marcha de un biobanco de muestras renales, así como un registro internacional de biopsias, puede ayudar a conocer más claramente el espectro de las lesiones renales asociadas al cáncer y a sus tratamientos (Tabla 1).
Prevención del desarrollo o progresión de la IRA (AKI) o de la enfermedad renal crónica
Inhibidores de la enzima de conversión de la angiotensina o bloqueantes del receptor de la angiotensina II en enfermedad renal crónica o en pacientes nefrectomizados por cáncer renal.
Los fármacos inhibidores de la enzima de conversión de la angiotensina (IECA) o los bloqueantes del receptor de la angiotensina II (ARA-II) se deben considerar en el manejo de los pacientes nefrectomizados con ERC en los que exista una indicación para inhibir el sistema renina angiotensina aldosterona (SRAA) (como por ejemplo, hipertensión, proteinuria o afectación cardiaca) [40] [41] [42]. Dichos fármacos pueden ser de utilidad en pacientes con hipertensión y/o proteinuria derivados del uso de los inhibidores del factor de crecimiento endotelial vascular (VEGF), aunque la evidencia en el momento actual es escasa. El uso de IECA y ARA-II en los pacientes con cáncer podría estar relacionada con un aumento de la supervivencia de estos pacientes [43] [44] [45] [46] [47] [48]. En un metaanálisis que incluyó 11 estudios se demostró su beneficio en el cáncer de vía urinaria (hazard ratio [HR] 0.22), cáncer colorrectal (HR 0.22), cáncer de páncreas (HR 0.58), cáncer de próstata (HR 0.14), aunque sin beneficio en el cáncer de mama o en el hepatocelular [47]. Dicho metaanálisis determina que el uso de IECA o ARA-II en los pacientes con cáncer puede incluso propiciar un 40% de reducción en la recaída del tumor o hasta un 25% de mejoría en la supervivencia. En otro metaanálisis que incluyó 55 estudios usando inhibidores del SRAA, se demostró un efecto similar sobre la supervivencia, si bien es cierto que el beneficio dependió del tipo de tumor y también del tipo de fármaco (IECA o ARA-II) que se utilizó [48]. El mayor beneficio se observó en los tumores malignos del tracto urinario, como el carcinoma de células renales, cáncer urotelial superior, tumor de vejiga, así como el cáncer gástrico y el hepatocarcinoma. En cualquier caso, se requieren más estudios con resultados focalizados en pacientes con ERC de los que aun carecemos.
En los pacientes que reciben tratamiento sistémico activo, el uso de bloqueantes del SRAA se puede asociar a mayor riesgo de presentar IRA [49] [50], por lo que su indicación debe decidirse de manera individualizada en cada caso. Incluso podría considerarse su discontinuación en algunas situaciones durante el tratamiento del cáncer para evitar efectos indeseados.
Insuficiencia renal aguda inducida por contraste
La IRA inducida por contraste es una situación relevante en el momento actual y que pone el foco especialmente en pacientes con algunas comorbilidades y, sobre todo, en los pacientes con ERC (grados 3b-5). El uso de medios de contraste y, especialmente, la necesidad de exámenes repetidos con contraste incrementa el riesgo de IRA. Asimismo, los pacientes inestables o que presentan alguna alteración tienen mayor riesgo de presentar IRA tras la administración de un contraste que aquellos estables que se examinan de manera ambulatoria [51]. En los pacientes que no padecen un cáncer, aquellos con ERC G4-5 tienen una mayor incidencia de IRA inducido por contraste que aquellos con mejor función renal (G3a-G3b) (13.6% vs 2.7%) incluso tras la administración profiláctica de hidratación [52]. No se han realizado estudios aleatorizados sobre el riesgo de la administración de contraste radiológico en pacientes oncológicos, y no existen datos suficientes para determinar si los pacientes con ERC y cáncer deben recibir menor cantidad de contraste cuando se les realizan exploraciones mediante tomografía computarizada (TC). En un análisis retrospectivo de pacientes con cáncer [53], la prevalencia de nefropatía inducida por contraste (NIC) fue del 9% en aquellos pacientes con enfermedad renal preexistente (el 50% tuvieron NIC irreversible) y aproximadamente del 5% si no tenían enfermedad renal previa. Cicin y cols [54] describieron un riesgo 4,5 veces mayor de NIC entre los pacientes oncológicos sometidos CT dentro de los 45 días posteriores a la finalización de la quimioterapia frente a aquellos que no recibieron quimioterapia o se sometieron a CT más de 45 días después de finalizar la quimioterapia. Sin embargo, el concepto de NIC ha sido cuestionado debido a los resultados de análisis pareados de propensión múltiple que incluyeron más de 60,000 pacientes, incluidos con cáncer, en quienes el riesgo de IRA no fue significativamente mayor tras la realización de un CT con un contraste estándar frente a un contraste adecuado [55] [56]. Así mismo, una revisión sistemática demostró un riesgo similar de IRA, inicio de diálisis y mortalidad en ambos grupos [57].
El temor injustificado a desarrollar una NIC podría limitar la realización de estudios o de pruebas diagnósticas más adecuadas a los pacientes con ERC y reducir con ello sus posibilidades diagnósticas al no aplicarse los protocolos de seguimiento correctos. Por lo tanto, a los pacientes con ERC no se les debe denegar la realización de tomografías con contraste radiológico si los beneficios superan los riesgos de desarrollar una IRA. En pacientes con ERC G4 y G5, es preferible reducir la dosis de contraste y utilizar contrastes isoosmolares que limitar la realización de TC, aunque su rentabilidad (coste-efectividad) debe ser validada mediante estudios controlados.
Actualmente, es habitual la administración de salino intravenoso y/o hidratación oral durante el procedimiento radiológico en función del FG aunque los resultados tanto de estudios prospectivos y de metaanálisis son algo contradictorios [58]. Por ejemplo, en el estudio AMACING un ensayo controlado aleatorizado de pacientes con ERC G3a-G3b sin cáncer, la ausencia de profilaxis con hidratación intravenosa previa al procedimiento no mostro ser inferior en la prevención de la IRA postcontraste y tampoco supuso un ahorro de gastos frente al empleo de hidratación previa [59]. Así mismo, los resultados del ensayo PRESERVE en más de 5000 pacientes sin cáncer no apoyaron la eficacia de la administración de bicarbonato sódico y de acetilcisteína para prevenir la IRA poscontraste [60].
En base a los datos referidos es prioritario realizar un ensayo controlado y aleatorizado que compare el empleo de medios de contraste iso-osmolares frente a los de baja osmolaridad en pacientes con ERC G3b-G4 y cáncer, estratificados para pacientes ambulatorios y hospitalizados (Tabla 1). Así mismo, también es necesario evaluar el efecto de la hidratación oral frente a la intravenosa en pacientes con cáncer y ERC G3b-G5 (no tratados con diálisis) sometidos a tomografías computarizadas de manera repetida.
Manejo de las toxicidades renal asociada a los tratamientos
Nefrotoxicidad de tratamientos oncológicos
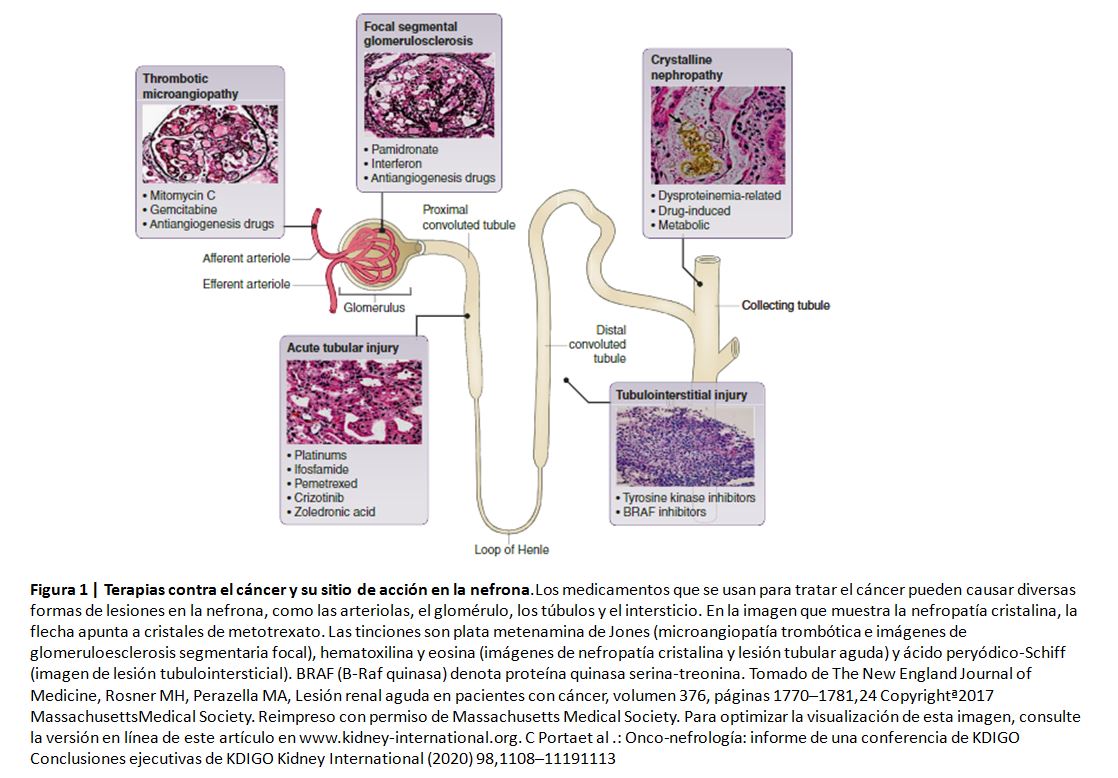
La nefropatía por radiación puede ocurrir después de un trasplante de células madre hematopoyéticas o después del tratamiento con radioisótopos. Los fármacos anticancerosos son una causa relativamente común de IRA y ERC, así como de alteraciones electrolíticas y ácido-base (Figura 1) [24]. En general estos fármacos anticáncer se pueden clasificar generalmente como (i) quimioterápicos citotóxicos, (ii) agentes dirigidos (targeted), e (iii) inmunoterapia (Tabla 2).
Los quimioterápicos citotóxicos son la causa más frecuente de lesión renal e incluyen numerosos agentes, como los compuestos que contienen platino (especialmente cisplatino), ifosfamida, gemcitabina, metotrexato y pemetrexed. La necrosis tubular aguda (NTA) es la lesión renal más común; Sin embargo, también se han detectado otras lesiones renales, como microangiopatía trombótica (MAT), podocitopatías, tubulopatías (síndrome de Fanconi, perdida de sal y magnesio, diabetes insípida nefrogénica), nefritis tubulointersticial aguda o crónica y nefropatía por cristales.
Los agentes dirigidos constituyen un grupo cada vez más importante en el tratamiento de diversas neoplasias, pero sus efectos adversos a nivel renal dificultan su uso. Los fármacos anti-angiogénicos se han asociado con hipertensión (de novo o refractaria), proteinuria (a veces nefrótica) y lesiones como MAT, enfermedad de cambios mínimos/ glomeruloesclerosis focal segmentaria y nefritis intersticial aguda (NIA). Otros agentes como el B-Raf y los inhibidores de la quinasa del linfoma anaplásico causan AKI (NTA y NIA) con menos frecuencia, mientras que los inhibidores del proteasoma se han asociado con MAT; en particular, los inhibidores ALK del linfoma anaplásico (ej., crizotinib) y los inhibidores de CDK4 y CDK6 (ej., abemaciclib) pueden causar un aumento de la creatinina sérica debido a que inhiben la secreción de creatinina, sin llegar a producir un daño renal establecido [61] [62]. Los inhibidores del factor de crecimiento epidérmico, en particular cetuximab, se han asociado con hipomagnesemia por pérdida renal de magnesio.
Los agentes inmunoterápicos también pueden causar daño renal. Se conocen bien los más antiguos, así como sus efectos; el interferón está asociado con diferentes tipos de glomerulonefritis (ej., glomeruloesclerosis focal, nefropatía membranosa, nefritis lupus-like, enfermedad de cambios mínimos), así como con MAT, mientras que la interleucina-2 a dosis altas está asociada con el síndrome de tormenta de citocinas y el de permeabilidad capilar, también con la IRA prerrenal y la NTA. Los inhibidores del checkpoint son una terapia novedosa y eficaz contra un importante número de cánceres sólidos. Estos agentes pueden causar IRA y proteinuria (a veces nefrótica); la IRA se debe principalmente a NTI, pero también producen NTA. También ha sido descrita la enfermedad por cambios mínimos y la glomerulonefritis producida por inmunocomplejos.
Se desconocen gran parte de los mecanismos de nefrotoxicidad de los tratamientos oncológicos, así como las estrategias para su prevención y manejo. Las áreas de investigación se describen en la (Tabla 1). Debe prestarse atención a la nefrotoxicidad en aquellos pacientes tratados con inmunoterapia y su aparición debe comunicarse e incluirse en los registros de estos agentes.
Agentes estimulantes de la eritropoyetina y terapia con hierro
Actualmente las indicaciones para el tratamiento con agentes estimulantes de eritropoyetina (AEE) y la terapia con hierro son similares para los pacientes con ERC tengan o no cáncer [63] [64]. La mayoría de las guías disponibles de nefrología y oncología sugieren el mismo nivel de hemoglobina diana (10-12 g/dl) [63] [64] [65] [66]. Las guías KDIGO recomiendan un rango más bajo, entre 9,0-11,5 g/dl [67]. La utilización de un rango objetivo de hemoglobina entre 9-11,5 g/dl permite la individualización terapéutica para determinar el mejor perfil riesgo-beneficio. En el caso del uso de AEE se sugiere la utilización de la misma dosis recomendada para pacientes con ERC, en aquellos que presenten enfermedad neoplásica. [68]
Los datos de metaanálisis de 2009 mostraron que el tratamiento con AEEs en pacientes con cáncer aumenta la mortalidad y empeora la supervivencia global [69]; sin embargo, otro metaanálisis de 2012, que incluía 91 ensayos clínicos con más de 20.000 participantes, no mostró un impacto directo de los AEE en la progresión de la enfermedad neoplásica [70]. En un artículo reciente, Thavarajah [71] subrayó que si bien la evidencia actual sugiere que los AEE pueden promover la progresión o empeorar los resultados en algunos tipos de cáncer, no hay evidencia sobre la probabilidad de desarrollar neoplasias de-novo en pacientes con ERC en diálisis o en etapas más tempranas de la ERC durante el tratamiento con AEE.
El análisis de los registros en pacientes con cáncer podría ayudar a comprender mejor la supervivencia en la población con ERC tratada con AEE. La evaluación de nuevos tratamientos para la anemia en pacientes con cáncer y ERC debe ser considerado un objetivo fundamental. El papel de los agentes que mejoran la producción endógena de eritropoyetina y la disponibilidad de hierro, como los inhibidores de la prolil-hidroxilasa (PHI) [22] deberá también ser analizado como alternativa terapéutica en este grupo de población.
Ajustes de dosificación y momento de administración de medicamentos contra el cáncer en pacientes con ERC G3-G5D.
La evidencia disponible sugiere que el hecho de no ajustar las dosis de los antineoplásicos en pacientes con ERC conlleva resultados perjudiciales. En un estudio prospectivo de 143 pacientes con cáncer colorrectal que recibieron dosis estándar de capecitabina y oxaliplatino, entre los 50 pacientes que presentaban aclaramiento de creatinina < 60 ml/min, la citopenia y la diarrea fueron significativamente más altas en relación a los pacientes que presentaban un aclaramiento mayor, y la eficacia de los fármacos se redujo [72]. Sin embargo, en otro estudio prospectivo que incluyó más de 600 pacientes con cáncer de mama, el ajuste de dosis de antineoplásicos en pacientes con aclaramiento de creatinina < 60 ml/min, mostró toxicidad y eficacia comparables en relación con aquellos con un filtrado mayor [73]. En la población con ERC en hemodiálisis, los catabolitos activos de ciertos fármacos tienen el potencial de acumularse y conducir a eventos adversos inesperados [74] [75] [76], por lo que el ajuste de la dosis es crucial para evitar la toxicidad. Existen publicaciones con recomendaciones acerca del inicio óptimo y el ajuste de la dosis de los fármacos antitumorales (también en cuanto a la coordinación con el inicio de la sesión de diálisis) en pacientes con cáncer y ERC estadio 5D [77] [78]; sin embargo, estas recomendaciones derivan de informes de casos o series de pocos casos. Además, un estudio nacional japonés ha indicado que existe desigualdad entre las recomendaciones y la práctica clínica en cuanto al ajuste de dosis de fármacos antitumorales en pacientes con ERC estadio 5D [79]. No existen datos disponibles en pacientes con ERC avanzada o en diálisis peritoneal y por lo tanto, son necesarios estudios de farmacocinética y farmacodinámica.
Toma de decisiones en cuanto al inicio o finalización del tratamiento renal sustitutivo en pacientes con cáncer de órgano sólido.
Actualmente hay una gran variación entre países en la valoración del inicio o la finalización de la diálisis en pacientes con cáncer de órgano sólido (o hematológico). Aunque existen sistemas de puntuación para predecir la supervivencia de pacientes en diálisis, éstos podrían y deberían mejorarse incluyendo la presencia de cáncer activo y/o su pronóstico. La retirada de la diálisis crónica conlleva la muerte en unas pocas semanas; por lo tanto, cuando el pronóstico asociado al cáncer es inferior a 2 semanas, debería suspenderse la diálisis. El desarrollo de directivas avanzadas a través de equipos interdisciplinares podría ayudar a los médicos y a los pacientes a evitar tomar decisiones complicadas en situaciones de emergencia. Es clave determinar las preferencias del paciente en cuanto a si prefiere diálisis a largo plazo, diálisis sólo durante un tiempo limitado, tratamiento conservador o tratamiento paliativo.
MANEJO Y TRATAMIENTO DE CÁNCER RENAL
Epidemiología, prevalencia y tipo de carcinoma de células renales.
La Organización Mundial de la Salud ha estimado que la incidencia estandarizada por edad de cáncer de riñón a nivel mundial es de 4,5 por 100.000 personas en 2018 [80]. El carcinoma de células renales (CCR), que se refiere a cáncer que se ha originado del epitelio renal, constituye >90% de todos los cánceres de riñón [81]. La incidencia de CCR predomina en hombres (1.5:1.0 hombre-mujer) y tiene un pico de incidencia en personas con edades comprendidas entre 60-70 años [81]. La incidencia de CCR, si bien varía ampliamente de forma global, está aumentando en muchos países [82]. La incidencia aumentada está relacionada fundamentalmente con cambios en la detección de tumores y en las prácticas diagnósticas (con amplío uso de TAC/ultrasonidos), lo que conlleva a un incremento en los diagnósticos de CCR en estadio precoz. Factores de riesgo establecidos son el tabaco, la obesidad, la hipertensión arterial, la ERC, la diabetes y ciertos factores genéticos [82]. No queda claro el efecto de otros factores como la actividad física, la dieta, el consumo de alcohol o factores ambientales, en el incremento del riesgo de CCR.
A pesar de las recientes mejoras en su tratamiento, el CRR si metastatiza, sigue siendo una enfermedad letal. La mortalidad del CCR varía según la disponibilidad y el acceso de los pacientes a protocolos y tratamientos de urología oncológica [83]. En la mayoría de países desarrollados, la mortalidad del CCR es estable o está disminuyendo como resultado de los esfuerzos de screening, diagnóstico precoz, la mejoría de los tratamientos y su disponibilidad [82].
Los síndromes hereditarios de CCR constituyen el 2-3% de todos los casos de CCR [84] y muchas variantes genéticas han sido asociadas con el CCR [84] [85]. La causa más frecuente de CCR hereditario es el síndrome von Hippel-Lindau, que tiene una incidencia acumulativa de CCR de aproximadamente 70% [84]. Las formas esporádicas generalmente se asocian con alteraciones estructurales del brazo corto del cromosoma 3.
Función renal en CCR
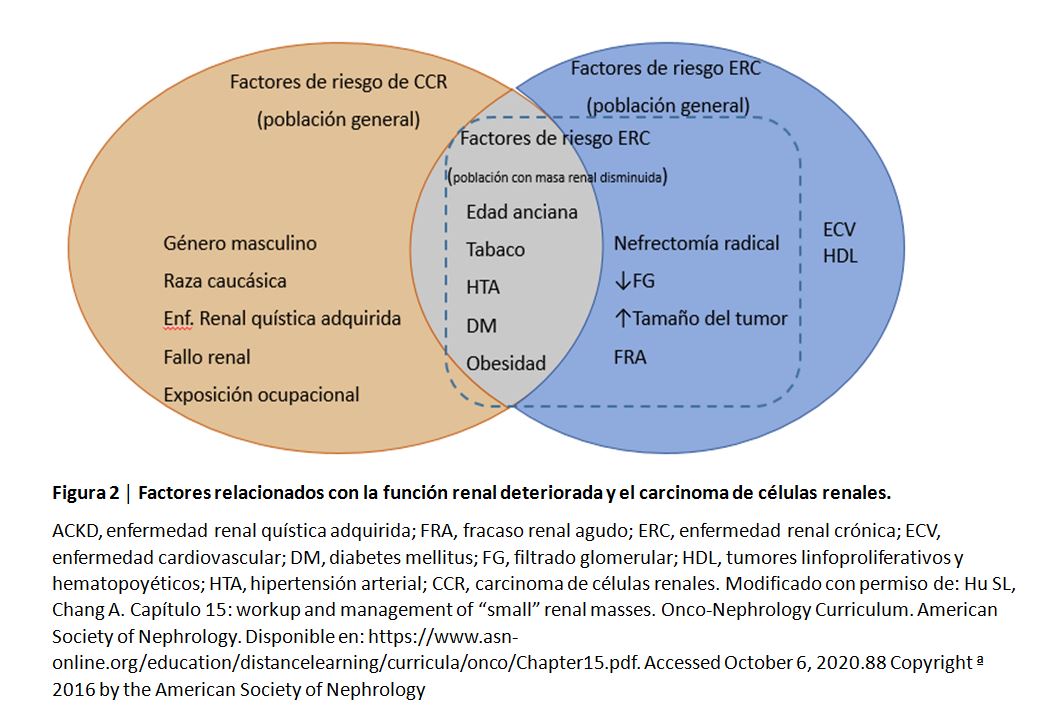
La insuficiencia renal es común en pacientes con CCR, tanto como una condición preexistente o como consecuencia del cáncer y su tratamiento [86]. El CCR y la insuficiencia renal comparten factores de riesgo intrínsecos y comorbilidades sistémicas (Figura 2) [87] [88]. Los factores de riesgo relacionados con cáncer, para desarrollar insuficiencia renal incluyen los siguientes: infiltración maligna, que puede afectar al parénquima renal y/o vena renal y vena cava inferior; síndromes paraneoplásicos causados por liberación de citoquinas o enfermedad inmunogénica, incluyendo nefropatías paraneoplásicas o hipercalcemia debida a la producción de proteína relacionada con hormona paratiroidea [89]; y obstrucción del tracto urinario.
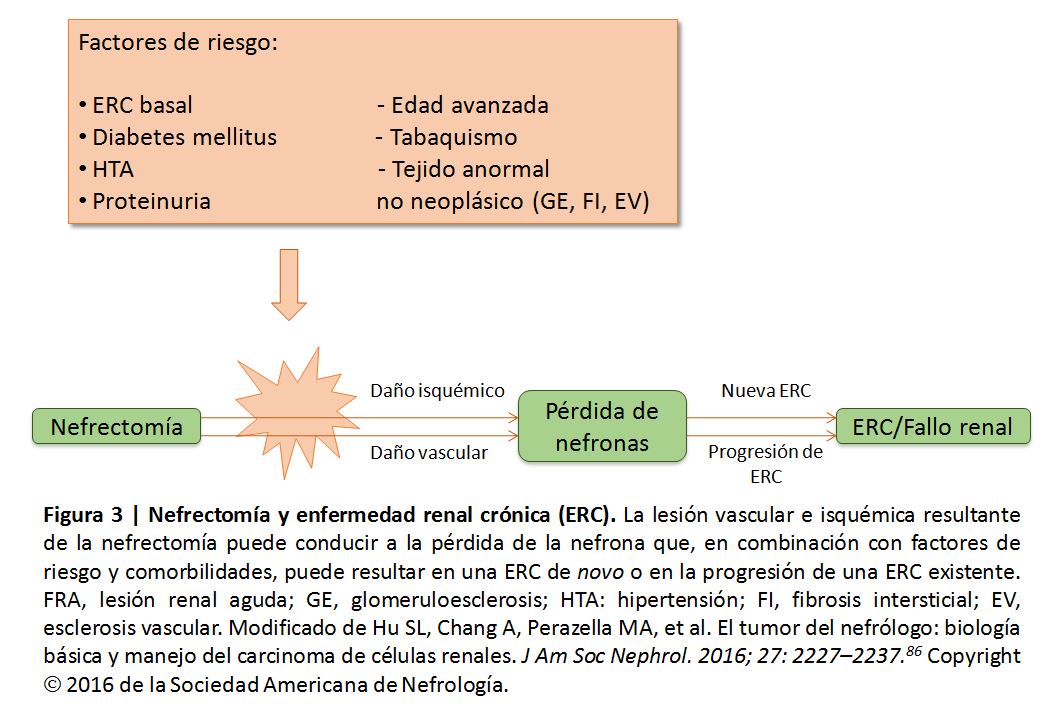
La resección quirúrgica continúa siendo la opción de tratamiento preferida en la mayoría de los casos de CCR. Desafortunadamente, la nefrectomía ha sido reconocida como un factor de riesgo independiente para la lesión renal (Figura 3) [86] [90]. Después de la nefrectomía, la reducción de la masa renal se continúa con una pérdida de función renal, especialmente en los pacientes con enfermedad renal previa; además, los glomérulos restantes pueden sufrir lesiones por hiperfiltración [87] [91].
Es sabido que los pacientes con ERC tienen un riesgo incrementado de CCR [92] [93]. Aunque se desconoce la causa del cáncer renal en la ERC, se han propuesto varios factores relacionados con la lesión renal que podrían explicar esta relación [94]. Además de la fibrosis y la atrofia tubular, la inflamación crónica relacionada con la uremia, el estrés oxidativo, la alteración de la función inmunológica, la diálisis, medicaciones y comorbilidades pueden ser también factores a considerar [86]. El riesgo de CCR se incrementa con la severidad de la enfermedad renal [92]. La asociación observada entre ERC y el riesgo futuro de CCR no es necesariamente causal; los pacientes con insuficiencia renal se someten a una vigilancia médica más estrecha en comparación con la población general, y esto puede conducir a una mayor detección de tumores localizados e indolentes mediante las pruebas de imagen abdominal.
La ERC es un factor pronóstico de CCR e incrementa los riesgos de mortalidad [95], eventos cardiovasculares, insuficiencia renal y hospitalización programada [10]. El empeoramiento de la función renal puede imposibilitar o retrasar la terapia antineoplásica. Además, la dosificación del fármaco puede ser inadecuada en pacientes en diálisis, quienes tienen un mayor aclaramiento de determinados fármacos.
Tipo de cirugía y resultados renales
Las guías actuales recomiendan la nefrectomía parcial para la resección de tumores en estadio T1 (es decir, tumores? 7 cm, confinados al riñón) para preservar la mayor cantidad posible de parénquima renal normal [96] [97]. La técnica también puede ser considerada para tumores en estadio T2 (es decir, tumores > 7 cm, confinados al riñón) y T3a (es decir, tumores extendidos macroscópicamente a la vena renal, o a sus ramas, o que invadan la grasa del seno perirrenal o renal). La nefrectomía citorreductora no debería realizarse en pacientes clasificados como de bajo riesgo de acuerdo a la clasificación del Memorial Sloan Kettering Cancer Center [98]. Aunque criticados por su metodología, los ensayos aleatorizados CARMENA y SURTIME, recientemente comunicados, apoyan la opción de ofrecer terapia sistémica previa a la terapia citorreductora en CCR metastático [99] [100]. Los criterios fiables para seleccionar pacientes para tratamientos neoadyuvantes con inhibidores de la tirosina quinasa (ITKs) con nefrectomía citorreductora siguen siendo en gran medida elusivos. No obstante, los resultados de los ensayos mencionados anteriormente indican que a los pacientes con hallazgos de riesgo se les debería ofrecer tratamiento sistémico, y no nefrectomía citorreductora, como tratamiento inicial de la enfermedad. Es también importante enfatizar que la cirugía sigue siendo una herramienta valiosa en el manejo del CCR metastático. Por lo tanto, los pacientes de riesgo intermedio con metástasis potencialmente resecables podrían considerarse candidatos a nefrectomía citorreductora con metastasectomía sin terapia sistémica como tratamiento inicial de la enfermedad. Actualmente no hay datos sobre el uso de inhibidores del punto de control ("chekpoint inhibitors") antes de la nefrectomía citorreductora.
Preocupaciones relacionadas con los riesgos perioperatorios y el seguimiento postoperatorio
La prevención de la ERC G5 después de la cirugía implica identificar y reducir los riesgos de IRA y tratar sus complicaciones [91]. Los pacientes con riesgo de IRA incluyen aquellos con ERC, diabetes mellitus, hipertensión arterial, proteinuria, edad avanzada o tejido no neoplásico anormal cerca del tumor, así como los pacientes fumadores [91]. Bhindi y col [101] desarrollaron recientemente modelos para predecir la evolución de la función renal después de una nefrectomía parcial y radical basándose en estas y otras características preoperatorios; sin embargo, las fórmulas necesitan ser validadas y confirmadas para poder generalizarse. Contar con mediciones de FG más precisas, imágenes mejores y una también mejor identificación de los grupos de riesgo ayudaría en los procesos relacionados con la predicción.
Los pasos intraoperatorios para prevenir la lesión renal incluirían minimizar la pérdida nefronal y su desvascularización, evitar el daño isquémico irreversible y mantener una perfusión renal adecuada durante la cirugía. Una variedad de intervenciones farmacológicas (manitol, dopamina, fenoldopam, antioxidantes, factores de crecimiento, porfirinas, aminoácidos protectores de daño mitocondrial) se han utilizado para prevenir o minimizar los efectos negativos de la isquemia, sin embargo, los resultados de los estudios traslacionales en la materia han sido negativos hasta la fecha. Una variedad de manipulaciones farmacológicas (manitol, dopamina, fenoldopam, antioxidantes, factores de crecimiento, porfirinas, aminoácidos protectores de daño mitocondrial) se han utilizado para prevenir o minimizar los efectos negativos de la isquemia, sin embargo, los resultados de los estudios traslacionales en la materia han sido negativos hasta la fecha. También se han ensayado diversas maniobras intraoperatorias para prevenir lesiones isquémicas irreversibles entre las que se incluyen: el uso de hipotermia, el desclampaje precoz y la isquemia cero. Los resultados de una revisión sistemática [102] indican que no hay evidencia que sustente que el tiempo de isquemia limitado ( 25-30 min) puede causar una lesión isquémica irreversible en el riñón intervenido quirúrgicamente.
En general, el manejo postoperatorio incluye realizar un seguimiento estricto que permita el reconocimiento temprano de complicaciones quirúrgicas y una intervención oportuna que incluya una derivación nefrológica temprana de pacientes de alto riesgo, evitar nefrotóxicos e hipoperfusión renal y corrección de factores reversibles relacionados con lesión renal aguda. Las estrategias para prevenir la progresión de la ERC a enfermedad renal terminal incluyen tanto el control regular de la función renal midiendo la creatinina sérica y el FG para limitar la aparición o progresión de la enfermedad renal, como el control de la hipertensión y la diabetes mellitus, y la corrección de la anemia, desnutrición y acidosis metabólica.
Efectos secundarios renales de las nuevas terapias dirigidas
Existe un grupo amplio de agentes dirigidos para tratar el CCR metastásico que incluye los bloqueantes del factor de crecimiento endotelial vascular y su receptor, los inhibidores de M-tor y los inhibidores de puntos de control (check point) inmunitarios. Estos fármacos se utilizan como monoterapia o como terapias combinadas. La nefrotoxicidad relacionada con los medicamentos contra el cáncer es una causa notable de lesión renal, que puede causar hipertensión, proteinuria, IRA y trastornos electrolíticos [91]. Las etiologías habituales son la necrosis tubular aguda, la nefritis intersticial aguda y una variedad de lesiones glomerulares y vasculares.
Inhibidores de tirosina quinasa.
En pacientes sometidos a diálisis, el tratamiento con inhibidores de la tirosina quinasa es seguro y eficaz. [103] [104] [105] [106] [107] [108] [109] [110] [111]. Los estudios retrospectivos indican que el uso de inhibidores de la tirosina quinasa multidireccionales (sorafenib,sunitinib, pazopanib, axitinib, cabozantinib y lenvatinib) pueden prolongar la esperanza de vida en el contexto de metástasis de carcinoma renal de células claras, incluso en pacientes sometidos a diálisis [107].
Los pacientes en diálisis que reciben inhibidores de la tirosina quinasa no requieren un aumento del número de sesiones de diálisis. La mayoría de los eventos adversos con inhibidores de la tirosina quinasa en los pacientes en diálisis son leves, siendo la anemia el más común de los eventos adversos descritos [103]. Una monitorización estricta del uso de heparina en los pacientes en diálisis sometidos a tratamiento con inhibidores de la tirosina quinasa ayuda a mitigar el riesgo de hemorragia en este contexto. En los pacientes que no requieren diálisis pero presentan ERC estadios 3a-5, la complicación más frecuente es la hipertensión arterial y se correlaciona con la edad y las comorbilidades de este grupo de pacientes [23]. El control de la presión arterial antes de iniciar la terapia dirigida y el seguimiento durante el tratamiento son de suma importancia [112] y el control de la presión arterial suele ser más difícil de conseguir en los pacientes con mejor función renal [113]. Desde un punto de vista práctico, en los pacientes con enfermedad renal, incluidos los sometidos a diálisis, los inhibidores de la tirosina quinasa deben iniciarse a una dosis más baja que la estándar y titular según la tolerancia hemodinámica. Un aspecto importante a considerar es evitar la sobrehidratación en el contexto de esta terapia dirigida debido al gran volumen de distribución de los TKI.
Inhibidores de punto de control inmunitario (Check point inhibitors)
Aunque no es un efecto frecuente, se ha descrito la aparición de nefritis intersticial autoinmune en pacientes tratados con Inhibidores de los puntos de control inmunitario [23]. La presencia de toxicidad renal grave (grado >3) se encuentra en aproximadamente el 1% de los pacientes y generalmente se revierte con la interrupción del agente responsable y la terapia con esteroides [114]. Los inhibidores de puntos de control se pueden reiniciar cuando la dosis de prednisona sea < 10 mg (aunque esta recomendación no está respaldada por un ensayo clínico). Otras opciones de tratamiento, sin esteroides, incluyen los derivados del ácido micofenolico y el rituximab que están indicados en casos raros refractarios a esteroides. En casos de lesión renal de origen incierto, se recomienda realizar una biopsia renal siempre que no exista contraindicación.
Los datos sobre el uso de inhibidores de puntos de control en pacientes con enfermedad renal sometidos a diálisis son extremadamente limitados (generalmente casos clínicos o series de casos). Actualmente no hay evidencia que sustente una reducción de dosis o del número de tratamientos con este tipo de inmunoterapia en pacientes con ERC o sometidos a diálisis.
CONCLUSIONES
Los participantes en esta conferencia enfatizaron la importancia del abordaje multidisciplinar y la colaboración entre especialistas de nefrología y hematología / oncología tanto en la asistencia como en la investigación clínica de los pacientes oncológicos con complicaciones renales asociadas a la neoplasia o con antecedente de ERC y que requieren tratamiento oncológico [115]. Temas importantes relacionados con la onco-nefrología y que no se han investigado completamente incluyen: la epidemiología del cáncer en pacientes con ERC y de la aparición de insuficiencia renal en pacientes con cáncer, así como la naturaleza de la respuesta al tratamiento oncológico en el paciente con ERC.
Las limitaciones de los métodos actuales para estimar el FG y la determinación de la función renal en general tienen implicaciones clínicas negativas en el paciente con cáncer, y se espera contar con nuevos abordajes para medir la función renal en un futuro próximo. No obstante, los pacientes de hematología / oncología deben someterse a evaluaciones de la función renal, incluida la estimación del FG y cuantificación de la proteinuria.
En el contexto de las neoplasias de órgano sólido, las exploraciones complementarias renales que se deben realizar son: evaluación de la función renal, así como de comorbilidades, equilibrio ácido-base, electrolitos y análisis de orina. En pacientes con ERC, el mejor enfoque actual para la dosificación de agentes quimioterapéuticos es utilizar la ecuación CKD-EPI.
Son necesarios estudios en pacientes con ERC que aporten información sobre la dosificación de fármacos oncológicos en pacientes con ERC G3b-G5D, ya que en la actualidad no existen datos sólidos al respecto. Finalmente se necesitan con urgencia ensayos centrados específicamente en pacientes con CCR e insuficiencia renal.
APPENDIX
Otros participantes en la Conferencia
Ali K. Abu-Alfa, Lebanon; Hatem Amer, USA; Gernot Beutel, Germany; Jeremy R . .Chapman, Australia; Xiaohong Chen, China; Jerzy Chudek, Poland; Laura Cos-mai, Italy; Romano Danesi, Italy; Filippo De Stefano, Italy; Kunitoshi Iseki, Japan;Edgar A. Jaimes, USA; Kenar D. Jhaveri, USA; Artur Jurczyszyn, Poland; RümeyzaTuran Kazancioglu, Turkey; Abhijat Kitchlu, Canada; Christian Kollmannsberger,Canada; Amit Lahoti, USA; Yang Li, China; Manuel Macía, Spain; TakeshiMatsubara, Japan; Dionysios Mitropoulos, Greece; Eisei Noiri, Japan; Mark A. Perazella, USA; Pierre Ronco, France; Mitchell H. Rosner, USA; Maria Jose SolerRomeo, Spain; Ben Sprangers, Belgium; Walter M. Stadler, USA; Paul E. Stevens,United Kingdom; Vladimír Tesar, Czech Republic; Verônica Torres da Costae Silva, Brazil; David H. Vesole, USA; Anitha Vijayan, USA; Ondrej Viklický, CzechRepublic; Biruh T. Workeneh, USA; Motoko Yanagita, Japan; Elena Zakharova,Russian Federation.
DISCLOSURE
CP declared having consultancy fees from AstraZeneca, Bristol Myers Squibb(BMS), Eisai, EUSA, Ipsen, Merck Serono, Merck Sharp & Dohme (MSD), Novartis,and Pfizer; stock from DNA; and research support from AstraZeneca, BMS, Eisai,EUSA, GE, Ipsen, Merck Serono, MSD, Novartis, and Pfizer; and CP was an expertwitness for DNA. AB declared having received consultancy fees from BMS,MSD, Pfizer, and Roche; speaker honoraria from BMS and MSD; and researchsupport from BMS and Pfizer. FRD declared having received research supportfrom National Institutes of Health. MG declared having received speakerhonoraria from General Electric. MAG declared having received consultancyfees from Abbvie, Alnylam, Amgen, Annexon, Appellis, Celgene, Janssen,Medscape, Physicians Education Resource, Prothena, Research to Practice,Sanofi, and Spectrum; stock options from Aurora Bio; speaker honoraria fromAkcea, Johnson and Johnson, and Teva; and research support from NationalInstitutes of Health and Spectrum. JTK declared having received consultancyfees from Amgen and Vifor Pharma; stock from Chemocentryx; speakerhonoraria from ExThera Medical and Vifor Pharma; and grants from ExTheraMedical; and JTK was an expert witness in vaccine injury cases trialed at the USFederal Court of Claims. PT declared having received consultancy fees fromAstraZeneca, Eli Lilly, Novartis, Pfizer, Pierre Fabre, and Roche; and speakerhonoraria from AstraZeneca, Eli Lilly, Novartis, Pfizer, Pierre Fabre, and Roche GW declared having received research support from the National Health andMedical Research Council. DCW declared having received consultancy feesfrom Amgen, Astellas, AstraZeneca, Boehringer Ingelheim, GlaxoSmithKline,Janssen, Mundipharma, Napp, and Vifor Fresenius Medical Care Renal Pharma;and speaker's honoraria from Amgen, Astellas, AstraZeneca, Mundipharma,Napp, Pharmacosmos, and Vifor Fresenius Medical Care Renal Pharma. WCWdeclared having consultancy fees from Akebia, Amgen, AstraZeneca, Bayer,Daiichi Sankyo, Relypsa, and Vifor Fresenius Medical Care Renal Pharma. JMdeclared having consultancy fees from Fresenius Medical Care and ViforPharma. All the other authors declared no competing interests
AGRADECIMIENTOS
La conferencia fué patrocinada por KDIGO y financiada en parte con unrestricted educational grants por Amgen, Akebia Therapeutics, Boehringer Ingelheim, Fresenius Medical Care, GE Healthcare, and MediBeacon. Agradecemos a Jennifer King, PhD, por su ayuda con la preparación del manuscrito. La agenda de la conferencia, las preguntas para discusión y las presentaciones de la sesión plenaria están disponibles en el sitio web de KDIGO: https://kdigorg/conferences/onco-nephrology-conference/
Material suplementario
Table S1. Estadiaje de Insuficiencia Renal Aguda