Manejo y tratamiento de enfermedades glomerulares (Parte 2) (2019)
In November 2017, the Kidney Disease: Improving Global Outcomes (KDIGO) initiative brought a diverse panel of experts in glomerular diseases together to discuss the 2012 KDIGO glomerulonephritis guideline in the context of new developments and insights that had occurred over the years since its publication. During this KDIGO Controversies Conference on Glomerular Diseases, the group examined data on disease pathogenesis, biomarkers, and treatments to identify areas of consensus and areas of controversy. This report summarizes the discussions on primary podocytopathies, lupus nephritis, anti-neutrophil cytoplasmic antibody-associated nephritis, complementmediated kidney diseases, and monoclonal gammopathies of renal significance. Kidney International (2019) 95, 281-295; https://doi.org/10.1016/ j.kint.2018.11.008
KEYWORDS: anti-neutrophil cytoplasmic antibody¿associated vasculitis; C3 glomerulopathy; focal and segmental glomerulosclerosis; KDIGO; lupus nephritis; membranoproliferative glomerulonephritis; minimal change disease; monoclonal gammopathies of renal significance Copyright ª 2019, The Author(s). Published by Elsevier Inc. on behalf of the International Society of Nephrology. This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).
KDIGO publicó su primera directriz sobre enfermedades glomerulares en 2012 [1]. Desde entonces, los conocimientos sobre la patogenia de las enfermedades glomerulares han avanzado y existen nuevos biomarcadores de uso clínico, y se han evaluado nuevas terapias en ensayos clínicos.
El objetivo de esta nueva conferencia KDIGO fue evaluar el progreso existente en el manejo de enfermedades glomerulares e identificar las recomendaciones de pautas existentes que deben revisarse en la próxima actualización.
Este segundo informe abarca las podocitopatías primarias, enfermedades glomerulares mediadas por el complemento, nefritis lùpica (LN), glomerulonefritis por anticuerpo anticitoplasma de los neutrófilos (ANCA) y las gammapatías monoclonales de significado renal.
Enfermedad de cambios mínimos (MCD) y Glomerulosclerosis focal y segmentaria (FSGS).
Terminología
Los términos "enfermedad de cambios mínimos" (MCD) y glomeruloesclerosis focal y segmentaria (FSGS) siguen siendo relevantes.
Aunque puede haber una superposición fisiopatológica entre ambas, la presencia de esclerosis focal y segmentaria en microscopía óptica tiene importancia diagnóstica y pronóstica.
Para discriminar entre MCD y FSGS mediante biopsia renal se necesitan al menos 20 glomérulos, y en las biopsias, a veces, la morfología puede mostrar una lesión compatible con MCD, pero los pacientes pueden más tarde desarrollar una FSGS [2]. Sin embargo, en niños, la biopsia renal generalmente no se realiza en pacientes que responden al tratamiento con prednisona. La respuesta al tratamiento con prednisona y el momento de las recaídas permiten clasificar el síndrome nefrótico infantil [3].
Las definiciones de síndrome nefrótico "corticosensible" y "corticoresistente" son descripciones clínicamente útiles en niños, y la mayoría de síndromes nefróticos idiopáticos sensibles a esteroides en niños son MCD. La respuesta a la terapia esteroidea a menudo es de mayor valor pronóstico que la biopsia renal.
Los términos "FSGS primario/idiopático" deben reservarse para FSGS causados por factores de permeabilidad aún desconocidos. Pacientes con alteraciones genéticas, respuesta adaptativa (en el contexto de reducción a de nefronas), FSGS inducida por fármacos o por virus no debe designarse como primario [4]. El FSGS primario a menudo es caracterizado por proteinuria intensa de inicio agudo y borramiento difuso podocítario. Otros subtipos de FSGS muestran típicamente proteinuria más modesta y borrado segmentario del proceso podocitario [5]. Todavía son necesarios mas datos para definir mejor estos subgrupos de FSGS en función de la supuesta patogenia.
Patogenia de MCD y FSGS primario/idiopático
El papel patogénico de la disfunción de células T en MCD se propuso hace mas de 40 años [6] y más recientemente, se han implicado también las células B, al inducir remisión mediante inmunoadsorcion [3]. Hasta la actualidad, ninguno de los factores candidatos que alteran la permeabilidad fueron validados independientemente en FSGS primario [7]. El Receptor soluble del activador de plasminógeno de tipo uroquinasa (suPAR) puede ser un nuevo biomarcador pronóstico para la enfermedad renal crónica, pero no parece tener un papel como diagnóstico o para representar el factor de permeabilidad en FSGS [8].
Citocina-1 similar a la cardiotrofina, es un miembro de la interleucina 6 y puede ser un candidato como factor de permeabilidad en FSGS. La citocina-1 similar a la cardiotrofina fue identificada en el plasma de pacientes con FSGS y también se demostró en cultivo podocitario su capacidad para disminuir la expresión de Nefrina. En pacientes con FSGS recurrente, su concentración puede ser de hasta 100 veces la de los sujetos normales. Angiopoyetina-like-4, glicoproteína que está altamente "upregulated" en el suero y en podocitos de modelos experimentales y humanos de MCD. Este biomarcador tiene potencial relevante en pacientes con síndrome nefrótico corticosensible [9][10].
Se ha sugerido que la MCD/FSGS puede ser mediada por Podocito CD80 (B7-1) expresión inducida después de un evento inocuo como una infección [11]. Sin embargo, la sobreexpresión de CD80 en podocitos no se pudo confirmar [12]. Recientemente se ha implicado a las Células Epiteliales Parietales en la patogénesis de todos los tipos histológicos de FSGS [13].
Biomarcadores y predicción del pronóstico.
No hay biomarcadores validados para uso clínico en MCD o FSGS. El subtipo histológico de FSGS como se define por la clasificación de Columbia [14] puede apoyar la toma de decisiones y ayudar a establecer la respuesta al tratamiento y el pronóstico [15], pero no ayuda en el conocimiento del mecanismo patogénico de la enfermedad. Las técnicas de inmunotincion de células epiteliales parietales pueden mejorar la sensibilidad para detectar lesiones escleróticas, que ayuden a distinguir la FSGS primaria de MCD [16] y el análisis proteómico de las biopsias pueden proporcionar información adicional.
Prueba genética
El uso de pruebas genéticas para síndrome nefrótico pediátrico y FSGS del adulto es controvertido, pero debe tenerse en cuenta para pacientes con formas congénitas e infantiles de síndrome nefrótico (niños menores de un año de edad) o menores de 2 años con síndrome nefrótico resistente a los esteroides, síndrome nefrótico asociado con otras características sindrómicas, o formas familiares de síndrome nefrótico resistente a los esteroides [17][18][19]. Solo se han encontrado mutaciones genéticas en el 30% de los pacientes menores de 25 años [18]. Las pruebas deben dirigirse a genes relevantes basados en características del paciente y conocimientos actuales. El papel de genotipos de apolipoproteína L1 de alto riesgo en el desarrollo de glomeruloesclerosis todavía está en investigación y los datos aún son insuficientes para apoyar el uso de esta información como guía en la toma de decisiones clínicas. Las pruebas genéticas pueden considerarse para inclusión y estratificación en ensayos clínicos y las muestras biológicas pueden ser obtenidas siempre con consentimiento informado.
Tratamiento General
General
Las terapias inmunomoduladoras son el tratamiento de primera línea en FSGS primario / idiopático causado por un factor de permeabilidad, y otros subtipos de FSGS responden mejor al control de la presión arterial y corrección de hemodinámica glomerular anormal, como la hipertensión glomerular (p. ej., en FSGS adaptativo) u otras intervenciones específicas. El uso de la terapia inmunomoduladora después de identificar las mutaciones causantes de la FSGS es controvertido. Los informes poco frecuentes de diversos grados de remisión en estos pacientes pueden o no reflejar los efectos moduladores no inmunes de estas terapias [20]. Después de la identificación de las mutaciones, el tratamiento debe incluir terapias dirigidas para mutaciones específicas (p. ej., coenzima Q-10, vitamina B12 cuando corresponda) [18], terapia antiproteinúrica e interrupción de terapia inmunosupresora en aquellos casos sin respuesta precoz [21].
Pediátrico
El 80% de los niños con síndrome nefrótico tiene MCD y del resto de los pacientes, algunos responderán a la terapia con corticosteroides, y la conferencia KDIGO acordó que no hay datos suficientes para contraindicar la práctica de tratar a todos los pacientes pediátricos nefróticos con corticosteroides primero, excepto aquellos menores de 9 a 10 meses de edad. Debido a la mayor incidencia de síndrome nefrótico corticoresistente y FSGS con la edad, se aconseja realizar biopsia renal a los niños mayores de 12 años antes de iniciar el tratamiento. En niños con síndrome nefrótico corticosensible, los datos recientes de ensayos controlados aleatorios aconsejan el tratamiento con esteroides un tiempo máximo de 8 a 12 semanas [22][23][24], pero sigue habiendo controversias sobre la duración mínima para definir la corticorresistencia. La guía KDIGO 2012 recomendó al menos 8 semanas de tratamiento con esteroides antes de definir la resistencia a los esteroides. Sí bien no se llegó a un consenso, es necesario una definición aceptada de "resistencia a los esteroides" para mejorar el diseño de futuros ensayos clínicos.
La eficacia de las bajas dosis diarias de corticoesteroides en días alternos para mantener la remisión del síndrome nefrótico recurrente es prometedora [25]. En el SN con recidivas frecuentes, se debe utilizar otra terapia inmunosupresora, y los datos apoyan el uso de la ciclofosfamida (CYC), levamisol, micofenolato mofetil (MMF), los inhibidores de la calcineurina (CNI) y el rituximab (RTX), pero el orden preciso del tratamiento no está bien determinado [26]. Algunos datos emergentes apoyan el uso de RTX en el sindrome nefrótico corticodependiente infantil. No se confirmó una acción directa del RTX sobre los podocitos, lo que apoya el agotamiento de las células B como mecanismo primario de acción del RTX [27]. Los análisis post hoc comparando MMF con CNI sugieren que dosis mas altas de MMF podrían dar lugar a resultados similares a los obtenidos con CNI, pero esto debe confirmarse en ensayos controlados aleatorios [28].
Los pacientes nefróticos tienen un alto riesgo de infección independientemente de la inmunosupresión. La directriz KDIGO 2012 proporciona algunas recomendaciones sobre vacunas en niños, pero no destaca la importancia de la detección y vacunación de hepatitis B, especialmente en aquellos que reciben terapias contra células B [29]. La vacunación antimeningococica debe ser incluida según la opinión de los expertos.
Adulto
Es controvertida la duración mínima de 16 semanas de corticosteroides en dosis altas como terapia de primera línea en FSGS o MCD, dado su potencial toxicidad, sin embargo, los datos para optar por alternativas de primera línea con agentes o terapias combinadas y dosis más bajas de corticosteroides son por ahora insuficientes. Los expertos de la conferencia KDIGO están de acuerdo en que los CNI o CYC deben permanecer como agentes de segunda línea en adultos con MCD corticorresistente o corticorrecidivante. RTX es una terapia de segunda línea emergente en MCD de adultos aunque la evidencia es solo observacional. La recomendación para CNI y MMF como tratamientos de segunda y tercera línea respectivamente para la FSGS debe mantenerse. Se están realizando ensayos controlados para investigar el valor de RTX en adultos con MCD (Eficacia de rituximab en comparación con tratamiento continuo con corticosteroides en el Sindrome Nefrotico Idiopático, NCT03298698) y el inhibidor de CD80 (Abatacept) (Estudio piloto para evaluar la seguridad y eficacia de Abatacept en adultos y niños de 6 años y mayores con síndrome nefrótico por Glomeruloesclerosis Focal y Segmentaria o enfermedad de Cambios Mínimos; NCT02592798).
Estudios futuros
Será importante distinguir entre FSGS secundaria y primaria para ensayos clínicos e incluir solo aquellos pacientes para los cuales una terapia de investigación puede ser efectiva. Las terapias inmunológicas deben enfocarse en el FSGS primario y las terapias antifibróticas podrían reclutar todas las formas de FSGS. Las recomendaciones de la directriz 2012 que debería ser revisitadas se resumen en la (Tabla complementaria S1).
GLOMERULONEFRITIS MEMBRANOPROLIFERATIVA
Terminología y diagnóstico
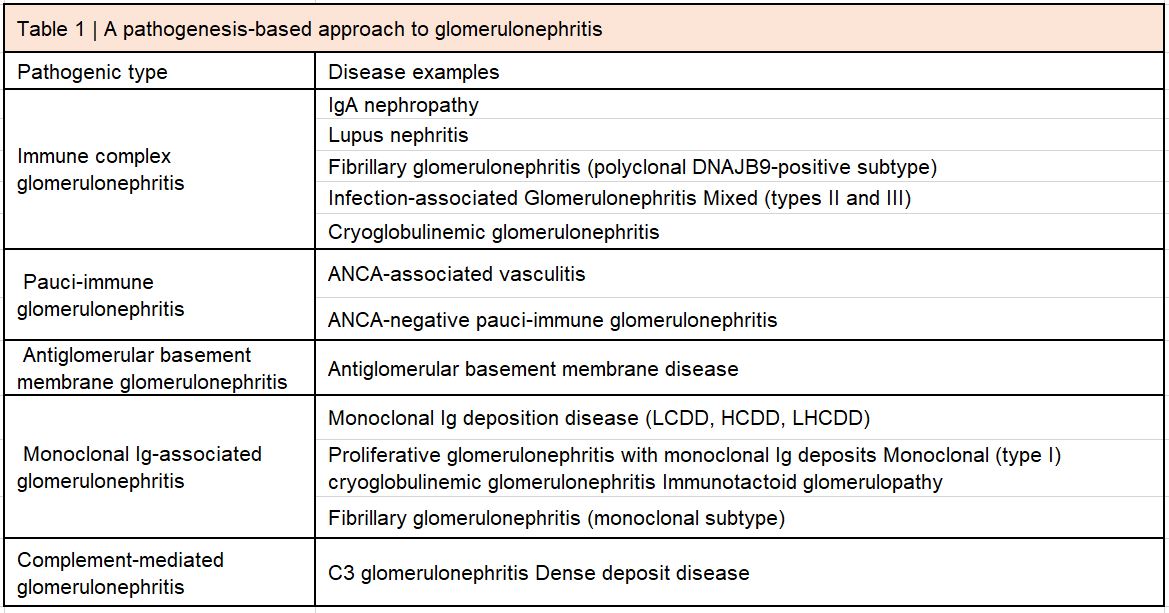
El término glomerulonefritis (GN) "membranoproliferativa" conserva el valor de la descripción histológica de la lesión glomerular, pero los conocimientos sobre la glomerulopatía C3 (C3G) y las gammapatías monoclonales de significado renal (MGRS) (enfermedades renales asociadas a paraproteína) aconseja utilizar una nomenclatura basada en la patogénesis y el patrón de las lesiones, y además, la histología, no siempre es GN membranoproliferativa. Por lo tanto, las guías de práctica clínica actualizadas deben enfatizar en un enfoque diagnóstico de GN que considera tanto la patobiología e histología renal, como la descrita en la (Tabla 1) [30]. Con el tiempo, y con una mayor comprensión de estas enfermedades, la utilización de ese esquema puede conducir a la eliminación de la GN membranoproliferativa como una categoría distinta de la GN en las directrices de la práctica clínica. En el siguiente análisis se destacan las controversias que existen en este aspecto, incluyendo la cuestión de mecanismos de enfermedad superpuestos, el enigma de características comunes de la biopsia de riñón y el hecho inevitable de que algunos casos seguirán siendo de naturaleza "idiopática " [31].
El uso de técnicas histológicas no rutinarias, incluida la tinción de la pronasa para desenmascarar los epítopos ocultos [32][33][34][35], la tinción de C4d para distinguir la C3G de la GN mediada por Ig y postinfecciosa [36], y la tinción para la proteína del miembro 9 de la subfamilia B homóloga del ADN J en la GN fibrilar [37][38], también pueden ayudar en el diagnóstico y posiblemente en la comprensión de la patogénesis de la GN con un patrón de GN membranoproliferativa. La mayoría de estas técnicas necesitan una verificación adicional.
Glomerulopatía C3
Patogénesis
La C3G es causada por activación, depósito y/o degradación anómala del complemento. Los mecanismos patogénicos de la enfermedad son revisados en recientes consensos [39] y controversias de la KDIGO [40].
Si bien se acordó en general que los datos obtenidos en humanos y animales apoyan el papel del complemento, por razones prácticas, sigue siendo difícil de probar el papel causal de los cambios de un solo nucleótido ó C3 en la mayoría de los casos [41][42]. Además, la interpretación de los datos publicados es confusa por la heterogeneidad en los criterios usados en la biopsia renal para el diagnóstico. Abordar estas controversias es especialmente importante dado que los agentes anticomplemento específicos están disponibles.
Biomarcadores y predicción del pronóstico. El papel de los biomarcadores en el diagnóstico y manejo de la GC3 fue resumido recientemente [40]. La utilidad de los biomarcadores como los niveles de C5b-9 soluble para predecir la respuesta al tratamiento sigue sin estar clara. Sigue habiendo controversia en cuanto a la utilidad clínica de una evaluación ampliada de los biomarcadores en el momento del diagnóstico, y el uso de pruebas de complemento en serie requiere un estudio más profundo. La alteración funcional del complemento en la C3G puede ser también consecuencia de una ganmapatia monoclonal [43].
Tratamiento
Un enfoque actual para el tratamiento de la GC3 fue esbozado [40], y deriva principalmente de informes de casos y series retrospectivas. Un importante gap en el conocimiento para el tratamiento de la GC3 es la ausencia de una comprensión sólida de su historia natural.
Consideraciones:
Los tratamientos actuales han sido empíricamente extrapolados de otras enfermedades glomerulares.
La duración óptima de la terapia sigue sin estar clara.
Las directrices actuales de tratamiento se centran en la inhibición de las vías definibles de la inflamación o de la actividad del complemento terminal con las terapias específicas disponibles (agentes antiproliferativos o bloqueadores del complemento terminal).
El tratamiento de la enfermedad activa con MMF y los corticoides se ha mostrado prometedor en 2 casos retrospectivos [44][45], pero no se encontró que fuera efectivo en un tercer caso en pacientes con una enfermedad renal más grave [46]. Para los pacientes con GC3 y gammapatía monoclonal, una reciente serie de casos retrospectivos encontró una mejor respuesta hematológica y renal asi como mayor supervivencia en aquellos que fueron tratados con quimioterapia adaptada al clon de células B en comparación con tratamiento conservador o inmunosupresor [47].
Gammopatías monoclonales de significado renal
Patogénesis
Los estudios preclínicos y clínicos han aclarado la patogenia de algunas enfermedades renales asociadas a paraproteina. Por ejemplo, la enfermedad de "Deposito de cadena pesada" es causada por una cadena pesada Ig truncada a la que le falta el primer dominio constante (deleción de CH1) [48][49]. Las propiedades fisicoquímicas específicas de la cadena pesada truncada pueden explicar su tropismo por el riñón [50]. La mayoría de los pacientes con "enfermedad de cadena pesada" tienen un clon de células plasmáticas subyacentes que no cumple los criterios para el mieloma múltiple (es decir, un MGRS), y la evidencia de la cadena pesada truncada se puede encontrar en suero y médula ósea [50].
En MGRS, las Igs patógenas son de células plasmáticas o clones de células B. Apuntar a estos clones puede mejorar los resultados [47][50][51], pero son a menudo indetectables. La International Kidney y el Monoclonal Gammopathy Research Group recomienda que en todos los pacientes con riñón asociado a paraproteína, se realice una evaluación hematológica, incluido una biopsia de médula ósea, pero la utilidad de la médula ósea no está clara en pacientes sin una paraproteína circulante detectable [47][52][53][54].
Biomarcadores y predicción del pronóstico
En el Mieloma Multiple y la Amiloidosis, conseguir una respuesta hematológica (mejoría en los niveles de paraproteína circulante) es asociada con una mejoría general y supervivencia renal.[55][56][57][58]. Además, la estabilización o mejora en la función renal y de la proteinuria puede estar relacionada con la supervivencia renal a largo plazo [59]. Hay datos emergentes sobre la importancia de la respuesta hematológica en MGRS [50][51][60], pero no está claro cómo controlar a los pacientes sin una paraproteína circulante detectable más allá de la tasa de filtración glomerular (TFG) y la proteinuria.
Tratamiento
La International Kidney y el Monoclonal Gammopathy Research Group publicó un enfoque para el manejo de la MGRS basado en la opinión de expertos [61]. La estratificación del riesgo fue basada en disfunción renal y proteinuria, y las estrategias de tratamiento utilizaron un enfoque dirigido por clones similar al empleado para mieloma múltiple y linfomas (ej. regímenes quimioterapéuticos, trasplante de células madre. Una serie larga de casos encuentran que usando Bortezomib para la enfermedad de depósito de Ig se logra una buena respuesta hematológica y renal y prolonga la supervivencia renal en comparación a otros resultados publicados con anterioridad [51]. Como como se mencionó anteriormente, la quimioterapia dirigida por clones mejoró los resultados hematológicos y renales de los pacientes con GC3 asociada a la paraproteína en comparación con otra inmunosupresión o tratamiento conservador [47].
Existe controversia con respecto al tratamiento de pacientes sin un clon subyacente detectable, pero datos recientes no controlados sugieren un beneficio de la quimioterapia empírica [53]. Finalmente, se recomienda a los pacientes con MGRS un enfoque onco-nefrológico [62].
Glomerulonefritis asociada a hepatitis C
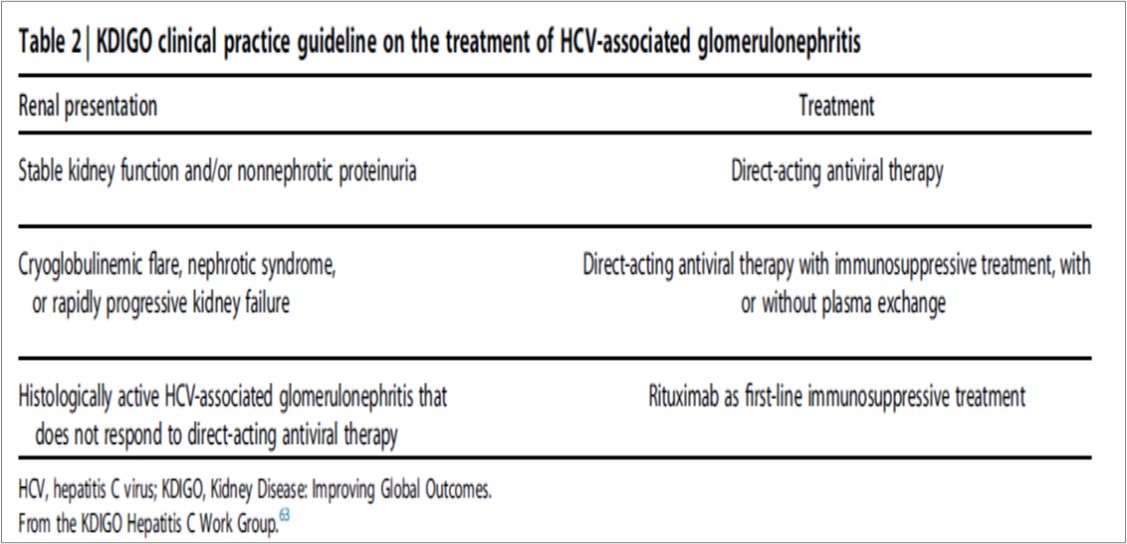
La KDIGO Clinical Practice Guideline on the Prevention, Diagnosis, Evaluation and Treatment of Hepatitis C in CKD resume un enfoque para el tratamiento de estos pacientes [63] (Tabla 2), aunque requerirá una futura validación. Han sido descritos algunos casos de desarrollo o persistencia de vasculitis crioglobulinémica (con o sin afectación renal) después de lograr una remisión virológica sostenida [64][65][66][67]. Es necesario seguir estudiando si esta presentación refleja la producción continua de células B de complejos inmunes patógenos.
GN fibrilar
En la biopsia renal, la tinción inmunohistoquímica para la proteína del miembro 9 de la subfamilia B homóloga del ADN J (DNAJB9) se identificó como un marcador sensible y específico en la GN fibrilar [37][38], pero el papel patogénico de DNAJB9 es desconocido. Los datos sobre el tratamiento de GN fibrilar consisten en pequeños estudios que utilizan una variedad de terapias, pero ninguno fue concluyente [68][69][70][71][72].
Futuros estudios
Investigaciones consideradas críticas para el desarrollo de protocolos para GC3, GN por inmunocomplejos y Gammapatías Monoclonales de Significado Renal se resumen en la (Tabla 3). Recomendaciones de las pautas de 2012 que deberían revisarse se detallan en (Tabla complementaria S2).
NEFRITIS LUPICA (LN)
Terminología
La LN está histológicamente clasificada por la International Society of Nephrology/Renal Pathology Society system [73], pero esta clasificación omite la patología tubulointersticial, las alteraciones vasculares o las podocitopatías [74][75][76]. Pacientes con lesión tubulointersticial, microangiopatía trombótica (TMA), y la vasculitis renal tienen peores resultados [74][75][77][78][79][80]. Además, según Sociedad Internacional de Nefrología / Sociedad de Patología Renal la clasificación carece de la suficiente cuantificación de la actividad de la enfermedad y cronicidad, y las categorías descriptivas carecen de un valor pronóstico claro. Se necesita un enfoque basado en la evidencia para mejorar la definición de categorías clínicamente relevantes dentro de la clase III / IV, incluida la importancia de la lesión necrotizante segmentaria [81][82] junto con el desarrollo de actividad de LN e índices de cronicidad que identifican con precisión a los pacientes que se beneficiarían del tratamiento inmunosupresor. Recientemente, un grupo de trabajo internacional de nefropatólogos propuso a la International Society of Nephrology/Renal Pathology Society una revisión de la clasificación de la LN para abordar las limitaciones actuales [83].
Según los criterios de diagnóstico de la Systemic Lupus International Collaborating Clinic, para diagnosticar el LES basta con una GN de complejo inmunológico compatible con LN y la detección de un anticuerpo antinuclear positivo o un ADN de doble cadena [84]. Los criterios de Systemic Lupus International Collaborating Clinic demostraron mayor sensibilidad en comparación con el American College of Rheumatology con especificidad similar en la cohorte control [84], sin embargo, la especificidad es menor [85].
Patogénesis
La patogenia de LN implica a procesos genéticos, epigenética, inmunorregulacion, fenómenos hormonales y ambientales [86]. Se han asociado múltiples polimorfismos de genes con un mayor riesgo de LES y / o LN [87] y muchos de ellos implican inmunidad célular y vías inmunorreguladoras [86][87][88]. Actualmente, no hay un beneficio clínico claro de las pruebas genéticas. Sin embargo, la identificación de estos polimorfismos ha dado una idea de vías involucradas en la patogénesis de la LN [87][89][90] . Pacientes con LN de ascendencia africana con alelos de riesgo de apolipoproteína L1 (APOL1) tienen mayor riesgo de nefropatías mas graves [91], sin embargo, las pruebas APOL1 no están disponibles de manera rutinaria y los riesgos y beneficios de las pruebas APOL1 deben aclararse.
Biomarcadores y predicción del pronóstico
Proteinuria, hematuria, sedimento urinario y TFGe
Ningún único biomarcador predice el desarrollo de la LN en pacientes con LES o con brotes de LN en pacientes con enfermedad inactiva. La detección de proteinuria, hematuria, el análisis de sedimento urinario y la creatinina sérica (con TFGe) [92] siguen siendo importantes para diagnosticar la LN y valorar la respuesta al tratamiento. El diagnóstico de LN debe confirmarse mediante biopsia.
Existen limitaciones para estos marcadores clínicos. Repetir los estudios de biopsia renal han demostrado que los pacientes con resolución de proteinuria y normalización de creatinina sérica pueden tener actividad histológica en la biopsia y viceversa [93][94][95][96][97], pero se necesitan estudios para evaluar la relevancia clínica de esta discordancia. La proteinuria al primer año fue el mejor predictor renal a largo plazo [98][99][100] y las tasas aleatorias de proteína/creatinina en la orina no son lo suficientemente precisas para dirigir los cambios terapéuticos. Dichos cambios deben basarse en tasas de proteinuria/24h o la relación proteína/creatinina tambien de 24 horas [101].
ADN anti-bicatenario, complemento C3, C4, anti-C1q.
La combinación de elevados niveles de anti-DNA doble cadena, complemento sérico bajo y autoanticuerpo anti-C1q están fuertemente asociados con afectación renal en la LN y debe controlarse en pacientes con riesgo de LN o LN florida [102][103]. Los niveles pueden cambiar varios meses antes de la LN florida y cómo estos cambios se relacionan con la predicción de la actividad, necesitan ser validados en estudios prospectivos.
Nuevos biomarcadores de orina / suero.
Se han estudiado varios biomarcadores de suero y orina en la LN [104][105][106][107]. Estos marcadores candidatos deben estudiarse de forma prospectiva esencialmente en ensayos clínicos. Es probable que se requerirán paneles para estratificar con precisión el riesgo, predecir brotes, determinar el tratamiento, validar la respuesta al tratamiento y predecir el pronóstico. El estudio molecular de la biopsia renal puede ayudar en estos procesos [108][109][110].
Tratamiento
Antipalúdicos
Se recomienda el tratamiento antipalúdico para todos los pacientes con LN. Los estudios observacionales y de cohorte han demostrado que los antipalúdicos reducen las probabilidades de desarrollar LN y están asociados con una mayor probabilidad de una respuesta renal completa al tratamiento y una reducción de desarrollar enfermedad renal terminal [111][112][113][114].
Corticosteroides
Es un tratamiento universal en todos los protocolos de LN y se asocian a corto y largo plazo a efectos adversos significativos. Los pacientes con LN tienen más probabilidades de desarrollar mas efectos secundarios asociados a los esteroides que los pacientes con LES pero sin LN [115]. Las dosis moderadas no son más seguras y están asociadas con tantos efectos adversos como dosis altas [116]. Por lo tanto, aunque no es posible para todos los pacientes, se debe hacer un intento para minimizar los corticosteroides (p. ej., prednisona equivalente < 5 mg / 24 h) durante la terapia de mantenimiento de la LN. Regímenes con corticosteroides orales reducidos o nulos se están investigando actualmente [93][117][118] (Aurinia Renal Response in Active Lupus with Voclosporina [AURORA], NCT03021499; Seguridad y eficacia de dos dosis de anifrolumab en comparación con el placebo en sujetos adultos con nefritis lúpica proliferativa [TULIP-LN1], NCT02547922).
Terapia inmunosupresora
Las terapias de inducción basadas en CYC o MMF siguen siendo el patrón oro para la mayoría de los pacientes, los regímenes basados en CNI han sido estudiados en Asia, y a menudo combinan MMF y corticosteroides con un CNI [119]. Un gran ensayo clínico multicéntrico chino comparando dosis bajas de MMF, tacrolimus y corticosteroides con CYC mensualmente i.v y corticosteroides como tratamiento de inducción de la NL. El régimen terapéutico basado en el CNI fue superior a la CYC iv para lograr remisiones completas o parciales de la LN a las 24 semanas [119]. Sin embargo, la tasa de respuestas acumuladas fue similar en los dos brazos de tratamiento con seguimiento extendido [120]. Los estudios en curso abordan el papel y toxicidad de los regímenes basados en CNI en poblaciones étnicamente diversas. Las biopsias de protocolo en ensayos clínicos con CNI ayudarán aclarar las respuestas inmunológicas ya que los CNI pueden reducir la proteinuria por mecanismos no inmunológicos.
Tratamiento de mantenimiento
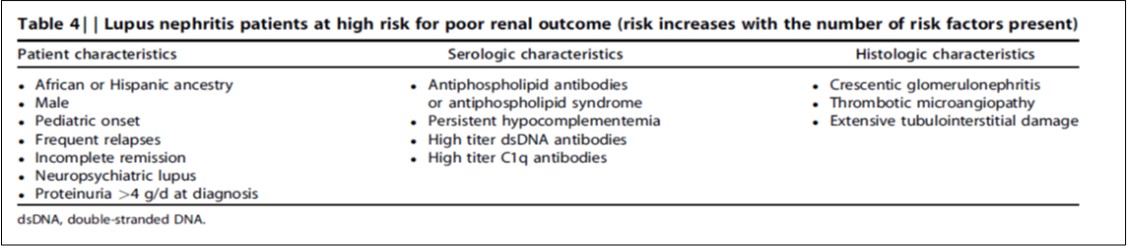
El tratamiento de mantenimiento después de la inducción típicamente consiste en MMF o azatioprina (AZA), con o sin corticosteroides en dosis bajas. No está claro cuanto debe durar el tiempo de mantenimiento. En ensayos clínicos recientes, la duración del mantenimiento ha sido de 3 a 5 años, y muchos de los pacientes permanecieron en terapia de mantenimiento durante 10 años [121][122]. Se sugiere un mínimo de 3 años de mantenimiento. Está en marcha un ensayo sobre la suspensión del mantenimiento (Randomized MMF Withdrawal in Systemic Lupus Erythematosus [ALE06]; NCT01946880). El mantenimiento prolongado para pacientes de "alto riesgo" se muestra en la (Tabla 4).
Los estudios preliminares sugieren que la depleción de células B con un régimen basado en RTX y CYC puede evitar la necesidad de terapia de mantenimiento [117]. Esto debe verificarse en grandes estudios.
Retirar lentamente la inmunosupresión podría ser considerado en pacientes con remisión clínica completa. Repetir la biopsia renal puede ser útil para excluir persistente actividad histológica clínicamente silenciosa. Los pacientes se deben revisar periodicamente para "monitorizar" una posible recaída después de disminuir o descontinuar terapia de mantenimiento [123][124][125][126][127].
Enfermedad refractaria
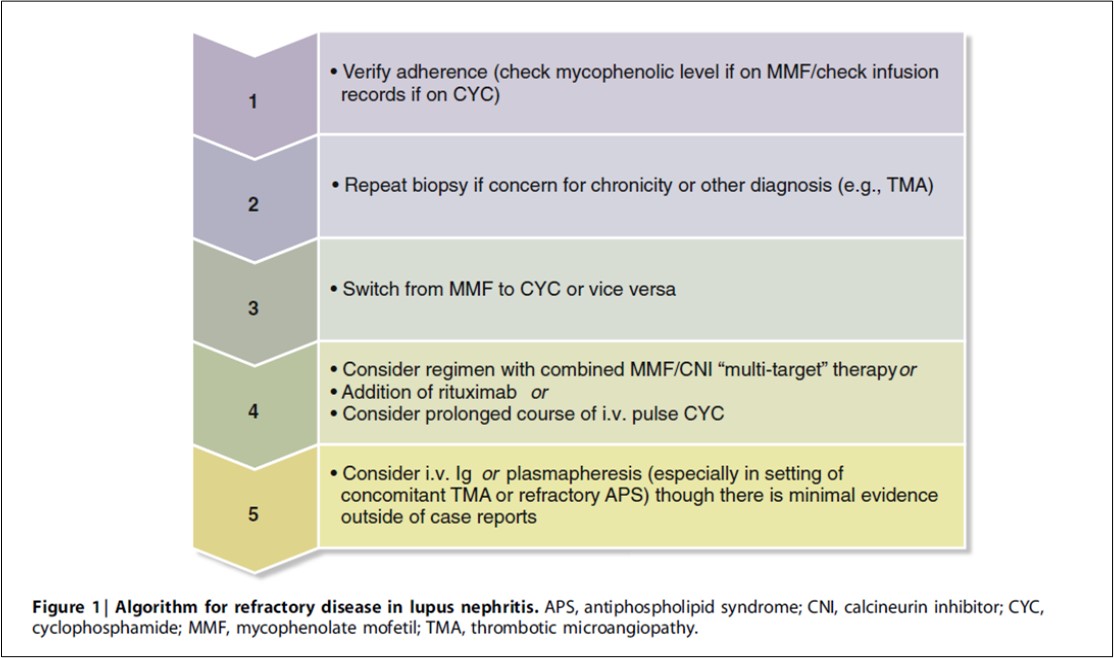
La LN puede considerarse refractaria si el paciente no responde a ninguno de las terapias estándares actuales de inducción (CYC o MMF) usadas secuencialmente. El algoritmo sugerido para la enfermedad refractaria se ilustra en la (Figura 1). Es preciso evaluar siempre la adherencia terapeutica. Repetir la biopsia renal para distinguir la LN activa de la cronicidad y / o identificar nuevas lesiones. Si persiste la LN activa, y si se usó MMF para la inducción, se debe considerar un cambio a CYC o viceversa. Después de esto, las alternativas son RTX o CNI [117][119][128][129][130][131].
Circunstancias especiales
Clase V de LN
Existe consenso en que la clase V de LN con persistente proteinuria en rango nefrótico debe recibir inmunosupresión, pero algunos autores también tratarían a pacientes con niveles más bajos de proteinuria [132]. Por tanto, se debe establecer el rango de proteinuria en el cual se debe tratar con inmunosupresión. La clase V de LN a menudo se trata inicialmente con MMF, pero si no es efectiva, se cambia a CYC. Algunos investigadores también sugieren usar CNI para clase V de LN y también se puede considerar el uso de RTX [133].
Microangiopatía trombótica
La TMA con LN en la biopsia renal puede deberse a síndrome antifosfolípido (APS), anticuerpos anticardiolipina, anti-b2 glicoproteína I y anticoagulante lúpico), púrpura trombocitopénica trombótica, o síndrome urémico hemolítico atípico [134][135]. El tratamiento debe dirigirse a la etiología subyacente de TMA [134]. La plasmaferesis está indicada para la púrpura trombocitopénica, pero puede también ser beneficiosa en casos de APS refractario [136][137]. Las terapias anticomplemento se pueden utlizar en APS catastrofico, púrpura trombocitopénica, TMA mediada por complemento, TMA y TMA recurrente en un aloinjerto [138][139][140][141]. La anticoagulación es prioritaria en APS [142]. Sin embargo, el impacto de la anticoagulación en la nefropatía no está clara y muchos pacientes experimentan una disminución en función renal a pesar de la anticoagulación terapéutica [143]. La rapamicina aumentó la supervivencia del injerto en pacientes con nefropatía por APS aunque se necesitan más estudios en riñones nativos [144].
Embarazo
Mujeres que están en mantenimiento con MMF y desean quedarse embarazadas deberán cambiar a AZA ya que MMF es teratogénico. Del mismo modo, los bloqueantes del sistema renina-angiotensina se deben suspender. Los CNI pueden ser utilizados para el tratamiento de la LN en el embarazo si existe intolerancia a AZA o como terapia complementaria con AZA en casos severos ó como terapia primaria para la LN clase V con síndrome nefrótico [145].
Postransplante
Los pacientes con LN tienen resultados equivalente o mejores en comparación con otras enfermedades glomerulares primarias [146]. La recurrencia es <20% [147][148][149][150][151]. Los pacientes deben seguir con hidroxicloroquina después del trasplante y régimen inmunosupresor con MMF / CNI. Pacientes con brotes leves se pueden solo con esteroides orales. Pacientes con brotes moderados deben tratarse con esteroides i.v. y aumento de MMF. Pacientes con enfermedad progresiva/brote severo deben ser tratados con. esteroides i.v y CYC. El MMF debe mantenerse mientras el paciente está en tratamiento con CYC.
Enfermedad de inicio pediátrico
La LN pediátrica, que ocurre antes de los 16 años, necesita más estudio, pero los niños están excluidos de ensayos de LN en adultos. Los niños a menudo tienen pocas comorbilidades, pero exhiben una enfermedad más severa con una mayor contribución genética. Existe consenso para la respuesta, recaída y tratamiento para niños con LN proliferativa [152]. Los niños con LN de clase V tienden a necesitar inmunosupresión adicional incluso con proteinuria subnefrótica [153][154]. La iniciativa The Single Hub and Access Point for Paediatric Rheumatology in Europe ha publicado recientemente recomendaciones para niños con LN [145].
Estudios futuros
La clase III / IV de LN debe estudiarse por separado de la clase V a la vista de sus diferentes cursos evolutivos. Se necesitan datos para evaluar los beneficios del tratamiento de pacientes con LN de clase V con proteinuria subnefrótica como asi mismo, índices validados de actividad histológica. Los ensayos clínicos deben requerir una biopsia renal reciente (< 3 meses) y la duración del ensayo debe ser al menos 12 meses para terapias de inducción y más tiempo para evaluar la recaída. Los resultados referidos por el paciente deben integrarse en futuros estudios y es necesario disponer de biomarcadores de pronóstico y de respuesta. Recomendaciones de la guía de 2012 se detallan en la (Tabla complementaria S3).
VASCULITIS ASOCIADAS ANCA
Terminología
La AAV (ANCA-associated vasculitis) representa un grupo de vasculitis de pequeño vaso, que incluyen poliangeitis granulomatos (GPA), poliangeítis microscópica y granulomatosis eosinofílica con poliangeítis [156] y vasculitis renal limitada. La histología renal es pauci-inmune (escasez, pero no a la ausencia de depósitos inmunes y de complemento) con GN necrotizante focal y semilunas. AAV es caracterizada por ANCA específico para mieloperoxidasa (MPO-ANCA) o proteinasa-3 (PR3-ANCA). Algunos pacientes con GN pauci-inmune son negativos para ANCA, pero se consideran en el mismo espectro de la enfermedad. Hay alguna evidencia de que un porcentaje de estos casos puede variar la detección de ANCA cuando se utilizan técnicas de detección diferentes [157].
La clasificación de pacientes como GPA o poliangeítis microscópica podría ayudar a establecer el pronóstico, pero la serología ANCA (MPO- o PR3-ANCA) es más relevante ya que parece predecir mejores resultados y riesgo de recaída [158] [159]. La patogénesis de la vasculitis asociada al ANCA tiene un componente genético, y existen diferencias genéticas entre la granulomatosis con poliangitis y la poliangitis microscópica que se asocian con la especificidad del ANCA y estos datos apoyan de manera preliminar el concepto de que la vasculitis asociada a la proteinasa 3 ANCA y la vasculitis asociada a la mieloperoxidasa ANCA son síndromes autoinmunes distintos [160].
Patogénesis
La patogenia del AAV implica a la genética, epigenética, fenómenos hormonales inmunorreguladores, y ambientales. La contribución relativa de cada uno de estos factores puede variar de un paciente. Los polimorfismos asociados con un aumento el riesgo de AAV involucra particularmente al sistema HLA y antígeno objetivo (en enfermedad anti-PR3) [160]. Estudios realizados con inhibidores del complemento [161][162] han demostrado la implicación patogénica del complemento en la patogénesis de la nefritis asociada a ANCA (AAN).
Biomarcadores y predicción del pronóstico.
Proteinuria, hematuria, sedimento urinario y GFRe
Proteinuria, hematuria, análisis de orina, GFRe y la biopsia renal son las herramientas clínicas mas importante para el diagnóstico y tratamiento de AAN [163]. En la actualidad, no hay biomarcadores que puede usarse para predecir el desarrollo de AAN o sus recidivas.
ANCA
Tanto un aumento en el título de ANCA como su persistente positividad se asocian de manera modesta pero significativa con recaída de la enfermedad, aunque la determinación seriada de ANCA no es argumento suficiente para realizar cambios terapeúticos [164]. La recidiva de la enfermedad es mas frecuente en PR3-ANCA que en pacientes MPO-ANCA, y la recaída puede ser predicha por niveles PR3-ANCA [158][159].
Nuevos biomarcadores de orina / suero.
The Birmingham Vasculitis Activity Score and the Vasculitis Damage Index utilizan biomarcadores clínicos y de laboratorio tradicionales para evaluar actividad y son valiosas herramientas de investigación [165][166]. Sin embargo, las medidas tradicionales de laboratorio no diferencian bien entre enfermedad activa y daño crónico. En un análisis post hoc del estudio Rituximab para la vasculitis asociada al ANCA (RAVE), el ligando de quimiocinas C-X-C 13, la metaloproteinasa matriz-3 y el inhibidor tisular de la metaloproteinasa-1 discriminaron la forma activa de la vasculitis inactiva, mejor que la velocidad de sedimentación y la proteína C reactiva [167]. El inhibidor tisular de metaloproteinasas-1 fue el mejor marcador de la actividad de AAV demostrado en el estudio Remission Induction Therapy in Japanese Patients With AAV and Rapidly Progressive Glomerulonephritis (RemIT-JAV-RPGN) [168]. La tasa de CD163 en orina también es un biomarcador prometedor para identificar la vasculitis renal activa [169]. Estos biomarcadores necesitan una validación prospectiva.
Tratamiento
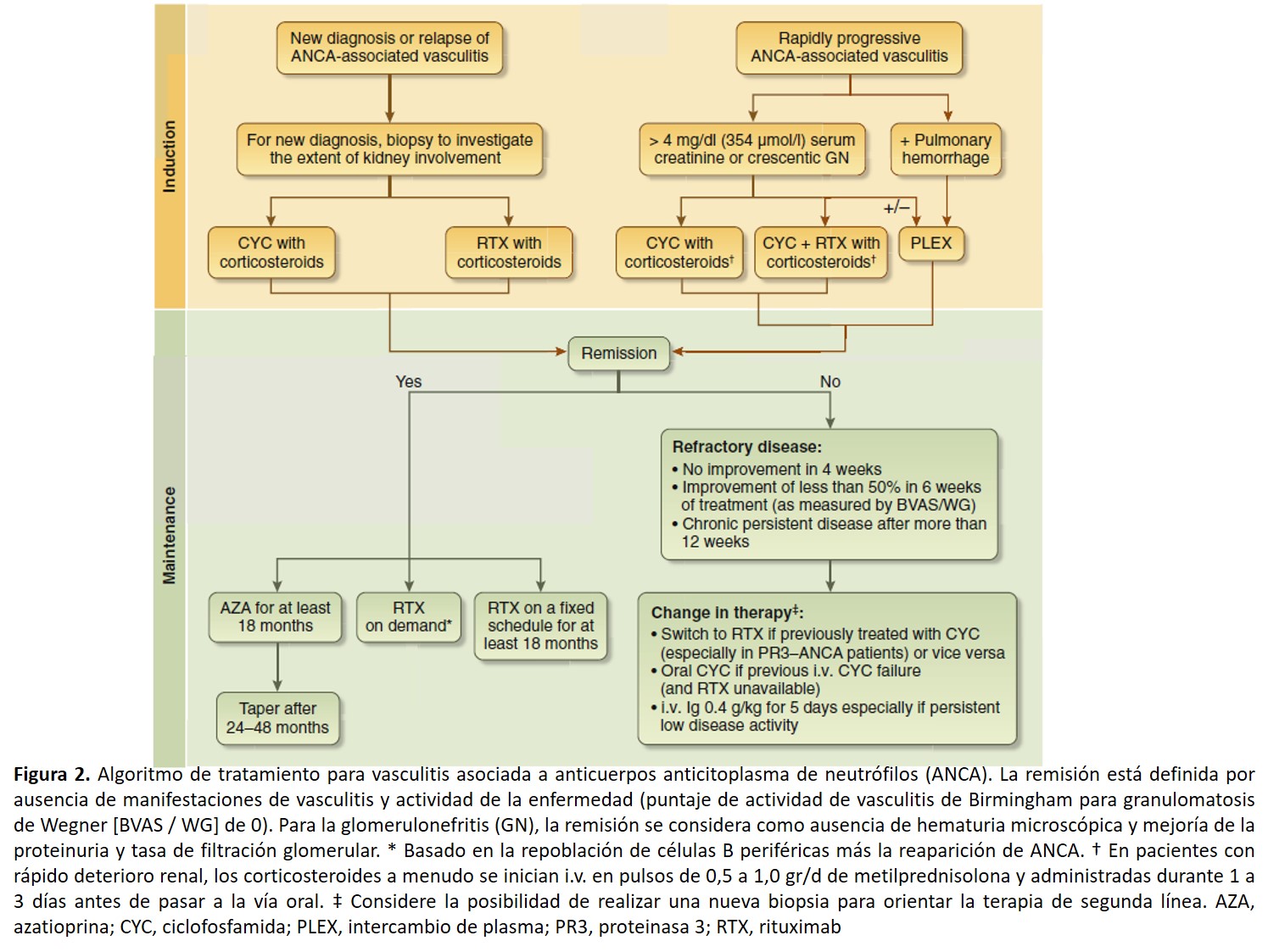
Un algoritmo para el tratamiento de AAV se muestra en la (Figura 2).
Corticosteroides
Los esteroides se usan casi universalmente para AAV y a menudo se administran como 500 a 1000 mg i.v. en bolus diarios durante 1 a 3 días al inicio del tratamiento, especialmente en pacientes con cuadro clínico de progresión rápida. Sin embargo, la monoterapia con corticosteroides no es eficaz y están asociados con importantes efectos adversos a corto y largo plazo. Los inhibidores del complemento son una esperanza como una terapia que puede reducir el uso de esteroides [170].
Inducción
CYC ha sido el inmunosupresor clásico de elección. A pesar de su eficacia en el manejo de AAV, su perfil de seguridad ha requerido la necesidad de probar otras opciones. Recientemente, se ha demostrado que RTX es tan efectivo como la inducción con CYC y el mantenimiento con AZA para pacientes con creatinina sérica menor 4 mg/dl (354 micromol/l) (171) (172) (173).
Un enfoque alternativo incluye el uso de CYC para la fase de inducción y RTX para mantenimiento. Se desconoce si el tratamiento debe ser diferente para MPO-ANCA y PR3-ANCA, sin embargo, un análisis post hoc de RAVE sugirió que RTX era superior a CYC para PR3-ANCA y tan efectivo como CYC para MPO-ANCA [174]. En un análisis de comparativo de los estudios Methotrexate or Azathioprine as Maintenance Therapy for ANCA-Associated Vasculitides (WEGENT) y el estudio RAVE, no se pudo demostrar diferencias clínicas importantes entre los pacientes MPO-ANCA-positivo y PR3-ANCA-positivo con GPA. El riesgo de recaída se asoció más estrechamente con el tipo de enfermedad que con el tipo de ANCA. Estos hallazgos merecen ser considerados en la evaluación del riesgo de recaída en pacientes con AAV [175].
En pacientes con GFRe menor 20 ml / min por 1.73 m2, un régimen terapéutico basado en RTX (International, Randomized, Open Label Trial Comparing a Rituximab-based Regimen With a Standard Cyclophosphamide/Azathioprine-based Regimen in the Treatment of Active, Generalized ANCA-Associated Vasculitis [RITUXVAS] trial) que consiste en una combinación de esteroides, RTX 375 mg / m2 por semana durante 4 semanas y 2 bolus i.v.de CYC seguidos de dosis bajas de esteroides, parece ser igual a la administración de esteroides estándar con CYC i.v. durante 3 a 6 meses seguido de AZA [176 ]. A los 24 meses, el resultado de muerte, ERC terminal ó recidiva, no difirió entre los grupos. Las recaídas ocurrieron en el 21% de los pacientes en el grupo RTX y 18% del grupo control [177].
Tratamiento de mantenimiento
En AAN (ANCA-associated nephritis), una vez lograda la remisión, empieza la terapia de mantenimiento, generalmente de 3 a 6 meses después de comenzar la inducción y usualmente, consiste en AZA o RTX. No hay consenso sobre el tiempo de mantenimiento. La duración puede ser diferente dependiendo de la serología ANCA, así como del tratamiento, pero esto no se ha estudiado adecuadamente.
Para terapia convencional con inducción de CYC y mantenimiento con AZA, la tasa de recaída fue menor si el mantenimiento fue continuo durante 48 en lugar de 24 meses [178]. Alternativamente, pacientes con MPO-ANCA que logran remisión y ANCA negativos al final de la inducción pueden requerir un curso más corto de mantenimiento. Esto se basa en la observación de que la mayoría de los pacientes con MPO-poliangeítis microscópica tratados con un solo curso de 6 infusiones de rituximab sin mantenimiento, no recayó durante una media de 66 meses [179]. Sin embargo, es poco probable que esta observación se pueda aplicar a MPO-GPA [175].
Estudios retrospectivos y prospectivos han utilizado RTX para mantenimiento de la remisión en AAV, pero no ha habido consenso sobre la dosificación para el mantenimiento o incluso para la terapia de inducción (Tabla 5) [172][177][180][181][182][183][184][185][186].
Tampoco está claro si rituximab debe administrarse como un régimen fijo o solo cuando la tasa de células B se recupera, pero esto es el objetivo del estudio Comparison Study of Two Rituximab Regimens in the Remission of ANCA Associated Vasculitis MAINRITSAN 2; NCT01731561).
Enfermedad refractaria
En un paciente con empeoramiento de la creatinina y/o proteinuria después de la terapia inicial, hay que evaluar la adherencia terapeutica. Además, se podría considerar la posibilidad de rebiopsiar para distinguir el AAV activo de la cicatrización y/o la identificación de nuevas lesiones podrían ser consideradas. Para las lesiones de AAV activas, el tratamiento inicial debe cambiar a otros regímenes estándar de inducción (es decir, cambiar de CYC a RTX o viceversa).
Circunstancias especiales
Papel de la plasmaféresis
La plasmaféresis estaría indicada en AAN con insuficiencia renal grave (creatinina> 5.6 mg / dl [495 mmol / l]) y / o semilunas difusas o acompañado de hemorragia alveolar. El uso de plasmaféresis en insuficiencia renal menos grave es objeto de estudio en Plasma Exchange and Glucocorticoids for Treatment of Antineutrophil Cytoplasm Antibody-Associated Vasculitis (PEXIVAS) trial (NCT00987389).
Enfermedad de inicio en la infancia
AAV en niños debe ser estudiado por separado de los adultos [187]. Se han desarrollado "score" para valorar la a actividad de la enfermedad. Hay una alta frecuencia de enfermedad renal (75%) entre AAV pediátrico y predominio de mujeres (65%, en comparación con el 40-45% en cohortes de adultos) [188]. No hubo ensayos controlados aleatorizados en niños, pero estudios de cohorte apoyan la eficacia de CYC y RTX [189][190].
Estudios futuros
Los estudios futuros deberían investigar más a fondo la disminución de dosis de CYC, el efecto de agentes biológicos (p. ej., terapias anti-células B) y la disminución de los esteroides y mayor conocimiento de los nuevos agentes más actuales, como los inhibidores del complemento.
El papel clínico y la rentabilidad de RTX en pacientes con enfermedad renal grave y en pautas de mantenimiento esta aun sin definir.
Los ensayos clínicos futuros en AAV deben apuntar a subgrupos de pacientes estratificados según subtipo ANCA, identificación de pacientes de alto riesgo (p. ej., con comorbilidades) y diferenciando entre enfermedad activa versus crónica por biomarcadores no invasivos.
Se debería rediseñar los ensayos clínicos definiendo de forma muy precisa el end point y el tiempo minimo de seguimiento (el consenso de los expertos ha sugerido un mínimo de 12 a 24 meses). Además, se deberían incorporar los efectos secundarios comunicados por los pacientes.
Las recomendaciones de la directriz de 2012 que deberían revisarse se esbozan en la (Tabla Suplementaria S4).
CONCLUSIONES
Desde la primera guía de KDIGO GN publicada en 2012, se han realizado importantes avances en la definición de enfermedades (p. ej., C3G), mejorar el diagnóstico (p. ej., antifosfolipasa Receptor A2), identificando biomarcadores relevantes (p. ej., ADN J homólogo subfamilia B miembro 9), y aplicando nuevas terapias (por ejemplo, rituximab en AAN). Pero todavía nos faltan conocimientos para un manejo clínico óptimo. Están empezando a surgir consideraciones en torno a la inutilidad del tratamiento y los resultados centrados en el paciente, que son importantes para todas las enfermedades glomerulares. Esta Conferencia sobre Controversias puede resumirse mejor como una evaluación honesta de dónde estamos actualmente y una hoja de ruta de dónde debemos estar.