Iniciación a la diálisis. Elección de modalidad, acceso y prescripción (2019)
Iniciación a la diálisis, elección de modalidad, acceso y prescripción: conclusiones de Conferencia de Controversia de KDIGO (Kidney Disease Improving Global Outcomes)
Christopher T. Chan1 , Peter J. Blankestijn2 , Laura M. Dember3 , Maurizio Gallieni4 , David C.H. Harris5 , Charmaine E. Lok1 , Rajnish Mehrotra6 , Paul E. Stevens7 , Angela Yee-Moon Wang8 , Michael Cheung9 , David C. Wheeler10, Wolfgang C. Winkelmayer11 and Carol A. Pollock5 ; for Conference Participants12
1 University Health Network, University of Toronto, Ontario, Canada; 2 Department of Nephrology and Hypertension, University Medical Center Utrecht, Utrecht, The Netherlands; 3 Renal-Electrolyte and Hypertension Division, Perelman School of Medicine, University of Pennsylvania, Philadelphia, Pennsylvania, USA; 4 Department of Clinical and Biomedical Sciences ¿Luigi Sacco¿, University of Milan, Milan, Italy; 5 University of Sydney, Sydney, NSW, Australia; 6 Division of Nephrology, Kidney Research Institute and Harborview Medical Center, University of Washington, Seattle, Washington, USA; 7 Kent Kidney Care Centre, East Kent Hospitals, University NHS Foundation Trust, Canterbury, Kent, UK; 8 Department of Medicine, Queen Mary Hospital, University of Hong Kong, Hong Kong, China; 9 KDIGO, Brussels, Belgium; 10University College London, London, UK; and 11Selzman Institute for Kidney Health, Section of Nephrology, Department of Medicine, Baylor College of Medicine, Houston, Texas, USA
A nivel mundial, el número de pacientes sometidos a mantenimiento con diálisis está aumentando, pero en todo el mundo hay una diferencia significativa en la práctica de iniciar diálisis. Factores como la disponibilidad de recursos, razones para el inicio de diálisis, momento de inicio de diálisis, educación y preparación del paciente, modalidad de diálisis y tipo de acceso, así como diferentes factores "específicos del país" significativamente afectan las expectativas y los resultados del paciente. Como la carga de la enfermedad renal en etapa terminal (ESKD) ha aumentado a nivel mundial, también ha habido un creciente reconocimiento de la importancia de la participación del paciente en la determinación de objetivos de atención y decisiones con respecto al tratamiento. En Enero 2018, KDIGO (Kidney Disease: Improving Global Outcomes) convocó una conferencia de controversias centrada en iniciación de diálisis, incluida la opción de modalidad, acceso y prescripción. Aquí presentamos un resumen de las discusiones de la conferencia, incluidas las lagunas de conocimiento identificadas, áreas de controversia y prioridades para la investigación. Una gran novedad fué el tema representado durante la conferencia sobre la necesidad de una atención más individualizada, eliminando el concepto de dialisis para todos igual (¿one-size-fits-all¿) procurando alcanzar los objetivos y preferencias del paciente mientras se mantienen las prácticas de calidad y seguridad. Identificar y requerir objetivos centrados en el paciente que puedan validarse como indicadores de calidad en el contexto de diversos sistemas de salud para lograr la equidad de los resultados requerirá la alineación de los objetivos e incentivos entre pacientes, proveedores, reguladores y pagadores que logicamente variarán según las jurisdicciones de atención sanitaria.
Kidney International (2019) 96, 37-47; https://doi.org/10.1016/ j.kint.2019.01.017
PALABRAS CLAVE: diálisis dirigida a objetivos; hemodiálisis; diálisis en casa; iniciación; modalidad; diálisis peritoneal; prescripción; control de síntomas , acceso vascular y peritoneal
Copyright ª 2019 The Authors. Published by Elsevier Inc., on behalf of the International Society of Nephrology. This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).
-------------
Correspondencia: Christopher T. Chan, Division of Nephrology, University Health Network, 200 Elizabeth Street, 8N room 846, Toronto, ON M5G 2C4, Canada. E-mail: christopher.chan&uhn.ca; or Carol A. Pollock, The University of Sydney School of Medicine, Kolling Institute of Medical Research, Royal North Shore Hospital, Pacific Hwy, St. Leonards NSW 2065, Australia. E-mail: carol.pollock&sydney.edu.au 12See Appendix for list of other conference participants. Received 20 September 2018; revised 21 December 2018; accepted 4 January 2019; published online 13 April 2019
-----------------
Durante las últimas 3 décadas, el número de personas sometidas a diálisis de mantenimiento a nivel mundial ha aumentado dramáticamente [1]. En 2010 se estimó que el el número de pacientes en diálisis era más de 2 millones en todo el mundo, y los datos del modelo de calculo sugieren que este número será más el doble para 2030 [2]. Varios factores han contribuido a la aumento: mejora de la supervivencia de la población general, reducción en la mortalidad de pacientes en diálisis, un aumento en la incidencia de enfermedad renal crónica (ERC), ampliación de criterios de aceptación del tratamiento de sustitución renal, y mayor acceso a diálisis crónica en paises con ingresos bajos y medios [1] [3][4][5].
Las circunstancias del inicio de diálisis y la elección de la modalidad inicial y el acceso pueden afectar significativamente las experiencias y los resultados del paciente. La falta de preparación del paciente. y un inicio urgente de diálisis están asociados con una menor supervivencia y una mayor morbilidad [6] [7]. Las modalidades domiciliarias como la hemodiálisis en casa y la diálisis peritoneal pueden mejorar la capacidad de los pacientes en cuanto a percepción de autonomía [8]. Menor mortalidad, menos complicaciones médicas y menores costos se asocian con la hemodiálisis con acceso vascular a través de una fístula arteriovenosa (FAV) versus injerto arteriovenoso (AVG) o catéter venoso central (CVC) [4] Sin embargo en algunas circunstancias, como en pacientes mayores o con acceso arteriovenoso deficiente: se puede preferir un AVG o CVC.
Históricamente, la evaluación de la "dialisis adecuada " se ha basado aclaramiento de solutos de pequeño peso molecular . Este enfoque limitado excluye los parámetros multidimensionales involucrados para el logro óptimo de la diálisis y pasa por alto las evaluaciones necesarias que reflejan las muchas comorbilidades presentes en la población de diálisis y el grado de satisfacción que sienten los pacientes con su tratamiento. Los pacientes y los médicos pueden tener objetivos diferentes y a veces conflictivos en cuanto al tratamiento de hemodiálisis, con médicos enfocados más en resultados como mortalidad y marcadores bioquímicos y pacientes priorizando su bienestar y estilo de vida [9]. Por ejemplo, algunos pacientes en dialisis domiciliaria han reportado una preferencia en la capacidad de viajar sobre la supervivencia 10 Con el creciente reconocimiento de la importancia de las preferencias del paciente y la satisfacción de compartir la toma de decisiones y evaluación de resultados [8] [9] [11] [12] [13] [14] [15] [16] [17] se ha convenido claramente que se necesita un enfoque más multifacético para evaluar diálisis como modalidad de tratamiento [18].
En enero de 2018, KDIGO (Kidney Disease: Improving Global Outcomes Enfermedad renal: Mejorando Resultados Gobales ) convocó una Conferencia de Controversias titulada "Diálisis Iniciación, elección de modalidades, acceso y prescripción". Aquí presentamos un resumen de la discusión, incluyendo lagunas de conocimiento, áreas de controversia y prioridades para la investigación. La agenda de la Conferencia, preguntas de discusión y presentaciones en la sesión plenaria están disponibles en el sitio web KDIGO: http://kdigo.org/conferences/ controversias-conferencia-en-diálisis-iniciación /. Hay que considerar que aquellos pacientes en espera preementiva o planificada de trasplante renal no fueron considerados por los conferenciantes.
MODALIDADES DE DIALISIS Y DISPONIBILIDAD
Las modalidades de diálisis incluyen centro , centro satèlite o autocuidado, donde se realizan diálisis con ayuda personal de apoyo en el procedimiento de diálisis y hemodiálisis en el hogar así como dialisis peritoneal continua ambulatoria y automatizada Los patrones de prescripción se pueden clasificar como convencionales, incremental, intensivo (corto diario o nocturno), basado en ensayos y paliativos. La disponibilidad de modalidades y los patrones de prescripción generalmente son más dependientes de los recursos locales ,de las políticas de reembolso y existencias de infraestructuras que de las preferencias del paciente informado . En algunas partes del mundo la hemodiálisis en el centro es la modalidad predominante, mientras que el enfoque de "diálisis peritoneal primero" es la consideración inicial en un número de lugares con excelentes resultados. En países industrializados, la diálisis peritoneal es a menudo más costo efectiva que la hemodiálisis, sin embargo, lo contrario puede ser cierto para países sin fabricación local de líquidos de diálisis peritoneal o con aranceles sobre la importación de suministros de diálisis peritoneal [19] [20] [21] Factores que se han asociado independientemente con una menor probabilidad de uso de diálisis peritoneal son diabetes como la causa de la enfermedad renal en etapa terminal (ESKD), mayor gasto en atención de salud como porcentaje del producto interno bruto, una mayor cantidad de instalaciones de hemodiálisis privada con ánimo de lucro y un mayor costo de material de diálisis peritoneal en relación a la dotación de personal [20].
La mortalidad temprana (muerte dentro de los primeros 90 días de comenzar diálisis) afecta desproporcionadamente a los pacientes que reciben hemodiálisis en el centro. Esto probablemente se deba, al menos en parte, al sesgo de selección porque los pacientes con lesión renal aguda que evolucionan a insuficiencia renal crónica o aquellos con peor estado de salud tienen más probabilidades de usar hemodiálisis en el centro que diálisis peritoneal [22]. Las estrategias para reducir la mortalidad temprana no están bien estudiadas.
La única contraindicación absoluta para la hemodiálisis crónica es la ausencia de un posible acceso vascular o una Inestabilidad cardiovascular que no lo permita La diálisis peritoneal está contraindicado si la cavidad peritoneal tiene obstrucciones , la membrana no funciona o no es posible colocar un catéter.
La anuria no es una contraindicación para la diálisis peritoneal. Todas las otras comorbilidades son contraindicaciones relativas, y por lo tanto, la selección de la modalidad de diálisis debe basarse en la elección informada del paciente unido a una aceptación apropiada por el sistema de salud. Los pacientes y cuidadores deben ser informado de los riesgos, consideraciones y compensaciones de las diferentes modalidades de diálisis para que la selección de cada modalidad se adapte a su salud y circunstancias sociales.
En varios países se ha informado que los hombres reciben más comúnmente diálisis que las mujeres [2] [23] [24]. Es necesario investigar para para aclarar las disparidades, dónde existen, y si estas resultan de diferencias biológicas o sesgos socioculturales.
Cabe destacar que los participantes de la conferencia reconocieron que preservar la función renal residual es importante y debe ser un objetivo para todos los médicos y pacientes en diálisis. Sin embargo, la función renal residual no debe ser la única consideración al seleccionar la modalidad inicial de diálisis, porque la calidad de la evidencia que compara la disminución de la función renal residual en todas las modalidades se basa en estudios observacionales pequeños, en su mayoría de un solo centro, de hace más de 2 décadas [25]. Por ello, los datos disponibles no son suficientemente sólidos para sugerir que una modalidad es favorable sobre otra.
Del mismo modo, aunque existe evidencia de que algunos pacientes puede beneficiarse de la hemodiálisis incremental versus tres veces por semana en términos de preservación de la función renal residual [26], actualmente no hay pruebas suficientes para la adopción generalizada de diálisis incremental como un medio para preservar la función renal residual.
Inicio urgente versus no urgente y planificado versus no planificado
Los inicios urgentes se definen como aquellos en los que debe realizarse la diálisis inminentemente o en menos de 48 horas después de la presentación para corregir manifestaciones potencialmente mortales. Los comienzos no urgentes son aquellos en los que la iniciación de diálisis puede demorarse más de 48 horas después de la presentación. Un enfoque planificado es aquel en el que la modalidad ha sido elegida antes de la necesidad de diálisis y hay un acceso listo para usar al inicio de diálisis. Un inicio no planificado es cuando se accede y no está listo un acceso o requiere hospitalización o cuando la diálisis se inicia con una modalidad que no es la de elección del paciente.
Tanto en la hemodiálisis como en la diálisis peritoneal es posible un inicio planificado o no planificado y urgente o no urgente. Sin embargo, los pacientes que requieren diálisis urgente en la situación de hiperpotasemia, sobrecarga de volumen o uremia avanzada, no son buenos candidatos para el inicio de dialisis peritoneal urgente. Los siguientes puntos son 5 elementos clave para comenzar con éxito una dialisis peritoneal urgente en pacientes en los que el médico ha considerado un tratamiento óptimo con la elección del paciente [27] :
(i) Posibilidad de colocar un catéter peritoneal dentro de las 48 horas
(ii) Educación del personal sobre el uso del catéter inmediatamente después de la colocación
(iii) Apoyo administrativo en pacientes hospitalizados y ambulatorios
(iv) Identificación de candidatos apropiados para inicio urgente de diálisis peritoneal
(v) Utilización de protocolos en cada paso del proceso de inicio urgente (desde la selección del paciente para diálisis peritoneal hasta un seguimiento apropiado después del alta).
Las principales barreras para un programa de diálisis peritoneal de inicio urgente son la falta de profesionales que puedan colocar un catéter de diálisis dentro del tiempo de inicio urgente (es decir 48 horas) y la capacidad limitada del centro médico para organizar el tratamiento de diálisis peritoneal para pacientes de inicio urgente y formar a los pacientes a corto plazo. Donde la experiencia técnica en la colocación del catéter de DP no existe, esto generalmente puede ser abordado aumentando la formación en nefrología intervencionista a nefrólogos y / o radiólogos. Cuando la enfermedad está en una situación crítica o el tiempo y/o capacidad de iniciar hemodialisis o dialisis peritoneal estan limitadas para la elección en un inicio urgente ,los pacientes necesitan posteriormente soporte organizativo y educativo para permitir la transición a su modalidad preferida cuando sea factible.
EDUCACIÓN Y APOYO AL PACIENTE
Preparación para diálisis
Las ayudas educativas y de decisión son esenciales para ayudar a los pacientes a comprender mejor la insuficiencia renal, sopesar los tratamientos disponibles, mantener una sensación de control y compartir información con miembros de la familia y / o cuidadores [14]. Además, la educación temprana se asocia con una menor mortalidad después de iniciarse la diálisis [15]. La educación efectiva generalmente se ofrece a los pacientes a medida que se acercan al grado 4 de ERC [28]. Los materiales educativos pueden incluir recorridos o videos con entrevistas de pacientes usando las diferentes modalidades En ausencia de contraindicaciones para una forma de terapia dialítica, todas las opciones deben estar igualmente representadas. La educación integral deberá asimismo estar disponible para pacientes hospitalizados y para aquellos que no tuvieron un seguimiento regular con un nefrólogo o acceso a la educación adecuada antes de comenzar la diálisis.
La modalidad de diálisis se elige idealmente con toma de decisiones compartida entre el equipo de atención médica, pacientes, y sus cuidadores. Son necesarias las discusiones sobre las opciones e implicaciones. de varias modalidades de diálisis que deben incluir tambien a personas que comenzaron la diálisis de manera no planificada. El enfoque para la elección de la modalidad debe estar idealmente centrada en la persona, involucrando al paciente al elegir la modalidad de diálisis en el contexto de sus objetivos de atención , recursos de politica sanitaria local , capacidades del servicio de salud en cuanto a infraestructuras y personal médico .
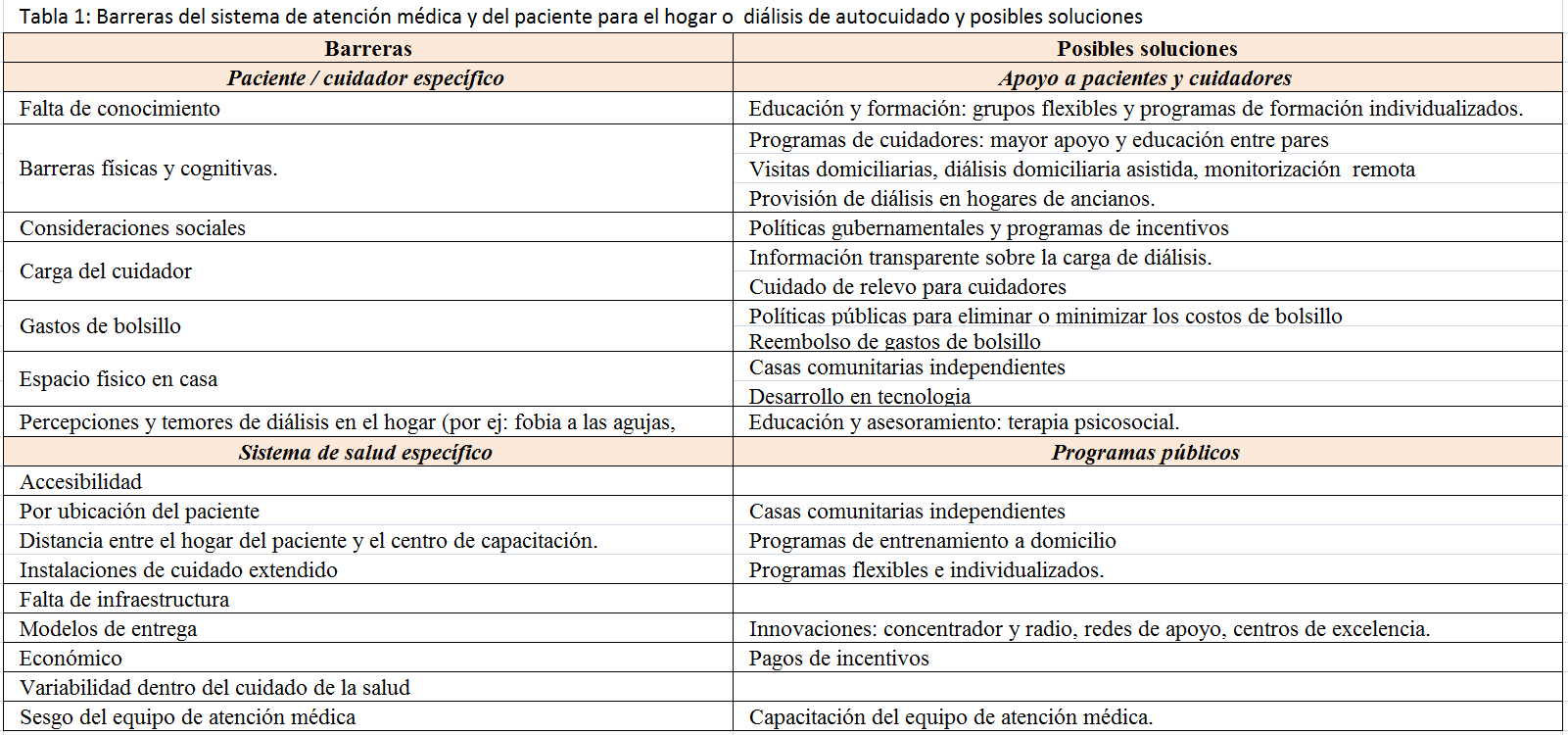
Los pacientes que perciben esa diálisis en el hogar (diálisis peritoneal o hemodiálisis) tienen la oportunidad de prosperar: mejora la libertad, flexibilidad y bienestar, y fortalece las relaciones [8] [13]. Con soporte adecuado y entrenamiento prediálisis , se estima que hasta el 50% de los pacientes con ERC avanzada puede lograr diálisis de autocuidado [29]. Sin embargo, existen casos de ansiedad y miedo para realizar tratamientos de diálisis en el hogar por falta de confianza en su habilidad para dominar los aspectos técnicos, incluida la autocanulación para hemodiálisis en casa, y el aislamiento del médico y apoyo social [8] [13]. De hecho porque muchos más pacientes en el mundo podrían estar dializándose en casa o en regimen de autocuidado de lo que están haciendo actualmente, los asistentes a la conferencia recomendaron como objetivo alentar y apoyar a los pacientes para seleccionar un tratamiento en casa (diálisis peritoneal o hemodiálisis) o diálisis de autocuidado e identificar formas de superar las barreras que tiene este objetivo (Tabla 1). Al mismo tiempo se reconoció que muchos pacientes en muchas partes del mundo necesitarán o preferirán hemodiálisis en Centro y que las modalidades de diálisis en algunos países pueden depender de las circunstancias locales.
Apoyo a los pacientes durante diálisis
Después de que un paciente comienza la diálisis, el equipo de atención médica debe brindar apoyo continuo para optimizar los beneficios para la salud de la modalidad seleccionada El apoyo puede ser más necesario en el período inmediatamente después del inicio y puede disminuir con el tiempo. Un cansancio temprano puede ocurrir con la diálisis peritoneal o la hemodiálisis en el hogar debido a problemas mecánicos del catéter, infección, manejo en un centro pequeño o derivación tardía a nefrólogos o para la atención de la ERC [30]. Anticipar y prevenir estos factores modificables para abordar rápidamente estos problemas es importante. La confianza del paciente en el manejo de la diálisis en casa debe ser evaluada antes del inicio de la diálisis y después de la iniciación.
La fragilidad puede afectar a las complicaciones de la diálisis y a la experiencia del paciente y lógicamente al pronóstico . Porque la fragilidad puede ocurrir a cualquier edad, debe ser evaluada de forma regular para identificar cualquier problema reversible y para informar la toma de decisiones sobre el tratamiento y apoyo al paciente.
MOMENTO Y PREPARACIÓN PARA LA INICIACIÓN DE DIÁLISIS
No ha sido establecido un un valor específico estimado de la tasa de filtración glomerular (TFGe) para iniciar diálisis, en ausencia de síntomas de insuficiencia renal De hecho, el estudio IDEAL no demostró ningún beneficio clínico al comenzar la diálisis a niveles más altos de TFGe, y la variabilidad en la medición de eGFR en CKD G5 es tal que no debe considerarse para reflejar de manera confiable la función renal [31]. Los datos de registros indican que la TFGe media previa a la iniciación de la diálisis varía entre países (aproximadamente 5 ml / min por 1.73 m2 en Taiwán; 8,5 promedio en el Reino Unido, 7.3 en Australia, 6.4 en Nueva Zelanda 9-10 en Canadá y Francia, y 11 en los Estados Unidos [32] [33] [34] [35]. Generalmente, las pautas actuales aconsejan el inicio de diálisis preventiva [36] [37] [38], aunque una excepción es la guía europea de 2011 [39]. Mientras que el momento óptimo para comenzar la diálisis no está claro, y en la practica clinica las razones para iniciar dialisis varían [40], las ecuaciones de riesgo pueden ser útiles para predecir un tiempo aproximado para cuando el tratamiento de sustitución real pudiera ser necesario (Tabla 2).
El inicio de diálisis generalmente se considera cuando uno o más de los siguientes datos están presentes: síntomas o signos atribuibles a insuficiencia renal (p. ej., signos neurológicos y síntomas atribuibles a uremia, pericarditis, anorexia, anormalidades acido-base o electroliticas resistentes a tratamiento médico, nivel de energía reducido, pérdida de peso sin otra potencial explicación, prurito intratable o sangrado); incapacidad para controlar el estado del volumen o la presión arterial; y un progresivo deterioro en el estado nutricional refractario intervenciones [36]. Dependiendo de las preferencias del paciente y de las circunstancias, un ensayo agresivo de medidas médicas no dialíticas para el manejo de los síntomas en la ERC avanzada puede estar justificado antes de iniciar la diálisis de mantenimiento.
En adultos mayores de 60 años, en ausencia de lesión renal aguda y donde existen bajos niveles de albuminuria, la disminución en el eFG puede ser relativamente lento [34], y por lo tanto el riesgo de morir antes de la necesidad de iniciar la diálisis mayor que en otras poblaciones De hecho, del 20% al 35% de los pacientes mayores ERC G4¿G5 mueren antes de llegar a diálisis [41]. Además, los pacientes mayores tienen una menor probabilidad de supervivencia en los 90 días después de iniciar la diálisis [42]. Si los pacientes no tienen otras indicaciones para comenzar la diálisis, se puede tomar la decisión de retrasar el inicio de la diálisis en estos pacientes mayores hasta que caiga el eGFR a menos de 6 ml / min por 1.73 m2. En pacientes en estados avanzados de ERC es importante discutir las opciones tanto médicas como dialíticas ante la eventualidad de lesión renal aguda o una adicional enfermedad significativa.
La toma de decisiones, incluyendo planificación avanzada de la atención, se puede ayudar de modelos predictivos como los desarrollados por Couchoud et al. [43], Bansal et al. [44] y Ivory et al [45]. Esta planificación a menudo incluye discusiones individualizadas sobre el curso clínico, los objetivos del tratamiento y las preferencias del paciente Los pacientes deben ser informados de las opciones de tratamiento médico sin diálisis, como cuidados de apoyo y / o medidas de confort y cuidados paliativos, cuando sea apropiado [46].
La toma de decisiones, incluyendo planificación avanzada de la atención, se puede ayudar de modelos predictivos como los desarrollados por Couchoud et al. [43], Bansal et al. [44] y Ivory et al [45]. Esta planificación a menudo incluye discusiones individualizadas sobre el curso clínico, los objetivos del tratamiento y las preferencias del paciente Los pacientes deben ser informados de las opciones de tratamiento médico sin diálisis, como cuidados de apoyo y / o medidas de confort y cuidados paliativos, cuando sea apropiado [46].
Evaluaciones prediálisis
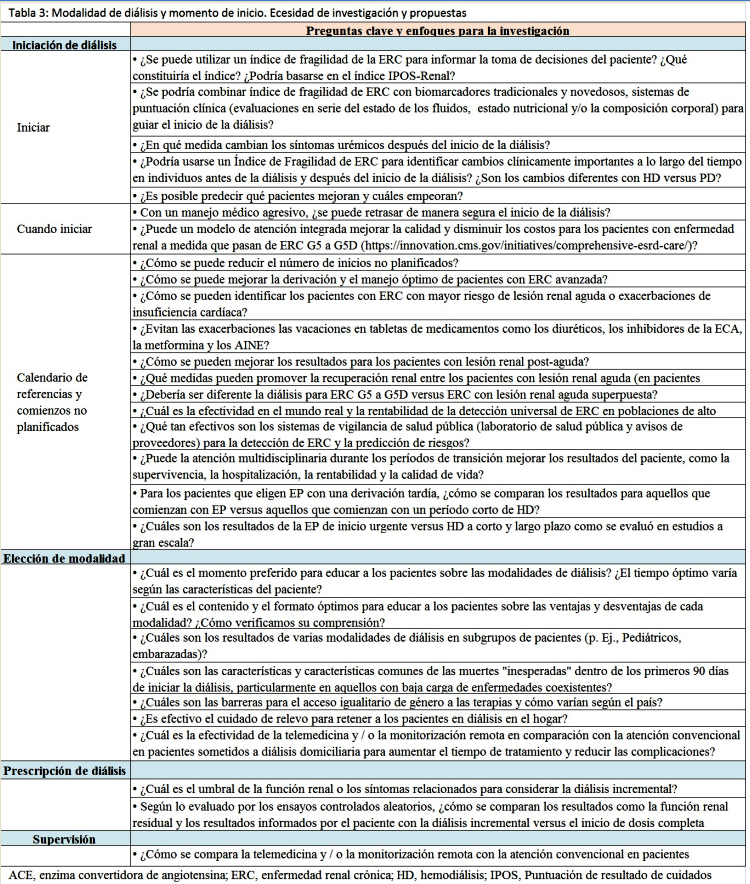
Las evaluaciones disponibles para medidas de los resultados reportados por el paciente pertenecen a síntomas, marcadores objetivos de nutrición, capacidad funcional y marcadores de la función renal. Los resultados clínicos reportados incluyen fuerza muscular, marcha, velocidad, índice de masa corporal y biomarcadores como eGFR, albúmina sérica , etc. Hay una variación considerable en la dependencia del médico de variables bioquímicas y hematológicas como creatinina, eFG, urea, bicarbonato, potasio y fosfato y niveles de hemoglobina entre pacientes al inicio de la diálisis [40]. Los índices que miden la fragilidad en la ERC pueden ser útiles para informar a los pacientes en la toma de decisiones [49], pero se necesita más investigación sobre la efectividad de este enfoque (Tabla 3).
Los tiempos de evaluaciones de prediálisis dependen del valor y velocidad de disminución de la función renal, síntomatología y la presencia de alteraciones metabólicas, hematológicas y comorbilidades clinicas pero generalmente estarán dentro del rango de uno a cada tres meses Hubo consenso general de que síntomas como anorexia, náuseas y fatiga deben haber mejorado o resuelto dentro de los 3 meses posteriores al inicio de la diálisis aunque se reconoció que hay escasez de datos para informar la interpretación de los cambios en los síntomas después del inicio del tratamiento sustitutivo de la función renal.
Cuidados prediálisis y derivación
Los cuidados prediálisis se han asociado con una mejoría en resultados medibles como retraso en el inicio de la diálisis, complicaciones cardiovasculares y mortalidad [50]. El óptimo cuidado predialisis multidisciplinar incluye no solo la adecuada derivación sino asimismo visitas frecuentes donde los pacientes pueden acceder a diferentes miembros del equipo de atención [51]. Informe de datos de registro reportan una amplia variación en el período de transición de CKD G5 a CKD G5D. Un período de transición mínimo de 90 días se alinea con recuperación de lesión renal aguda, y mortalidad temprana en diálisis; sin embargo, los efectos de las intervenciones sobre el estilo de vida y modificación del factor de riesgo pueden requerir años para surtir efecto.
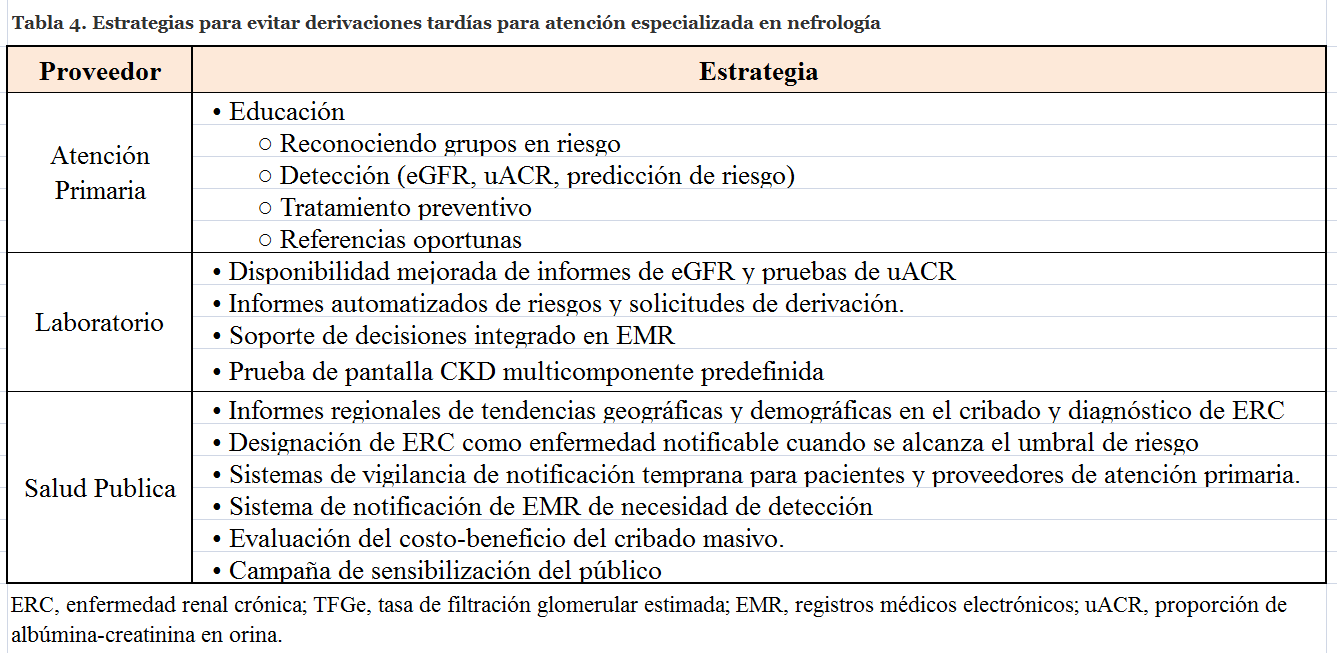
El tiempo de atención de la ERC previa a la diálisis es idealmente lo suficientemente largo como para abarcar el período de transición de 90 días. Recomendaciones para "derivación oportuna" a un nefrólogo, particularmente para la creación de acceso, se basan principalmente en el tiempo para diálisis, por ejemplo, 6 meses antes de la necesidad de comenzar diálisis. Aunque el momento para comenzar la diálisis puede ser difícil de predecir con precisión pueden usarse ecuaciones basadas en la evidencia sobre el riesgo de fallo renal [52]. Sin embargo, esto debe combinarse ,más bien que reemplazar, con el juicio clínico. Estrategias para evitar retrasos en la derivación se enumeran en la (Tabla 4).
Adaptación de tiempos y apoyo para ciertos subgrupos de pacientes
Iniciación de diálisis en el contexto de un injerto que falla o cambio entre modalidades de diálisis. Los pacientes con trasplante fracasado pueden no estar preparados adecuadamente para mentalizarse a la insuficiencia renal en fase terminal porque el foco de atención pueda ser el mantenimiento del injerto en lugar de prepararse para la diálisis. Los catéteres se utilizan en casi dos tercios de los pacientes con trasplante renal fracasado [53] y la prevalencia relativamente baja de FAVIs o protesis en este grupo al inicio de la diálisis necesita ser investigada más a fondo [53]. La colaboración con los programas de ERC puede ser beneficiosa, especialmente cuando el FGe disminuye por debajo de 20 a 30 ml / min /1.73m2. La educación y revisión de las preferencias del paciente y sus objetivos de vida son importantes, como es la preparación para posibles próximos pasos como hemodiálisis, diálisis peritoneal, otro trasplante renal , o cuidados de apoyo, como parte del plan de vida de los pacientes con insuficiencia renal avanzada [54]. Se necesitan estudios basados en registros globales de trasplante renal para investigar los problemas específicos que afectan a los pacientes con injertos renales en fase de fracaso.
Los datos de los Estados Unidos indican que los pacientes en diálisis peritoneal pacientes bajo cuidado nefrológico tienen una muy baja tasa de acceso arteriovenoso tras la transición a hemodialisis [55]. Por tanto, la vigilancia en el tiempo de los aclaramientos y los volumenes de ultrafiltación son necesarios en los pacientes en DP. Se necesitan modelos predictivos para identificar aquellos pacientes en diálisis peritoneal que requieran preparación para una transición tales como la educación y la creación de acceso vascular [56] [57] particularmente para apoyar la hemodiálisis en casa cuando sea apropiado.
Iniciación de diálisis en pacientes pediátricos Los modelos de atención pediátrica no fueron tratados en esta conferencia. En niños, los aspectos de crecimiento, nutrición y cognitivos, así como la maduración emocional aumentan la complejidad del diagnóstico, tratamiento y toma de decisiones, y por lo tanto tener un equipo multidisciplinario para abordar estos problemas es especialmente importante. Los niños tendrán diferentes necesidades a medida que crecen , y es importante reconocer que en la edad de joven adulto y en la transición a una vida independiente puede ser un momento en que los pacientes necesiten mucho apoyo. En la población pediátrica, la ERC es más probable que conduzca a la ERC en fase terminal que a la muerte, y por lo tanto, los modelos de predicción validados para derivación a trasplante preemptivo o a diálisis son especialmente importantes. En un estudio retrospectivo de una cohorte de 603 niños con FGe inferior a 60 ml / min /1.73m2, las ecuaciones de riesgo de insuficiencia renal proporcionaron excelentes resultados de discriminación en el riesgo de desarrollar ERC terminal en 1 o 2 años en aquellos con una puntuación de ecuación de riesgo de insuficiencia renal (KFRE) de al menos 13.2% en comparación con aquellos con una puntuación menor a 13.2% [58]. Una iniciativa pediátrica global para determinar el impacto de inicio temprano versus tardío o de trasplante preemtivo podría realizarse de forma aleatoria en ensayo controlado, con un enfoque similar al del estudio IDEAL en adultos [59] pero con resultados centrados en el crecimiento, desarrollo cognitivo y estado nutricional.
Embarazo e inicio de diálisis. El metodo definitivo para diagnosticar el embarazo en el contexto de insuficiencia renal es ecografía, porque los niveles de b-hCG pueden elevarse durante insuficiencia renal, conduciendo a resultados falsos positivos de la prueba de embarazo [60]. El embarazo predialisis da como resultado una mayor supervivencia infantil y menor probabilidad de prematuridad que la concepción después de comenzar la diálisis [61]. Los datos de cohortes han indicado que la intensidad de la diálisis afecta los resultados, con dialisis de duración más largas resultando en una mayor tasa de nacimientos vivos, mayor edad gestacional y mayor peso al nacer [62]. En mujeres embarazadas sometidas diálisis, se debe considerar una prescripción intensiva. Durante el embarazo, las mujeres en diálisis necesitan ser controladas para bajo contenido de potasio, fosfato y ácido fólico, así como alto en glucosa, especialmente para pacientes sometidos a diálisis peritoneal en la modalidad de marea.
También es importante evaluar la anemia , nutrición y niveles de magnesio. Anteriormente el momento del inicio de la diálisis en el embarazo se basaba niveles de urea elevados (nitrógeno ureico en sangre [BUN] > 36 mmol / l, con un objetivo de disminución < 18 mmol / l). El objetivo actualmente es iniciar con BUN inferior a 18 mmol/l [63], también reconociendo la importancia de las alteraciones de fluidos, electrolitos y ácido-base. UNA posible estrategia de investigación es evaluar los datos del registro para determinar el impacto del inicio temprano versus tardío de la diálisis en el embarazo, en la línea del estudio IDEAL en adultos [59] pero con resultados concentrados en la tasa de nacimientos vivos, supervivencia del embarazo , edad gestacional y peso al nacer.
DIÁLISIS ACCESO Y PREPARACIÓN
Es ampliamente aceptado que el establecimiento preventivo de un acceso para diálisis conduce a mejores resultados para el paciente; sin embargo, hay desafíos y barreras importantes dentro de los sistemas de salud y entre los pagadores y pacientes para establecer un acceso de diálisis que esté madurado y sea funcional para el inicio de diálisis, véase Tabla complementaria S1 (Tabla 7) [64] [70]. Según la mayoría de las pautas,el acceso a la diálisis peritoneal debe prepararse siempre que sea posible al menos 2 semanas antes de comenzar el tratamiento de sustitución renal [71] [72]. Para los pacientes remitidos tarde, esta recomendación podría determinar un cambio temporal o definitivo de pacientes hacia la hemodiálisis. Sin embargo, la evidencia reciente ha demostrado que la diálisis peritoneal de inicio urgente es posible y segura, sise conduce adecuadamente [73]. Aunque los participantes en la reunión reconocieron los beneficios de las fístulas [74] reconocieron que el enfoque de "fistula first " no es apropiado para todos los pacientes.
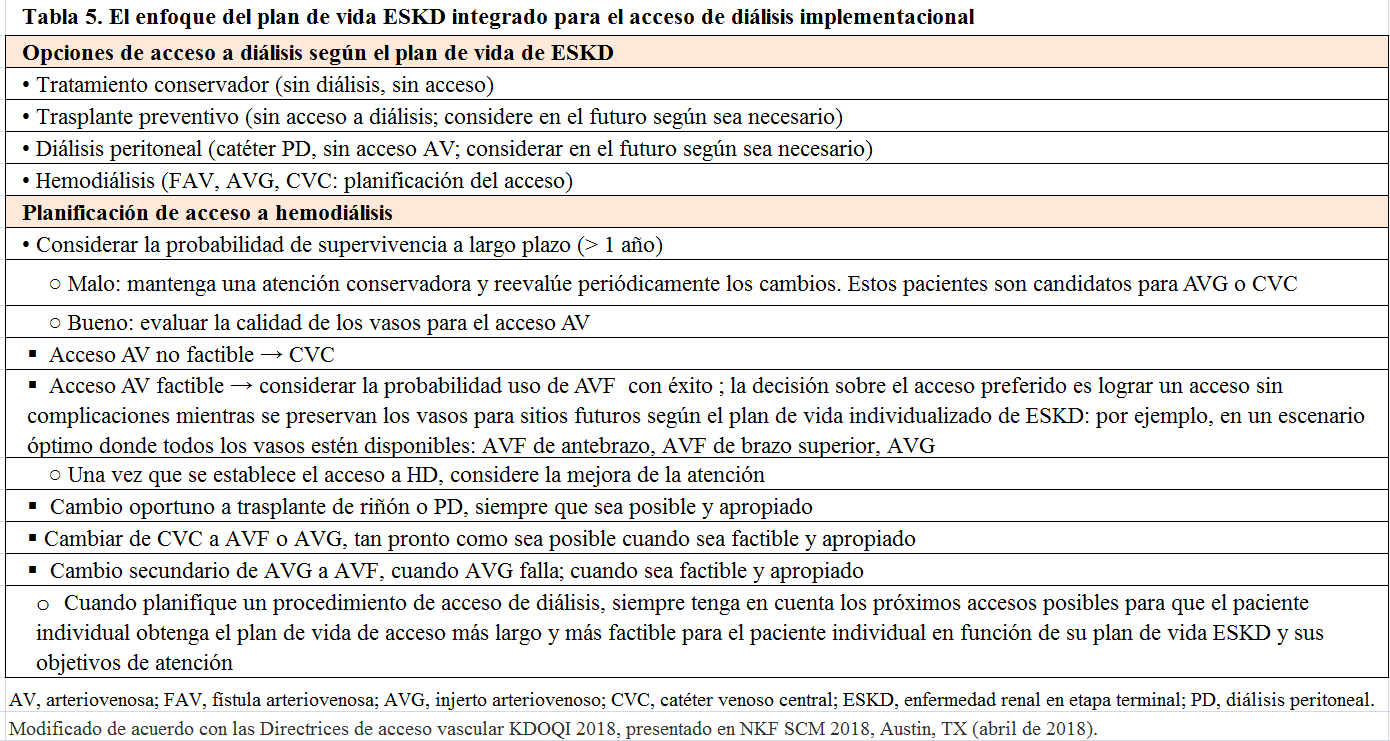
Es necesario reconsiderar los paradigmas establecidos para acceso a diálisis en el marco del plan de vida de ERC del paciente [54] teniendo en cuenta individualmente a cada paciente , las características de sus vasos y los objetivos y preferencias de la vida del paciente. Edad, comorbilidades, probabilidad de supervivencia a largo plazo, objetivos del tratamiento y el momento del inicio de la diálisis son factores que podrían afectar la elección de acceso y requerir individualización para cada paciente [54] [75]. También es importante tener en cuenta cual es la mejor modalidad de tratamiento y acceso para cada paciente en concreto (Tabla 5). Muchos pacientes pueden emprender dialisis en casa con un cateter permcath y la ausencia de un acceso vascular quirúrgico no es una contraindicación para ello.
Selección y gestión del acceso en relación con las politicas de financiación.
La selección y gestión del acceso que está estrechamente vinculado a las políticas de financiación pueden tener serias implicaciones para la salud del paciente . En entornos con recursos limitados, si la cirugía es menos costosa que los procedimientos endovasculares, puede poner a los pacientes en riesgo de agotamiento temprano de los sitios de acceso vascular.las restricciones económicas pueden conducir al uso prolongado de cateteres no tunelizados con aumento del riesgo de infección para los pacientes. Por el contrario, en paises ricos en recursos la repetición de los procedimientos endovasculares bien reembolsados pueden conducir a una sobreintervención, daño a los vasos y pérdida prematura del acceso vascular. Idealmente, los incentivos financieros deben estar alineados con las mejores prácticas de atención. Desafortunadamente, no hay consenso, base de evidencia o medida de resultados para que las mejores prácticas a nivel de paciente individual puedan ser aplicables a una base poblacional. Además, resultados específicos utilizando como medida las mejores prácticas a nivel poblacional no siempre son aplicables a nivel del paciente. Para proveer atención individualizada del paciente, puede ser necesario adoptar medidas de "proceso" versus resultados de las mejores prácticas, como el porcentaje de pacientes referidos y evaluados para acceso vascular antes del inicio de diálisis. Medidas practicas con objetivos concretos (p. ej., derivación para acceso vascular) pueden conducir a mejores resultados en la práctica (p. ej., accesos AV más funcionales). Las prioridades para la investigación y la educación se describen en la Tabla Suplementaria S2 (Tabla 8).
"Estrategias de éxito" para acceso a dialisis
En el proceso de toma de decisiones para elegir el acceso inicial a diálisis es importante la consideración de las opciones disponibles si el acceso inicial falla. Actualmente no hay publicada evidencia para respaldar una acción concreta , y por lo tanto se necesita investigación para evaluar el orden óptimo de las estrategias de éxito en el acceso para hemodiálisis. Dadas las diversas modalidades y necesidades de acceso de cada paciente, tales planes de contingencia de acceso y seguimiento deben ser individualizados En el mejor de los casos, las consecuencias de la falta de planificación( como se discutió anteriormente para los trasplantes fallidos y la DP ) enfatiza la necesidad de acciones de contingencia y plan de seguimiento en el acceso para dialisis.
PROPORCIONANDO DIÁLISIS "ADECUADA" Y CONTROL DE SÍNTOMAS
Durante décadas, la adecuación de la diálisis ha sido definida por el aclaramiento de pequeños solutos solutos (Kt / V y ratio de reducción de urea en hemodiálisis; Kt / V y aclaramiento de creatinina en diálisis peritoneal). La medición del aclaramiento de solutos pequeños se ha enfatizado en guías de práctica clínica, utilizadas como base para el trabajo clinico y / o pagos, y tratados por muchos clínicos como dogma. Sin embargo, la evidencia de las relaciones entre aclaramiento de pequeños solutos, niveles plasmáticos de estos solutos, y los resultados clínicos y/o la sintomatología son débiles. Está cada vez más reconocido que el aclaramiento de pequeños solutos refleja solo uno de los muchos aspectos de la atención de diálisis que probablemente afecta resultados [16] [18] [76].
Por lo tanto, los objetivos cinéticos de solutos deben ser interpretados e implementados en el contexto de los objetivos generales del paciente del y del estado clínico.
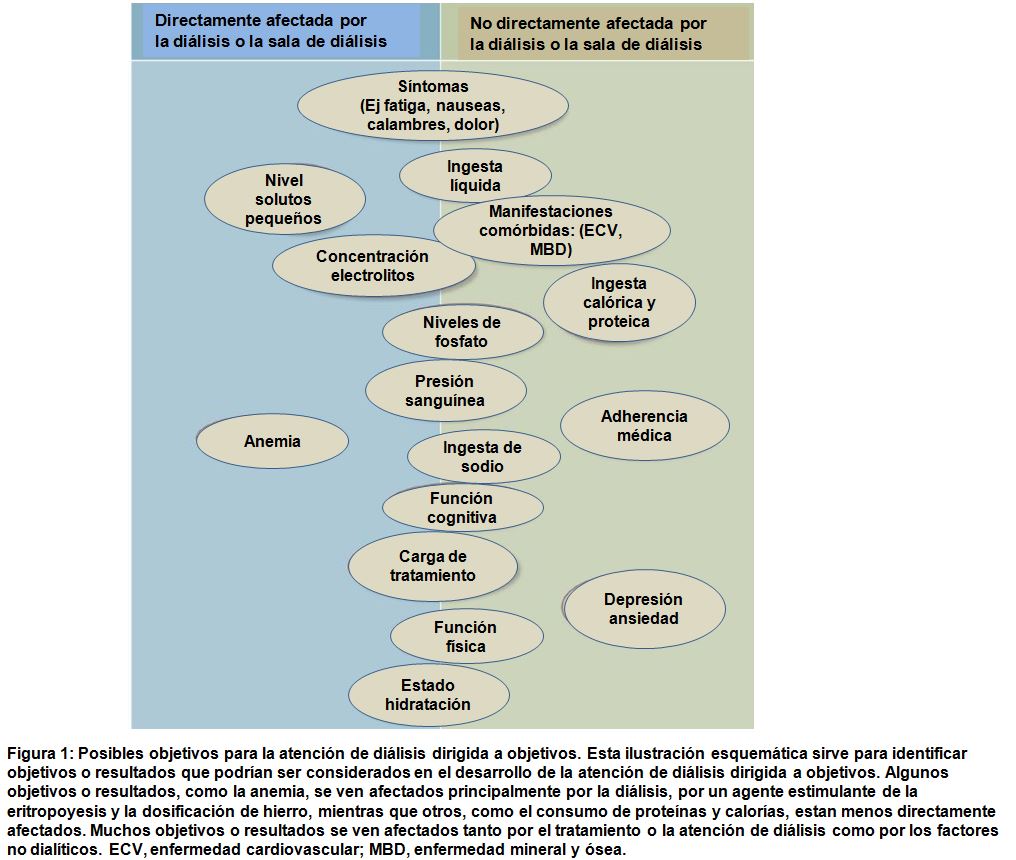
Los participantes de la reunión favorecieron una visión integral del cuidado de ERC con un paradigma más multifacético que reemplaza lo que actualmente se conoce como "adecuación de diálisis". Múltiples medidas y objetivos han de considerarse al evaluar la adecuación de diálisis, incluyendo aclaramiento de solutos pequeños, función renal residual, estado de volumen, medidas bioquímicas, estado nutricional , función cardiovascular, síntomas y las experiencias y objetivos del paciente . Mientras que muchos participantes de la reunión sintieron que un énfasis rígido en la eliminación de solutos no sirve al intereses de todos los pacientes, hubo acuerdo general en que los médicos deben continuar aceptando los mínimos aconsejados de eliminación de pequeños solutos durante la diálisis. También se reconoció que se necesita investigación para conocer la importancia de otros solutos incluyendo solutos medianos y grandes, unidos a proteínas y moléculas carbamiladas y productos metabólicos de las bacterias intestinales como posibles contribuyentes al mal estado funcional, síntomas, comorbilidades y mortalidad en pacientes en dialisis crónica. Debe reconocerse que los pacientes pueden interpretar "adecuación" diferente a los médicos, y por lo tanto, objetivos para el tratamiento deben individualizarse y reevaluarse con el tiempo. Con este fin, muchos, pero no todos, los participantes de la reunión proponen que el término "diálisis adecuada" se cambie a " diálisis dirigida a objetivo ", que se refiere específicamente al uso compartido de toma de decisiones entre el paciente y el equipo de atención para establecer objetivos de atención realistas que permitan que el paciente cumpla con sus propios objetivos de vida y permitan que el clínico ofrezca atención individualizada, con cuidado dialítico de alta calidad. Se puede aceptar que los componentes de la diálisis dirigida a objetivos sean aquellos directamente afectados por el procedimiento de diálisis, como aclaramiento de solutos pequeños, concentraciones de electrolitos, estado de volumen, y síntomas intradiálisis, así como aquellos que son afectados indirectamente por el procedimiento de diálisis, como la carga de síntomas, estado nutricional, nivel de actividad, capacidad de trabajo y compromiso social (Figura 1). Las prioridades deben ser individualizadas y consistentes con las metas alcanzables para el paciente. Las prioridades del paciente probablemente cambiarán entre los iniciales meses de diálisis y posteriormente; por lo tanto, la priorización requiere discusiones continuas entre pacientes y médicos sobre expectativas realistas y pronóstico. La discusión necesita ser adaptada dependiendo del conocimiento del paciente, de su foemación en salud, estado socioeconómico, y sus experiencias iniciales de diálisis.
Implementación de diálisis dirigida a objetivos
La implementación de la atención basada en objetivos requeriría un importante cambio en la práctica internacional actual, así como la aceptación de múltiples partes interesadas, incluidos pacientes, proveedores, reguladores y pagadores, que pueden tener expectativas y motivaciones contradictorias (Tabla 6). Se necesitan herramientas para facilitar la comunicación entre pacientes y médicos porque pueden tener experiencia limitada expresando o requiriendo, respectivamente, objetivos de cuidados y prioridades. En los sistemas de salud, los incentivos para proveedores y pagadores deben estar alineados, y los métodos para evaluar los resultados centrados en el paciente, como los síntomas deberán ser validados y luego incorporados en los cuidados rutinarios posiblemente a través de la tecnología. Como se discutió previamente para el acceso vascular, evaluando la calidad de la atención altamente individualizada ello requerirá el desarrollo de desarrollo de medidas de los procedimientos.
CONCLUSIÓN
Un tema importante identificado durante la conferencia fué la necesidad de alejarse de un enfoque de "diálisis para todos" y brindar una atención más individualizada o personalizada. Identificar y conseguir el logro de objetivos centrados en el paciente hoy día se reconoce como un componente importante de la atención de diálisis, y estos requeriran métodos para proveedores, pacientes y la organización de objetivos e incentivos para pacientes, cuidadores, proveedores de atención médica, reguladores y pagadores. Los participantes en la reunión reconocen que cualquier sugerencia para avanzar hacia un objetivo centrado en el paciente en dialisis supone que cualesquiera que sean los sistemas de organización del tratamiento dialitico que existen en la actualidad son modificables. Cierto es que,en algunas regiones del mundo, la capacidad de cambiar las existentes estructuras pueden ser limitadas. Por lo tanto, los enfoques descritos aquí están destinados a servir como estrategias que pueden implementarse a través de diferentes técnicas según el entorno local. Esta conferencia es la primera de una serie de reuniones sobre controversias en diálisis para ayudar a proporcionar un plan para un óptimo tratamiento de reemplazo renal contemporáneo. En temas posteriores en esta serie de conferencias se abordará el manejo de la diálisis, complicaciones, innovaciones en el tratamiento de la sustitución de la función renal y control de la presión arterial y del volumen en la ERC en estadio final.
APENDICE
Otros participantes en la conferencia
Ali K. Abu-Alfa, Lebanon; Joanne M. Bargman, Canada; Anthony J. Bleyer, USA; Edwina A. Brown, UK; Andrew Davenport, UK; Simon J. Davies, UK; Frederic O. Finkelstein, USA; Jennifer E. Flythe, USA; Eric Goffin, Belgium; Thomas A. Golper, USA; Rafael Gómez, Colombia; Takayuki Hamano, Japan; Manfred Hecking, Austria; Olof Heimbürger, Sweden; Barnaby Hole, UK; Daljit K. Hothi, UK; T. Alp Ikizler, USA; Yoshitaka Isaka, Japan; Kunitoshi Iseki, Japan; Vivekanand Jha, India; Hideki Kawanishi, Japan; Peter G. Kerr, Australia; Paul Komenda, Canada; Csaba P. Kovesdy, USA; Ed Lacson, Jr, USA; Maurice Laville, France; Jung Pyo Lee, Korea; Edgar V. Lerma, USA; Nathan W. Levin, USA; Monika Lichodziejewska-Niemierko, Poland; Adrian Liew, Singapore; Elizabeth Lindley, UK; Robert S. Lockridge, USA; Magdalena Madero, Mexico; Ziad A. Massy, France; Linda McCann, USA; Klemens B. Meyer, USA; Rachael L. Morton, Australia; Annie-Claire Nadeau-Fredette, Canada; Hirokazu Okada, Japan; Jose J. Perez, USA; Jeff Perl, Canada; Kevan R. Polkinghorne, Australia; Miguel C. Riella, Brazil; Bruce M. Robinson, USA; Michael V. Rocco, USA; Steven J. Rosansky, USA;
Joris I. Rotmans, the Netherlands; María Fernanda Slon Roblero, Spain; Navdeep Tangri, Canada; Marcello Tonelli, Canada; Allison Tong, Australia; Yusuke Tsukamoto, Japan; Kriang Tungsanga, Thailand; Tushar J. Vachharajani, USA; Ismay N. van Loon, the Netherlands; Suzanne Watnick, USA; Daniel E. Weiner, USA; Martin Wilkie, UK; Elena Zakharova, Russian Federation
ACUERDO DE CONFIDENCIALIDAD
CTC declared having received consultancy fees from Medtronic and NxStage; speaker honoraria from Fresenius; and research support from Medtronic. MG declared having received consultancy fees from B. Braun Medical and speaker honoraria from Medtronic. DCHH declared having received speaker honoraria from Otsuka Japan and research support from National Health and Medical Research Council. AY-MW declared having received speaker honoraria from Sanofi Renal; and research support from Otsuka and Sanofi Renal. DCW declared having received consultancy fees from Akebia Therapeutics, Amgen, AstraZeneca, Boehringer Ingelheim, GlaxoSmithKline, Janssen, and Vifor Fresenius; speaker honoraria from Amgen and Vifor Fresenius; and research support from AstraZeneca. WCW declared having received consultancy fees from Akebia Therapeutics, AMAG, Amgen, AstraZeneca, Bayer, Daichii-Sankyo, Relypsa, and ZS Pharma; speaker honoraria from FibroGen; and research support from National Institutes of Health. CAP declared having served on advisory boards of AstraZeneca, Janssen Cilag, and Vifor; and received speaker honoraria from AstraZeneca, Novartis, Sanofi, and Vifor. All the other authors declared no competing interests.
AGRADECIMIENTOS
La conferencia fue patrocinada por KDIGO y apoyada en parte por becas educativas sin restricciones de Akebia Therapeutics, Amgen, AstraZeneca, Baxter, Boehringer Ingelheim, Fresenius Medical Care, Kaneka, NxStage, Relypsa, Roche, Rockwell Medical, and Vifor Fresenius Medical Care Renal Pharma. We thank Jennifer King, PhD,
for assistance with manuscript preparation.
MATERIAL SUPLEMENTARIO
Tabla Complementaria S1 (Tabla 7). Barreras para elegir el acceso a diálisis [64] [65] [66] [67] [68] [69] [70].
Tabla Complementaria S2 (Tabla 8). Preguntas de investigación y prioridades para la educación en el acceso para diálisis.
AV, arteriovenous; AVF, arteriovenous fistula; CVC, central venous catheter; CKD, chronic kidney disease.
El material complementario está vinculado a la versión en línea del documento en www.kidney-international.org.