Dinapenia en la Enfermedad Renal Crónica
INTRODUCCION
La población de la UE está envejeciendo y esto se puede ver a través de diferentes indicadores estadísticos como la evolución de la proporción de la población mayor. La evolución de la proporción de personas mayores en la población: en 2020, el 21 % de la población tenía 65 años o más, frente al 16 % en 2001, lo que supone un aumento de 5 puntos porcentuales. A 1 de enero de 2022, el número de personas de 65 y más años en España es de 9.063.493 lo que supone un 19,09 % de toda la población [1].
La población mundial está envejeciendo rápidamente. A medida que la sociedad envejece, la incidencia de limitaciones físicas aumenta drásticamente, lo que reduce la calidad de vida y aumenta los gastos en atención médica. En la sociedad occidental, aproximadamente el 30% de la población mayor de 55 años se enfrenta a limitaciones físicas moderadas o graves [2].
El crecimiento de la población y el aumento asociado de discapacidades físicas han despertado un interés científico significativo en la biología del envejecimiento. En las últimas décadas, tanto la comunidad científica como la médica han reconocido que la disfunción del músculo esquelético (como la debilidad muscular, la atrofia muscular y la mala coordinación muscular) es una afección debilitante y potencialmente mortal en los adultos mayores.
La pérdida de fuerza muscular relacionada con la edad está estrechamente relacionada con la mortalidad y la discapacidad física [3][4][5][6][7]. Mantener la masa muscular a medida que envejecemos es crucial porque actúa como un reservorio metabólico necesario para combatir eficazmente las enfermedades [8][9][10].
En los últimos años, ha habido un esfuerzo creciente por establecer criterios para el diagnóstico clínico de la "sarcopenia". Por ejemplo, un equipo europeo publicó recientemente una declaración de consenso que describe la definición y el diagnóstico de la sarcopenia [11].
Los criterios para diagnosticar la sarcopenia incorporan aspectos de (a) la función física (es decir, la velocidad de la marcha), (b) la fuerza muscular y (c) la masa muscular. El término “sarcopenia”, que inicialmente se definió como la pérdida de masa muscular relacionada con la edad, también se ha convertido en sinónimo de la pérdida de fuerza muscular relacionada con la edad y el deterioro de la función física relacionado con la edad [12].
La dinapenia es un término griego (pronunciada dahy-nuh-p¿-n¿-a,) para describir la pérdida de fuerza muscular asociada con la edad, que no es causada por enfermedades neurológicas o musculares [2]. Esta afección se observa comúnmente en adultos mayores [2][13].
DIAGNOSTICO DE LA DINAPENIA
No existe consenso sobre los criterios diagnósticos específicos de la dinapenia. El diagnóstico de la dinapenia generalmente requiere una evaluación integral de la fuerza y la función muscular, teniendo en cuenta los diversos factores que pueden contribuir a la debilidad muscular en los adultos mayores.
Los siguientes métodos se pueden utilizar para diagnosticar la dinapenia:
a. Dinamómetro
La fuerza manual es un indicador simple y confiable de la fuerza muscular general, que se evalúa fácilmente en la clínica [14]. Una disminución de la fuerza de agarre manual es la característica más notable de la dinapenia. Se pueden utilizar varias herramientas para medir la fuerza muscular, incluidos los dinamómetros de mano y los dinamómetros isocinéticos [15]. Los valores de corte de fuerza muscular utilizados para definir la dinapenia varían según la población estudiada y el método de medición utilizado. Sin embargo, el valor de corte generalmente aceptado para la fuerza de agarre manual en hombres es <30 kg y en mujeres <20 kg [11].
Además de la fuerza manual, otras medidas de fuerza muscular y potencia, como las ejercidas con la extensión de la rodilla, también se pueden utilizar para evaluar la dinapenia [2].
b. Test de “Levántate y Anda”
La prueba de levantarse y andar cronometrada es una medida de movilidad funcional y equilibrio que evalúa el tiempo que tarda una persona en levantarse de una silla, caminar una distancia corta, darse vuelta, caminar de regreso y sentarse nuevamente [16]. Los tiempos más lentos en esta prueba se asocian con una función muscular deficiente y un mayor riesgo de caídas [17].
c. Batería Corta de Funcionalidad Física [SPPB]
La SPPB es una serie de pruebas que evalúan la función de las extremidades inferiores, incluido el equilibrio, la velocidad al caminar y las posturas repetidas en la silla [18]. Las puntuaciones bajas en el SPPB se asocian con una función muscular deficiente y un mayor riesgo de discapacidad y mortalidad [19].
Biopsia Muscular
En casos especiales, se puede utilizar una biopsia muscular para evaluar el tamaño y la composición de las fibras musculares e identificar anomalías estructurales o metabólicas subyacentes [20].
d. DEXA
La absorciometría de rayos X de energía dual (DEXA) puede evaluar la masa muscular, que es un componente importante de la fuerza y la función muscular [21]. Sin embargo, la DEXA por sí sola no puede diferenciar entre sarcopenia de dinapenia.
MECANISMOS DE DINAPENIA
La dinapenia es un proceso multifactorial afectado por factores internos y externos [22]. Aunque no se ha dilucidado con claridad la fisiopatología exacta que subyace en la dinapenia, se pueden resumir en:
Cambios neuromusculares
Los cambios neuromusculares son uno de los mecanismos primarios
de la dinapenia [23]. Con el envejecimiento, hay una disminución en el número de unidades motoras del músculo esquelético, lo que conduce. a una disminución de la masa y la fuerza muscular. Además, el envejecimiento se asocia con una disminución del tamaño de las fibras musculares, atrofia de las fibras de tipo II y un aumento de la grasa intermuscular y del tejido conectivo [24]. Estos cambios contribuyen a una disminución de la calidad muscular, lo que puede conducir a una menor producción de potencia muscular. Además, los cambios en el sistema nervioso, especialmente en la unión neuromuscular, también pueden conducir al desarrollo de dinapenia [23].
Cambios hormonales
Los cambios hormonales son un factor significativo que contribuye a la dinapenia [25]. A medida que las personas envejecen, se produce una disminución de las hormonas anabólicas como la testosterona, la hormona del crecimiento y el factor de crecimiento similar a la insulina-1 [26]. Estas hormonas son vitales para la síntesis y reparación de proteínas musculares, y su reducción puede conducir a una disminución tanto de la masa como de la fuerza muscular [25].
Inflamación
La inflamación crónica de bajo grado es común en adultos mayores y puede contribuir al desarrollo de dinapenia [27]. La proteína C reactiva (PCR), el factor de necrosis tumoral-α (TNF-α) y/o la interleucina-6 (IL-6) pueden intervenir en el desarrollo de dinapenia en adultos mayores de 50 años [28].
Estrés oxidativo y disfunción mitocondrial
El estrés oxidativo y la disfunción mitocondrial son dos mecanismos clave que intervienen en el desarrollo de la dinapenia [29]. El estrés oxidativo se produce cuando hay un desequilibrio entre la producción de especies reactivas de oxígeno (ROS) y la capacidad del cuerpo para desintoxicar y reparar el daño resultante [30]. Estas ROS pueden dañar componentes celulares como proteínas, lípidos y ADN, lo que provoca un deterioro de la función muscular y un mayor riesgo de atrofia muscular. Además, el estrés oxidativo puede contribuir a la inflamación y activar vías de señalización que promueven el desgaste muscular [29].
La disfunción mitocondrial puede provocar una disminución de la producción de ATP y un aumento de la producción de ROS, lo que contribuye aún más al estrés oxidativo. Esto, a su vez, provoca un deterioro de la contracción muscular y un aumento de la fatiga muscular [29][30].
Inactividad física
La disminución de la actividad física con el envejecimiento es un factor externo importante que contribuye a la dinapenia [2]. Está bien establecido que la actividad física regular es crucial para mantener la masa muscular, la fuerza y la función general. La falta de actividad física puede provocar desuso y atrofia muscular, lo que conduce a una disminución de la fuerza y la potencia musculares [2][31].
Fármacos
Fármacos usados frecuentemente para tratar enfermedades crónicas pueden provocar dinapenia [32]. Algunos ejemplos de estos medicamentos incluyen estatinas, sulfonilureas, glinidas, glucocorticoides, relajantes musculares, ciertos antidepresivos, antipsicóticos, sedantes y analgésicos que pertenecen a la clase de los opioides [32][33][34].
Factores Nutricionales
La nutrición juega un papel crucial como factor externo que contribuye a la dinapenia [35]. La ingesta adecuada de nutrientes esenciales, como proteínas, vitamina D y ácidos grasos omega-3, es vital para mantener la masa y la función muscular [35][36]`37]. Sin embargo, a medida que las personas envejecen, pueden experimentar una disminución del apetito y una absorción deficiente de nutrientes, lo que conduce a la desnutrición y dinapenia [35].
En general, estos factores dan lugar a atrofia muscular, alteración de la síntesis de proteínas musculares y alteraciones del metabolismo muscular, lo que en última instancia conduce a la dinapenia. Se necesita más investigación para comprender a fondo los mecanismos subyacentes.
DINAPENIA EN LA ENFERMEDAD RENAL CRONICA. CONCEPTO
La enfermedad renal crónica (ERC) constituye un problema de salud pública a nivel mundial con una alta morbimortalidad. La prevalencia de ERC es del 15,1%, más frecuente en varones y el 37,3% en personas mayores de 65 años. La ERC afecta a uno de cada 7 adultos en España [37] y abarca una variedad de trastornos heterogéneos que afectan la estructura y la función renal. Se clasifica en función de los niveles de gravedad de la enfermedad, que se evalúan mediante los niveles de albuminuria, la tasa de filtración glomerular (TFG) y el diagnóstico clínico en relación con la causa y la patología [38]. Los cambios fisiopatológicos en la ERC inducen directamente la degeneración muscular e interfieren en la regeneración muscular. Además, la atrofia muscular inducida por la ERC contribuye a la reducción de la actividad física, una dieta baja en proteínas y una menor independencia funcional [39][40].
La pérdida de fuerza y masa muscular es un factor pronóstico negativo en la ERC. Esto es particularmente importante en pacientes con ERC no en diálisis que tienen una función renal deteriorada [41].
La disminución de la masa muscular está relacionada con niveles plasmáticos más bajos de albúmina sérica, una mayor tasa de mortalidad y una duración más corta hasta la progresión a la enfermedad renal terminal (ERCT) [39][40]. Además, la dinapenia contribuye a una aparición más grave y temprana de la ERC en comparación con las que no la presentan [41].
La dinapenia se define como la pérdida de fuerza y potencia muscular en relación con la calidad muscular y se refiere específicamente a la debilidad muscular asociada con el envejecimiento, en lugar de estar causada por trastornos del sistema nervioso o enfermedades musculares. Se diferencia de la sarcopenia, en que en ésta se produce una reducción de la masa muscular o masa magra [2].
La revisión de la literatura sugiere que la creencia generalizada de que la masa muscular y la fuerza son equivalentes es incorrecta [42][43]. Esta conclusión se basa en dos puntos clave: (i) los estudios longitudinales sobre el envejecimiento muestran que la pérdida de masa muscular y fuerza no siempre están relacionadas, y (ii) los cambios en la masa muscular y la fuerza resultantes de variaciones en los niveles de actividad física, como el entrenamiento físico o el desuso, no ocurren a lo largo de la misma línea de tiempo [44][45]. Esto evidencia que la masa muscular se reduce significativamente más lentamente que la fuerza muscular, lo que sugiere que la dinapenia puede tener un mecanismo fisiopatológico diferente al de la sarcopenia [46]
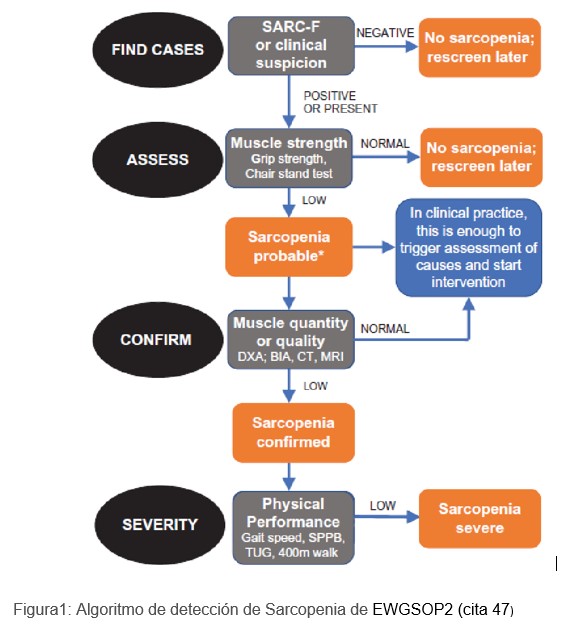
El grupo europeo define dinapenia en varones cuando la fuerza muscular es <27Kg y en las mujeres <16Kg y la sarcopenia cuando a la dinapenia se asocia la masa muscular medida por bioimpedancia en varones <20 kg y en la mujer <15 kg [47] (Figura 1), Este grupo no identifica la dinapenia como entidad independiente.
Es por ello por lo que en el diagnóstico correcto de la sarcopenia y la dinapenia es fundamental para investigar los factores que vinculan estas afecciones con la progresión y la gravedad de la enfermedad. La dinapenia se refiere a una reducción de la fuerza muscular sin cambios en la masa muscular [45][46].
El consenso también establece que la sola demostración de una fuerza muscular patológica es suficiente para iniciar el tratamiento. Esto deja abierta la cuestión de si la dinapenia debe considerarse un estado patológico. Ni la EWGSOP de 2010 ni su sucesora, la EWGSOP2, clasificaron esta afección como una entidad clínica distinta [48]. Sin embargo, la evidencia clínica sugiere que la función muscular puede verse afectada sin ninguna pérdida evidente de masa muscular, lo que puede ocurrir en el envejecimiento y las enfermedades sistémicas. Es probable que este deterioro se deba a una disfunción en la transmisión neuromuscular [46].
Dos recientes trabajos [48][49], el primero de ellos, observacional, con 85 pacientes con edad media de 65 (62,5-72) años, de los cuales 55 eran varones, con ERC 3-5 encontraron que la prevalencia de sarcopenia fue del 7.1% y de dinapenia del 17.6% [48]. El segundo estudio, observacional, prospectivo y longitudinal con 1924 pacientes con ERC 1-5 no en diálisis seguidos durante catorce años evidenció que la prevalencia de dinapenia fue del 33,2% en los varones y del 35.4% en las mujeres, con una prevalencia de sarcopenia del 4.7% [49]. Ambos estudios evidencian que la dinapenia es independiente a la sarcopenia e indican que los resultados renales en pacientes con ERC están influenciados más significativamente por la pérdida de fuerza muscular que por la pérdida de masa muscular [48][49]. Un tercer estudio desarrollado en 2014, prospectivo y observacional con 165 pacientes con ERC 1-5 seguidos durante 33 meses evidenció que la dinapenia es un predictor independiente de evolución en pacientes con ERC-ND [50].
La dinamometría se utiliza principalmente como un indicador clave de la fuerza muscular al diagnosticar dinapenia y sarcopenia. Tiene la ventaja de ser fácil de realizar y aporta una medida directa de evaluación de la fuerza y potencia muscular.
Consecuencias de la Dinapenia en ERC
La pérdida de fuerza y masa muscular es un factor pronóstico negativo para la ERC. Esta pérdida también está relacionada con niveles plasmáticos más bajos de albúmina sérica, una mayor tasa de mortalidad y un aumento de la progresión de la ERC [48][49]. Además, la dinapenia conduce a una aparición más grave y temprana de la ERC en comparación con las personas sin dinapenia [48].
La conexión entre la ERC y la dinapenia se puede explicar de varias maneras.
Un factor destacado es la resistencia a la insulina, que puede contribuir a la pérdida muscular en pacientes con ERC. De hecho, varios estudios previos han demostrado una relación entre la resistencia a la insulina y pérdida de fuerza muscular [51][52].
El estado inflamatorio con aumento de los niveles de IL-6 debido al estrés oxidativo y la inflamación crónica puede conducir a una disminución de la fuerza y la función muscular, que es una consecuencia adversa de la ERC [53][54][55]. Los niveles elevados de IL-6 y las respuestas inflamatorias se observan comúnmente en pacientes con ERC, que actúan como desencadenantes de la progresión de la ERC y sus complicaciones relacionadas [54]. Además, los pacientes con ERC presentan niveles elevados de citoquinas circulantes, que contribuyen a un estado de inflamación leve, principalmente a través de la vía NF-kB [53]. Este proceso promueve la atrofia muscular esquelética y exacerba el desgaste muscular [55].
El músculo esquelético sufre apoptosis en respuesta a la estimulación del sistema renina-angiotensina y tanto la miostatina como la apoptosis influyen significativamente en la expresión génica [56][57]. La administración de angiotensina II mejora la proteólisis muscular, mientras que el uso de bloqueadores del receptor de angiotensina II tipo 1 puede amortiguar la regeneración muscular causada por el NF-kB [58][59]. Estos hallazgos sugieren que la activación del sistema renina-angiotensina puede contribuir al desgaste muscular en pacientes con ERC.
En pacientes con ERC, la dinamometría está relacionada con el inicio de terapia renal sustitutiva y la mortalidad por todas las causas con los puntos de corte actuales [49][60]. Es necesario establecer los puntos de corte en la población general y en la ERC. Hasta que esto suceda la dinamometría en pacientes con ERC debe ser superior a los 18 kg, y lo ideal es no superar los 40 kg [60].
La acidosis metabólica influye desfavorablemente en el estado nutricional de los pacientes con ERC, incluida la pérdida de masa muscular y funcionalidad. Un reciente metaanálisis con 12 estudios de intervención analizó los efectos de la corrección de la acidosis metabólica sobre el músculo de pacientes con ERC [61]. Se incluyeron 1995 pacientes con una edad media de 63,7 años (±11,7), GFR de 29,8 ml/min por 1,73 m² (±8,8), y el 58% de los pacientes eran varones. Entre estos estudios, 11 compararon los efectos del bicarbonato de sodio oral con un placebo o la atención estándar, mientras que un estudio evaluó el veverimer, un polímero que se une al CLH oral, vs placebo. Los autores concluyen que corregir la acidosis metabólica en pacientes con ERC con bicarbonato de sodio o veverimer tiene un impacto positivo y clínicamente significativo en la masa muscular y la función física. Estos hallazgos sugieren que se debe dar mayor énfasis al tratamiento de la acidosis metabólica en los esfuerzos por mantener o mejorar el estado nutricional de los pacientes con ERC [61].
Finalmente, entre los pacientes en ERC estadios 1-5 no en diálisis, los pacientes dinapénicos evidencian un mayor envejecimiento vascular [49].
Manejo de la Dinapenia en la ERC
El tratamiento de la dinapenia requiere un enfoque integral que incluya ejercicio, nutrición, tratamientos farmacológicos y el tratamiento de cualquier complicación de la ERC. El manejo de la dinapenia debe incluir las siguientes medidas:
Nutrición
La nutrición desempeña un papel fundamental en el tratamiento de la dinapenia, ya que la ingesta adecuada de proteínas es esencial para el mantenimiento y la reparación del tejido muscular [2]. Se debe motivar a los pacientes mayores que padecen dinapenia a seguir una dieta rica en proteínas, de acuerdo con su estadio ERC, para apoyar la síntesis de proteínas musculares [62]. Una dieta equilibrada que incluya frutas, verduras, fibra y fuentes de proteínas magras es importante para estas personas.
Es recomendable el consumo entre 1,0 y 1,2 gramos de proteína por kilogramo de peso corporal cada día. Las fuentes de proteína incluyen carnes magras, pescado, aves, huevos y productos lácteos [63]. Se están realizando investigaciones sobre los efectos de nutrientes específicos, como los ácidos grasos omega-3, la creatina y la leucina, en la salud muscular y la dinapenia [64]. La evidencia sugiere que estos nutrientes pueden contribuir a la síntesis de proteínas musculares y al funcionamiento general de los músculos.
Además, dado que la vitamina D es crucial para el funcionamiento muscular y el calcio es necesario para mantener la salud ósea, es relevante que estos pacientes se aseguren una ingesta adecuada de vitamina D y calcio [65]. Se recomienda el consumo de al menos 800- 1000 miligramos de calcio por día y deben exponerse lo suficiente a la luz solar o tomar un suplemento de vitamina D para alcanzar niveles séricos adecuados, especialmente en invierno [65].
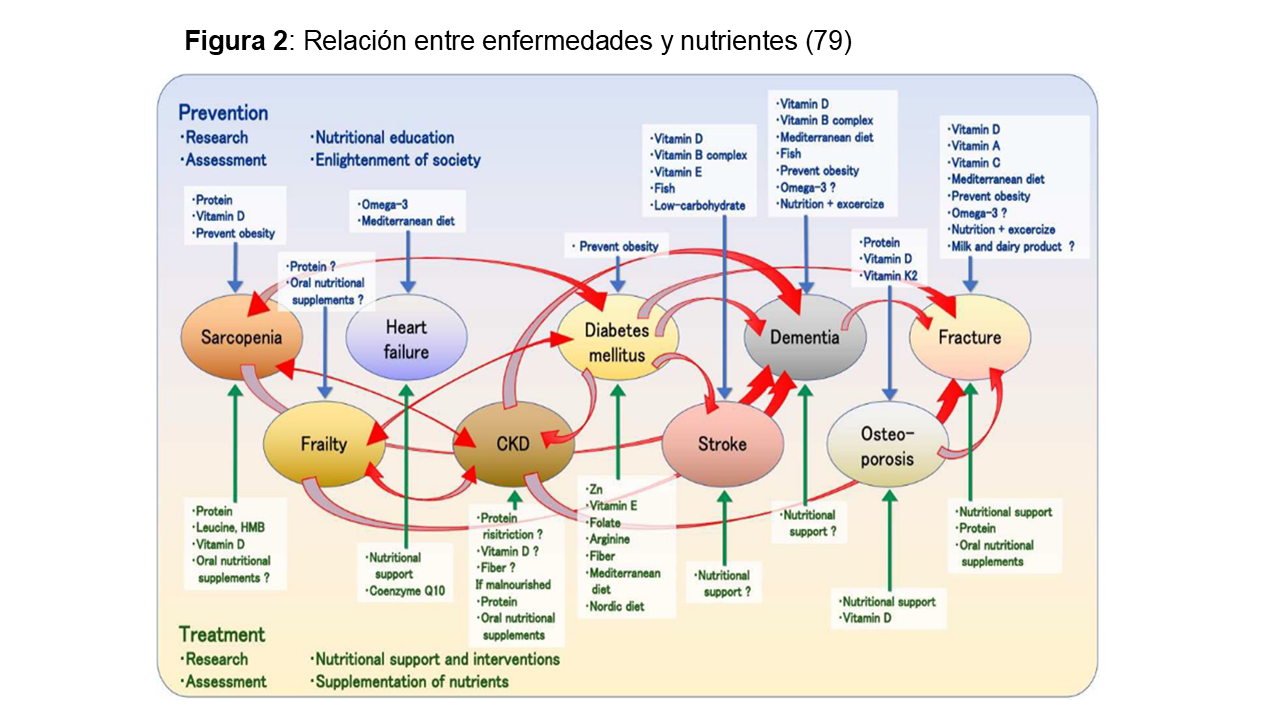
La (Figura 2) muestra la relación entre nutrientes y sus consecuencias.
Ejercicio Físico
El ejercicio es la forma más eficaz de mejorar la fuerza muscular y la función en pacientes con dinapenia [45]. Estudios recientes han explorado el tipo, la intensidad y la duración óptimos de las intervenciones de ejercicio para esta afección. Si bien el entrenamiento en intervalos de alta intensidad y los ejercicios aeróbicos pueden ser beneficiosos, el entrenamiento de resistencia tradicional a menudo se recomienda como un tratamiento más eficaz para la dinapenia [66]. Se ha demostrado que el ejercicio de resistencia aumenta la fuerza muscular, mejora la función física y reduce el riesgo de caídas de los pacientes mayores que presentan dinapenia [67]. Un reciente metaanálisis [68], que analizó 44 estudios incluyendo a 35.432 pacientes con ERC no en diálisis y diálisis (incluyendo diálisis peritoneal y hemodiálisis) presenta una sólida evidencia o altamente sugerente de que el entrenamiento aeróbico y combinado son los más efectivos para mejorar la aptitud cardiorrespiratoria. Además, el entrenamiento combinado mostró beneficios consistentes en los aspectos psicosociales. En general, todas las modalidades de ejercicio mejoraron significativamente el rendimiento funcional, excepto el entrenamiento isométrico, que solo afectó a la maduración de la fístula. Los autores concluyen que el ejercicio parece ser una terapia no farmacológica prometedora para los pacientes con ERC. Personalizar el ejercicio para lograr resultados específicos parece esencial, ya que los diferentes tipos de ejercicio demuestran distinta efectividad [68].
Testosterona
La testosterona es una hormona que desempeña un papel crucial en el crecimiento muscular y el mantenimiento de la masa muscular. La testosterona endógena se asocia de forma independiente con la fuerza muscular y la masa libre de grasa en hombres con ERC. La disminución en los niveles de testosterona que acompaña a la ERC puede contribuir aún más al entorno catabólico que conduce al desgaste muscular [69]. Se asocia de forma independiente con la fuerza muscular y la masa libre de grasa en hombres con enfermedad renal crónica moderada. La disminución en los niveles de testosterona que acompaña a la enfermedad renal crónica puede contribuir aún más al entorno catabólico que conduce al desgaste muscular [69][70].
Se ha demostrado que la terapia de reemplazo con testosterona aumenta tanto la masa muscular como la fuerza en hombres mayores con niveles bajos de testosterona. Sin embargo, el uso de testosterona puede provocar efectos secundarios significativos, como cáncer de próstata, apnea del sueño y enfermedad cardiovascular [71].
Vitamina D
La deficiencia de vitamina D es común en las primeras etapas de la ERC [72]. Varios factores contribuyen a esta deficiencia, incluida una reducción en la masa renal, restricciones dietéticas, deficiencias nutricionales, síntesis cutánea alterada de colecalciferol, diabetes mellitus, obesidad, acumulación de toxinas urémicas, proteinuria, disminución de la reabsorción debido a la disfunción de la megalina en el túbulo proximal y niveles elevados de FGF23 [73].
La vitamina D influye positivamente en el tamaño y la cantidad de fibras musculares de tipo II y células musculares, que desempeñan un papel crucial en el rendimiento neuromuscular [74]. Las investigaciones han demostrado que la deficiencia de vitamina D está relacionada con la dinapenia, sarcopenia, debilidad muscular, mayor riesgo de caídas y de fracturas [75].
En resumen, las hormonas influyen significativamente en el desarrollo de la masa muscular y la regulación de la fuerza en pacientes con ERC. Las hormonas clave que afectan la aparición de la dinapenia y sarcopenia incluyen la testosterona, la hormona del crecimiento (GH), la insulina, las hormonas tiroideas y la vitamina D [76].
Manejo de las Comorbilidades
Las enfermedades crónicas que contribuyen a la dinapenia, como la enfermedad pulmonar obstructiva crónica, la insuficiencia cardíaca o la osteoartritis, deben tratarse de manera eficaz y minimizar los efectos negativos de estas enfermedades sobre la fuerza y la función muscular [77]. Además, es importante tener en cuenta los factores psicosociales que pueden contribuir a la dinapenia en los ancianos. La depresión, el aislamiento social y otros problemas de salud mental pueden contribuir al desarrollo de la dinapenia al provocar una disminución de la actividad física y la función muscular. Abordar estos factores a través del asesoramiento u otras intervenciones puede ser importante para mejorar la función muscular y la salud general en los ancianos [78].
Prevención de caídas
Los adultos mayores con dinapenia tienen un mayor riesgo de sufrir caídas, lo que puede tener consecuencias graves. Para mitigar este riesgo, es importante implementar estrategias de prevención. Estas estrategias pueden incluir modificar el entorno del hogar, mejorar el equilibrio y la movilidad y reducir el uso de medicamentos que pueden aumentar la probabilidad de sufrir caídas.
Las evaluaciones e intervenciones nutricionales en pacientes de edad avanzada, junto con la educación nutricional para individuos y la concienciación de la sociedad, deberían contribuir a reducir la dinapenia, sarcopenia, la fragilidad y las comorbilidades en una sociedad superenvejecida [79].
Los pacientes con ERC evidencian una mayor incidencia de accidentes por caídas que los que no la padecen. Las caídas en personas mayores son una preocupación primordial debido a su asociación con resultados adversos como fracturas, disminución de la calidad de vida, pérdida de independencia y mortalidad [80].
Conclusión
La dinapenia es una afección común entre los adultos mayores, que se caracteriza por una disminución de la fuerza muscular sin una pérdida significativa de masa muscular. El mecanismo subyacente de la dinapenia no se comprende por completo, pero se cree que está relacionada con cambios en la unión neuromuscular y la composición de las fibras musculares. Se trata de un campo en rápido desarrollo, con investigaciones en curso centradas en el diagnóstico, el tratamiento y la mejora de los resultados para las personas que la padecen.
El futuro del tratamiento de la dinapenia es prometedor, ya que nuevas investigaciones continúan arrojando luz sobre esta afección e identificando posibles objetivos terapéuticos. Los avances en medicina de precisión, terapia con células madre, terapia genética, nuevos objetivos farmacológicos e inteligencia artificial pueden conducir a tratamientos más efectivos y personalizados en el futuro.
Si bien la dinapenia es común entre los adultos mayores, no es una parte inevitable del envejecimiento. Con un tratamiento adecuado, los adultos mayores pueden mantener la fuerza y la función muscular en sus últimos años, preservando así su independencia y calidad de vida.