Evaluación reglada del estado nutricional en el paciente renal: escalas de cribado y valoración
INTRODUCCIÓN
El perfil nutricional en la Enfermedad Renal Crónica (ERC) viene determinado por circunstancias relacionadas con la enfermedad de base, pero también con factores previos al estado urémico, así como por factores genéticos, ambientales, procesos agudos coexistentes y presencia de comorbilidades (diabetes mellitus, enfermedad cardiovascular, hiperparatiroidismo, inflamación, anemia, depresión, sedentarismo e infecciones). Esta complejidad hizo que la Sociedad Internacional de Nutrición Renal y Metabolismo (ISRNM), propusiera el concepto de Desgaste Proteico-Energético (DPE) o Protein-Energy Wasting (PEW) que incluye tanto el fenómeno de la desnutrición como el aumento del catabolismo observado en estos pacientes, con o sin inflamación, como se menciona en el capítulo correspondiente de Nefrología al Dia [1] [2]. Por otro lado, el progresivo envejecimiento de los pacientes con ERC incrementa este riesgo de malnutrición al sumarse a los factores relacionados con la edad avanzada, problemas dentales, dieta monótona, dificultades para adquirir alimentos si no disponen de soporte familiar o económico, alteración de la microbiota intestinal y pérdida visual/auditiva [3].
Los pacientes adultos con ERC tienen una tasa de hospitalización más elevada que la población general y más prolongada, y un alto riesgo de presentar algún grado de malnutrición a su ingreso. Asimismo, la hospitalización per se aumenta aún más el riesgo de desnutrición y sus efectos adversos [4].
Dado que uno de los principales predictores de mal pronóstico en los pacientes con ERC avanzada (ERCA) es la desnutrición, realizar una valoración nutricional correcta debería formar parte de la práctica clínica habitual en un servicio de nefrología, tanto a nivel de consultas externas como de planta de hospitalización. Para ello, es aconsejable contar con un equipo multidisciplinar que incluya a nefrólogos/as, enfermeras, nutricionistas y fisioterapeutas que puedan posteriormente ofrecer una actuación específica [5].
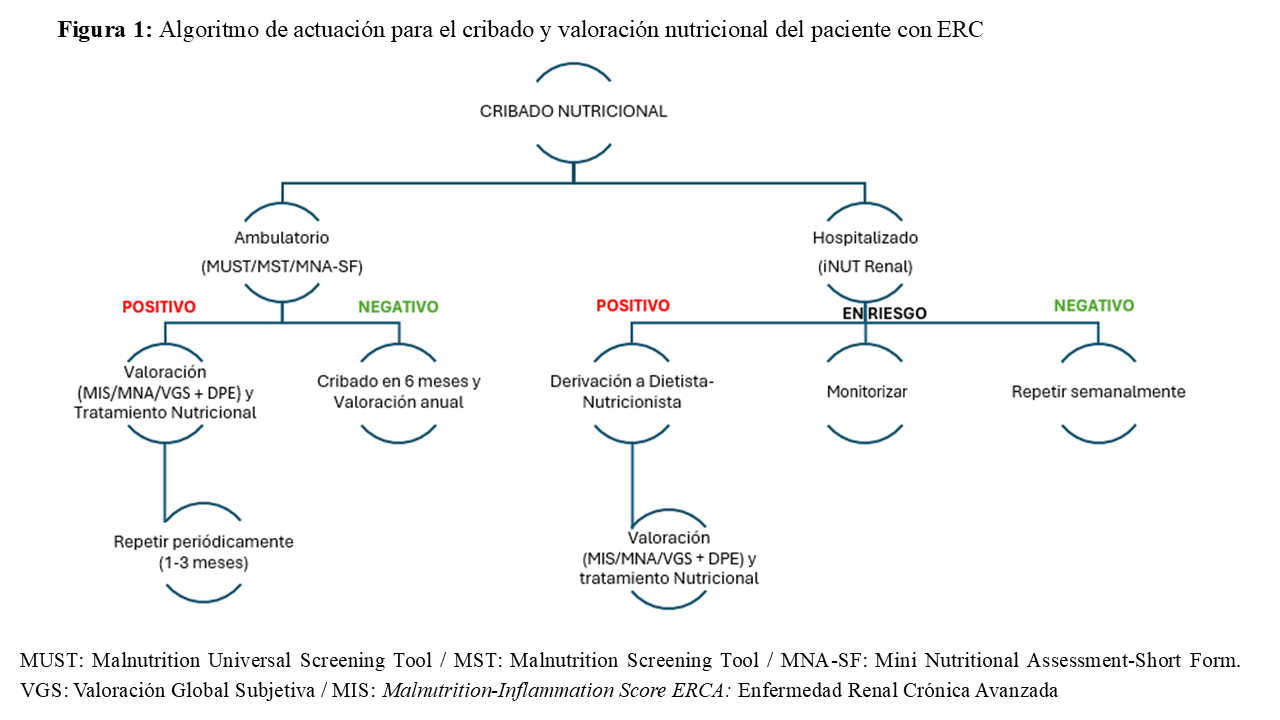
Una completa valoración nutricional debe integrar una exploración física, parámetros antropométricos y bioquímicos, así como la ingesta dietética y síntomas digestivos que puedan comprometerla o afectar a la absorción de nutrientes. En este capítulo se explican las escalas que se utilizan para el cribado y valoración nutricional (Figura 1). En otros capítulos, se encuentran los aspectos anteriormente mencionados.
Herramientas
1. Cribado nutricional
Es el primer paso por realizar para detectar de manera precoz al paciente con riesgo de desnutrición y así poder decidir si precisa de una valoración nutricional más completa y un posterior tratamiento por ser un método rápido y sencillo. Generalmente incluye el peso, el índice de masa corporal, la pérdida de peso en los últimos meses y la ingesta dietética. Según la población analizar, se escogerá una escala u otra:
• Paciente ambulatorio:
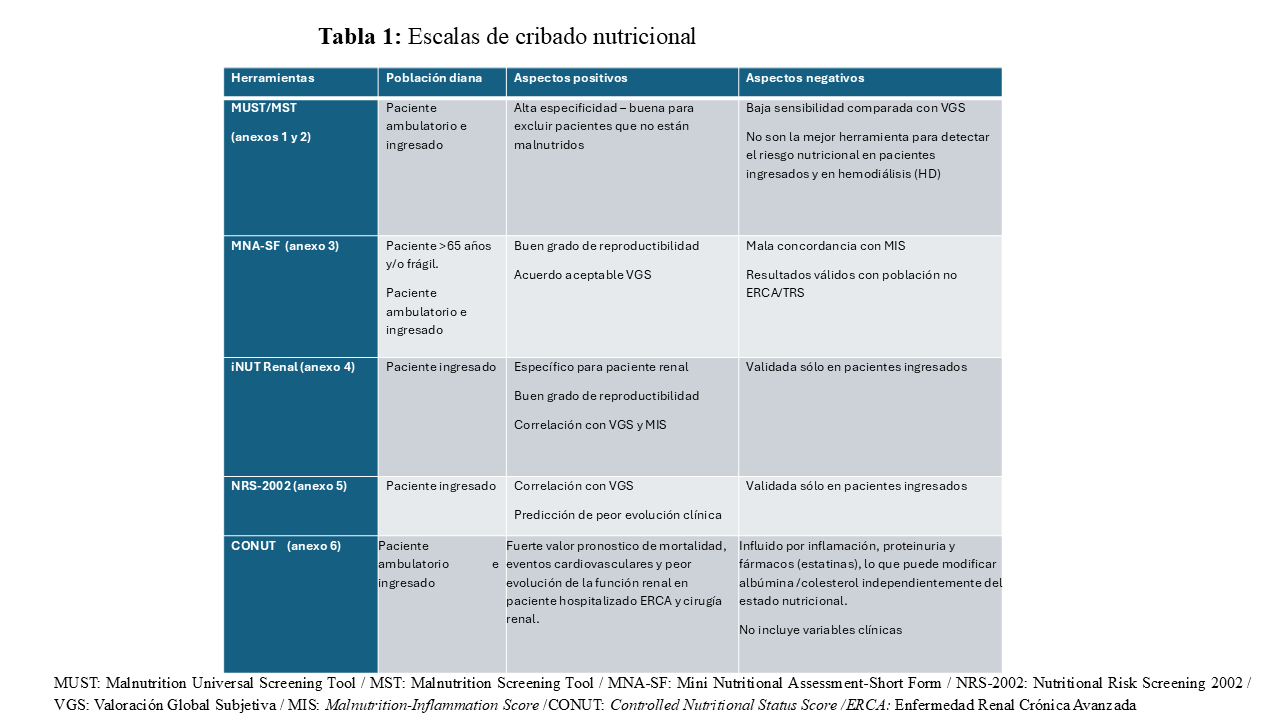
No existe una herramienta específicamente diseñada para pacientes renales en el ámbito ambulatorio, pero las mencionadas en la (Tabla 1) son las utilizadas habitualmente para cribar su estado nutricional. Puede ser realizado por personal sanitario no especializado en nutrición y suele ser rápido de contestar y también reproducible. Se aconseja realizarlo al menos dos veces al año o con mayor frecuencia (1-3 meses) si el paciente está en riesgo o con desnutrición.
• Paciente hospitalizado:
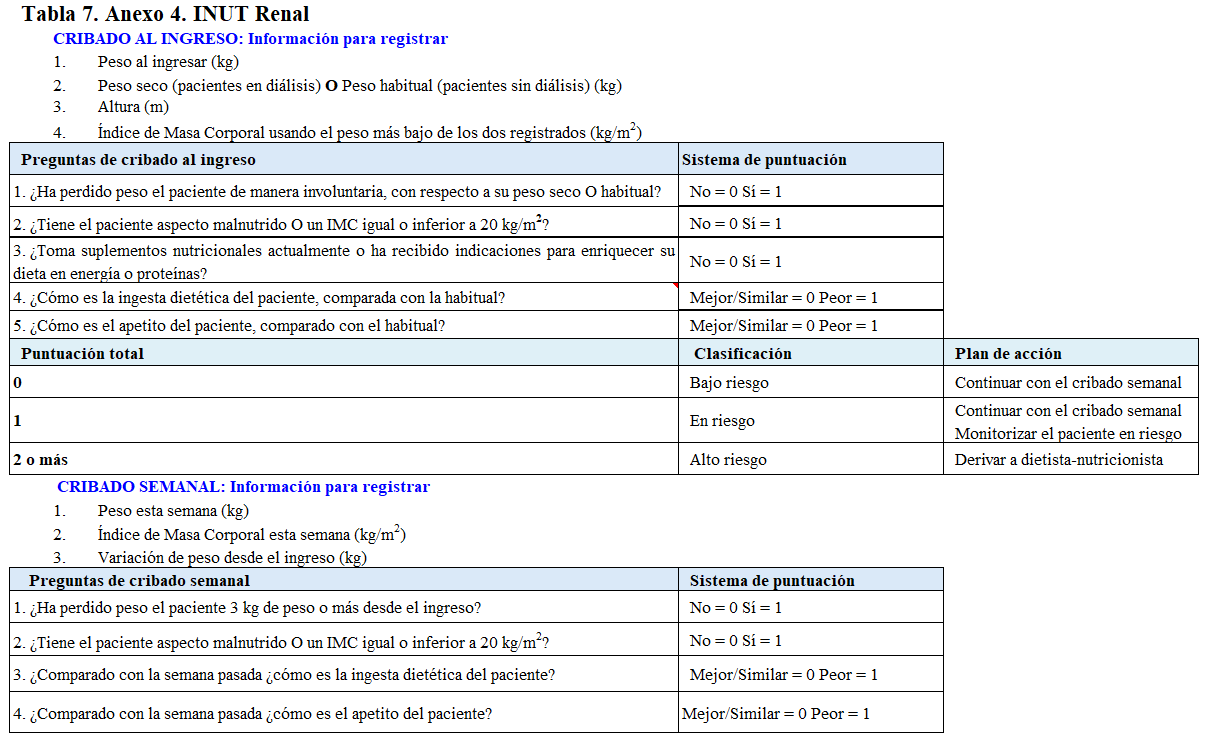
En este caso, es aconsejable que enfermería realice un cribado nutricional en las primeras 24-48h desde el ingreso, repitiéndolo semanalmente en caso de que el resultado haya sido negativo o solicitando una interconsulta con el equipo de nutrición si el resultado es positivo. Es en ese momento donde el personal especializado en nutrición realizará una valoración nutricional y planteará un tratamiento personalizado. Existe una herramienta diseñada específicamente para pacientes renales ingresados, iNUT Renal [6], por lo que se aconseja esta como primera opción, aunque también haya otras herramientas aceptadas para cribar a pacientes renales (Tabla 1).
Situaciones especiales: paciente oncológico
Existen factores asociados a la ERC y a las terapias renales sustitutivas que aumentan el riesgo oncológico en estos pacientes. De hecho, el cáncer renal es el más común en personas con ERC si comparamos con la población general. Además de las herramientas ya citadas, existen escalas de cribado nutricional específicas para este tipo de pacientes:
1. Prognostic Nutritional Index (PNI), herramienta diseñada principalmente para evaluar el pronóstico de este tipo de pacientes que pueden estar en riesgo de desnutrición y, por tanto, beneficiarse de una intervención nutricional para mejorar sus resultados [7] [8]
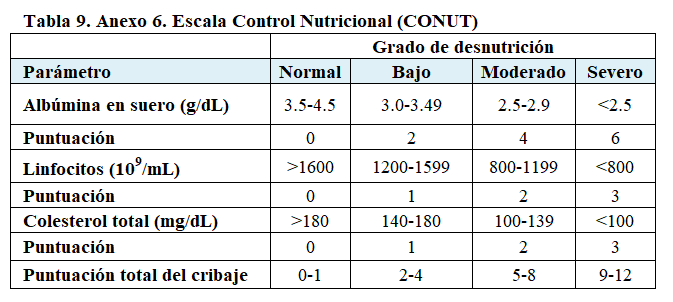
2. Control Nutricional (CONUT) es más utilizado en este tipo de pacientes en régimen de hospitalización candidato a nefrectomía o trasplante renal ( pre y postoperatorio) para identificar la malnutrición y ajustar el tratamiento nutricional según la evaluación clínica diaria [9], aunque también se ha empleado en paciente ambulatorio con ERCA o en diálisis (HD/DP) al inicio y durante seguimiento.
Ambas escalas valoran los niveles de albúmina sérica y el recuento de linfocitos, añadiendo el colesterol sérico en el caso de CONUT. Un PNI bajo y/o un CONUT elevado se asocian a la progresión del tumor y una peor supervivencia que podría mejorar con una intervención nutricional temprana.
2. Valoración nutricional
Permite conocer el estado nutricional del paciente y detectar si precisa o no tratamiento nutricional y lo realiza el personal especializado en nutrición, como el dietista-nutricionista. Para ello, se deben combinar diversos datos y valorarlos en conjunto ya que no existe una herramienta patrón oro. Periódicamente se debe repetir para poder comparar su evolución en el tiempo. Estos se describen a continuación:
• Historia clínica y dietética:
Se debe registrar el estadio de ERC, especialmente en caso de tratamiento conservador, así como el tratamiento renal sustitutivo (TRS) que esté recibiendo para, en función de ello, dirigir adecuadamente la anamnesis.
Es imprescindible recoger la información de aquellas posibles intervenciones quirúrgicas que haya sufrido y puedan alterar la absorción de nutrientes, la medicación actual, así como las comorbilidades típicas en paciente con ERC que contribuyan al desarrollo de DPE (diabetes, insuficiencia cardíaca, anemia, hipervolemia, infecciones intercurrentes, hiperparatiroidismo, estreñimiento, etc.). Además, se debe tener en consideración otros factores como la alteración de la deglución, problemas dentales, la disgeusia o alteración de los sabores, alergias e intolerancias alimentarias, sin menospreciar los aspectos psicosociales que influyen en la elección y obtención de alimentos.
Desde el punto de vista dietético, será importante conocer su apetito actual, posibles síntomas gastrointestinales como náuseas, vómitos y diarreas y la evolución ponderal de los últimos meses. Es necesario conocer sus hábitos dietéticos e ingesta actual para poder personalizar el plan alimentario y favorecer su adherencia al tratamiento. Debe incluir también aspectos socioeconómicos como el acceso a la comida, quién cocina, las técnicas culinarias habituales, el número y horario habitual de comidas, las preferencias, aversiones, intolerancias y alergias alimentarias, si tiene creencias culturales y/o religiosas que pueden influir en su alimentación y también averiguar sobre la actividad física que realiza el paciente. Estas se deben respetar, siempre que no sean contraproducentes para su salud (dieta vegetariana, halal, etc.).
Todo ello, permite realizar una intervención posterior más adecuada y personalizada para aumentar la adherencia al tratamiento nutricional.
• Evaluación de la ingesta dietética:
Existen diversas herramientas para evaluar la ingesta que realiza habitualmente el paciente. Los aspectos positivos y negativos están indicados en la (Tabla 2). La herramienta más adecuada, siempre que sea posible, será el registro dietético de mínimo tres días (dos días laborables –en caso de que realice hemodiálisis convencional: un día de diálisis y otro de no diálisis– más uno de fin de semana o festivo).
Es un método prospectivo abierto que debe acompañarse de instrucciones, verbales y escritas, para indicar cómo debe cumplir el paciente y/o cuidador (lo más específico posible: nombre del plato e ingredientes, cantidades orientativas, aliños, bebidas, picoteo, etc.) y se completará con una entrevista posterior apuntando detalles que no se reflejen.
En ocasiones, a falta de contar con un registro dietético o por querer conocer lo que ingirió en el día anterior de la entrevista, el recordatorio de 24 horas puede ser otra herramienta útil para conocer la ingesta del paciente. Consiste en recoger información sobre los alimentos y bebidas consumidos el día anterior de manera detallada (tipo, cantidad, preparación, etc.).
La nPCR (protein catabolic rate) o nPNA (protein nitrogen appearance), traducido como tasa de catabolismo proteico, se correlaciona con la ingesta proteica en pacientes metabólicamente estables (sin catabolismo o anabolismo). Se calcula en función de la eliminación de nitrógeno urinario (fórmula de Maroni) en orina de 24 horas en pacientes con ERCA, con el modelo cinético de la urea si está en HD o mediante la determinación de nitrógeno ureico en el efluente y en orina de 24 horas en diálisis peritoneal (DP). Sus valores de referencia deberían ser las recomendaciones de ingesta proteica para el estadio de ERC correspondiente, habiéndose definido malnutrición generalmente como nPCR <0,8 g/kg/día [10].
• Escalas de valoración nutricional
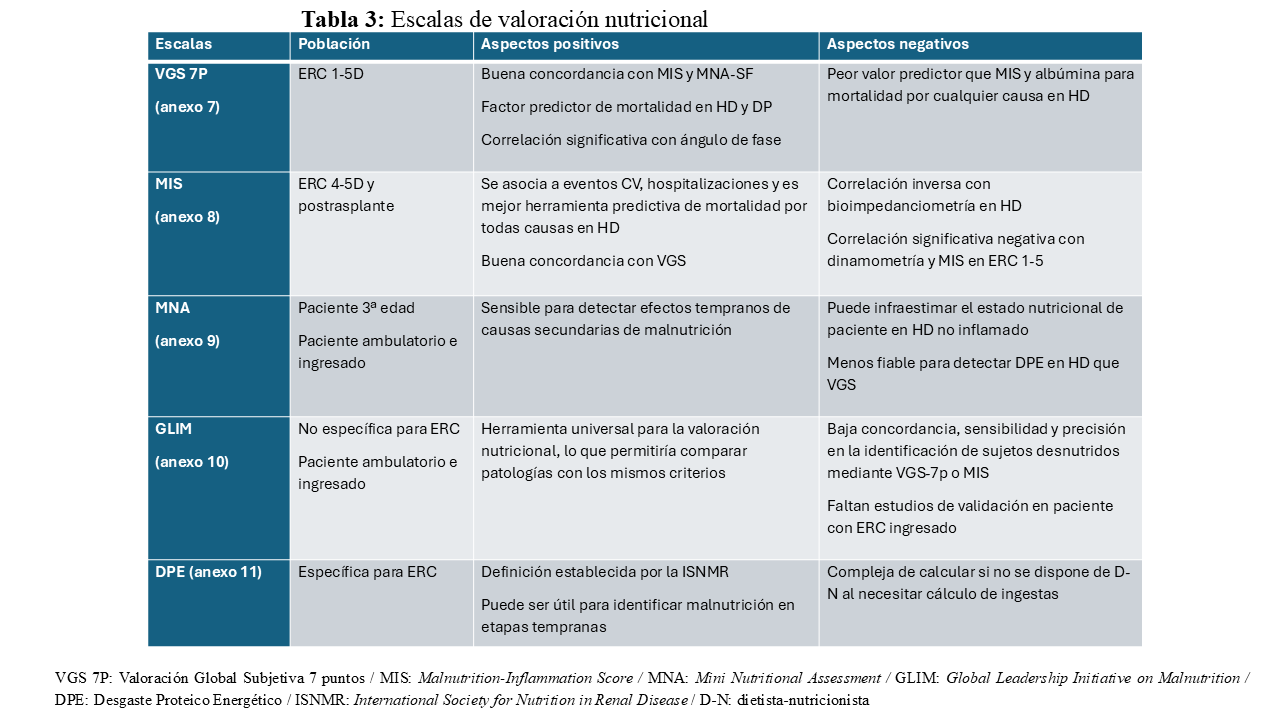
Son diversas las herramientas validadas para su uso en el paciente con ERC y estas sirven para diagnosticar el estado nutricional del paciente. Suelen combinar datos objetivos y subjetivos y es recomendable que sean utilizadas por personal experimentado para reducir el riesgo de diferencias inter/intraobservador. Según la población a analizar, se escogerá una escala u otra (Tabla 3).
En el caso de pacientes ambulatorios con ERC 3-5 o postrasplante, es aconsejable realizarlo anualmente o cuando lo indique el cribado nutricional. Si hablamos de pacientes en diálisis, es importante llevarla a cabo en los tres primeros meses desde el inicio del tratamiento sustitutivo y periódicamente, según el resultado de la valoración.
La Valoración Global Subjetiva (VGS) o Subjective Global Assessment (SGA) es una herramienta ampliamente utilizada para la evaluación del estado nutricional en el paciente con ERC. Integra información procedente de la historia clínica, que incluye la evolución del peso corporal, los cambios en la ingesta dietética, la presencia de síntomas gastrointestinales, el estado funcional y la enfermedad de base con su impacto sobre los requerimientos nutricionales, junto con datos obtenidos de un examen físico dirigido, como la pérdida de grasa subcutánea, la disminución de la masa muscular y la presencia de edemas [11].
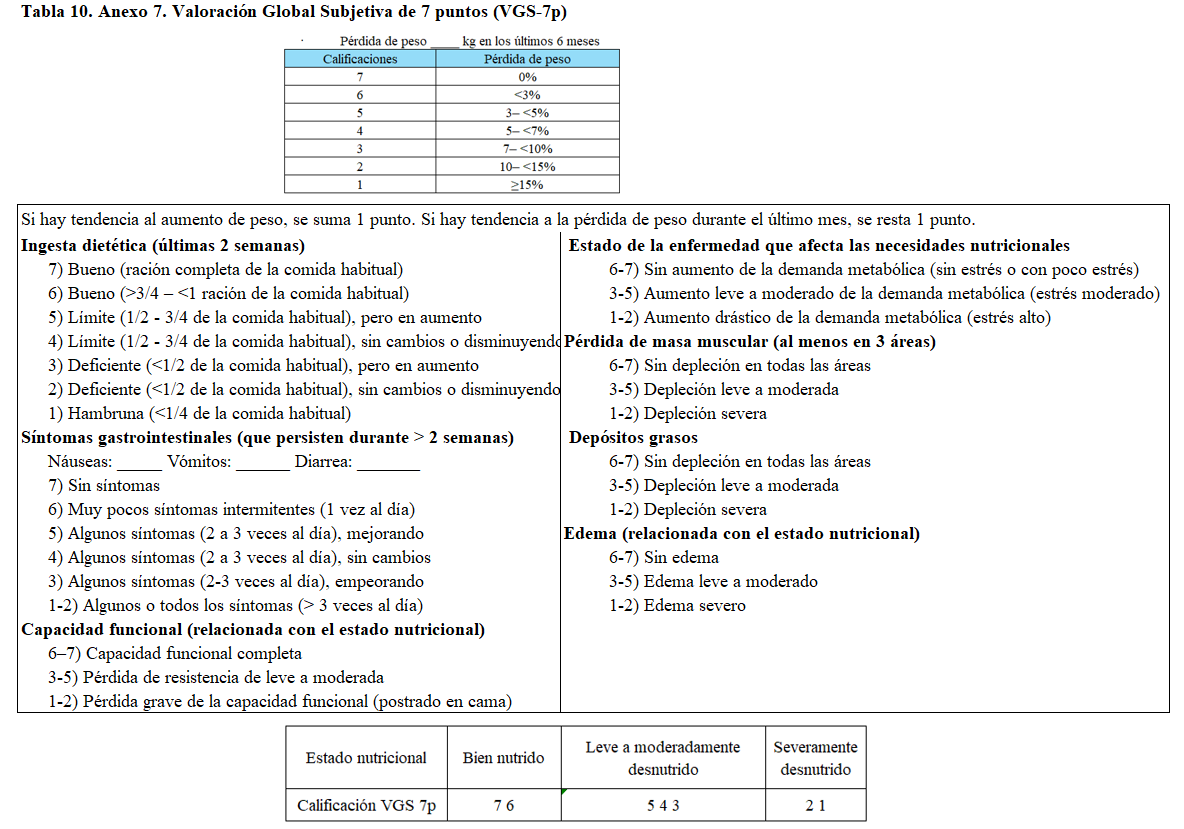
Las guías internacionales de práctica clínica recomiendan específicamente el uso de la Valoración Global Subjetiva de 7 puntos (VGS-7p) [12] [13] en pacientes con ERC, tanto en diálisis como en estadios no dialíticos, al tratarse de una versión semicuantitativa que permite una gradación más precisa del estado nutricional. La VGS-7p clasifica a los pacientes en una escala de 1 a 7, donde las puntuaciones más bajas reflejan desnutrición grave y ha demostrado una buena reproducibilidad y una asociación consistente con parámetros antropométricos, calidad de vida y desenlaces clínicos relevantes, incluida la mortalidad. A pesar de que no existe una traducción validada al castellano, se aconseja usar esta versión de VGS.
Tras la descripción original, se han desarrollado diversas variantes (VGS modificada, Objective Score of Nutrition on Dialysis, Dialysis Malnutrition Score) con el objetivo de mejorar la cuantificación y el valor predictivo del estado nutricional en pacientes en diálisis [12] [14] [15] [16].
La escala de desnutrición-inflamación o Malnutrition Inflammation Score (MIS) consta de diez componentes, cinco relacionados con los antecedentes médicos de los pacientes (cambio en el peso seco postdiálisis, ingesta dietética, síntomas gastrointestinales, capacidad funcional y comorbilidad, incluido el tiempo en hemodiálisis), dos relacionados con el examen físico según los criterios de la VGS que son disminución de las reservas de grasa y signos de desgaste muscular, dos relacionados con parámetros de laboratorio (albúmina sérica y transferrina) y el IMC. Cada componente tiene cuatro niveles de gravedad, de 0 (normal) a 3 (muy grave). La suma de los diez componentes varía de 0 a 30, que indica el aumento del grado de severidad. Se considerará una puntuación mayor de 8 como predictiva de DPE. Tiene mejor correlación que la VGS con el resto de los parámetros nutricionales, la inflamación, la anemia y la morbimortalidad [17].
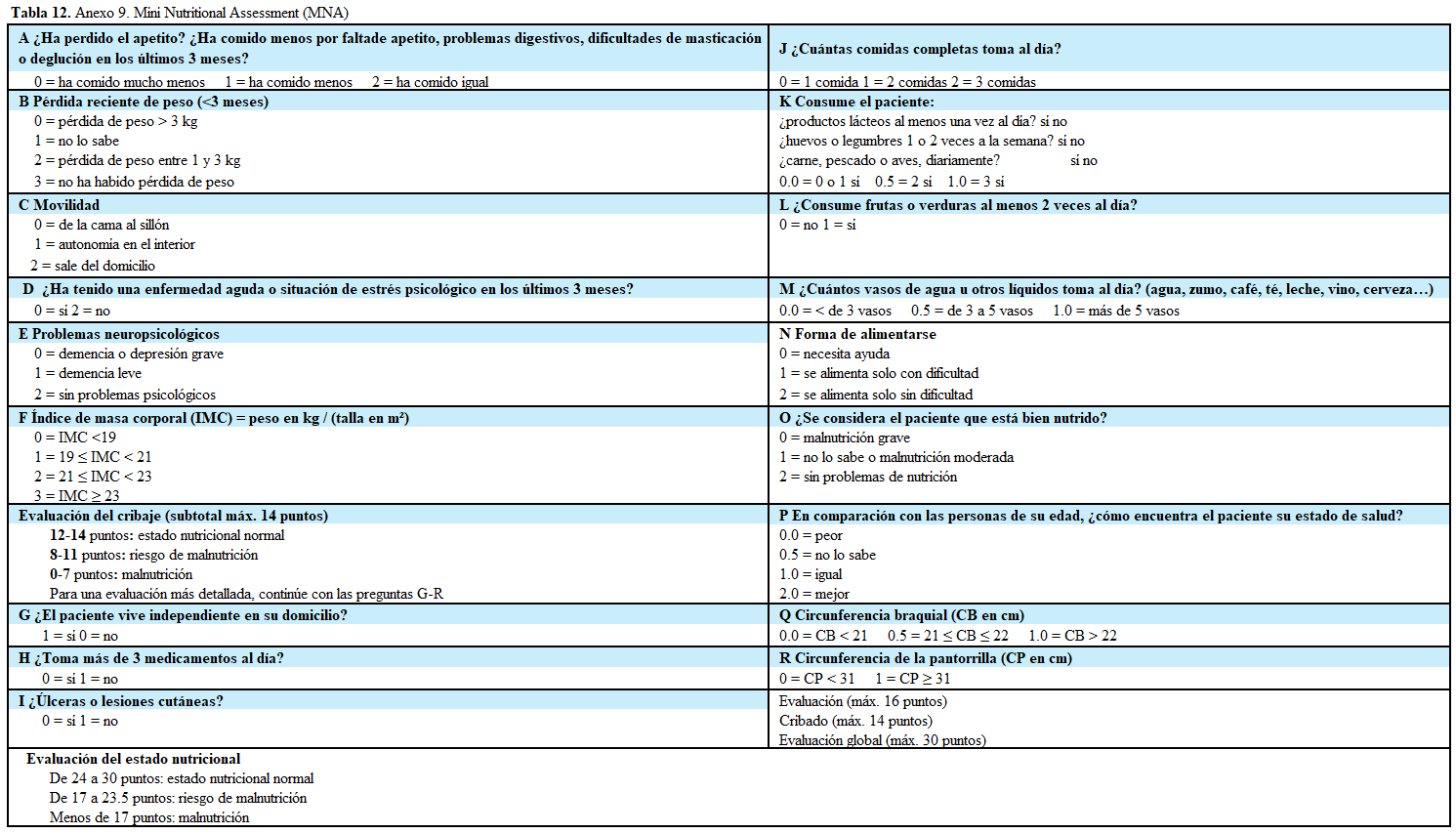
El MNA (Mini Nutritional Assessment) es una herramienta validada para población de la tercera edad que es aceptada para evaluar a pacientes con ERC, aunque no haya sido diseñada específicamente para ello. Consta de una versión corta de seis preguntas usada como cribado nutricional (MNA-SF) y ampliada para hacer una completa valoración con doce preguntas más que incluyen, a diferencia de otras escalas, factores psicosociales relacionados con este rango de edad [18] [19].
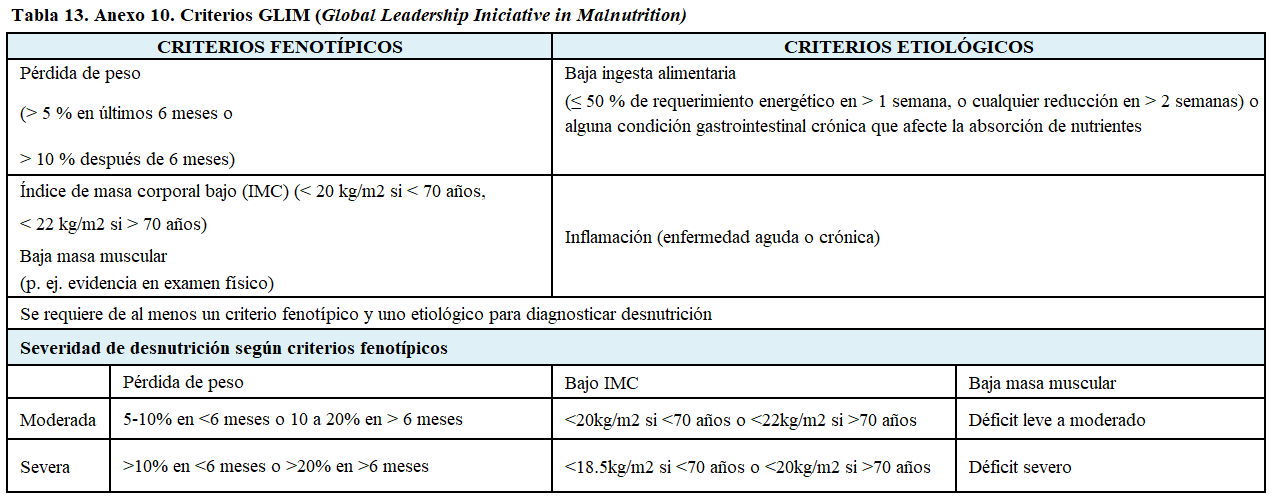
Los criterios GLIM (Global Leadership Iniciative on Malnutrition) proporcionan un sistema diagnóstico que ha sido aceptado por las principales sociedades científicas internacionales en el campo de la nutrición clínica. Estos incluyen criterios fenotípicos –pérdida de peso, IMC bajo y reducción de la masa muscular– y etiológicos –reducción de la ingesta alimentaria o de la absorción de nutrientes y estado de inflamación– para evaluar el estado nutricional. Para diagnosticar desnutrición debe aparecer un resultado positivo en cada grupo de criterios, fenotípico y etiológico. Actualmente, faltan estudios para poder validar su uso en pacientes con ERC [20].
Realizar estas escalas supone invertir un tiempo más o menos considerable, dependiendo de cuál se escoja o si se quiere comparar el resultado de varias. Existe una herramienta informática llamada Nutrendial (www.nutrendial.cat) [21] de acceso gratuito, previa solicitud de creación de usuario, que combina dos herramientas de valoración nutricional (VGS y MIS) y los criterios de DPE. Esta web facilita calcular las escalas en menos tiempo, permitiendo la comparación de los resultados.
En las siguientes tablas se ilustran los Anexos
Anexo 1: (Tabla 4)
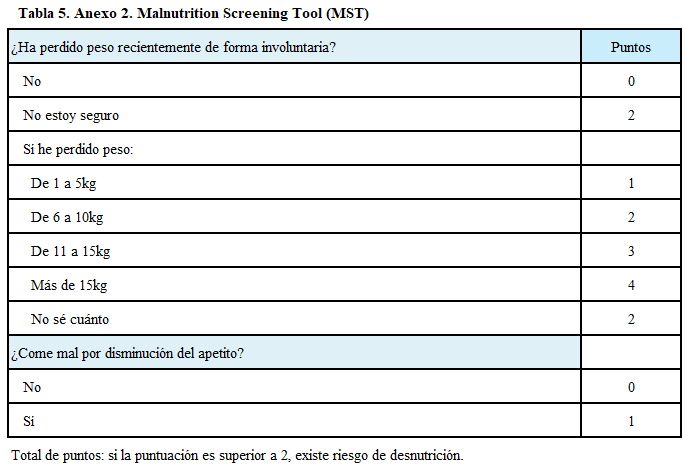
Anexo 2: (Tabla 5)
Anexo 3: (Tabla 6)
Anexo 4: (Tabla 7)
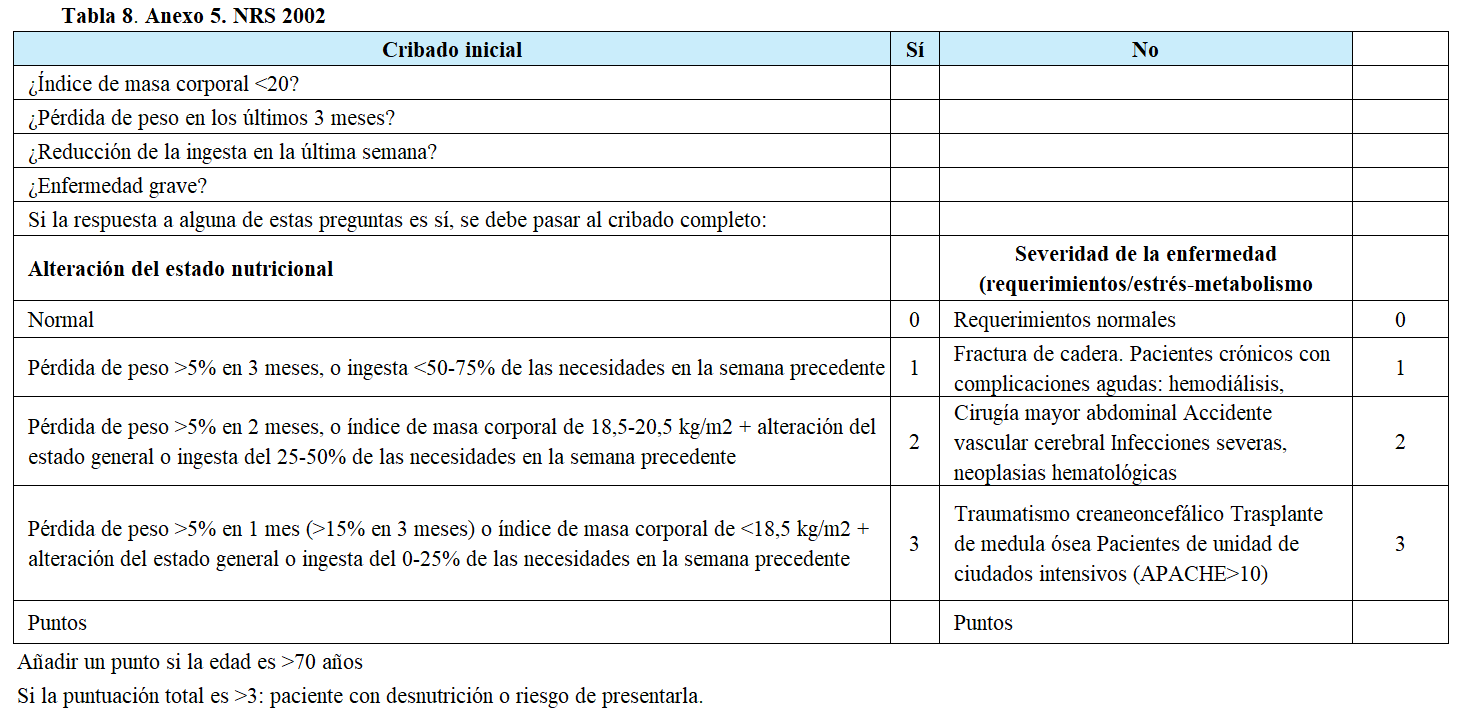
Anexo 5: (Tabla 8)
Anexo 6: (Tabla 9)
Anexo 7: (Tabla 10)
Anexo 8: (Tabla 11)
Anexo 9: (Tabla 12)
Anexo 10: (Tabla 13)
Anexo 11: (Tabla 14)