Glomerulosclerosis Focal y Segmentaria
Palabras clave
Glomerulosclerosis segmentaria y focal, Glomerulonefritis colapsante
INTRODUCCIÓN
La Glomeruloesclerosis Focal y Segmentaria (GEFS) es la causa del 10 al 15% de los casos de Síndrome Nefrótico (SN) del adulto [1]. No es una enfermedad sino un patrón morfológico, caracterizado por una esclerosis que afecta parte del ovillo de algunos glomérulos (lesión segmentaria y focal) y por una fusión de extensión variable de los pedicelos. Este patrón es común a varias enfermedades que tienen mecanismos fisiopatológicos, pronóstico y tratamientos muy distintos [2][3].
Junto a la nefropatía por cambios mínimos (NCM) y a la glomeruloesclerosis mesangial difusa en el niño, es una de las principales entidades incluidas en las podocitopatías. Tienen en común una lesión del podocito que produce una proteinuria. La lesión puede ser reversible o en algunos casos, puede ser la causa de una enfermedad renal crónica [3][4].
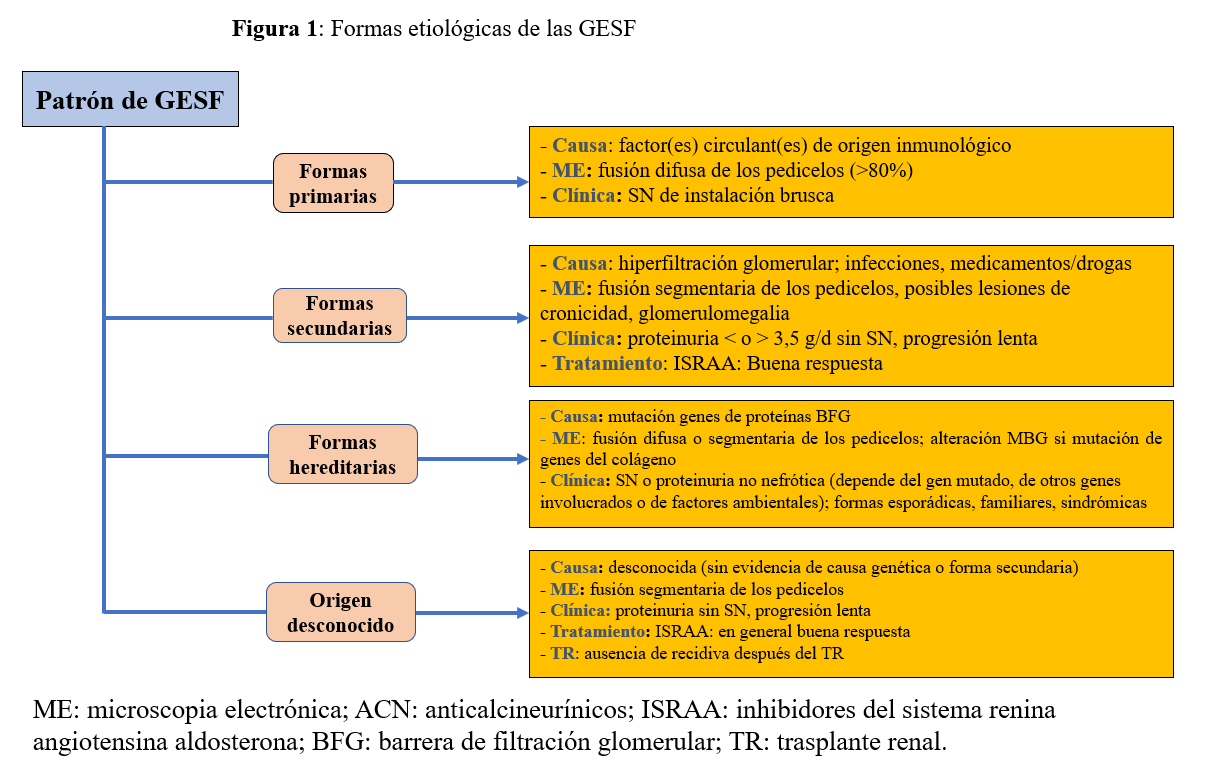
Según los mecanismos fisiopatológicos conocidos hasta ahora, se distinguen las formas primarias (GEFSp), secundarias, hereditarias y las formas de etiología desconocida [5][6] (Figura 1).
. Las GEFS primarias [5] son de origen inmunológico. Están causadas por un factor o factores circulantes aún no identificados, tóxicos para el podocito [3][7]. La mayoría responde al tratamiento inmunosupresor (IS) y la mitad de los que se someten a un trasplante renal (TR) recidivan. Los inhibidores del sistema renina angiotensina aldosterona (ISRAA) no disminuyen la proteinuria de estos pacientes [6][8][9][10].
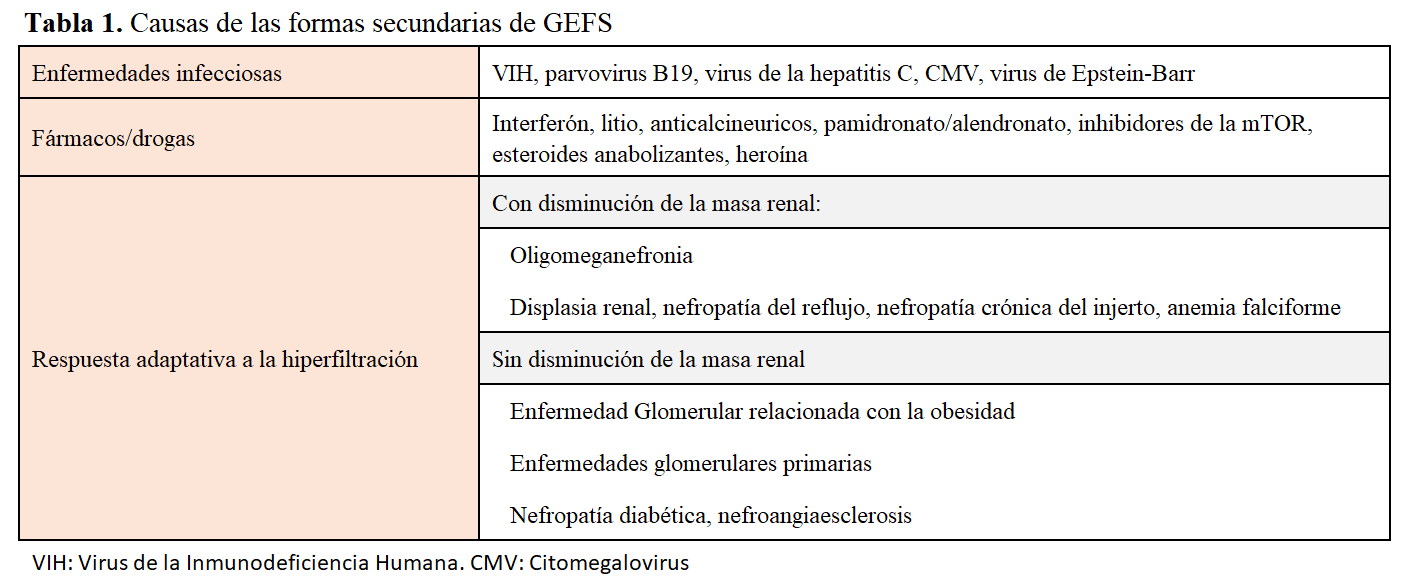
. Las formas secundarias son formas “postadaptativas” a una reducción del número de nefronas funcionantes o formas causadas por la toxicidad directa de fármacos o infecciones virales al podocito (Tabla 1) [5][11]. El tratamiento nefroprotector incluyendo los ISRAA suele disminuir la proteinuria.
. Las formas hereditarias son el resultado de mutaciones en más de 60 genes que codifican proteínas implicadas en la estructura y función de la barrera de filtración glomerular (BFG) [12]. Su prevalencia como causa de SN cortico resistente (SNCR) aumenta con la edad: cerca del 30% de los casos en el niño [13] y más del 10% en el adulto (más del 40% en los casos familiares) [14][15]. El fenotipo varía mucho según el gen mutado, además, algunos genes conocidos por su asociación a síndromes específicos, pueden manifestarse como una afectación renal aislada [12]. Los ISRAA disminuyen la proteinuria [16]. No recidivan después de un TR [5].
. En algunos casos, no se encuentra ninguna de las causas enumeradas y se habla de GEFS de causa desconocida. La forma de presentación clínica es similar a la de las formas secundarias. Puede tratarse de formas secundarias cuya causa no se ha evidenciado o de formas hereditarias no diagnosticadas [4].
EPIDEMIOLOGÍA
Incidencia
Existe un aumento progresivo de la incidencia de GEFS en Estados Unidos [17][18][19][20][21][22]. En algunas series (especialmente en los pacientes de raza negra [18][19], y en otras afectando a todas las razas) se ven afectadas por este aumento: en el registro de biopsia renales (BR) del condado de Olmsted (Minnesota) cuya población es de predominio caucasiana, la incidencia de la GEFS ha aumentado desde 1,4/100.000 personas/día (1974-1983) hasta 3,2/100.000 personas/día (1994-2003) [19]. En Europa la incidencia es menor y estable en las últimas décadas. En Flandes es de 12,1 pmp/año (2017-2019 [22]. En Uruguay, pasa de 8,3 (periodo: 1990-1994) a 7,66 pmp/año (2010-2014) [23].
Frecuencia relativa
Un estudio multicéntrico reciente en el que colaboran 29 servicios de nefrología de todo el mundo incluye 42603 pacientes con enfermedades glomerulares (diagnosticados en el periodo 2012-2013). Muestra las siguientes incidencias de la GEFS como causa de SN: Europa: 14,9%, América del Norte: 19,1%, América Latina: 14,8% y Asia: 6,9%. Los pacientes de origen europeo y asiático que viven en Estados Unidos tienen una mayor incidencia que los que viven en su continente de origen [24]. Estos datos coinciden con los de otros registros de BR en Europa [25][26], Asia [27][28], Australia [29] o América Latina [23]. No se observa ningún aumento de la incidencia con el tiempo en los pacientes europeos o asiáticos [30][31][32][33][34].
En Estados Unidos, en las últimas décadas, existe un aumento de la incidencia global de GEFS y de su incidencia como causa de SN [22][24][25][34][35][36] y de ERC [37].
En España, se ha publicado recientemente una actualización (periodo: 1994-2019) de los datos del Registro Español de Glomerulonefritis que incluye 26.671 BR [38]. La GEFS representa el 8 % de las enfermedades glomerulares, la NCM el 6,8%. Por intervalos de edad los resultados son los siguientes:
. < 15 años GEFS: 11%, NCM: 21,5%
.15-65 años: GEFS: 9%, NCM: 6,6%
.65-80 años: GEFS: 4,7%, NCM: 4,7%
.>80 años: NCM: 6,1%
Frecuencia relativa de las formas primarias y de las formas secundarias
El registro del Condado de Olmsted, Minnesota, recoge en el periodo 1994-2013, 282 BR realizadas por enfermedad glomerular. El 17% (46 pacientes) tiene una GEFS. Con los siguientes criterios diagnósticos:
-formas primarias: distribución difusa de la fusión de los pedicelos y SN,
-formas secundarias: distribución focal sin SN,
12 pacientes tienen una forma primaria, 34 una forma secundaria y 3 una forma hereditaria. En el 60% de las formas secundarias no se encuentra una causa [39]. Cuatro pacientes tienen una fusión difusa pero una causa clara de una forma secundaria.
PRESENTACIÓN CLÍNICA
La GEFSp debuta con un SN. Se acompaña de hipertensión arterial, hematuria microscópica e insuficiencia renal (IR) en el 30-45% de los casos [8]. Las remisiones espontáneas son <5% [40][41].
Al inicio pueden estar presentes una insuficiencia renal aguda (relacionada con la isquemia renal y favorecida por los nefrotóxicos, los diuréticos y una hipoalbuminemia severa [42][43]) y complicaciones trombóticas en más del 20% de los casos [44].
Las formas secundarias a una hiperfiltración debutan sin hipoalbuminemia, sea o no la proteinuria de rango nefrótico. Cuando no es nefrótica, la proteinuria suele aumentar progresivamente [45]. Si hay una agresión directa (medicamentos o infecciones virales) la mayoría de los casos debutan con un SN [46].
Las formas hereditarias tienen una forma de presentación variable dependiendo de la mutación implicada.
Los niños tienen habitualmente un patrón de herencia autosómico recesivo con una penetrancia completa, debutan con un SN severo y pueden presentar un cuadro sindrómico [47].
En el adulto la transmisión es autosómica dominante, la penetrancia variable, no suele estar presente un SN y se observa una progresión lenta de la ERC [48].
EVOLUCIÓN Y FACTORES PRONÓSTICOS
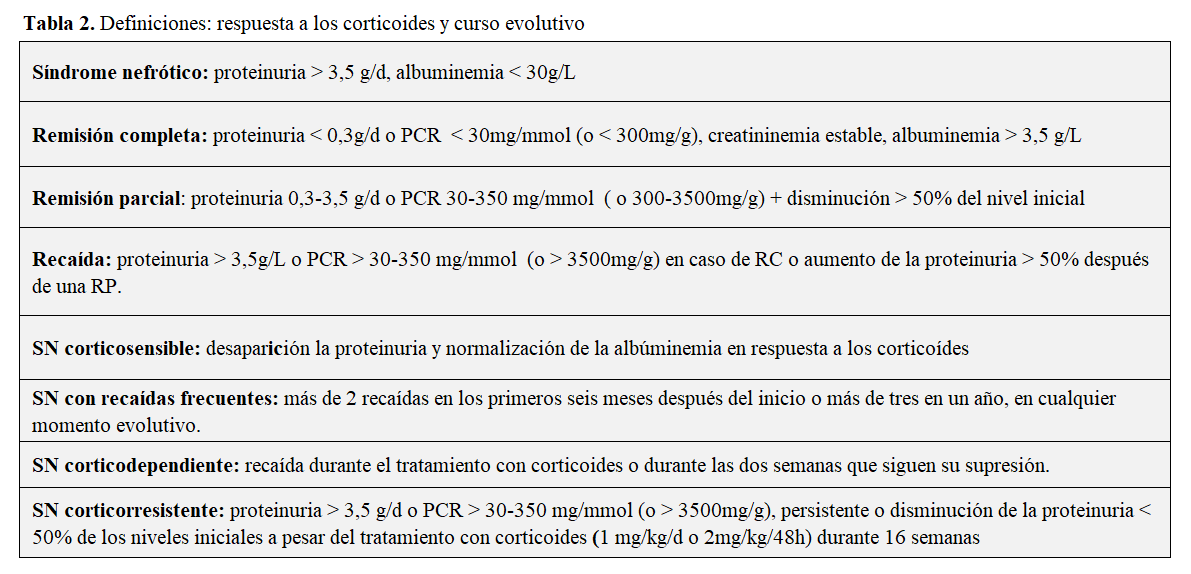
ver definiciones en la (Tabla 2)
Evolución del SNI de la edad pediátrica a la edad adulta.
Del 9 al 33% de los niños con SN corticosensible (SNCS) tienen recaídas en la edad adulta. La supervivencia renal es excelente si persiste la CS. Las principales complicaciones son la presencia de factores de riesgo cardiovascular y la afectación gonadal por la administración de ciclofosfamida [49][50][51][52].
Evolución
Respuesta a los corticoides
-del 34% al 53% de los adultos y del 10 al 20% de los niños son CR [46][53],
-del 47% al 66% entran en remisión completa (RC) o parcial (RP): (32-47% RC, 19-27% RP) si el tratamiento dura más de 4 semanas [8][54][55][56],
-45% de los CR no responden a los anticalcineurínicos (ACN) y la función renal del 9,5% de estos casos empeora durante un periodo de observación de 23,6 meses (6-65,5) [54].
Recaidas: ocurren en el 30-60% de los casos [54][57].
ERC: en Estados Unidos la GEFS fue en 1980 y en 2000, la causa respectivamente, del 0,2% y 2,3% de los casos que necesitan tratamiento renal sustitutivo [37].
Si el tratamiento no es adecuado o si no hay respuesta a los corticoides, la enfermedad progresa hacia la ERC en el 50% de los adultos (30-40% de los niños), en un plazo de 6 a 8 años [41][42][46].
En una publicación reciente basada en el registro de biopsias renales de Escocia (periodo 2013-2017), el 8% de los pacientes menores de 60 años y el 25% de los mayores de 60 años necesitan tratamiento renal sustitutivo a los 3 años de evolución [55].
Mortalidad: en el estudio escoces antes citado, el riesgo de muerte, durante un seguimiento de 3 años, es 2 veces mayor entre los menores de 60 años que en la población general de la misma edad. La principal causa de muerte son las enfermedades cardiovasculares (28% versus 18% en la población general) [55].
Pacientes mayores de 60 años: según un estudio multicéntrico con 124 pacientes (31% con NCM, 69%, con GEFS), el SNI e caracteriza en estos pacientes por:
·un alto porcentaje de remisiones (RC en el 65,5% de los casos y una RP en el 17,2%), y solo 15,5% son CR.
·un periodo de tiempo largo hasta conseguir la remisión (60 días de media antes de los 60 años y 120 días después)
·un alto porcentaje de recaídas con una incidencia acumulada a los 7 años de evolución del 90%
Al finalizar este periodo, el 67,2% están en RC, el 4% necesita tratamiento renal sustitutivo y el 6% ha fallecido. El riesgo de muerte es 3 veces mayor que en la población general (emparejada por edad y sexo). Más del 50% de los pacientes tienen complicaciones (infecciones, trombosis venosas, diabetes, HTA) [58].
Factores pronósticos
. Forma de comienzo: durante un periodo de evolución de 6-8 años, la supervivencia renal es superior al 80% si la proteinuria inicial no es nefrótica e inferior al 50% si es nefrótica [59][60].
. Remisión: la RC es un factor de buen pronóstico, cualquiera que sea la variante histológica y el tratamiento utilizado. La supervivencia renal es superior al 95% a los 10 años en caso de RC o RP e inferior al 30% si no se ha conseguido una remisión [56][61][62][63][64].
Los pacientes tratados con IS tienen una mayor incidencia de remisiones y una menor probabilidad de llegar a la ERC [54][65][66]. Cuanto antes se consigue la remisión, menos posibilidades hay de recaída [57].
Anatomía Patológica
Las lesiones tubulointersticiales graves son un factor de mal pronóstico [66].
Otras lesiones histológicas:
El estudio Neptune, “the Nephrotic Syndrome Study Network”, está dedicado en parte, a analizar el valor pronóstico de un gran número de cambios estructurales (“descriptors”), valorados de forma cuantitativa o semicuantitativa (NEPTUNE Digital Pathology Scoring System: NDPSS) en una cohorte de pacientes con SNI (NCM y GEFS) [67][68]. En una publicación reciente, se analiza el valor pronóstico de 61 “descriptors” sobre la función renal y la proteinuria en un grupo de 224 pacientes incluidos entre 2010 y 2017, con un seguimiento mínimo de 5 años. Algunos de los cambios estructurales que tienen valor pronóstico son conocidos o esperables (esclerosis glomerular global, obliteración capilar segmentaria, colapso glomerular, fibrosis intersticial) otros no (hiperplasia de los podocitos, fibrosis periglomerular, células espumosas en el intersticio, microvellosidades podocitarias y anomalías del endotelio y de la MBG en ME) [68][69].
Formas histológicas: según un estudio del 2013 [70], tienen un valor pronóstico. 47% de las variantes colapsantes, 20% de las NOS y 7 % de las “Tip” alcanzan la ERC estadio 5D a los 3 años de seguimiento. Este estudio confirmaba resultados anteriores en Estados Unidos y Europa [71][72]. En publicaciones posteriores, la clase histológica no tiene ninguna influencia sobre la evolución, responden todas de la misma forma al tratamiento IS [46][55][61][73][74].
Raza
La progresión hacia la ERC es más frecuente entre los niños afroamericanos que entre los niños de ascendencia europea o del Sur Asiático (15-39%) [75].
Las variantes G1 y G2 del gen APOL1, presentes en el 35% de la población afroamericana en Estados Unidos, son un factor de mal pronóstico [76][77].
ANATOMIA PATOLÓGICA
Véase Atlas de Histopatología Renal
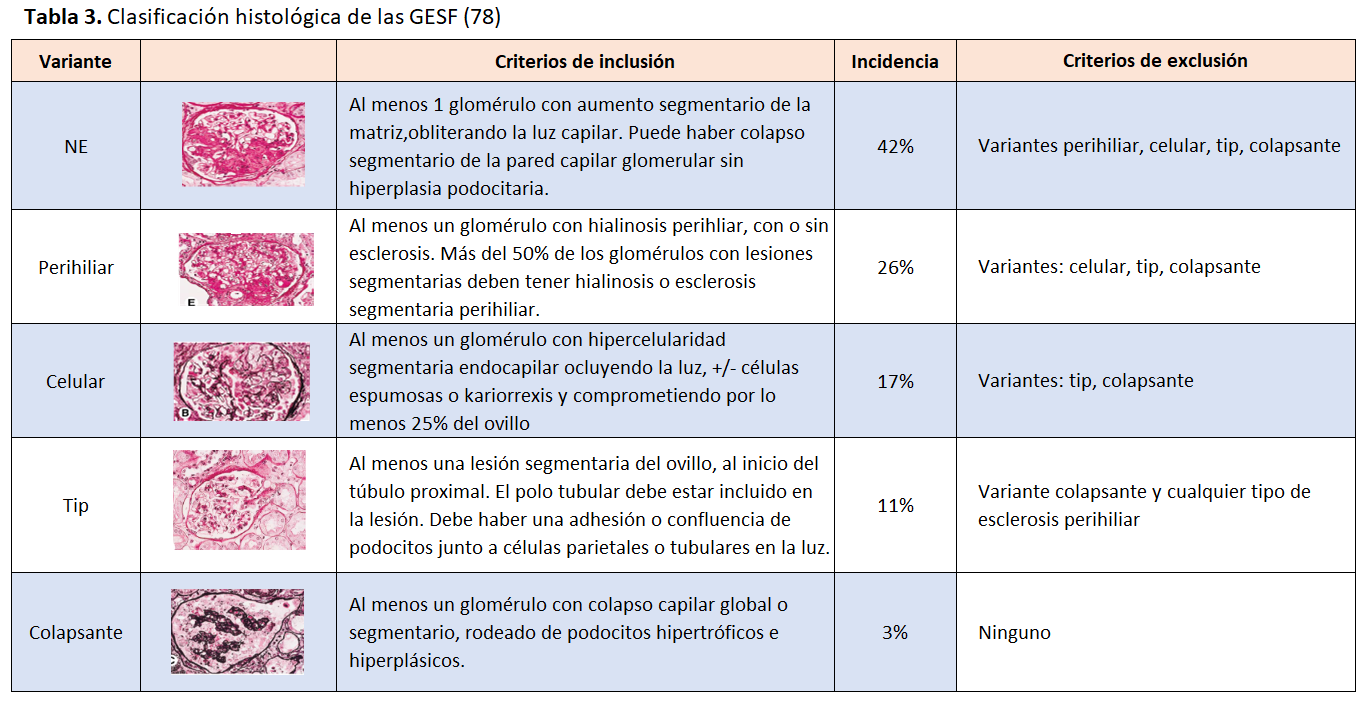
La lesión fundamental y diagnóstica es una esclerosis que afecta parte del ovillo glomerular (segmentaria) de algunos glomérulos (focal). Se asocia a un colapso de las asas capilares, con aumento de la matriz mesangial y condensación en el polo vascular, perihiliar y a una lesión focal de hialinosis (material acelular, liso y homogéneo, fucsinófilo con el tricrómico). Se suele utilizar la clasificación de Columbia que subdivide, independientemente de que se trate de formas primarias o secundarias, las GEFS en 5 clases histológicas: colapsante, celular, “tip”, perihiliar and “not otherwise specified” (NOS) [1][78] (Tabla 3). Estas clases histológicas no tiene correlación ni con los mecanismos fisiopatológicos ni con la respuesta al tratamiento. Tampoco tienen un valor pronóstico.
En la variante colapsante, a menudo asociada al VIH, puede no evidenciarse ninguna causa [79].
El estudio ultraestructural está indicado siempre que sea posible. Al ser la GEFS un diagnóstico de patrón y no de etiología, la microscopía electrónica (ME) resulta fundamental para identificar posibles formas secundarias, además de permitir valorar el grado de lesión podocitaria.
No hay ninguna lesión histopatológica patognomónica de una GEFSp. En las formas primarias la fusión de los pedicelos es difusa (>80%) en más del 70% de las biopsias y en las formas secundarias suele ser segmentaria. En las hereditarias es de extensión variable si el gen implicado codifica proteínas del cito esqueleto o del diafragma en hendidura y segmentaria si codifica las otras proteínas [15][80][81][82].
La utilización de nuevas técnicas como la microscopía de superresolución y la observación en 3D del diafragma en hendidura y del ovillo glomerular permiten visualizar cambios estructurales o lesiones de esclerosis que pueden pasar desapercibidas con la microscopia óptica convencional [83][84][85].
La combinación de estas técnicas con la digitalización de las imágenes, el estudio molecular de la BR y el análisis bioinformático permitirá entender mejor los cambios estructurales y la heterogeneidad molecular de estas enfermedades [69].
Biomarcadores
No existe actualmente ningún biomarcador en suero o en orina que permita diagnosticar las distintas podocitopatías, diferenciar los mecanismos fisiopatológicos y utilizar nuevas dianas terapéuticas. El desarrollo de nuevas tecnologías de alto rendimiento (como la secuenciación de células individuales y la determinación de micro ARN en suero y orina) probablemente lo harán. Estudios de proteómica en orina han valorado la alpha-1-antitripsina, la transferrina, la histatina-3, la proteína ribosomal 39S y la calretinina como posibles biomarcadores urinarios. Los resultados se tienen que confirmar [86][87][88][89].
Clasificación de las podocitopatías según el patrón histológico
GEFSp y NCM
Según la mayoría de los autores la NCM y la GEFSp son la misma enfermedad: la NCM es un estadio inicial cuyas lesiones histológicas son reversibles, la GEFS una forma más tardía que aparece si el insulto inicial persiste o es muy intenso. Es decir que las lesiones histológicas dependen del momento en el que se realiza la biopsia y de que la lesión inicial sea o no reversible [90].
Muchos aspectos relacionados con la sintomatología clínica inicial, la anatomía patológica, la respuesta al tratamiento y la fisiopatología muestran un gran solapamiento entre NCM y GEFS.
Aspectos anatomopatológicos:
Una GEFS puede ser diagnosticada de NCM si:
-el cilindro no pertenece a la zona juxtamedular: los glomérulos juxtaglomerulares son los primeros en presentar las lesiones de esclerosis [78].
-la muestra de la BR, al tratarse de una lesión focal, puede no tener un número de glomérulos suficiente (>8) para ser representativa [75][91].
-las secciones del cilindro de BR no incluyen la zona con esclerosis del glomérulo ya que se trata de una lesión segmentaria que ocupa por término medio el 12,5% del volumen glomerular total. La observación de múltiples cortes seriados del glomérulo y la reconstrucción en 3D permite ver lesiones de esclerosis que pasan desapercibidas con las técnicas habituales y confirman que una GEFS puede ser diagnosticada de NCM [92].
-la BR se realiza de forma precoz durante el curso evolutivo de la enfermedad. Se han descrito muchos casos de cambio histológico (NCM a GEFS) tanto en riñones propios como en riñones trasplantados. En este último caso la BR inicial, en caso de recidiva, solo muestra una fusión difusa de los pedicelos. Las lesiones de esclerosis aparecen en las BR posteriores [2][93][94][95][96][97].
Para algunos autores, el tamaño de los glomérulos diferencia las dos entidades: esta aumentado en los pacientes con GEFS (incluso el de los glomérulos sin esclerosis o en los pacientes diagnosticados de NCM que desarrollan posteriormente una GEFS) y es normal en la NCM [98].
Mecanismos fisiopatológicos:
Es probable, la implicación de uno o varios factores circulantes en las GEFSp y en las NCM [7][99]. Para algunos autores, el o los mismos factores de permeabilidad podrían ser responsables de las dos enfermedades.
Se han descubierto muy recientemente anticuerpos antinefrina en el suero del 30% de los pacientes de una cohorte de 62 adultos y niños con una NCM. Los niveles son altos cuando la extracción coincide con un brote de SN y disminuyen o desaparecen en periodos de remisión. La IF muestra una colocalización de depósitos granulares muy finos de IgG y nefrina en 9 pacientes con anticuerpos circulantes. Una mujer adulta, con un SN corticodependiente (SNCD) que debuto en la infancia, desarrolla una GEFS y una ERC-5D. Después de un TR, el SN recidiva, coincidiendo con niveles altos de anticuerpos antinefrina en el suero. La plasmaféresis permite la remisión del SN y la desaparición de los anticuerpos circulantes [100]. También muy recientemente se ha descubierto en el 66% de 341 niños chinos con SNI, 7 autoanticuerpos dirigidos contra antígenos podocitarios [101][102].
Las formas hereditarias se asocian esencialmente a las GEFS. Algunas mutaciones en genes que codifican proteínas de la BFG, como la proteína “tyrosine phosphatase receptor type”, han sido descritas en ambas entidades [103][104].
En la NCM se han identificado variantes de genes, relacionados con el sistema inmunológico [105][106], o con la endocitosis [107][108].
Respuesta al tratamiento
Aunque en la literatura es todavía frecuente el utilizar indistintamente GEFS y SNCR o NCM y SNCS, la corticosensibilidad no es sinónimo de NCM (10-30% son CR), ni la CR de GEFS (50% son CS) [64]. Por ejemplo, en una serie pediátrica reciente de 187 niños con SNCR, 54,1% tienen una GEFS y 23,8% una NCM [12].
Variantes GEFS/NCM
Existen otras tres enfermedades glomerulares que debutan con un SN y lesiones histológicas similares a las de la NCM y la GEFS: la glomerulonefritis (GN) proliferativa mesangial idiopática, la GN con depósitos de IgM y la nefropatía C1q. Para algunos autores son variantes de la NCM o de la GEFS, mientras que para otros son entidades distintas.
GN proliferativa mesangial idiopática: pueden o no estar presentes depósitos de IgM, de distribución focal o difusa en el mesangio [109]. Hay una fusión, en general difusa, de los podocitos. Más del 50% de los pacientes responden a los corticoides [110][111]. Del 10 al 30% de los pacientes desarrollan lesiones de esclerosis glomerular y una insuficiencia renal [110].
GN con depósitos mesangiales de IgM: los depósitos mesangiales de IgM y C3 junto a depósitos mesangiales electrodensos y la proliferación mesangial permiten identificar esta enfermedad glomerular distinta, para algunos autores, de la NCM y de la GEFS [112][113]. Para otros se trata de una forma de transición entre estas dos glomerulopatías [114][115]. La presencia de IgM en mesangio, en ausencia de depósitos electrodensos, es la consecuencia de una fijación inespecífica. La evolución varía mucho según las series. En algunas cohortes, la respuesta a los corticoides (menos del 50% de los casos) es menor y evolucionan más pacientes hacia la ERC (más de 35% a los 10 años) que en la NCM [116][117]. En trabajos más recientes, no se confirman estos datos [118].
Nefropatía C1Q: en esta glomerulopatía, la proliferación mesangial se asocia a depósitos mesangiales de C1Q y a depósitos electrodensos [119][120]. A nivel óptico, hay una proporción variable de glomérulos normales, con proliferación mesangial o con esclerosis. Para muchos autores se trata de una variante de la GEFS [121][122][123][124][125].
La diferenciación entre patrones histológicos (NCM/GEFS) o la clasificación de Columbia no tienen ninguna utilidad práctica para orientar el tratamiento. Se adopta en la actualidad una clasificación basada en los mecanismos fisiopatológicos y en datos ultraestructurales que también tiene limitaciones [3]. En el futuro, ha propuesto valorar en cada paciente algunos parámetros clínicos, histológicos y moleculares que permitan incluirlo en grupos con dianas terapéuticas específicas [3][75][126][127].
Clasificación de las podocitopatías según el mecanismo fisiopatológico
La GEFS está caracterizada por una lesión inicial del podocito o de algún otro componente de la BFG. Como en otras enfermedades glomerulares, se produce un espectro continuo de lesión desde la fusión de los pedicelos hasta la pérdida de los mecanismos de anclaje de los podocitos a la MBG y su desprendimiento. La fusión de los pedicelos es la respuesta inicial de los podocitos para aumentar la superficie de adhesión a la MBG y evitar desprenderse [59].
El número de podocitos está determinado antes de nacer. No pueden replicarse porque son incapaces de completar la citoquinesis [128][129][130] y no se compensa su pérdida. Al contrario, los podocitos adyacentes a los podocitos desprendidos, también abandonan la MBG dejando áreas denudadas [131][132].
Esta la falta de cobertura conduce a la dilatación del asa capilar y al engrosamiento de la matriz mesangial. Cuando más del 30% de los podocitos han desaparecido, se producen adherencias a la capsula de Bowman y glomeruloesclerosis, y aumenta la permeabilidad de la BFG a las proteínas [133][134][135]. Las de mayor peso molecular no pasan esta barrera y se acumulan en el espacio subendotelial formando hialina que acaba ocluyendo los capilares [75].
Para compensar la pérdida de podocitos, las células epiteliales parietales (CEP) adquieren un fenotipo de transición epitelio-mesénquima, proliferan, migran hasta el ovillo glomerular al que se adhieren y forman sinequías entre ovillo y capsula de Bowman [136].
Si la pérdida es rápida y masiva (toxicidad medicamentosa, enfermedad viral), estas CEP hiperplásicas forman “seudo semilunas” que rellenan el espacio de Bowman y se asocian a un colapso de ovillo glomerular [130][137].
Por otra parte, un subgrupo de CEP adquiere el fenotipo podocitario para sustituir los podocitos desprendidos. Del balance entre estas 2 reacciones de las CEP (regenerativo y lesivo) depende la aparición de esclerosis [138][139].
Para compensar la pérdida de nefronas funcionantes, cualquiera que sea la causa que provoca la pérdida de podocitos, el filtrado glomerular (FG) por nefrona única aumenta en las nefronas restantes y se activa el sistema renina angiotensina aldosterona. Estos mecanismos de adaptación establecen un círculo vicioso que amplifica el proceso de esclerosis glomerular y lo generalizan [131][140][141].
Es probable que en muchos casos se necesite más de un estímulo patogénico para provocar la pérdida de podocitos. Por ejemplo una variante de riesgo en un gen de la BFG induce una mayor vulnerabilidad del podocito al estrés mecánico o a algún tóxico podocitario [46][47][142].
La lesión inicial tiene un origen muy variado [46]: factor circulante en las formas primarias, mutaciones de los genes que codifican proteínas de la BFG en las formas genéticas y el estrés mecánico en las formas secundarias a la hiperfiltración.
Formas primarias
El responsable inicial de las formas primarias es uno o varios factores circulantes, tóxicos para el podocito. La secreción de estos factores es debida a alteraciones de la función de los linfocitos T (LT) y B (LB) mal conocidas: se ha descrito un desequilibrio entre los linfocitos T colaboradores 17 (TH17) y los T reguladores (TH17/Treg). La implicación de los LB se deduce de la eficacia de los anticuerpos monoclonales anti-CD20 en muchos casos de SNCD [143][144][145][146].
La implicación de un factor circulante se apoya en varias observaciones:
·la GEFSp recidiva en el 30% - 50% de los pacientes en horas o días después del trasplante renal (TR). En las BR precoces, hay una fusión generalizada de los pedicelos y los glomérulos son normales. En la BR más tardías aparecen las lesiones de esclerosis glomerular. Con intercambios plasmáticos o inmunoadsorción se puede conseguir una remisión completa [147][148][149].
·se han descrito varios casos en los que, un riñón con una recidiva de una GEFS se reimplanta a un paciente con ERC por una causa distinta a una GEFS: la proteinuria desaparece y disminuye la esclerosis glomerular [150][151].
·la administración de suero proveniente de pacientes con GEFS provoca proteinuria en ratas [152]
·el sarampión, probablemente porque altera la inmunidad celular, induce la remisión de un SN [153].
Las sustancias que podrían estar implicadas tanto en la patogenia como en la recurrencia de la GEFS en el injerto renal son la CLCF- 1 (cardiotrophin-like cytokine factor-1), la ApoA1b (una isoforma de ApoA1), los anticuerpos anti-CD40 y el receptor soluble de la uroquinasa (suPAR), entre otras.
suPAR: es la forma soluble del receptor del activador del plasminógeno tipo urokinasa (soluble urokinase-type plasminogen activator receptor).
El suPAR activa la beta-3-integrina del podocito que tiene un papel importante en la regulación dinámica del citoesqueleto y en la adhesión del podocito a la MBG [154].
Los niveles de suPAR están más elevados en el suero de los pacientes con GEFS que en los pacientes con otras causas de SN [155] y aumentan en los pacientes cuando recidiva la enfermedad glomerular después de un TR [156].
Los intercambios plasmáticos, en algunos casos de recidiva post TR, disminuyen los niveles plasmáticos de suPAR, la actividad de la beta-3-integrina del podocito y la fusión de los pedicelos [157].
Su papel está cuestionado en estudios más recientes ya que los niveles en suero no permiten diferenciar:
·las GEFS de otras enfermedades glomerulares y están elevados en caso de disminución del filtrado glomerular independientemente de la causa, así como en otras enfermedades que no causan proteinuria [158][159]
·las formas primarias de las formas secundarias [160].
CLCF1 (Cardiotrophin-like cytokine factor 1) pertenece a la familia de la IL-6. Está presente en el plasma de pacientes con recidiva post TR de una GEFS [161]. Su papel como factor de permeabilidad está por confirmar.
Micro-ARN: los micro ARN son pequeñas moléculas (21-23 nucleótidos) de ARN no codificantes que regulan la expresión génica a nivel post-transcripcional. Actúan silenciando o degradando los ARNm diana.
La expresión de un microARN, miR-193a, produce una GEFS en ratas. miR-193a inhibe la transcripción de la proteína WT1 en los podocitos y en consecuencia la activación de algunos genes que intervienen en la función del podocito como NPHS1. La expresión de miR-193a también aumenta en los glomérulos de pacientes con formas no genéticas de GEFS, pero no en sujetos sanos o en pacientes con otras enfermedades glomerulares.
Muchos de los estudios que actualmente se están llevando a cabo están basados en la detección de microARN para diagnosticar la GEFS, diferenciar los casos primarios de los secundarios, e incluso valorar la respuesta al tratamiento. Se han detectado niveles elevados de miR-193a en biopsias de pacientes afectos de GEFSp, no así en sujetos controles ni en pacientes con nefropatía IgA, nefropatía membranosa o NCM. Las razones que justificarían este aumento son desconocidas en la actualidad [162].
Anticuerpos anti CD40: un aumento de estos anticuerpos precede la recidiva de una GEFS después del trasplante renal. Pertenecen a la superfamilia de los receptores del TNF y tienen un papel importante como moléculas coestimuladoras en la inmunidad y en la inflamación. Como su ligando (CD40L), se expresan en diversos tejidos (células presentadoras de antígeno endotelio, células epiteliales como los podocitos) y estimulan la producción de quimioquinas, metaloproteasas, suPAR y uPAR. Los datos disponibles son experimentales y necesitan confirmación [163]
No se ha demostrado hasta ahora que alguno de los candidatos mencionados sea el factor de permeabilidad responsable, ni si se trata de un único factor o de varios factores relacionados.
Formas hereditarias
Aproximadamente un 30% de los niños y un 10% de los adultos a los que se realiza un estudio genético por CR tienen una mutación en uno de los genes que codifica alguna de las proteínas esenciales para mantener la estructura y/o la función de la BFG [14][164][165].
Hasta la actualidad se han identificado más de 60 genes. Este número está aumentando rápidamente. Se pueden clasificar:
-según la localización y función de las proteínas codificadas por estos genes [13][166][167]:
·son parte de la estructura o participan en la función del diafragma de filtración: NPHS2, NPHS1, CD2AP, TRPC6.
·forman el citoesqueleto de actina: ACTN4, INF2, MYO1E, ARHGAP24, ANLN, APOL1
·son proteínas nucleares y factores de transcripción WT1, PAX2
·son proteínas de la MBG: COL4A3/4/5/6
·son proteínas mitochondriales: COQ2, COQ6, PDSS2, COQ8 (ADCK4), MT-TL1
·son proteínas lisosomales: SCARB2
·son proteínas del aparato ciliar: TTC2B1 (nefronoptisis)
-según su patrón de herencia:
·autosómico recesivo (NPHS1, NPHS2, COQ8B (ADCK4), MYO1E, APOL1, ARHGAP24, COQ2, COQ6, COQ8 (ADCK4), SCARB2, TTC2B1): la mayoría lo son habitualmente. La clínica debuta en edad pediátrica, la penetrancia es completa, el SN grave [13].
·autosómica dominante (WT1, INF2, PAX2, LMX1B, TRPC6, ACTN4, ANLN): se suelen presentar en adolescentes o adultos jóvenes [15]. La penetrancia es variable, el SN no es grave y hay una progresión lenta hacia la insuficiencia renal crónica.
·AR/AD: CD2AP
·Ligada al cromosoma X: COL4A5
·AR/AD, DIGÉNICA: COL4A3/4/5
·Herencia materna (ADN mitocondrial): MTTL1
-si están asociados a una forma sindrómica:
·INF2: enfermedad de Charcot Marie-Tooth
·LMX1B : síndrome uña-rotula
·PAX2 : CAKUT,coloboma
·MTTL1 : MELAS (mitochondrialencephalomyopathy, lactic acidosis, stroke-like episodes)
·COQ2, COQ6, PDSS2,COQ8 (ADCK4) : Déficit coenzima Q10 (afectación SNC, retraso del crecimiento, sordera sensorial)
·TTC21B: nefronoptisis
·SCARB2: action myoclonus-renal failure syndrome (AMRF)
·COL4A3/4/5 : síndrome de Alport
En el caso de COL4A3/4/5, COQ8B (ADCK4), CRB2, INF2, LMX1B, and WT1, el fenotipo puede consistir en una manifestación renal aislada.
Los más frecuentes en el adulto son los siguientes:
COL4A3, COL4A4 and COL4A5 (genes del colágeno IV)
Las mutaciones en estos genes son causa del Síndrome de Alport. Son, con mucha ventaja, las más frecuentes de las mutaciones identificadas en las formas hereditarias de GEFS (> 10% de los pacientes con formas esporádicas y > 30% de los pacientes con formas familiares). Representan del 44 al 56% de todas las mutaciones identificadas en esta enfermedad [168][169].
Muchos pacientes con una variante patogénica en uno de los genes del síndrome de Alport no presentan manifestaciones extrarrenales y se presentan como una forma aislada de GEFS (con microhematuria), aunque se tiene que buscar una posible pérdida de audición y anomalías oftálmicas. La progresión de la ERC suele ser rápida. Se encuentran anomalías de la MBG en la mayoría de los pacientes [13][167][170].
NPHS2 (codifica la podocina, componente del diafragma de filtración)
Las mutaciones bialélicas en el gen NPHS2 son una de las principales causas de SNCR en la edad adulta.
La mayoría de los adultos son portadores de una variante de secuencial p.R229Q y de una mutación en el segundo alelo en heterozigosis compuesta [171].
La variante p.R229Q solo es patogénica si se asocia con una mutación situada en el extremo C-terminal de un alelo del gen NPHS2 que ejerce un efecto dominante-negativo. Los individuos con esta variante en homocigosis son asintomáticos [172].
El patrón de herencia es autosómico recesivo, aunque en algunos casos las mutaciones aparecen de novo.
Gen INF2 (codifica la proteína formina invertida 2, inverted formin 2: implicada en los procesos de polimerización de la actina y de los microtúbulos)
Codifica la proteína inverted formin 2 (INF2), miembro de la familia de las forminas. Estas proteínas tienen un dominio de unión a la actina y estabilizan la polimerización de los monómeros de actina formando los microfilamentos.
Se han identificado mutaciones en el gen INF2 en heterocigosis en el 12-17% de familias con SNCR/GEFS con patrón de herencia autosómico dominante.
Estas mutaciones tienen una penetrancia incompleta y una expresividad variable: proteinuria no nefrótica en la adolescencia o edad adulta.
La herencia es autosómica dominante. Las edades de diagnóstico de la proteinuria y de aparición de la ERC estadio 5 son muy variables (11 a 72 años y 13 a 67 respectivamente) [173][174].
Algunas mutaciones en el gen INF2 son las principales causas de la GEFS asociada a la enfermedad de Charcot-Marie-Tooth (neuropatía periférica sensitivo- motora hereditaria). La mayoría de estos pacientes presentan mutaciones en el exón 2. Desarrollan proteinuria entre los 7 y 30 años y neuropatía durante la segunda década de vida [174].
Gen TRPC6 (codifica el canal de receptor transitorio de potencial catiónico 6)
Es un canal catiónico poco selectivo, permeable al calcio, asociado a la podocina en el diafragma en hendidura. Mutaciones en el gen TRPC6 en heterocigosis son responsables de un 5% de familias con SNCR/GEFS con patrón de herencia autosómico dominante.
No obstante, la penetrancia es incompleta y la expresividad variable [175].
Los pacientes presentan proteinuria de rango nefrótico generalmente en la tercera o cuarta década, aunque también se han descrito casos pediátricos. Progresan hacia la ERC grado V en 10 años. No se han descrito manifestaciones extrarrenales asociadas a mutaciones en TRPC6 [167].
Gen ACTN4 (codifica la alpha actina 4,a-actinin-4, actin-binding protein)
La alpha actina 4 establece puentes entre los filamentos de actina. Son mutaciones en heterozigosis responsables de un porcentaje muy bajo de los SNCR. Los pacientes debutan con proteinuria durante la adolescencia y llegan a la ERC grado V en unos 10 años [176].
Gen COQ8B/ADCK4 (coenzima Q8B, codifica una cinasa (aarF domain containig kinase 4, ADCK4)
Es uno de los genes responsables de la síntesis de la coenzima CoQ10. Es responsable en adolescentes de un SNCR/GEFS aislado o asociado a una forma síndrómica. Con menos frecuencia se puede ver un déficit del CoQ10 con afectación glomerular en caso de mutaciones en los genes COQ2, COQ6, PDSS2. El patrón de herencia es autosómico recesivo, producen una pérdida de función de ACDK4 con descenso de los niveles de CoQ10 y reducción de la migración de los podocitos.
El déficit en CoQ10 se caracteriza por una gran variabilidad clínica dependiendo del gen afectado [177]. El diagnóstico es importante ya que la suplementación precoz con COQ10 puede disminuir los síntomas, en particular la proteinuria [166].
LMX1B (“lim homeobox transcription factor 1 beta”, factor de transcripción del DNA).
En el niño mutaciones en heterozigosis del gen LMX1B son la causa del síndrome uña-rótula.
Algunas mutaciones específicas de este gen provocan una GEFS que debuta en la edad adulta, sin manifestaciones extra renales, y son de herencia autosómica dominante [178].
Genes del desarrollo renal
WT1:
El gen WT1 codifica un factor de transcripción implicado en el desarrollo renal y gonadal. Las mutaciones en heterozigosis son causa de un amplio espectro de enfermedades sindrómicas de herencia autosómica dominante, principalmente Síndrome de Denys Drash y Síndrome de Frasier.
Mutaciones de este gen también pueden ser responsables de una GEFS aislada en adolescentes o adultos jóvenes [167][179].
PAX2 (Paired Box gene2)
. El gen PAX2, con herencia autosómica dominante, codifica un factor de transcripción implicado en el desarrollo del aparato urinario, del ojo, del oído y del sistema nervioso y es causa de malformaciones severas del aparato urinario. Se han descrito pacientes con mutaciones en PAX2 con hipodisplasia renal aislada o GEFS, sin alteraciones extrarrenales [180].
Genes del aparato ciliar
Mutaciones en el gen TTC2B1 (que codifica la proteína IFT139, ciliary retrograde intraflagellar transport-A protein) son algunas de las causas de nefronoptisis. La mutación más frecuente (p.P209L) está presente en familias con GEFS. El fenotipo correspondiente asocia HTA, ERC a la edad adulta y a nivel histológico, GEFS y engrosamiento de la MB tubular [181]..
APOL1 (apolipoprotein L1, high-risk polymorphisms)
El gen APOL1 tiene una variante de riesgo para el desarrollo de una ERC (que protege contra el tripanosoma brucei), presente en el 35% la población general de ascendencia africana en EU, en el 26% de la población de África Central y en el 50% de la población de África del Oeste. El 40% de los pacientes con una ERC por una GEFS son de raza negra. Comparados con los que tienen una sola variante o no tienen ninguna, el riesgo de desarrollar una GEFS, con una velocidad de progresión más rápida, esta multiplicado por 3 a 5. La GEFS asociada a una variante de riesgo del gen APOL1, aunque no es una forma monogénica por no ser causal sino un factor de riesgo, es de lejos la forma genética más habitual en países con poblaciones importantes de descendencia africana.
La variante de riesgo del gen APOL1 se encuentra en homozigosis (G1/G1 o G2/G2) o heteregozigosis compuesta (G1/G2). La forma de transmisión es autosómica recesiva y la penetrancia incompleta [182] [183].
¿Cuándo se tiene que realizar un estudio genético a un adulto con SNCR/GEFS?
En los últimos años han disminuido considerablemente los costes de los estudios genéticos gracias a las técnicas de secuenciación masiva (permiten la secuenciación simultánea de todos los genes relevantes para un determinado fenotipo a un coste y tiempo de respuesta mucho más reducido que con el método de Sanger y con una sensibilidad comparable). Esta mejoría será aun mayor cuando se incorporen a la rutina del diagnóstico genético los secuenciadores de tercera generación que permiten secuenciar fragmentos de ADN considerablemente más largos [184][185].
En el paciente adulto con GEFS/SNCR sería recomendable realizar el estudio genético (Tabla 4):
-si presenta una historia familiar de enfermedad renal y/o manifestaciones extrarrenales, teniendo en cuenta que:
. las mutaciones en genes que habitualmente causan formas sindrómicas pueden también manifestarse como una GEFS aislada: es el caso de LMX1B asociado al síndrome de uña-rótula, del gen PAX2 responsable de anomalías congénitas del riñón y del tracto urinario (CAKUT) y del coloboma del nervio óptico, de COL4A3/4/5, COQ8B (ADCK4), INF2 y de WT1) [167]
. la interpretación de variantes candidatas puede verse dificultada en el adulto por la ausencia de miembros de la familia (no permite la segregación familiar de la variante) y por la falta de una historia familiar si la variante tiene una penetrancia incompleta, una herencia autosómica recesiva o existe un mosaicismo germinal [14].
-frente a una GEFS clasificada como primaria (con los criterios diagnósticos anteriormente presentados) pero CR [14]
-en caso de discordancia entre los datos de la ME y la forma de debut [14]
-en caso de una forma aparentemente secundaria, pero sin causa identificada [14]
- en presencia de alteraciones de la MBG en la ME [177]
-si necesita un TR, para la selección del donante familiar y valorar el riesgo de recidiva [166].
¿Hasta qué edad?
La posibilidad de que se diagnostique una alteración genética en un paciente con GEFS disminuye según aumenta la edad de debut de la enfermedad (69% en los 3 primeros meses de vida, 50% de 4 a 12 meses), 25% de 13 meses a 6 años, 18% de 7 a 12 años, 11% de 13-18 años y 21% de 19 a 25 años) [14].
En el adulto, se han realizado pocos estudios utilizando paneles amplios o que incluyan casos esporádicos. La frecuencia de las formas hereditarias varía en los estudios actuales del 8 al 12% [167][184].
Es probable, como se ha demostrado recientemente, que realizando una correcta valoración de los criterios diagnósticos a favor de una forma genética en cada paciente (Figura 1), se consiga mejorar considerablemente, como publicado recientemente, el rendimiento de los estudios genéticos en el adulto [14][168].
Las mutaciones en los genes que no están relacionados con la enfermedad del colágeno suelen estar presentes cuando la proteinuria aparece antes de los 25 años, en cambio las mutaciones en los genes relacionados con la enfermedad del colágeno pueden estar presentes en pacientes diagnosticados a los 50 o 60 años [14][178].
Beneficios del estudio genético
La identificación de una forma hereditaria de SNCR/GEFS aporta grandes beneficios: permite entender el mecanismo fisiopatológico de la enfermedad, hacer un seguimiento de las manifestaciones extra renales cuando existen, proporcionar asesoramiento genético preciso y confirmar o descartar la enfermedad en otros miembros de la familia, evitar un tratamiento IS inútil y con efectos secundarios, saber que no hay riesgo de recidiva después del TR y asesorar a los familiares en caso de donante vivo [177].
Se tiene que interrogar y explorar correctamente al paciente buscando manifestaciones extra renales, realizar un árbol genealógico (descartando consanguinidad de los padres y enfermedad renal en los familiares) y buscar una alteración del sedimento en los familiares.
La lesión podocitaria puede ser el resultado de una sola causa (alteraciones monogénicas y la mayoría de las formas primarias), pero en algunos casos se necesita más de un estímulo patogénico para provocar la pérdida de podocitos. Por ejemplo, en las formas con implicación de las variantes de riesgo del gen APOL1, se necesita otro mecanismo fisiopatológico (vírico como la infección por el VIH [46][47][142][166]. Otros factores que pueden contribuir a la lesión podocitaria son el bajo peso al nacer, la prematuridad, la obesidad, la enfermedad hipertensiva del embarazo, episodios previos de fracaso renal agudo, la exposición a nefrotóxicos y la edad avanzada.
Formas secundarias
En todas las formas secundarias existe un aumento del estrés mecánico que se ejerce sobre la pared lateral de los pedicelos a través del diafragma en hendidura. Es debido a la hipertensión intraglomerular que se produce como mecanismo de compensación a la disminución del número de nefronas. Aumenta el FG por nefrona única para conseguir un FG global normal [78]. El estrés mecánico está elevado en la porción inicial del ovillo y va disminuyendo hasta llegar a la arteriola aferente. Esto explica la distribución heterogénea de la fusión de los pedicelos en el ovillo [81][82].
Las formas secundarias debutan habitualmente con una proteinuria no nefrótica y una insuficiencia renal. No responden al tratamiento inmunosupresor y evolucionan lentamente hasta la ERC estadio V. No recidivan después del trasplante renal [45].
Respuesta adaptativa a la hiperfiltración:
Disminución de la masa renal: las causas son múltiples (Tabla 1). Para mantener un FG global normal, aumenta la presión de filtración intraglomerular y el volumen glomerular. Después de un tiempo de evolución variable, dependiendo en parte de la utilización de los inhibidores del SRAA, se producen las lesiones de esclerosis y la disminución del FG como hemos visto anteriormente.
Si la pérdida de masa renal es superior al 75% aparece una GEFS [186], si es igual al 50% (donante de vivo por ejemplo) aumenta el riesgo de proteinuria y se puede desarrollar una ERC si están presentes otros factores de riesgo (morbilidades asociadas o susceptibilidad a la enfermedad del donante si son familiares) [187][188][189]. En caso de riñón único congénito, existe un riesgo mayor de proteinuria y de ERC en ausencia de hipertrofia compensadora o de otra anomalía congénita (CAKUT) [188][189].
Todas las causas de ERC provocan la pérdida de nefronas sanas (también ocurre en la edad avanzada). Esto implica un aumento del FG en las nefronas restantes [190][191].
Otros de los mecanismos son: el aumento del volumen glomerular que se asocia a la obesidad, al aumento extremo de masa muscular, la disminución del número de nefronas (bajo peso al nacer o prematuridad). En esta situación, los podocitos no aumentan su volumen y no pueden cubrir toda la superficie del ovillo glomerular hipertrofiado [192][193][194][195][196].
Obesidad
Algunos pacientes obesos tienen una proteinuria y una GEFS denominada glomerulopatía relacionada con la obesidad (GRO) [197]. A veces solo presentan una glomerulomegalia sin evidencia de esclerosis [198]. El aumento de masa corporal provoca una hiperfiltración por nefrona única, aumento del tamaño glomerular y el resto de los mecanismos fisiopatológicos descritos anteriormente [196][197][198][199][200].
Es probable que los estadios iniciales sean reversibles puesto que la pérdida de peso y la administración de inhibidores del SRAA permiten disminuir la proteinuria [197][201][202].
En ausencia de tratamiento, 10 a 30% de los pacientes llegan a la ERC-5 [197].
Se desconoce por qué algunos individuos obesos desarrollan este tipo de glomerulopatía y otros no. La incidencia de la GRO se ha multiplicado por 10 entre los años 1986 y 2000. La coincidencia frecuente de la GRO con otros procesos fisiopatológicos (enfermedades renales, hipertensión arterial o edad avanzada), potencia la aparición de la lesión renal.
Enfermedades virales
Una de las formas más conocidas es la nefropatía asociada al VIH (NVIH).
Es particularmente frecuente entre la población de descendencia africana (sobre todo de África del Oeste), donde la presencia de 2 alelos de riesgo en el gen APOL1 es muy frecuente [203][204].
Puede ser una complicación no solo de los estadios avanzados de la infección, ya que también puede aparecer en fases iniciales. La proteinuria puede ser de rango no nefrótico [205][206], pero la progresión de la ERC suele ser rápida [207].
La lesión habitual es la forma colapsante asociada a un infiltrado intersticial y a lesiones tubulorreticulares visibles en ME [208].
No se llega a conocer la causa de la GEFS de una parte importante de los pacientes con una forma secundaria. Probablemente muchos de ellos tienen una causa genética que no se puede diagnosticar con los paneles de los que disponemos.
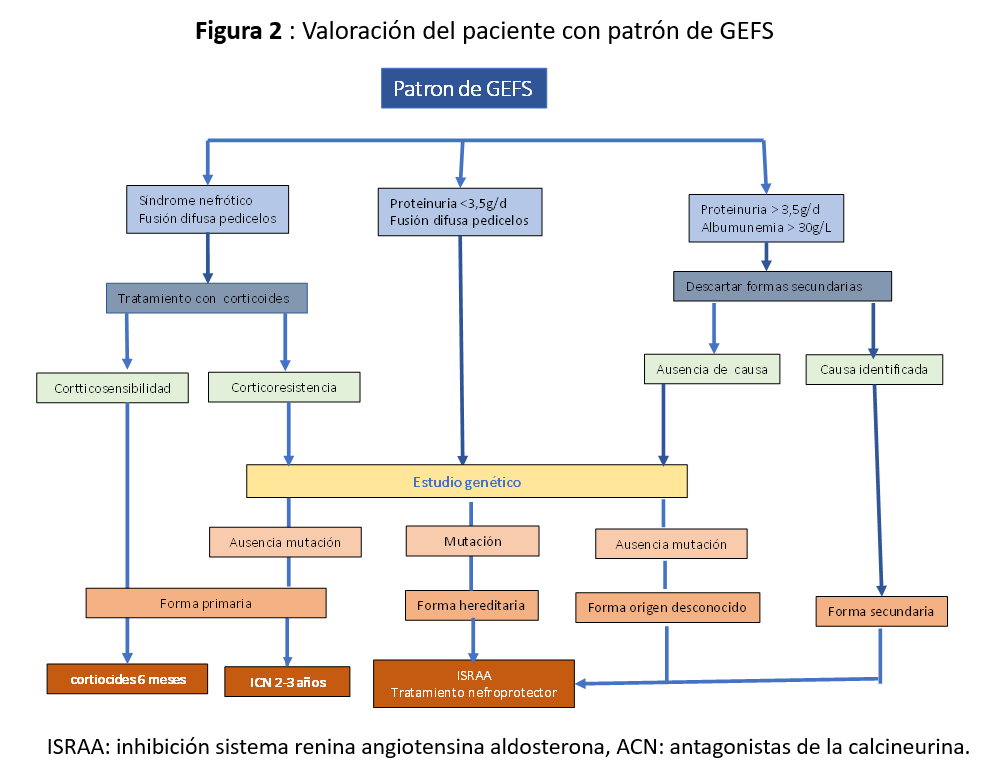
Con los medios de los que disponemos en la actualidad, el clasificar un paciente con GEFS en uno de los grupos fisiopatológicos tiene que ser nuestro principal objetivo. Nos tenemos que apoyar en un estudio clínico e histológico, acompañados o no de un estudio genético (Figura 2) y (Tabla 4).
TRATAMIENTO
Tratamiento de las formas primarias
Los corticoides son el tratamiento de primera línea. El efecto depende en parte de la duración del tratamiento:
-si es inferior a 16 semanas, se consigue una RC o RP en el 15% de los casos, si es superior a 16 semanas, se consigue una RC en el 61% de los casos [56],
- la duración media del tratamiento de los respondedores es superior en 5,7 meses a la de los no respondedores [209].
La dosis inicial recomendada por la mayoría de los autores es de 1mg/kg/d (máximo 80mg/d) o 2 mg/kg/d a días alternos (máximo 120mg/d) hasta conseguir la remisión. Esta dosis no debe ser administrada más de 16 semanas. Se suspenden los corticoides antes de la semana 16 si no se observa una disminución de la proteinuria (los respondedores inician el descenso de la proteinuria a partir de las 8 semanas), sobre todo en presencia de efectos secundarios graves. Una vez conseguida la remisión completa, se inicia 2 semanas más tarde, la disminución de la dosis de corticoides de forma progresiva (5 mg/semana) y se suspenden a los 6 meses del inicio. El mismo protocolo se aplica en caso de recidiva [6][64][209][210][211].
Los anticalcineurínicos (ACN) están indicados como tratamiento de segunda línea en casos de CR, de recaídas frecuentes, de intolerancia o de contraindicación relativa a los corticoides (osteoporosis grave, obesidad, enfermedad psiquiátrica) [189][190][191][192][193][194][195][196][197][198][199][200][201][202][203][204][205][206][207][208][209][2010][211][212]. En este último caso se pueden administrar desde el inicio, sin corticoides [190][191][192][193][194][195][196][197][198][199][200][201][202][203][204][205][206][207][208][209][2010][211][212][213].
El principal mecanismo de acción de la Ciclosporina A (CsA) es la inhibición de la calcineurina, una fosfatasa dependiente del Calcio iónico. La calcineurina, al desfosforilar los factores de transcripción NFAT (nuclear factor of activated T cells), permite su translocación en el núcleo y la activación linfocitaria. Los anticalcineurínicos impiden este fenómeno. El Tacrolimus inhibe la activación de los linfocitos-T al unirse a la proteína intracelular FKBP12, formando un complejo que inhibe de forma competitiva la calcineurina.
La dosis inicial de Ciclosporina (CsA) es de 3-7mg/k/d, en dos dosis, y se ajusta posteriormente para conseguir niveles valle de 100-175 ng/ml [6]. El tacrolimus se inicia a la dosis de 0,05-0,1 mg/kg/d para conseguir niveles de 5-10 mg/ml. Se recomienda un mínimo de 6 meses de tratamiento para valorar la respuesta. Se observa un 47% de RC o RP según la última revisión de la Biblioteca Cochrane [213]. El riesgo de recaídas es muy alto después de la suspensión (60-80% al año). Para evitarlas se mantienen los niveles plasmáticos mencionados 12 meses si se consigue una RC o una RP [214] [215][216][217]. Posteriormente, se disminuye de forma progresiva la dosis de los anticalcineurínicos durante 12 meses hasta suspenderlos. Algunos autores recomiendan realizar una biopsia renal después de 18-24 meses de tratamiento para diagnosticar una posible nefrotoxicidad. Los efectos secundarios de la CsA (hipertricosis, hipertrofia gingival) hacen que sea más utilizado el tacrolimus [215].
En la revisión de la Biblioteca Cochrane ya mencionada, se analizan cinco estudios controlados que incluyen 240 pacientes: la CsA asociada o no a la prednisona y comparada con micofenolato mofetil o dexametasona, aumenta la posibilidad de conseguir una RC (RR 2.31, 95% CI 1.13-4.73) o una RP (RR 1.64, 95% CI 1.10- 2.44) [213].
Micofenolato Mofetil (MMF): No hay ningún estudio que haya comparado el MMF a los corticoides, solo disponemos de algunos estudios observacionales sin resultados concluyentes [218][219].
Rituximab: es un anticuerpo monoclonal quimérico dirigido contra el antígeno CD20 situado en la superficie celular de los LB. Ha demostrado, en las formas CD, ser capaz de mantener una remisión prolongada en el niño [220][221].
En un reciente estudio multicéntrico, 346 niños con SN CD reciben una media de 3,4 dosis de rituximab (de 2 a 7). El seguimiento medio es de 6 años (4,3-7,7). La duración de los periodos de remisión aumenta con el número de tratamientos: la primera recidiva ocurre a los 10 meses (IC: 9,0-10,7), la última a los 16 meses (13,3- 19,7) aunque la duración del periodo de depleción de los LB se mantiene idéntica (6,1 meses: 6,0-6,3). La reconstitución de los LB coincide en el 70% de los casos con un nuevo brote de la enfermedad (2,6 meses después de media). En el 30% de los casos restantes, no se produce ningún brote. Los autores aconsejan no tratar de formar profiláctica una vez reconstituida la población de LB y hacerlo solo en caso de nuevo brote. Los efectos secundarios son raros y sin gravedad: hipogammaglobulinemia (51%), infecciones (4,5%), neutropenia (3,7%). Al final del periodo de estudio, el 96% de los niños tienen una función renal normal [222].
En el adulto, se observan resultados favorables en estudios observacionales, retrospectivos, o con pocos casos incluidos [223][224][225]. El estudio de GLOSEN [200] incluye 50 adultos con SNCD o con recaídas frecuentes (28 se tratan con rituximab, 22 con otros inmunosupresores y constituyen el grupo control): 83% consiguen una RC en el grupo rituximab, 63% en el grupo control. La incidencia de recaídas por año y la cantidad de IS necesaria para mantener la remisión son menores en el grupo Rituximab.
Disponemos además de un estudio controlado reciente que no muestra ninguna ventaja del rituximab sobre el tacrolimus [226].
No es eficaz en caso de CR [204-227].
Los efectos secundarios son tolerables [228].
Hay dos posibles protocolos de inicio: 4 dosis de 375mg/m2 semanales o dos dosis de 1 gramo separadas por quince días. Es posible que una sola dosis de 375mg/m2 sea suficiente para inducir la remisión [229].
El rituximab persiste en sangre durante al menos 6 meses y la recuperación de los LB se produce a los 12 meses [228].
Se desconoce cual es el mejor tratamiento posterior para evitar las recaídas: administración de 1g, 500mg o 375mg/m2 cada 6 meses o solo después de la repoblación de células B (el brote de SN coincide en muchas ocasiones con la recuperación de los LB, especialmente de los LB transicionales CD19+. Pero en algunas ocasiones, la recuperación de los LB no es un predictor de brote, una remisión puede persistir a pesar de la repoblación de LB y un brote ocurrir persistiendo la depleción de LB. Es probable que la recuperación de LB memoria conmutados sea más útil para predecir un brote [230][231][232]. El rituximab parece reducir, en los SN CD o con recaídas frecuentes, el número de recaídas y la dosis de corticoides necesaria para mantener la remisión. Se tienen que confirmar los datos de los trabajos publicados. Tres ensayos controlados para estudiar eficacia y efectividad del rituximab están actualmente incluyendo pacientes con GEFS/NCM: TURING (EudraCT: 2018-004611-50), RIFIREINS (NCT03970577) y (NCT03298698) [5].
Los corticoides, los ACN y el rituximab tienen un efecto protector directo sobre los podocitos estabilizando el citoesqueleto de actina: los corticoides aumentan la expresión de la nefrina, la CsA inhibe la desfosforilación de la sinaptopodina, el rituximab restablece la expresión de la fosfodiesterasa ácida de esfingomielina 3B (SMPDL3B), disminuida en las GEFS y necesaria a una correcta función del citoesqueleto [233][234][235].
Dapagliflozina: los inhibidores del cotransportador sodio-glucosa tipo 2 (SGLT2i) son capaces de disminuir la hiperfiltración glomerular y de proporcionar un efecto nefroprotector a largo plazo en varias nefropatías incluidas la GEFS [236][237][238].
Hay actualmente un ensayo clínico en marcha incluyendo pacientes con GEFS (EMPA-KIDNEY trial) [238].
Sparsentan (bloqueador del receptor de endotelina A y del receptor de la angiotensina I). Un estudio aleatorizado, multicéntrico, doble ciego que compara los efectos del Sparsentan al del Irbesartan (bloqueador del receptor de la angiotensina II), en las formas primarias o genéticas de GEFS, ha demostrado que a las ocho semanas consigue una mayor reducción de la proteinuria que el Irbesartan [239]. Este fármaco también es útil cuando la proteinuria no es nefrótica o después de haber conseguido una RP con el tratamiento IS [240].
Quedan muchas dudas sobre el tratamiento:
-los ensayos clínicos tienen que incluir pacientes correctamente clasificados según los grupos etiológicos descritos y solo se tienen que utilizar IS en las formas primarias.
-el seguimiento tiene que ser suficiente para valorar lo efectos secundarios a largo plazo de los tratamientos biológicos.
-en las formas CD se debe valorar la asociación de dos IS o la prolongación del rituximab para aumentar los periodos de remisión.
Tratamiento de mantenimiento: se debe comparar los distintos protocolos del tratamiento de mantenimiento con rituximab (dosis, periodicidad, duración).
Hay nuevos tratamientos, algunos están en fase de ensayo clínico: aféresis, adalimumab, fresolimumab, galactosa a dosis elevadas y ofatumumab.
Tratamiento de las formas secundarias
Siempre que sea posible se tiene que tratar la causa: pérdida de peso en caso de obesidad, suspensión del fármaco o tóxico responsables etc.
El tratamiento nefroprotector es el mismo que el que se aplica a todos los pacientes con proteinuria: restricción de sal, diuréticos de asa y tiazidas si es necesario, ISRAA para controlar de forma estricta la TA. Se deben emplear las dosis máximas toleradas. La dapagliflozina se debe incorporar al tratamiento nefroprotector. También es importante la pérdida de peso en general y el hacer ejercicio [59].
Los corticoides y anticalcineurínicos no están indicados.
Tratamiento de las formas genéticas.
Estas formas no responden a los IS, pero los inhibidores del SRAA disminuyen, en la mayoría de los casos, la proteinuria (se ha demostrado en los pacientes con alguna mutación en los genes COL4) [15].
No obstante, los pacientes con mutaciones en EMP2 o en genes que codifican proteínas que interactúan con las Rho-GTPasas (reguladoras del citoesqueleto de actina) presentan una remisión parcial con los corticoides, lo que hace suponer que tienen estos un efecto directo sobre la función de los podocitos.
También pacientes con otras mutaciones, WT1 por ejemplo, pueden responder parcialmente a los anticalcineurínicos [241][242][243][244].
Los pacientes con mutaciones en el gen COQ8B/ADCK4 deben recibir una suplementación precoz con COQ(10) [177].
Recidiva después del TR de las formas primarias
La recidiva de una GEFS solo ocurre en las formas primarias. Lo hace en el 30 a 60% de los pacientes después de un primer TR y en el 80% a 100% después de un segundo TR, en caso de recidiva en el primero. Ocurre de forma inmediata en algunos casos, en general durante las primeras semanas después del TR. El riesgo de la pérdida del injerto es, después de la recidiva, del 40-60% [1][99][149].
Los principales factores de riesgo para la aparición de una recidiva son [8][245]:
·el inicio de la enfermedad a una edad temprana
·una velocidad de progresión rápida (< 3 años) de la enfermedad inicial hasta una ERC estadio 5
·la nefrectomía previa de los riñones propios
·la existencia de una recidiva en un TR anterior
·una albuminemia < 25g/l en el momento del diagnóstico
La aparición de una proteinuria, con o sin SN, hace sospechar la recidiva. El diagnóstico definitivo lo da la biopsia del injerto. Si es precoz, se observa un riñón ópticamente normal con fusión difusa de los pedicelos en ME. Las lesiones de esclerosis aparecen más tardíamente [99].
La recidiva, como hemos visto anteriormente, es debida a la presencia de un factor circulante. El tratamiento de la recidiva, adoptado por la mayoría de los grupos, está basado en los intercambios plasmáticos asociados o no al rituximab [245][246][247].
Este tratamiento, utilizado de forma preventiva, no evita la recidiva según la mayoría de los trabajos publicados. Pero estos son estudios observacionales, incluyen pocos casos, no disponen de un estudio genético y no son homogéneos en cuanto al tratamiento IS, la dosis de rituximab y el protocolo de plasmaféresis [246][247][248][249][250].
Si la recidiva es precoz (menos de 3 meses), se consigue una RC o RP en el 60-75% de los casos con intercambios plasmáticos iniciados inmediatamente después de la recidiva [99][251][252].
La adición de rituximab no aporta beneficios claros [247][250][253][254]. Un ensayo clínico, controlado, está actualmente en fase de reclutamiento. Su objetivo principal es comparar la eficacia de la plasmaféresis asociada o no al rituximab en la prevención de la recidiva de una GEFS (NCT03763643).
Las sesiones de plasmaféresis se prolongan 15 días, una sesión cada 48h. Se valora la necesidad de sesiones adicionales según la respuesta al tratamiento. Se suele utilizar la albumina como liquido de reposición y se recambia una a una vez y media el volumen plasmático por sesión. Habitualmente se administra una o dos dosis de Rituximab (375mg/m2).
Si la recidiva es tardía (más de 3 meses), se debe descartar una forma secundaria.y aplicar el mismo tratamiento que en el caso de una recidiva precoz.
En ausencia de respuesta a los intercambios plasmáticos con o sin rituximab se han utilizado tratamientos alternativos cuya eficacia testa por confirmar [255][256][257][258].
La supervivencia del injerto, a pesar del tratamiento, es baja: 52-61% a los 5 años [245].
No parece aconsejable realizar un segundo TR si ha habido una recidiva en el primero ya que se desconoce en este momento un tratamiento eficaz para prevenir la recidiva [252].
Conclusión
La GEFS es un patrón histológico que corresponde a varias enfermedades con etiologías, mecanismos fisiopatológicos y tratamientos distintos.
Antes de iniciar el tratamiento se tiene que hacer el diagnóstico diferencial entre estas enfermedades (formas primarias, secundarias y genéticas). Para ello son necesarias una historia clínica y una exploración física recogidas de forma exhaustiva, el estudio histológico (en algunos casos la ME si se dispone de ella a pesar de sus limitaciones) y también en algunos casos el estudio genético.
Las formas hereditarias no son a menudo diagnosticadas y veremos en el futuro cual es la prevalencia real de las formas con autoanticuerpos.
Solo se deben tratar con IS las formas primarias.
Se sigue progresando en el conocimiento del SNI. La información conseguida permitirá una clasificación basada en los mecanismos fisiopatológicos, con dianas terapéuticas específicas.