Glomerulonefritis Membranoproliferativa
INTRODUCCIÓN
La Glomerulonefritis membranoproliferativa (GnMP) también llamada Glomerulonefritis mesangiocapilar, incluye un grupo de nefropatías glomerulares poco frecuentes que comparten una lesión histológica característica, y que pueden originarse por muy diversos mecanismos patogénicos. Deberíamos considerar a la GnMP más como una lesión que como una enfermedad como tal, y el hallazgo de este patrón histológico en una biopsia renal obliga a comenzar un proceso diagnóstico etiológico. El patrón glomerular característico consiste en hipercelularidad mesangial, engrosamiento de la membrana basal glomerular e interposición mesangial en la pared capilar, adoptando con frecuencia el glomérulo un aspecto lobulado. Estos cambios en la microscopía óptica se producen como resultado del depósito de inmunoglobulinas, factores del complemento o ambos, en la pared capilar y en el mesangio. Aunque algunas enfermedades asociadas al patrón de GnMP son bien conocidas, avances en el conocimiento de los mecanismos patogénicos y la identificación de su asociación con otras patologías, motivaron un cambio en la clasificación histológica y en el enfoque diagnóstico y terapéutico de esta glomerulonefritis [1].
EPIDEMIOLOGÍA
La prevalencia de GnMP ha disminuido a lo largo de los años en Europa y EE.UU., como lo muestran los estudios de biopsias renales, con una prevalencia actual del 1 al 4%. En España supone, según datos del Registro Español de Enfermedades Glomerulares, el 4% de la patología glomerular biopsiada, y constituye la cuarta causa de enfermedad renal terminal secundaria a glomerulonefritis. Por el contrario, esta patología es una de las más frecuentes en países en vías de desarrollo (Asia, África y Sudamérica), con frecuencias que varían entre el 20 y el 50% en las series de biopsia renal. Las formas idiopáticas son más prevalentes en población infantil y adultos jóvenes, frente a las formas secundarias que se diagnostican con más frecuencia en la edad adulta [2].
CLASIFICACIÓN PATOLÓGICA
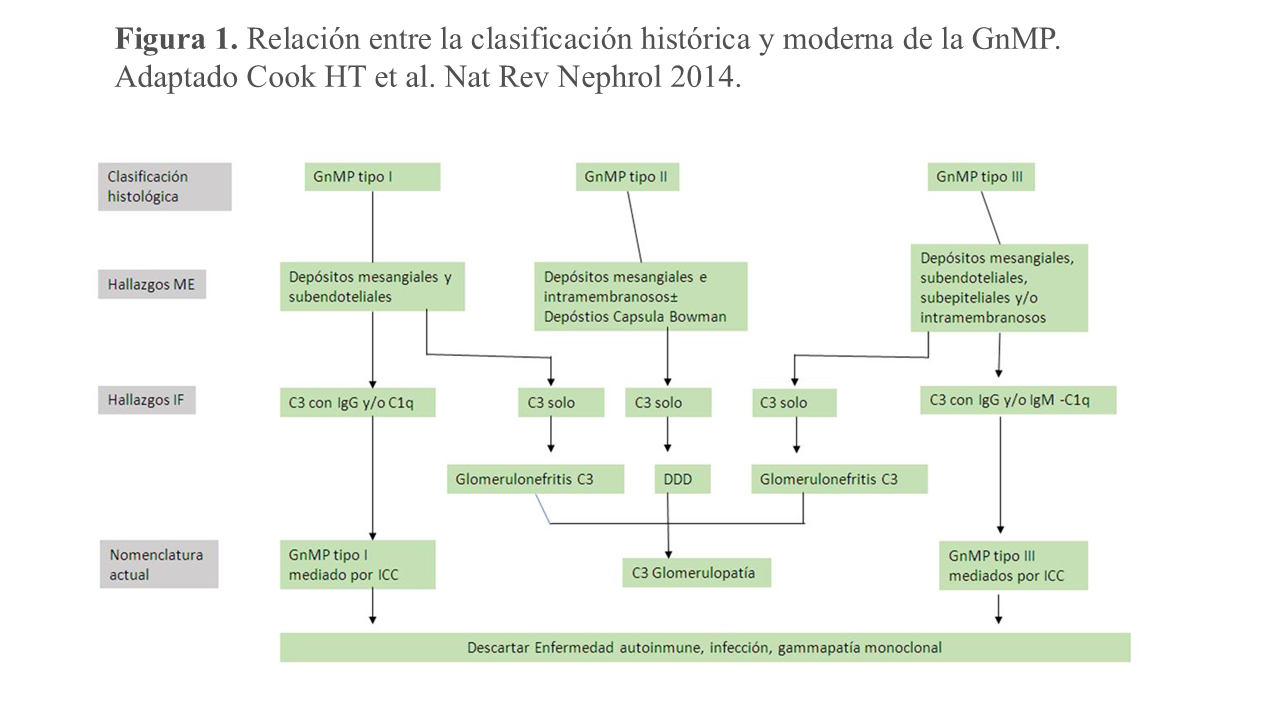
Clásicamente, la GnMP se ha clasificado de acuerdo con los hallazgos de la microscopia electrónica (ME) en tres tipos: Tipo 1: es la forma más frecuente y se caracteriza por la presencia de depósitos inmunes en el mesangio y en el subendotelio. Estos depósitos posible mente proceden en casi todos los casos de inmunocomplejos circulantes. Tipo 2: (también llamada enfermedad de depósitos densos) se caracteriza por la presencia de depósitos continuos a lo largo de la membrana basal del glomérulo, túbulos y capsula de Bowman. Tipo 3: se caracteriza por la presencia de depósitos subepiteliales, mesangiales y subendoteliales. Posteriormente se propuso una nueva clasificación de acuerdo con los hallazgos de la inmunofluorescencia (IF). Esta nueva clasificación, a diferencia de la anterior, no es un mero índice morfológico, sino que añade importantes implicaciones etiológicas y patogénicas. Se proponen dos tipos de GnMP (Figura 1): - GnMP mediada por inmunocomplejos: se caracteriza por el depósito de inmunocomplejos y elementos del complemento. - GnMP mediada por complemento: se caracteriza por el depósito de componentes del complemento en ausencia de inmunocomplejos.
CARACTERÍSTICAS PATOLÓGICAS
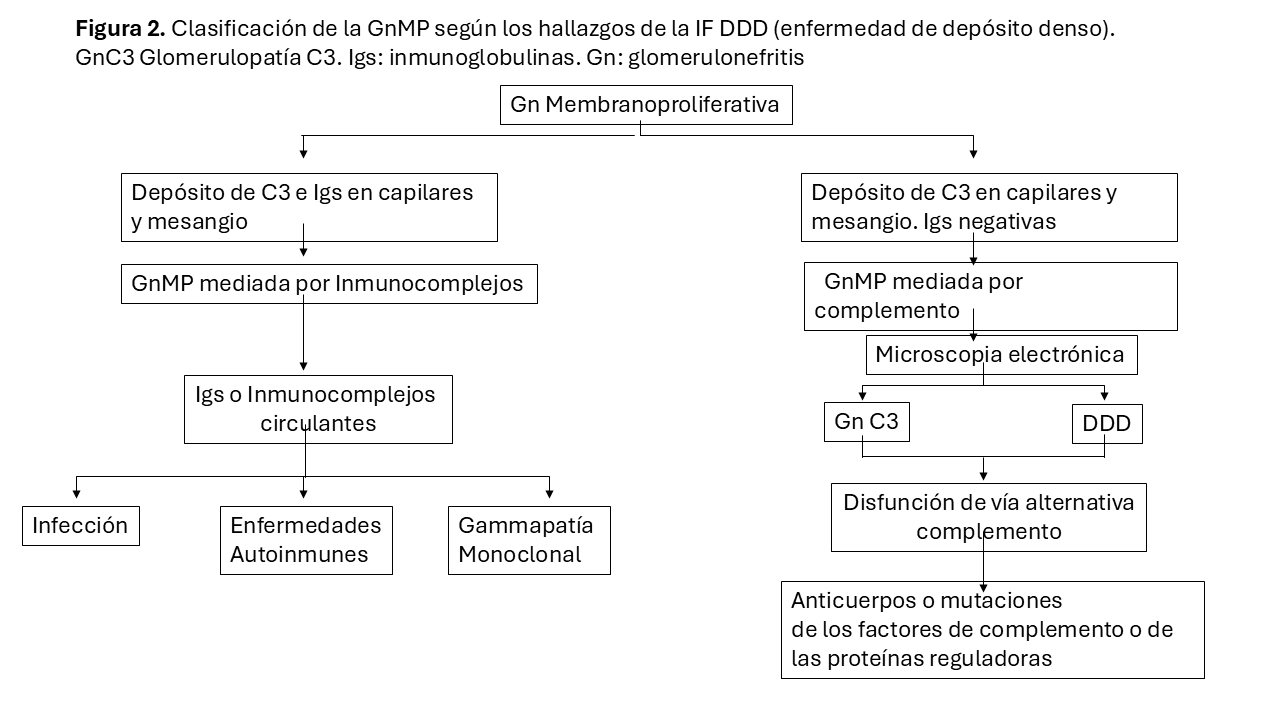
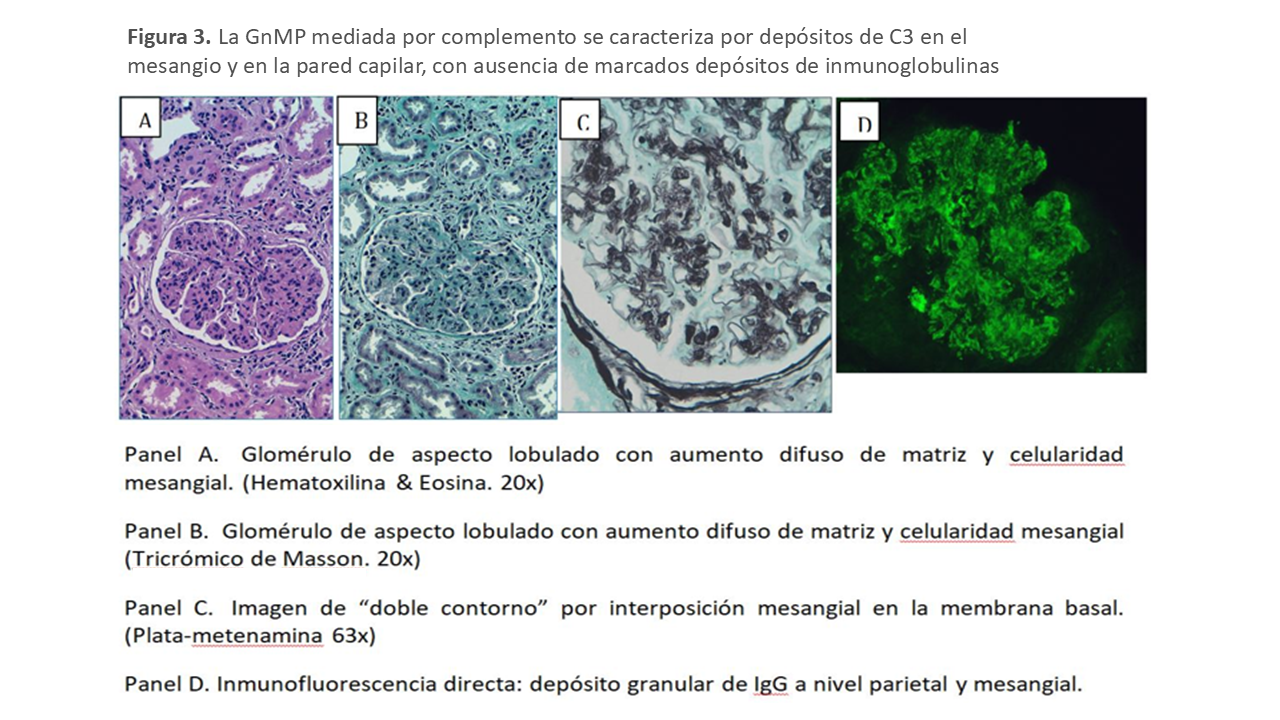
En la GnMP el daño renal inicial ocurre por el depósito de inmunoglobulinas, elementos del complemento o ambos en el mesangio y en el endotelio capilar. Este depósito desencadena la llegada de células inflamatorias y el subsiguiente daño inflamatorio (celular o proliferativo). En una fase reparativa posterior, se generará nueva matriz mesangial (expansión mesangial) y una nueva membrana glomerular que, en conjunto, ofrece la típica imagen de expansión mesangial y doble contorno de la membrana basal de la microscopia óptica. Las alteraciones mesangiales varían de unos pacientes a otros, aunque tienden a ser uniformes entre los glomérulos de una biopsia. A veces el componente exudativo es tan importante que puede sugerir una GN post-infecciosa. La presencia de trombos hialinos en el interior de las luces capilares obliga a descartar la crioglobulinemia o el LES, responsable del patrón histológico membrano-proliferativo. Los trombos hialinos no constituyen trombos verdaderos sino agregados de inmunocomplejos que rellenan las luces capilares. La IF permite distinguir si el daño renal de la GnMP ha sido iniciado por inmunocomplejos o por desregulación de la vía alterna del complemento. De forma genérica, en la primera encontramos depósitos de inmunoglobulinas y factores del complemento de la vía clásica y en la segunda encontramos depósitos mayoritarios de C3. Estos hallazgos son los pilares fundamentales en los que se sustenta la nueva clasificación (Figura 2). Así, la GnMP asociada a gammapatía monoclonal muestra inmunoglobulinas monotípicas con restricción a cadenas ligeras lambda o kappa. La GnMP asociada a infección por VHC típicamente muestra IgM, IgG, C3, kappa y lambda. En el caso de las formas asociadas a enfermedades autoinmunes con frecuencia se observan inmunoglobulinas y proteínas del complemento, IgG, IgM, IgA, C1q, C3 y kappa y lambda. La GnMP mediada por complemento se caracteriza por depósitos dominantes de C3 en el mesangio y en la pared capilar, con ausencia de marcados depósitos de inmunoglobulinas (Figura 3). El microscopio electrónico (ME) revela típicamente depósitos mesangiales y subendoteliales y en algunos casos, intramembranosos y subepiteliales. Esta técnica es incapaz de distinguir entre GnMP mediada por inmunoglobulinas o por complemento. Hay que mencionar que podemos observar un patrón de GnMP sin depósitos inmunes ni de complemento en casos de microangiopatía trombótica cuya patogénica implica un daño endotelial como generador de la glomerulonefritis, también en casos de membrano-proliferativa inducida por fármacos (por ejemplo, inhibidores del factor de crecimiento vascular endotelial o inhibidores de la tirosin-kinasa), en la glomerulopatía crónica del trasplante renal o el síndrome antifosfolipídico.
CLÍNICA
Los pacientes con GnMP pueden presentar una enorme variedad de síntomas y signos, desde microhematuria aislada con o sin proteinuria, hasta la presencia de síndrome nefrótico, sin que exista ninguna relación entre la forma patológica y la forma de presentación. Únicamente en la enfermedad por depósitos densos (DDD) se han descrito asociaciones con lipodistrofia parcial y alteraciones oculares en forma de retinopatía con aparición de drusas, neovascularización y degeneración macular. Si bien se pueden observar formas rápidamente progresivas, la evolución habitual es la lenta progresión de la enfermedad renal.
FORMAS DE GN MEMBRANO-PROLIFERATIVA
1. GnMP mediada por inmunocomplejos
La GnMP mediada por complejos inmunes se produce por la presencia de una antigenemia persistente que genera la formación de complejos antígeno-anticuerpo circulantes. Los complejos desencadenan la activación de la vía clásica del complemento y el depósito de varios de sus factores junto con inmunoglobulinas en la membrana basal y el mesangio, siguiendo el patrón característico de GnMP. Diversas enfermedades podrían inducir este efecto.
1.1 GnMP asociada a VHC
La afectación glomerular que se asocia con más frecuencia a la infección por VHC es la crioglobulinemia tipo II, cuyo patrón histológico suele ser de GnMP tipo I. La asociación de infección por VHC y GnMP sin crioglobulinemia resulta menos frecuente y evidente. El tratamiento de la GnMP asociada al VHC va encaminado a reducir o eliminar la replicación viral, y disminuir secundariamente la formación y el depósito glomerular de inmunocomplejos con el virus. El principal factor pronóstico es la respuesta viral sostenida al menos 12 meses tras finalizar el tratamiento. En los últimos años, el tratamiento con antivirales de acción directa ha demostrado conseguir respuesta viral sostenida en el 95- 99% de los casos, dependiendo del genotipo y de la situación previa del paciente. La indicación y duración de distintas combinaciones de tratamiento antiviral excede el objetivo de este capítulo [3], sin embargo, es importante destacar que el uso de algunos de estos fármacos como el sofosbuvir, un inhibidor de la nucleosin polimerasa, con un excelente perfil de eficacia en los seis genotipos y muy baja resistencia asociadas, está contraindicado en pacientes con filtrado glomerular <30 ml/min [4]. En enfermos con GnMP asociada a VHC que cursan con un brote agudo severo (insuficiencia renal rápidamente progresiva y síndrome nefrítico) o afectación de un órgano vital, se debe plantear tratamiento inmunosupresor y demorar el tratamiento antiviral unos meses hasta el control del cuadro agudo. En estos casos, clásicamente el tratamiento con corticoides y ciclofosfamida fue el tratamiento de elección. Sin embargo, el uso del anticuerpo monoclonal anti-CD20 (rituximab) ha mostrado ser beneficioso en dos ensayos controlados [5] [6]. Su mejor tolerancia frente a la ciclofosfamida y el hecho de que ocasiona una menor reactivación de la replicación viral hace que las guías recomienden su empleo en las situaciones previamente mencionados. En caso muy severos (hemorragia pulmonar o afectación renal severa) debemos considerar la asociación de plasmaféresis. Si bien la evidencia que sustenta su uso deriva de pequeñas series y de casos clínicos, su teórico papel removiendo crioglobulinas circulantes justificaría su utilización, en espera de que el tratamiento inmunosupresor realice su efecto. La plasmaféresis no limita la síntesis de crioglobulinas y, por tanto, el porcentaje del criocito no es un buen marcador para medir su eficacia, siendo la evolución clínica y analítica un mejor indicador. En la mayoría de las series la pauta planificada ha sido de plasmaféresis a días alternos hasta mejoría clínica o completar entre 7 y 10 sesiones.
1.2 GnMP asociadas a otras infecciones
Además de las infecciones virales, las infecciones bacterianas crónicas (principalmente la endocarditis, la infección del shunt y los abscesos), las micosis y las infecciones parasitarias se asocian con la aparición de GnMP, sobre todo en el mundo en desarrollo. Los microorganismos que se han vinculado a esta glomerulonefritis incluyen el Estafilococo, Micobacterias, Estreptococo, Propionibacterium acnes, Mycoplasma pneumoniae, Brucella, Coxiella burnetii, Nocardia, Meningococo, Plasmodium y Schistosoma. El tratamiento en todos estos casos de GnMP es únicamente antimicrobiano, ya que no hay evidencia en el empleo de tratamiento inmunosupresor concomitante. La erradicación de la infección repercutirá en el control del proceso glomerular.
1.3 Disproteinemias
Varios estudios han vinculado la presencia de procesos monoclonales con el patrón histológico de GnMP [7]. En 2004, se describió un patrón de GnMP secundario al depósito monotípicos de inmunoglobulinas (con restricción de subclase y subtipo de cadena ligera) [8]. En una serie de 37 pacientes con dicho patrón histológico, un tercio de los enfermos presentaban proteína monoclonal circulante [9]. Posteriormente la serie se amplió a 126 pacientes con patrón GnMP y observaron que, tras excluir los pacientes que presenta ban infección crónica, el 41% tenían algún tipo de gammapatía monoclonal, evaluado mediante electroforesis e inmunofijación en suero, orina o ambas. El estudio de las biopsias de médula ósea en estos enfermos reveló una gran variedad de condiciones: gammapatía monoclonal de significado incierto (GMSI) en la mayoría de los casos (50%), linfoma de células B de bajo grado, linfoma linfoplasmocítico, leucemia linfocítica crónica y mieloma múltiple [10]. Este estudio mostró el vínculo estrecho existente entre disproteinemias y este tipo de glomerulonefritis, cuya asociación resultó ser más frecuente que la presencia del VHC. Los autores acuñaron el término “GnMP asociada a depósitos de Inmunoglobulinas monoclonales” (PGNMID) para estos pacientes, constituyendo parte del espectro de lo que se había denominado como ¨Gammapatía de significado renal (GMSR)¨ [11].
La aparición de la GnMP puede ser, por tanto, el debut de un proceso linfoplasmocítico oculto, lo cual pone de relieve la importancia de realizar estudios electroforéticos y de inmunofijación en sangre y orina en pacientes con GnMP, así como despistajes periódicos mediante sedimento urinario en enfermos ya diagnosticados de disproteinemias, independientemente de cuál sea su grado de afectación de la medula ósea. Aunque el patrón membrano-proliferativo es visto con frecuencia en paciente con disproteinemias, no es exclusivo y podemos encontrar patrones con depósito de cadenas ligeras, cadenas pesadas o inmunoglobulina intacta, muy variados, siendo su punto común la restricción para una cadena ligera en la inmunofluorescencia. Es importante la realización de estudios de inmunofluorescencia en parafina mediante técnica de digestión con pronasa en las biopsias de pacientes con GnMP asociada a paraproteína circulante en las que los estudios de IFD son negativos o poco expresivos [12]. Esta técnica permite desenmascarar depósitos monoclonales que, debido a que presentan una disposición diferente de los epítopos, no permite la unión antígeno-anticuerpo necesaria para su identificación mediante las técnicas de inmunofluorescencia convencional. En caso de que los estudios sean negativos mediante IFD convencional e IFD en tejido parafinado tratado con proteasa, si existe pico monoclonal o sospecha de posible GnMP asociada a gammapatía, debería completarse el estudio con espectrometría de masas en la biopsia renal, dónde en un muy pequeño porcentaje de casos se puede identificar la paraproteína depositada que las técnicas anteriores no han sido capaces de identificar [13]. Así mismo, se recomienda le realización de microscopía electrónica ya que puede revelar en un porcentaje pequeño de casos la presencia de depósitos organizados fibrilares o tubulares. La terapia implicaría el tratamiento de los desórdenes subyacentes, que en el caso del mieloma y de los procesos linfo-proliferativos es el tratamiento quimioterápico hematológico indicado en cada caso. El enfoque terapéutico en los pacientes con gammapatía monoclonal de significado renal (GMSR) no está tan bien definido. Cuando asocia un pico monoclonal en sangre o en orina, los resultados de los escasos estudios realizados hasta ahora recomiendan el uso de quimioterapia si existe proteinuria significativa (>1 gr) mantenida a pesar de tratamiento antiproteinúrico, síndrome nefrótico o deterioro de función renal [14]. Si el pico monoclonal corresponde a IgM el tratamiento debe estar basado en rituximab (similar al tratamiento indicado en el Waldestrom), mientras que cuando el pico monoclonal corresponda a IgG o IgA, un régimen basado en dexametasona, ciclofosfamida y bortezomib sea el tratamiento de elección. En casos de GMSR sin identificación de pico monoclonal, la indicación de tratamiento hematológico es más dudosa, y se debería reservar a aquellas situaciones en las que existe progresión renal a pesar del tratamiento con bloqueo del sistema renina angiotensina [15].
1.4 Enfermedades autoinmunes
La GnMP se asocia a diversas enfermedades autoinmunes, incluyendo al lupus eritematoso sistémico, el síndrome de Sjögren, la artritis reumatoide y la enfermedad mixta del tejido conectivo. Típicamente estas enfermedades muestran un patrón de ¨full house¨ en la inmunofluorescencia, con presencia de ambas cadenas ligeras en igual intensidad.
La microscopia electrónica puede ayudar a identificar algunas de estas enfermedades; así las estructuras tubulorreticulares en las células endoteliales pueden sugerir lupus o un patrón de huella digital con crioprecipitado puede ser visto en la crioglobulinemia.
La clínica sistémica extrarrenal asociada a la presencia de los anticuerpos específicos de cada entidad orienta a la etiología específica de la GnMP secundaria a una enfermedad autoinmune. El tratamiento en estos casos consiste en la terapia inmunomoduladora eficaz en el control de la enfermedad de base
1.5 Otras causas.
Se considera GnMP idiopática aquella cuyo daño está mediado por inmunocomplejos, y en la que no se ha conseguido identificar el antígeno responsable. En los últimos años, según recientes evidencias, se ha propuesto que las formas de GnMP con depósitos de Inmunocomplejos y C3 sin antígeno responsable también son formas mediadas por desregulación del complemento.
En una amplia cohorte que incluyó biopsias de 319 pacientes con GnMP primaria, el 60 % no cumplía los criterios para glomerulopatía C3 (C3G). Entre los pacientes sometidos a biopsias repetidas, el 40 % presentó patrones de tinción en inmunofluorescencia diferentes en la biopsia inicial y en la de seguimiento, y el 17 % mostró un cambio de C3G a GnMP mediada por inmunocomplejos (IC-MPGN) o viceversa [16].
Algunos niños pueden debutar con una biopsia caracterizada por glomerulonefritis proliferativa y un patrón de IC-MPGN con tinción codominante de C3 e inmunoglobulinas, seguida de una biopsia posterior en la que predomina la C3 [17]. Probablemente esto se deba a inmunocomplejos inducidos por infecciones u otros desencadenantes que inician la enfermedad en un paciente con una anomalía subyacente de la vía alternativa, y a que la dominancia de C3 se hace evidente tras la inactivación de la vía clásica después de la resolución de la infección o del tratamiento inmunosupresor.
Por último, alrededor del 50 % de los pacientes con IC-MPGN primaria se identifican anomalías que provocan desregulación de la vía alternativa. Estas incluyen alteraciones genéticas que afectan a reguladores del complemento —principalmente el factor H (FH)— o a los dos componentes de la convertasa C3 de la vía alternativa, C3 y factor B (FB), y/o alteraciones adquiridas, como C3NeF o C5NeF (autoanticuerpos que estabilizan las convertasas C3 o C5 de la vía alternativa), anticuerpos activadores anti-FB o anti-C3b y anticuerpos inhibidores anti-FH. Cabe destacar que los porcentajes de pacientes con C3G primaria y con IC-MPGN que presentan anomalías genéticas y/o adquiridas de la vía alternativa son comparables [18]. De hecho, en un ensayo clínico publicado, el tratamiento con bloqueo del complemento (pegcetacopan) ha demostrado reducción sustancial de la proteinuria en estos pacientes [19].
2. GnMP mediada por complemento
Este patrón, habitualmente denominado glomerulopatía C3, se caracteriza por depósitos exclusivos o claramente predominantes de la proteína C3, con una diferencia de al menos dos órdenes de magnitud respecto a otros componentes. Al microscopio electrónico, se distinguen dos formas: la glomerulonefritis C3 y la glomerulopatía con depósitos densos (DDD). Se trata de una patología ultra rara, cuya prevalencia en Europa se estima en 12–16 casos por cada 100 000 habitantes [20]. Esta patología se describe de forma más detallada en el capítulo de NAD titulado “Glomerulonefritis asociadas a alteraciones del complemento” https://www.nefrologiaaldia.org/es-articulo-glomerulonefritis-asociadas-a-alteraciones-del-complemento-619
La glomerulopatía C3 se produce como consecuencia de la acumulación de componentes del complemento o de sus productos de degradación en el mesangio y a lo largo de la pared capilar, fenómeno que obedece a una sobreestimulación de la C3 convertasa de la vía alternativa del complemento [21]. Esta sobreactivación puede originarse tanto por variantes genéticas en reguladores clave (como los factores H, I o B, o las proteínas relacionadas (FHRs), como por la presencia de autoanticuerpos que estabilizan la convertasa o inhiben sus mecanismos de control. Se han identificado polimorfismos en los genes de factor H, factor B, la proteína cofactor de membrana y C3 [22].
Entre el 15 % y el 20 % de los casos presentan una predisposición genética, mientras que los autoanticuerpos frente a la C3 convertasa se detectan en el 80 % de los pacientes con DDD y en el 40–50 % de los de C3G [23]. Esto implica que una proporción significativa de enfermos no se logra determinar el origen preciso de la desregulación del complemento.
Recientemente se ha descrito además un subtipo de glomerulonefritis con patrón membrano-proliferativo mediado por desregulación de la vía de las lectinas: la denominada C4GN (incluyendo C4 y DDD), y que se define como depósito de C4 sin presencia de C3, C1q ni inmunoglobulinas [24]. Todos estos datos ponen de relieve la complejidad y diversidad del estudio del patrón de membrano-proliferativa.
EVALUACIÓN
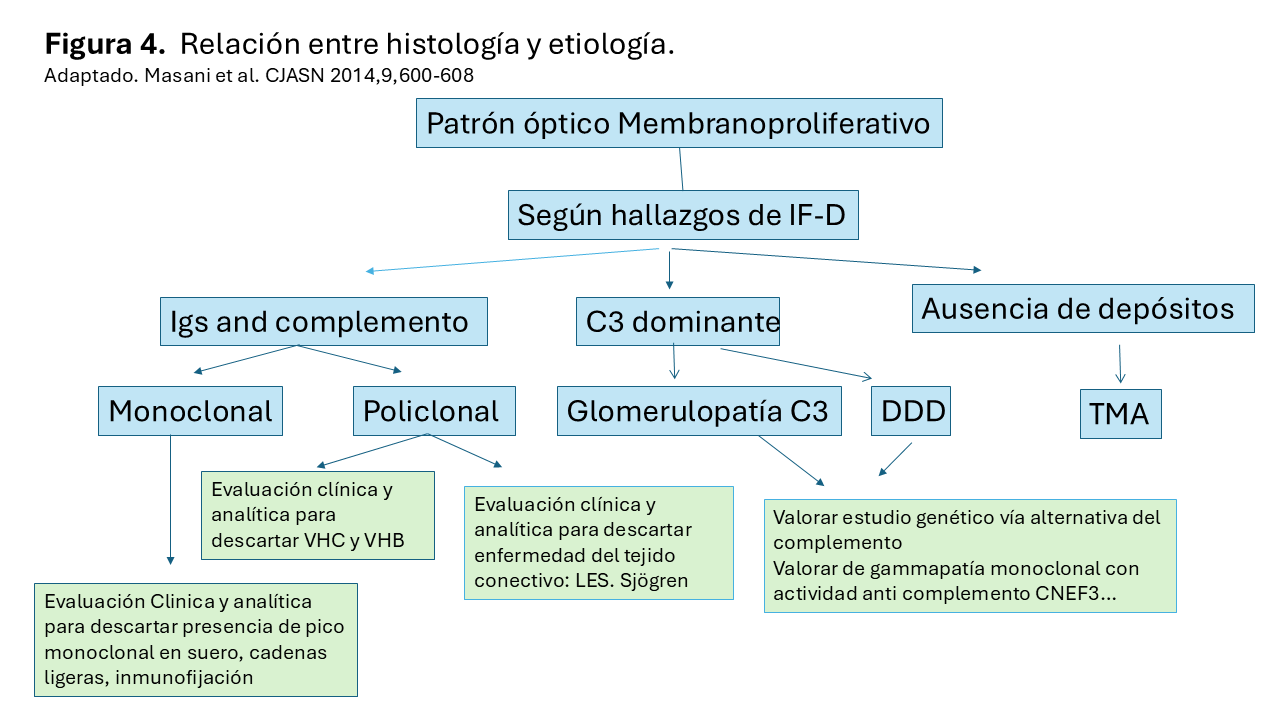
La hipocomplementemia, en general, es un hallazgo frecuente en todos los tipos de GnMP, aunque los niveles séricos de complemento (C3 y C4) también pueden estar en rangos normales. Niveles bajos de C3 y C4 son más frecuentes en la GnMP asociada a inmunocomplejos, mientras que niveles bajos de C3 y normales de C4 se encuentran con más frecuencia en las formas asociadas a disfunción de la vía alternativa del complemento, sobre todo en la fase aguda. No obstante, la presencia de niveles normales de C3 no excluye esta patología. La estrategia diagnóstica está resumida en la (Figura 4). Cuando la biopsia renal muestra un patrón de GnMP con depósitos de inmunoglobulinas estaría indicado descartar la asociación con un proceso infeccioso, enfermedad autoinmune, o la presencia de gammapatía monoclonal u otros procesos linfoplasmocitarios, sobre todo si hay restricción en las inmunoglobulinas de la biopsia renal. La batería de pruebas a realizar incluye estudios microbiológicos, inmunológicos y pruebas de electroforesis e inmunofijación, que se resume en la (Tabla 1). Si, por el contrario, los depósitos son fundamentalmente de C3 (sin presencia o con mínimos depósitos de inmunoglobulinas, siendo la diferencia de dos magnitudes o más) o no existe una etiología identificada de la IC-MPGN, estaría indicado realizar un estudio para detectar anormalidades de la vía alternativa del complemento.
La evaluación inicial de la vía alternativa del complemento debería incluir niveles séricos de complemento, del complejo de ataque de membrana, estudio funcional de la vía alternativa del complemento seguido de estudio genético en búsqueda de variantes patogénicas / probablemente patogénicas o variantes alélicas y determinación de anticuerpos frente a proteínas reguladoras, entre ellos el C3NEF. La mayor parte de estas determinaciones, no se realizan en los laboratorios habituales y deben ser remitidos a laboratorios de referencia (Tabla 2). En el caso de Glomerulopatía C3 con patrón DDD, se debería explorar la presencia de drusas oculares o signos de lipodistrofia. A pesar de haber realizado una extensa evaluación, la etiología puede continuar siendo des conocida en un pequeño porcentaje de casos.
TRATAMIENTO
El tratamiento de las GnMP estará condicionado por la enfermedad subyacente como se ha ido describiendo en las secciones anteriores. Por ello, es fundamental realizar una evaluación profunda para establecer el diagnóstico etiológico que guiará la actitud terapéutica. Respecto a la GnMP idiopática, existe escasa evidencia acerca del tratamiento y los pocos estudios controlados han sido realizados en población infantil. La terapia está condicionada por la severidad del daño renal: así pues, pacientes con función renal conservada y proteinuria no nefrótica pueden ser manejados con inhibidores del SRA para control de la tensión arterial y la proteinuria. Las guías clínicas recomiendan el tratamiento inmunosupresor en enfermos con fallo renal progresivo, síndrome nefrótico persistente o afectación histológica severa (proliferación extracapilar difusa) [25]. Los esteroides en monoterapia no se han estudiado en adultos; en niños demostraron eficacia al enlentecer la progresión renal y reducir la proteinuria; no obstante, las limitaciones metodológicas de los estudios, la aparición tardía de la respuesta y los efectos secundarios ensombrecen en cierta medida los resultados obtenidos. Actualmente las guías clínicas recomiendan un ciclo de tratamiento esteroideo para los casos que presenten síndrome nefrótico persistente o deterioro de función renal. En los casos que no exista respuesta, basándose en estudios observacionales, plantean adicionar un segundo fármaco inmunosupresor, micofenolato sódico en el caso de que exista deterioro de función renal o tacrolimus en síndrome nefrótico con función renal preservada. En las formas rápidamente progresivas con presencia de proliferación extracapilar en la biopsia se sigue considerando la pauta consistente en esteroides y ciclofosfamida o esteroides y rituximab [26].
Finalmente, en pacientes con glomerulopatía C3 / GnMP primaria con proteinuria persistente >1g/día pese a tratamiento de soporte, microhematuria persistente y/o deterioro de función renal, se recomienda como primer escalón la combinación de esteroides y micofenolato mofetil [27]. En formas con curso rápidamente progresivo, se ha reportado el posible beneficio terapéutico con bloqueantes a nivel de C5 (eculizumab) [28]. No obstante, en los últimos años se han desarrollado nuevos bloqueantes de complemento proximales, a destacar iptacopan y pegcetacoplan, que han demostrado gran efectividad en términos de reducción de proteinuria, estabilización de la función renal y desaparición de depósitos de C3 en biopsias postratamiento [29]. Por tanto, teniendo en cuenta la patogenia subyacente y la efectividad mostrada en ensayos clínicos, probablemente en el futuro pasen a ser fármacos de primera elección en el manejo terapéutico de esta entidad.
RECURRENCIA DESPUÉS DEL TRASPLANTE RENAL
La GnMP con frecuencia recurre tras el trasplante renal. El porcentaje se sitúa entre el 27 y el 56 % dependiendo de las series. En un reciente estudio, en el que se excluían la forma de depósito denso (DDD), la recurrencia ocurrió en el 41%, correspondiendo un 36% a formas asociadas a gammapatías monoclonales [30]. En este último caso, las recaídas fueron precoces y severas. La hipocomplementemia fue un marcador precoz de recaída. Existen pocos datos para la enfermedad de depósitos densos, la recidiva parece que es universal con pérdida del injerto en el 50% de los casos a los 5 años [31].
En cualquier caso, y como se ha comentado previamente, el patrón membrano-proliferativo no debe considerase como una entidad, sino como un patrón producido por diversas
entidades, con diversas tasas de recidiva, que se deben considerar y tratar de forma diferencial según la entidad subyacente.
Referencias bibliográficas
1
.
Sethi S, Fervenza FC. Membranoproliferative Glomerulonephritis ¿A new look at an Old entity. N Engl J Med 2012;366:1119-1131.
http://www.ncbi.nlm.nih.gov/pubmed/?term=N+Engl+J+Med+2012%3B366%3A1119-1131
2
.
Nakagawa, N., Hasebe, N., Hattori, M. et al. Clinical features and pathogenesis of membra noproliferative glomerulonephritis: a nationwide analysis of the Japan renal biopsy registry from 2007 to 2015. Clin Exp Nephrol 2018: 22; 797¿807.
http://www.ncbi.nlm.nih.gov/pubmed/?term=Clin+Exp+Nephrol+2018%3A+22%3B+797%C2%BF807
3
.
Pharmacological interventions for acute hepati tis C infection. Kalafateli M, Buzzetti E, Thorburn D, Davidson BR, Tsochatzis E, Gurusamy KS. Co chrane Database Syst Rev. 2018 Dec 3.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2018+Dec+3
4
.
Pol S, Parlati L, Jadoul M. Hepatitis C virus and the kidney . Nat Rev Nephrol. 2018 Nov 19
http://www.ncbi.nlm.nih.gov/pubmed/?term=2018+Nov+19
5
.
Roccatello D, Baldovino S, Rossi D, et al. Long-term effects of anti-CD20 monoclonal anti body treatment of cryoglobulinaemic glomerulo nephritis. Nephrol Dial Transplant 2004; 19:3054.
http://www.ncbi.nlm.nih.gov/pubmed/?term=Nephrol+Dial+Transplant+2004%3B+19%3A3054
6
.
Montero N, Favà A, Rodriguez E, Barrios C, Cruzado JM, Pascual J, Soler MJ. Treatment for hepatitis C virus-associated mixed cryoglobulinae 2004; 65:85. Cochrane Database Syst Rev. 2018 May 7;5
http://www.ncbi.nlm.nih.gov/pubmed/?term=2018+May+7%3B5
7
.
Masai R, Wakui H, Komatsuda A, et al. Charac teristics of proliferative glomerulo- nephritis with monoclonal IgG deposits associated with membra noproliferative features. Clin Nephrol 2009; 72:46.
http://www.ncbi.nlm.nih.gov/pubmed/?term=Clin+Nephrol+2009%3B+72%3A46
8
.
Nasr SH, Markowitz GS, Stokes MB, et al. Pro liferative glomerulonephritis with monoclonal IgG deposits: a distinct entity mimicking immune-complex glomerulonephritis. Kidney Int
http://www.ncbi.nlm.nih.gov/pubmed/?term=Kidney+Int
9
.
Nasr SH, Satoskar A, Markowitz GS, Va leri AM, Appel GB, Stokes MB, Nadasdy T, D¿Agati VD. Proliferative glomerulonephritis with monoclonal IgG deposits. J Am Soc Nephrol. 2009 Sep;20(9):2055-64.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2009+Sep%3B20%289%29%3A2055-64
10
.
Sethi S, Zand L, Leung N, et al. Membra noproliferative glomerulonephritis secondary to monoclonal gammopathy. Clin J Am Soc Nephrol 2010; 5:770.
http://www.ncbi.nlm.nih.gov/pubmed/?term=Clin+J+Am+Soc+Nephrol+2010%3B+5%3A770
11
.
Leung N, Bridoux F, Hutchinson C et al. Monoclonal gammopathy of renal significance. Blood (2012) 120 (22): 4292¿4295.
http://www.ncbi.nlm.nih.gov/pubmed/?term=Blood+%282012%29+120+%2822%29%3A+4292%E2%80%934295
12
.
Nars SH, Fidler ME, Said MS. Paraffin Immunofluorescence: A Valuable Ancillary Technique in Renal Pathology. Kidney Int Rep. 2018; 3(6): 1260¿1266.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2018%3B+3%286%29%3A+1260%C2%BF1266
13
.
13. Fervenza FC, Sethi S, Glassock RJ. Idiopathic membranoproliferative glomerulonephritis: does it exist? Nephrol Dial Transplant 2012; 27:4288.
http://www.ncbi.nlm.nih.gov/pubmed/?term=Idiopathic+membranoproliferative+glomerulonephritis%3A+does+it+exist%3F+Nephrol+Dial+Transplant+2012%3B+27%3A4288
14
.
Zhou H, Li M, Zeng C et al. Efficacy of Immunomodulatory Drugs in Combination With Dexamethasone in Proliferative Glomerulonephritis With Monoclonal Immunoglobulin Deposits. Kidney Int Rep. 2022 Aug 8;7(10):2166-2175.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2022+Aug+8%3B7%2810%29%3A2166-2175
15
.
Terashita M, Selatmet U, Midha S et al. Clinical Outcomes of Monoclonal Gammopathy of Renal Significance Without Detectable Clones. Kidney Int Rep. 2023 Sep 22;8(12):2765- 2777.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2023+Sep+22%3B8%2812%29%3A2765-+2777
16
.
Hou J, Markowitz GS, Bomback AS et al. Toward a working definition of C3 glomerulopathy by immunofluorescence Kidney Int 2014; 85: 450¿456.
http://www.ncbi.nlm.nih.gov/pubmed/?term=Toward+a+working+definition+of+C3+glomerulopathy+by+immunofluorescence+Kidney+Int+2014%3B+85%3A+450%E2%80%93456
17
.
Spartà G, Gaspert A, Neuhaus TJ, Weitz M, Mohebbi N, Odermatt U, Zipfel PF, Bergmann C, Laube GF. Membranoproliferative glomerulonephritis and C3 glomerulopathy in children: change in treatment modality? A report of a case series. Clin Kidney J. 2018 Aug;11(4):479-490.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2018+Aug%3B11%284%29%3A479-490
18
.
Iatropoulos P, Noris M, Mele Cet al. Complement gene variants determine the risk of immunoglobulin-associated MPGN and C3 glomerulopathy and predict long-term renal outcome. Mol Immunol 2016; 71: 131¿142
http://www.ncbi.nlm.nih.gov/pubmed/?term=Mol+Immunol+2016%3B+71%3A+131%E2%80%93142
19
.
Dixon BP, Greenbaum LA, Huang L, Rajan S, Ke C, Zhang Y, Li L. Clinical Safety and Efficacy of Pegcetacoplan in a Phase 2 Study of Patients with C3 Glomerulopathy and Other Complement-Mediated Glomerular Diseases. Kidney Int Rep. 2023 Aug 25;8(11):2284- 2293.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2023+Aug+25%3B8%2811%29%3A2284-+2293
20
.
McGrogan A, Franssen CF, de Vries CS. The incidence of primary glomerulonephritis worldwide: a systematic review of the literature. Nephrol Dial Transplant. 2011 Feb;26(2):414-30
http://www.ncbi.nlm.nih.gov/pubmed/?term=2011+Feb%3B26%282%29%3A414-30
21
.
Sethi S, Fervenza FC, Zhang Y, Zand L, Vra na JA, Nasr S, Theis JD, Dogan A, Simith R. C3 Glomerulonephritis: clinicopatological findings, complement abnormalities glomerular, proteomic profile, treatment and follow up. Kidney Int. 2012 Aug;82(4):465-73
http://www.ncbi.nlm.nih.gov/pubmed/?term=2012+Aug%3B82%284%29%3A465-73
22
.
Cook HT, Pickering MC. Histopathology of MPGN and C3 glomerulopathies. Nat Rev Nephrol. 2015 Jan;11(1):14-22.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2015+Jan%3B11%281%29%3A14-22
23
.
Servais A, Hoël LH, Roumenina LT, Le Quin trec M, Ngo S, Dragon-Durey MA, Macher MA, Zuber J, Karras A, Frovot F, Moulin B, Grünfeld JP, Niaudet P, Lesavre P, Fremeaux-Bacchi V. Acquired and genetic complement abnormalities play a critical role in dense deposit disease and other C3 glomerulopathies. Kidney Int 2012;82:454-464.
http://www.ncbi.nlm.nih.gov/pubmed/?term=Kidney+Int+2012%3B82%3A454-464
24
.
Sethi S, Quint PS, O''''Seaghdha CM, Fervenza FC, Bijol V, Dorman A, Dasari S, Smith RJ, Kurtin PJ, Rennke HG. C4 Glomerulopathy: A Disease Entity Associated With C4d Deposition. Am J Kidney Dis. 2016 Jun;67(6):949-53
http://www.ncbi.nlm.nih.gov/pubmed/?term=2016+Jun%3B67%286%29%3A949-53
25
.
KDIGO 2021 Clinical Practice Guideline for Glomerulonephritis. Kidney Int Suppl 2021; 100(4):1-276
http://www.ncbi.nlm.nih.gov/pubmed/?term=Kidney+Int+Suppl+2021%3B+100%284%29%3A1-276
26
.
Masani N, Jhaveri KD, Fishbane S. Update on membranoproliferative GN. Clin J Am Soc Nephrol. 2014 Mar;9(3):600-8.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2014+Mar%3B9%283%29%3A600-8
27
.
Caravaca-Fontán F, Díaz-Encarnación MM, Lucientes L, Cavero T, Cabello V et al; Spanish Group for the Study of Glomerular Diseases GLOSEN. Mycophenolate Mofetil in C3 Glomerulopathy and Pathogenic Drivers of the Disease. Clin J Am Soc Nephrol. 2020 Sep 7;15(9):1287-1298.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2020+Sep+7%3B15%289%29%3A1287-1298
28
.
Le Quintrec M, Lapeyraque AL, Lionet A, Sellier-Leclerc AL, Delmas Y et al. Patterns of Clinical Response to Eculizumab in Patients With C3 Glomerulopathy. Am J Kidney Dis. 2018 Jul;72(1):84-92.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2018+Jul%3B72%281%29%3A84-92
29
.
Wong E, Nester C, Cavero T et al. Efficacy and Safety of Iptacopan in Patients With C3 Glomerulopathy. Kidney Int Rep. 2023 Sep 22;8(12):2754-2764
http://www.ncbi.nlm.nih.gov/pubmed/?term=2023+Sep+22%3B8%2812%29%3A2754-2764
30
.
Aziz F, Singh T, Garg N, Zhong W, Mandelbrot D. Post-transplant idiopathic immune complex membrano-proliferative glomerulonephritis: Characteristics and outcomes. Clin Nephrol. 2023 Feb;99(2):69-77
http://www.ncbi.nlm.nih.gov/pubmed/?term=2023+Feb%3B99%282%29%3A69-77
31
.
Regunathan-Shenk R, Avasare RS, Ahn W, et al. Kidney Transplantation in C3 Glomerulopathy: A Case Series. Am J Kidney Dis. 2019;73(3):316-323.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2019%3B73%283%29%3A316-323