Glomerulonefritis Fibrilar e Inmunotactoide
INTRODUCIÓN
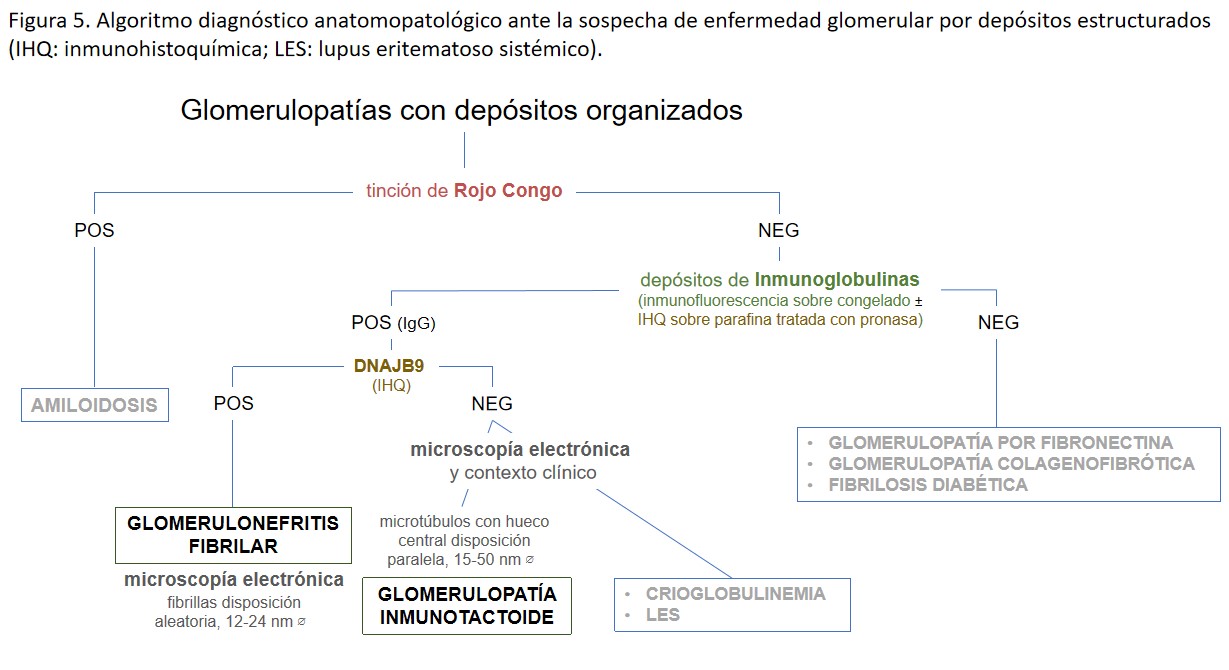
La glomerulonefritis fibrilar y la inmunotactoide forman parte de un grupo de nefropatías caracterizadas por la presencia de depósitos inmunes organizados glomerulares, de apariencia ultraestructural fibrilar o microtubular, rojo congo negativo (no amiloide) [1].
Son enfermedades raras, diagnosticándose en <1% de las biopsias renales, siendo proporcionalmente más frecuente la glomerulonefritis fibrilar que la inmunotactoide [1][2][3]
Aunque desde su primera mención en la década de los setenta [4] ha habido controversia sobre si eran o no variantes de una misma enfermedad, actualmente existe unanimidad en considerarlas entidades diferentes, con distinta patogenia y particularidades clínicas e histopatológicas propias (Tabla 1). Siguen existiendo sin embargo casos de overlap difíciles de clasificar.
GLOMERULONEFRITIS FIBRILAR
Se define como una glomerulopatía por depósito de fibrillas de distribución aleatoria y de unos 12-24 nm de diámetro en el estudio ultraestructural, derivadas de inmunoglobulinas (inmunofluorescencia positiva para IgG) y no amiloide (rojo congo negativo) [5]
Presentación clínica
Afecta predominantemente a pacientes caucásicos, en la sexta década de la vida [5].
La clínica es inespecífica, siendo la proteinuria su principal manifestación, a menudo en forma de síndrome nefrótico (36-70%). En el momento de su diagnóstico, suele presentar insuficiencia renal en grado variable (54-70%), microhematuria (70-80%) e hipertensión arterial (67%) [5][6]. Los valores de complemento sérico son normales. Aunque de forma poco frecuente puede presentarse en forma de insuficiencia renal rápidamente progresiva [7][8]. No suele presentar manifestaciones extrarrenales.
Se ha descrito como una glomerulopatía primaria, aunque en determinados casos aparece coincidente o relacionada a diversas patologías, como neoplasias sólidas (4-23%), infección por VHC (3-27%), (principalmente en pacientes afroamericanos), y enfermedades autoinmunes (10-30%) [9][10]. Su asociación directa con gammapatía monoclonal se considera excepcional [11].
Diagnóstico
El diagnóstico se realiza mediante biopsia renal, en el estudio de una nefropatía proteinúrica.
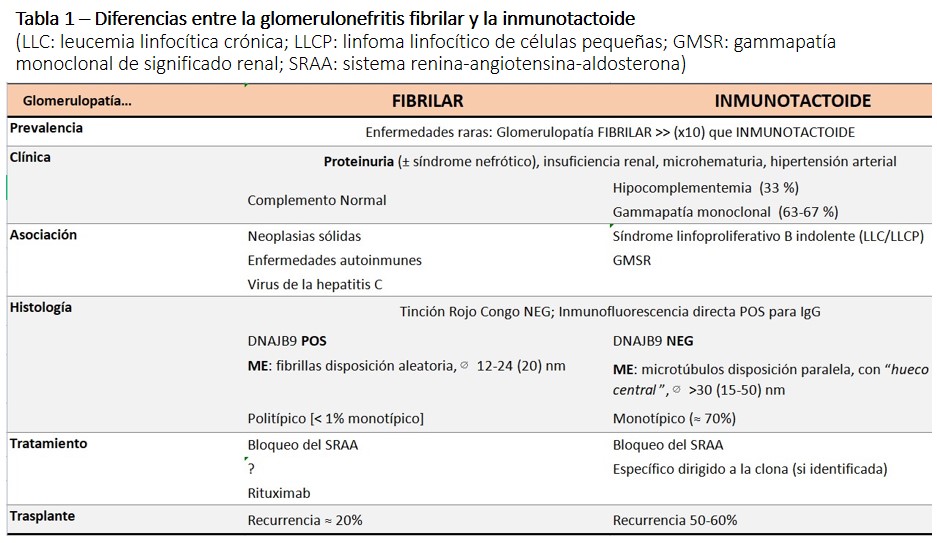
A nivel histológico [12], se observa en la microscopía óptica un patrón predominantemente mesangial con expansión por depósitos eosinófilos (Figura 1), con positividad variable en la tinción de PAS, escasa tinción en plata-metenamina, y por definición, Rojo congo negativos. Se acompaña de esclerosis y/o proliferación mesangial variables. También puede presentarse como un patrón membranoproliferativo, con dobles contornos segmentarios, asociado a la expansión mesangial, pudiendo ser una forma evolucionada de la enfermedad, como sugiere el hecho de que se ha reportado la transformación de una forma a otra en biopsias seriadas [13]. Con menor frecuencia se puede presentar como una forma “membranous like” o proliferativa endocapilar, generalmente sobre una base de expansión y proliferación mesangial. Un 25% de los casos pueden presentar semilunas fibroepiteliales, aunque la presencia de semilunas difusas (> 50%) es rara.
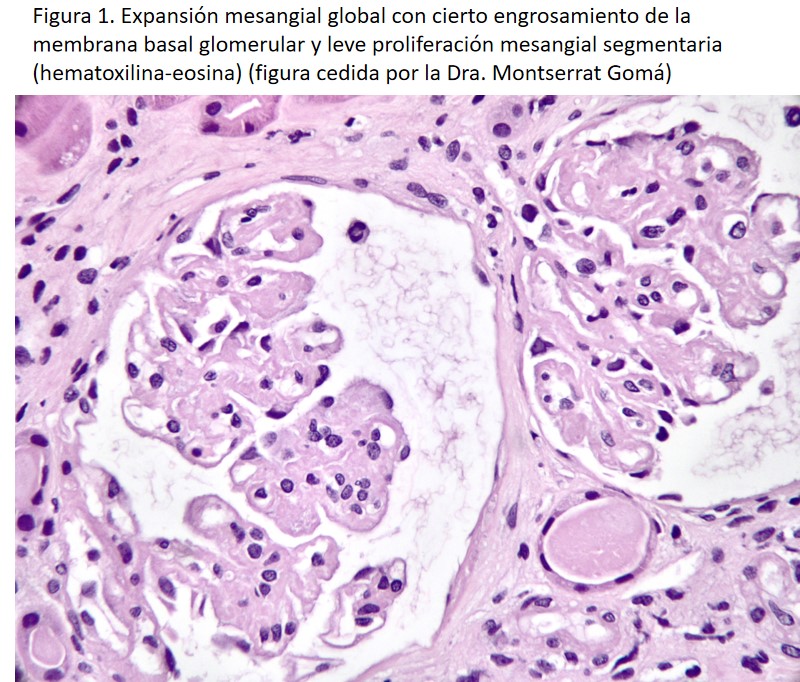
La inmunofluorescencia directa muestra un depósito intenso mesangial y en pared capilar de un característico aspecto desflecado o “borroso” con IgG politípica (predominantemente IgG4 y/o IgG1) y C3 (asociado o no a C1q), habitualmente sin restricción de cadena ligera (Figura 2). En aquellos casos donde la inmunofluorescencia directa realizada sobre tejido congelado muestra restricción de cadena ligera (principalmente si es lamba) es necesario ampliar el estudio inmunohistoquímico sobre tejido en parafina previo tratamiento con pronasa para desenmascarar un patrón politípico. Aplicado este proceso a la biopsia renal, la caracterización de esta entidad como monotípica es excepcional (<1%) [11].
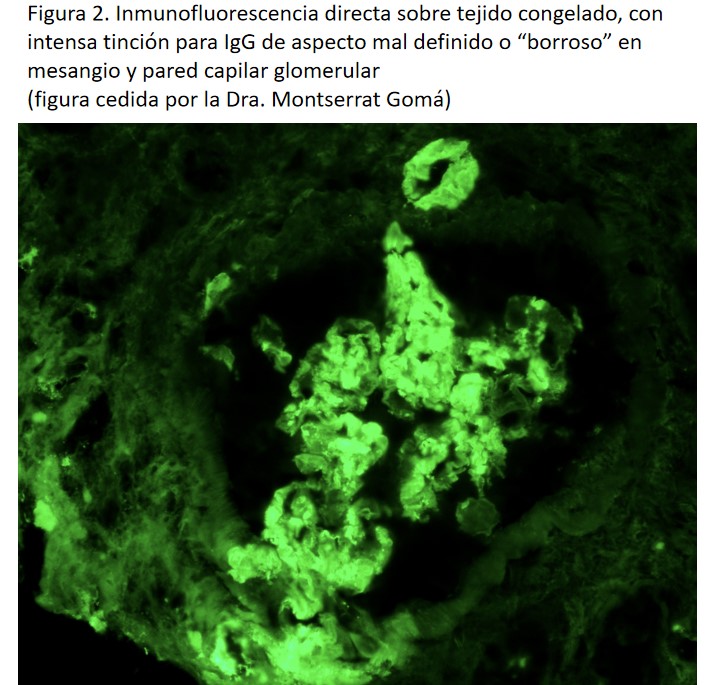
En la microscopia electrónica se identifican los depósitos organizados mesangiales y/o en la lámina densa de la membrana basal glomerular, de fondo amorfo con fibrillas de disposición aleatoria de 12-24 nm de diámetro [1] (Figura 3).
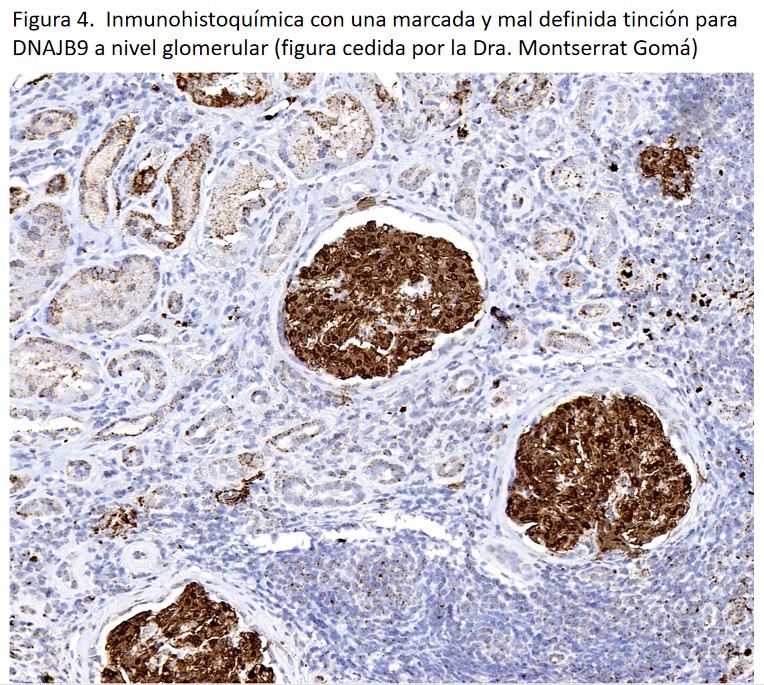
Clásicamente, la glomerulonefritis fibrilar requería para su diagnóstico del estudio ultraestructural mediante microscopia electrónica. Actualmente, desde su descripción en 2018 disponemos de la tinción por DNAJB9 [14][15], principalmente mediante inmunohistoquímica, con una gran sensibilidad (98%) y especificidad (>99%) para el diagnóstico histológico de la glomerulonefritis fibrilar [16]. Presenta un patrón de depósito glomerular similar al de la IgG (Figura 4). La tinción por inmunohistoquímica de DNAJB9 se ha convertido en una herramienta básica para el diagnóstico histológico de la glomerulonefritis fibrilar de tal forma que hoy en día ya no es imprescindible el estudio ultraestructural [12]. Además, comparada con la microscopía electrónica, tiene las ventajas de ser una técnica más fácil, rápida, económica y accesible, y que se puede realizar sobre muestra en parafina.
Así como la tinción inmunohistoquímica del DNAJB9 en la biopsia renal se ha aceptado como un método diagnóstico de gran utilidad, la determinación de los niveles séricos de DNAJB9 no parecen aportar hoy en día un beneficio como biomarcador sérico de la enfermedad. Aunque los pacientes con glomerulonefritis fibrilar presentan valores séricos significativamente más elevados de DNAJB9, no se relacionan con la actividad de la enfermedad ni la respuesta al tratamiento, y se correlacionan negativamente con los valores de filtrado glomerular [17][18][19].
Ante la posible asociación con diversos procesos subyacentes, se recomienda en el momento del diagnóstico realizar un cribado de neoplasia, apropiado por la edad y características del o la paciente, determinación de serologías del VHC y un estudio de autoinmunidad tanto clínico como serológico.
Clásicamente, se había incluido a la glomerulonefritis fibrilar considerada monoclonal, aquella coincidente con gammapatía monoclonal y/o con aparente restricción de cadenas ligeras en la inmunofluorescencia sobre tejido congelado, dentro del grupo de gammapatías monoclonales de significado renal [20]. Actualmente, con la amplia utilización de técnicas de inmunohistoquímica sobre tejido parafinado tratado con pronasa y de tinción para subclases de IgG se ha evidenciado que la gran mayoría de los casos aparentemente monotípicos son de estirpe policlonal, y la presencia de gammapatía monoclonal parece ser más coincidente que patogénica. Solamente hay casos excepcionales (<1%) [11] en los que sí se demuestran depósitos monotípicos tras el estudio completo histológico [21][22]. Aun así, en <10% de estos pocos casos se detecta una paraproteína circulante, proporción similar a la de los casos policlonales. Es por esto por lo que en recientes revisiones sobre las gammapatías monoclonales de significado renal, la glomerulonefritis fibrilar queda excluída de este grupo [23]. Estos casos monotípicos suelen ser DNAJB9 negativos y con rasgos clínicos e histológicos similares a los de la glomerulonefritis inmunotactoide [24].
El principal diagnóstico diferencial debe realizarse con la glomerulopatía inmunotactoide, la cual no tiñe con DNAJB9, y con la amiloidosis, aunque por definición los depósitos en la glomerulonefritis fibrilar son rojo Congo y tioflavina negativos (Figura 5). De todas formas, se han descrito contados casos de glomerulonefritis fibrilar congofílica, DNAJB9 positivos, que suponen un evidente reto diagnóstico [25].
Etiopatogenia
Se considera una enfermedad por depósitos de inmunocomplejos, aunque la naturaleza de éstos sigue siendo motivo de estudio. Las fibrillas están compuestas por IgG (eminentemente policlonal) y DNAJB9, que colocaliza con la IgG [14][15].
El DNAJB9 (DNAJ homolog subfamily B member 9, también conocido como ERDJ4) es una proteína de 223 aminoácidos miembro de la familia de las chaperonas DNAJ, que actúa como cochaperona de HSP70 (heat shock protein 70), activándose en situaciones de estrés celular y de estrés del retículo endoplásmico. Como chaperona, participa facilitando el correcto plegamiento y ensamblaje de las proteínas sintetizadas, imprescindible para una adecuada conformación tridimensional y función. Es una proteína ubicua en el organismo en condiciones fisiológicas, presente principalmente en hígado, placenta y riñón, y en éste en células tubulares, mesangiales y podocitos [9][26].
Se ha demostrado que aparece en elevadas cantidades a nivel glomerular en la glomerulopatía fibrilar, y se considera que puede tener un papel relevante en su patogenia [15][16]. Hay diversas hipótesis de su papel en el desarrollo de esta nefropatía, aunque aún con mucha incertidumbre al respecto: una primera teoría es que el DNAJB9, sintetizado de forma aberrante a nivel extrarrenal, actuaría como un autoantígeno que desencadenaría una respuesta autoinmune activando la síntesis de autoanticuerpos (IgG4 predominante), con depósito o generación de inmunocomplejos a nivel glomerular (de todas formas, no se han podido identificar autoanticuerpos circulantes contra el DNAJB9). Una segunda teoría postula que el DNAJB9 es una proteína que se une secundariamente a moléculas de IgG aberrantes sintetizadas con defectos de plegamiento y depositándose a nivel glomerular [9][12]. Los depósitos glomerulares tienen determinadas características fisicoquímicas que les confieren capacidad fibrilogénica y desencadenamiento de la reacción inflamatoria y daño local.
Tratamiento
Actualmente no disponemos de un tratamiento específico eficaz para esta nefropatía. Todos los pacientes deben ser tratados de base con bloqueo del sistema renina-angiotensina-aldosterona (SRAA) si no hay contraindicación, buscando un adecuado control de la tensión arterial como en cualquier nefropatía proteinúrica.
Al tratarse de una enfermedad de trasfondo autoinmune o derivada del depósito de inmunoglobulinas aberrantes se han ensayado diversas estrategias inmunosupresoras. Diferentes pautas con esteroides en monoterapia o asociados a ciclofosfamida, micofenolato o anticalcineurínicos, recogidas en series de casos o estudios retrospectivos, han mostrado resultados dispares y poco consistentes, con una escasa eficacia en conseguir la remisión o evitar la progresión de la enfermedad. Se han reportado series con índices de remisión completa o parcial de 13% y 30% respectivamente, con tratamiento con bloqueo del SRAA independientemente de tratamiento inmunosupresor [13][27].
Considerando la naturaleza inmune de la enfermedad, una potencial opción terapéutica son las terapias dirigidas al linfocito B, con anticuerpos anti-CD20. El rituximab se ha ido utilizando de forma progresiva con respuestas irregulares, experiencia recogida en estudios retrospectivos con pocos pacientes, sin ensayos controlados debido a la rareza de la nefropatía. Mientras algunas series han reportado remisiones parciales en una proporción significativa de sus pacientes tratados [28][29], otras han reflejado resultados menos optimistas en términos de retrasar la progresión de la enfermedad [10][30]. Un estudio piloto prospectivo abierto con 11 pacientes con rituximab dos dosis de 1 g quincenales, repetido a los 6 meses, observaron que a los 12 meses de seguimiento los pacientes mantenían una estabilidad de la función renal, aunque sin un cambio significativo de la proteinuria, consiguiendo solamente 3 de ellos una remisión parcial. Estos resultados deben interpretarse sin embargo dentro de un seguimiento de solamente un año, relativamente corto para esta nefropatía [19]. Una serie retrospectiva con 266 pacientes, 30 de ellos tratados con inmunosupresión, ocho con rituximab, el uso de este fármaco fue el único que se asoció de forma significativa a la no progresión hacia enfermedad renal crónica avanzada en el seguimiento evolutivo [31].
No disponemos de claros marcadores que orienten a que pacientes tratar y a cuáles no con tratamiento inmunosupresor. La decisión de utilizar tratamiento inmunosupresor, basado en opinión y con un escaso nivel de evidencia, depende en buena medida de la severidad en el momento de su presentación y de la evolución, así como de las características histológicas. En general, los casos con función renal conservada (filtrado glomerular ≥60 ml/min) y proteinuria no nefrótica se pueden manejar de inicio con tratamiento conservador con bloqueo del SRAA. En los casos con síndrome nefrótico y/o con deterioro progresivo de la función renal, sin daño crónico histológico significativo, se recomienda ensayar tratamiento inmunosupresor, siendo el rituximab el fármaco que genera mayor consenso hoy en día, siempre sopesando riesgo-beneficio y de acuerdo con el paciente, y con el objetivo de al menos conseguir un enlentecimiento de la progresión de la nefropatía.
Aquellos casos que se presentan como una insuficiencia renal rápidamente progresiva y/o con reacción extracapilar difusa en el estudio histológico se suelen tratar de forma agresiva con dosis elevadas de glucocorticoides y ciclofosfamida, aunque suelen presentar un mal pronóstico renal.
En los casos en los que se sospeche relación con una neoplasia, infección por VHC o enfermedad autoinmune subyacente se recomienda inicialmente tratar el proceso subyacente ya que en determinados casos se ha descrito que su control ha conseguido mejorar la nefropatía.
El pronóstico de la glomerulonefritis fibrilar es en general malo, con la mitad de los pacientes requiriendo tratamiento renal sustitutivo a los 3-5 años del diagnóstico [1][2][13][27]. Como en otras nefropatías, las mejores respuestas aparecen en aquellos casos con mejor función renal en el diagnóstico, sugiriendo que el tratamiento precoz de la nefropatía es importante, antes de que desarrolle un punto de no retorno. Los principales factores de mal pronóstico son la edad, la función renal, el grado de proteinuria y la presencia de un patrón membranoproliferativo, daño crónico o reacción extracapilar en la biopsia renal [13][27][31].
Cuando la nefropatía progresa hacia requerimiento de tratamiento renal sustitutivo, el trasplante renal es una buena opción si no hay otra contraindicación. La glomerulonefritis fibrilar puede recidivar en aproximadamente una quinta parte de los injertos, pero habitualmente su presentación suela ser tardía (>5 años) y más leve, con escasa repercusión clínica y una evolución más larvada en el tiempo que en el riñón nativo [32]. La supervivencia del injerto ronda el 67% a los 10 años, similar al de pacientes trasplantados por otras nefropatías [33].
GLOMERULOPATÍA INMUNOTACTOIDE
Se define como una nefropatía por depósito glomerular de estructuras microtubulares de distribución aleatoria y de 15-50 nm de diámetro en el estudio ultraestructural, derivadas de inmunoglobulinas (inmunofluorescencia positiva para IgG) y no amiloide (rojo congo negativo) [34]
Presentación clínica
Descrita en el 1980 por Schwartz et al [35] es unas 10 veces menos frecuente que la glomerulonefritis fibrilar (<0,1% de las biopsias de riñón nativo) [1][34]. Predomina también en pacientes caucásicos, alrededor de la sexta década de la vida.
Se presenta con un patrón clínico similar a la glomerulonefritis fibrilar, con proteinuria, a menudo con síndrome nefrótico, microhematuria, insuficiencia renal en grado variable, e hipertensión arterial, aunque a diferencia de aquella con una mayor incidencia de hipocomplementemia, por la vía clásica, en una tercera parte de los casos [34][36]. No suele presentar tampoco manifestaciones extrarrenales.
Se asocia de manera más frecuente con enfermedades hematológicas, principalmente con síndromes linfoproliferativos indolentes tipo leucemia linfocítica crónica/linfoma linfocítico de células pequeñas, y con menos frecuencia con otros linfomas B o mieloma múltiple [34].
Diagnóstico
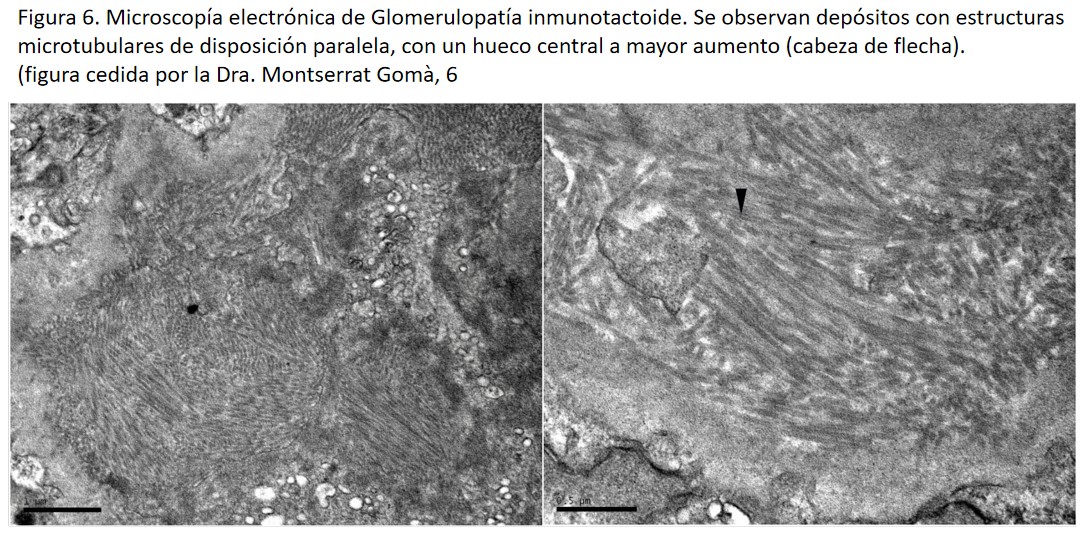
El diagnóstico se realiza mediante la biopsia renal, con la identificación de los característicos depósitos con estructuras microtubulares en el estudio ultraestructural, habitualmente de >30 (15-50) nm de diámetro de disposición paralela o apilada, y con un hueco central a gran aumento. Se localizan a nivel subepitelial y también subendotelial y mesangial (Figura 6) [36].
Ópticamente suelen presentar un patrón membranoproliferativo o un patrón membranoso atípico, con mayor o menor proliferación mesangial y/o endocapilar. Característicamente son rojo congo y DNAJB9 negativos [36].
La inmunofluorescencia objetiva depósitos intensos parietales y mesangiales de IgG predominante (principalmente IgG1), C3 y C1q. Los depósitos son generalmente monotípicos con restricción de cadena ligera (70%), básicamente kappa. La inmunohistoquímica sobre tejido parafinado tratado con pronasa puede ayudar a corroborar el diagnóstico y confirmar o descartar la monotipia desenmascarando depósitos no identificados en la inmunofluorescencia sobre tejido congelado [37].
La frecuente presentación con depósitos monoclonales condiciona que se hable de dos variantes de esta nefropatía [34], una variante monoclonal de la glomerulopatía inmunotactoide, la cual se incluye dentro del grupo de las gammapatías monoclonales de significado renal [23], y una variante policlonal.
La presencia de la variante monoclonal obliga en el momento del diagnóstico a descartar la presencia de gammapatía monoclonal si ésta no ha sido ya diagnosticada con anterioridad [36]. Aun así, debe considerarse que el estudio de gammapatía monoclonal puede ser normal, y que la glomerulopatía inmunotactoide puede desarrollarse sin que se llegue a detectar ningún componente monoclonal en suero u orina por las técnicas habituales. En los casos policlonales, un porcentaje (25%) puede estar relacionado con enfermedades autoinmunes, por lo que se recomienda su despistaje en estos casos [34].
El principal diagnóstico diferencial debe realizarse con la glomerulonefritis crioglobulinémica tipo I, con la glomerulonefritis proliferativa por depósitos inmunes monoclonales y con la glomerulonefritis fibrilar (Figura 5).
La distinción entre la glomerulonefritis fibrilar y la inmunotactoide no siempre es clara y determinados casos se pueden solapar con los estudios anatomopatológicos disponibles. Algunos casos con glomerulonefritis con depósitos fibrilares monotípicos, DNAJB9 negativos, muestran características clínicas e histológicas más propias de la glomerulopatía inmunotactoide, a pesar de no mostrar en el estudio ultraestructural los característicos microtúbulos de esta entidad [22].
Etiopatogenia
Los depósitos glomerulares se generan por la cristalización anómala de las inmunoglobulinas-inmunocomplejos o las inmunoglobulinas monoclonales depositadas, capaces de formar microtúbulos o estructuras tactoides por sus características estructurales y sus propiedades fisicoquímicas específicas, todo ello favorecido por el proceso fisiológico de la ultrafiltración (en entornos concentrados hay mayor tendencia a generar estructuras cristalinas tactoides) [38]. En cuanto a los depósitos policlonales, se hipotetiza que puedan deberse al depósito de proteínas no identificadas con capacidad intrínseca de polimerizar en microtúbulos, con una respuesta secundaria autoinmune similar a lo propuesto para la glomerulonefritis fibrilar y el DNAJB9 [34].
Tras el depósito y la formación de las estructuras tactoides, parte de la lesión se considera mediada por la activación del complemento [39].
Tratamiento
Como el resto de las glomerulopatías con proteinuria debe tratarse con bloqueo del SRAA si no hay contraindicación, con un adecuado control de la tensión arterial.
Ya que un porcentaje relevante de casos están asociados a una gammapatía monoclonal, el tratamiento se basa en una terapia dirigida a la alteración hematológica de base identificada [36]. En los casos monoclonales en los cuales no se identifica una gammapatía monoclonal, se recomienda iniciar tratamiento inmunosupresor empírico con rituximab, ante una posible clona linfocítica oculta subyacente, reservando pautas dirigidas a la célula plasmática como segunda línea.
En los casos policlonales, si presenta manifestaciones renales leves se puede mantener tratamiento conservador con inhibición del SRAA y un seguimiento estrecho. En los casos más severos con proteinuria nefrótica y/o insuficiencia renal progresiva, el tratamiento no está bien definido, aunque se recomienda el tratamiento con rituximab sopesando riesgo-beneficio en cada caso.
En los casos con una insuficiencia renal evolucionada con marcada lesión crónica histológica y escasa probabilidad de recuperación, el tratamiento inmunosupresor o quimioterápico dirigido a la clona debería reservarse para aquellos pacientes candidatos a trasplante renal para preservar en la medida de lo posible la evolución a largo plazo del injerto [40].
La variante monoclonal de la glomerulopatía inmunotactoide, cuando se asocia a enfermedad hematológica, presenta un mejor pronóstico que la variante policlonal. Las manifestaciones renales y el pronóstico de la nefropatía están estrechamente ligados a la evolución de la discrasia hematológica tras el tratamiento. La consecución de una buena respuesta hematológica se traduce habitualmente en una mejoría de los parámetros renales, y las recurrencias renales suelen ser un reflejo de recidivas hematológicas. El objetivo pues es conseguir una buena y sostenida remisión de la enfermedad hematológica [36].
Cuando la nefropatía progresa a requerimiento de tratamiento sustitutivo renal el trasplante renal es una buena opción. Los índices de recurrencia sobre el injerto son del 50-60% de los casos, a veces precoces, similar a lo que ocurre con otras nefropatías por depósito asociadas a discrasias hematológicas [6][41]. Es importante llegar al trasplante renal con una buena respuesta hematológica y mantener un seguimiento regular hematológico posterior para reducir el riesgo de recidiva sobre el injerto [36].