Feocromocitoma, Paraganglioma, e Incidentalomas Suprarrenales
Introducción
El feocromocitoma (FEO) es un tumor que deriva de las células cromafines de la médula suprarrenal que produce, almacena, metaboliza y libera cantidades excesivas de catecolaminas y sus metabolitos. En caso de que el tumor derive de ganglios simpáticos (tórax, abdomen y pelvis), parasimpáticos (generalmente cabeza y cuello) o residuos embrionarios cromafines extrasuprarrenales se denomina paraganglioma o FEO extra-adrenal. Los FEO extra-adrenales representan entre un 10-15% de los tumores productores de catecolaminas [1]. Excepcionalmente pueden secretar otros péptidos como: adrenomedulina, renina, somatostatina y endotelina. Clásicamente se ha estimado que la incidencia de FEO se sitúa entre 1 y 2 casos por cada 100.000 habitantes/año [2] si bien revisiones más recientes sitúan la incidencia de esta patología en torno a 0,6-0,8 casos por cada 100.000 habitantes/año [1].
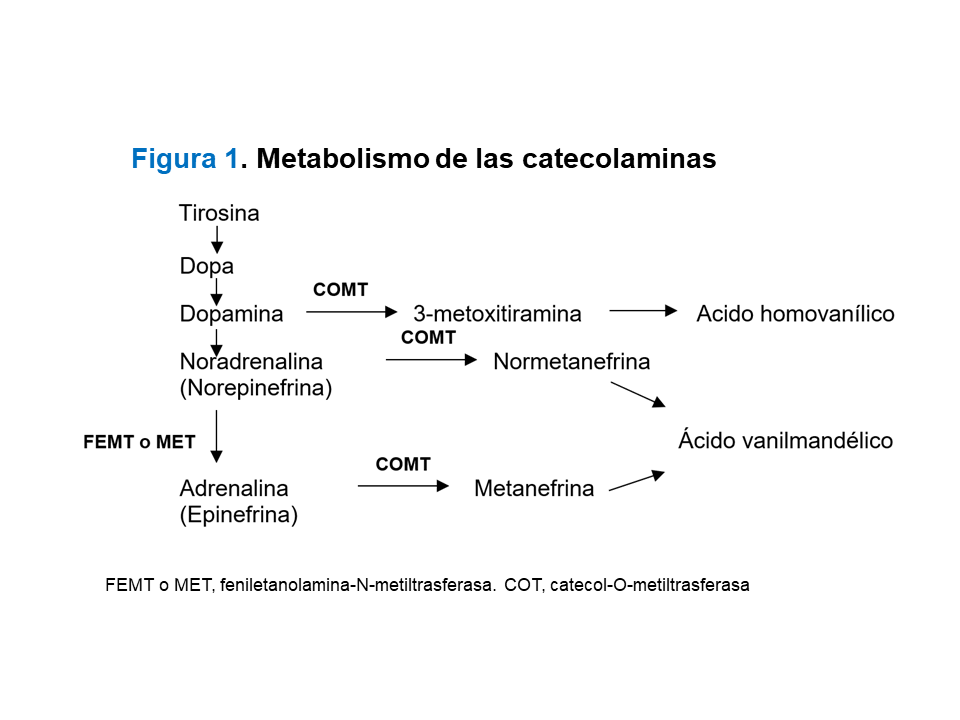
Las células cromafines sintetizan catecolaminas a partir del aminoácido tirosina de la dieta (o por hidroxilación de fenilalanina); el producto final es la dopamina que, tras beta-hidroxilación por el enzima dopamina beta hidroxilasa, se transforma en noradrenalina. En la médula suprarrenal, más del 75% de la noradrenalina es trasformada por la FEMT o MET (feniletanolamina-N-metiltrasferasa) a adrenalina [2]. Los FEO-paragangliomas secretan normalmente noradrenalina y adrenalina; si sólo secretan adrenalina hay que sospechar la localización adrenal. Los tumores extra-adrenales suelen tener un fenotipo noradrenérgico o dopaminérgico ya que el tejido cromafin extra-adrenal apenas tiene FEMT. Los paragangliomas derivados de ganglios parasimpáticos (cabeza y cuello) suelen ser no secretores, excepto algunos que secretan dopamina y su metabolito tras la metilación, la 3-metoxitiramina [3]. La metilación de las catecolaminas se produce mediante el enzima COMT (catecol-O-metiltransferasa) y da lugar a las metanefrinas (metanefrina y normetanefrina), de gran interés desde el punto de vista diagnóstico. La (Figura 1) muestra el metabolismo de las catecolaminas.
Fenotipos
Se han descrito tres fenotipos según las catecolaminas predominantes [1]:
1) Fenotipo adrenérgico. Es el fenotipo que con más frecuencia se asocia a síntomas y signos paroxísticos. Fuera de las crisis el paciente puede estar normotenso e incluso hipotenso. Esto se debe a que además de la estimulación alfa-adrenérgica, la adrenalina produce también estimulación beta-adrenérgica que favorece la vasodilatación. Puede aparecer hiperglucemia e hiperlipidemia que se relaciona con los efectos diabetogénicos de la adrenalina sobre varias enzimas involucradas en la lipólisis, glucogenólisis y gluconeogénesis.
2) Fenotipo noradrenérgico. Suele presentar una clínica leve y puede parecer una HTA esencial. Aunque la noradrenalina estimula los receptores alfa-adrenérgicos, que condicionan crono e inotropismo positivo y vasoconstricción arterial, también induce una disminución de los receptores adrenérgicos que contribuye a una clínica leve e incluso presión arterial normal. También pueden presentar estreñimiento y cefalea.
3) Fenotipo dopaminérgico. Pueden ser asintomáticos o presentar manifestaciones atípicas (diarrea crónica, náuseas, vómitos e hipotensión), Los síntomas pueden estar asociados a ocupación de espacio ej dolor en localizaciones abdominales, tinitus y pérdida auditiva en los tumores localizados en cabeza y cuello. La estimulación de los receptores dopaminérgicos tipo 1 produce vasodilatación, y la de los receptores dopaminérgicos tipo 2 pre-sinápticos disminuye la liberación de noradrenalina de las terminaciones nerviosas. Estos efectos contrarrestan la vasoconstricción y cualquier efecto cardíaco causado por la co-liberación de noradrenalina presentando una clínica leve. Son tumores raros, en general más inmaduros y con frecuencia malignos.
Manifestaciones clínicas
La clínica va a depender de: 1) la liberación de catecolaminas, 2) el crecimiento tumoral y 3) la asociación a otras patologías.
1) Liberación de catecolaminas:
Las manifestaciones se asocian al tipo y cantidad de catecolaminas liberadas [4]. Clásicamente se relacionan con el desarrollo de hipertensión arterial (HTA), que puede ser paroxística o persistente, en torno a un 50% y 30% de los casos, respectivamente. En un 10-15% de los casos los FEO extra-adrenal-paragangliomas pueden cursar con normotensión e incluso hipotensión ortostática. Esto último se asocia a tumores productores de adrenalina y dopamina. Este tumor representa entre un 0.5-0.6% de las causas de HTA secundaria en la población general [3][4].
El FEO puede acompañarse de episodios de cefalea intensa, palpitaciones y sudoración. Sin embargo, ha sido denominado como ‘el gran simulador’. Esto se debe a su asociación con sintomatología muy variada: alteraciones endocrinas (hipercalcemia, síndrome de Cushing, diabetes mellitus tipo 2 en menores de 50 años con normopeso), metabólicas (acidosis láctica), quirúrgicas (abdomen agudo), cardiovasculares (shock, miocarditis, cardiomiopatía dilatada, insuficiencia cardíaca, bradicardia, taquicardia, infarto de miocardio, cardiomiopatía inducida por estrés o Takotsubo), neurológicas e intestinales.
Los paroxismos pueden aparecer espontáneamente o se pueden precipitar en determinadas situaciones como:
- procedimientos (colonoscopia)
- inducción anestésica
- micción (paragangliomas vesicales)
- manipulación del tumor
- toma de alimentos ricos en tiramina
- uso de fármacos: glucagón, betabloqueantes, corticoides, metoclopramida y antidepresivos tricíclicos.
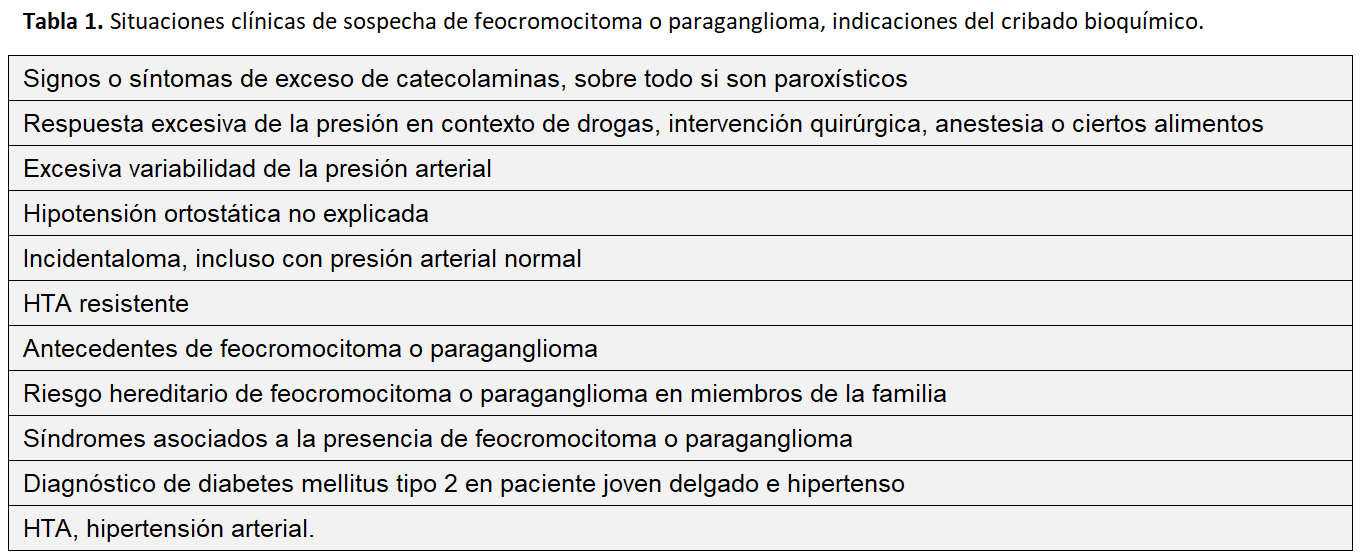
Las situaciones clínicas de sospecha y, por tanto, las indicaciones de cribado del FEO se exponen en la (Tabla 1). Durante el embarazo es rara la existencia de un FEO como causa de HTA. Sin embargo, en la gestación la posición en decúbito supino puede hacer que el útero grávido comprima el tumor causando HTA. A veces la presencia de HTA y proteinuria puede hacer difícil diferenciar un FEO de una preeclampsia [5][6][7].
2) Crecimiento tumoral:
Las manifestaciones clínicas asociadas al crecimiento tumoral son raras en los FEO y más frecuentes en paragangliomas, sobre todo en los de localización en cabeza y cuello. Estos últimos raramente son secretores, es decir son bioquímicamente silentes, y los síntomas están más relacionados con el efecto masa. También pueden producir invasión a distancia, siendo las metástasis esqueléticas, ganglionares, hepáticas y pulmonares las más frecuentes.
3) 3) Asociación a otras patologías [5][6][7] (ver siguiente apartado).
Genética del feocromocitoma y de los paragangliomas
Atendiendo a los perfiles de expresión génica y a las manifestaciones clínicas, los feocromocitomas y paragangliomas pueden dividirse en tres grandes grupos:
1. Mediadas por la vía de señalización de las kinasas (generalmente tumores adrenales con fenotipo adrenérgico)
1.1. Neoplasia endocrina múltiple (NEM) o multiple endocrine neoplasia (MEN):
1.1.1. MEN-1: Mutación en el gen de la menina, con herencia autosómica dominante. Se manifiesta con tumores neuroendocrinos de páncreas (no funcionantes, gastrinomas, insulinomas), hiperparatiroidismo primario, adenomas de la hipófisis anterior (no funcionantes, prolactinomas, somatropinomas), adenomas suprarrenales, FEOs.
1.1.2. MEN-2: Mutación activadora en el protooncogén RET. Representa el 50% de los FEOs sindrómicos.
- MEN 2a: FEO, carcinoma medular de tiroides, hiperparatiroidismo primario.
- MEN 2b: FEO, carcinoma medular de tiroides, ganglioneuromatosis intestinal y urinaria y hábito marfanoide.
1.2. Neurofibromatosis tipo 1, asociado al gen NF1 tumor-suppressor.
Representa el 3% de los FEOs síndromicos. Se manifiesta con trastornos neuro-cutáneos: manchas café con leche, hamartoma del iris (nódulos de Lisch), pecas axilares o inguinales, displasia ósea y múltiples neurofibromas. Puede acompañarse también de glioma del nervio óptico, tumor del estroma gastrointestinal (GIST) y FEO.
1.3. Se ha descrito también mutaciones en TMEM127 (FEO y carcinoma renal) y MAX (FEO).
2. Mediadas por la vía de la hipoxia (con más frecuencia tumores extra-adrenales, excepto la enfermedad de Von Hippel-Lindau, con fenotipo noradrenérgico):
2.1. Enfermedad de Von Hippel-Lindau (VHL) (20% de los FEOs sindrómicos): variedad de tumores benignos y malignos, principalmente tumores de retina y de cerebelo, y hemangioblastoma espinal, carcinoma de células renales y FEO. Asociada al gen VHL tumor-suppressor gene.
2.2. FEO-paraganglioma hereditario: presentan mutaciones en los genes que codifican para un enzima de la cadena respiratoria mitocondrial, la succinato deshidrogenasa (SDH). Se han descrito mutaciones en SDHD (9%), SDHC, SDHB (10%), SDHA (<1%) y SDHAF2. Las mutaciones en SDHB se asocia con tumores malignos (multifocal y metastásico) y, por tanto, mal pronóstico.
2.3. Síndrome de Reed: leiomiomatosis hereditaria y carcinoma de células renales. Asociado a mutación en la fumarato hidratasa (FH).
2.4. Otras: factor 2 alfa inducible por hipoxia (HIF-2 asociado a paraganglioma, policitemia y raramente somatostatinoma), eritrocitosis familiar asociado a mutación en PDH1 (gen EGLN2; policitemia con FEO y paraganglioma), eritrocitosis familiar asociado a mutación en PDH2 (gen EGLN1; policitemia con FEO y paraganglioma) y KIF1b (asociado a neuroblastoma).
3. Otras: Genes relacionados con la señalización de Wnt
3.1. Complejo esclerosis tuberosa: tumores benignos en cerebro, riñones, corazón, ojos, piel. En el riñón puede presentar angiomiolipomas bilaterales, quistes renales y, más raramente, tumor de células claras).
3.2. Enfermedad de Sturge-Weber: malformaciones capilares faciales y/o malformaciones vasculares ipsilaterales cerebrales y oculares).
La edad de presentación suele ser hasta 15 años más joven en los casos sindrómicos que en los esporádicos. Hay mucha heterogeneidad por lo que hay que sospechar un componente genético cuando el tumor cromafin aparece en: edades tempranas, con historia familiar previa, si hay confirmación de tumor maligno, tumores múltiples y paraganglioma [8]. Actualmente la detección de alteraciones en el estudio genético de pacientes con FEO unilateral, sin historia familiar y sin síntomas o signos sindrómicos es de un 8-28%, por lo que las guías aconsejan la realización de estudio genético en todos los casos.
Diagnóstico
El diagnóstico requiere la demostración de un aumento de catecolaminas o sus metabolitos y la documentación anatómica del tumor [5][7].
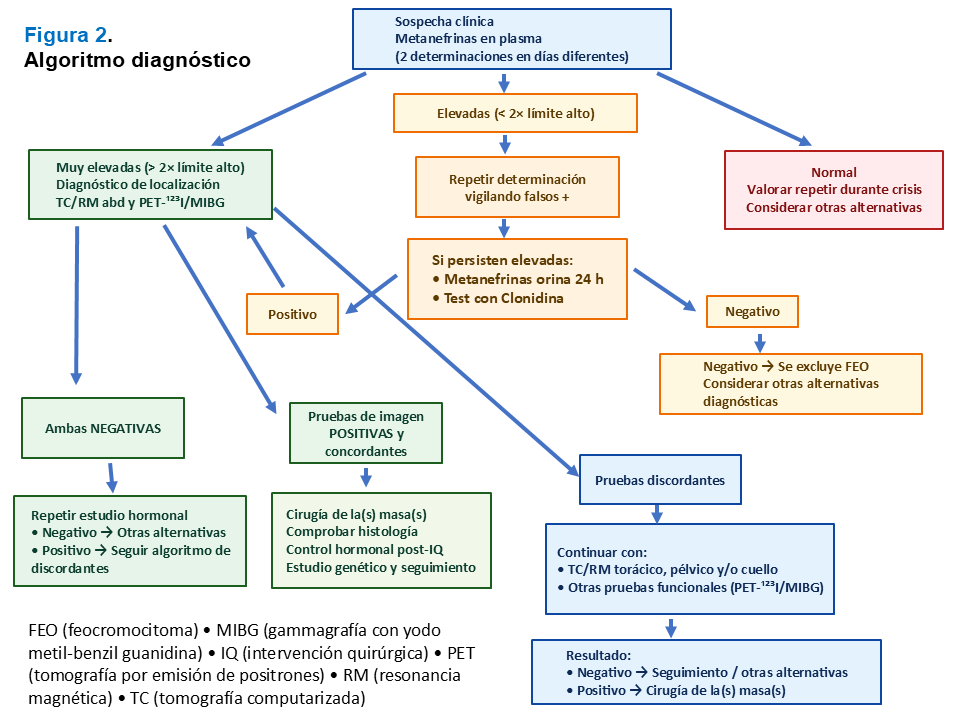
En estos tumores no se aconseja ni la toma selectiva de vena adrenal, ni la muestra para biopsia. La (Figura 2) muestra el algoritmo diagnóstico.
Determinaciones hormonales
Está indicada su realización en pacientes con manifestaciones clínicas sugestivas de FEO o en aquellos con tumores suprarrenales detectados casualmente (Tabla 1) [9]. Los tumores pueden liberar de forma episódica catecolaminas mientras que las metanefrinas se producen continuamente a partir de catecolaminas que salen al citoplasma desde las vesículas de almacenamiento [10]. De forma general se puede analizar:
1. Determinaciones en plasma:
1.1) Metanefrinas libres (metanefrina y normetanefrina) que tienen altas sensibilidad (98%) y menor especificidad (92%) por lo que son consideradas de elección para el cribado del FEO o paraganglioma. Un aumento de dos veces el límite superior es muy sugestivo. Tiene un valor predictivo negativo muy elevado excepto en tumores silentes.
1.2) Adrenalina, noradrenalina y dopamina. Los valores normales en pacientes asintomáticos no descartan la enfermedad, por lo que actualmente no se usan para el diagnóstico. Podría ser útil su determinación justo después de una crisis.
1.3) 3-metoxitiramina. En paraganglioma, enfermedad metastásica o sospecha de fenotipo dopaminérgico.
1.4) Cromogranina-A, que se almacena y se libera en las células cromafines juntamente con las catecolaminas. Es una determinación en desuso por tener baja especificidad. Únicamente se recomienda en pacientes con mutaciones en SDHB, ya que puede estar aumentada en casos de FEO pobremente diferenciado que no presentan un incremento de la secreción de catecolaminas o sus derivados.
2. Determinaciones en orina:
2.1) Metanefrinas fraccionadas en orina de 24h: alta especificidad, por lo que se recomienda cuando hay alta sospecha.
2.2) Catecolaminas libres: alta especificidad después de una crisis, pero múltiples interferencias en su determinación.
2.3) Ácido vanilmandélico: poco sensible, aunque muy específico.
La determinación de metanefrinas después de una crisis hipertensiva tiene gran valor diagnóstico [9].
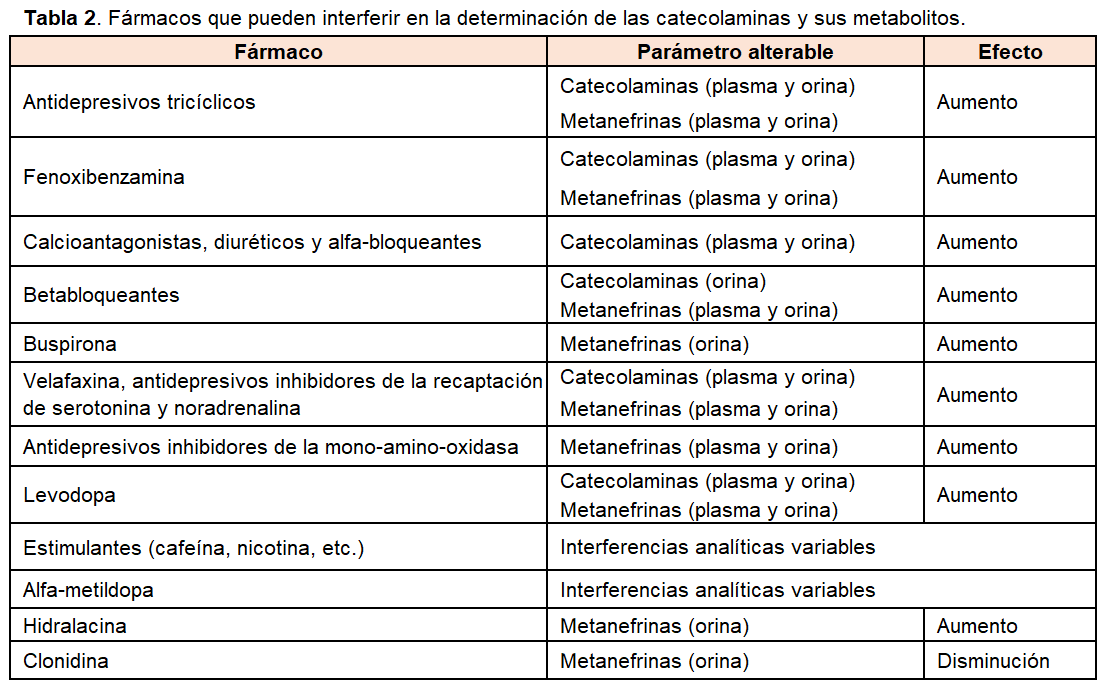
Las determinaciones hormonales citadas pueden verse artefactadas por diversas situaciones que pueden inducir a errores diagnósticos [11].
Son causas de falsos negativos:
1) tumores pequeños (<1 cm)
2) tumores que producen dopamina
3) tumores que no sintetizan noradrenalina o adrenalina o que no se metabolizan a metanefrinas
4) enfermedad microscópica
Son causas de falsos positivos:
1) situaciones de estrés: supresión aguda de clonidina, supresión aguda de alcohol, monoterapia con vasodilatadores arteriales como hidralacina o minoxidil, isquemia miocárdica aguda, ictus agudo, abuso de cocaína e insuficiencia cardiaca congestiva.
2) factores dietéticos: la ingesta de determinados alimentos puede producir elevación de la concentración de metanefrinas. Los factores dietéticos no influyen en la concentración de metanefrinas plasmáticas libres, ni de 3-metoxitiramina (valoradas mediante técnicas de HPLC o espectrometría de masas) siempre que se cumpla el ayuno desde la cena y se evite la ingesta de cafeína 24 h antes del análisis. En caso de estudio de metanefrinas fraccionadas en orina las restricciones dietéticas se deben realizar desde el día anterior y durante la recogida.
3) fármacos: determinados fármacos pueden interferir sobre el procedimiento de medida utilizado o por su efecto sobre la síntesis, metabolización y excreción de las catecolaminas o sus metabolitos (Tabla 2). En condiciones ideales, se debería retirar toda la medicación susceptible de causar interferencias, al menos una semana antes de la extracción de sangre o de la recogida de la orina. Desde el punto de vista operativo se aconseja realizar el cribado con la medicación habitual, salvo la Fenoxibenzamina, los antidepresivos tricíclicos y el Paracetamol que siempre deben retirarse. Si se obtiene un resultado positivo se debe repetir la prueba retirando cualquier medicación que pueda interferir.
En definitiva, es importante consensuar todos estos puntos con el laboratorio que realiza las determinaciones [12]. En situaciones con valores bioquímicos discretamente elevados, se puede realizar una “prueba de frenación con clonidina” para inhibir el flujo simpático, con el fin de distinguir pacientes con FEO con un nivel bajo de actividad, de los individuos sin FEO y con un aumento de la actividad simpática.
Diagnóstico de localización (tanto anatómica como funcional)
El diagnóstico de localización está indicado una vez que se haya confirmado, mediante pruebas bioquímicas, la existencia de un exceso de catecolaminas [13]. Hay alguna excepción a este orden en las pruebas diagnósticas, como un paciente en situación crítica o si hay sospecha de un tumor silente. La edad, las características bioquímicas, la historia familiar y la presencia de algún síndrome o mutación relacionada son importantes a la hora de considerar el tipo y la localización del tumor [1]. El 97-99% tienen localización abdominal (de estos el 85-90% son FEOs adrenales). La localización extra-adrenal más frecuente es el área para-aórtica (75%), seguido de vejiga (10%), tórax (10%), y cabeza, cuello y pelvis (5%).
Pruebas de imagen anatómica
La tomografía computarizada (TC) abdominopélvica o la resonancia magnética (RM) son técnicas sensibles para detectar masas suprarrenales, aunque poco específicas, por lo que se aconseja también realizar las pruebas funcionales. La posibilidad de precipitación de una crisis con el contraste endovenoso del TC es muy infrecuente. La atenuación no realzada de más de 10 HU en el TC es muy característica. En función del fenotipo hormonal, la sospecha clínica y los resultados obtenidos se solicitarán pruebas de imagen de otros territorios (tórax, pelvis y/o cuello). En los fenotipos noradrenérgico y dopaminérgico se aconseja descartar paraganglioma. En general, la RM se prefiere para tumores extra-adrenales y paragangliomas de cabeza y cuello, por una mejor resolución espacial (Figura 2).
Pruebas funcionales
La célula cromafín expresa diversos receptores y transportadores – como GLUT (transportador de glucosa), AAT (transportador de aminoácidos), SST (receptor de somatostatina) y NET (transportador de noradrenalina) – que permiten aprovechar la afinidad de distintos radiotrazadores para su localización. Esta característica se utiliza en las pruebas de imagen funcional para identificar tejido cromafín, lo que resulta especialmente útil en la detección de tumores múltiples o metástasis y también puede tener utilidad en el tratamiento. Estas pruebas son, por orden de preferencia [14]:
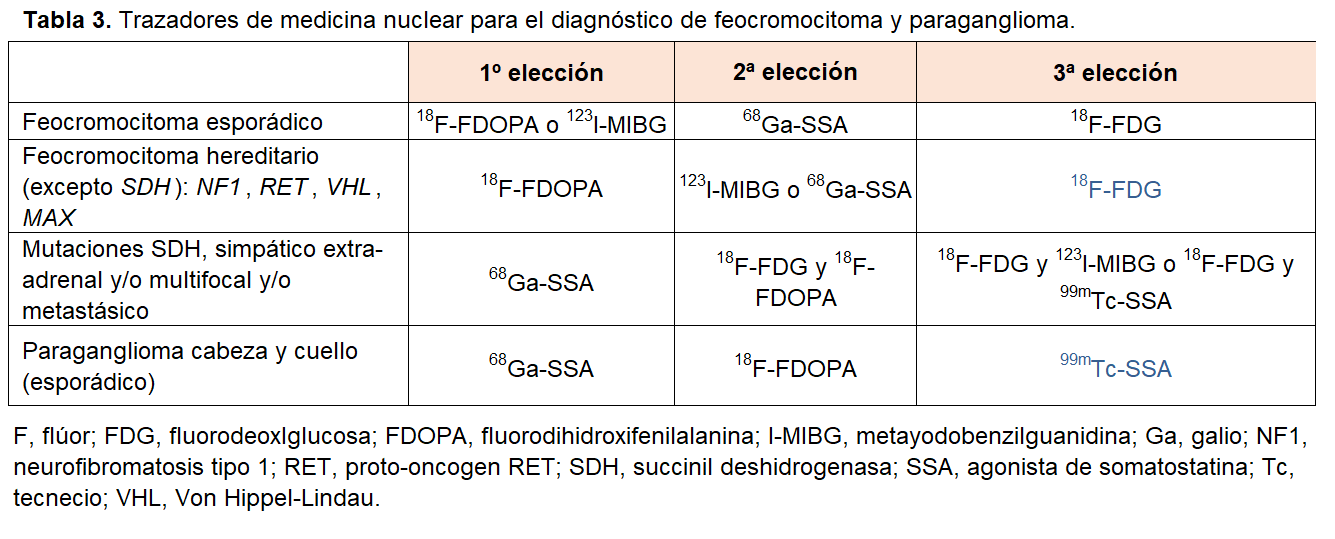
1) Tomografía por emisión de positrones (PET-TC): es preferible a la gammagrafía con metayodobencilguanidina (MIBG) y también ayuda para el estadiaje de la enfermedad neoplásica. Existen diversos radiofármacos: 18F-fluorodihidroxifenilalanina (18F-FDOPA), 18F-fluorodeoxyglucosa (18F-FDG), y varios DOTA asociados a agonistas de somatostatina (SSA) marcados con galio (DOTATATE, DOTATOC y DOTANOC en general denominados 68Ga-SSAs). La elección del radiofármaco depende del genotipo, del fenotipo bioquímico, del tamaño y de la localización (Tabla 3).
2) Gammagrafía con metayodobencilguanidina (análogo de la noradrenalina) (123I-MIBG): prueba específica (95-100%) aunque menos sensible (78%) que la anterior, por lo que una gammagrafía negativa no excluye el diagnóstico. El MIBG es captado a través del trasportador de membrana de noradrenalina (NET). Puede ocurrir que haya poca afinidad del MIBG por el NET, que la célula no almacene gránulos o que se pierda el transportador al desdiferenciarse la célula. De ahí que esta prueba no se aconseje en paragangliomas extradrenales y tumores malignos o metastásicos. En VHL apenas expresa NET por lo que no se aconseja su uso en esta patología.
Tratamiento
Una vez diagnosticado, todos los pacientes deben ser intervenidos [7]. La intervención por laparoscopia (adrenalectomía o tumorectomía) ha demostrado ser una técnica segura, aunque también se pueden utilizar otros abordajes: transperitoneal anterior, toracoabdominal o retroperitoneal laparoscópico, dependiendo de la localización y del tamaño del tumor. Se trata de un procedimiento con alto riesgo quirúrgico, por lo que es aconsejable un equipo con experiencia y multidisciplinar. En pacientes con diagnóstico sindrómico pre-intervención, es fundamental evaluar los otros órganos potencialmente afectados asociados al síndrome. Además, se debe considerar la viabilidad y seguridad de preservar una cantidad adecuada de corteza adrenal, equilibrando esto con el riesgo de recidiva.
Los paragangliomas de cabeza y cuello tienen crecimiento lento y sintetizan pocas catecolaminas por lo que, aunque la resección es el tratamiento curativo, dependiendo del tamaño, localización y clínica que presenta (compresión), se pueden realizar cirugías menos invasivas por las potenciales secuelas. En pacientes con enfermedad localmente avanzada o si presentan metástasis, se puede optar por la radioterapia, el tratamiento con radionúclidos ([¹³¹I]-MIBG, [177Lu]Lu-DOTA-TATE) o la quimioterapia en función de cada caso.
Tratamiento farmacológico preoperatorio
Lo más importante antes de la intervención es el bloqueo de receptores alfa adrenérgicos. Se puede hacer con Doxazosina (bloqueo selectivo receptor alfa-1 con dosis de inicio de 2 mg/día, incrementable hasta 16 mg/día preferiblemente con formulación de liberación retardada, durante 4 semanas (mínimo 1 semana) [15][16]. Si a la semana de iniciado el bloqueo alfa el paciente presenta extrasistolia frecuente o frecuencia cardiaca superior a 90 lpm en reposo, se puede asociar un beta-bloqueante (preferible β1 selectivo). Se recomienda no iniciarlo antes de los alfa-bloqueantes para evitar crisis hipertensivas debido a la perdida de vasodilatación mediada por β2. En el caso de intolerancia a los alfa-bloqueantes o control insuficiente con los fármacos anteriores, se puede usar un calcioantagonista.
En estos pacientes hay que evitar la administración de fármacos que puedan provocar crisis hipertensivas como antagonistas de los receptores dopaminérgicos D2, simpaticomiméticos, opioides, inhibidores de la recaptación de NA, inhibidores de la recaptación de serotonina, iMAO, relajantes musculares del grupo benzilisoquinolinas y despolarizantes.
Preparación pre-cirugía
Es importante realizarla e incluye el tratamiento farmacológico anteriormente comentado y una adecuada evaluación cardiovascular. El objetivo es identificar enfermedad cardíaca subyacente funcional o estructural, si hay duda puede ser preciso realizar un ecocardiograma. En caso de identificarse condiciones cardíacas activas, deben ser valoradas y tratadas previamente. Se recomienda alcanzar los siguientes criterios pre-intervención (tiempo mínimo estimado un mes): 1) mantener la presión arterial en bipedestación >90/50 mmHg y <160/90 mmHg y en sedestación <130/80 mmHg, 2) mantener la frecuencia cardíaca ≤90 lpm (60-70 lpm sedestación y 70-80 lpm en bipedestación), 3) presentar menos de 5 extrasístoles ventriculares por minuto, y 4) no presentar alteración del segmento ST y onda T. Además, la vasoconstricción periférica mantenida, mediada por las catecolaminas, provoca una depleción de volumen que será necesario reponer para evitar inestabilidad hemodinámica intraoperatoria. En este sentido se recomienda dieta rica en sodio e importante ingesta hídrica (2-3 L/día) previo a la intervención.
Recomendaciones para la cirugía y postoperatorio inmediato
Los objetivos intraoperatorios son mantener euvolemia, estabilidad hemodinámica, normocapnia, normoxemia y normoglicemia, además de mantener un plano anestésico profundo.
Las complicaciones intraoperatorias más frecuentes son la HTA, la aparición de arritmias y la hipotensión post-exéresis tumoral [17]. Se recomienda iniciar la analgesia postoperatoria antes de finalizar la intervención y pautar tratamiento corticoideo sustitutivo en los casos de suprarrenalectomía bilateral.
Las complicaciones postoperatorias más frecuentes son la hipotensión e HTA, por lo que habrá que ajustar el tratamiento según la evolución de la presión. También pueden presentarse somnolencia, hipoglucemia y trastornos electrolíticos en las siguientes 24 horas de la intervención, por lo que se aconseja monitorizarización.
Seguimiento
Monitorización periódica de metanefrinas y seguimiento a largo plazo
En el postoperatorio se recomienda repetir los controles de metanefrinas entre las 2-6 semanas posteriores. Deben normalizarse en aproximadamente una semana tras la cirugía, si no es así, está indicado realizar una prueba de imagen a los 3-6 meses de la intervención por la posibilidad de tumor residual. Posteriormente, se aconseja la evaluación clínica y bioquímica anual durante los cinco primeros años y cada dos años posteriormente hasta completar 10 años de seguimiento [3] En los pacientes con tumores sindrómicos o mutaciones germinales el control es de por vida, dado el alto riesgo de recidiva.
Estudio anatomo-patológico y molecular
El estudio histológico confirmará el diagnóstico del FEO o paraganglioma. Se han desarrollados diversas escalas anatomo-patológicas para orientar ante la posibilidad de malignidad del tumor, como la Pheochromocytoma of Adrenal Gland Scaled Score (PASS) y la Grading System for Adrenal Pheochromocytoma and Paraganglioma (GAPP), sin embargo, es difícil prever el comportamiento de los tumores [18]. Únicamente la presencia de invasión local en tejidos u órganos adyacentes (p.ej. riñón, hígado) o una metástasis es la confirmación de un tumor maligno, por lo que hoy en día se prefiere el termino de FEO metastásico en vez de FEO maligno. Hay que informar siempre al paciente que hay un riesgo de malignidad y que no hay por el momento datos claros para diferenciar tumor benigno de metastásico.
Los avances tecnológicos han permitido identificar diversos perfiles moleculares que podrían ayudar en la predicción del comportamiento tumoral y en la orientación de las estrategias de manejo y seguimiento [19].
De manera que las características especiales de este tumor hacen que estos pacientes deban hacer seguimiento en un centro con una unidad especializada de abordaje multidisciplinar.
Estudio sindrómico y genético
Una vez confirmado el diagnóstico, hay que recoger la historia familiar y realizar el despistaje de enfermedad sindrómica por las potenciales implicaciones diagnósticas y terapéuticas. El estudio genético está indicado en todos los casos sindrómicos y no sindrómicos. Cerca de un 40% de los pacientes son portadores de una mutación en las células germinales. Se prefiere el estudio en el DNA del tumor que en el DNA de la sangre o de la mucosa oral. Una edad más avanzada o ausencia de historia familiar no excluye mutación germinal ya que puede ser el reflejo de una baja penetrancia de algunas mutaciones. Los genes a estudiar en casos no sindrómicos aumentan a medida que se van descubriendo nuevos genes implicados. Se han identificado más de 15 genes de predisposición al feocromocitoma (SDHA, SDHB, SDHC, SDHD, RET, VHL, NF1, TMEM127, MAX, FH, KIF1B). Por ello, el diagnóstico genético debería realizarse con secuenciación masiva de un panel de genes que incluya como mínimo los genes más frecuentemente mutados (SDHB, RET, VHL, NF1, SDHD, SHDAF2 FH, MAX). En general la herencia es con un patrón autosómico dominante, por lo que hay que realizar consejo genético en los casos indicados.
Tumores metastásicos
Los factores de mal pronóstico para un curso maligno de la enfermedad son el tamaño grande del tumor y la presencia de extensión local en el momento de la cirugía. Los casos que más frecuentemente metastatizan son SDHB (43%), seguidos de VHL, SDHD y NF1. Si es posible, se aconseja resecar las metástasis, aunque hay que individualizar el tratamiento. Hay diversas alternativas: 1) resección total o la mayor cantidad posible, ya que puede mejorar los síntomas, disminuir la secreción de hormonas, prevenir complicaciones asociadas al crecimiento del tumor en localizaciones críticas y mejorar la respuesta a otros tratamientos; 2) según si captan o no el radiotrazador, se puede usar tratamiento con radionúclidos ([¹³¹I]-MIBG, [¹¿¿Lu]Lu-DOTA-TATE); 3) crioablación; 4) quimioterapia CVD (Ciclofosfamida, Vincristina y Dacarbazine) ha demostrado beneficio, pero no curación, responden mejor las mutaciones SDHx; 5) radiación externa, ablación percutánea, quimio-embolización percutánea; y 6) inhibidores de la tirosin-kinasa, mTOR e inhibidores HIF2A pueden ser una alternativa.
En general, en metástasis con rápida progresión se recomienda quimioterapia y con lenta progresión radioterapia.
Incidentaloma suprarrenal
El hallazgo casual de un tumor en la glándula suprarrenal (incidentaloma) debe estudiarse porque pueden ser funcionalmente activos y malignos [20] [21]. El 80-85% son adenomas (el 70% no funcionantes), el resto presentan etiologías variadas:
- 5-10% producen de manera autónoma cortisol (Cushing subclínico)
- 3-4% son FEO,
- 2-5% son casos de hiperaldosteronismo primario,
- 3-4% síndrome de Cushing
- 3-7% son metástasis.
Hay que evaluar dos aspectos:
1) Crecimiento y características del nódulo: revisar si hay una prueba de imagen previa para poder comparar y si hay historia oncológica ya que podría tratarse de una metástasis. Se aconseja repetir el estudio de imagen a los 6-12 meses, pero raramente está indicado reiterar la evaluación si no se producen cambios clínicos y el nódulo no ha crecido más de 3 mm/año (los adenomas son de crecimiento muy lento). Según las últimas guías, no sería necesario repetir la TC si por las características radiológicas se puede determinar que se trata de un adenoma. Los signos radiológicos que sugieren benignidad son: homogeneidad, nódulo bien delimitado, rico en grasa y densidad < 10HU, aunque un 30% de los adenomas benignos tienen una atenuación > de 10HU. Son signos de malignidad: crecimiento rápido, heterogeneidad, forma irregular, calcificaciones, necrosis e invasión de estructuras adyacentes.
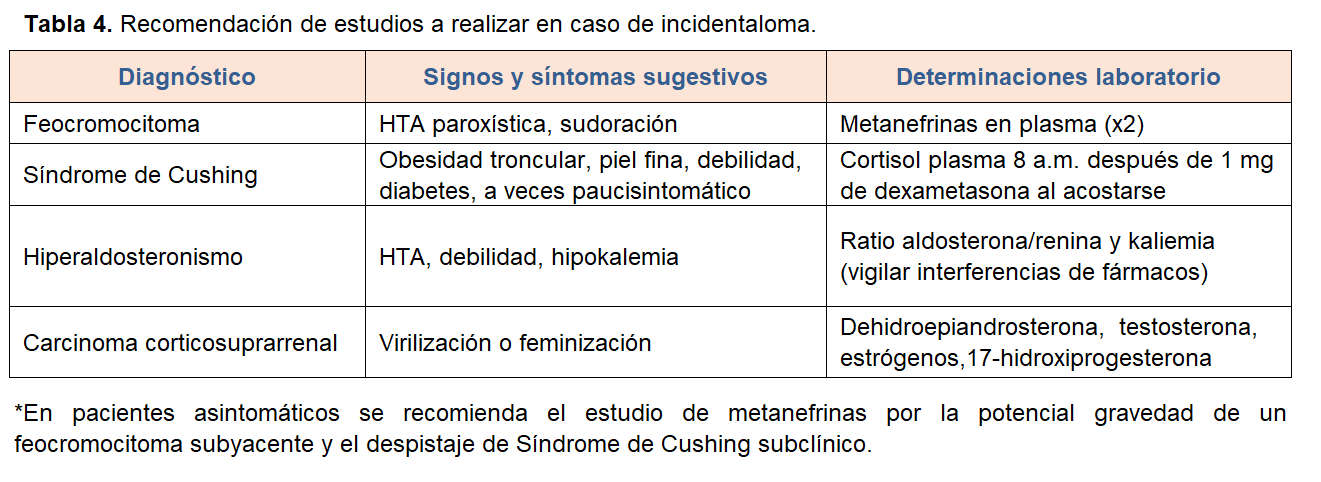
2) Funcionalidad hormonal: realizar un estudio hormonal dependiendo de las manifestaciones clínicas asociadas que presente el paciente (Tabla 4). En pacientes asintomáticos recomendamos el estudio de las MNs por la potencial gravedad de un FEO subyacente y el despistaje de síndrome de Cushing subclínico. También se recomienda determinarlas en caso de imágenes sugestivas de metástasis.
Si el paciente no presenta HTA ni hipopotasemia, no es necesario evaluar el eje renina-angiotensina-aldosterona. En caso de incidentalomas, cada lesión debe ser evaluada de manera independiente. Se recomienda incluir en el estudio hormonal 17-OH-progesterona para excluir hiperplasia suprarrenal.
Independientemente del resultado hormonal, se recomienda cirugía en tumores mayores de 4-5 cm, a excepción de pacientes con antecedentes oncológicos, en quienes podría estar indicado realizar un PET/CT [20] [21].