Hiperaldosteronismo primario
Palabras clave
Hipopotasemia, Alcalosis metabólica, hiperaldosteronismo familiar
Introducción
Se define hiperaldosteronismo primario (HAP) como un grupo de alteraciones de la glándula suprarrenal en el que se produce un exceso de aldosterona de manera autónoma (no suprimible), que conlleva hipertensión arterial (HTA), retención de sodio, pérdida urinaria de potasio, con o sin hipopotasemia y alcalosis metabólica. La aldosterona aumenta la reabsorción de sodio y agua y la eliminación de potasio e hidrogeniones en el túbulo renal distal. El HAP, también denominado síndrome de Conn, se caracteriza por una hipersecrección anómala de aldosterona que es independiente de los estímulos para su regulación como el sistema renina-angiotensina-aldosterona (SRAA), el volumen intravascular o la concentración de potasio en sangre [1].
El HAP es una causa frecuente de HTA secundaria y de HTA resistente y conlleva un aumento del riesgo vascular y del daño orgánico relacionado tanto con los niveles de presión arterial (PA) como con los niveles de aldosterona [2].
En el presente artículo, se revisan las indicaciones de cribado, los métodos analíticos y radiológicos para llevar a cabo el despistaje y la confirmación diagnóstica y las posibilidades terapéuticas del HAP.
Prevalencia de hiperaldosteronismo primario
El HAP es una causa infradiagnosticada de HTA secundaria. Los estudios más antiguos sugirieron una prevalencia de HAP menor del 1% en pacientes hipertensos, en probable relación con la indicación del cribado únicamente en pacientes que presentaban la triada clásica de HTA, hipopotasemia y alcalosis metabólica. Estudios más recientes con cribado extendido a pacientes hipertensos en general, como el estudio PAPY (Primary Aldosteronism Prevalence in Hypertensives) y el estudio PATO (Primary Aldosteronism in Torino) indican prevalencias de HAP del 11,2% y 5,9%, respectivamente [3][4]. Además, el HAP es una de las causas más frecuentes de HTA resistente, habiéndose descrito prevalencias de HAP de en torno al 20% en pacientes con resistencia al tratamiento antihipertensivo [5].
Presentación clínica del hiperaldosteronismo primario
La triada clásica del HAP es HTA, hipopotasemia inexplicable por otros motivos y alcalosis metabólica. Sin embargo, según el estudio PAPY sólo un 48% de los pacientes con adenoma suprarrenal o un 17% de los pacientes con HAP secundario a hiperplasia suprarrenal bilateral presentan hipopotasemia.
Hipertensión arterial
La HTA es el hallazgo principal en el HAP. La elevación de la PA es dependiente de la expansión de volumen. La persistencia de la hipervolemia aumenta las resistencias vasculares y esto perpetúa la HTA. Además, la hipervolemia es responsable de la supresión de la renina plasmática, que da lugar a niveles bajos de renina en plasma. Los niveles bajos de renina plasmática permiten diferenciar el HAP de las formas secundarias de hiperaldosteronismo hiperreninémicos como la hipertensión renovascular, la coartación de aorta, las neoplasias secretoras de renina y el tratamiento diurético. La HTA asociada al HAP suele ser una HTA resistente, de difícil control, y se caracteriza por un potencialmente importante daño de órgano diana debido al efecto de las altas concentraciones de aldosterona a nivel cardiaco en particular y vascular en general. De hecho, cuando se comparan los pacientes con HTA secundaria a HAP con hipertensos esenciales, estos tienen mayor albuminuria, mayor hipertrofia ventricular izquierda y mayores eventos cardiovasculares a largo plazo [1][2][6]. A pesar de la expansión del volumen, los pacientes con HAP no tienen edemas. Esto se explica por el fenómeno de escape de la aldosterona. Inicialmente, la aldosterona aumenta el volumen extravascular, estimulando por un lado la liberación del péptido atrial natriurético y por otro aumentando la presión de perfusión renal, disminuyendo la reabsorción de sodio a nivel del túbulo proximal, favoreciendo la natriuresis y aumentando diuresis que regula el volumen e impide la formación de edemas.
Hipopotasemia
La hipopotasemia puede estar presente únicamente en menos de la mitad de los pacientes con HAP. La aparición de hipopotasemia va a depender de la ingesta de sodio y del estado de volemia. Por eso, es importante para hacer el cribado del HAP que el paciente realice una ingesta diaria mínima de 5 gramos de sal y no esté hipovolémico. Si aumenta la ingesta de sodio, aumenta el flujo en el túbulo distal que estimula la secreción de aldosterona y con ello la eliminación de potasio, justificando así que muchos pacientes con HAP que realizan dieta con restricción de sodio presenten niveles normales de potasio. Para valorar la eliminación de potasio en orina, que debe estar aumentada en pacientes con HAP, utilizamos el gradiente transtubular de potasio (Calculadora). Este gradiente permite valorar la eliminación de potasio corregido según la reabsorción de agua en el túbulo colector. La fórmula para la determinación es: osmolaridad en orina por potasio en plasma dividido por la osmolaridad en plasma por potasio en orina. Un gradiente transtubular mayor de 7 implica un exceso de la acción de aldosterona a nivel tubular y es característico de los pacientes con HAP.
Alcalosis metabólica
La alcalosis metabólica suele asociarse a la hipopotasemia y se debe al aumento en la excreción urinaria de hidrogeniones secundaria a la hipopotasemia y al efecto directo de la aldosterona en la acidificación en el túbulo renal distal.
Riesgo cardiovascular
Los pacientes con HAP tienen mayor morbilidad y mortalidad cardiovascular que los pacientes con HTA esencial con los mismos niveles de PA. El riesgo cardiovascular del HAP es independiente de los niveles de potasio en plasma. Los pacientes con HAP tienen mayor hipertrofia de ventrículo izquierdo, mayor disfunción sistólica, más riesgo de ictus, de infarto de miocardio y de fibrilación auricular comparado con pacientes con otro tipo de HTA [6].
Síndrome metabólico
El síndrome metabólico y la diabetes mellitus son más prevalentes en pacientes con HAP que en población general o en pacientes con HTA esencial. La obesidad se asocia con mayores concentraciones de aldosterona en diferentes estudios. Además, los pacientes obesos tienen una mayor prevalencia de síndrome de apnea-hipopnea del sueño (SAHS). El SAHS es una causa frecuente de HTA resistente. La obstrucción de la vía aérea presente en los pacientes con SAHS estimula el SRAA y en concreto la aldosterona, presentando en una gran proporción de casos una secreción inadecuada de aldosterona.
Alteraciones renales
La aldosterona produce hiperfiltración glomerular y aumento de la presión de perfusión renal (independientemente de la hipertensión sistémica) y esto aumenta la excreción de albúmina. Estos cambios son reversibles con el tratamiento médico o quirúrgico del HAP.
Alteraciones en la natremia
La expansión de volumen inhibe la hormona antidiurética y la sed, y esto aumenta la natremia, que suele oscilar entre 143 y 147 mEq/L.
Calidad de vida
Varios estudios han demostrado el impacto negativo del HAP en la calidad de vida [72][73][74]. En una revisión sistemática de 15 estudios, los pacientes no tratados mostraron una disminución de la calidad de vida tanto física como mental con respecto a la población general. Síntomas de ansiedad, estrés, depresión y nerviosismo son descritos más frecuentemente en pacientes con HAP que en la población general y que en pacientes con hipertensión [7]. Tanto el tratamiento médico como el quirúrgico mejoran los parámetros de calidad de vida pero el tratamiento quirúrgico ocasiona una mejoría añadida en estas variables [8].
Diagnóstico diferencial
El diagnóstico diferencial de pacientes con HAP se debe realizar entre todas las situaciones que pueden cursar con HTA e hipopotasemia: HTA esencial y uso de diuréticos, HTA renovascular, síndrome de Cushing, otros trastornos suprarrenales como los tumores productores de hormonas sexuales y el uso abusivo de regaliz (el ácido glicirrínico inhibe la 11-beta-hidroxilasa).
Subtipos de hiperaldosteronismo primario
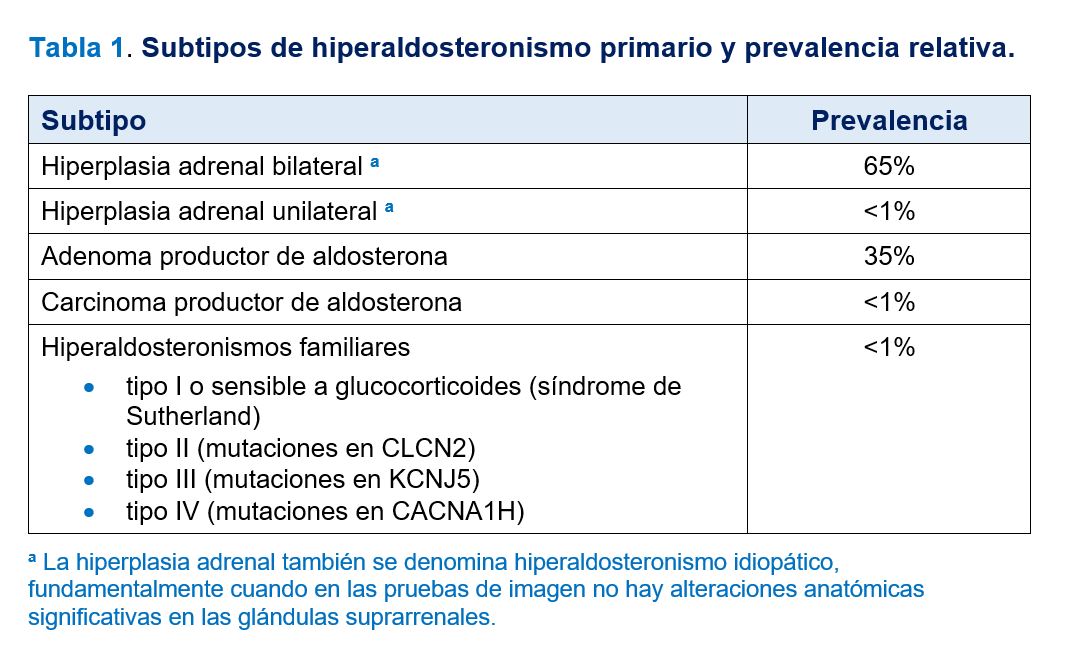
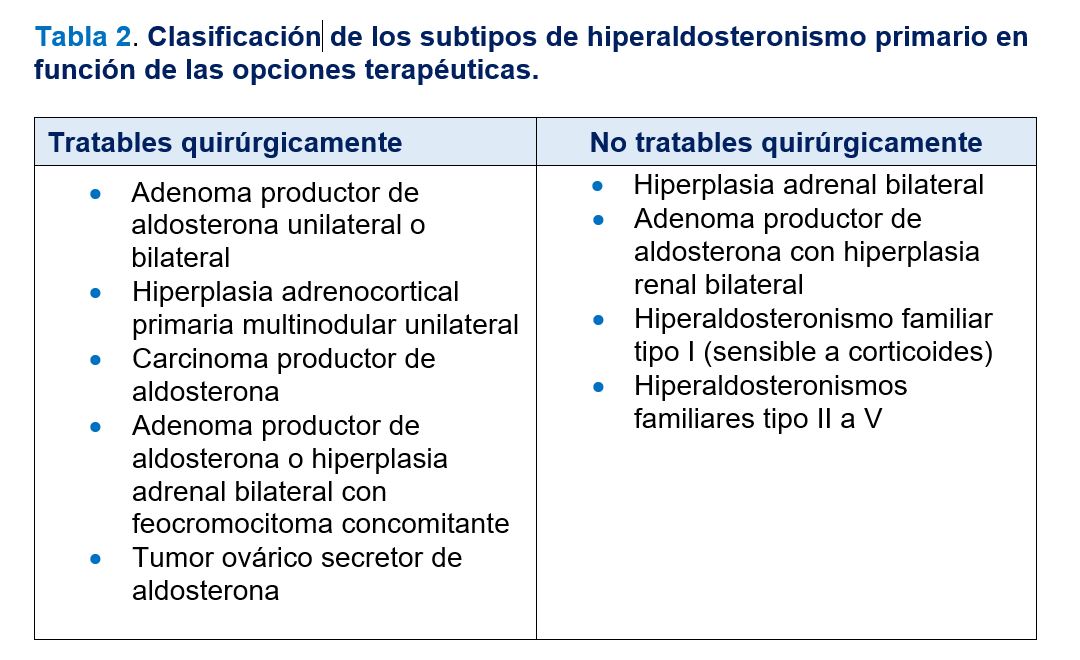
Los subtipos más frecuentes de HAP y su prevalencia se exponen en la (Tabla 1). Las formas más frecuentes son la hiperplasia suprarrenal bilateral y los adenomas productores de aldosterona. Las formas menos frecuentes incluyen los hiperaldosteronismos familiares tipos I a IV, la hiperplasia suprarrenal unilateral, los carcinomas adrenocorticales productores de aldosterona y los tumores ectópicos productores de aldosterona. Desde el punto de vista clínico, la clasificación más útil de los subtipos de HAP distingue los que se tratan quirúrgicamente de los que no son susceptibles de cirugía (Tabla 2).
Formas genéticas de hiperaldosteronismo
El hiperaldosteronismo familiar es un subconjunto poco frecuente del HAP. Existes cuatro formas de hiperaldosteronismo familiar denominados tipos I a IV [9].
Hiperaldosteronismo familiar tipo I
El hiperaldosteronismo familiar tipo I, o hiperaldosteronismo sensible a glucocorticoides o síndrome de Sutherland, se debe a la mutación en un gen quimérico CYP11B1/CYP11B2. El gen CYP11B1 localizado en el brazo largo del cromosoma 8 (8q21) codifica una enzima denominada 11-beta-hidroxilasa. Esta enzima ayuda a producir cortisol y corticosterona. La corticosterona se convierte en aldosterona a través de la enzima aldosterona-sintasa codificada por el gen CYP11B2, situado en el brazo largo del cromosoma 8 (8q21-q22). Un cambio genético que afecta al gen CYP11B1 y al gen CYP11B2 da lugar a este tipo de HAP. Este cambio une la sección del gen CYP11B1 denominada región promotora que ayuda a iniciar la codificación de la enzima 11-beta-hidroxilasa con la sección del gen CYP11B2 que codifica la aldosterona- sintasa. Esta fusión aumenta la producción de aldosterona y esta hipersecreción puede ser revertida con dosis fisiológicas de corticoides. La herencia es autosómica dominante. Es una causa infrecuente de HAP y debe sospecharse en pacientes con historia familiar de HAP que desarrollan HTA en las 2 primeras décadas de la vida. Más de la mitad de los pacientes tiene niveles de potasio plasmáticos normales, pero pueden desarrollar hipopotasemia incluso grave con la administración de tiazidas. Son frecuentes las complicaciones cerebrovasculares, principalmente ictus hemorrágicos debidos a la ruptura de aneurismas intracraneales. Se desconoce la causa del mayor riesgo de ictus hemorrágicos, pero una de las hipótesis planteadas es que la HTA congénita durante los estadios iniciales del desarrollo cerebrovascular pueda ser un factor responsable. En estos pacientes, se debe realizar cribado de aneurismas intracraneales en el momento del diagnóstico y cada 5 años. El diagnóstico se basa en el test de supresión de aldosterona con dexametasona, en la detección de hipersecreción de 18-hidroxicortisol y 18-oxocortisol en plasma y, fundamentalmente, en el estudio genético. El tratamiento del hiperaldosteronismo familiar tipo I son los corticoides (Prednisona, Dexametasona o Hidrocortisona).
Hiperaldosteronismo familiar tipo II
El hiperaldosteronismo familiar tipo II se ha relacionado con una mutación en el gen CLCN2 que codifica el canal del cloro CLC-2. La herencia es autosómica dominante. En el hiperaldosteronismo familiar tipo II se observa una agrupación familiar de casos de adenomas productores de aldosterona, hiperplasia suprarrenal bilateral o ambos. El hiperaldosteronismo familiar tipo II es indistinguible del HAP no familiar tanto desde el punto de vista bioquímico como morfológico y en la actualidad no hay test genéticos para el diagnóstico.
Hiperaldosteronismo familiar tipo III
El hiperaldosteronismo familiar tipo III está causado por mutaciones en el canal de potasio KCNJ5. El gen KCNJ5 está situado en el brazo largo del cromosoma 11 (11q24) y codifica una proteína que funciona como canal de potasio. Las mutaciones en este gen producen canales de potasio que son menos selectivos, permitiendo el paso de otros iones como el sodio, estimulando así la producción de aldosterona. La herencia es autosómica dominante y constituye una causa muy infrecuente de HAP. Esta forma de hiperaldosteronismo familiar debe sospecharse en pacientes con hiperplasia adrenal bilateral masiva. El diagnóstico es genético y el tratamiento es farmacológico aunque en casos refractarios con hiperplasia adrenal bilateral masiva puede ser necesario la adrenalectomía bilateral.
Hiperaldosteronismo familiar tipo IV
El hiperaldosteronismo familiar tipo IV está causado por mutaciones en el gen CACNA1H que codifica la subunidad alfa de un canal de calcio tipo L. El diagnóstico es genético y el tratamiento es farmacológico.
Diagnóstico
Indicaciones de cribado de hiperaldosteronismo primario
El cribado del HAP se realiza midiendo en plasma las concentraciones de aldosterona y la actividad de renina plasmática (ARP) o concentración de renina directa (CRD) para establecer el cociente aldosterona/renina plasmática, ARR (aldosterone to renine ratio en la literatura internacional) [10].
En las guías especializadas de Endocrinología [11][12] o de HTA [13][14][15], no se recomienda realizar el cribado de HAP a todo paciente hipertenso. Las situaciones clínicas de sospecha y, por tanto, de indicación de realizar el cribado de HAP se exponen en la (Tabla 3). Además, algunos autores han recomendado recientemente realizar cribado también a pacientes con inicio de fibrilación auricular no explicada puesto que se ha observado una mayor incidencia en el HAP en relación con el efecto nocivo de la aldosterona a nivel cardiaco. Por otra parte, hay autores que indican que el HAP está infradiagnosticado y que recomiendan que el ARR debería realizarse en todos los pacientes hipertensos en al menos una ocasión.
Unidades de medida en la determinación del cociente aldosterona / renina
Como se ha comentado, la evaluación secuencial de un paciente con sospecha diagnóstica de HAP comienza con la determinación de la concentración de aldosterona en plasma y de la ARP o la CRD para obtener el cociente aldosterona/renina plasmática o ARR [10], en una muestra sanguínea obtenida a primera hora de la mañana en sedestación. La ARP refleja la actividad enzimática de la renina (cantidad de angiotensina I generada por unidad de tiempo) mientras que la CRD es la propia concentración de la renina en plasma. Los valores normales del cociente aldosterona/renina plasmática o ARR en sujetos sanos y en pacientes con HTA esencial se sitúan entre 4 y 10 cuando aldosterona y ARP se expresan en ng/dL y ng/mL/h, respectivamente. En la mayoría de los pacientes con hiperaldosteronismo, el ARR llega a cifras de 30-50. En general, un ARR superior a 20 es considerado sospechoso de HAP, aunque otros autores usan 30 como punto de corte. Los valores de los puntos de corte también dependen las unidades en las que se midan la aldosterona plasmática y la CRD y varían en función del ensayo que se use para su determinación. En España, la mayoría de los laboratorios utilizan la concentración de aldosterona en ng/dL o pg/mL mientras que existe variabilidad en la evaluación de la renina entre la ARP en ng/mL/h y la CRD en µU/mL y mU/L. Existe una correlación directa entre ambas medidas de tal forma que 1 ng/mL/h de ARP equivale a 12 mU/L de CRD. Con menor frecuencia, la aldosterona plasmática se mide en pmol/L (1 ng/dL o 10 pg/mL equivalen a 27,7 pmol/L). Con respecto a los puntos de corte del ARR comentados de 20 o 30 (ng/dL)/(ng/mL/h), las equivalencias para la medida mediante CRD son 2,4 y 3,7 (ng/dL)/(mU/L) o (ng/dL)/(μU/mL). Cuando la aldosterona plasmática se mida en pmol/L, el punto de corte del ARR correspondiente a 30 (ng/dL)/(ng/mL/h) es 750 (pmol/L)/(ng/mL/h) [11]. Existe una APP de uso libre (ARR-app), en la que se pueden realizar cálculos de ARR en función de las diferentes medidas de aldosterona y renina.
Condiciones para la determinación del cociente aldosterona / renina
Para la realización del ARR y con el fin de evitar interferencias en los valores de la aldosterona y de la renina se recomienda: 1) suspender, siempre que la situación clínica lo permita, los fármacos que interfieren con el SRAA, 2) corregir los niveles de potasio en caso de hipopotasemia, 3) evitar una dieta de contenido bajo en sal y 4) efectuar la extracción de sangre cuando el paciente lleve levantado al menos 2 horas y tras un periodo previo de reposo.
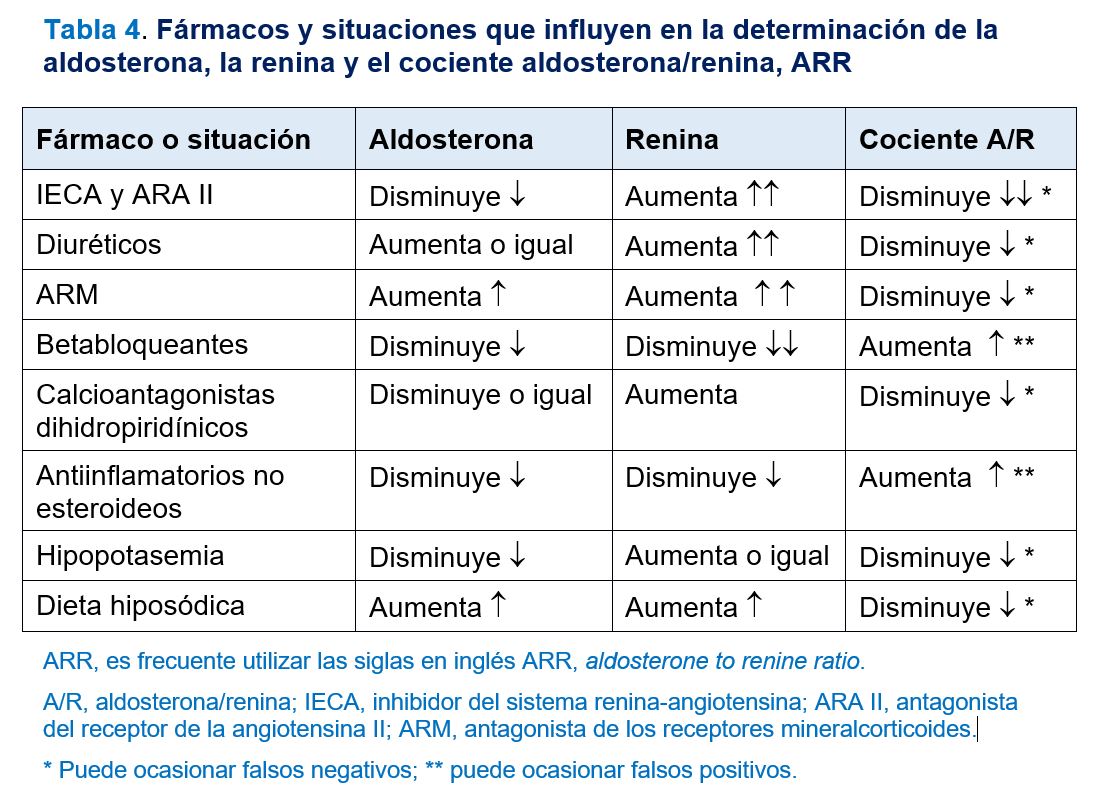
Fármacos intercurrentes y determinación del cociente aldosterona / renina
La medición del ARR se realizará suspendiendo previamente, siempre que la situación clínica lo permita, los fármacos que interfieran con el SRAA, sobre todo los que estimulan la secreción de renina, como los diuréticos (incluidos los ahorradores de potasio), los inhibidores del enzima de conversión de la angiotensina (IECA), los antagonistas de los receptores de la angiotensina II (ARA II) y los calcioantagonistas dihidropiridínicos. Los inhibidores directos de la renina (IDR), como aliskiren, también deben suspenderse. Los IDR, debido a su acción en el inicio del SRAA, conllevan una disminución de la ARP pero un aumento en la CRD. Otras situaciones, no derivadas del uso de fármacos, que ocasionan un estímulo de la secreción de renina son la dieta de contenido bajo en sal y la hipopotasemia. Todas estas circunstancias que conllevan estímulo de la secreción de renina pueden ocasionar falsos negativos en la medición del ARR. Desde el punto de vista práctico, una cifra de renina no suprimida en un paciente tratado con diuréticos o bloqueantes del SRAA no excluye el diagnóstico de HAP pero la obtención de una cifra de renina suprimida en estas circunstancia es un fuerte predictor del diagnóstico de HAP.
Por otra parte, los betabloqueantes, los agentes antihipertensivos de acción central como Alfametildopa y los antiinflamatorios no esteroideos pueden ocasionar disminución de la secreción de renina por lo que pueden conllevar falsos positivos en la evaluación del ARR. En la (Tabla 4), se resumen los efectos de estos fármacos y situaciones sobre el SRAA y la determinación del ARR. Los diuréticos deben suspenderse 4 semanas antes de la realización de la prueba y el resto de los fármacos 2 semanas antes.
Con respecto a los antagonistas del receptor de mineralocorticoides (ARM), espironolactona y eplerenona, estos fármacos impiden que la aldosterona active el receptor, lo que conlleva pérdida de sodio, disminución del volumen plasmático, elevación de ARP y reducción del ARR. Por esta razón, el tratamiento con estos fármacos, que es el tratamiento médico de elección en el HAP como se comentará más adelante, no debe iniciarse hasta que la evaluación diagnóstica se haya completado. No obstante, puede plantearse alguna excepción. Si el paciente presenta hipopotasemia a pesar del tratamiento ARM, esto indica que los receptores mineralcorticoides no están plenamente bloqueados y que la ARP o CRD debería estar suprimida en aquellos pacientes con HAP. Además, la mayor parte de los pacientes con HAP que se tratan con ARM suelen estar recibiendo dosis infraterapéuticas y en la determinación del ARR se observa una ARP o CRD suprimida. En esta situación, puede entenderse que el uso de ARM no está interfiriendo de forma significativa en la medición de ARR y que, además, todo el proceso diagnóstico incluido, llegado el caso, el muestreo venoso suprarrenal, puede realizarse sin retirar el fármaco ARM. Sin embargo, si la renina no está suprimida, el ARM debe ser suspendido de 4 a 6 semanas antes de las determinaciones analíticas. Otros diuréticos ahorradores de potasio, como amiloride y triamterene, normalmente no interfieren en los resultados analíticos a no ser que se trate de altas dosis.
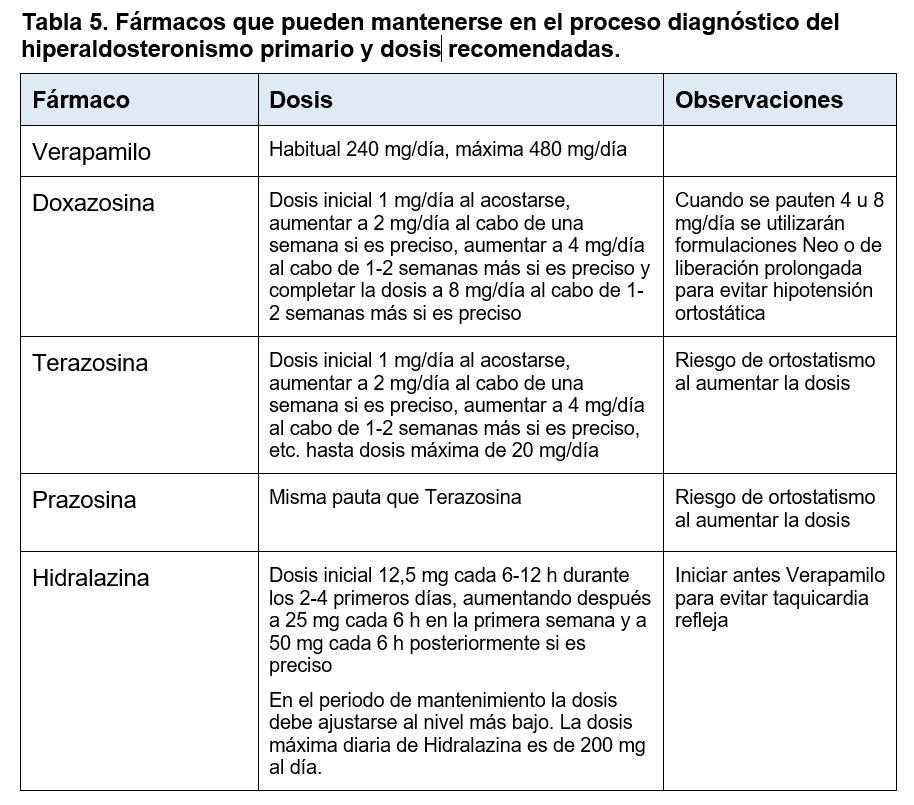
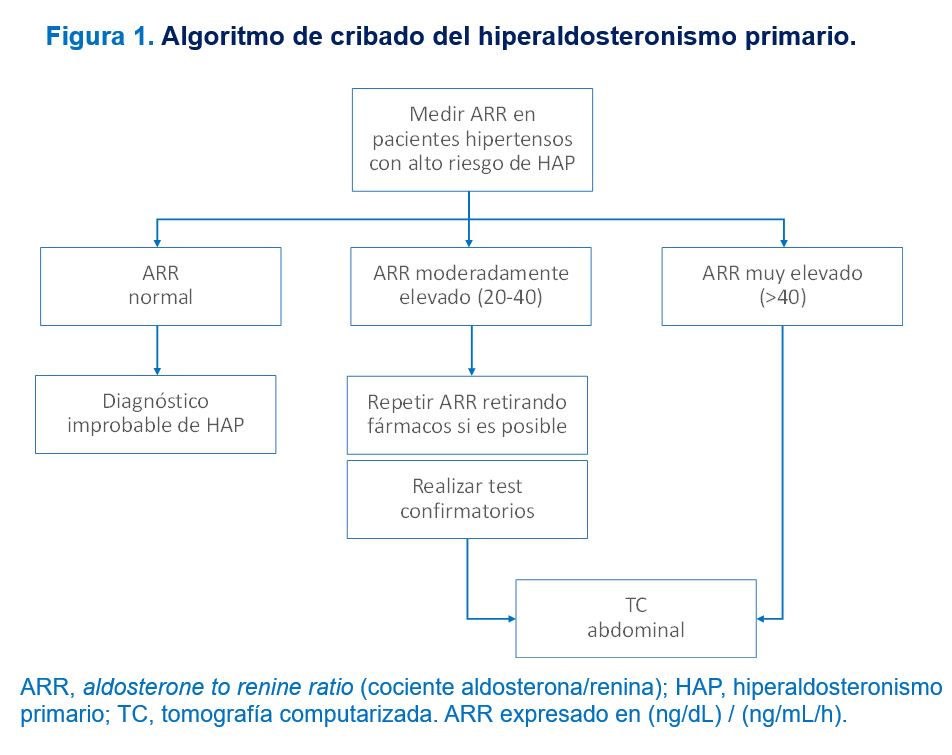
Los fármacos antihipertensivos sin un efecto significativos sobre el SRAA y que, por tanto, pueden utilizarse durante el proceso diagnóstico (antagonistas de calcio no dihidropiridínicos, alfabloqueantes e hidralazina), con las correspondientes dosis y pautas, se exponen en la (Tabla 5). Se han descrito complicaciones derivadas de la suspensión de fármacos antihipertensivos para la determinación del ARR de tal forma que en las últimas guías de la Sociedad Europea de Endocrinología [12], se recomienda completar el proceso diagnóstico del HAP sin hacer cambios en el tratamiento si el ARR es > 40 (ng/dL)/(ng/mL/h), o su equivalente en otras unidades como > 4,9 (ng/dL)/(mU/L) o (ng/dL)/(μU/mL) o 1000 (pmol/L)/(ng/mL/h), por considerarlo como altamente sugestivo de HAP. Por tanto, inicialmente se puede llevar a cabo el cribado de HAP sin modificar el tratamiento antihipertensivo y valorar posteriormente el cambio de tratamiento en caso de un ARR entre 20 y 40 (ng/dL)/(ng/mL/h) o entre 2,4 y 4,9 (ng/dL)/(mU/L) o (ng/dL)/(μU/mL) o entre 500 y 1000 (pmol/L)/(ng/mL/h). En la (Figura 1) se expone el algoritmo de cribado del hiperaldosteronismo primario y en la (Tabla 6) se resumen las recomendaciones para la determinación del cociente aldosterona / renina o ARR.
Test confirmatorios en el diagnóstico de hiperaldosteronismo primario
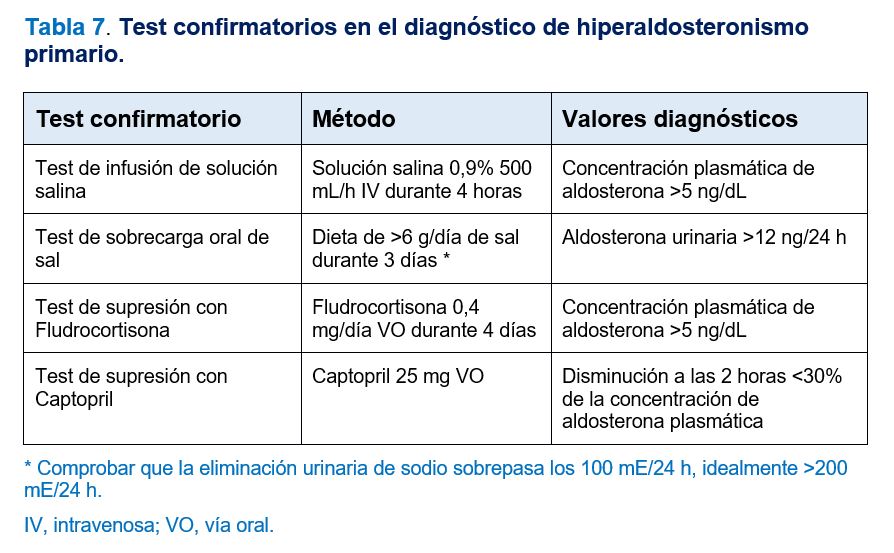
En pacientes con ARR sugestivo de HAP, > 30 (ng/dL)/(ng/mL/h) o su equivalente en otras unidades, se debe realizar alguno de los métodos confirmatorios para el diagnóstico definitivo que se exponen en la (Tabla 7). El objetivo de estas pruebas consiste en demostrar que la producción de aldosterona es autónoma con respecto a los estímulos que suprimen la angiotensina II y, por tanto, producen una inhibición en la síntesis de aldosterona [11][12].
En los casos de pacientes con HAP evidente (hipopotasemia espontánea, concentración de aldosterona plasmática > 20 ng/dL o > 200 pg/mL o > 550 pmol/L y una ARP o CRD menor del límite de detección de la prueba de laboratorio que estemos utilizando) no será necesario realizar test confirmatorios, se establecerá el diagnóstico y se indicarán directamente pruebas de imagen [11][12]. Asimismo, en situaciones en las que la realización de estas pruebas confirmatorias pueda constituir un riesgo añadido, fundamentalmente HTA no controlada, insuficiencia cardiaca o enfermedad renal crónica avanzada, también se valorará la indicación directa de pruebas de imagen en casos de ARR sugestivo de HAP.
Pruebas de imagen: tomografía computarizada y resonancia magnética
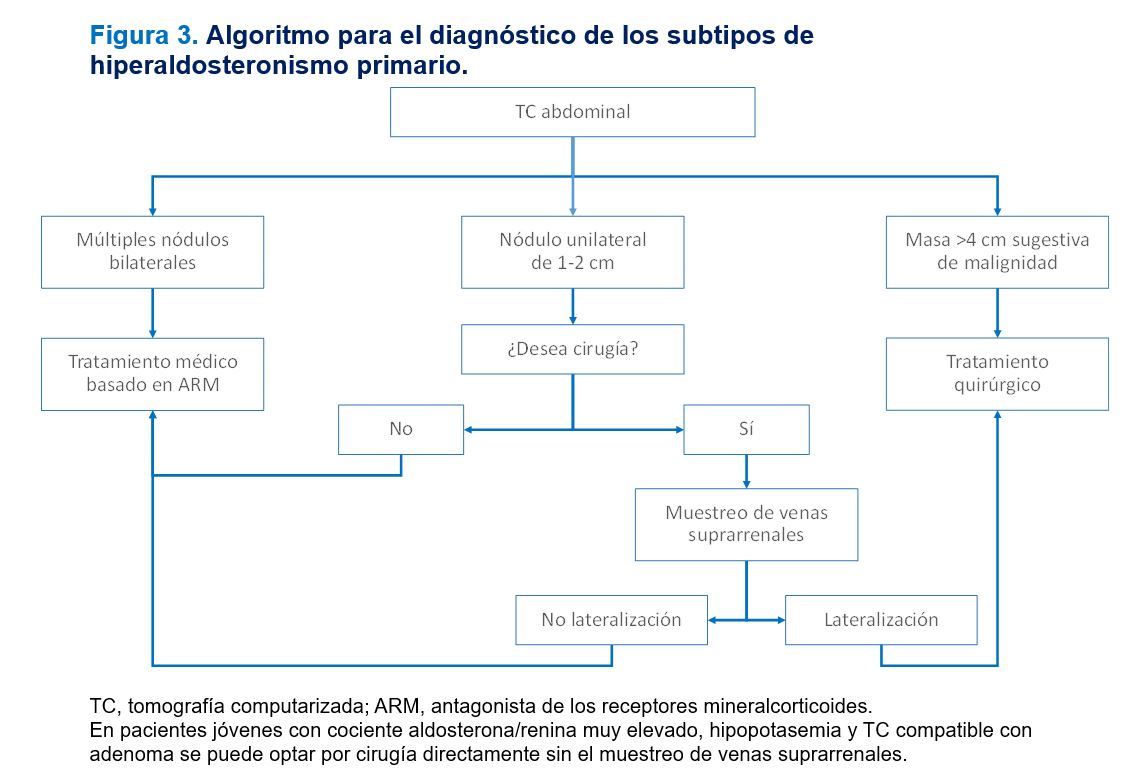
La tomografía computarizada (TC) presenta mejor especificidad en el diagnóstico de adenomas suprarrenales que la resonancia magnética (RM), siendo ésta más sensible pero menos específica y más artefactable. Las imágenes de la RM no parecen ofrecer ventajas sobre la TC para la detección de nódulos, no obstante, si bien pueden ser de gran valor en el diagnóstico diferencial de patología benigna y maligna. La TC de alta resolución es la mejor prueba para identificar adenomas de más de 2 cm. Sin embargo, el 50% de las lesiones miden menos de 2 cm y el 40% menos de 0,6 cm. Cuando la lesión es mayor de 4 cm siempre hay que sospechar que sea maligna. En general, estas pruebas de imagen tienen una sensibilidad del 78% y especificidad del 75%. La limitación principal de estas pruebas de imagen es la detección de microadenomas productores de aldosterona. Otra de las limitaciones es la presencia de incidentalomas, que aumentan con la edad y que conllevarían falsos positivos. Aproximadamente el 2-8% de la población general tiene incidentalomas. Además, en algún estudio comparativo realizado, se ha visto una concordancia de sólo el 50% entre los casos diagnosticados por TC y los diagnosticados mediante muestreo de venas suprarrenales. Independientemente de estas discrepancias, en la actualidad, a todos los pacientes con sospecha de HAP se debe realizar una TC. En caso de lesión mayor de 4 cm se indicará la cirugía directamente, en lesiones bilaterales se iniciará tratamiento médico y en lesiones unilaterales sospechosas de adenoma suprarrenal, se debe llevar a cabo un muestreo de venas suprarrenales para confirmar la unilateralidad en la secreción de aldosterona cuando se plantee la opción de tratamiento quirúrgico.
Pruebas de imagen: tomografía por emisión de positrones con metomidato
La tomografía por emisión de positrones/tomografía computarizada (PET/TC) con metomidato (inhibidor de 11-beta-hidroxilasa) es una prueba de implantación creciente para sustituir al muestreo de venas suprarrenales [16]. El metomidato tiene algunos inconvenientes como su corta vida media y que tiene diferente afinidad por CYP11B2 (4 veces menor) que por CYP11B1, por lo que hay que administrar dexametasona. Actualmente, se está investigando usar otros radioisótopos como un análogo de metomidato (FAMTO), el F-CDP2230 y un ligando del receptor de quimoquinas tipo 4 que está elevado en los adenomas productores de aldosterona, el CXCR4 ligando. Sin embargo, los casos descritos con estas técnicas son anecdóticos y requieren de alta tecnología de disponibilidad limitada.
Muestreo de venas suprarrenales
El muestreo o sampling de venas suprarrenales se considera la prueba definitiva en el diagnóstico diferencial de los diferentes subtipos de hiperaldosteronismo con una sensibilidad del 95% y especificidad del 100% [17]. Sin embargo, es una prueba difícil de realizar, invasiva y que requiere experiencia por parte del equipo de Radiología Intervencionista, por lo que no se realiza en muchos hospitales de forma rutinaria. Las guías Europeas de Endocrinología sugieren que en todo paciente que vaya a ser sometido a una cirugía se debería utilizar la medición de aldosterona en ambas venas suprarrenales para distinguir entre adenoma e hiperplasia suprarrenal bilateral [11][12]. Sin embargo, si el paciente es menor de 35 años, con imagen de adenoma en la TC > 1 cm, con la glándula suprarrenal contralateral normal, con niveles de aldosterona mayores de 30 ng/dL e hipopotasemia basal, la sospecha es tan alta que se podría suprimir la prueba de muestreo e indicar la cirugía directamente.
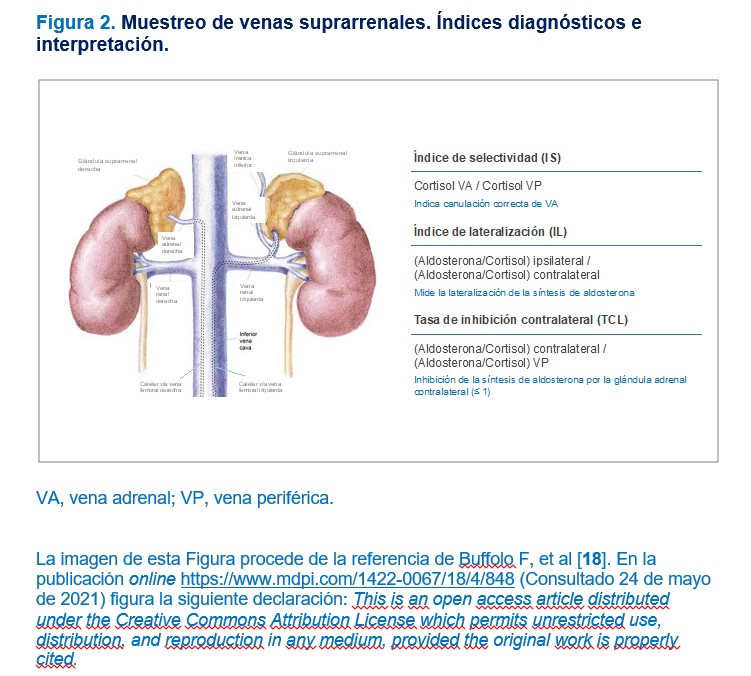
El muestreo de venas suprarrenales se realiza por vía femoral y se cateterizan la vena cava inferior y ambas venas suprarrenales. La canulación de la vena adrenal derecha resulta más dificultosa que la vena izquierda por circunstancias anatómicas (Figura 2) [18]. En los centros con experiencia en la técnica, las complicaciones son menores al 2,5%, siendo el principal riesgo la rotura de la vena suprarrenal con hemorragia. Para realizar esta prueba se debe suspender la medicación que interfiere en el SRAA, siguiendo las mismas indicaciones que al medir el ARR. En pacientes con HTA no controlada, con HTA grado 2-3, no será necesaria la suspensión del tratamiento si la renina está suprimida. La medición de aldosterona en venas adrenales se debe realizar a primera hora de la mañana, después de estar en posición decúbito supino durante una hora, para tener la máxima estimulación de aldosterona por la hormona adrenocorticotropa (ACTH) y evitar la estimulación del SRAA con cambios posturales. En algunos centros, se utiliza la administración de ACTH (generalmente 0,25 mg o 0,50 mg) en bolos o infusión constante, para disminuir las variaciones producidas por el estrés y permitir una estimulación máxima de aldosterona a nivel del adenoma. Existe discordancia sobre la administración de ACTH y aunque algunos autores afirman que mejora la sensibilidad, otros piensan que disminuyen la lateralización y por lo tanto infradiagnostica el adenoma. El éxito de la prueba consiste en canalizar adecuadamente las venas adrenales, utilizando como referencia el índice de selectividad, que es la relación del cortisol en la vena adrenal respecto al cortisol en vena periférica (generalmente vena cava). Para el diagnóstico, se usa el índice de lateralización que expresa que la síntesis de aldosterona en el lado del adenoma es muy superior al lado contralateral. Algunos autores indican que es necesario también medir la tasa de supresión de síntesis de aldosterona en el lado contralateral con el llamado índice o tasa de supresión contralateral (Figura 2) [18]. Sin embargo, no existe consenso en relación con los puntos de corte de estos índices que diagnostiquen la existencia de adenoma suprarrenal e indicación de cirugía. En general, se considera cateterización exitosa si el índice de selectividad es mayor de 2 en condiciones basales o > 3 bajo estimulación por ACTH. Se considera que existe lateralización cuando el índice de lateralización es entre 2 y 4 veces mayor en condiciones basales en el lado del adenoma o entre 2,6 y 4 veces mayor bajo infusión de ACTH.
En el ensayo clínico SPARTACUS (Subtyping Primary Aldosteronism: a Randomized Trial Comparing Adrenal Vein Sampling and Computed Tomography Scan) [19], se comparó el pronóstico a largo plazo de pacientes diagnosticados de HAP mediante una TC respecto a los diagnosticados mediante muestreo de venas suprarrenales. No se describieron diferencias entre los operados y los tratados medicamente diagnosticados por una u otra técnica, concluyendo que una técnica diagnóstica sofisticada como es la medición de aldosterona en venas suprarrenales tiene un error de un 5% y una técnica sencilla como la TC de un 20%. Sin embargo, a pesar de que el estudio SPARTACUS es el único ensayo clínico aleatorizado publicado sobre el diagnóstico del HAP, tiene importantes limitaciones que podrían invalidar sus resultados como el sesgo en la población incluida (más del 60% de los pacientes presentaban hipopotasemia espontánea, que se podría asociar a una población con mayor probabilidad de adenoma suprarrenal y en la que el diagnóstico con TC sería suficiente), el tamaño muestral limitado y que la variable principal de resultados fue el control de la PA y no la tasa de curación. Por lo tanto, se sigue recomendado realizar el muestreo de venas suprarrenales en los pacientes que van a ser sometidos a cirugía excepto en pacientes jóvenes en los que el diagnóstico sea evidente. Los centros que utilizan sistemáticamente el muestreo de venas suprarrenales para diagnóstico del HAP encuentran adenomas en 2/3 de los casos, una tasa que duplica el hallazgo de los centros que no utilizan esta prueba diagnóstica. Por lo tanto, el muestreo es fundamental para diferenciar los casos que se van a beneficiar de la cirugía (Figura 3).
Tratamiento
La causa del HAP determina si el tratamiento es quirúrgico o médico (Tabla 2) [20]. En resumen, en pacientes con adenoma suprarrenal el tratamiento de elección es la adrenalectomía laparoscópica y en pacientes con hiperplasia suprarrenal bilateral el tratamiento es médico. En un estudio internacional de cohortes, la adrenalectomía unilateral normalizó la PA en 37% de 705 pacientes con adenoma y mejoró el pronóstico (número de antihipertensivos y respuesta a la medicación) en un 47%. Además, corrigió la hipopotasemia y el ARR en un 94% de los pacientes [21]. En la actualidad, la cirugía laparoscópica es de elección dado que presenta menos complicaciones y los periodos de hospitalización y recuperación son más cortos con respecto a la cirugía clásica. La respuesta favorable al tratamiento médico con espironolactona durante por lo menos 4 semanas previas a la cirugía predice la corrección de la PA y de los niveles de potasio. La persistencia de la HTA parece relacionarse con la gravedad o cronicidad de la enfermedad hipertensiva, la duración de la HTA mayor a 5 años, el valor ARR muy elevado en el preoperatorio o la coexistencia de HTA esencial. Algunas veces, tras la adrenalectomía laparoscópica, se produce una supresión de la glándula contralateral, aparece hiperpotasemia y se requiere suplementación con mineralocorticoides.
El tratamiento farmacológico es la terapia de elección para pacientes afectados por hiperplasia suprarrenal bilateral. La espironolactona, el ARM clásico, ha sido el fármaco tradicionalmente usado. Las dosis varían entre 25 y 200 mg/día con las que se alcanzan un efectivo control de la PA y de la hipopotasemia en la mayoría de los casos. Sin embargo, el uso de espironolactona puede producir efectos adversos como ginecomastia, mastodinia, disfunción eréctil, disminución de la libido, síntomas gastrointestinales e irregularidades menstruales. Otros ARM de desarrollo posterior, como eplerenona, tienen el mismo mecanismo de acción sin los efectos progestágenos ni anti-androgénicos de la espironolactona. Sin embargo, eplerenona tiene menor potencia antialdosterónica que espironolactona y mayor coste. Otros ARM todavía no comercializados en España, como Finerenona, podrían constituir una alternativa en caso de que se demuestre su eficacia en pacientes con HAP. Otras alternativas de tratamiento son el amiloride y el triamterene, fármacos que impiden la acción de aldosterona al inducir un bloqueo del canal de sodio a nivel renal y con ello impiden la retención de sodio y la perdida de potasio. La adición de estas fármacos a espironolactona a veces es necesaria para disminuir la dosis del ARM y mejorar la adherencia. En un estudio longitudinal que incluyó 602 pacientes con HAP tratados con ARM en comparación con 41853 pacientes con HTA esencial tratados convencionalmente, se observó una tasa más elevada de eventos cardiovasculares en los pacientes con HAP independientemente del control de PA [22]. Los pacientes con HAP tuvieron mayores tasas ajustadas de mortalidad, fibrilación auricular y diabetes. Este mayor riesgo cardiovascular se ha asociado en pacientes que presentan ARP suprimida menor 1 ng/mL/h a pesar de recibir tratamiento con ARM. Los pacientes con diagnóstico de HAP tratados farmacológicamente que mantienen una ARP o una CRD suprimidas presentaron un riesgo cardiovascular elevado. Según estos datos, las recomendaciones recientes sugieren la medición de los niveles de renina para titular la dosis de ARM y conseguir un mejor pronóstico a largo plazo.
Sumario
Los puntos clave respecto al HAP son:
1) El HAP es una causa frecuente e infradiagnosticada de HTA secundaria y de HTA resistente. Para aumentar el diagnóstico, algunos autores plantean incluso el cribado de HAP en todo paciente hipertenso al menos una vez en la vida.
2) Más de la mitad de los casos de HAP no presentan hipopotasemia. La aparición de hipopotasemia depende de la ingesta de sal.
3) El cociente aldosterona/renina o ARR es la prueba de cribado de elección aunque puede estar artefactado por el tratamiento. Si la concentración de aldosterona está muy elevada y la de renina muy baja a pesar de la toma de diuréticos o fármacos bloqueantes del SRAA, no será necesaria la suspensión de estos fármacos para la determinación del ARR.
4) En casos de ARR no concluyente e hipopotasemia no espontanea se realizarán test confirmatorios.
5) La TC de glándulas suprarrenales es la prueba de imagen de elección. Existe alta prevalencia de incidentalomas en la población general.
6) El cateterismo de venas suprarrenales es la prueba gold-standard para la identificación del subtipo de hiperaldosteronismo, aunque únicamente se realizará en pacientes con indicación de cirugía. En pacientes menores de 35 años, con clara sospecha de adenoma suprarrenal, se puede indicar directamente la suprarrenalectomía.