Hipertensión arterial secundaria
Palabras clave
Enfermedad renovascular arteriosclerótica, Displasia fibromuscular, Hiperaldosteronismo primario, Feocromocitoma, Paraganglioma, Cushing, Hipertiroidismo, Hipotiroidismo, Apnea del sueño, Acromegalia, Coartación de aorta
INTRODUCCIÓN
La hipertensión arterial (HTA) puede ser clasificada como primaria o secundaria en función de la ausencia o presencia de una enfermedad o situación que condicione el aumento de la presión arterial (PA). La HTA primaria, en la práctica clínica denominada HTA probablemente esencial, es la forma que afecta a la inmensa mayoría de los pacientes con HTA. La HTA secundaria suele detectarse en un 5-10 % de los pacientes hipertensos si bien la prevalencia varía en función de la edad y el contexto clínico. La HTA secundaria, entendida por la definición clásica como una HTA ocasionada por una etiología corregible, es mucho menos frecuente en la práctica clínica, ya que con frecuencia el tratamiento de la causa no conlleva la normalización de la PA debido a la alta prevalencia de HTA esencial subyacente o a un daño vascular endotelial ya establecido.
El presente capítulo constituye una actualización del artículo homónimo de 2015 [1], en base a las principales guías sobre HTA de los últimos años: guía norteamericana del American College of Cardiology, la American Heart Association y una serie de sociedades e instituciones relacionadas (ACC/AHA 2017) [2], guía europea de la European Society of Cardiology y European Society of Hypertension (ESC/ESH 2018) [3], y guía de la International Society of Hypertension, (ISH 2020) [4].
APROXIMACIÓN DIAGNÓSTICA
El protocolo básico de estudio del paciente con HTA (anamnesis, exploración física y estudios complementarios básicos) constituye la base para descartar o sospechar una HTA secundaria [5]. Una sistemática de trabajo acerca de cuándo sospechar HTA secundaria y cómo investigarla son determinantes para una práctica clínica segura y eficiente. Las causas de HTA secundaria son múltiples y la indicación de exploraciones complementarias específicas debe dirigirse a una etiología o grupo etiológico concreto evitando la realización indiscriminada de estudios con frecuencia costosos y no exentos de riesgos. En la (Tabla 1) se exponen las situaciones clínicas de sospecha de HTA [1][2][3][4][5].
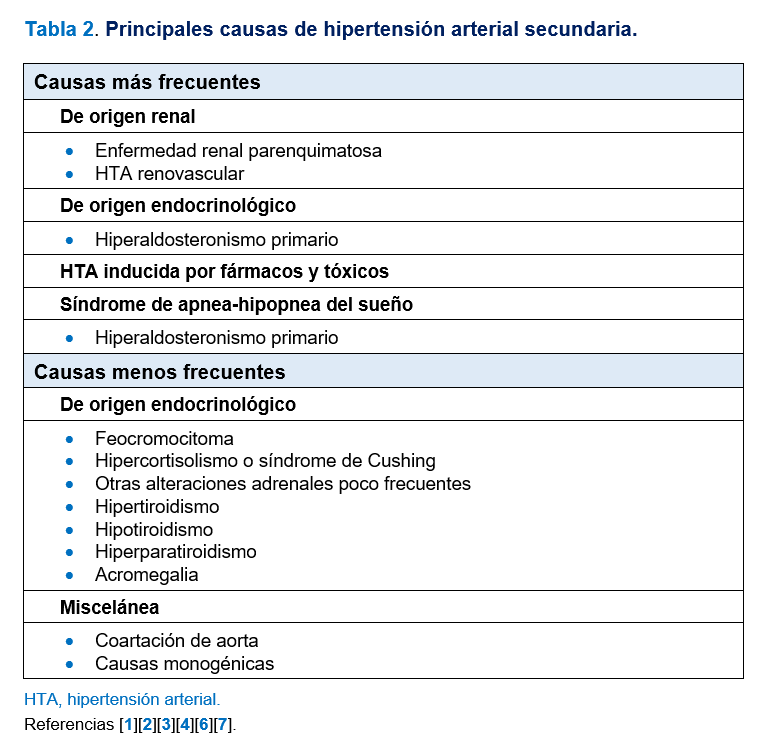
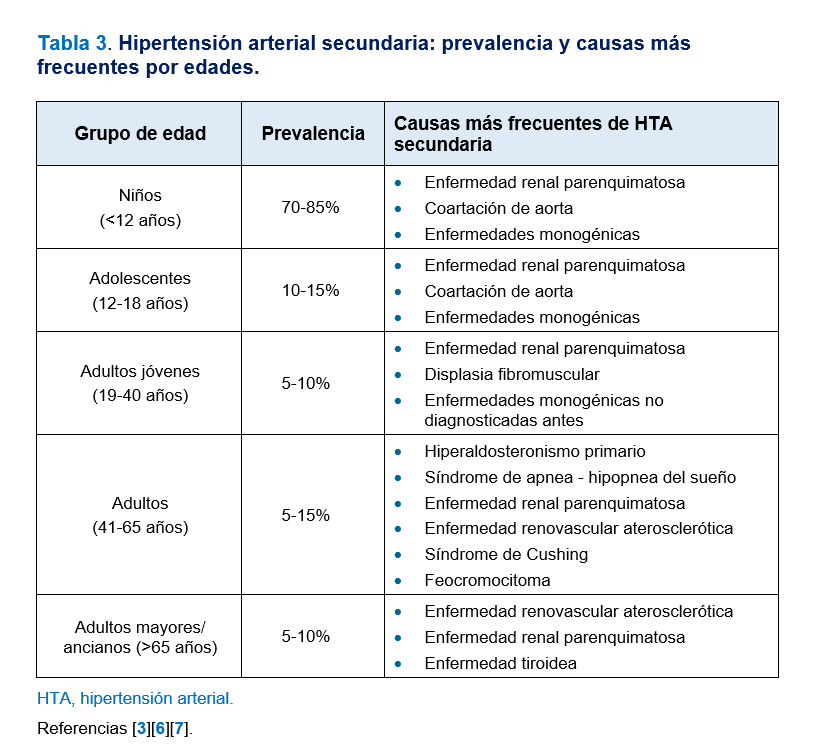
Las causas más frecuentes de HTA secundaria son las enfermedades renales (parenquimatosas o renovasculares), el hiperaldosteronismo primario (HAP), la HTA inducida por fármacos o tóxicos y el síndrome de apnea-hipopnea del sueño (SAHS). Las causas menos frecuentes son trastornos endocrinológicos distintos al HAP (feocromocitoma, síndrome de Cushing, otras enfermedades suprarrenales, hipertiroidismo, hipotiroidismo, hiperparatiroidismo y acromegalia), la coartación de aorta y formas monogénicas de HTA. La prevalencia de cada una de las causas de HTA secundaria también oscila dependiendo de la edad y el contexto clínico del paciente. La aproximación al diagnóstico etiológico de la HTA secundaria basada en la edad constituye otra estrategia básica en este campo [6][7]. En la (Tabla 2) se exponen las principales causas de HTA secundaria y en la (Tabla 3) se exponen las prevalencias y causas más frecuentes de HTA secundaria por tramos de edad [3][6][7]. Es probable que la prevalencia de HTA secundaria en la práctica clínica diaria, salvo en el caso de la edad pediátrica, sea menor a las citadas pues los estudios en los que se basan estas cifras están realizados mayoritariamente en cohortes seleccionadas y no en población general hipertensa.
DIAGNÓSTICO DE LAS DIFERENTES CAUSAS DE HIPERTENSIÓN ARTERIAL SECUNDARIA
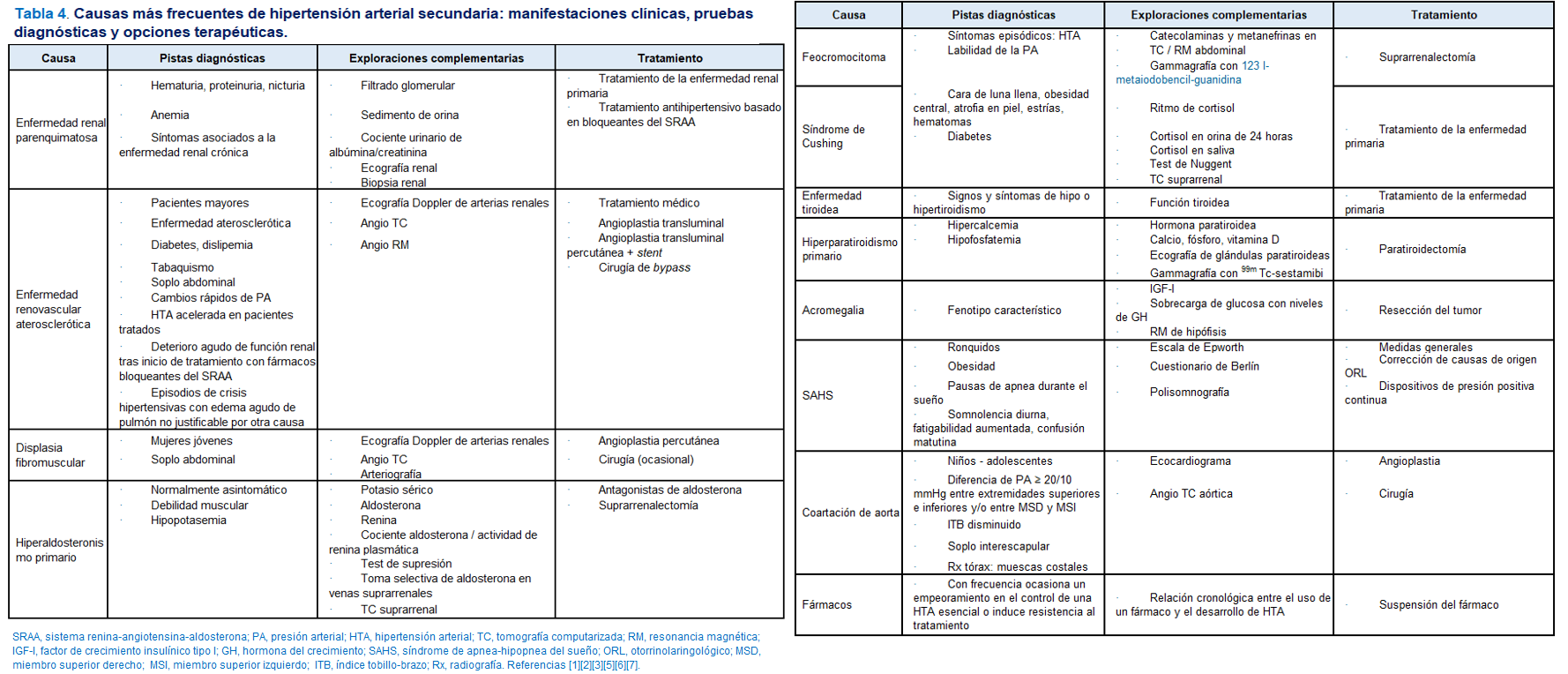
Tras la aproximación referida, los estudios a llevar a cabo para la confirmación diagnóstica se indicarán orientados por la edad, los síntomas y signos clínicos y las alteraciones en las exploraciones complementarias que se hayan realizado. En la (Tabla 4), se exponen las causas más frecuentes de HTA secundaria, las manifestaciones clínicas y las pruebas diagnósticas y opciones terapéuticas correspondientes a cada etiología o grupo de causas.
Hipertensión arterial secundaria de causa renal
La HTA secundaria de origen renal se divide en dos grandes grupos de causas: las enfermedades renales parenquimatosas y las enfermedades vasculares de las arterias renales principales, principalmente la enfermedad renovascular aterosclerótica y la enfermedad renovascular por displasia fibromuscular.
Hipertensión arterial secundaria a enfermedad renal parenquimatosa
La HTA es un hallazgo casi constante en la enfermedad renal parenquimatosa aguda o crónica. La patogénesis y el tratamiento dependen de la causa y tiempo de evolución. En el caso de enfermedades agudas con compromiso principalmente glomerular y vascular (enfermedades glomerulares inflamatorias agudas, vasculitis, crisis renal esclerodérmica) el desarrollo de HTA está en relación con la sobrecarga de volumen y la activación del sistema renina-angiotensina-aldosterona (SRAA). En el caso de la enfermedad renal crónica (ERC) la elevación de la PA suele relacionarse con activación del SRAA, sobrecarga de volumen, activación del sistema nervioso simpático y complicaciones asociadas a la uremia como el hiperparatiroidismo secundario, la disfunción endotelial y el uso de factores estimulantes de la eritropoyesis. El diagnóstico de la enfermedad renal se realiza mediante las exploraciones adecuadas (indicadores de función renal, cuantificación de proteinuria, sedimento urinario, autoinmunidad, proteinograma, técnicas de imagen y biopsia renal). En el tratamiento son relevantes el tratamiento específico de la enfermedad renal concreta si lo hubiere, y el uso de fármacos antihipertensivos bloqueantes del SRAA y diuréticos [8][9].
Enfermedad renovascular aterosclerótica
La estenosis de la arteria renal es una de las causas frecuentes de HTA secundaria y habitualmente está en relación con la presencia en las arterias renales de lesiones ateroscleróticas (habitualmente en pacientes mayores) o con la displasia fibromuscular (habitualmente en pacientes jóvenes). Otras causas de HTA renovascular menos frecuentes incluyen la disección aórtica, la inflamación vascular (como la arteritis de Takayasu, otras vasculitis y la esclerodermia) o compresiones extrínsecas de las arterias renales.
La HTA renovascular en población general hipertensa es poco frecuente, probablemente menos de un 1%, mientras que en pacientes con HTA grave y otras manifestaciones de aterosclerosis puede estar presente hasta en un 35% de los casos [10].
La estenosis de la arteria renal ocasiona una disminución de la perfusión renal por lo que el aparato yuxtaglomerular aumenta la secreción de renina conduciendo a concentraciones elevadas de angiotensina y aldosterona, que condicionan HTA debido a vasoconstricción y retención de sodio.
La HTA renovascular por lesiones ateroscleróticas suele sospecharse en pacientes mayores de 50 años con factores de riesgo vascular (sobre todo tabaquismo, dislipemia y diabetes mellitus) o con manifestaciones de enfermedad vascular a otros niveles (principalmente cardiopatía isquémica, enfermedad cerebrovascular o enfermedad vascular periférica) que presentan cambios rápidos de la PA, HTA acelerada, deterioro agudo de la función renal tras inicio de fármacos bloqueantes del SRAA o episodios de crisis hipertensivas con edema agudo de pulmón no justificable por otra causa. Además, pueden presentar signos de enfermedad vascular periférica en otras áreas como asimetría de pulsos periféricos y soplos carotídeos o abdominales.
Para el diagnóstico, la prueba inicial es la ecografía renal con doppler de las arterias renales. La medida de la velocidad pico sistólica tiene una sensibilidad del 85 % y una especificidad del 92 %. La velocidad pico sistólica es elevada cuando es superior a 180 cm/s. Respecto a los datos analíticos, la función renal puede ser normal o estar deteriorada y la concentración o actividad de renina plasmática puede estar elevada. La asimetría en la medida de la actividad de renina en muestras plasmáticas de las venas renales indica el riñón con mayor efecto presor. La angiografía con tomografía computarizada (TC) permite identificar el número de vasos renales, su distribución, variantes vasculares y presencia de estenosis. La sensibilidad y especificidad de la angiografía por TC es del 90-100%. Generalmente la estenosis de la arteria renal tiene repercusión hemodinámica cuando es superior al 50%, mientras que suele causar HTA renovascular cuando la estenosis es superior al 70%. El uso de estas técnicas de imagen con contraste puede estar limitado por su nefrotoxicidad. Para pacientes con alto riesgo de nefropatía por contraste, la angiografía con CO2 puede ser una opción. La resonancia magnética (RM) con gadolinio permite un adecuado diagnóstico de la existencia de estenosis, aunque puede sobreestimar la gravedad de la estenosis. El riesgo de fibrosis sistémica en relación con el uso de gadolinio, la presencia de implantes metálicos o marcapasos y la claustrofobia que pueda tener el paciente, limitan su uso. La gammagrafía renal se usa para determinar la función relativa de los dos riñones, pero no proporciona información anatómica sobre los vasos renales.
La arteriografía es la técnica de referencia para el diagnóstico de estenosis de la arteria renal. La principal ventaja es que permite la medida del gradiente de presión de la lesión. En pacientes sintomáticos, un gradiente de presión superior a 20 mmHg o un ratio de presión distal/proximal inferior a 0,9 son indicadores de estenosis significativa. Este método se reserva para aquellos pacientes en los que se plantea tratamiento de revascularización con angioplastia en el mismo acto si es necesaria.
El tratamiento de la HTA renovascular de origen aterosclerótico incluye el tratamiento médico y el intervencionista (angioplastia transluminal percutánea con colocación de stent o tratamiento quirúrgico con revascularización). Se debe valorar el riesgo-beneficio del tratamiento intervencionista respecto al tratamiento médico. Los principales estudios clínicos para determinar la eficacia de la intervención sobre la lesión ateroesclerótica, STAR (Stent Placement and Blood Pressure and Lipid-Lowering for the Prevention of Progression of Renal Dysfunction Caused by Atherosclerotic Ostial Stenosis of the Renal Artery), ASTRAL (Angioplasty and Stenting for Renal Artery Lesions) y CORAL (Cardiovascular Outcomes in Renal Atherosclerotic Lesions) no mostraron beneficios significativos del tratamiento intervencionista en el control de la PA, recuperación de la función renal o muerte. Por ello, en pacientes asintomáticos o con adecuado control con tratamiento médico no se aconseja la revascularización invasiva. En estos casos se sugiere control estricto de los factores de riesgo vascular con reducción del colesterol con estatinas, antiagregación plaquetaria, control de la glucosa, suspensión del tabaco y tratamiento con bloqueo del SRAA, con monitorización de la función renal por el riesgo de deterioro de la función renal. La angioplastia transluminal percutánea con colocación de stent suele reservarse para casos con estenosis superiores al 70% con relación causal entre la estenosis y la HTA y en pacientes con HTA resistente [11][12][13].
Enfermedad renovascular por displasia fibromuscular
La HTA renovascular por displasia fibromuscular se suele sospechar en pacientes menores de 30 años, habitualmente mujeres, con HTA de difícil control y asimetría de tamaño renal, por lo que es relevante realizar una rápida detección para plantear tratamiento con intención curativa. A partir de la sospecha clínica, el diagnóstico puede orientarse mediante la ecografía con doppler de arterias renales, la angiografía con TC o RM y confirmarse con arteriografía. La arteriografía suele revelar estenosis arrosariadas en las arterias renales, en relación con la proliferación de tejido fibroso en la media arterial. Además si se detecta una fibrodisplasia de la arteria renal, se aconseja explorar otros territorios vasculares debido a la asociación con lesiones vasculares en otros niveles [14].
La arteriografía permite el tratamiento mediante angioplastia, con o sin stent, con alta probabilidad de éxito. El tratamiento quirúrgico se realiza de forma ocasional cuando es necesario por la presencia de grandes aneurismas [15].
Hipertensión arterial secundaria de causa endocrinológica
La HTA puede constituir la primera expresión detectada de múltiples enfermedades endocrinológicas. La causa más frecuente de HTA secundaria de origen endocrinológico es el HAP. Las causas menos frecuentes son trastornos endocrinológicos distintos al HAP: feocromocitoma, síndrome de Cushing, otras enfermedades suprarrenales, hipertiroidismo, hipotiroidismo, hiperparatiroidismo y acromegalia.
Hiperaldosteronismo primario
El HAP, o síndrome de Conn, es un grupo de alteraciones de la glándula suprarrenal en las que se produce un exceso de aldosterona de manera autónoma (no suprimible) que conlleva HTA, retención de sodio y pérdida urinaria de potasio, con o sin hipopotasemia (más de la mitad de los pacientes con HAP pueden cursar sin hipopotasemia) y alcalosis metabólica [16][17].
Se considera que el HAP es una causa sistemáticamente infradiagnosticada de HTA secundaria. Los estudios más antiguos sugirieron una prevalencia de HAP menor del 1% de los pacientes hipertensos, en probable relación con la indicación del cribado únicamente en pacientes hipertensos que presentaban la triada clásica de HTA, hipopotasemia y alcalosis. Estudios más recientes con cribado extendido a pacientes hipertensos en general, como el estudio PAPY (Primary Aldosteronism Prevalence in Hypertensives) y el estudio PATO (Primary Aldosteronism in Torino) indican prevalencias de HAP del 11,2% y 5,9%, respectivamente [18][19]. Además, el HAP es una de las causas más frecuentes de HTA resistente, habiéndose descrito prevalencias de HAP de en torno al 20% en pacientes con resistencia al tratamiento antihipertensivo [20].
El HAP incluye cinco subtipos: 1) hiperplasia suprarrenal bilateral, 2) adenoma productor de aldosterona, 3) hiperaldosteronismos familiares tipos I a IV, 4) hiperplasia suprarrenal unilateral y 5) carcinoma adrenocortical productor de aldosterona y tumores ectópicos productores de aldosterona. Las formas más frecuentes son la hiperplasia suprarrenal bilateral y el adenoma productor de aldosterona, siendo el resto causas muy infrecuentes de HAP [16].
El signo más común y precoz del HAP es la HTA grados 2-3 (PA > 160/100 mmHg). La hipopotasemia se ha considerado clásicamente como un hallazgo frecuente. Sin embargo, en la actualidad se considera que la hipopotasemia se presenta en únicamente un 30-40% de los casos, probablemente en relación con un diagnóstico más precoz. Los pacientes con hipopotasemia pueden presentar polidipsia, nicturia, episodios periódicos de debilidad muscular, disnea por debilidad de la musculatura respiratoria, arritmias, estreñimiento, espasmos musculares o parálisis. Asimismo, el exceso de aldosterona conduce a una situación de hipervolemia, daño vascular, activación del estrés oxidativo e inflamación, induce remodelado y fibrosis vascular y miocárdica e incrementa el riesgo de eventos vasculares de manera independiente a la HTA [21].
El HAP debe descartarse en situaciones de HTA resistente, en casos de HTA con hipopotasemia espontánea o inducida por diuréticos, en pacientes jóvenes (menores de 40 años) con HTA grados 2-3 (PA > 160/100 mmHg), ante el hallazgo incidental de un nódulo adrenal, en pacientes con HTA con historia familiar de HTA temprana o ictus en menores de 40 años y en familiares de primer grado de pacientes con HAP diagnosticado [2][3].
El cribado diagnóstico de HAP se realiza con la determinación de las concentraciones de aldosterona y renina, o de la concentración de aldosterona y la medición de la actividad de renina plasmática, y los cocientes aldosterona/renina correspondientes. Estas determinaciones han de llevarse a cabo en condiciones estandarizadas, tras suspender los fármacos antihipertensivos que actúen sobre el SRAA durante al menos cuatro semanas antes y tras normalizar el potasio sérico. Los fármacos antihipertensivos con efectos significativos en el SRAA que deben suspenderse antes de las determinaciones de aldosterona y renina son los inhibidores del enzima de conversión de la angiotensina, los antagonistas de los receptores de la angiotensina II, los diuréticos, los antagonistas mineralocorticoides y los betabloqueantes. Existe cierta variabilidad entre centros en los métodos de medida de la aldosterona y la renina y se utilizan diferentes valores de corte en los cocientes aldosterona/renina para el cribaje del HAP. Ante un cociente aldosterona/renina indicativo de HAP se llevarán a cabo test de confirmación como el test de infusión de solución salina, el test de sobrecarga oral de sal, el test de supresión con fludrocortisona o el test de supresión con captopril. Estos test confirmatorios están encaminados a demostrar la autonomía de la aldosterona con respecto a los mecanismos inhibitorios correspondientes. Tras un test confirmatorio positivo, se debe realizar una TC abdominal dirigida a las glándulas suprarrenales para evaluar el subtipo de enfermedad causante del HAP, descartar el carcinoma adrenal y evaluar las opciones de tratamiento quirúrgico. La toma selectiva de muestras de sangre de venas suprarrenales para medida de la aldosterona puede ayudar en el diagnóstico de lateralización.
Respecto al tratamiento, en los pacientes con enfermedad unilateral se suele recomendar la adrenalectomía, habitualmente mediante laparoscopia, mientras que en los pacientes con enfermedad bilateral se debe iniciar tratamiento con un antagonista de los receptores mineralocorticoides. La adrenalectomía es curativa en aproximadamente un 30% de los pacientes, en un 30-50% ocasiona una mejora significativa en el control farmacológico de la HTA y en un 30-40 % no presenta beneficio clínico. Existen varios factores de riesgos asociados al fracaso de la cirugía con respecto a la normalización de las cifras de PA como son la edad avanzada, una duración prolongada de la HTA, un mayor número de fármacos antihipertensivos utilizados y la presencia de lesión de órgano diana. La opción de tratamiento quirúrgico debe ser individualizada considerando los riesgos y los beneficios potenciales de la intervención. En relación con el tratamiento farmacológico, la espironolactona es el fármaco más frecuentemente utilizado. La dosis inicial será 25 mg/día y la dosis habitual de mantenimiento 100 mg/día. El amiloride puede ser utilizado para bloquear la reabsorción de sodio inducida por mineralocorticoides [16][17][22][23].
Feocromocitoma y paraganglioma
Los feocromocitomas y paragangliomas son tumores neuroendocrinos derivados de células cromafines que producen catecolaminas y suelen localizarse en la médula adrenal (80-85%) y en los ganglios simpáticos paravertebrales (15-20%). Existen dos fenotipos bioquímicos: los tumores adrenérgicos y los no adrenérgicos. Los tumores adrenérgicos habitualmente se localizan en la médula adrenal y producen adrenalina y noradrenalina, mientras que los no adrenérgicos pueden estar tanto en la médula adrenal como en localizaciones extraadrenales y producen noradrenalina. La relevancia de su diagnóstico estriba en que se asocian a una alta morbilidad y mortalidad vascular, pueden tener un componente familiar y tienen potencial de malignización [24].
Las manifestaciones clínicas pueden oscilar entre situaciones asintomáticas o con síntomas menores hasta situaciones graves incluso con compromiso vital. La triada clásica de síntomas consiste en cefalea, sudoración y palpitaciones que ocurren en las crisis (crisis adrenérgicas) y pueden durar entre minutos y una hora. En la literatura internacional esta triada clásica se amplía en ocasiones a 5 síntomas y signos, descritos con ‘the five P’ (Paroxysmal hypertension, Palpitation, Perspiration, Pallor, Pounding headache) [3]. La frecuencia de las crisis es variable y pueden ser desencadenadas por estímulos físicos o químicos como la micción, anestesia y fármacos (bloqueantes betaadrenérgicos, antidepresivos tricíclicos o glucocorticoides). En ocasiones es difícil sospechar debido a que los pacientes pueden no presentar síntomas clásicos.
El diagnóstico se confirma con la medida de metanefrinas en plasma o en orina de 24 horas. Tras la sospecha bioquímica y para la localización de los tumores se aconseja una TC o una RM abdominal, que a su vez permiten planificar la intervención quirúrgica. La gammagrafía con 123 I-metayodobenzilguanidina (MIBG) se sugiere para diagnóstico de imagen en enfermedad metastásica detectada por otras técnicas de imagen y cuando se planea la radioterapia con 131 I-MIBG. La extirpación del feocromocitoma permite el control de la PA. Los pacientes precisan de un manejo preoperatorio específico desde al menos una semana antes de la intervención, indicando el uso de bloqueantes alfa-adrenérgicos y reposición de sodio y agua para revertir la contracción de volumen inducida por las catecolaminas que predispone a inestabilidad hemodinámica operatorio e hipotensión grave tras extirpación del tumor [25].
Síndrome de Cushing
El síndrome de Cushing es un hipercortisolismo patológico provocado por una secreción autónoma adrenal de cortisol o por un exceso de producción de hormona adrenocorticotropa (ACTH). Los pacientes con hipercortisolismo presentan un fenotipo característico: cara de luna llena, obesidad central, atrofia en piel, estrías violáceas, hematomas y alteraciones del metabolismo hidrocarbonado, remedando un síndrome metabólico grave. Estos pacientes presentan un riesgo elevado de morbimortalidad cardiovascular. El diagnóstico se basa en la determinación del cortisol en sangre, en orina de 24 horas y en saliva. Además se debe realizar el test de Nuggent para confirmar la secreción autónoma de cortisol y una TC suprarrenal. El tratamiento depende de la causa del aumento de cortisol, por lo que el tratamiento de la enfermedad primaria permitirá el control de la PA [26].
Hipertiroidismo e hipotiroidismo
El hipertiroidismo y el hipotiroidismo son causa de HTA secundaria con una prevalencia que oscila entre 1 y 5%, aunque con diferentes formas de presentación: el hipertiroidismo se suele presentar como HTA sistólica aislada y el hipotiroidismo como HTA diastólica aislada [7][27][28].
El hipertiroidismo como causa de HTA secundaria suele ser más común en mujeres entre 20 y 40 años y clínicamente se caracteriza por presentar fatiga, sudoración, pérdida de peso, hiperactividad, ansiedad, irritabilidad, insomnio, pérdida de concentración, temblor, palpitaciones y disnea. En la exploración física suele ser llamativo el exoftalmos y aumento de tamaño de la glándula tiroidea. El hipotiroidismo debe ser sospechado en pacientes con astenia, aumento de peso, dolores musculares, depresión, bradicardia, estreñimiento o irregularidades menstruales. En la exploración suelen presentar piel seca y fría, edema en cara y manos y caída del cabello. La enfermedad tiroidea produce cambios en la contractilidad miocárdica, consumo de oxígeno miocárdico, gasto cardiaco y resistencia vascular periférica. Estos pacientes pueden tener un mayor riesgo de desarrollar lesión de órganos diana, independientemente de los niveles de PA. Es fundamental realizar un diagnóstico precoz determinando hormona estimulante de la tiroides (TSH) y hormonas tiroideas ya que estos cambios cardiovasculares son reversibles cuando la alteración tiroidea subyacente es tratada. La determinación de TSH debe formar parte de las exploraciones complementarias analíticas básicas en el estudio inicial de la HTA [3][5][7][27][28]. El hipertiroidismo es tratado con fármacos antitiroideos, 131I radiactivo o cirugía. El tratamiento del hipotiroidismo requiere el uso de hormona tiroidea.
Hiperparatiroidismo primario
El hiperparatiroidismo primario es un trastorno en el que una glándula paratiroidea produce exceso de hormona paratiroidea (PTH). La mayoría de los casos de hiperparatiroidismo primario son esporádicos y están en relación con la presencia de adenomas paratiroideos. Existen formas hereditarias, en los que puede existir historia familiar de síndromes tumorales hereditarios y que están en relación con mutaciones en genes supresores de tumores o con la activación de proto-oncogenes.
La mayoría de los casos de hiperparatiroidismo se detectan de forma incidental tras detectar una hipercalcemia. En situaciones avanzadas el paciente con hiperparatiroidismo puede presentar astenia, pérdida de peso y de apetito, náuseas, vómitos, poliuria, polidipsia, litiasis reno-ureterales, dolores osteo-articulares o deformidades esqueléticas en casos de larga evolución.
Para el diagnóstico es necesario determinar PTH, calcio, fósforo y vitamina D séricos. La presencia de hipercalcemia con hipofosfatemia, hiperfosfaturia y elevación de PTH sugieren el diagnóstico. La localización anatómica de la lesión se realiza con ecografía de las glándulas paratiroides y con gammagrafía con sestamibi-Tc99m que permiten identificar el aumento de tamaño y la captación del isótopo respectivamente. El tratamiento es quirúrgico en la mayoría de las situaciones [29].
Acromegalia
La acromegalia es consecuencia de un exceso de hormona del crecimiento que ocasiona un fenotipo característico. Los pacientes se caracterizan por presentar manos y pies grandes, y cambios graduales en la forma del rostro con facciones faciales más grotescas (mandíbula y frente protuberantes, nariz agrandada, labios más gruesos y más espacio entre los dientes). Se debe solicitar factor de crecimiento insulínico tipo I (IGF-I) y realizar sobrecarga de glucosa con niveles de hormona del crecimiento. Normalmente la causa es un adenoma hipofisiario, por lo que está indicada la realización de una RM de hipófisis [30].
Otras causas de hipertensión arterial secundaria
Síndrome de apnea-hipopnea del sueño
En la actualidad se reconoce que el SAHS constituye una de las causas más frecuentes de HTA secundaria y de HTA resistente [2][3][7][31] y un determinante clave en el riesgo cardiovascular y renal [32][33]. El SAHS consiste en pausas de apnea durante el sueño causadas por el colapso parcial o total de la vía respiratoria alta. En el SAHS se observan incrementos de la PA diurna y de la PA nocturna por aumento de la actividad simpática, por hipoxemia y por la activación del SRAA. Las características clínicas básicas son ronquidos, episodios de apnea durante el sueño, nicturia, somnolencia diurna, cefaleas matutinas, fatigabilidad aumentada, irritabilidad y episodios de confusión diurna. En la exploración física suele destacar sobrepeso-obesidad, cuello corto, macroglosia u otras alteraciones de la vía respiratoria alta que favorecen el colapso durante el sueño. Ante la sospecha clínica, se realizarán cuestionarios para cuantificar el riesgo como la escala de Epworth y cuestionario de Berlín. El diagnóstico se realiza con los estudios polisomnográficos. La evaluación otorrinolaringológica se indicará para descartar problemas anatómicos subsidiarios de tratamiento específico. El tratamiento del SAHS precisa de un abordaje integral de modificaciones del estilo de vida, tratamiento farmacológico de la HTA y del resto de los factores de riesgo cardiovascular asociados y de uso de dispositivos de presión continua positiva en las vías respiratorias durante el sueño [34][35].
Coartación de aorta
La coartación de aorta es una enfermedad cardiaca congénita, por lo que se suele diagnosticar en niños y adolescentes. Se produce aumento de PA en los miembros superiores y disminución del flujo a través de la arteria aorta estrechada, llegando a existir asimetrías de PA. Esto conduce a cambios estructurales en el corazón y los vasos, produciendo hipertrofia cardiaca y fibrosis intersticial, por lo que es necesario que sea diagnosticada y tratada de manera precoz para evitar el desarrollo de una cardiopatía dilatada. Los pacientes suelen tener un soplo interescapular y pueden presentar muescas en las costillas en la radiografía de tórax. El diagnóstico de confirmación se lleva a cabo con ecocardiografía y angio TC torácico-abdominal. El tratamiento es fundamentalmente quirúrgico con angioplastia o cirugía convencional [36].
Fármacos y tóxicos
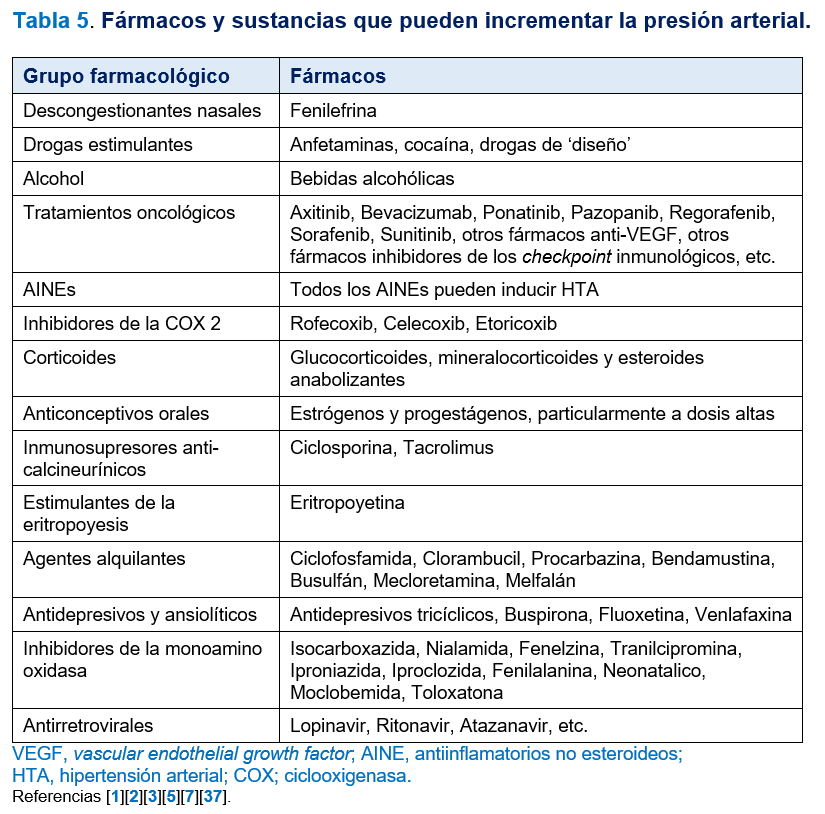
La HTA inducida por fármacos o tóxicos es una causa frecuente de HTA secundaria que es fácilmente corregible. Algunos de los fármacos capaces de inducir HTA se recogen en la (Tabla 5). Con frecuencia estos fármacos desenmascaran una HTA esencial, dificultan el control de la HTA esencial y ocasionan HTA resistente. Otros agentes externos químicos relacionados con HTA secundaria son: alcohol, cocaína, plomo y regaliz. La ingesta crónica excesiva de regaliz imita al hiperaldosteronismo por estimulación del receptor mineralocorticoide e inhibición del metabolismo del cortisol. Es fundamental detectar la relación cronológica entre el uso de un fármaco o sustancia y el desarrollo de HTA. El tratamiento consiste en la suspensión del fármaco o minimización de las dosis [1][2][3][7][37].
Hipertensión arterial de base genética
Existen causas genéticas poco frecuentes que ocasionan HTA secundaria, como las reflejadas en la (Tabla 6). Suelen presentarse en edades tempranas de la vida y su patogenia suele estar relacionada con un aumento de la absorción tubular de sodio. Así, habitualmente presentan supresión de la concentración plasmática de renina o de la actividad de renina plasmática. El diagnóstico suele orientarse por la presencia de antecedentes familiares de HTA y confirmado por el perfil bioquímico y estudio genético [3][38].
CONCLUSIONES
La HTA secundaria suele detectarse en un 5-10 % de los pacientes hipertensos. La anamnesis, la exploración física y el protocolo inicial de estudio del paciente hipertenso constituyen los métodos básicos para descartarla.
Las situaciones clínicas de sospecha de HTA secundaria son:
1) la HTA en las primeras décadas de la vida (particularmente en casos sin antecedentes familiares de HTA probablemente esencial, obesidad ni otros factores de riesgo cardiovascular asociados),
2) la HTA de comienzo a partir de la séptima década de la vida,
3) la HTA resistente (tras descartar pseudo-resistencia por fenómeno de bata blanca o por falta de adherencia terapéutica),
4) la HTA con sospecha clínica de SAHS,
5) las formas graves de HTA (con crisis hipertensivas repetidas, emergencias hipertensivas o repercusión orgánica grave), y 6) la presencia de síntomas o signos que orienten hacia una enfermedad subyacente causante de HTA.
No se considera indicado el diagnóstico diferencial indiscriminado en casos de sospecha de HTA secundaria sino un estudio dirigido específicamente a descartar una causa o grupo de causas de HTA en función de la edad y de las características clínicas y analíticas del caso.
Las causas más frecuentes de HTA secundaria son las enfermedades renales (parenquimatosas o renovasculares), el hiperaldosteronismo primario, la HTA inducida por fármacos y el SAHS. Con cierta frecuencia el tratamiento de la causa de una HTA secundaria no conlleva la normalización de la PA debido a la alta prevalencia de HTA subyacente o a un daño vascular ya establecido.