Síndrome Hemolítico Urémico
RESUMEN
El síndrome hemolítico urémico (SHU) es una enfermedad rara y grave, definida por la presencia de una anemia hemolítica microangiopática y afectación renal aguda. La patogenia central del SHU es un daño de las células del endotelio vascular, causado por diferentes etiologías. La clasificación actual distingue el SHU asociado a toxina Shiga y el SHU atípico; dentro de este último debe distinguirse el SHU atípico primario (con una estrecha relación con anomalías genéticas o adquiridas de la vía alterna del complemento que originan una hiperactividad de la misma) de los SHU atípicos secundarios a muy diversas causas: fármacos, infecciones, tumores o enfermedades sistémicas o metabólicas. El tratamiento del SHU asociado a toxina Shiga consiste en un tratamiento de soporte intensivo, sin que otras medidas (plasmaféresis, bloqueantes del complemento) hayan demostrado un efecto beneficioso. El tratamiento de primera línea del SHU atípico primario es el eculizumab, bloqueante de la vía terminal del complemento que ha supuesto una revolución en el manejo de la enfermedad, mejorando la supervivencia renal y disminuyendo significativamente el riesgo de recurrencia tras el trasplante renal. El tratamiento de los SHU atípicos secundarios es el de la causa que origina el trastorno (suspensión del fármaco implicado, tratamiento de la infección o de la enfermedad autoinmune subyacente, etc). No obstante, dada la evidencia de una activación transitoria del complemento en muchos casos de SHU secundario, se han empleado ciclos cortos de eculizumab en este trastorno. Aunque los resultados son en general positivos, no se han realizado estudios prospectivos controlados, por lo que sigue siendo un tema controvertido.
CONCEPTOS CLAVE
Los conceptos clave del SHU asociado a toxina Shiga se resumen en la (Tabla 1).
Los conceptos clave SHU atípico se resumen en la (Tabla 2).
INTRODUCCIÓN
El SHU es una enfermedad rara que se caracteriza por la presencia de anemia hemolítica no inmune (test de Coombs negativo), trombocitopenia y fracaso renal agudo. La anemia es hemolítica y por ello se presenta con una lactato deshidrogenasa (LDH) elevada y haptoglobina disminuida (por tratarse de una hemólisis intravascular). Además, es microangiopática y, por tanto, en el frotis de sangre periférica observaremos esquistocitos y el recuento plaquetario será bajo, por consumo de las mismas en la formación de los trombos. En cuanto al fracaso renal agudo tendrá un origen vascular como consecuencia de los trombos a nivel de la microvasculatura renal (arteriolas y capilares glomerulares) con la consecuente isquemia glomerular. Derivado de ello, es frecuente encontrar hipertensión arterial asociada a la enfermedad.
El trastorno fundamental del SHU es un daño en las células del endotelio vascular. Este daño endotelial va a dar lugar a una activación de las plaquetas con la consecuente agregación plaquetaria y formación de trombos en la microcirculación [1]. Son estos microtrombos los que van a causar obstrucción de la luz vascular y, por tanto, isquemia tisular. Además, la anemia hemolítica tendrá lugar cuando los hematíes atraviesen estos trombos plaquetarios y se rompan. La presencia de esquistocitos en sangre refleja la deformidad de los hematíes al chocar con los trombos.
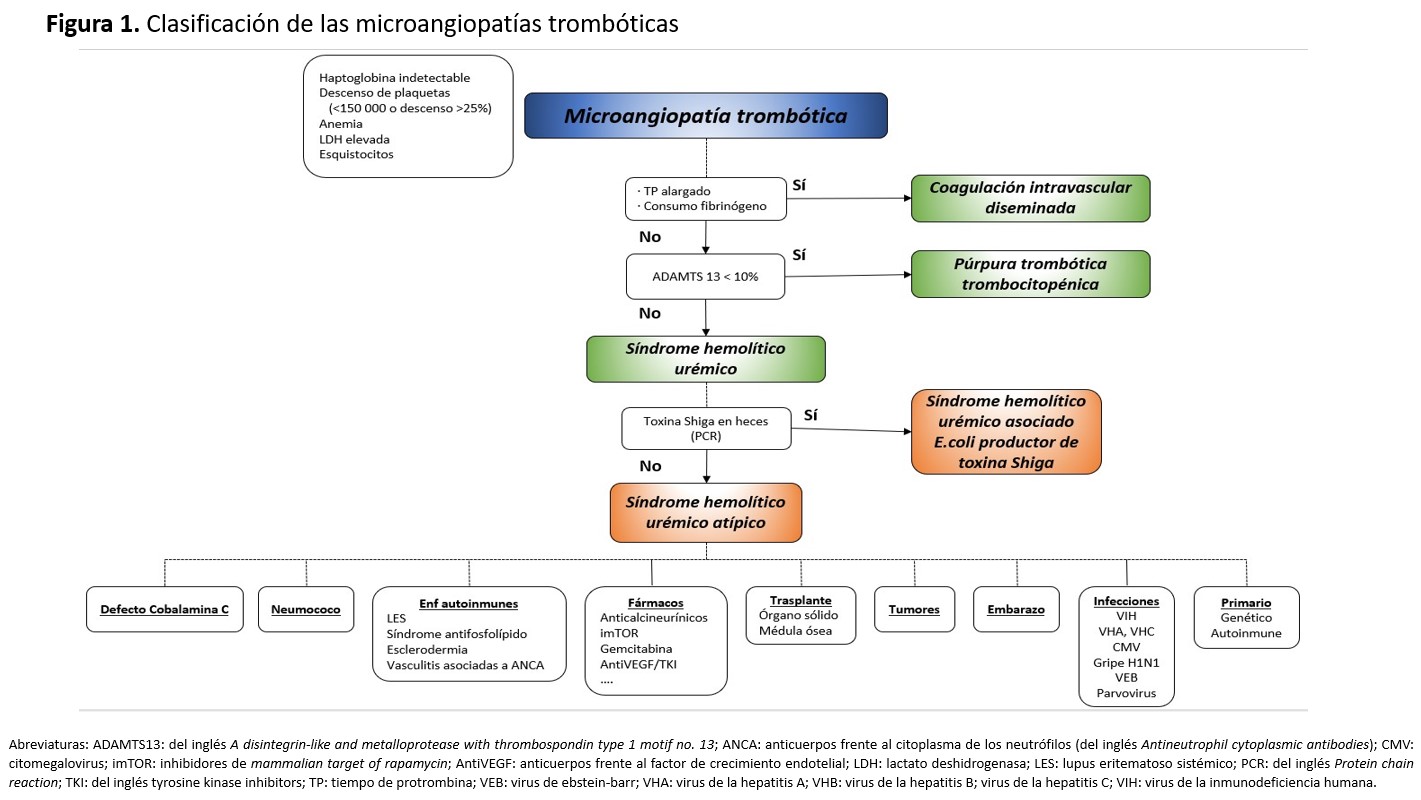
Es importante recalcar que el SHU no es la única entidad dentro de las microangiopatías trombóticas (MAT) y que por tanto debe de establecerse un rápido diagnóstico diferencial con otras formas de MAT: la púrpura trombótica trombocitopénica (PTT) y la coagulación intravascular diseminada (CID) (Figura 1). La exclusión de estas entidades debe de hacerse en base a datos clínicos y analíticos (trombopenia intensa, afectación renal leve o ausente y predominio de síntomas neurológicos en la PTT; situación clínica del paciente muy comprometida con anomalías evidentes de los estudios de coagulación en la CID). La determinación de la actividad del enzima ADAMTS-13 es la forma más precisa y rápida de excluir PTT (en la cual dicha actividad es inferior a 5-10% de lo normal) pero también se han validado scores clínico-analíticos como el PLASMIC [2].
La mayoría de los casos de SHU ocurren en niños y están relacionados con la presencia de diarrea causada por una bacteria productora de toxina Shiga [3]. Es el SHU asociado a toxina Shiga (o STEC-HUS, en inglés Shiga-Toxin producing E.Coli – Hemolylic Uremic Syndrome). Los casos no producidos por este mecanismo se denominan SHU atípico. Este tipo de SHU puede estar causado por alteraciones genéticas o adquiridas en las proteínas que participan en la vía alternativa del complemento (SHU atípico primario), o por otras múltiples causas como fármacos, tumores, infecciones, enfermedades autoinmunes, trasplante de médula ósea u órgano sólido, entre otros [4] (SHU atípico secundario).
Las causas de SHU varían en función de la edad. En la edad pediátrica, la causa más frecuente de SHU es la relacionada con la toxina Shiga, seguida por el SHU atípico primario, SHU asociado a infección invasiva por neumococo (5%-15%), SHU relacionado con trasplante, y menos frecuentemente por defectos en el metabolismo de la cobalamina o las mutaciones en la diacilglicerol kinasa-epsilon (DGKE) [5]. Sin embargo, el SHU que se presenta en la edad adulta es mayoritariamente secundario a fármacos, cáncer, embarazo, trasplante de órgano sólido o médula ósea y algunas infecciones y enfermedades autoinmunes, siendo el SHU asociado a toxina Shiga incluso más infrecuente que las formas primarias [6][7].
SÍNDROME HEMOLÍTICO URÉMICO ASOCIADO A TOXINA SHIGA
El SHU asociado a toxina Shiga (Stx) es una enfermedad generalmente relacionada con la infancia ya que aparece fundamentalmente en niños entre 3-5 años. La incidencia anual en Europa y Norte América es menor 1 caso por cada 100 000 niños (menores 15-18 años) y 1,9–2,9 por cada 100 000 niños (menores 3-5 años) [8][9], mientras que la incidencia en América Latina es muy superior (10-17 casos por cada 100 000 niños menores de 5 años en Argentina) [10]. En España, el número de casos reportados de diarrea enteroinvasiva por E. coli productor de toxina Shiga en 2022 fue de 620 (1,36 casos/100.000 habitantes), en claro ascenso desde 2021, y solo 6 de ellos asociaron SHU (5 eran niños). Tras la exposición a E. coli productor de enterotoxina, 38-61% de los individuos manifiestan una colitis hemorrágica y el 3-9%, si se trata de una infección esporádica, o 20%, en las formas epidémicas, desarrollan un SHU [11][12]. Diferentes cepas de E. coli han sido aisladas en estos casos siendo la más frecuente (hasta 2010) la O157. Las cepas O26, O111, O121, O145, O91, O103, O104 y O80, son actualmente tan frecuentes como la O157 en Europa y Norte América [13]. E. coli productora de Stx coloniza el intestino del ganado sano, caballos, perros, aves e incluso moscas. Los humanos se infectan al consumir leche, carne o agua contaminada, o por el contacto con heces de animales o humanos contaminados [13][14].
Fisiopatología
La característica común a todos los SHU primarios, secundarios o asociados a Stx, es el daño de la célula endotelial. En el caso del SHU asociado a Stx, el daño de dicha célula es causado directamente por la toxina. Las toxinas Shiga pertenecen a un grupo de proteínas AB5 constituidas por dos subunidades principales: una subunidad A que se une de forma no covalente a un pentámero formado por 5 subunidades B idénticas [15]. La subunidad B se va a unir al glicolípido globotriaosilceramida (Gb3) de la célula huésped (célula endotelial, Gb3+), lo que va a permitir su endocitosis. Una vez en el citoplasma celular, las subunidades A y B se disocian, siendo la subunidad A capaz de eliminar una adenina del 28S rARN (ácido ribonucleico ribosómico) inhibiendo la síntesis proteica [15][16]. Además, las Stx son capaces de inducir la apoptosis de la célula endotelial probablemente inhibiendo la expresión de la proteína antiapoptótica Mcl-1, de la familia Bcl-2 [17]. La Stx es capaz de atravesar la célula epitelial intestinal vía transcelular hacia el torrente sanguíneo; traslocación potenciada por la transmigración de leucocitos a través del endotelio. Se desconoce el mecanismo mediante el cual la toxina es capaz de llegar al órgano diana, fundamentalmente riñón y sistema nervioso central, ya que no se ha conseguido determinar la Stx libre en sangre.
Los dos grupos principales de Stx son la Stx1 y la Stx2 (codificados por los genes Stx1 y Stx2), formado cada uno de ellos por varios subtipos. Los diferentes subtipos van a determinar la infección en humanos o no y su virulencia, siendo diferentes subtipos de la Stx2 los más frecuentemente asociados a colitis enterohemorrágica y SHU [18]. La determinación de las toxinas en heces se realiza mediante técnicas de PCR (del inglés polymerase chain reaction), mientras que E. coli se aisla en coprocultivo [19].
Además de la inhibición en la síntesis proteica a nivel de la célula endotelial, se ha demostrado que las Stx son capaces de aumentar la expresión de quimiocinas como IL-8 y MCP-1 (del inglés Monocyte Chemoattractant Protein-1), así como moléculas de adhesión celular como P-selectina e ICAM-1 (Intercellular Adhesion Molecule-1) y factores de transcripción (EGR-1, NF-B2, NF-BIA) (Early Growth Response protein-1, Nuclear Factor-B2 o Nuclear Factor-BIA)[20][21]. Todo ello va a favorecer la quimiotaxis de células inflamatorias, que contribuirán a la lisis de la célula endotelial y la activación de plaquetas y de la coagulación con la consecuente formación de trombos en la microvasculatura. La predilección por el endotelio renal viene probablemente derivada de la elevada presencia de Gb3 que expresan las células del endotelio glomerular [22].
El papel del complemento en el SHU asociado a Stx no es del todo claro. Se sabe que la P-selectina, molécula de adhesión celular cuya expresión está aumentada por la acción de la Stx, es capaz de fijar y activar C3. El C3a resultante de la hidrólisis de la molécula de C3 por la acción de la C3 convertasa reduce la expresión de trombomodulina, favoreciendo la formación de microtrombos [23]. Además, se ha demostrado in vitro que Stx puede fijar FH (factor H) disminuyendo su capacidad de unión a superficies celulares, dando lugar a la formación del complejo de ataque de membrana (CAM) [24]. En distintas series de casos, sobre todo en niños, se ha demostrado un aumento de los niveles séricos de Bb (fracción B del Factor B) y C5b-9 sérico (complejo de ataque de membrana en su forma soluble) [25], niveles también elevados de C3a y C5b-9 sérico [26], así como niveles reducidos de C3 séricos, reflejo de la hiperactividad de la vía alternativa del complemento [27].
Manifestaciones clínicas
El síntoma inicial es una diarrea, generalmente sanguinolenta, que aparece a los 3-8 días de la ingesta de la comida contaminada [28], acompañada de fiebre, dolor abdominal y/o vómitos. La duración de la diarrea es variable y dependiente del subtipo de E. coli causante, siendo de 7 días en los casos por E. coli O157:H7, y más prolongada en los casos por E. coli no O157. Cerca del 5-15% de los pacientes desarrollará un SHU después de una mediana de 7 días desde el inicio de la diarrea, en la fase de resolución de esta. El fracaso renal agudo y la hipertensión son las manifestaciones más frecuentes, pudiendo también observarse con menor frecuencia alteraciones neurológicas, cardiológicas o gangrena de partes acras [29][30][31]. Los factores de riesgo para el desarrollo de SHU incluyen edad <5 años, leucocitosis, y algunas cepas específicas de E. coli (O157:H7, O103:H25 y O104:H4), así como infecciones por bacterias productoras de Stx2 [11][29][32][33].
El 30-40% de los pacientes requieren terapia renal sustitutiva por la gravedad del fracaso renal, durante una mediana de 10 días. Los factores de riesgo para el desarrollo de insuficiencia renal crónica (IRC) son la presencia de hipertensión arterial en el debut de la enfermedad, la duración de la oligoanuria y el tiempo de hospitalización [34]. Hasta un 20-25% de los pacientes va a mantener datos de daño renal permanente (hipertensión arterial, proteinuria o disminución del filtrado glomerular) después de la recuperación del SHU asociado a Stx [35].
La afectación neurológica es la complicación aguda más grave del SHU asociado a Stx ya que puede ocasionar la muerte del paciente o dejar secuelas neurológicas importantes. Ocurre en el 20-25% de los casos [36]. Las manifestaciones neurológicas son variables: letargo, cefalea, alteraciones visuales, convulsiones, apnea central, hemiparesia, ceguera cortical o coma [29][37][38]. Estas manifestaciones son causadas por el efecto directo de la Stx sobre el endotelio vascular cerebral, pero también por el efecto de la hipertensión arterial o las alteraciones iónicas derivadas de la afectación renal [38]. La mayoría de los casos con afectación neurológica asocian también afectación renal severa con necesidad de diálisis, lo que demuestra que se trata de una afectación sistémica muy grave.
La diarrea sanguinolenta puede persistir en algunos casos como reflejo de la microangiopatía trombótica (MAT) a nivel de la microvasculatura intestinal, ocasionando dolor abdominal y/o distensión abdominal y en los casos más graves isquemia, necrosis e incluso perforación intestinal [39][40]. Sobreinfecciones por C. difficile también han sido descritas [41]. La elevación de enzimas hepáticas refleja MAT en la microvasculatura hepática y no es infrecuente [42], aunque no se han descrito hepatitis aguda grave o fallo hepático. Hasta un 66% de los pacientes presenta elevación de amilasa y lipasa en la fase aguda del SHU [42], pero diabetes mellitus insulinodependiente por necrosis de los islotes pancreáticos, o insuficiencia pancreática endocrina y exocrina derivada de la necrosis completa del páncreas ocurren infrecuentemente [43][44]. La isquemia miocárdica derivada de la MAT a nivel de las arterias coronarias aunque infrecuente puede ser causa del fallecimiento al producir disfunción miocárdica por isquemia o necrosis y shock cardiogénico. Como forma de afectación cardiaca también se ha descrito la presencia de derrame pericárdico, así como miocarditis o verdaderos taponamientos cardiacos [45][46][47].
La hipertensión arterial, consecuencia de la sobrehidratación y/o de isquemia renal, está presente en 27-33% de los casos [11][45].
Tratamiento
El único tratamiento claramente demostrado en el SHU asociado a Stx es el tratamiento de soporte intensivo, basado en fluidoterapia, terapia de renal sustitutiva cuando es necesaria y administración de hemoderivados (concentrados de hematíes) cuando hay anemia grave. La administración de plaquetas, dado que puede empeorar la formación de microtrombos, se reserva a situaciones de sangrado importante o previo a una intervención quirúrgica [48]. El uso de antibioterapia para tratar la infección por E. coli continúa siendo controvertido ya que podría teóricamente, al lisar la bacteria, producir una liberación brusca y masiva de Stx contenida en su interior y desencadenar de ese modo un SHU. Aunque existen datos contradictorios en la literatura, algunos estudios han mostrado una asociación significativa entre el uso de antibióticos y el riesgo de SHU, por lo que no se recomienda su empleo en infecciones por E.coli productor de Stx cuando los casos se presentan de forma individual [49]. Por el contrario, en las formas epidémicas, con el fin de recortar la progresión de la epidemia, la antibioterapia sí estaría justificada.
Una vez desarrollado el SHU, el tratamiento de soporte es la única recomendación generalmente aceptada. El uso de plasmaféresis, aunque reportó evidencia de beneficios en términos de supervivencia en la epidemia escocesa de 1996 [50], actualmente no se recomienda. En la epidemia alemana de 2011 [11] y en otro estudio prospectivo no se demostró ningún efecto favorable de las plasmaféresis, e incluso se observó una relación entre su uso y una peor evolución de la función renal y mayores secuelas a largo plazo [51].
Teniendo en cuenta las posibles implicaciones de una desregulación en la vía alternativa del complemento en la patogenia del SHU asociado a Stx (ver apartado de Fisiopatología de la enfermedad) se ha contemplado el uso de eculizumab, anticuerpo monoclonal que bloquea C5 impidiendo su hidrólisis por parte de la C5 convertasa. Durante la epidemia alemana de 2011 se puso en marcha un ensayo clínico con una única rama de tratamiento con eculizumab (sin rama control) para evaluar la seguridad y eficacia de eculizumab en el SHU asociado a Stx. Los resultados no fueron concluyentes. Recientemente, se han publicado los resultados de un ensayo clínico Fase III (ECULISHU) [52] de tratamiento con eculizumab versus con placebo en 100 niños (1 mes a 18 años de edad) con diagnóstico SHU asociado a la toxina Shiga de E. coli en Francia. El objetivo principal del estudio fue evaluar la duración del tratamiento con diálisis después de la primera administración de eculizumab o placebo. Como objetivos secundarios, se valoraron la función renal durante los primeros 60 días y las secuelas renales a los 6 y 12 meses del cuadro. Se excluyeron pacientes con fallo multiorgánico grave (neurológico, cardiológico o digestivo). La necesidad de terapia renal sustitutiva durante <48 horas fue comparable en ambos grupos (48% en el grupo de placebo y 38% en el grupo de eculizumab), así como la evolución de la función renal durante los primeros 60 días. Sin embargo, la proporción de pacientes con secuelas renales a 12 meses fue inferior en el grupo tratado con eculizumab (43.5% versus 64.4%). Una limitación importante de este estudio es que una proporción importante de los casos tratados con eculizumab (>40%) no mostró un bloqueo suficiente de la vía terminal del complemento a lo largo del tratamiento. En otro estudio, se analizó la experiencia con eculizumab en 33 niños con un SHU asociado a Stx con presentación muy grave (afectación neurológica, cardiaca y/o digestiva), además de fracaso renal agudo con necesidad de diálisis en el 94% de los casos. Se observó una rápida mejoría de las manifestaciones neurológicas en 19 de los 28 pacientes que se presentaron con afectación neurológica grave. Interesantemente, la mayoría de los casos con una mejor respuesta al eculizumab habían alcanzado un bloqueo completo de la vía terminal del complemento, medido por el test hemolítico CH50 [53].
SÍNDROME HEMOLÍTICO URÉMICO ATÍPICO
En el adulto, el SHU atípico secundario es claramente la forma más frecuente de SHU (56-94%), seguido de SHU atípico primario (3-15%) y de SHU asociado a Stx (6-23%) [9][10], este último muy variable en función de las regiones y la existencia de epidemias.
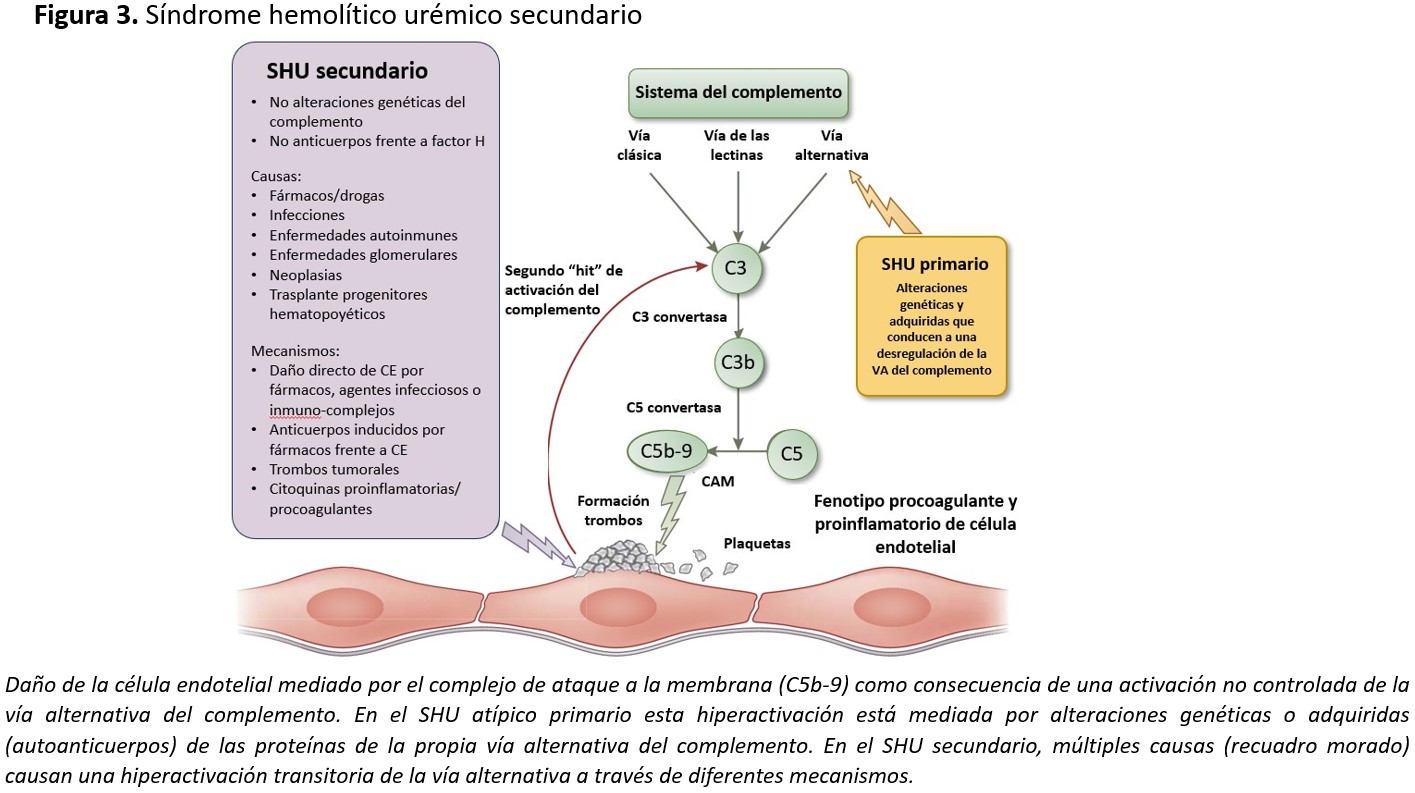
Según las recientes clasificaciones de las MAT [4], el SHU atípico se subdividiría en formas primaria y secundarias (Figura 1). Las primeras son debidas a alteraciones genéticas o adquiridas (autoanticuerpos) en las proteínas de la vía alternativa del complemento. Las formas secundarias están relacionadas con enfermedades, infecciones o condiciones capaces de causar SHU al dañar directamente o a través de la desregulación de la vía alternativa del complemento la célula endotelial. No deberían, por tanto, considerarse dentro de este grupo, aquellos SHU atípicos que aun presentando una causa secundaria tienen una alteración genética claramente causante de SHU atípico primario.
Fisiopatología
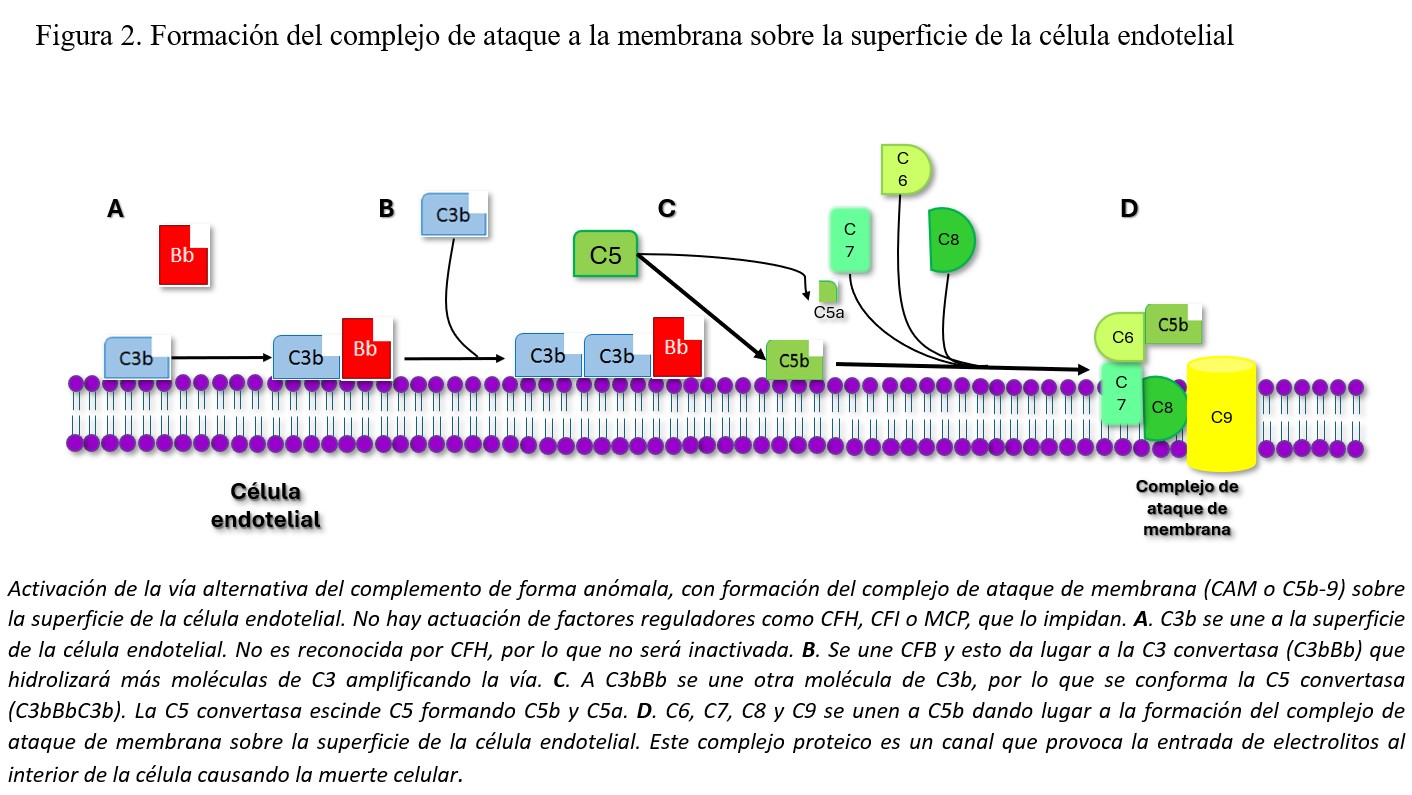
Como ya se comentó en el apartado de Fisiopatología del SHU asociado a Stx, el daño principal en todos los casos de SHU acontece a nivel de la célula endotelial. En el SHU atípico primario la desregulación de la vía alternativa del complemento a nivel de las superficies celulares es la causante del daño endotelial, a través de una producción anómala de CAM sobre la superficie celular (Figura 2). El CAM provoca un desequilibrio iónico en el interior celular que va a conducir a la apoptosis de la célula endotelial. La desregulación de la vía alternativa del complemento puede estar causada por alteraciones en los genes que codifican las proteínas reguladoras (CFH, o factor H del complemento, CFI o factor I del complemento, o MCP o membrane cofactor protein) que confieren pérdida de función [54][55][56][57], o en las proteínas activadoras (C3 o CFB, o factor B del complemento), proporcionando una ganancia de función (www.FH-HUS.org) [58][59]. Además de las alteraciones genéticas, la desregulación también puede estar causada por autoanticuerpos frente a estas proteínas reguladoras (anticuerpos anti-FH) [60][61][62][63][64], que bloquearían la acción de este regulador.
En el SHU atípico secundario, la causa del daño endotelial también puede estar mediada por el complemento, como en las formas asociadas a embarazo/postparto [65][66][67], formas asociadas a enfermedades autoinmunes como lupus o síndrome antifosfolípido [68][69], formas asociadas a fármacos [70], tumores [71][72] o las relacionadas con el trasplante de médula ósea [73][74] o trasplante de órgano sólido [75]. Si bien en algunas de estas entidades no es del todo conocido el mecanismo por el cual se produce el daño endotelial, la respuesta positiva a bloqueantes de C5 (eculizumab) apoya que una desregulación de la vía alternativa del complemento está participando en dicho daño [65][66][68][69][70][73][74][75][76]. Se trataría de una activación secundaria y transitoria del complemento que amplificaría el daño endotelial inicial producido por la etiología específica del SHU atípico secundario [77], ya que se ha observado que en estos casos no existe una mayor prevalencia de anomalías genéticas del complemento que en la población general [78] (Figura 3).
Sin embargo, también existen formas de SHU atípico secundario en las que no hay ninguna participación del complemento como en el asociado a mutaciones en el gen MMACHC (methylmalonic aciduria and homcystinuria) [79], que da lugar a SHU asociado a hipertensión pulmonar, o mutaciones en el gen DGKε (diacilglicerol kinasa epsilon), que ocasiona SHU a edades muy precoces, generalmente en < 1 año, y que asocian característicamente un síndrome nefrótico [80]. En estos casos el uso de bloqueantes del complemento no estaría justificado.
Existe también un grupo de SHU atípico secundario en el que el complemento sí parece estar implicado, pero el uso de bloqueantes del complemento podría ser peligroso: es el SHU atípico secundario a Streptococcus pneumoniae. La neuraminidasa producida por este germen tiene la capacidad de eliminar el ácido siálico presente en las glicoproteínas de la superficie de las células endoteliales, lo que tiene importantes consecuencias patogénicas: 1) Al quedar expuesto el antígeno Thomsen-Friedenreich (antígeno T), los anticuerpos anti-T (IgM), presentes de forma natural en el plasma, interaccionaría con dicho antígeno T dañando la célula endotelial y promoviendo la activación plaquetaria y de la cascada de coagulación (este anticuerpo anti-T es además el responsable de que en este SHU el test de Coombs sea positivo de forma característica); 2) El factor H no ejerce su función protectora normal en las células endoteliales desprovistas de ácido siálico, lo que conduce a un depósito de C3b sobre ellas con formación de MAC y consecuente destrucción celular. Menos del 1% de las infecciones graves por S. pneumoniae asocian un SHU, y esto ocurre fundamentalmente en niños <2 años [81][82][83]. Es importante destacar que, al tratarse de una bacteria encapsulada, el complemento es fundamental para lisar y eliminar este patógeno y, de hecho, las vacunas frente al neumococo (13v y 23v) están indicadas como profilaxis en pacientes sometidos a bloqueantes del complemento. A pesar de esto, se ha descrito el uso de eculizumab en esta forma de SHU en casos aislados [84]. En una pequeña serie de 7 niños, cuatro recibieron eculizumab [85] sin observarse una peor evolución de la infección pero tampoco una clara influencia favorable sobre el SHU.
Manifestaciones clínicas y aproximación diagnóstica
La clínica común a todas las MAT es una anemia hemolítica microangiopática con daño isquémico de algún órgano, generalmente, el cerebro y/o el riñón. Es importante resaltar que hasta en el 20% de los casos no hallamos trombopenia, y que una haptoglobina normal o la ausencia de esquistocitos no descartan la enfermedad, dado que en ocasiones el paciente consulta cuando el daño hematológico ya se ha resuelto y el daño renal se ha establecido (fase crónica). La afectación cerebral en forma de convulsiones, bajo nivel de conciencia, ictus isquémico/hemorrágico cerebral o más levemente en forma de cefalea o visión borrosa, clásicamente se ha asociado a la PTT. Sin embargo, esta afectación extrarrenal es relativamente frecuente en el SHU atípico, estando presente en el 10-30% de los casos [76][86][87]. La afectación renal, prácticamente constante, requiere diálisis aguda en un alto porcentaje de los casos [76][88], con diferentes grados de proteinuria, generalmente por debajo del rango nefrótico, y microhematuria. Otra manifestación muy frecuente es la hipertensión arterial (HTA). Según nuestra experiencia, el 87% de los pacientes con diagnóstico de SHU atípico primario presenta HTA en el momento del diagnóstico, siendo esta grave (definida como presión arterial sistólica ≥160 mmHg y/o presión arterial diastólica ≥100 mmHg) en el 65% de los casos, y cumpliendo criterios de HTA maligna (retinopatía hipertensiva grado III y/o IV en el fondo de ojo en pacientes con HTA grave) en el 35% [89]. De hecho, la principal causa de HTA maligna en un paciente que presenta datos de MAT en sangre periférica, es el SHU atípico primario (60% de los casos), seguido de otras formas de SHU atípico secundarios (a fármacos, 15%; a nefropatía IgA, 10%; o a enfermedades sistémicas como la esclerodermia o las vasculitis asociadas a ANCA, 10%) [90]
Existen otras afectaciones extrarrenales, menos frecuentes pero que pueden poner en riesgo la vida del paciente. La gangrena digital, manifestación poco frecuente pero muy grave, suele afectar las falanges medias y distales de manos y pies y puede llevar a la amputación de estas [91][92]. Se han descrito estenosis arteriales tanto craneales como extracraneales [93][94] que se presentan como accidentes isquémicos transitorios. La revascularización percutánea de dichas estenosis puede conducir a la disección [94]. A nivel cardiológico, se han descrito casos de miocardiopatía dilatada [95] o infarto de miocardio secundario a trombosis de arterias coronarias [96]. Dado que la miocardiopatía dilatada puede estar infradiagnosticada, se recomienda la realización de un ecocardiograma a todo SHU atípico.
La diarrea no es únicamente una manifestación del SHU asociado a Stx. En una proporción importante de casos de SHU atípico, la diarrea es una manifestación clínica inicial y puede ser la forma de presentación de una isquemia mesentérica secundaria a trombosis de las arterias mesentéricas. El pulmón puede verse afectado en el SHU atípico en forma de hipertensión pulmonar bien por estenosis de las arterias pulmonares [94], poco frecuente, o por la presencia de una enfermedad veno-oclusiva secundaria a trombosis de la microvasculatura. En todo paciente, generalmente adolescente, que presente MAT e hipertensión pulmonar por enfermedad veno-oclusiva se debe descartar un SHU atípico asociado a déficit de cobalamina C (mutaciones en el gen MMACHC) [79].
Las pruebas complementarias solicitadas irán dirigidas, por un lado, a establecer el diagnóstico de microangiopatía trombótica y, por otro lado, a buscar la causa (Tabla 3). Será, por tanto, necesario demostrar anemia hemolítica microangiopática con un estudio bioquímico y hematológico en el que objetivemos anemia regenerativa (reticulocitos elevados), trombopenia, LDH elevada, haptoglobina disminuida y presencia de esquistocitos en sangre periférica. Y posteriormente, buscaremos la causa de la MAT: 1) determinación de actividad de ADAMTS13 (para evaluar si se trata de una PTT), 2) de toxina Shiga en heces si procede (para confirmar/descartar si es un SHU asociado a Stx), y 3) de causas secundarias de SHUa a través del estudio de autoinmunidad, infecciones virales o bacterianas, tumores, fármacos, e incluso el metabolismo de la cobalamina C. Es conveniente incluir dentro de las determinaciones analíticas la homocisteína, porque unos niveles muy elevados obligan a descartar SHU asociado a trastornos en el metabolismo de la cobalamina. Si no se hallaran causas secundarias, estaría indicado la realización de un estudio tanto inmunológico como genético de las proteínas que intervienen en la vía alternativa del complemento.
Histología
El diagnóstico de SHU, en cualquiera de sus variantes (asociado a Stx o SHU atípico primario o secundario), es un diagnóstico clínico y analítico; por tanto, no es preciso tener confirmación histológica. Sin embargo, en casos con escasa expresión hematológica, o como factor pronóstico renal, la realización de una biopsia renal puede resultar interesante.
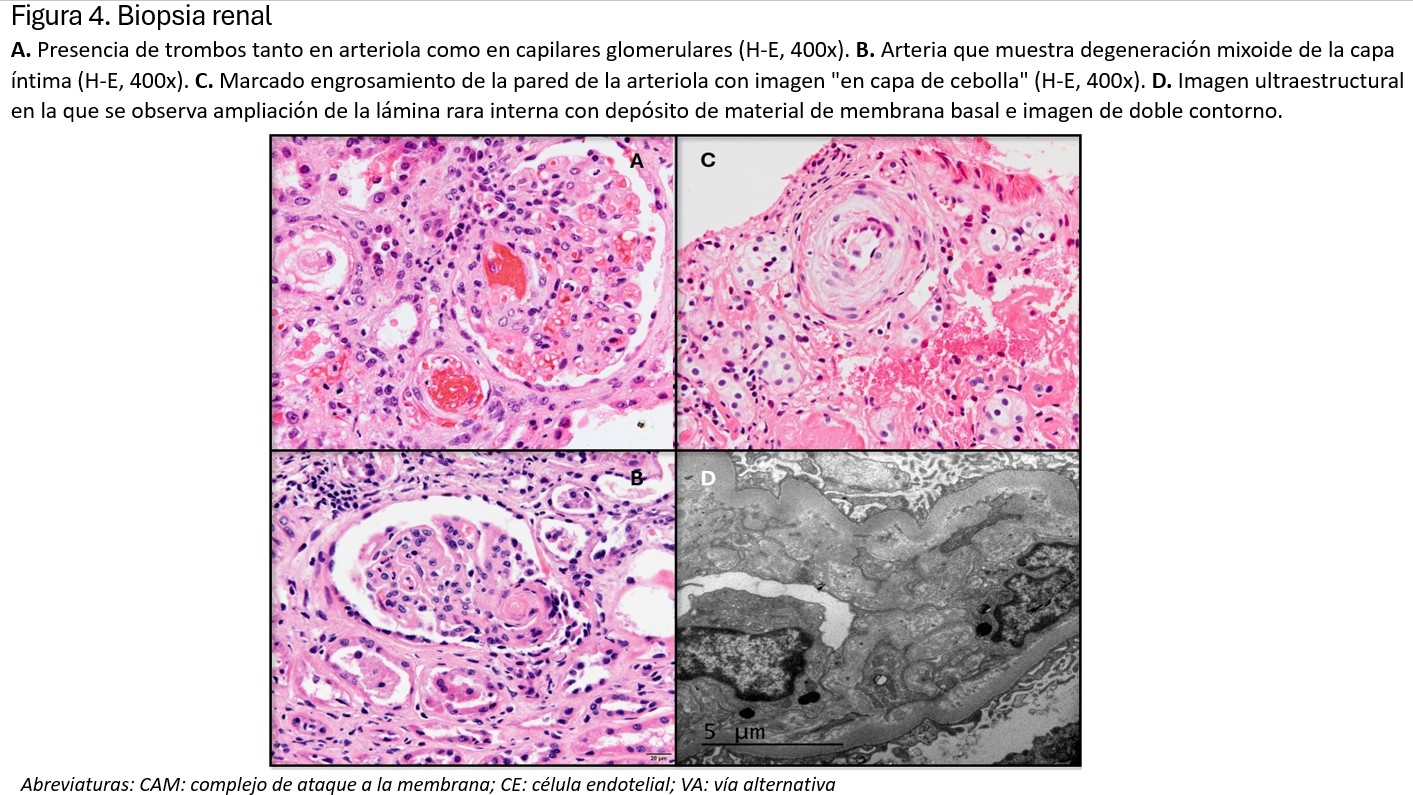
Los cambios histológicos más importantes, como es lógico, se van a observar a nivel vascular. En el glomérulo, las paredes capilares están engrosadas debido a edema subendotelial, lo que podría ocasionar un aspecto de doble contorno. En la luz de estos capilares se pueden encontrar microtrombos de fibrina y plaquetas, con eritrocitos atrapados y fragmentados, como consecuencia de la anemia hemolítica microangiopática (imagen A) (Figura 2). El retraimiento e incluso necrosis del penacho glomerular son consecuencias de la isquemia producida por los trombos intravasculares. El mesangio puede verse ensanchado y edematizado, con pérdida de la matriz y células mesangiales, en los casos más graves, hallazgo conocido como mesangiolisis. En arterias y arteriolas, hallaremos edema endotelial con degeneración mixoide de la íntima (imagen B) (Figura 2). Es frecuente encontrar necrosis fibrinoide de la pared acompañada de trombos plaquetarios, con eritrocitos atrapados (imagen A) (Figura 2). En lesiones de más tiempo de evolución, la íntima está engrosada con aumento de células miointimales que suele adoptar un engrosamiento concéntrico en forma de “capas de cebolla” (Imagen C) (Figura 2).
La inmunofluorescencia es habitualmente negativa para todos los antisueros empleados, aunque pueden observarse ocasionales depósitos parietales de IgG, IgM, IgA o C3 sin significación diagnóstica ni patogénica. En microscopía electrónica, se observa edema subendotelial y frecuentemente dobles contornos, bien por interposición de células mesangiales o por depósito de material de membrana basal (imagen D) (Figura 2).
Tratamiento
La supervivencia renal y del paciente con SHU atípico primario ha cambiado drásticamente desde la aparición de eculizumab. Eculizumab (Soliris®) es un anticuerpo monoclonal humanizado IgG2 que bloquea C5. De esta manera, evita la actuación de la C5 convertasa sobre dicha proteína y la formación de CAM sobre la célula endotelial. Su eficacia y seguridad ha sido demostrada en dos ensayos clínicos durante los cuales los pacientes recibían el fármaco durante 26 semanas, y posteriormente eran seguidos durante 1 año [97][98]. En uno de estos ensayos clínicos se incluyeron pacientes con SHU atípico primario con progresión a pesar de tratamiento con plasmaféresis o plasma fresco congelado (n=17). En el otro se incluyeron pacientes con SHU atípico primario que estaban recibiendo tratamiento de mantenimiento con plasmaféresis o plasma fresco congelado (n=20). En ambos estudios, eculizumab demostró mejoría tanto hematológica como renal a las 26 semanas y tras el año de seguimiento, sin nuevos brotes de la enfermedad.
Antes de la disponibilidad de eculizumab el tratamiento consistía en plasmaféresis e infusión de plasma fresco congelado, con lo que se consiguió disminuir la mortalidad desde un 50% a un 25% [99]. Sin embargo, la necesidad de diálisis a los 3 años continuaba siendo del 67% [95]. Además, la tasa de recurrencia de la enfermedad tras un trasplante renal se situaba en un 70% con pérdida de función del injerto en prácticamente todos los casos [100]. Aunque la plasmaféresis suele mejorar las anomalías hematológicas (anemia, trombopenia), no actúa sobre el problema básico de la enfermedad, la disregulación de la vía alternativa del complemento. Un metaanálisis no demostró efectos beneficiosos adicionales de la plasmaféresis con relación a la terapia de soporte [101]. La plasmaféresis puede ser eficaz en los casos de SHU atípico primario causado por anticuerpos anti-FH, al eliminar anticuerpos del torrente sanguíneo [102][103]. La infusión de plasma fresco podría ser útil en el tratamiento del SHU atípico primario por el aporte de factores reguladores de la vía alterna del complemento: CFH, CFI, y probablemente CFB y C3, con una tasa de respuesta muy variables [104][105]. No sería útil, por el contrario, en mutaciones en MCP, ya que es una proteína de membrana.
Las terapias inmunosupresoras como corticoides o rituximab solamente aportan beneficio en los casos debidos etiologías autoinmunes, como las asociadas a anticuerpos anti-FH o a enfermedades autoinmunes como lupus o síndrome antifosfolípido.
Por todo ello, existe acuerdo general en que el eculizumab es el tratamiento de primera línea del SHU atípico primario. Un aspecto muy importante del tratamiento con eculizumab es que el grado de recuperación de la función renal guarda una clara relación con la rapidez de instauración del tratamiento. Retrasos en el tratamiento superiores a 1-2 semanas tras la detección del fracaso renal agudo se asocian ya a un mayor riesgo de insuficiente recuperación de la función renal basal, y si el retraso es mayor (lo que muchas veces es debido a los problemas burocráticos que conlleva la autorización del fármaco) el riesgo de ERC terminal es elevado [97][98][106][107].
La duración del tratamiento con eculizumab continúa siendo motivo de controversia. Algunos autores [108] plantean el uso de eculizumab únicamente para tratar los brotes de la enfermedad, sin emplear un tratamiento de mantenimiento o preventivo. Sin embargo, se ha demostrado que tras la suspensión de este existe un 24-30% de recidivas en los primeros 24 meses. Con la reinstauración precoz del tratamiento en los casos de recaída los resultados son favorables, aunque no se han estudiado las consecuencias sobre el daño crónico o a otros niveles como el sistema cardiovascular o pulmonar [109][110].
Actualmente las guías KDIGO recomiendan mantener el tratamiento al menos 6-12 meses desde que se objetiva la respuesta o, al menos, 3 meses desde que se normaliza/estabiliza la función renal e individualizar caso a caso la posibilidad de suspensión [4]. La suspensión de eculizumab parece segura en aquellos pacientes que no tienen una alteración genética en las proteínas que forman parte de la vía alternativa del complemento, ya que diversos estudios han mostrado la estrecha relación entre dichas variantes patogénicas y el riesgo de recaída [109][110]. Alrededor del 50% de los pacientes con anomalías genéticas presentará una recaída de la enfermedad al suspender eculizumab. Por ello, es fundamental realizar un estudio genético y funcional de la vía alternativa complemento que nos ayude a tomar esta decisión. Los niveles séricos de C5b-9 son también útiles en este sentido: niveles elevados en el momento de la suspensión de eculizumab aumenta el riesgo de recurrencia (>300 ng/mL según el test de ELISA empleado en este estudio) [110]. Por otra parte, se ha puesto en marcha un ensayo clínico (NCT04859608) acerca de la reducción de dosis de eculizumab en pacientes que requieren tratamiento crónico, comparando tratamiento estándar (mantenimiento con dosis fijas de 1200 mg cada 2 semanas) con una administración del fármaco ajustada a sus niveles séricos.
Más recientemente, se ha introducido el ravulizumab (Ultomiris®), un anticuerpo monoclonal humanizado que, al igual que eculizumab, se une a C5 impidiendo su hidrólisis por parte de la C5 convertasa. La ventaja frente a eculizumab es la duración de su efecto, que permite una administración del fármaco cada 2 meses, frente a la administración cada 2 semanas de eculizumab [111][112].
En el SHU atípico secundario el tratamiento fundamental es el de la causa desencadenante. No obstante, existen casos refractarios o con mala evolución a nivel renal o extrarrenal (neurológico, cardiológico…), a pesar del tratamiento específico de la enfermedad original. Estos pacientes podrían beneficiarse de un ciclo corto de eculizumab, considerando que existe en ellos una activación transitoria de la vía alterna del complemento que amplifica el daño endotelial [76]. Numerosos casos clínicos y series de pacientes han mostrado el efecto favorable de ciclos cortos (1-3 meses) de eculizumab en pacientes con SHU atípico secundario que no responden al tratamiento de la causa específica del SHU [113]. No obstante, dada la ausencia de ensayos terapéuticos controlados, el uso de eculizumab en estos pacientes continúa siendo controvertido [114].
Como ya hemos comentado, puesto que el daño endotelial no está mediado por el complemento, aquellos pacientes con SHU atípico asociado a déficit de cobalamina C o con mutaciones en DGKε no deberían ser tratados con eculizumab. En el primero, el daño en la célula endotelial es causado por un defecto en el metabolismo de la vitamina B12 (cobalamina) y su tratamiento será la administración de esta vitamina [79]. En el caso de déficit de DGKε, no se conoce el mecanismo por el cual se produce el daño endotelial, por lo que no existe un tratamiento eficaz para la enfermedad [80].
Actualmente se están ensayando otras moléculas bloqueantes del complemento (Tabla 4). Crovalimab , (un anticuerpo monoclonal secuencial anti-C5 con tecnología de reciclaje); iptacopan, (molécula que se une a la fracción b del factor B (Bb) impidiendo la hidrólisis de C3 por parte de la C3 convertasa); ruxoprubart (anticuerpo monoclonal humanizado que se une a Bb); cemdisirán (molécula de interferencia del ácido deoxirribonucleico (ARN) que impide la expresión del gen de C5 en el hepatocito); pegcetacoplan (molécula que se une a C3 impidiendo la acción de la C3 convertasa, tanto de la vía alternativa como de la clásica/lectinas); ARO-C3 (siRNA que impide la expresión génica de C3 en el hepatocito); y KP104, (anticuerpo monoclonal dual). Varios de estos fármacos se están ensayando en otras patologías relacionadas con el complemento como la hemoglobinuria paroxística nocturna, enfermedades glomerulares como nefropatía IgA o glomerulopatía C3, o enfermedades sistémicas como el lupus.
Trasplante
Los SHU atípicos secundarios no recurren tras el trasplante renal a no ser que la enfermedad o causa subyacente continúe activa. Probablemente el SHU atípico secundario con más riesgo de recidiva es el relacionado con el síndrome antifosfolípido catastrófico. En dos pequeñas series de tres pacientes cada una [115][116], el uso de eculizumab preventivo o terapéutico tras recidiva de la enfermedad en el trasplante consiguió un adecuado control de la misma.
El diagnóstico de MAT después del trasplante renal requiere un análisis exhaustivo de todas las posibles causas. En el momento del postrasplante existen múltiples agresores endoteliales que pueden desencadenar una MAT: el estrés quirúrgico, el daño isquemia-reperfusión, el rechazo agudo mediado por anticuerpos, fármacos como inhibidores de la calcineurina o inhibidores de mTOR (del inglés mammalian Target of Rapamycin), o infecciones bacterianas o virales. Añadido a esto, un número no desdeñable de pacientes llega al trasplante sin un diagnóstico claro de la causa de su enfermedad renal. En un trabajo reciente, en el que se incluyeron 92 pacientes con MAT de novo tras un trasplante renal, encontraron que un 91% de los casos fueron debidos a anticalcineurínicos o a rechazo mediado por anticuerpos (54% y 37%, respectivamente), aunque en un tercio de los casos se hallaron múltiples factores desencadenantes. Interesantemente, en la mayoría de los casos (82%) el diagnóstico fue histológico ya que no se encontraron datos de anemia hemolítica microangiopática en sangre periférica [117]. La ausencia de anemia hemolítica microangiopática en una gran parte de los casos de SHU en el trasplante renal puede retrasar el diagnóstico y, por tanto, el tratamiento. La información acerca de la supervivencia del injerto renal en pacientes con MAT limitada al riñón frente a MAT sistémica es escasa e inconsistente [118], aunque sí está claro el impacto negativo de la MAT de novo sobre la supervivencia del injerto renal [117].
Respecto al SHU atípico primario, los pacientes presentaban una elevada tasa de recidiva antes de la disponibilidad de eculizumab, con pérdida de función del injerto en el 80-90% de las recurrencias [3][100][110]. El riesgo de recidiva guarda una estrecha relación con el tipo de anomalía genética: pacientes con mutaciones en CFH o CFI desarrollan recidiva del SHU en el 70-90% de los casos. Sin embargo, aquellos pacientes con mutaciones aisladas en proteínas de membrana como MCP o proteínas intracelulares como DGKε tendrán un muy bajo riesgo de recurrencia post-trasplante ya que el injerto renal expresará correctamente estas proteínas [3][80][100].
El riesgo de recurrencia es mayor durante el primer año de trasplante (70% de los casos) y su aparición supone un drástico descenso en su supervivencia, con solo un 30% de trasplantes funcionantes a 5 años. Además, más del 80% de los pacientes que pierden un trasplante renal por recidiva, presentarán recidivas en injertos posteriores, por lo que la posibilidad de conseguir un trasplante renal funcionante en estos pacientes era muy baja antes del desarrollo de eculizumab [3][100][117].
El tratamiento de la recidiva de un SHU atípico primario consiste en la administración de eculizumab. La plasmaféresis tanto preventiva, antes de presentar la recurrencia, como terapéutica no ha demostrado mejorar la supervivencia del injerto renal [100][107]. Existe una controversia actual acerca del uso de eculizumab preventivo (administrado desde el primer día del trasplante) en los pacientes con SHU primario. Según datos publicados del Global aHUS registry [119], la estrategia de uso de eculizumab preventivo consigue mejor función del injerto renal en comparación con su uso solamente cuando se objetiva la recurrencia. Estos datos también son confirmados por el grupo francés [107]. En este estudio, el único factor de riesgo asociado a pérdida del injerto fue la recurrencia de la enfermedad, mientras que el único factor protector fue el uso de eculizumab profiláctico. Otros grupos defienden el uso de eculizumab solamente en casos de recidiva objetivada, basándose en análisis de coste-eficacia [120]. No obstante, en este estudio solamente una minoría de pacientes alcanzó la función renal que tenían antes de la aparición del SHU.
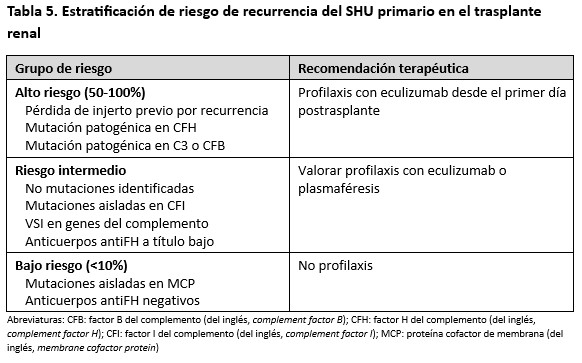
El estudio genético y funcional del complemento resulta una herramienta fundamental para tomar decisiones acerca del uso de eculizumab preventivo. Según las recomendaciones de las KDIGO (2017) [4] los pacientes se deben estratificar en diferentes grupos de riesgo en función de las anomalías encontradas (Tabla 5). En el estudio colaborativo francés [107], los pacientes de alto riesgo que no recibieron profilaxis con eculizumab presentaron una alta tasa de recurrencia (cercana al 80%) y esto comprometió la supervivencia del injerto. En el grupo de riesgo intermedio la recurrencia fue del 50%, aunque esto no supuso un impacto significativo en la supervivencia del injerto al iniciar el tratamiento con eculizumab de forma precoz tras el diagnóstico de la recidiva. En este grupo, la mayoría de las recurrencias aparecieron en pacientes sin mutación patogénica en los genes candidatos, salvo el hallazgo del haplotipo de riesgo CFH-H3 en homozigosis. Doce de los 13 pacientes de este grupo intermedio que recibieron eculizumab profiláctico suspendieron eculizumab sin recidivas posteriores. En cuanto al grupo de pacientes de riesgo bajo, ningún caso recibió eculizumab preventivo y no se observaron recidivas. En resumen, estos datos indican que los pacientes con riesgo alto/intermedio se benefician del uso de eculizumab profiláctico, pudiendo plantearse su suspensión en pacientes de riesgo intermedio (mutaciones patogénicas en CFI y sin hallazgo de mutaciones); mientras que los pacientes de bajo riesgo pueden recibir su trasplante renal sin tratamiento.