Amiloidosis Renal
INTRODUCCIÓN
Las amiloidosis son un grupo de enfermedades de etiología diversa y de incidencia infrecuente, que se caracterizan por el depósito en los tejidos de diferentes órganos de un material amorfo que toma específicamente la tinción Rojo Congo, presenta una estructura fibrilar característica en la microscopía electrónica, y un patrón de láminas beta-plegadas por difracción de rayos X [1][2][3][4][5][6][7][8].
El término amiloidosis fue acuñado por primera vez por Virchow [9], y etimológicamente procede de las palabras griegas a-myl(o)-: almidón, -eid(és): que tiene aspecto, y -o-sis: proceso patológico, haciendo referencia al aspecto similar al almidón que tiene este agregado proteico, y que comparten la misma avidez por las tinciones yodadas.
Hasta el momento se han identificado 42 proteínas precursoras amiloidogénicas humanas, 14 de ellas con capacidad de afectación sistémica [10], que de forma natural o debido a mutaciones en su estructura poseen la capacidad de cambiar su conformación (anormal con plegamiento en láminas ß), agregarse y formar fibrillas insolubles en soluciones acuosas, resistentes a la proteólisis, que infiltran extracelularmente los tejidos, y son capaces de alterar gravemente la estructura y función de los órganos afectados, e incluso provocar la muerte [1][2][3][4][5][6][7][8].
Las amiloidosis se pueden clasificar según su extensión en sistémicas o localizadas.
El riñón es uno de los órganos más frecuentemente afectado en las formas sistémicas, pero es excepcional el depósito localizado de amiloide en el parénquima renal, habiéndose descrito solo algunos casos en la vía urinaria [11][12]. Así, la mayoría de las amiloidosis renales se asocia con depósito y daño concomitante de otros órganos, como el corazón, hígado, sistema nervioso periférico, tejidos blandos, etc.
Según su etiopatogenia, las amiloidosis renales se clasificaban hasta hace unas décadas en primarias, secundarias o reactivas, hereditarias, e idiopáticas. El desarrollo de nuevas técnicas diagnósticas ha permitido la identificación de numerosas proteínas amiloidogénicas, y es por esta razón que actualmente esta enfermedad se clasifica por el tipo de proteína precursora fibrilar causante [1], que se designa con siglas que comienzan con la letra A (amiloidosis), seguida de la inicial de la proteína amiloidogénica específica (L para las cadenas ligeras, A para la proteína A, TTR para la transtiretina, etc). Así la nomenclatura correcta para designar la enfermedad consistiría en añadir al término “amiloidosis” la proteína amiloidogénica causante, p.ej. amiloidosis AL, AA, etc [1]. En los casos de proteínas mutadas puede además incluirse en la nomenclatura la descripción de la mutación o variante, p. ej. ATTRVal30Leu [1].
En los siguientes apartados de esta revisión se desarrollan las principales características de las amiloidosis con afectación renal.
Aunque vinculada con la insuficiencia renal, se excluye de este tema la amiloidosis por ß2-microglobulina por ser más consecuencia que causa de la enfermedad renal, y corresponder mejor su exposición a capítulos relacionados con la enfermedad renal crónica y diálisis.
TIPOS DE AMILOIDOSIS RENAL
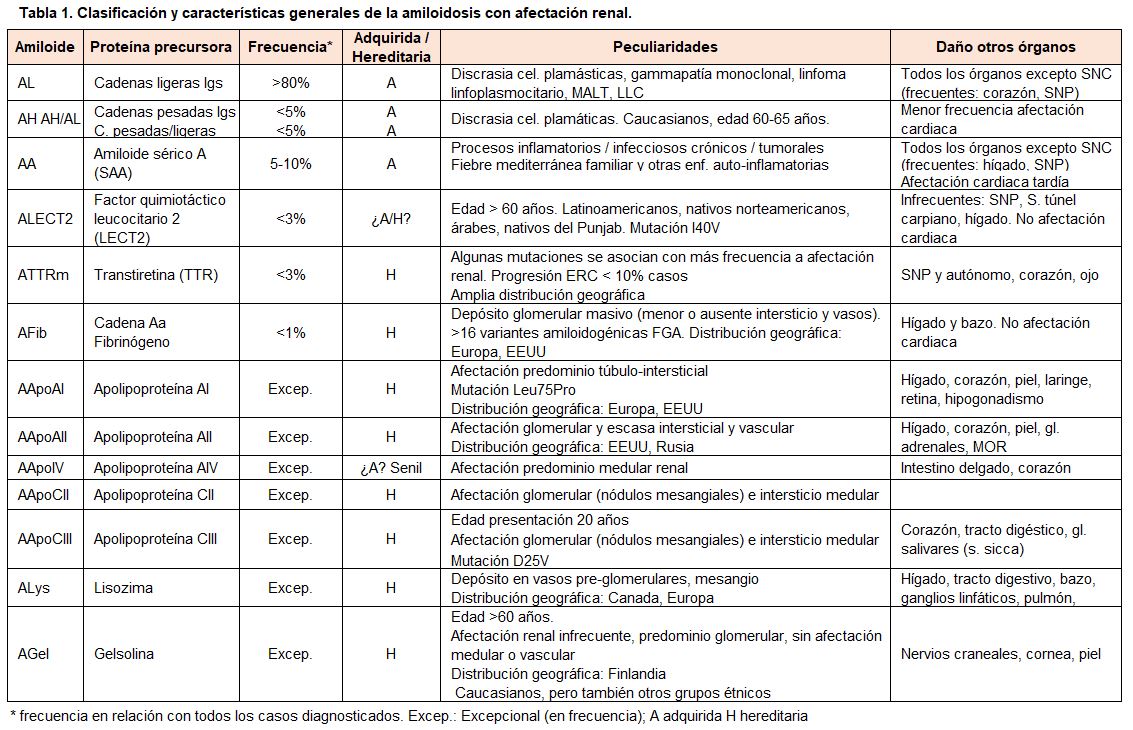
En la (Tabla 1) se muestran los tipos de amiloidosis sistémica con frecuente afectación renal, clasificados por orden descendente de incidencia.
Los fragmentos de inmunoglobulinas, sobre todo las cadenas ligeras, son con diferencia, la proteína precursora fibrilar más frecuentemente asociada a las amiloidosis sistémicas en países desarrollados (>80%), seguida a distancia de la amiloidosis por amiloide sérico A (SAA) secundaria a procesos inflamatorios o infecciosos crónicos (5-10%) [1][5][6][7][8][13][14][15].
Entre las formas infrecuentes de amiloidosis sistémica con afectación renal destacan las relacionadas con la proteína factor quimiotáctico leucocitario 2 (ALECT2) [16][17][18][19][20], formas mutadas de la proteína transtiretina (ATTR) [21], cadena A del fibrinógeno [22][23], varias apolipoproteínas [24][25][26][27][28], lisozima [29][30] y gelsolina [31]. La incidencia de estas formas infrecuentes de amiloidosis es menor al 10% del total [1][5][6][7][8][13][14][15].
Alguna de estas amiloidosis infrecuentes como la ALECT2 incide de forma especial en determinados grupos étnicos como los latinoamericanos (especialmente centroamericanos), nativos norteamericanos, y en algunas regiones de Asia central y países árabes [17][18][19][20].
La amiloidosis por transtiretina no mutada (“wild type” ATTRwt) es actualmente una causa frecuente de amiloidosis en la población masculina anciana [21]. En esta clasificación (Tabla 1) no se ha incluido este tipo de amiloidosis porque afecta predominantemente al corazón, siendo infrecuente un daño renal significativo.
ETIOPATOGENIA
Las discrasias de células plasmáticas en las que un clon celular proliferado produce de forma anormal grandes cantidades de fragmentos de inmunoglobulina, principalmente cadenas ligeras (AL), y más raramente cadenas pesadas (AH) o ambas (AL/AH), son la causa más frecuente de amiloidosis sistémica [3][6][32][33][34]. Otros procesos patológicos en los que puede existir una sobreproducción de fragmentos de inmunoglobulinas por parte de linfocitos B como los linfomas linfoplasmocitarios, linfoma MALT o leucemia linfocítica crónica también pueden asociarse al desarrollo de amiloidosis [4][6][10].
La mayoría de estas discrasias de células plasmáticas (90%) no reúne criterios de mieloma, presentándose como gammapatías monoclonales de significado incierto o de significado renal [3][6][10][32][33][34].
Entre un 75-80% de los casos la cadena ligera implicada es λ, que en una gran proporción corresponde a la familia λVI (IGVL6-57) [33]. En menos de un 10% de los casos con afectación renal, la cadena ligera implicada es κ, y de forma mucho más excepcional las cadenas pesadas (AH) [35], cuya dificultad diagnóstica se acrecienta por la expresión anómala de su estructura (cadena truncada) [36][37].
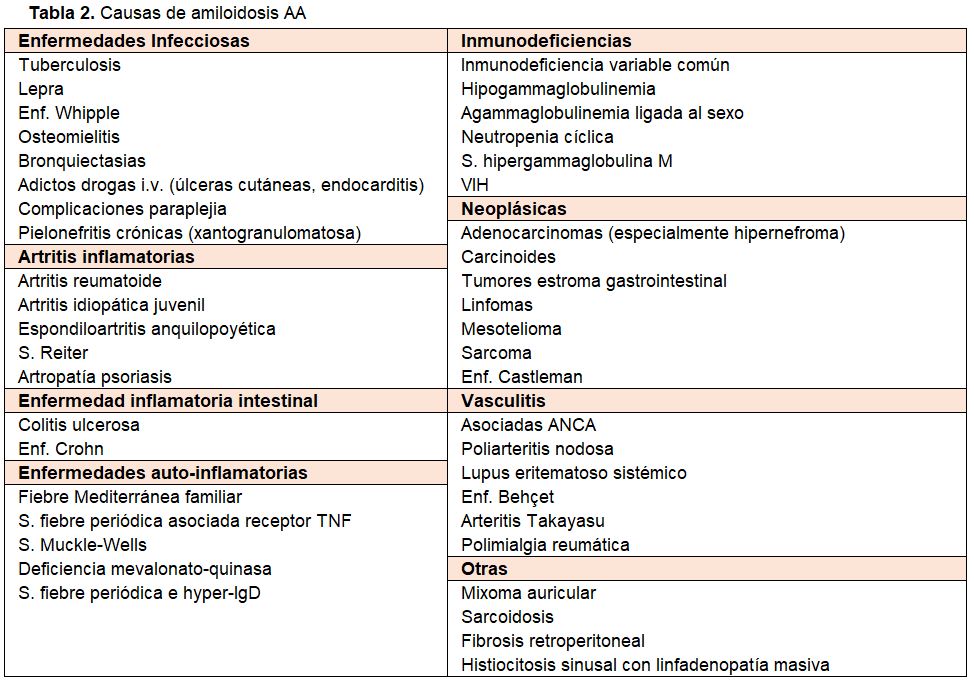
La amiloidosis AA se relaciona con un aumento de producción de proteína sérica amiloide A (SAA), un reactante de fase aguda de síntesis hepática, inducido por procesos inflamatorios o infecciosos crónicos, y en menor frecuencia por tumores, síndromes auto-inflamatorios, inmunodeficiencias, o vasculitis (Tabla 2) [4][6][8][38].
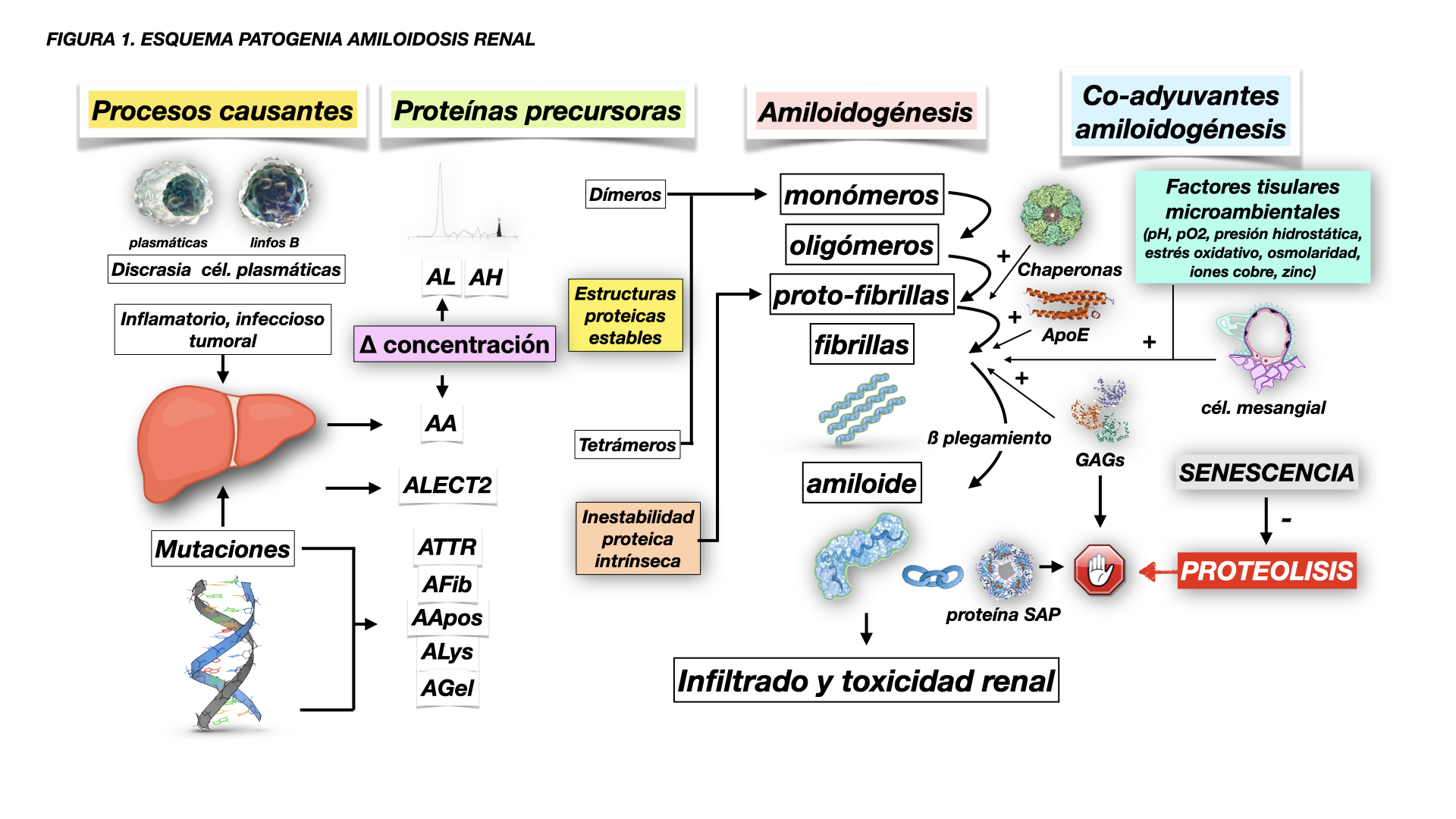
Las bases patogénicas de las amiloidosis sistémicas se pueden resumir en (Figura 1): (i) Aumento de síntesis de proteínas con una capacidad natural de ß-plegamiento en capas que las hace insolubles, con formación de fibrillas, y resistentes a la proteólisis, como las proteínas AL, AA, ALECT2, ATTRwt [2][3][4][33][38]. (ii) Mutaciones (espontáneas o hereditarias) en la estructura de algunas proteínas, o formación de estructuras proteicas inestables derivadas de una descomposición o escisión proteolítica, que las convierten en amiloidogénicas (ß-plegamiento) [2][3][4][33]. (iii) Determinadas características físico-químicas del medio extracelular (pH, pO2, tensión de cizallamiento, oxidación, iones metálicos, etc.), contenido de glicosaminoglicanos (GAGs) (heparan-sulfato y dermatan-sulfato) [2], e interacción con determinadas células como las mesangiales [39][40], que en su conjunto podrían promover la fibrilogénesis, protección contra la proteólisis y menor aclarado de estas proteínas amiloidogénicas, e incremento de la capacidad de agregación e infiltración del tejido. Esto explicaría por qué unos órganos se afectan con más frecuencia que otros, e incluso algunas partes de esos órganos son más proclives a ser infiltradas por determinadas proteínas amiloidogénicas.
La disminución de la capacidad de proteólisis y renovación proteica celular en relación con la senescencia podría también explicar por qué la mayoría de las amiloidosis se manifiesta en mayores de 60-65 años [33].
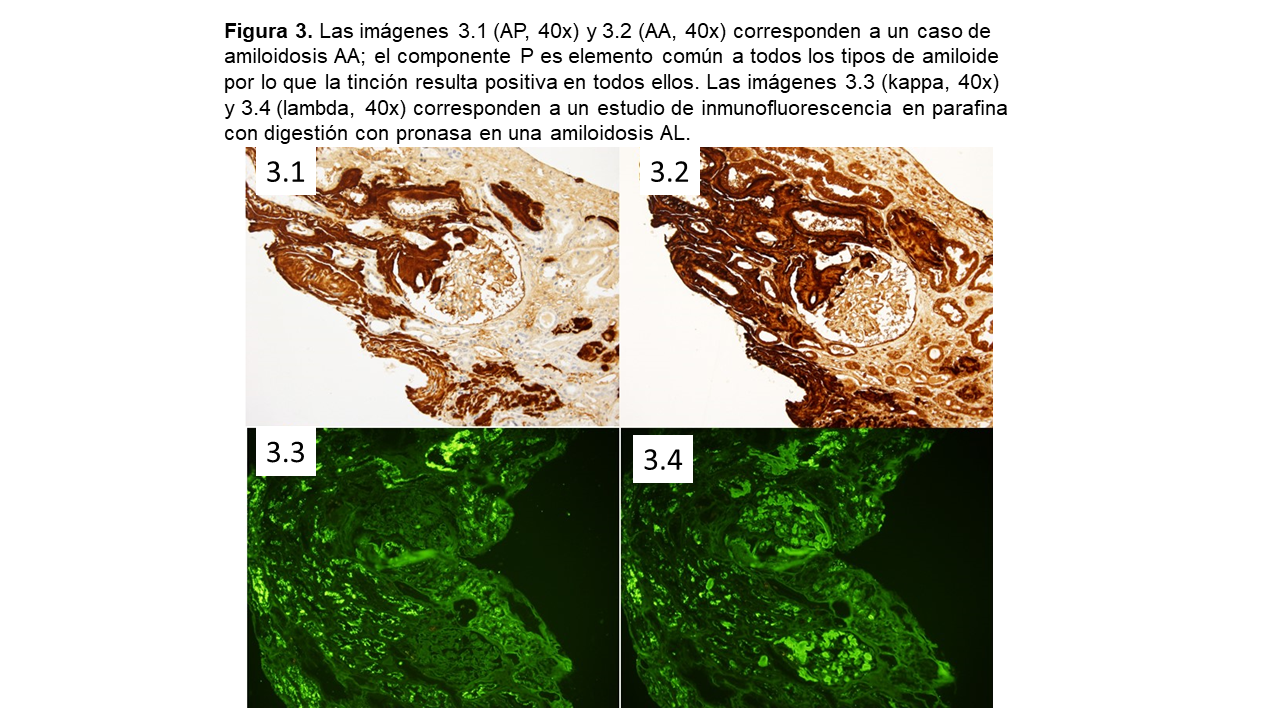
Además de la proteína amiloide predominante en cada tipo de amiloidosis, es constante encontrar en la composición de este material la proteína amiloide sérica P (SAP), una glicoproteína que pertenece a la familia de las pentraxinas, que se une a todo tipo de amiloide mediante enlaces calcio-dependientes [2][4][41]. La SAP es altamente resistente a la proteólisis y confiere a las fibrillas de amiloide resistencia a la degradación [41].
La apolipoproteína E (ApoE) es otro elemento constante en la composición de cualquier amiloide sistémico [2][42][43], y especialmente en las formas localizadas (p.ej. ß-amiloide de la enfermedad de Alzheimer) [44]. Podría tener algún papel como proteína chaperona patológica promotora de fibrilogénesis.
Los mecanismos por los que el amiloide daña los tejidos podrían estar relacionados con los cambios de arquitectura que mecánicamente interferirían con la función fisiológica de los órganos afectos. Aunque no existe una clara correlación entre la extensión de la infiltración de amiloide en un determinado órgano y el daño o la recuperación funcional del mismo, algún estudio sí lo ha observado en tejido renal [45]. Es probable que algunos fragmentos oligoméricos pre-fibrilares puedan comportarse como tóxicos y contribuir a la disfunción de órganos [2][46][47].
HISTOPATOLOGÍA
El diagnóstico de amiloidosis se basa en su demostración histopatológica [4][8][48][49][50][51][52][53]. La biopsia renal rinde buenos resultados diagnósticos, incluso mejores que el examen de muestras de recto, grasa subcutánea, hígado o médula ósea [4][53].
El glomérulo es uno de los principales y más precoces tejidos donde se deposita la mayoría de los amiloides. El depósito de amiloide en el parénquima renal puede observarse tanto en mesangio, pared capilar, intersticio, como los vasos arteriales [52][53]. Cuando el depósito mesangial de amiloide es extenso pueden formarse nódulos semejantes a la nefropatía diabética o a la enfermedad de depósitos de cadenas ligeras [54].
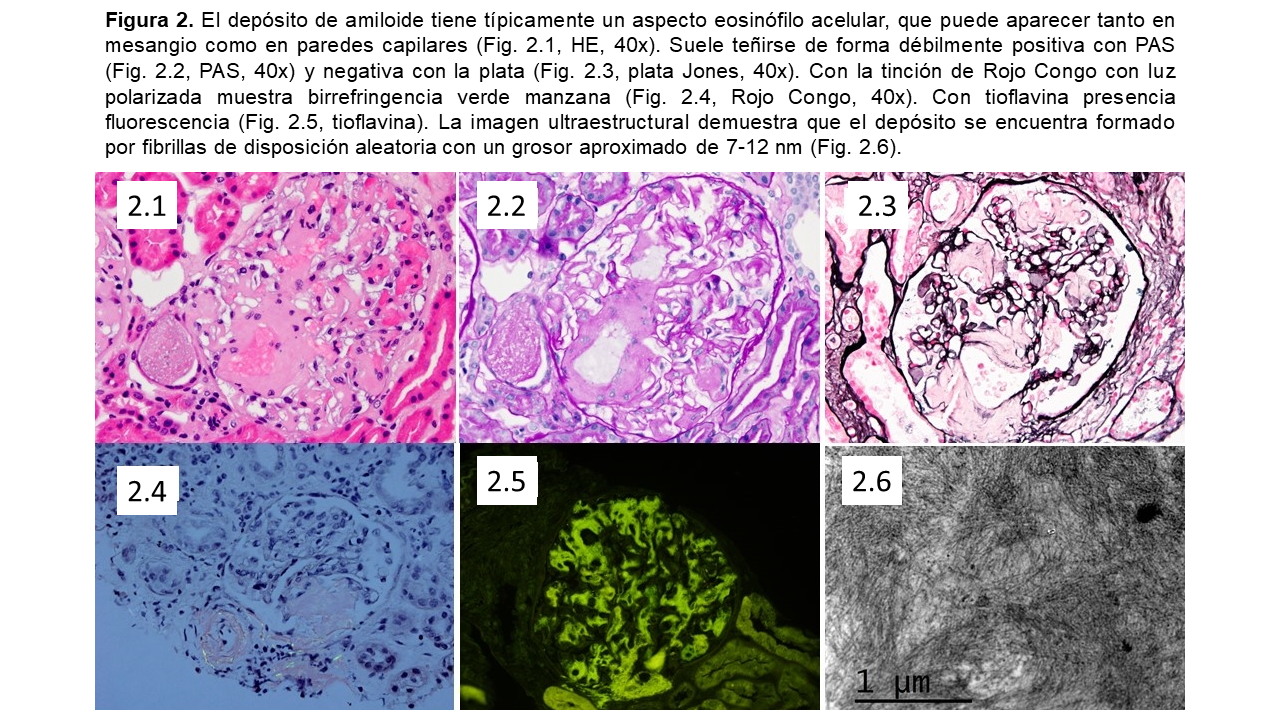
En tinciones de hematoxilina-eosina, el amiloide se reconoce por el aspecto de material extracelular hialino amorfo y eosinofílico [53]. Característicamente no se tiñe o solo de forma muy débil con la tinción de PAS (periodic acid-Schiff), o tricrómico de Masson [3]. Aunque la tinción con plata metenamina también suele ser negativa, ocasionalmente se puede observar con esta tinción un patrón espicular subepitelial perpendicular a la membrana basal glomerular semejante a la glomerulonefritis membranosa [14][49][53].
La tinción con Rojo Congo (RC) sigue siendo el estándar diagnóstico rutinario de la amiloidosis [1][2][3][4][5][6][7][8][55]. Mediante luz polarizada esta tinción muestra una característica birrefringencia color verde manzana, a diferencia de la birrefringencia amarillo-verdosa del colágeno [56]. El amiloide también puede tomar otras tinciones (azul alcián, rojo sirio, violeta cristal o de metilo) [49][53].
La tinción RC también emite fluorescencia, y junto con las tinciones de Tioflavina T y S pueden apoyar el diagnóstico en el examen rutinario de inmunofluorescencia [3][53] (Figura 3). También existen otras tinciones fluorescentes como el oligotiofeno conjugado luminiscente (h-FTAA) y otros polímeros similares que han mostrado una buena sensibilidad en la detección de amiloide [57][58].
Una vez que se realiza el diagnóstico genérico o primario de amiloidosis son necesarios más estudios para identificar el tipo de proteína fibrilar amiloide.
No existen hallazgos histomorfológicos específicos que ayuden a distinguir los distintos tipos de amiloide mediante microscopía óptica y/o electrónica [49][52]. Algunas amiloidosis por apolipoproteínas muestran depósitos que pueden afectar de forma predominante o exclusiva al intersticio y médula renal [24][25][59][60], mientras que la causada por la cadena Aα fibrinógeno afecta más intensamente el glomérulo, pero respetando el resto de estructuras de la nefrona [22].
En la microscopía electrónica el amiloide aparece como agregados de fibras rígidas, alargadas, y no ramificadas, de 7-12 nm de diámetro, y orientadas al azar [2][3][61]. Suele aparecer con otras estructuras pentaméricas asociadas (amilode P), y la distribución es extracelular, con efecto de compresión sobre las células mesangiales adyacentes en el glomérulo o sobre miocitos en las paredes vasculares. Aunque no es útil para la identificación del tipo de amiloide, sí es capaz de diferenciar otras patologías renales asociadas a depósitos fibrilares (p.ej. glomerulopatía fibrilar o inmunotactoide, fibrilosis de la nefropatía diabética, etc.) [3][62][63].
Uno de los métodos, ya en desuso, que permitía distinguir indirectamente la amiloidosis AA de las denominadas primarias (gran parte de ellas AL), hereditarias o idiopáticas, era la pérdida de la tinción RC cuando el amiloide AA se incubaba con permanganato potásico (método de Wright), a diferencia de la resistencia a esta pérdida de tinción por parte del resto de los amiloides [64][65].
Otro método pionero en el diagnóstico de la identificación de amiloidosis AL fue el inmuno-etiquetado con anticuerpos anti-kappa y anti-lambda en partículas de oro para microscopía electrónica (indirect immunogold staining) [66][67]. Este método es más experimental que de rutina diagnóstica, y puede ser útil para una valoración más precisa de la localización y extensión del amiloide, y en la identificación de proteínas chaperonas.
Los métodos de tinción inmunohistoquímicos (inmunofluorescencia directa, tinción de inmunoperoxidasa) son los principales procedimientos para la identificación de las proteínas amiloidogénicas en la actual rutina diagnóstica clínico-patológica [3][7][8][10][52][63][68][69][70][71].
Se han comercializado antisueros frente a las principales proteínas amiloidogénicas conocidas, y están disponibles para el diagnóstico clínico-patológico, aunque la mayoría de los departamentos de patología solo suelen disponer de los antisueros más comunes.
La sensibilidad y especificidad de estos métodos no son siempre óptimas, sobre todo en los casos de amiloidosis AL, en los que no son infrecuentes resultados falsos negativos, tinciones confusas con más de un anticuerpo, o falsos positivos al unirse el anticuerpo a las cadenas ligeras de las inmunoglobulinas intactas [3][8][70][71][72].
Las causas de estos problemas de fiabilidad podrían ser atribuibles a los propios antisueros comerciales, a la heterogeneidad del amiloide, la contaminación del suero, y la ausencia de controles adecuados [70][71].
Se estima que entre un 8-32% de amiloidosis AL puede no llegar a ser diagnosticada correctamente mediante inmunofluorescencia [14][70][72]. Así, una tinción negativa o no concluyente frente a cadenas ligeras no descarta automáticamente la enfermedad, y debería ser calificada como de diagnóstico indeterminado y por tanto intentar su identificación por otros métodos más precisos y fiables [3][73].
El desarrollo e innovación de los análisis de proteómica ha sido fundamental en el avance del conocimiento y diagnóstico de las amiloidosis [3][7][73][74][75][76][77][78][79][80][81].
El método que se utiliza actualmente para la identificación del proteoma (conjunto de proteínas producido por un organismo o sistema) en una muestra de tejido es la espectrometría de masas (MS). Como este procedimiento es muy dependiente de la concentración, las proteínas tienen que ser separadas antes del análisis mediante cromatografía líquida [3][78][81].
El estándar de aplicación proteómica para la identificación de amiloide es la microdisección con láser seguida de la MS (LMD-MS). Las áreas teñidas con RC son micro-disecadas con láser y sometidas a digestión con tripsina. Los péptidos digeridos son analizados por cromatografía líquida MS en tándem mediante ionización con electrospray (ESI) o mediante desorción/ionización láser asistido por matriz (MALDI) [79]. La secuencia es analizada mediante diferentes algoritmos, y al resultado se le asigna una puntuación de probabilidad de que la lectura de los péptidos corresponda a proteínas de interés (para una más completa y didáctica explicación de estos métodos diagnósticos se recomiendan las referencias [78] y [81]).
Las aplicaciones prácticas de este método alcanzan sensibilidad y especificidad del 97-100% en la identificación de proteínas amiloidogénicas, por lo que se consideran actualmente como estándar de máxima fiabilidad [3][14][68][77].
Otra ventaja añadida de este método es que analiza directamente el péptido real, y así puede identificar si presenta o no mutaciones. Con el software y bases de datos que se disponen actualmente se pueden identificar numerosas variantes genéticas y mutaciones [3][78][81].
Además de la proteína amiloidogénica predominante, en todos los depósitos de amiloide también se encuentran característicamente otras proteínas que ayudan a confirmar el diagnóstico y que se pueden identificar con LMD-MS como son: amiloide sérico P (SAP), apoliproteínas E y A-IV, y vitronectina [3][76][78][81].
El estudio LMD-MS para la identificación de amiloide se puede hacer en cualquier tejido, incluyendo el aspirado de grasa, y además no requiere muestras congeladas, sino que se pueden utilizar las incluidas en parafina, por lo que es muy útil en las revisiones de diagnósticos de archivo [3][8]. Podría estar especialmente indicado cuando los resultados inmunohistoquímicos son negativos o confusos, o cuando se sospeche que el tipo de amiloide es del grupo infrecuente [73].
A pesar de todas las ventajas mencionadas, el acceso actual a esta técnica diagnóstica en la rutina clínica es muy limitado, costoso, y la obtención de resultados es lenta.
EPIDEMIOLOGÍA
Las amiloidosis sistémicas son enfermedades infrecuentes, aunque esta afirmación debe basarse en los escasos estudios rigurosos sobre su incidencia y prevalencia, los cuales se circunscriben en la mayoría de las ocasiones a la amiloidosis AL, la forma más frecuente en países desarrollados.
Uno de los estudios más destacados sobre la incidencia de amiloidosis realizado en el condado de Olmsted (Minnesota, EEUU) con un largo seguimiento [82], mostró que la incidencia de amiloidosis AL ajustada a edad era de 5,1-12,8 casos por millón persona-años.
Un estudio del Registro Español de Glomerulonefritis mostró un descenso progresivo en la incidencia de amiloidosis, especialmente de la amiloidosis AA [83].
Otros estudios posteriores han observado también incidencias entre 8-14 casos por millón persona-años [84][85][86], con prevalencias crecientes de entre 15-40 casos p.m.p [86][87].
Estas incidencias estimadas en la clínica contrastan con los hallazgos de amiloidosis en necropsias de aproximadamente 0,6 casos x 1000, hecho que apoya el consenso general sobre el infra-diagnóstico clínico de estas enfermedades [86].
La edad media en el momento del diagnóstico es de aproximadamente 65 años [84][85][86][87], y existe una pequeña mayor incidencia de amiloidosis AL en hombres, y en cambio mayor incidencia de amiloidosis AA en mujeres [84].
Entre las formas infrecuentes de amiloidosis, pueden existir diferencias notables en cuanto a grupos étnicos (amiloidosis ALECT2) [20], y regiones geográficas (amiloidosis ATTRm, fiebre mediterránea familiar, etc.) [51][84].
Se estima una afectación renal en el 70% de los casos de amiloidosis AL [15][88], y más del 95% en las amiloidosis AA [89].
El diagnóstico de amiloidosis se realiza en el 1,7-2,1% de todas las biopsias renales [13][14][51], y según otro estudio [90], esta patología representa el 0,8% de todas las causas de enfermedad renal crónica avanzada en diálisis.
MANIFESTACIONES CLÍNICAS
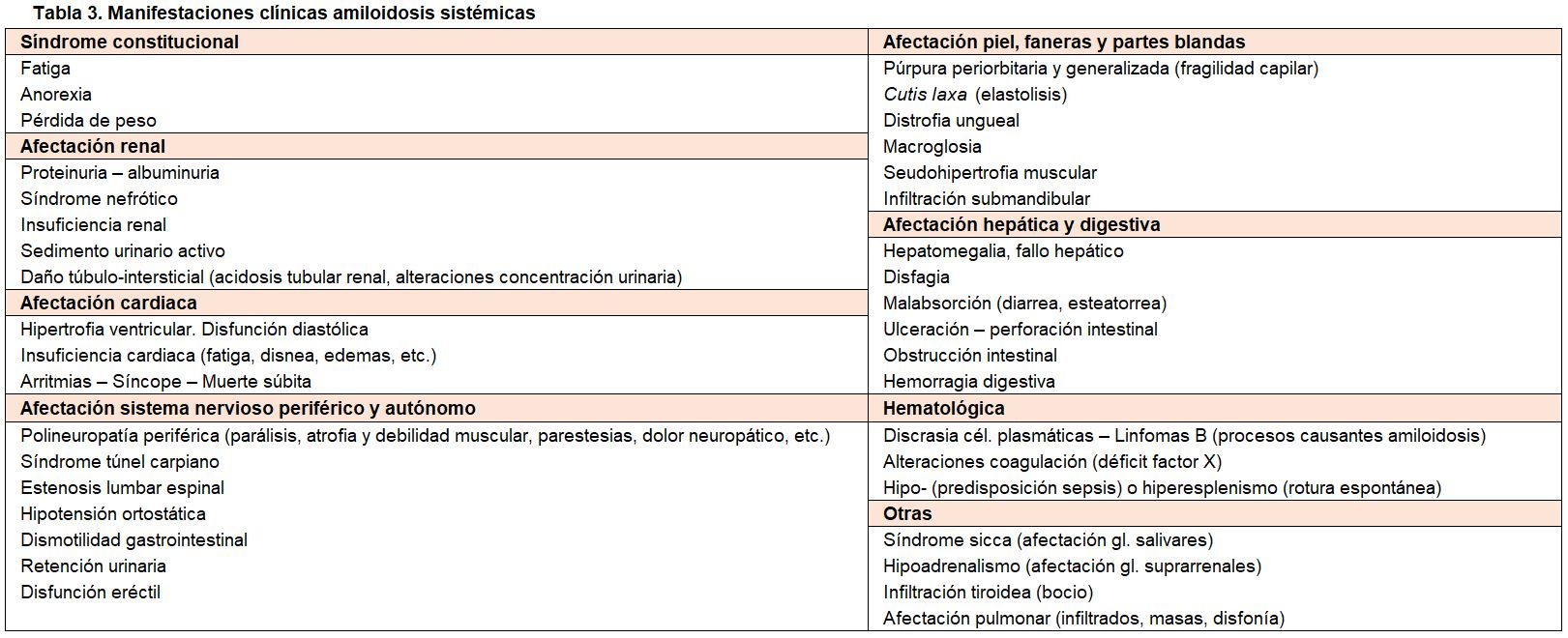
Las amiloidosis renales son en su mayoría enfermedades sistémicas, y así, entre sus manifestaciones clínicas se pueden distinguir las asociadas a las enfermedades causantes de la amiloidogénesis, las atribuibles al daño renal, y las relacionadas con el infiltrado extra-renal.
Enfermedad causante amiloidogénesis
Más de un 90% de las gammapatías monoclonales (GM) generadoras de amiloide AL o AH son asintomáticas (GM significado incierto o renal). Una minoría se asocia a mieloma o linfomas con manifestaciones clínicas floridas [3][6][10][32][33][34].
Una GM diagnosticada por pruebas serológicas asociada a depósito de amiloide en tejido renal o en otros órganos (rojo Congo positivo) no debe presuponer causalidad entre ambas mientras que no se demuestre por métodos inmunohistoquímicos o proteómicos que el amiloide depositado corresponde a cadenas ligeras o pesadas o ambas (AL o AH). Las GM de significado incierto son frecuentes en mayores de 65 años, y la mayoría de las amiloidosis sistémicas relacionadas o no con cadenas ligeras también se manifiestan en estas edades avanzadas. Esta recomendación puede evitar errores diagnósticos generadores de iatrogenia [3].
Las numerosas enfermedades causantes de amiloidosis AA (Tabla 2), en su mayoría de evolución crónica, se manifiestan de forma muy diversa pero característica de cada proceso, y con peculiaridades de herencia familiar y agrupación geográfica (cuenca Mediterránea) en los casos de síndromes auto-inflamatorios (fiebre mediterránea familiar) [38][89].
Manifestaciones renales
Las manifestaciones renales se relacionan con la extensión y localización preferente de los infiltrados amiloideos (glomerular, intersticial o vascular).
La afectación glomerular se manifiesta como proteinuria (albuminuria), síndrome nefrótico con proteinurias que pueden ser extremadamente elevadas (>15 g/24h) [33], sedimento urinario activo (microhematuria, leucocituria, cilindros), insuficiencia renal crónica con rápida progresión, e incluso grave deterioro del filtrado glomerular en el momento del diagnóstico [3][13][33][38].
Algunos tipos de amiloidosis infrecuentes (ver más adelante) se pueden manifestar con daño más localizado túbulo-intersticial y progresión más lenta de la insuficiencia renal crónica [24][25][59][60].
Los factores predictores de la progresión hacia la insuficiencia renal avanzada son, como en otras enfermedades renales, el grado de disfunción renal en el momento del diagnóstico y la magnitud de la proteinuria [91].
Manifestaciones extra-renales
Las manifestaciones de la afectación sistémica de las amiloidosis son numerosas y muy diversas (Tabla 1) y (Tabla 3). Destacan: el síndrome constitucional (fatiga, anorexia, pérdida de peso), la afectación cardiaca, muy frecuente en la amiloidosis AL, que condiciona en gran medida el pronóstico de esta enfermedad, manifestándose con hipertrofia ventricular, disfunción diastólica, insuficiencia cardiaca y arritmias. También son frecuentes las alteraciones del sistema nervioso periférico (polineuropatías), sistema nervioso autónomo (disautonomía), hepáticas, digestivas, piel, lengua (macroglosia), coagulación (déficit factor X), glandulares (síndrome seco), etc. (Tabla 2) [3][5][8][10][13][33][38][89].
CARACTERÍSTICAS DE LAS AMILOIDOSIS INFRECUENTES QUE AFECTAN AL RIÑÓN
Amiloidosis ALECT2
El factor quimiotáctico leucocitario 2 (leukocyte chemotactic factor 2, LECT2) es una proteína de 16,4 kD que se sintetiza en el hígado y es segregada a la circulación [16][92]. Se expresa en otros tejidos (sistema nervioso central, paratiroides, monocitos, piel, y vasos), y desempeña numerosas funciones en la inmunidad, respuesta inflamatoria, angiogénesis hepática, crecimiento y reparación celular [16][93].
Una amiloidosis provocada por la forma amiloidogénica de esta proteína (ALECT2) ha sido identificada recientemente [16][17][18][19].
El origen de esta transformación amiloidogénica es incierto. Se sospecha que podría ser hereditaria, y aunque no se ha observado ninguna mutación genética, sí es común encontrar una peculiaridad genética entre estos enfermos: genotipo G/G (homocigoto) en un polimorfismo puntual no sinónimo en posición 172 (polimorfismo I40V) [16][17][18][19][93]. Esta alteración, paradójicamente, es más frecuente entre europeos, y parece insuficiente para explicar la amiloidogénesis, por lo que se sospecha que podrían concurrir otras alteraciones genéticas o adquiridas aún por determinar. Una hipótesis reciente propone que el déficit de zinc o el efecto de un ambiente ácido sobre la afinidad de los enlaces dependientes de zinc tendría un efecto desestabilizador de la molécula que la haría más vulnerable a la agregación [93].
La amiloidosis ALECT2 tiene una clara predisposición en latinoamericanos, especialmente centroamericanos [16][17][18][19], aunque también se ha descrito en nativos norteamericanos [94], y en algunas comunidades de Asia central (Punjab) y países árabes. En un estudio realizado en Reino Unido [20] se ha observado que los diagnosticados con ALECT2 eran todos de origen étnico no-Caucasiano (la mayoría indios y egipcios). En estas comunidades predispuestas la ALECT2 es la segunda causa más frecuente de amiloidosis [18].
Las manifestaciones clínicas aparecen en pacientes con más de 65 años, y no se observan diferencias en la incidencia según el sexo. El riñón, hígado y bazo son los órganos más frecuentemente afectos, mientras que el corazón suele ser respetado, lo que le confiere un mejor pronóstico vital en comparación con otras amiloidosis. La afectación renal es predominante en intersticio cortical, y las manifestaciones clínicas más frecuentes son la insuficiencia renal (>90%), proteinuria leve-moderada (s. nefrótico <10%), sedimento urinario anodino, e hipertensión arterial.
Amiloidosis ATTR
La transtiretina (TTR), también conocida como prealbúmina, es un tetrámero de 55 kD, sintetizado principalmente (90%) en el hígado. Tiene una función de transporte de la tiroxina y de la proteína transportadora del retinol en sangre y líquido cefaloraquídeo, e impide la pérdida de vitamina A circulante por vía renal [95].
Esta proteína tiene la característica de presentar frecuentes mutaciones (>100 descritas), que inducen cambios conformacionales que inestabilizan su estructura tetramérica, la cual tiende a disociarse en monómeros amiloidogénicos [21]. Pero incluso su estructura natural (wild type) tiene propiedades intrínsecas amiloidogénicas, y de hecho es la causa de la denominada amiloidosis senil, que afecta preferentemente a varones ancianos dañando el corazón [21].
Las mutaciones de TTR son la causa más frecuente de amiloidosis hereditaria (∼10 p.m.p). La herencia es autosómica dominante, pero con penetrancia variable, y es endémica en muchas áreas geográfica. La mutación más frecuente ATTRv Val30Met es endémica en poblaciones de Portugal, Suecia, Japón, EEUU, Chipre [21].
La afectación de sistema nervioso periférico es la manifestación clínica más frecuente. La afectación renal ocurre en aproximadamente un 50% de los casos, se manifiesta en forma de proteinuria, con daño de predominio intersticial, en los estadios más avanzados de la enfermedad. Menos del 10% de los casos llegan a desarrollar insuficiencia renal [21].
Amiloidosis AFib
La cadena α del fibrinógeno A es un componente del fibrinógeno, de síntesis hepática, que tiene un peso molecular de 66 kD [22][23]. La amiloidosis causada por mutaciones del gen FGA que codifica esta proteína se transmite por herencia autosómica dominante, pero con penetrancia variable (frecuente ausencia de antecedentes familiares) [22][23]. La edad media de presentación es de 58 años, y representa una de las formas más frecuentes de amiloidosis hereditaria en Reino Unido, norte de Europa y EEUU [22][23].
Las manifestaciones más frecuentes son renales (síndrome nefrótico, hipertensión arterial e insuficiencia renal), y de forma característica el depósito de amiloide afecta masivamente a los glomérulos con obliteración de su normal arquitectura, pero con escasa o nula extensión a intersticio y vasos [22].
Aunque se pueden observar depósitos extra-renales en hígado, glándulas suprarrenales suelen mantenerse clínicamente silentes. La infiltración esplénica puede causar anemia, y eventual rotura espontánea del órgano con consecuencias muy graves.
La recurrencia es frecuente tras el trasplante aislado de riñón, pero no se ha documentado en pacientes que reciben un trasplante combinado de hígado y riñón.
Amiloidosis Agel (gelsolina)
La gelsolina es una proteína unida a la actina, ampliamente distribuida en el organismo, que tiene como función regular la longitud de los filamentos de actina. Se expresa intra- y extracelularmente, y juega un papel importante en procesos fisiológicos como la contracción muscular, tráfico de organelas, división y motilidad celular [96].
La amiloidosis hereditaria (autosómica dominante) por gelsolina (Agel) es también conocida como amiloidosis familiar tipo Fines [31]. Se trata de una mutación puntual (más de 4 identificadas) que provoca la escisión de la proteína transformándola en amiloidogénica [97]. Sus manifestaciones clínicas están dominadas por la afectación del sistema nervioso periférico y nervios craneales, y distrofia corneal. Una peculiaridad clínica de esta amiloidosis es la asociación con cutis laxa (elastolisis severa), alteración dermatológica que también se puede observar en otras amiloidosis.
Aunque infrecuente, este tipo de amiloidosis puede afectar el riñón (síndrome nefrótico y progresión lenta insuficiencia renal). El infiltrado amiloide renal es predominante en glomérulo. La edad media de presentación es de 64 años, y aunque es más frecuencia en Caucasianos, también se ha observado en todos los grupos étnicos.
Amiloidosis Alys (lisozima)
La lisozima es una proteína enzimática con actividad antimicrobiana que se encuentra principalmente en las secreciones externas (lágrimas, saliva, leche, y moco), y también se presenta en gránulos citoplasmáticos de macrófagos y polimorfonucleares.
La amiloidosis por lisozima (Alys) es una enfermedad hereditaria autosómica dominante extremadamente rara [29][30][98][99] que se manifiesta clínicamente por afectación renal (proteinuria, insuficiencia renal), síntomas gastrointestinales, síndrome seco. La afectación cardiaca y neuropática son infrecuentes. Se manifiesta en adultos jóvenes, y las familias descritas hasta el momento son de origen Caucasiano.
Amiloidosis por Apolipoproteínas (AApoAI, AII, AIV, CII y CIII)
Las apolipoproteínas (Apo) son los principales componentes proteicos de las lipoproteínas. Modificaciones en su estructura por mutación genética las transforma en amiloidogénicas, constituyendo un grupo de amiloidosis muy raras, de herencia autosómica dominante con penetrancia variable, y afectación sistémica, incluyendo el riñón, hígado y corazón [24][25][26][27][28].
Una peculiaridad de la AApoI es la afectación predominante del intersticio renal, y de la AApoIV y AApoCII la afectación limitada a la médula renal con preservación de la cortical [24][25][26][27][28].
En la AApoIV no se ha observado ninguna mutación ni herencia de la enfermedad, por lo que se especula que podría tratarse de una amiloidosis adquirida edad-dependiente, similar a la amiloidosis senil ATTRwt [60].
DIAGNÓSTICO
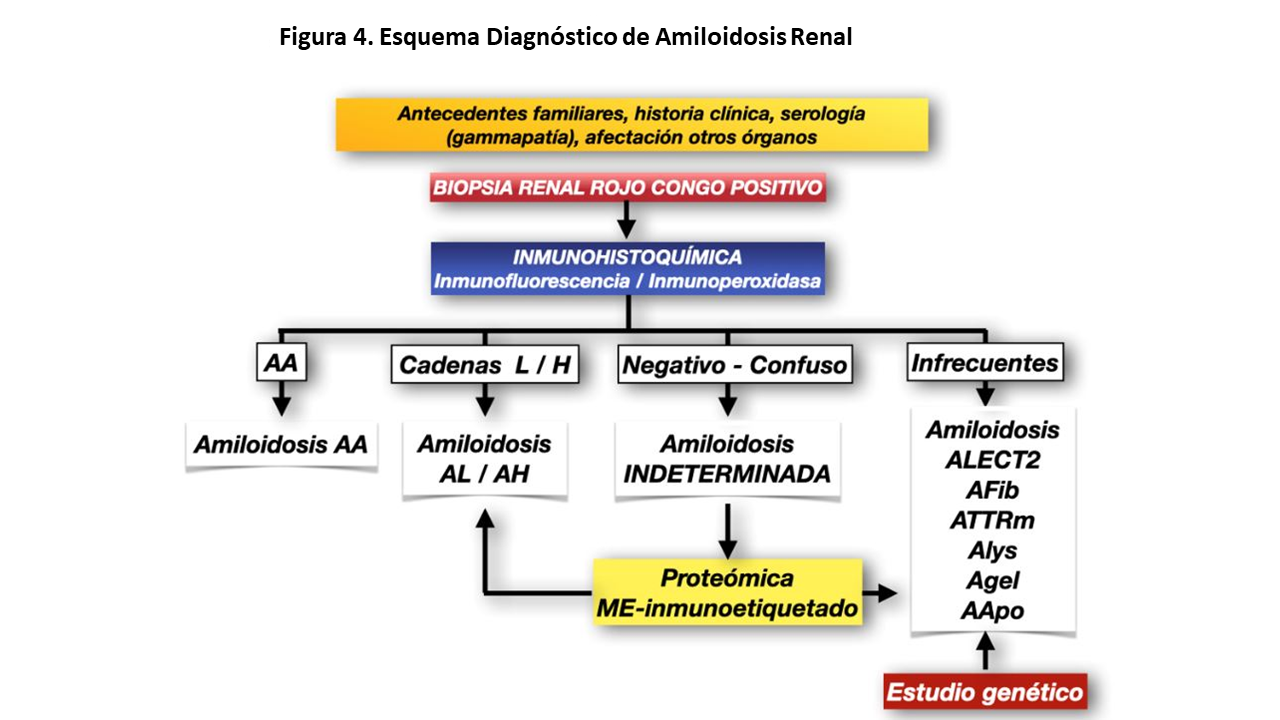
El diagnóstico de confirmación de una amiloidosis renal se debe realizar mediante la demostración de los depósitos de amiloide en tejido renal: biopsia con infiltrados material Rojo Congo positivo (ver apartado histopatología) (Figura 4). La identificación de cada tipo de amiloidosis se debe realizar mediante inmunohistoquímica y/o técnicas de proteómica (ver apartado histopatología) (Figura 2).
Además de los antecedentes familiares y la historia clínica, las pruebas serológicas (datos función renal, proteinograma e inmunofijación, cadenas ligeras libres, reactantes de fase, etc.) son de utilidad para el diagnóstico y en la monitorización evolutiva. Según los datos clínicos y serológicos se debería ampliar los estudios (p.ej. biopsia médula ósea, radiología ósea, etc.) si se sospechan procesos oncológicos asociados (mieloma, linfoma) [3][4][5][8].
La biopsia renal está indicada en pacientes que presentan manifestaciones de daño renal, y específicamente en los casos asociados a gammapatía monoclonal, el examen histopatológico aporta información fundamental para establecer el diagnóstico de los múltiples procesos renales asociados a las discrasias de células plasmáticas, entre las que se encuentra la amiloidosis AL [3][100].
Si los pacientes no presentan alteraciones de la coagulación – no infrecuentes en la amiloidosis AL¬– u otras contraindicaciones [101], las complicaciones esperables de una biopsia renal son iguales e incluso inferiores a las del resto de las patologías renales [102][103].
En el caso de contraindicación de biopsia renal, se puede investigar como alternativa la presencia de depósitos de amiloide en otros tejidos y órganos (grasa subcutánea, encía, recto, hígado, corazón, etc.), y especialmente en aquellos que muestren signos clínicos de estar también afectados, lo que mejora la sensibilidad de la prueba [3][4][5]. En estas muestras también se puede determinar el tipo de amiloide mediante análisis inmunohistoquímico y/o proteómico [3][78].
La gran mayoría de las amiloidosis renales son sistémicas, por tanto, además del daño renal también es preciso determinar el grado de afectación y extensión a otros órganos mediante estudios: cardiológicos (ecocardio, resonancia magnética, escáner isótopos, etc), neurológicos (electroneuro- y miogramas), biopsia partes blandas afectadas, endoscopias digestivas, tomografías computarizadas, biopsia hepática, etc. [3][4][5][8][10].
El escáner isotópico con la proteína SAP (proteína amiloidea P) marcada con I123 puede ser útil para determinar la extensión del amiloide en hígado, bazo, riñones, adrenales, médula ósea y articulaciones, aunque no sirve para valorar el infiltrado de amiloide en el miocardio, y además esta prueba es menos sensible en las amiloidosis hereditarias [4].
El estudio genético puede estar indicado en casos de amiloidosis hereditarias, y sobre todo para diferenciar amiloidosis por proteínas naturales, p. ej. la ATTRwt (amiloidosis senil), de las formas mutadas ATTRm.
La variable penetrancia de las amiloidosis hereditarias, además de hacer menos valorables los antecedentes familiares, podría desajustar los hallazgos genotipo-fenotipo, es decir podría no manifestarse la enfermedad a pesar de la existencia de una mutación [3].
Otra limitación de los estudios genéticos cuando se utilizan métodos comerciales de polimorfismos con fragmentos de longitud restringida es que solo pueden ser diagnosticadas mutaciones ya conocidas, pero no nuevas mutaciones, siendo necesario para este último objetivo diagnóstico el análisis de la secuencia genética completa (microarrays ADN, polimorfismo de un solo nucleótido, etc.) [3].
Otro uso de los estudios genéticos aplicable a la amiloidosis AL es la identificación de variaciones de secuencia de las cadenas ligeras que se asocian a resistencia a determinados tratamientos, y que pueden guiar la elección de otros más eficaces [8].
EVOLUCIÓN Y PRONÓSTICO DE LAS AMILOIDOSIS RENALES
En general, estas enfermedades se asocian con un mal pronóstico vital. La evolución y el pronóstico de las amiloidosis renales depende principalmente de la enfermedad causante de la amiloidosis y las posibilidades de ser tratada, el grado de severidad de la enfermedad renal y velocidad de su progresión, y el daño de otros órganos, siendo la afectación cardiaca uno de los principales factores limitantes de la supervivencia de estos pacientes [5][8][10].
La supervivencia estimada de una amiloidosis AL a los 4 años de su diagnóstico era de aproximadamente el 28% en la década 1990, incrementándose progresivamente hasta ser de un 50% en la última década [5].
Cuando se desarrolla enfermedad renal crónica avanzada, la supervivencia media se reduce a solo 2 años. El trasplante renal mejora esta supervivencia aunque sigue resultando inferior que la de los trasplantados renales con enfermedades distintas a la amiloidosis.
TRATAMIENTO
A) Tratamiento de soporte
El tratamiento de soporte será común a todos los tipos de amiloidosis y requerirá un abordaje multidisciplinar. Entre las medidas a implementar se incluyen: la restricción de sal de la dieta; el uso cuidadoso de diuréticos, aunque la prescripción de iSGLT2 podría resultar beneficiosa, especialmente si hay afectación cardiológica asociada; precaución con la anticoagulación por diátesis hemorrágica; vigilancia de hipotensión ortostática y evitar en la medida de lo posible el uso de fludrocortisona para evitar sobrecarga hidrosalina; tratamiento del dolor neuropático (en caso de existir) con gabapentina o pregabalina; suplementos nutricionales de forma individualizada.
B) Tratamiento dirigido
Debido a que el tratamiento de cada una de las amiloidosis es muy específico, la identificación precisa del tipo de amiloide es el primer paso importante, tanto para la elección de las terapias más efectivas como para evitar exposiciones a procedimientos innecesarios y/o iatrogénicos.
Algunos de los medicamentos que se proponen para modificar el curso de las amiloidosis están todavía siendo analizados en fases pre-clínicas o en ensayos clínicos, y otros muestran una eficacia dudosa, pero que ante la grave evolución de estas enfermedades se siguen proponiendo como terapia de uso compasivo, sobre todo en las afectaciones cardiacas o neurológicas con un peor pronóstico.
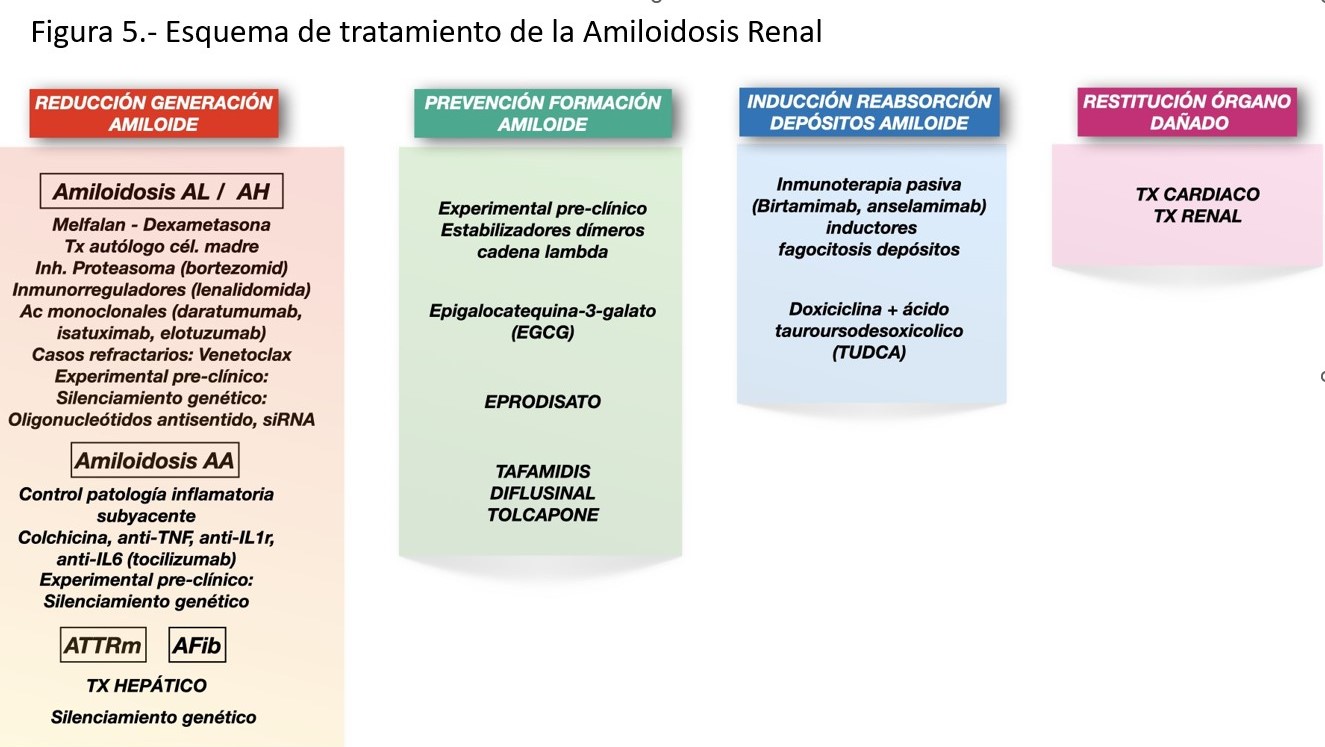
Con base en los mecanismos patogénicos de las amiloidosis, las estrategias actuales de tratamiento se pueden resumir en (Figura 5):
1. Disminuir producción proteína amiloidogénica y tóxicos pre-fibrilares.
2. Prevenir o dificultar la formación de amiloide.
3. Inducir la reabsorción del amiloide depositado.
4. Restablecer órganos dañados.
1. Disminuir producción proteína amiloidogénica y tóxicos pre-fibrilares
En las amiloidosis AL/AH el objetivo primario es la erradicación del clon celular productor de la proteína amiloidogénica [6][34]. El tratamiento convencional ha sido la quimioterapia (melfalan) y dexametasona a dosis altas [104][105], o melfalán a dosis mieloablativas seguido de trasplante autólogo de progenitores hematopoyéticos (TAPH) [106]. El TAPH conduce a una respuesta hematológica en el 40% de los pacientes y se estima que aquellos que logran una respuesta completa, incrementarían su supervivencia >15 años. Sin embargo, sólo entre el 10–20% de los pacientes con amiloidosis AL recién diagnosticada son candidatos al trasplante autólogo debido a factores como un estado funcional deficiente, disfunción orgánica avanzada y enfermedad multiorgánica [34]. Por otra parte, el panorama terapéutico en expansión es otro motivo del papel limitado del TAPH.
Actualmente se emplean esquemas terapéuticos que combinan inhibidores del proteasoma (bortezomid, ixazomid, carfilzomid) junto a ciclofosfamida y dexametasona (CyBorD) [6][107], inmunomoduladores como análogos talidomina (lenalidomida, pomalidomida) [108][109], aunque su uso se ve limitado por la tolerabilidad;, anticuerpos monoclonales frente antígenos de células plasmáticas CD38 como el daratumumab o el isatuximab [110][111][112][113] o frente SLAMF7 (CD319) como el elotuzumab [112][113]. En algunos casos refractarios a estos tratamientos se usa el inhibidor BCL-2, venetoclax, bendamustina, anticuerpos biespecíficos o incluso terapia de células T con receptores de antígeno quimérico (CAR-T) [113].
Si el tratamiento es capaz de reducir en >90% las cadenas ligeras séricas libres basales se consigue una estabilización de la función renal, incluso en pacientes con deterioro grave del filtrado glomerular [114].
En la amiloidosis AA, el control de la enfermedad inflamatoria, infecciosa o tumoral causante es fundamental para reducir la producción de proteína SAA [38,89]: corticoides, antibióticos, anti-TNF, colchicina y antagonista receptor IL-1 en las auto-inflamatorias hereditarias. Nuevas moléculas anti-inflamatorias como el anti-IL6 (tocilizumab) también han demostrado preservar de la función renal en amiloidosis AA asociada a artritis reumatoide, incluso sin que se consigan cambios significativos en la extensión del infiltrado renal [115,116].
En la amiloidosis por formas mutadas de ATTR, el único método efectivo para reducir la producción de esta proteína es el trasplante hepático [6,21]. Sin embargo, este reemplazo de órgano no impide que se siga produciendo ATTRm en plexo coroideos y retina que puede causar amiloidosis leptomeningea y vítrea [6][117].
El trasplante hepático también es el tratamiento para detener la producción de Afib (cadena A¿¿ fibrinógeno), y se suele recomendar junto con el trasplante renal para evitar la recurrencia de la enfermedad en el injerto renal [22][118][119].
A nivel experimental pre-clínico se está analizando la viabilidad de las técnicas de silenciamiento (knockdown) genético sobre las proteínas amiloidogénicas tanto AL, AA como ATTR [120][121][122][123][124]. Este método se realiza mediante oligonucleótidos antisentido [123][124] o con ARN pequeño de interferencia (small interfering RNA: siRNA) [120][121][122][123][124], interfiriendo en la expresión del gen objetivo.
2. Prevenir o dificultar la formación de amiloide
Las cadenas ligeras circulantes pueden estar en forma de dímeros o monómeros. Un exceso de estos últimos son los responsables de formar fibrillas amiloides. De este modo, la estabilización de los dímeros circulantes podría contribuir a evitar la formación de amiloide en los excesos de producción de cadenas ligeras en las amiloidosis AL.
Las investigaciones en curso [125] han descubierto que 2 sustancias: azul de metileno y sulfasalazina son capaces de estabilizar los dímeros de cadenas ligeras y, aunque están todavía lejos de poder ser utilizados en la práctica clínica, abre la vía de investigación sobre el futuro uso terapéutico de estas sustancias.
La molécula epigalocatequina-3-galato (EGCG) es una catequina polifenólica abundante en el té verde que es capaz de inhibir la formación de fibrillas de proteína ß amiloide y TTR [46][127], y de interactuar con cadenas ligeras kappa y lambda, transformándolas en estructuras no amiloides, con un efecto más intenso sobre las formas con dominio VL más amiloidogénicos o sobre las proteínas mutadas [128]. Hasta el momento se ha ensayado clínicamente el efecto de esta sustancia en 2 pequeños grupos de pacientes con cardiomiopatía amiloide ATTR, mostrando un efecto estabilizador sobre la evolución de la enfermedad [129][130].
El eprodisato es una molécula sulfonada con carga negativa de bajo peso molecular que estructuralmente es similar al heparan sulfato [131][132]. De forma competitiva se une a los lugares de enlace para glucosaminoglicanos de la proteína SAA, inhibiendo de esta forma la polimerización fibrilar y depósito de amiloide AA en modelos animales [131]. Farmacológicamente, tiene una buena biodisponibilidad cuando se administra por vía oral, no se une a proteínas, tiene una vida media plasmática entre 10-20 h, y no es tóxico ni teratogénico [132]. Ha sido ensayado clínicamente en amiloidosis renal, mostrando un efecto favorable en la preservación de función renal [133].
Algunos medicamentos como el tafamidis, diflunisal, tolcapone [6][8] tiene la capacidad de estabilizar la estructura tetramérica de la proteína TTR, impidiendo su descomposición en monómeros, haciéndola de esta forma menos amiloidogénica. Se han probado clínicamente en amiloidosis ATTR con resultados esperanzadores sobre la evolución de la polineuropatía y cardiomiopatía [6][8].
3. Inducir la reabsorción del amiloide depositado
En la amiloidosis AL se investiga la eficacia de anticuerpos antifibrilares con potencial de eliminar las fibrillas amiloides de los órganos al activar las células inmunitarias para su degradación química y enzimática, e inducir la fagocitosis dependiente de anticuerpos [134].
Birtamimab (NEOD0001) es un anticuerpo monoclonal completamente humanizado que se dirige a un epítopo oculto en la proteína amiloide sérica A, que se revela cuando está mal plegada. Este agente reacciona de manera cruzada con las fibrillas amiloides de cadenas ligeras de inmunoglobulina, activando la degradación y eliminación de las fibrillas de cadenas ligeras mediada por macrófagos [135].
El anticuerpo monoclonal IgG1, anselamimab (CAEL-101) es la forma quimérica del anticuerpo murino mAb 11-1F4, el cual se une a un neo-epítopo conformacional de cadenas ligeras mal plegadas, lo que desencadena la activación de los macrófagos. En un estudio de Fase Ia/b que incluyó a pacientes con amiloidosis AL en recaída o refractaria, se observó una respuesta temprana y sostenida en órganos en el 67% de los pacientes evaluables, lo que se asoció con una mejora significativa en la deformación longitudinal global de la fibra muscular cardiaca, mientras que los pacientes restantes mostraron una enfermedad cardíaca estable [136].
La doxiciclina es capaz de degradar los depósitos de amiloide ATTR en ratones [137]. Este antibiótico junto con el ácido tauro-urso-desoxicólico (TUDCA), un estabilizante de la proteína TTR, han sido ensayados terapéuticamente en la amiloidosis ATTR con resultados discretos sobre la estabilización del daño neuropático y cardiaco [138][139].
Una molécula perteneciente a la familia de las antraciclinas, la 4´yodo-4-desoxidoxorubicina, ha mostrado un efecto inductor de la reabsorción de amiloide interactuando con varios tipos de fibrillas e inhibiendo la conversión de proteínas nativas en amiloide [34][140]. Sin embargo, la toxicidad cardiaca intrínseca de esta molécula ha impedido su uso terapéutico, pero ha abierto líneas de investigación con el objetivo de modificar farmacológicamente la estructura de las proteínas amiloidogénicas para evitar su agregación y promover su reabsorción [141].
Por último, una estrategia de movilización y aclarado del amiloide ya depositado en tejidos es la de neutralizar o eliminar la proteína SAP, constituyente esencial de toda amiloidosis, que protege al amiloide de su degradación proteolítica e impide su reabsorción [142]. Para ello, ya se ha probado un tratamiento mixto que incluye la molécula miridesap (CPHPC), que reduce de forma muy eficiente el SAP circulante en plasma, asociado a un IgG1-antiSAP que se ocupa de neutralizar esta proteína ya depositada en el amiloide, activando complemento y fagocitosis que se encargan de aclarar los depósitos a través de células gigantes multi-nucleadas procedente de macrófagos. Los resultados de este ensayo clínico en fases iniciales mostraron una reducción significativa de la carga de amiloide en hígado, riñón y ganglios linfáticos [143]. Sin embargo, estudios clínicos de fase 2 posteriores en pacientes con amiloidosis cardíaca mostraron perfiles de beneficio-riesgo desfavorables (NCT03044353, NCT03417830), y el desarrollo de miridesap/dezamizumab para el tratamiento de la amiloidosis fue suspendido.
4. Restablecer órganos dañados
El deterioro de función renal en el momento del diagnóstico de las amiloidosis empeora notablemente la evolución y el pronóstico vital [89,144,145]. Incluso el desarrollo de fracaso renal agudo durante el tratamiento de la enfermedad de base, como en el caso del autotrasplante de TAPH, incrementa significativamente la mortalidad [146].
El trasplante renal ofrece una aceptable supervivencia en la amiloidosis AL, comparable por algunos investigadores con la de la nefropatía diabética [147], pero a expensas de una exhaustiva selección, entre las que se tienen en cuenta el control de la enfermedad de base, siendo importante una muy buena respuesta parcial o completa al tratamiento de la gammapatía monoclonal [147][148][149], y la ausencia de afectación amiloidea cardiaca [147].
En los pacientes con amiloidosis AA, la recurrencia en el trasplante renal se relaciona con los niveles de SAA y otros reactantes de fase, aunque no parece influir en la evolución [147], la cual es significativamente peor que la de otras etiologías de la enfermedad renal crónica [89][50].
En amiloidosis por formas mutadas de generación hepática como en la ATTR o la Afib, el trasplante hepático puede evitar las recurrencias en los injertos renales [21][118].
Referencias bibliográficas
1
.
Benson MD, Buxbaum JN, Eisenberg DS, Merlini G, Saraiva MJM, Sekijima Y el al. Amyloid nomenclature 2018: recommendations by the International Society of Amyloidosis (ISA) nomenclature committee. Amyloid. 2018; 25:215¿9
http://www.ncbi.nlm.nih.gov/pubmed/?term=2018%3B+25%3A215%E2%80%939
2
.
Merlini G, Bellotti V. Molecular mechanisms of amyloidosis. N Engl J Med. 2003; 349: 583¿96
http://www.ncbi.nlm.nih.gov/pubmed/?term=2003%3B+349%3A+583%E2%80%9396
3
.
Leung N, Nasr SH, Sethi S. How I treat amyloidosis: the importance of accurate diagnosis and amyloid typing. Blood. 2012; 120: 3206¿13
http://www.ncbi.nlm.nih.gov/pubmed/?term=2012%3B+120%3A+3206%E2%80%9313
4
.
Hazenberg BP. Amyloidosis: a clinical overview. Rheum Dis Clin North Am. 2013; 39: 323¿45
http://www.ncbi.nlm.nih.gov/pubmed/?term=2013%3B+39%3A+323%E2%80%9345
5
.
Wechalekar AD, Gillmore JD, Hawkins PN. Systemic amyloidosis. Lancet. 2016; 387: 2641¿54
http://www.ncbi.nlm.nih.gov/pubmed/?term=2016%3B+387%3A+2641%E2%80%9354
6
.
Nuvolone M, Merlini G. Systemic amyloidosis: novel therapies and role of biomarkers. Nephrol Dial Transplant. 2017;32: 770¿80
http://www.ncbi.nlm.nih.gov/pubmed/?term=2017%3B32%3A+770%E2%80%9380
7
.
Dogan A. Amyloidosis: Insights from Proteomics. Annu Rev Pathol. 2017; 12: 277¿304
http://www.ncbi.nlm.nih.gov/pubmed/?term=2017%3B+12%3A+277%E2%80%93304
8
.
Gertz MA, Dispenzieri A. Systemic Amyloidosis Recognition, Prognosis, and Therapy: A Systematic Review. JAMA. 2020; 324: 79¿89
http://www.ncbi.nlm.nih.gov/pubmed/?term=2020%3B+324%3A+79%E2%80%9389
9
.
Kyle, R.A. Amyloidosis: a convoluted story. Br. J. Haematol. 2001; 114: 529 38
http://www.ncbi.nlm.nih.gov/pubmed/?term=2001%3B+114%3A+529+38
10
.
Buxbaum JN, Dispenzieri A, Eisenberg DS, Fändrich M, Merlini G, Saraiva MJM et al. Amyloid nomenclature 2022: update, novel proteins, and recommendations by the International Society of Amyloidosis (ISA) Nomenclature Committee. Amyloid. 2022 Dec;29(4):213-219
http://www.ncbi.nlm.nih.gov/pubmed/?term=2022+Dec%3B29%284%29%3A213-219
11
.
Tirzaman O, Wahner-Roedler DL, Malek RS, Sebo TJ, Li CY, Kyle RA. Primary localized amyloidosis of the urinary bladder: a case series of 31 patients. Mayo Clin Proc. 2000; 75: 1264¿8
http://www.ncbi.nlm.nih.gov/pubmed/?term=2000%3B+75%3A+1264%E2%80%938
12
.
Merrimen JL, Alkhudair WK, Gupta R. Localized amyloidosis of the urinary tract: case series of nine patients. Urology. 2006; 67: 904¿9
http://www.ncbi.nlm.nih.gov/pubmed/?term=2006%3B+67%3A+904%E2%80%939
13
.
Bergesio F, Ciciani AM, Santostefano M, Brugnano R, Manganaro M, Palladini G et al. Immunopathology Group, Italian Society of Nephrology. Renal involvement in systemic amyloidosis¿an Italian retrospective study on epidemiological and clinical data at diagnosis. Nephrol Dial Transplant. 2007; 22: 1608¿18
http://www.ncbi.nlm.nih.gov/pubmed/?term=2007%3B+22%3A+1608%E2%80%9318
14
.
Said SM, Sethi S, Valeri AM, Leung N, Cornell LD, Fidler ME et al. Renal amyloidosis: origin and clinicopathologic correlations of 474 recent cases. Clin J Am Soc Nephrol. 2013; 8: 1515¿23
http://www.ncbi.nlm.nih.gov/pubmed/?term=2013%3B+8%3A+1515%E2%80%9323
15
.
Abe R, Katoh N, Takahashi Y, Takasone K, Yoshinaga T, Yazaki M et al. Distribution of amyloidosis subtypes based on tissue biopsy site - Consecutive analysis of 729 patients at a single amyloidosis center in Japan. Pathol Int. 2021; 71: 70¿9
http://www.ncbi.nlm.nih.gov/pubmed/?term=2021%3B+71%3A+70%E2%80%939
16
.
Benson MD, James S, Scott K, Liepnieks JJ, Kluve-Beckerman B. Leukocyte chemotactic factor 2: A novel renal amyloid protein. Kidney Int. 2008; 74: 218¿22
http://www.ncbi.nlm.nih.gov/pubmed/?term=2008%3B+74%3A+218%E2%80%9322
17
.
Said SM, Sethi S, Valeri AM, Chang A, Nast CC, Krahl L et al. Characterization and outcomes of renal leukocyte chemotactic factor 2-associated amyloidosis. Kidney Int. 2014; 86: 370¿7
http://www.ncbi.nlm.nih.gov/pubmed/?term=2014%3B+86%3A+370%E2%80%937
18
.
Larsen CP, Kossmann RJ, Beggs ML, Solomon A, Walker PD. Clinical, morphologic, and genetic features of renal leukocyte chemotactic factor 2 amyloidosis. Kidney Int. 2014; 86: 378¿82
http://www.ncbi.nlm.nih.gov/pubmed/?term=2014%3B+86%3A+378%E2%80%9382
19
.
Nasr SH, Dogan A, Larsen CP. Leukocyte Cell-Derived Chemotaxin 2-Associated Amyloidosis: A Recently Recognized Disease with Distinct Clinicopathologic Characteristics. Clin J Am Soc Nephrol. 2015; 10: 2084¿93
http://www.ncbi.nlm.nih.gov/pubmed/?term=2015%3B+10%3A+2084%E2%80%9393
20
.
Rezk T, Gilbertson JA, Rowczenio D, Bass P, Lachmann HJ, Wechalekar AD et al. Diagnosis, pathogenesis and outcome in leucocyte chemotactic factor 2 (ALECT2) amyloidosis. Nephrol Dial Transplant. 2018; 33: 241¿7
http://www.ncbi.nlm.nih.gov/pubmed/?term=2018%3B+33%3A+241%E2%80%937
21
.
Lobato L, Rocha A. Transthyretin amyloidosis and the kidney. Clin J Am Soc Nephrol. 2012; 7: 1337¿46
http://www.ncbi.nlm.nih.gov/pubmed/?term=2012%3B+7%3A+1337%E2%80%9346
22
.
Gillmore JD, Lachmann HJ, Rowczenio D, Gilbertson JA, Zeng CH, Liu ZH et al. Diagnosis, pathogenesis, treatment, and prognosis of hereditary fibrinogen A alpha-chain amyloidosis. J Am Soc Nephrol. 2009; 20: 444¿51
http://www.ncbi.nlm.nih.gov/pubmed/?term=2009%3B+20%3A+444%E2%80%9351
23
.
Picken MM, Linke RP. Nephrotic syndrome due to an amyloidogenic mutation in fibrinogen A alpha chain. J Am Soc Nephrol. 2009; 20: 1681¿5
http://www.ncbi.nlm.nih.gov/pubmed/?term=2009%3B+20%3A+1681%E2%80%935
24
.
Gregorini G, Izzi C, Ravani P, Obici L, Dallera N, Del Barba A et al. Tubulointerstitial nephritis is a dominant feature of hereditary apolipoprotein A-I amyloidosis. Kidney Int. 2015; 87: 1223¿9
http://www.ncbi.nlm.nih.gov/pubmed/?term=2015%3B+87%3A+1223%E2%80%939
25
.
Sethi S, Theis JD, Shiller SM, Nast CC, Harrison D, Rennke HG et al. Medullary amyloidosis associated with apolipoprotein A-IV deposition. Kidney Int. 2012; 81: 201¿6
http://www.ncbi.nlm.nih.gov/pubmed/?term=2012%3B+81%3A+201%E2%80%936
26
.
Nasr SH, Dasari S, Hasadsri L, Theis JD, Vrana JA, Gertz MA et al. Novel Type of Renal Amyloidosis Derived from Apolipoprotein-CII. J Am Soc Nephrol. 2017; 28: 439¿45
http://www.ncbi.nlm.nih.gov/pubmed/?term=2017%3B+28%3A+439%E2%80%9345
27
.
Das M, Gursky O. Amyloid-Forming Properties of Human Apolipoproteins: Sequence Analyses and Structural Insights. Adv Exp Med Biol. 2015; 855: 175-211
http://www.ncbi.nlm.nih.gov/pubmed/?term=2015%3B+855%3A+175-211
28
.
Valleix S, Verona G, Jourde-Chiche N, NÇdelec B, Mangione PP, Bridoux F et al. D25V apolipoprotein C-III variant causes dominant hereditary systemic amyloidosis and confers cardiovascular protective lipoprotein profile. Nat Commun. 2016; 7: 10353
http://www.ncbi.nlm.nih.gov/pubmed/?term=2016%3B+7%3A+10353
29
.
Gillmore JD, Booth DR, Madhoo S, Pepys MB, Hawkins PN. Hereditary renal amyloidosis associated with variant lysozyme in a large English family. Nephrol Dial Transplant. 1999; 14: 2639¿44
http://www.ncbi.nlm.nih.gov/pubmed/?term=1999%3B+14%3A+2639%E2%80%9344
30
.
Nasr SH, Dasari S, Mills JR, Theis JD, Zimmermann MT, Fonseca R et al. Hereditary Lysozyme Amyloidosis Variant p. Leu102Ser Associates with Unique Phenotype. J Am Soc Nephrol. 2017; 28: 431¿8
http://www.ncbi.nlm.nih.gov/pubmed/?term=2017%3B+28%3A+431%E2%80%938
31
.
Sethi S, Dasari S, Amin MS, Vrana JA, Theis JD, Alexander MP et al. Clinical, biopsy, and mass spectrometry findings of renal gelsolin amyloidosis. Kidney Int. 2017; 91: 964¿71
http://www.ncbi.nlm.nih.gov/pubmed/?term=2017%3B+91%3A+964%E2%80%9371
32
.
Basnayake K, Stringer SJ, Hutchison CA, Cockwell P. The biology of immunoglobulin free light chains and kidney injury. Kidney Int. 2011; 79: 1289¿301
http://www.ncbi.nlm.nih.gov/pubmed/?term=2011%3B+79%3A+1289%E2%80%93301
33
.
Karam S, Leung N. Renal involvement in systemic amyloidosis caused by monoclonal immunoglobulins. Hematol Oncol Clin North Am. 2020; 34: 1069¿79
http://www.ncbi.nlm.nih.gov/pubmed/?term=2020%3B+34%3A+1069%E2%80%9379
34
.
Rysavá R. AL amyloidosis: advances in diagnostics and treatment. Nephrol Dial Transplant. 2019; 34: 1460¿6
http://www.ncbi.nlm.nih.gov/pubmed/?term=2019%3B+34%3A+1460%E2%80%936
35
.
Nasr SH, Said SM, Valeri AM, Sethi S, Fidler ME, Cornell LD et al. The diagnosis and characteristics of renal heavy-chain and heavy/light-chain amyloidosis and their comparison with renal light-chain amyloidosis. Kidney Int. 2013; 83: 463¿70
http://www.ncbi.nlm.nih.gov/pubmed/?term=2013%3B+83%3A+463%E2%80%9370
36
.
Picken MM. Non-light-chain immunoglobulin amyloidosis: time to expand or refine the spectrum to include light+heavy chain amyloidosis? Kidney Int. 2013; 83: 353¿6
http://www.ncbi.nlm.nih.gov/pubmed/?term=2013%3B+83%3A+353%E2%80%936
37
.
Manabe S, Hatano M, Yazaki M, Nitta K, Nagata M. Renal AH Amyloidosis Associated With a Truncated Immunoglobulin Heavy Chain Undetectable by Immunostaining. Am J Kidney Dis. 2015; 66: 1095¿100
http://www.ncbi.nlm.nih.gov/pubmed/?term=2015%3B+66%3A+1095%E2%80%93100
38
.
Papa R, Lachmann HJ. Secondary, AA, Amyloidosis. Rheum Dis Clin North Am. 2018; 44: 585¿603
http://www.ncbi.nlm.nih.gov/pubmed/?term=2018%3B+44%3A+585%E2%80%93603
39
.
Keeling J, Teng J, Herrera GA. AL-amyloidosis and light-chain deposition disease light chains induce divergent phenotypic transformations of human mesangial cells. Lab Invest. 2004; 84: 1322¿38
http://www.ncbi.nlm.nih.gov/pubmed/?term=2004%3B+84%3A+1322%E2%80%9338
40
.
Herrera GA, Teng J, Turbat-Herrera EA, Zeng C, Del Pozo-Yauner L. Understanding Mesangial Pathobiology in AL-Amyloidosis and Monoclonal Ig Light Chain Deposition Disease. Kidney Int Rep. 2020; 5: 1870¿93
http://www.ncbi.nlm.nih.gov/pubmed/?term=2020%3B+5%3A+1870%E2%80%9393
41
.
Pilling D, Gomer RH. The Development of Serum Amyloid P as a Possible Therapeutic. Front Immunol. 2018; 9: 2328
http://www.ncbi.nlm.nih.gov/pubmed/?term=2018%3B+9%3A+2328
42
.
Gallo G, Wisniewski T, Choi-Miura NH, Ghiso J, Frangione B. Potential role of apolipoprotein-E in fibrillogenesis. Am J Pathol. 1994; 145: 526¿30
http://www.ncbi.nlm.nih.gov/pubmed/?term=1994%3B+145%3A+526%E2%80%9330
43
.
Kisilevsky R. The relation of proteoglycans, serum amyloid P and apo E to amyloidosis current status, 2000. Amyloid. 2000; 7: 23¿5
http://www.ncbi.nlm.nih.gov/pubmed/?term=2000%3B+7%3A+23%E2%80%935
44
.
Hirschfield GM. Amyloidosis: a clinico-pathophysiological synopsis. Semin Cell Dev Biol. 2004; 15: 39¿44
http://www.ncbi.nlm.nih.gov/pubmed/?term=2004%3B+15%3A+39%E2%80%9344
45
.
Kuroda T, Tanabe N, Kobayashi D, Wada Y, Murakami S, Nakano M et al. Significant association between renal function and amyloid-positive area in renal biopsy specimens in AL amyloidosis. BMC Nephrol. 2012; 13: 118
http://www.ncbi.nlm.nih.gov/pubmed/?term=2012%3B+13%3A+118
46
.
Sayed RH, Hawkins PN, Lachmann HJ. Emerging treatments for amyloidosis. Kidney Int. 2015; 87: 516¿26
http://www.ncbi.nlm.nih.gov/pubmed/?term=2015%3B+87%3A+516%E2%80%9326
47
.
Ronco P, Aucouturier P. Renal involvement in AL amyloidosis: the facts, the promise and the hope. Nephrol Dial Transplant. 2009; 24: 2967¿9
http://www.ncbi.nlm.nih.gov/pubmed/?term=2009%3B+24%3A+2967%E2%80%939
48
.
Watanabe T, Saniter T. Morphological and clinical features of renal amyloidosis. Virchows Arch. 1975; 366: 125¿35
http://www.ncbi.nlm.nih.gov/pubmed/?term=1975%3B+366%3A+125%E2%80%9335
49
.
Dikman SH, Churg J, Kahn T. Morphologic and clinical correlates in renal amyloidosis. Hum Pathol. 1981; 12: 160¿9
http://www.ncbi.nlm.nih.gov/pubmed/?term=1981%3B+12%3A+160%E2%80%939
50
.
Shiiki H, Shimokama T, Yoshikawa Y, Toyoshima H, Kitamoto T, Watanabe T. Renal amyloidosis: correlations between morphology, chemical types of amyloid protein and clinical features. Virchows Arch. 1988; 412: 197¿204
http://www.ncbi.nlm.nih.gov/pubmed/?term=1988%3B+412%3A+197%E2%80%93204
51
.
von Hutten H, Mihatsch M, Lobeck H, Rudolph B, Eriksson M, Rîcken C. Prevalence and origin of amyloid in kidney biopsies. Am J Surg Pathol. 2009; 33: 1198¿205
http://www.ncbi.nlm.nih.gov/pubmed/?term=2009%3B+33%3A+1198%E2%80%93205
52
.
Hopfer H, Wiech T, Mihatsch MJ. Renal amyloidosis revisited: amyloid distribution, dynamics and biochemical type. Nephrol Dial Transplant. 2011; 26: 2877¿84
http://www.ncbi.nlm.nih.gov/pubmed/?term=2011%3B+26%3A+2877%E2%80%9384
53
.
Sen S, Sarsik B. A proposed histopathologic classification, scoring, and grading system for renal amyloidosis: standardization of renal amyloid biopsy report. Arch Pathol Lab Med. 2010; 134: 532¿44
http://www.ncbi.nlm.nih.gov/pubmed/?term=2010%3B+134%3A+532%E2%80%9344
54
.
Nakamoto Y, Hamanaka S, Akihama T, Miura AB, Uesaka Y: Renal involvement patterns of amyloid nephropathy: A comparison with diabetic nephropathy. Clin Nephrol. 1984; 22: 188¿94
http://www.ncbi.nlm.nih.gov/pubmed/?term=1984%3B+22%3A+188%E2%80%9394
55
.
Yakupova EI, Bobyleva LG, Vikhlyantsev IM, Bobylev AG. Congo Red and amyloids: history and relationship. Biosci Rep. 2019; 39: BSR20181415
http://www.ncbi.nlm.nih.gov/pubmed/?term=2019%3B+39%3A+BSR20181415
56
.
Steensma DP. "Congo" red: out of Africa? Arch Pathol Lab Med. 2001; 125: 250¿2
http://www.ncbi.nlm.nih.gov/pubmed/?term=2001%3B+125%3A+250%E2%80%932
57
.
Nilsson KP, Ikenberg K, Aslund A, Fransson S, Konradsson P, Rîcken C et al. Structural typing of systemic amyloidoses by luminescent-conjugated polymer spectroscopy. Am J Pathol. 2010; 176: 563¿74
http://www.ncbi.nlm.nih.gov/pubmed/?term=2010%3B+176%3A+563%E2%80%9374
58
.
Sjölander D, Röcken C, Westermark P, Westermark GT, Nilsson KP, Hammarström P. Establishing the fluorescent amyloid ligand h-FTAA for studying human tissues with systemic and localized amyloid. Amyloid. 2016 ; 23: 98¿108
http://www.ncbi.nlm.nih.gov/pubmed/?term=2016+%3B+23%3A+98%E2%80%93108
59
.
Colombat M, Aldigier JC, Rothschild PR, Javaugue V, Desport E, Frouget T et al. New clinical forms of hereditary apoA-I amyloidosis entail both glomerular and retinal amyloidosis. Kidney Int. 2020; 98: 195¿208
http://www.ncbi.nlm.nih.gov/pubmed/?term=2020%3B+98%3A+195%E2%80%93208
60
.
Dasari S, Amin MS, Kurtin PJ, Vrana JA, Theis JD, Grogg KL et al. Clinical, biopsy, and mass spectrometry characteristics of renal apolipoprotein A-IV amyloidosis. Kidney Int. 2016; 90: 658¿64
http://www.ncbi.nlm.nih.gov/pubmed/?term=2016%3B+90%3A+658%E2%80%9364
61
.
Markowitz GS. Dysproteinemia and the kidney. Adv Anat Pathol. 2004; 11: 49¿63
http://www.ncbi.nlm.nih.gov/pubmed/?term=2004%3B+11%3A+49%E2%80%9363
62
.
Dember LM. Amyloidosis-associated kidney disease. J Am Soc Nephrol. 2006; 17: 3458¿71
http://www.ncbi.nlm.nih.gov/pubmed/?term=2006%3B+17%3A+3458%E2%80%9371
63
.
Herrera GA, Turbat-Herrera EA. Renal diseases with organized deposits: an algorithmic approach to classification and clinicopathologic diagnosis. Arch Pathol Lab Med. 2010; 134: 512¿31
http://www.ncbi.nlm.nih.gov/pubmed/?term=2010%3B+134%3A+512%E2%80%9331
64
.
van Rijswijk MH, van Heusden CW. The potassium permanganate method. A reliable method for differentiating amyloid AA from other forms of amyloid in routine laboratory practice. Am J Pathol. 1979; 97: 43¿58
http://www.ncbi.nlm.nih.gov/pubmed/?term=1979%3B+97%3A+43%E2%80%9358
65
.
Janssen S, Elema JD, van Rijswijk MH, Limburg PC, Meijer S, Mandema E. Classification of amyloidosis: immunohistochemistry versus the potassium permanganate method in differentiating AA from AL amyloidosis. Appl Pathol. 1985;3: 29¿38
http://www.ncbi.nlm.nih.gov/pubmed/?term=1985%3B3%3A+29%E2%80%9338
66
.
Herrera GA, Paul R, Turbat-Herrera EA, Work J, Viale G, dell''''Orto P et al. Ultrastructural immunolabeling in the diagnosis of light-chain-related renal disease. Pathol Immunopathol Res. 1986; 5: 170¿87
http://www.ncbi.nlm.nih.gov/pubmed/?term=1986%3B+5%3A+170%E2%80%9387
67
.
Veeramachaneni R, Gu X, Herrera GA. Atypical amyloidosis: diagnosis and challenges and the role of immunoelectron microscopy in diagnosis. Ultrastruct Pathol. 2004;28: 75¿82
http://www.ncbi.nlm.nih.gov/pubmed/?term=2004%3B28%3A+75%E2%80%9382
68
.
Sethi S, Vrana JA, Theis JD, Leung N, Sethi A, Nasr SH et al. Laser microdissection and mass spectrometry-based proteomics aids the diagnosis and typing of renal amyloidosis. Kidney Int. 2012; 82: 226¿34
http://www.ncbi.nlm.nih.gov/pubmed/?term=2012%3B+82%3A+226%E2%80%9334
69
.
Owen-Casey MP, Sim R, Cook HT, Roufosse CA, Gillmore JD, Gilbertson JA et al. Value of antibodies to free light chains in immunoperoxidase studies of renal biopsies. J Clin Pathol. 2014; 67: 661¿6
http://www.ncbi.nlm.nih.gov/pubmed/?term=2014%3B+67%3A+661%E2%80%936
70
.
Gonzalez Suarez ML, Zhang P, Nasr SH, Sathick IJ, Kittanamongkolchai W, Kurtin PJ et al. The sensitivity and specificity of the routine kidney biopsy immunofluorescence panel are inferior to diagnosing renal immunoglobulin-derived amyloidosis by mass spectrometry. Kidney Int. 2019; 96: 1005¿9
http://www.ncbi.nlm.nih.gov/pubmed/?term=2019%3B+96%3A+1005%E2%80%939
71
.
Wisniowski B, Wechalekar A. Confirming the Diagnosis of Amyloidosis. Acta Haematol. 2020; 143: 312¿21
http://www.ncbi.nlm.nih.gov/pubmed/?term=2020%3B+143%3A+312%E2%80%9321
72
.
Kebbel A, Rîcken C. Immunohistochemical classification of amyloid in surgical pathology revisited. Am J Surg Pathol. 2006; 30: 673¿83
http://www.ncbi.nlm.nih.gov/pubmed/?term=2006%3B+30%3A+673%E2%80%9383
73
.
Picken MM. Amyloidosis-where are we now and where are we heading? Arch Pathol Lab Med. 2010; 134: 545¿51
http://www.ncbi.nlm.nih.gov/pubmed/?term=2010%3B+134%3A+545%E2%80%9351
74
.
Murphy CL, Wang S, Williams T, Weiss DT, Solomon A. Characterization of systemic amyloid deposits by mass spectrometry. Methods Enzymol. 2006; 412: 48¿62
http://www.ncbi.nlm.nih.gov/pubmed/?term=2006%3B+412%3A+48%E2%80%9362
75
.
Brambilla F, Lavatelli F, Di Silvestre D, Valentini V, Rossi R, Palladini G et al. Reliable typing of systemic amyloidoses through proteomic analysis of subcutaneous adipose tissue. Blood. 2012; 119: 1844¿7
http://www.ncbi.nlm.nih.gov/pubmed/?term=2012%3B+119%3A+1844%E2%80%937
76
.
Casadonte R, Kriegsmann M, Deininger SO, Amann K, Paape R, Belau E et al. Imaging mass spectrometry analysis of renal amyloidosis biopsies reveals protein co-localization with amyloid deposits. Anal Bioanal Chem. 2015; 407: 5323¿31
http://www.ncbi.nlm.nih.gov/pubmed/?term=2015%3B+407%3A+5323%E2%80%9331
77
.
Gilbertson JA, Theis JD, Vrana JA, Lachmann H, Wechalekar A, Whelan C et al. A comparison of immunohistochemistry and mass spectrometry for determining the amyloid fibril protein from formalin-fixed biopsy tissue. J Clin Pathol. 2015; 68: 314¿7
http://www.ncbi.nlm.nih.gov/pubmed/?term=2015%3B+68%3A+314%E2%80%937
78
.
Picken MM. Proteomics and mass spectrometry in the diagnosis of renal amyloidosis. Clin Kidney J. 2015; 8: 665¿72
http://www.ncbi.nlm.nih.gov/pubmed/?term=2015%3B+8%3A+665%E2%80%9372
79
.
Winter M, Tholey A, Krüger S, Schmidt H, Röcken C. MALDI-mass spectrometry imaging identifies vitronectin as a common constituent of amyloid deposits. J Histochem Cytochem. 2015; 63: 772¿9
http://www.ncbi.nlm.nih.gov/pubmed/?term=2015%3B+63%3A+772%E2%80%939
80
.
Ogawa M, Shintani-Domoto Y, Nagashima Y, Ode KL, Sato A, Shimizu Y et al. Mass spectrometry-based absolute quantification of amyloid proteins in pathology tissue specimens: Merits and limitations. PLoS One. 2020; 15: e0235143
http://www.ncbi.nlm.nih.gov/pubmed/?term=2020%3B+15%3A+e0235143
81
.
Rinschen MM, Saez-Rodriguez J. The tissue proteome in the multi-omic landscape of kidney disease. Nat Rev Nephrol. 2021; 17: 205¿19
http://www.ncbi.nlm.nih.gov/pubmed/?term=2021%3B+17%3A+205%E2%80%9319
82
.
Kyle RA, Linos A, Beard CM, Linke RP, Gertz MA, O''''Fallon WM et al. Incidence and natural history of primary systemic amyloidosis in Olmsted County, Minnesota, 1950 through 1989. Blood. 1992; 79: 1817¿22
http://www.ncbi.nlm.nih.gov/pubmed/?term=1992%3B+79%3A+1817%E2%80%9322
83
.
Panizo N, Rivera F, López-Gómez JM; Spanish Registry of Glomerulonephritis. Decreasing incidence of AA amyloidosis in Spain. Eur J Clin Invest. 2013;43: 767¿73
http://www.ncbi.nlm.nih.gov/pubmed/?term=2013%3B43%3A+767%E2%80%9373
84
.
Hemminki K, Li X, Försti A, Sundquist J, Sundquist K. Incidence and survival in non-hereditary amyloidosis in Sweden. BMC Public Health. 2012; 12: 974
http://www.ncbi.nlm.nih.gov/pubmed/?term=2012%3B+12%3A+974
85
.
Janssen S, Van Rijswijk MH, Meijer S, Ruinen L, Van der Hem GK. Systemic amyloidosis: a clinical survey of 144 cases. Neth J Med. 1986; 29: 376¿85
http://www.ncbi.nlm.nih.gov/pubmed/?term=1986%3B+29%3A+376%E2%80%9385
86
.
Pinney JH, Smith CJ, Taube JB, Lachmann HJ, Venner CP, Gibbs SD et al. Systemic amyloidosis in England: an epidemiological study. Br J Haematol. 2013; 161: 525¿32
http://www.ncbi.nlm.nih.gov/pubmed/?term=2013%3B+161%3A+525%E2%80%9332
87
.
Quock TP, Yan T, Chang E, Guthrie S, Broder MS. Epidemiology of AL amyloidosis: a real-world study using US claims data. Blood Adv. 2018; 2: 1046¿53
http://www.ncbi.nlm.nih.gov/pubmed/?term=2018%3B+2%3A+1046%E2%80%9353
88
.
Lin HM, Gao X, Cooke CE, Berg D, Labotka R, Faller DV et al. Disease burden of systemic light-chain amyloidosis: a systematic literature review. Curr Med Res Opin. 2017; 33: 1017¿31
http://www.ncbi.nlm.nih.gov/pubmed/?term=2017%3B+33%3A+1017%E2%80%9331
89
.
Lachmann HJ, Goodman HJ, Gilbertson JA, Gallimore JR, Sabin CA, Gillmore JD et al. Natural history and outcome in systemic AA amyloidosis. N Engl J Med. 2007; 356: 2361¿71
http://www.ncbi.nlm.nih.gov/pubmed/?term=2007%3B+356%3A+2361%E2%80%9371
90
.
Tang W, McDonald SP, Hawley CM, Badve SV, Boudville N, Brown FG et al. End-stage renal failure due to amyloidosis: outcomes in 490 ANZDATA registry cases. Nephrol Dial Transplant. 2013; 28: 455¿61
http://www.ncbi.nlm.nih.gov/pubmed/?term=2013%3B+28%3A+455%E2%80%9361
91
.
Palladini G, Hegenbart U, Milani P, Kimmich C, Foli A, Ho AD et al. A staging system for renal outcome and early markers of renal response to chemotherapy in AL amyloidosis. Blood. 2014; 124: 2325¿32
http://www.ncbi.nlm.nih.gov/pubmed/?term=2014%3B+124%3A+2325%E2%80%9332
92
.
Nagai H, Hamada T, Uchida T, Yamagoe S, Suzuki K. Systemic expression of a newly recognized protein, LECT2, in the human body. Pathol Int. 1998; 48: 882¿6
http://www.ncbi.nlm.nih.gov/pubmed/?term=1998%3B+48%3A+882%E2%80%936
93
.
Ha JH, Tu HC, Wilkens S, Loh SN. Loss of bound zinc facilitates amyloid fibril formation of leukocyte cell-derived chemotaxin 2 (LECT2). J Biol Chem. 2021;296: 100446
http://www.ncbi.nlm.nih.gov/pubmed/?term=2021%3B296%3A+100446
94
.
Hutton HL, DeMarco ML, Magil AB, Taylor P. Renal leukocyte chemotactic factor 2 (LECT2) amyloidosis in First Nations people in Northern British Columbia, Canada: a report of 4 cases. Am J Kidney Dis. 2014; 64: 790¿2
http://www.ncbi.nlm.nih.gov/pubmed/?term=2014%3B+64%3A+790%E2%80%932
95
.
Goodman DS. Retinol-binding protein, prealbumin, and vitamin A transport. Prog Clin Biol Res. 1976; 5: 313¿30
http://www.ncbi.nlm.nih.gov/pubmed/?term=1976%3B+5%3A+313%E2%80%9330
96
.
Wen D, Corina K, Chow EP, Miller S, Janmey PA, Pepinsky RB. The plasma and cytoplasmic forms of human gelsolin differ in disulfide structure. Biochemistry. 1996; 35: 9700¿9
http://www.ncbi.nlm.nih.gov/pubmed/?term=1996%3B+35%3A+9700%E2%80%939
97
.
Ahmad M, Esposto J, Golec C, Wu C, Martic-Milne S. Aggregation of gelsolin wild-type and G167K/R, N184K, and D187N/Y mutant peptides and inhibition. Mol Cell Biochem. 2021 Online ahead of print
http://www.ncbi.nlm.nih.gov/pubmed/?term=2021+Online+ahead+of+print
98
.
Granel B, Serratrice J, Valleix S, Grateau G, Droz D, Lafon J et al. A family with gastrointestinal amyloidosis associated with variant lysozyme. Gastroenterology. 2002; 123: 1346¿9
http://www.ncbi.nlm.nih.gov/pubmed/?term=2002%3B+123%3A+1346%E2%80%939
99
.
Granel B, Valleix S, Serratrice J, Chérin P, Texeira A, Disdier P et al. Lysozyme amyloidosis: report of 4 cases and a review of the literature. Medicine (Baltimore). 2006; 85: 66¿73
http://www.ncbi.nlm.nih.gov/pubmed/?term=2006%3B+85%3A+66%E2%80%9373
100
.
Leung N, Bridoux F, Batuman V, Chaidos A, Cockwell P, D''''Agati VD et al. The evaluation of monoclonal gammopathy of renal significance: a consensus report of the International Kidney and Monoclonal Gammopathy Research Group. Nat Rev Nephrol. 2019; 15: 45¿9
http://www.ncbi.nlm.nih.gov/pubmed/?term=2019%3B+15%3A+45%E2%80%939
101
.
Hogan JJ, Mocanu M, Berns JS. The Native Kidney Biopsy: Update and Evidence for Best Practice. Clin J Am Soc Nephrol. 2016; 11: 354¿62
http://www.ncbi.nlm.nih.gov/pubmed/?term=2016%3B+11%3A+354%E2%80%9362
102
.
Soares SM, Fervenza FC, Lager DJ, Gertz MA, Cosio FG, Leung N. Bleeding complications after transcutaneous kidney biopsy in patients with systemic amyloidosis: single-center experience in 101 patients. Am J Kidney Dis. 2008; 52: 1079¿83
http://www.ncbi.nlm.nih.gov/pubmed/?term=2008%3B+52%3A+1079%E2%80%9383
103
.
Halimi JM, Gatault P, Longuet H, Barbet C, Bisson A, Sautenet B et al. Major Bleeding and Risk of Death after Percutaneous Native Kidney Biopsies: A French Nationwide Cohort Study. Clin J Am Soc Nephrol. 2020; 15: 1587¿94
http://www.ncbi.nlm.nih.gov/pubmed/?term=2020%3B+15%3A+1587%E2%80%9394
104
.
Kyle RA, Gertz MA, Greipp PR, Witzig TE, Lust JA, Lacy MQ et al. A trial of three regimens for primary amyloidosis: colchicine alone, melphalan and prednisone, and melphalan, prednisone, and colchicine. N Engl J Med. 1997; 336: 1202¿7
http://www.ncbi.nlm.nih.gov/pubmed/?term=1997%3B+336%3A+1202%E2%80%937
105
.
Palladini G, Perfetti V, Obici L, Caccialanza R, Semino A, Adami F et al. Association of melphalan and high-dose dexamethasone is effective and well tolerated in patients with AL (primary) amyloidosis who are ineligible for stem cell transplantation. Blood. 2004; 103: 2936¿8
http://www.ncbi.nlm.nih.gov/pubmed/?term=2004%3B+103%3A+2936%E2%80%938
106
.
Cibeira MT, Sanchorawala V, Seldin DC, Quillen K, Berk JL, Dember LM et al. Outcome of AL amyloidosis after high-dose melphalan and autologous stem cell transplantation: long-term results in a series of 421 patients. Blood. 2011; 118: 4346¿52
http://www.ncbi.nlm.nih.gov/pubmed/?term=2011%3B+118%3A+4346%E2%80%9352
107
.
Venner CP, Lane T, Foard D, Rannigan L, Gibbs SD, Pinney JH et al. Cyclophosphamide, bortezomib, and dexamethasone therapy in AL amyloidosis is associated with high clonal response rates and prolonged progression-free survival. Blood. 2012; 119: 4387¿90
http://www.ncbi.nlm.nih.gov/pubmed/?term=2012%3B+119%3A+4387%E2%80%9390
108
.
Dispenzieri A, Lacy MQ, Zeldenrust SR, Hayman SR, Kumar SK, Geyer SM et al. The activity of lenalidomide with or without dexamethasone in patients with primary systemic amyloidosis. Blood. 2007; 109: 465¿70
http://www.ncbi.nlm.nih.gov/pubmed/?term=2007%3B+109%3A+465%E2%80%9370
109
.
Dispenzieri A, Buadi F, Laumann K, LaPlant B, Hayman SR, Kumar SK et al. Activity of pomalidomide in patients with immunoglobulin light-chain amyloidosis. Blood. 2012; 119: 5397¿404
http://www.ncbi.nlm.nih.gov/pubmed/?term=2012%3B+119%3A+5397%E2%80%93404
110
.
Khouri J, Kin A, Thapa B, Reu FJ, Bumma N, Samaras CJ et al. Daratumumab proves safe and highly effective in AL amyloidosis. Br J Haematol. 2019; 185: 342¿44
http://www.ncbi.nlm.nih.gov/pubmed/?term=2019%3B+185%3A+342%E2%80%9344
111
.
Sidiqi MH, Gertz MA. Daratumumab for the treatment of AL amyloidosis. Leuk Lymphoma. 2019; 60: 295¿301
http://www.ncbi.nlm.nih.gov/pubmed/?term=2019%3B+60%3A+295%E2%80%93301
112
.
Popkova T, Hajek R, Jelinek T. Monoclonal antibodies in the treatment of AL amyloidosis: co-targetting the plasma cell clone and amyloid deposits. Br J Haematol. 2020; 189: 228¿38
http://www.ncbi.nlm.nih.gov/pubmed/?term=2020%3B+189%3A+228%E2%80%9338
113
.
Sanchorawala V. Systemic Light Chain Amyloidosis. N Engl J Med. 2024 Jun 27;390: 2295-307
http://www.ncbi.nlm.nih.gov/pubmed/?term=2024+Jun+27%3B390%3A+2295-307
114
.
Rezk T, Lachmann HJ, Fontana M, Sachchithanantham S, Mahmood S, Petrie A et al. Prolonged renal survival in light chain amyloidosis: speed and magnitude of light chain reduction is the crucial factor. Kidney Int. 2017; 92: 1476¿83
http://www.ncbi.nlm.nih.gov/pubmed/?term=2017%3B+92%3A+1476%E2%80%9383
115
.
Yamagata A, Uchida T, Yamada Y, Nakanishi T, Nagai K, Imakiire T et al. Rapid clinical improvement of amyloid A amyloidosis following treatment with tocilizumab despite persisting amyloid deposition: a case report. BMC Nephrol. 2017; 18: 377
http://www.ncbi.nlm.nih.gov/pubmed/?term=2017%3B+18%3A+377
116
.
Fukuda M, Sawa N, Hoshino J, Ohashi K, Motoaki M, Ubara Y. Tocilizumab preserves renal function in rheumatoid arthritis with AA amyloidosis and end-stage kidney disease: Two case reports. Clin Nephrol. 2021; 95: 54¿61
http://www.ncbi.nlm.nih.gov/pubmed/?term=2021%3B+95%3A+54%E2%80%9361
117
.
Beirao JM, Malheiro J, Lemos C, Matos E, Beirao I, Pinho-Costa P et al. Impact of liver transplantation on the natural history of oculopathy in Portuguese patients with transthyretin (V30M) amyloidosis. Amyloid. 2015; 22: 31¿5
http://www.ncbi.nlm.nih.gov/pubmed/?term=2015%3B+22%3A+31%E2%80%935
118
.
Gillmore JD, Booth DR, Rela M, Heaton ND, Rahman V, Stangou AJ et al. Curative hepatorenal transplantation in systemic amyloidosis caused by the Glu526Val fibrinogen alpha-chain variant in an English family. QJM. 2000; 93: 269¿75
http://www.ncbi.nlm.nih.gov/pubmed/?term=2000%3B+93%3A+269%E2%80%9375
119
.
Tennent GA, Brennan SO, Stangou AJ, O''''Grady J, Hawkins PN, Pepys MB. Human plasma fibrinogen is synthesized in the liver. Blood. 2007; 109: 1971¿4
http://www.ncbi.nlm.nih.gov/pubmed/?term=2007%3B+109%3A+1971%E2%80%934
120
.
Pinney JH, Hawkins PN. Amyloidosis. Ann Clin Biochem. 2012; 49: 229¿41
http://www.ncbi.nlm.nih.gov/pubmed/?term=2012%3B+49%3A+229%E2%80%9341
121
.
Zhou P, Ma X, Iyer L, Chaulagain C, Comenzo RL. One siRNA pool targeting the constant region stops light-chain production and causes terminal endoplasmic reticulum stress. Blood. 2014; 123: 3440¿51
http://www.ncbi.nlm.nih.gov/pubmed/?term=2014%3B+123%3A+3440%E2%80%9351
122
.
Hovey BM, Ward JE, Soo Hoo P, O''''Hara CJ, Connors LH, Seldin DC. Preclinical development of siRNA therapeutics for AL amyloidosis. Gene Ther. 2011; 18: 1150¿6
http://www.ncbi.nlm.nih.gov/pubmed/?term=2011%3B+18%3A+1150%E2%80%936
123
.
Titze-de-Almeida SS, Brandao PRP, Faber I, Titze-de-Almeida R. Leading RNA Interference Therapeutics Part 1: Silencing Hereditary Transthyretin Amyloidosis, with a Focus on Patisiran. Mol Diagn Ther. 2020; 24: 49¿59
http://www.ncbi.nlm.nih.gov/pubmed/?term=2020%3B+24%3A+49%E2%80%9359
124
.
Bezerra F, Saraiva MJ, Almeida MR. Modulation of the Mechanisms Driving Transthyretin Amyloidosis. Front Mol Neurosci. 2020; 13: 592644
http://www.ncbi.nlm.nih.gov/pubmed/?term=2020%3B+13%3A+592644
125
.
Ohno S, Yoshimoto M, Honda S, Miyachi S, Ishida T, Itoh F et al. The antisense approach in amyloid light chain amyloidosis: identification of monoclonal Ig and inhibition of its production by antisense oligonucleotides in in vitro and in vivo models. J Immunol. 2002; 169: 4039¿45
http://www.ncbi.nlm.nih.gov/pubmed/?term=2002%3B+169%3A+4039%E2%80%9345
126
.
Brumshtein B, Esswein SR, Salwinski L, Phillips ML, Ly AT, Cascio D et al. Inhibition by small-molecule ligands of formation of amyloid fibrils of an immunoglobulin light chain variable domain. Elife. 2015; 4: e10935
http://www.ncbi.nlm.nih.gov/pubmed/?term=2015%3B+4%3A+e10935
127
.
Ehrnhoefer DE, Bieschke J, Boeddrich A, Herbst M, Masino L, Lurz R et al. EGCG redirects amyloidogenic polypeptides into unstructured, off-pathway oligomers. Nat Struct Mol Biol. 2008; 15: 558¿66
http://www.ncbi.nlm.nih.gov/pubmed/?term=2008%3B+15%3A+558%E2%80%9366
128
.
Hora M, Carballo-Pacheco M, Weber B, Morris VK, Wittkopf A, Buchner J et al. Epigallocatechin-3-gallate preferentially induces aggregation of amyloidogenic immunoglobulin light chains. Sci Rep. 2017; 7: 41515
http://www.ncbi.nlm.nih.gov/pubmed/?term=2017%3B+7%3A+41515
129
.
Kristen AV, Lehrke S, Buss S, Mereles D, Steen H, Ehlermann P et al. Green tea halts progression of cardiac transthyretin amyloidosis: an observational report. Clin Res Cardiol. 2012; 101: 805¿13
http://www.ncbi.nlm.nih.gov/pubmed/?term=2012%3B+101%3A+805%E2%80%9313
130
.
aus dem Siepen F, Bauer R, Aurich M, Buss SJ, Steen H, Altland K et al. Green tea extract as a treatment for patients with wild-type transthyretin amyloidosis: an observational study. Drug Des Devel Ther. 2015; 9: 6319¿25
http://www.ncbi.nlm.nih.gov/pubmed/?term=2015%3B+9%3A+6319%E2%80%9325
131
.
Kisilevsky R, Lemieux LJ, Fraser PE, Kong X, Hultin PG, Szarek WA. Arresting amyloidosis in vivo using small-molecule anionic sulphonates or sulphates: implications for Alzheimer''''s disease. Nat Med. 1995; 1: 143¿8
http://www.ncbi.nlm.nih.gov/pubmed/?term=1995%3B+1%3A+143%E2%80%938
132
.
Rumjon A, Coats T, Javaid MM. Review of eprodisate for the treatment of renal disease in AA amyloidosis. Int J Nephrol Renovasc Dis. 2012; 5: 37¿43
http://www.ncbi.nlm.nih.gov/pubmed/?term=2012%3B+5%3A+37%E2%80%9343
133
.
Dember LM, Hawkins PN, Hazenberg BP, Gorevic PD, Merlini G, Butrimiene I et al. Eprodisate for AA Amyloidosis Trial Group. Eprodisate for the treatment of renal disease in AA amyloidosis. N Engl J Med. 2007; 356: 2349¿60
http://www.ncbi.nlm.nih.gov/pubmed/?term=2007%3B+356%3A+2349%E2%80%9360
134
.
Nuvolone M, Nevone A, Merlini G. Targeting Amyloid Fibrils by Passive Immunotherapy in Systemic Amyloidosis. BioDrugs. 2022; 36: 591-608.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2022%3B+36%3A+591-608
135
.
Gertz MA, Cohen AD, Comenzo RL, Kastritis E, Landau HJ, Libby EN et al. Birtamimab plus standard of care in light-chain amyloidosis: the phase 3 randomized placebo-controlled VITAL trial. Blood. 2023 Oct 5;142(14):1208-1218.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2023+Oct+5%3B142%2814%29%3A1208-1218
136
.
Edwards CV, Rao N, Bhutani Det al.. Phase 1a/b study of monoclonal antibody CAEL-101 (11-1F4) in patients with AL amyloidosis. Blood 2021;138:2632¿2641
http://www.ncbi.nlm.nih.gov/pubmed/?term=Blood+2021%3B138%3A2632%E2%80%932641
137
.
Cardoso I, Saraiva MJ. Doxycycline disrupts transthyretin amyloid: evidence from studies in a FAP transgenic mice model. FASEB J. 2006; 20: 234¿9
http://www.ncbi.nlm.nih.gov/pubmed/?term=2006%3B+20%3A+234%E2%80%939
138
.
Obici L, Cortese A, Lozza A, Lucchetti J, Gobbi M, Palladini G et al. Doxycycline plus tauroursodeoxycholic acid for transthyretin amyloidosis: a phase II study. Amyloid. 2012; 19 Suppl 1: 34¿6
http://www.ncbi.nlm.nih.gov/pubmed/?term=2012%3B+19+Suppl+1%3A+34%E2%80%936
139
.
Wixner J, Pilebro B, Lundgren HE, Olsson M, Anan I. Effect of doxycycline and ursodeoxycholic acid on transthyretin amyloidosis. Amyloid. 2017; 24: 78¿9
http://www.ncbi.nlm.nih.gov/pubmed/?term=2017%3B+24%3A+78%E2%80%939
140
.
Merlini G, Ascari E, Amboldi N, Bellotti V, Arbustini E, Perfetti V et al. Interaction of the anthracycline 4''''-iodo-4''''-deoxydoxorubicin with amyloid fibrils: inhibition of amyloidogenesis. Proc Natl Acad Sci U S A. 1995; 92: 2959¿63
http://www.ncbi.nlm.nih.gov/pubmed/?term=1995%3B+92%3A+2959%E2%80%9363
141
.
Giorgetti S, Greco C, Tortora P, Aprile FA. Targeting Amyloid Aggregation: An Overview of Strategies and Mechanisms. Int J Mol Sci. 2018; 19: 2677
http://www.ncbi.nlm.nih.gov/pubmed/?term=2018%3B+19%3A+2677
142
.
Merlini G. Reducing the amyloid burden through immunotherapy: a major therapeutic advance. Nephrol Dial Transplant. 2011; 26: 1471¿3
http://www.ncbi.nlm.nih.gov/pubmed/?term=2011%3B+26%3A+1471%E2%80%933
143
.
Richards DB, Cookson LM, Berges AC, Barton SV, Lane T, Ritter JM et al. Therapeutic Clearance of Amyloid by Antibodies to Serum Amyloid P Component. N Engl J Med. 2015; 373: 1106¿14
http://www.ncbi.nlm.nih.gov/pubmed/?term=2015%3B+373%3A+1106%E2%80%9314
144
.
Bollée G, Guery B, Joly D, Snanoudj R, Terrier B, Allouache M et al. Presentation and outcome of patients with systemic amyloidosis undergoing dialysis. Clin J Am Soc Nephrol. 2008; 3: 375¿81
http://www.ncbi.nlm.nih.gov/pubmed/?term=2008%3B+3%3A+375%E2%80%9381
145
.
Gertz MA, Leung N, Lacy MQ, Dispenzieri A, Zeldenrust SR, Hayman SR et al. Clinical outcome of immunoglobulin light chain amyloidosis affecting the kidney. Nephrol Dial Transplant. 2009; 24: 3132¿7
http://www.ncbi.nlm.nih.gov/pubmed/?term=2009%3B+24%3A+3132%E2%80%937
146
.
Leung N, Kumar SK, Glavey SV, Dispenzieri A, Lacy MQ, Buadi FK et al. The impact of dialysis on the survival of patients with immunoglobulin light chain (AL) amyloidosis undergoing autologous stem cell transplantation. Nephrol Dial Transplant. 2016; 31: 1284¿9
http://www.ncbi.nlm.nih.gov/pubmed/?term=2016%3B+31%3A+1284%E2%80%939
147
.
Law S, Cohen O, Lachmann HJ, Rezk T, Gilbertson JA, Rowczenio D et al. Renal transplant outcomes in amyloidosis. Nephrol Dial Transplant. 2021; 36: 355¿65
http://www.ncbi.nlm.nih.gov/pubmed/?term=2021%3B+36%3A+355%E2%80%9365
148
.
Angel-Korman A, Stern L, Sarosiek S, Sloan JM, Doros G, Sanchorawala V et al. Long-term outcome of kidney transplantation in AL amyloidosis. Kidney Int. 2019; 95: 405¿11
http://www.ncbi.nlm.nih.gov/pubmed/?term=2019%3B+95%3A+405%E2%80%9311
149
.
Heybeli C, Bentall A, Wen J, Alexander MP, Buadi FK, Cosio FG et al. A study from The Mayo Clinic evaluated long-term outcomes of kidney transplantation in patients with immunoglobulin light chain amyloidosis. Kidney Int. 2021; 99: 707¿15
http://www.ncbi.nlm.nih.gov/pubmed/?term=2021%3B+99%3A+707%E2%80%9315
150
.
Sarihan I, Caliskan Y, Mirioglu S, Ozluk Y, Senates B, Seyahi N et al. Amyloid A Amyloidosis After Renal Transplantation: An Important Cause of Mortality. Transplantation. 2020; 104: 1703¿11
http://www.ncbi.nlm.nih.gov/pubmed/?term=2020%3B+104%3A+1703%E2%80%9311