Síndrome Cardiorrenal
INTRODUCCIÓN
La expresión síndrome cardiorrenal (SCR) que tradicionalmente se había empleado para designar una variedad de situaciones clínicas en las que existe simultáneamente un daño o disfunción renal y cardiaca, se actualizó y unificó en el año 2008. En una Conferencia de Consenso bajo el auspicio de la Acute Dialysis Quality Initiative (ADQI) que reunió a expertos y líderes de opinión de Nefrología, Cuidados Intensivos, Cardiología, Cirugía Cardiaca y Epidemiología se elaboró un documento sobre la definición y clasificación del SCR, así como sobre los métodos diagnósticos, la prevención y el tratamiento, vigente actualmente [1].
En esta Conferencia de Consenso, se definió el término SCR como una serie de “desórdenes del corazón y riñón en los que la disfunción aguda o crónica en un órgano induce la disfunción aguda o crónica del otro” [1]. Asimismo, se propuso una clasificación en 5 tipos dependiendo del órgano inicialmente lesionado y la naturaleza aguda o crónica del daño (Tabla 1).
Desde entonces, han sido múltiples las publicaciones en las que se revisan la epidemiología, fisiopatología y tratamiento de los diferentes tipos de SCR [2] [3] [4] [5] [6] [7] [8].
En los últimos años, se está profundizando en los mecanismos que relacionan la disfunción de ambos órganos, describiendo factores hemodinámicos, mediadores neurohumorales y mecanismos inflamatorios que pueden tener un papel relevante en el empeoramiento de la función de los órganos que conduce a la progresión del SCR [9] [10] [11] [12] [13] [14] [15].
La relevancia del SCR estriba en que la coexistencia de enfermedad cardiaca y renal se ha relacionado con peor pronóstico a medio y largo plazo, debido a un mayor riesgo de reingresos y mortalidad de los pacientes.
Aunque existen guías clínicas para el manejo de la insuficiencia cardiaca aguda y crónica [16] y la enfermedad renal aguda y crónica [17] [18] [19] [20], no existen guías clínicas consensuadas para el manejo de los pacientes con SCR.
SÍNDROME CARDIORRENAL TIPO 1
Definición y epidemiología
El SCR tipo 1 hace referencia a la situación en la que la disfunción cardiaca aguda induce lesión y/o disfunción renal aguda [1].
Los eventos cardiacos agudos que se han relacionado con el desarrollo de lesión renal aguda incluyen la insuficiencia cardiaca aguda, el síndrome coronario agudo, el shock cardiogénico y las alteraciones asociadas a la cirugía cardiaca.
Los datos relacionados con la incidencia del SCR tipo 1 son variables dependiendo de las series. Se estima que la incidencia del SCR tipo 1 en pacientes con insuficiencia cardiaca oscila entre un 27-45% [21] [22] [23] [24] [25] [26], y entre un 9-54% en pacientes con infarto agudo de miocardio [27] [28] [29] [30] [31] [32] [33].
Este amplio rango en la incidencia puede ser atribuido al uso de diferentes definiciones del daño renal agudo, diferentes periodos de observación y/o a la heterogeneidad de las poblaciones estudiadas. Hasta fechas recientes, el principal problema era la ausencia de criterios consensuados para la definición del daño/disfunción renal aguda [34].
En 2004, se adoptó el concepto de daño renal agudo para la lesión renal y la clasificación RIFLE para definir esta entidad clínica [35]. Para el diagnóstico, se utilizan la variación de la concentración de la creatinina sérica en un intervalo de 7 días, la reducción del filtrado glomerular estimado y determinados parámetros de flujo de orina (Tabla 2) [35].
En 2007, la Acute Kidney Injury Network (AKIN) presentó un sistema de clasificación más minucioso en lo referente al daño renal agudo, que elimina los criterios de filtrado glomerular y cambia la franja de tiempo en la que se desarrolla el daño renal agudo (48 horas en lugar de los 7 días del sistema RIFLE) (Tabla 3) [36].
Centrándose en el daño renal agudo, la clasificación AKIN, reemplazó las categorías R, I y F de la clasificación RIFLE por los estadios I, II y III y eliminó las categorías L y E.
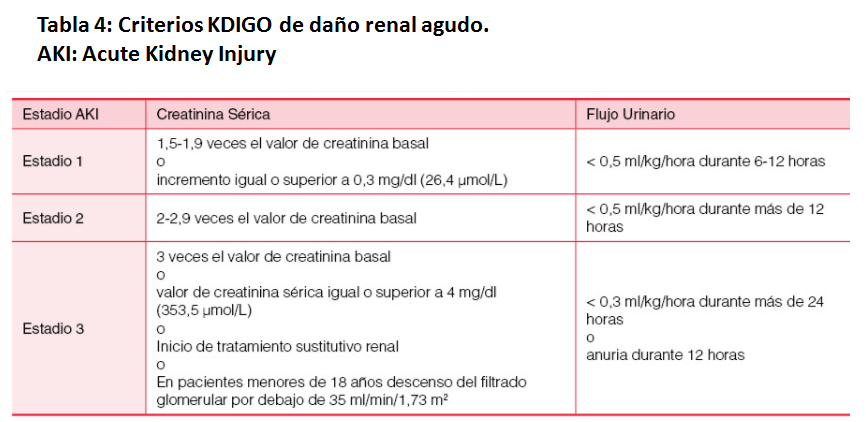
En 2012, el grupo Kidney Disease: Improving Global Outcomes (KDIGO) combinó parte de las clasificaciones RIFLE y AKIN para detectar el daño renal agudo con mayor sensibilidad (Tabla 4) [17].
La utilización de estos criterios diagnósticos en los pacientes que ingresan por insuficiencia cardiaca permite identificar a aquellos pacientes con disfunción renal que presentarán un peor pronóstico a medio y largo plazo [37] [38].
La relevancia clínica del SCR tipo 1 estriba en que su presencia en pacientes con insuficiencia cardiaca y/o infarto agudo de miocardio tiene valor pronóstico a corto y largo plazo ya que se asocia, independientemente de la patología cardiovascular y de la función sistólica de origen, con una mortalidad y una tasa de reingresos mayores [25] [27] [30] [31] [39] [40] [41] [42].
Fisiopatología
En la génesis del SCR tipo 1 se han implicado múltiples factores [4] [43] (Tabla 5). El deterioro agudo de la función cardiaca produce alteraciones hemodinámicas, entre las que se incluyen reducción del volumen sistólico y del gasto cardiaco, elevación de la presión en aurícula derecha y congestión venosa, que conducen a un descenso del filtrado glomerular [44].
Estas alteraciones hemodinámicas activan mecanismos neurohumorales compensatorios, que incluyen la activación del sistema nervioso simpático y del sistema renina-angiotensina-aldosterona, y la liberación de vasopresina y endotelina-1, que favorecen la retención hidrosalina y la vasoconstricción sistémica.
A) Activación neurohumoral
Las adaptaciones neurohumorales tienen como objetivo mantener la perfusión de los órganos vitales mediante vasoconstricción periférica y aumento de la contractilidad miocárdica y la frecuencia cardiaca, que mantienen la presión arterial sistémica. Los principales mediadores de estos eventos son el sistema renina-angiotensina-aldosterona, el sistema nervioso simpático y la vasopresina.
En las fases iniciales de la insuficiencia cardiaca, aumenta la secreción de renina y la producción de angiotensina II que induce sed, estimula el sistema nervioso simpático y produce vasoconstricción renal y sistémica, además de aumentar la liberación de aldosterona. En situaciones normales, la retención de sodio debida a la secreción de aldosterona es temporal y no causa edema ya que el incremento del volumen vascular produce un aumento de la liberación de sodio a los túbulos distales que en tres días sobrepasa el efecto de la aldosterona (fenómeno de escape de la aldosterona) [45] [46].
En pacientes con insuficiencia cardiaca, este efecto de escape se previene por la disminución de la perfusión renal y la alteración de la liberación de sodio al túbulo distal. El sodio que alcanza el túbulo distal es reabsorbido produciendo sobrecarga de volumen y congestión pulmonar. Al mismo tiempo, la elevación de la aldosterona se asocia con fibrosis en el miocardio que aumenta la disfunción cardiaca y el SCR [47]. La vasoconstricción renal y la disminución de la liberación de sodio al túbulo distal también atenúan los efectos reductores de sal de los péptidos natriuréticos y aumentan la susceptibilidad de los pacientes con insuficiencia cardiaca a daños por otros agentes: contrastes nefrotóxicos, sepsis y alteraciones hemodinámicas como la hipotensión y el incremento de la presión venosa renal.
En pacientes con insuficiencia cardiaca, existe un incremento de las catecolaminas séricas. La estimulación simpática de los receptores alfa-adrenérgicos en el túbulo proximal aumenta la reabsorción de sodio, mientras que la estimulación de los beta-receptores activa la secreción de renina en el aparato yuxtaglomerular.
En pacientes con insuficiencia cardiaca, a pesar de la existencia de una osmolaridad sérica normal o incluso disminuida, la vasopresina presenta una liberación no osmótica [48]. La activación de los receptores de la vasopresina V1 origina un aumento en la resistencia vascular sistémica y la activación de los receptores de la vasopresina V2 ocasiona un incremento en la reabsorción de agua en los túbulos colectores produciendo hiponatremia. La vasopresina también aumenta la actividad de los transportadores de urea en los túbulos colectores produciendo un incremento en los niveles de urea séricos [49].
B) Alteraciones hemodinámicas y congestión venosa
La sobrecarga de volumen es una característica de la insuficiencia cardiaca descompensada. Se ha demostrado que el incremento de la presión venosa central es un factor relevante asociado al deterioro de la función renal. Estudios en pacientes con insuficiencia cardiaca han demostrado una relación inversa entre la presión venosa central y el filtrado glomerular [50] [51] [52] [53].
Aunque los mecanismos por los que el incremento de la presión venosa renal reducen el filtrado glomerular no están claramente establecidos, existen evidencias experimentales que relacionan dicho incremento con una reducción de la producción de orina [54]. El incremento de la presión venosa central se transmite al sistema venoso renal aumentando la postcarga renal y la presión intrarrenal [55]. El incremento en la presión intrarrenal disminuye la perfusión renal y el flujo intratubular dando lugar a un descenso del filtrado glomerular y un incremento en la retención de sodio y agua. Así, la relación entre el incremento de la presión venosa y el deterioro de la función renal hace que la descongestión abdominal sea relevante en el manejo de los pacientes con insuficiencia cardiaca y SCR [56] [57].
C) Reacción del eje hipotálamo-hipófisis
Cualquier situación de estrés activa el eje hipotálamo-hipófisis-glándula suprarrenal. Una de las principales hormonas hipofisarias relacionadas con el estrés es la vasopresina que, como más arriba se decía, estimula los receptores V1 en los vasos, aumentando la resistencia vascular periférica, y los receptores V2 en los túbulos colectores, aumentando la reabsorción de agua. Las consecuencias clínicas de estos cambios incluyen la retención de sodio y agua, la congestión pulmonar y la hiponatremia, que ocurren en casos de insuficiencia cardiaca [43].
D) Inflamación y señalización inmunitaria
En pacientes con insuficiencia cardiaca existe un aumento de los niveles circulantes de algunas citoquinas, como el TNF-alfa, que tienen valor pronóstico [58] [59]. La activación de la inflamación puede jugar un papel en la insuficiencia cardiaca contribuyendo a la sobrecarga de volumen y la disfunción vascular [60] [61]. Estos mecanismos pueden tener consecuencias sobre la presión de perfusión renal, el edema peritubular, la reducción del filtrado glomerular y, finalmente, el daño inflamatorio e isquémico tubular renal [43] [61].
E) Papel del intestino y endotoxemia
En pacientes con insuficiencia cardiaca, la baja perfusión del intestino, el aumento de la permeabilidad de la pared intestinal y la liberación de endotoxinas en sangre se han propuesto como mecanismos de progresión de la insuficiencia cardiaca y el SCR tipo 1 [62]. En situación de hipoperfusión de las vellosidades intestinales, la permeabilidad paracelular de la pared intestinal puede aumentar dando lugar a la translocación de bacterias gram-negativas o lipopolisacáridos, así como de citoquinas, que pueden exacerbar la disfunción cardiaca [63].
F) Infección sobreimpuesta
La infección suele ser un factor precipitante de la insuficiencia cardiaca [64]. En estos casos, la inflamación sistémica puede ser el factor productor de la disfunción cardiaca y renal, con activación de citoquinas proinflamatorias, daño de la microcirculación, activación del endotelio y edema tisular [65].
G) Iatrogenia
En ocasiones, determinados tratamientos farmacológicos y técnicas diagnósticas pueden afectar el equilibrio entre el corazón y el riñón, dando lugar al deterioro de la función de ambos. Entre otros factores, los más frecuentemente descritos son: tratamiento con metformina que puede producir acúmulo de ácido láctico y disfunción cardiaca por efecto inotrópico negativo; agentes quimioterápicos; diuréticos; contrastes yodados radiológicos; bloqueantes del sistema renina-angiotensina-aldosterona y antiinflamatorios no esteroideos.
Diagnóstico
El diagnóstico precoz del deterioro de la función renal, que es vital para un adecuado manejo de los pacientes con SCR tipo 1, sigue siendo un reto.
Tradicionalmente, los valores de creatinina sérica y el volumen de diuresis han sido los parámetros utilizados para definir el daño renal agudo [17] [35] [36].
Sin embargo, estos marcadores clásicos se elevan cuando el daño renal ya se ha establecido. Por tanto, son necesarios parámetros que de una forma precoz alerten sobre la existencia de una disfunción renal [66]. En este sentido, son varios los marcadores que están siendo estudiados (Tabla 6) [67].
Existen datos que sugieren que estos biomarcadores permitirían detectar el daño renal agudo en fases precoces, incluso de manera independiente a la elevación de la creatinina sérica o la reducción en el flujo de orina, lo que podría tener importantes repercusiones en el tratamiento del paciente [68] [69] [70] [71] [72].
Prevención
La identificación de los pacientes en riesgo para el desarrollo de SCR tipo 1 y la instauración de las adecuadas medidas preventivas es una estrategia fundamental para reducir los riesgos y mejorar el pronóstico de los pacientes.
Varias situaciones clínicas han sido identificadas como factores de riesgo predisponentes para el SCR tipo 1 [73] [74] [75]. La presencia de diabetes, los episodios previos de ingreso por insuficiencia cardiaca descompensada o infarto agudo de miocardio, la presencia de una disfunción cardiaca severa o la función renal basal alterada se consideran factores de riesgo no modificables. El empleo de altas dosis de diuréticos y/o el tratamiento vasodilatador, así como altas dosis de contraste radiológico durante procedimientos invasivos se han identificado como factores de riesgo modificables. Así mismo, se han desarrollado sistemas de estimación del riesgo de desarrollar fracaso renal agudo (FRA) en la insuficiencia cardiaca descompensada [76], en casos de utilización de contraste radiológico [77] y tras cirugía cardiaca [78]. Estos sistemas permiten identificar a los pacientes en riesgo de desarrollar complicaciones agudas renales o cardiacas permitiendo la implantación de medidas de protección adecuadas.
Mejorar la función cardiaca y evitar la descompensación aguda son los elementos claves de la prevención del SCR tipo 1 [79]. Para ello, las medidas tradicionalmente aconsejadas incluyen: modificar los factores de riesgo cardiovascular, evitar agentes nefrotóxicos y fármacos que puedan precipitar la retención salina y el tratamiento farmacológico apropiado de la insuficiencia cardiaca [16].
Los agentes nefrotóxicos más comúnmente relacionados con el desarrollo del SCR tipo 1 son los antiinflamatorios no esteroideos (AINEs), las tiazolindionas y los contrastes radiológicos iodados. Los AINEs y las tiazolindionas, actuando sobre la hemodinámica renal, pueden dar lugar a la retención de sodio y volumen que puede descompensar la insuficiencia cardiaca. Los contrastes iodados inducen una intensa y prolongada vasoconstricción en la unión cortico-medular del riñón y deterioran la capacidad de autorregulación renal [80]; estos efectos, junto con un efecto tubular directo, conducen a la necrosis tubular aguda y al desarrollo de nefropatía por contraste.
Tratamiento
El tratamiento del SCR tipo 1 se basa en el empleo de fármacos que mejoren la función cardiaca y en evitar las situaciones que favorezcan el deterioro de la función cardiaca y renal. La aproximación inicial incluye una adecuada oxigenación, alivio del dolor y manejo de la congestión pulmonar, principalmente con diuréticos de asa y vasodilatadores, junto con el tratamiento de las arritmias y la suspensión de los agentes nefrotóxicos.
El principal objetivo terapéutico se centra en el balance entre la diuresis necesaria para el control de la insuficiencia cardiaca y el posible empeoramiento de la función renal debido a la pérdida de volumen y al deterioro de la perfusión.
Los inhibidores de la enzima convertidora de angiotensina (IECAs), los antagonistas de los receptores de angiotensina II (ARA II), los antagonistas de la aldosterona y los beta-bloqueantes están incluidos en los protocolos para el manejo de la insuficiencia cardiaca [16] porque son fármacos que han demostrado mejorar significativamente la supervivencia de estos pacientes en ensayos clínicos aleatorizados [81] [82] [83] [84] [85] [86] [87]. No obstante, algunos de ellos pueden contribuir al desarrollo de FRA por alteración de la hemodinámica sistémica y renal. Por ejemplo, los diuréticos que se recomiendan en pacientes con insuficiencia cardiaca para controlar la disnea y el edema pueden inducir complicaciones por una excesiva depleción de volumen intravascular que comprometa la perfusión renal [88].
A) Diuréticos
Los diuréticos son la primera línea en el tratamiento del paciente con insuficiencia cardiaca y SCR tipo 1. La congestión no sólo causa los síntomas, sino que probablemente contribuye al remodelado miocárdico y a la progresión de la insuficiencia cardiaca [89] [90]. Sin embargo, la diuresis excesiva puede deteriorar aún más la función renal, por ello la tasa de eliminación de fluido por los diuréticos no debería exceder la tasa de movilización del fluido del espacio intersticial, que en pacientes con enfermedad renal crónica (ERC) terminal se ha estimado en 12-15 ml/min [91], aunque en pacientes con insuficiencia cardiaca y bajo llenado arterial existe escasa información sobre el valor de dicha tasa.
El régimen óptimo de tratamiento diurético no se conoce. No se han encontrado diferencias significativas en los síntomas ni en la función renal que dependan de cómo se administre el diurético, ya sea en bolo o en infusión continua, y a bajas o altas dosis [92]. La estrategia con alta dosis se ha asociado con mayor diuresis y un pronóstico más favorable en algunas variables secundarias, pero también con empeoramiento transitorio de la función renal. Este deterioro de función renal en el seno del tratamiento de un episodio de insuficiencia cardiaca que clásicamente se ha considerado desfavorable, actualmente se considera un efecto hemodinámico e incluso de buen pronóstico [93].
Por otra parte, los diuréticos de asa predisponen a los pacientes a alteraciones hidroelectrolíticas e hipovolemia que pueden conducir a activación neurohumoral y FRA [94]. Por un lado, el fenómeno de escape a la acción de la aldosterona, antes descrito, está bloqueado en estos pacientes; por otro, la hipovolemia inducida por la administración de diuréticos puede provocar un aumento de la reabsorción tubular de sodio y reducir la respuesta a los mismos, especialmente en pacientes con ERC.
Sin embargo, la resistencia a la acción de los diuréticos es un problema permanente que desarrollan hasta el 30% de los pacientes con insuficiencia cardiaca. La definición clásica de sobrecarga de volumen a pesar de dosis altas de diuréticos probablemente ha quedado obsoleta a pesar de lo cual, hasta la fecha, ninguna alternativa goce del consenso científico [95].
Las estrategias para mejorar la resistencia diurética incluyen actualmente la liberalización (razonable) de la dieta estricta sin sal, la combinación de diferentes diuréticos, el uso de soluciones salinas hipertónicas junto con los propios diuréticos o incluso el uso de antagonistas del receptor de la ADH. Esta última estrategia se ha desechado a la vista de los resultados de estudios como el EVEREST o el TACTICS-HF y su uso ha quedado relegado a aquellos casos en los que coexista hiponatremia [96] [97].
B) Ultrafiltración
La ultrafiltración es una técnica invasiva que permite la eliminación del exceso de volumen. En los últimos años, ha aumentado el interés por su utilización como tratamiento de la insuficiencia cardiaca descompensada y la sobrecarga de volumen, aunque los resultados observados no son uniformes [98]. Por una parte, existen evidencias que muestran que la ultrafiltración es un tratamiento seguro que permite una adecuada pérdida de volumen en pacientes con insuficiencia cardiaca descompensada [99] [100], pero por otra existen evidencias a favor del tratamiento diurético escalonado, con mejores resultados en lo que se refiere a la preservación de la función renal a corto plazo [101]. Una posible explicación de la disparidad de resultados estriba en la heterogeneidad de los pacientes con insuficiencia cardiaca y SCR.
En el momento actual, parece recomendable utilizar la ultrafiltración en pacientes con insuficiencia cardiaca descompensada en los que no se logre una suficiente eliminación de volumen con un tratamiento diurético adecuado y el empleo de agentes vasoactivos, aunque se necesitan más estudios para guiar a los clínicos en el uso de los diuréticos y la ultrafiltración [102].
Véase NAD: Ultrafiltración Peritoneal en la insuficiencia cardiaca
C) Inhibición del sistema renina-angiotensina-aldosterona
Los efectos beneficiosos de los betabloqueantes, IECAs, ARA II y antagonistas de la aldosterona en la insuficiencia cardiaca y el infarto agudo de miocardio son bien conocidos [82] [83] [84] [85] [86] [87] [103] [104] [105]. Sin embargo, la administración de betabloqueantes en pacientes con SCR tipo 1 debe realizarse con cautela y, de hecho, se deben evitar hasta que el paciente haya sido estabilizado. Ello se debe a que, en estas situaciones, el gasto cardiaco se mantiene por la activación del sistema nervioso simpático y la taquicardia refleja y frenar esta respuesta compensatoria puede precipitar el shock cardiogénico [106]. Asimismo, la introducción de agentes bloqueantes del sistema renina-angiotensina-aldosterona debe realizarse mediante dosificación progresiva por el riesgo asociado de deterioro del filtrado glomerular.
D) Vasodilatadores
Los vasodilatadores (nitroglicerina, nitroprusiato, hidralazina) han sido utilizados en situaciones de SCR en las que el uso de IECAs o ARA II puede estar contraindicado [107].
El objetivo del uso de los vasodilatadores es disminuir las resistencias periféricas con el fin de reducir la regurgitación mitral, aumentar el flujo sanguíneo y disminuir las presiones de llenado. Los principales vasodilatadores utilizados son la nitroglicerina, el nitroprusiato y el nesiritide. La reducción de la poscarga por vasodilatadores puede aumentar el gasto cardiaco reduciendo el bajo llenado arterial y mejorando la función renal en pacientes seleccionados. Sin embargo, los vasodilatadores también pueden causar hipotensión y reducir la presión de perfusión.
E) Drogas inotropas
Los inotropos (dobutamina, milrinona y levosimendan) pueden ser de utilidad en pacientes críticos con sobrecarga de volumen resistente a diuréticos y disfunción renal y/o hepática. La necesidad de tratamiento inotropo se asocia a una mayor mortalidad porque por un lado su uso es, en sí mismo, un marcador de insuficiencia cardiaca avanzada y por otro por sus posibles efectos adversos. Estos agentes deben utilizarse como primera línea de tratamiento, a corto plazo y con estrecha monitorización, en pacientes con hipotensión (presión arterial sistólica inferior a 100 mmHg) e hipoperfusión periférica [108] [109]. Los inotropos deben usarse como puente hacia un tratamiento definitivo o para facilitar la diuresis, disminuir la sobrecarga de volumen y la regurgitación mitral, mejorando la perfusión renal y la hemodinámica.
SÍNDROME CARDIORRENAL TIPO 2
Definición y epidemiología
El SCR tipo 2 se caracteriza por un deterioro crónico de la función renal como consecuencia de un deterioro crónico de la función cardiaca [1]. El empeoramiento de la función renal en el contexto de una insuficiencia cardiaca crónica se ha asociado con un pronóstico adverso y hospitalizaciones prolongadas.
Recientemente, se ha actualizado la clasificación de la insuficiencia renal en función de la fracción de eyección del ventrículo izquierdo (FEVI), de manera que se considera insuficiencia cardiaca con FEVI preservada si esta es superior 50%, medianamente reducida si la FEVI se sitúa entre 41 y 49% y reducida si la FEVI es inferior a 40% (PMID: 35379504).
La prevalencia de disfunción renal en pacientes con insuficiencia cardiaca es de aproximadamente un 25% y pequeños descensos en el filtrado glomerular aumentan de manera significativa el riesgo de mortalidad [110].
Fisiopatología
Los mecanismos que subyacen al deterioro de la función renal en este contexto no están tan claramente estudiados como en el caso del SCR tipo 1, pero tanto las anormalidades neurohumorales, con excesiva producción de mediadores vasoconstrictores (epinefrina, angiotensina y endotelina) y alteración de la liberación de vasodilatadores endógenos (óxido nítrico y péptidos natriuréticos), como los tratamientos utilizados para la insuficiencia cardiaca pueden influenciar en el deterioro de la función renal.
La hipovolemia inducida por diuréticos, la introducción de agentes bloqueantes del sistema renina-angiotensina-aldosterona y la hipotensión inducida por fármacos están entre los factores contribuyentes que se han sugerido [111].
En los últimos años ha habido un interés creciente en el papel patogénico de la anemia y del déficit absoluto o relativo de eritropoyetina y hierro en estos pacientes.
Prevención
En este contexto, los tratamientos que mejoran la historia natural de la insuficiencia cardiaca incluyen: agentes bloqueantes del sistema renina-angiotensina-aldosterona, los inhibidores de la neprilisina, betabloqueantes, nitratos e hidralazina, y la resincronización cardiaca.
Tratamiento
El tratamiento de la insuficiencia cardiaca se basa en una combinación de dieta, ejercicio y tratamiento de las enfermedades subyacentes, principalmente la hipertensión arterial, la diabetes mellitus, la dislipemia y las arritmias.
Los síntomas de insuficiencia cardiaca crónica: ortopnea, disnea paroxística nocturna y edema periférico, resultan principalmente de la sobrecarga de volumen debida a las elevadas presiones de llenado.
Por ello, uno de los objetivos del tratamiento de la insuficiencia cardiaca es reducir el acúmulo de volumen sin comprometer el gasto cardiaco. Los diuréticos de asa y las tiazidas, aunque no reducen la mortalidad, mejoran los síntomas reduciendo la sobrecarga de volumen y están recomendados en pacientes con insuficiencia cardiaca descompensada [112].
Los betabloqueantes (carvedilol, metoprolol y bisoprolol) mejoran la fracción de eyección a largo plazo y reducen la mortalidad y la rehospitalización [103] [104].
Los antagonistas de los receptores de aldosterona reducen la mortalidad en pacientes con insuficiencia cardiaca avanzada o tras infarto agudo de miocardio con función renal adecuada [84] [85].
Los IECAs se incluyen precozmente en el tratamiento de la insuficiencia cardiaca y reducen la mortalidad, el infarto agudo de miocardio recurrente y la tasa de rehospitalización relacionada con la insuficiencia cardiaca [113]. Los ARA II podrían utilizarse como alternativa en los pacientes que no pueden tolerar IECAs [114].
Sin embargo, los IECAs y los ARA II pueden reducir el filtrado glomerular especialmente en presencia de diuréticos y principalmente en pacientes con ERC o estenosis de la arteria renal. Además, el uso de IECAs debería acompañarse de un seguimiento cuidadoso de la función renal y los niveles de potasio sérico debido al riesgo de hiperpotasemia, especialmente en pacientes con disfunción renal concomitante. Respecto a esto último, la novedad más relevante es la aparición de nuevos quelantes del potasio: patiromer y ciclosilicato de zirconio y sodio. Ambos agentes han sido capaces de demostrar su efectividad en la reducción de los niveles elevados de potasio secundario a uso de fármacos bloqueantes del sistema renina-angiotensina-aldosterona en diabéticos, en la insuficiencia cardiaca y en la insuficiencia renal [115].
En 2016, se comercializó un nuevo grupo farmacológico cuyo mecanismo de acción radica en la inhibición de la neprilisina. El sacubitrilo unido a una molécula de valsartán ha sido capaz de demostrar en amplios ensayos clínicos su efecto beneficio sobre la insuficiencia cardiaca en cuanto a calidad de vida, hospitalizaciones y mortalidad en pacientes con fracción de eyección de ventrículo izquierdo inferior a 40%, clase función de la New York Heart Association (NYHA) II-IV y que estuvieran recibiendo tratamiento máximo tolerado con bloqueantes del sistema renina-angiotensina-aldosterona y betabloqueantes [116]. Estos buenos resultados tanto en los ensayos clínicos como en estudios en vida real han posicionado a sacubitrilo/valsartán en las guías actuales con una elevada evidencia y en los primeros escalones terapéuticos [113]. Además, este fármaco, ha demostrado su seguridad y efectividad en pacientes con ERC hasta filtrado glomerular de 15 ml/min/1,73m2 [117].
Los vasodilatadores (nitratos e hidralazina), aunque inferiores a los IECAs, reducen la mortalidad en comparación con placebo, y están recomendados en pacientes que no toleran IECAs o ARA II o en afroamericanos con grado funcional III/IV de la clasificación de la NYHA [118]. La monitorización de la presión arterial y de potasio sérico es básico en los pacientes que reciben IECAs, ARA II, antagonistas del receptor mineralocorticoideo o ARNi. La comercialización de las nuevas resinas de intercambio iónico (ciclosilicato de sodio y zirconio y patiromer) han demostrado ser efectivos en la disminución de los valores séricos de potasio, lo que permite optimizar la titulación de los IECAs, ARA II, antagonistas del receptor mineralocorticoideo o ARNi (PMID: 33160639).
La digoxina ha sido aprobada porque reduce los ingresos relacionados con la insuficiencia cardiaca, aunque sin reducir la mortalidad [119]. Su posición actual en las guías se sitúa para pacientes con tratamiento completo y síntomas resistentes [113].
En cuanto a terapias novedosas, los inhibidores del cotransportador 2 sodio-glucosa (iSGLT2) en el túbulo proximal han demostrado resultados satisfactorios en pacientes con diabetes mellitus e insuficiencia cardiaca. Más allá del efecto beneficioso sobre los eventos cardiovasculares mayores, los iSGLT2 reducen la progresión de la enfermedad renal y la albuminuria en pacientes con enfermedad renal diabética [120] [121]. Los estudios DAPA-HF y EMPEROR-REDUCED han sido capaces de demostrar un potencial efecto beneficioso en pacientes con insuficiencia cardiaca con FEVI reducida en pacientes sin diabetes, lo que ha posicionado ya a este grupo farmacológico en las guías clínicas [122] [PMID: 32865377]. De igual modo, los estudios DELIVERY y EMPEROR-PRESERVE han mostrado un efecto beneficioso de dapagliflozina y empagliflozina en pacientes con insuficiencia cardiaca con FEVI preservada, lo que supone una revolución en esta patología [PMID: 34449189, PMID: 36027570].
El manejo de la anemia influye en la progresión de la insuficiencia cardiaca. Los estudios llevados a cabo han demostrado que la repleción de los valores de hierro en situación de ferropenia (incluso sin anemia), mejoran la situación clínica, por lo que la ferroterapia debe ser incluida en el arsenal terapéutico de la insuficiencia cardiaca [123] [124]. Sin embargo, la utilización sistemática de agentes estimulantes de la eritropoyesis en el tratamiento de la insuficiencia cardíaca se encuentra actualmente en desuso por la falta de eficacia demostrada [125].
Además del tratamiento farmacológico, en pacientes con insuficiencia cardiaca se utilizan dispositivos como los desfibriladores cardiacos y la terapia de resincronización. Los desfibriladores cardiacos se utilizan como prevención primaria en pacientes con síntomas y fracción de eyección menor del 35% o como prevención secundaria en pacientes con insuficiencia cardiaca de causa isquémica o no isquémica, en los que han demostrado reducir la mortalidad y la morbilidad [126]. La terapia de resincronización cardiaca reduce la mortalidad y mejora la fracción de eyección en pacientes con insuficiencia cardiaca NYHA III-IV con fracción de eyección ≤ 35% y QRS ≥ 120 ms [127]. En pacientes con NYHA I/II, fracción de eyección < 30% y QRS ancho, la terapia de resincronización reduce la insuficiencia cardiaca sin reducir la tasa de mortalidad. Sin embargo, en pacientes con SCR avanzado, la efectividad de los desfibriladores y la terapia de resincronización es menor.
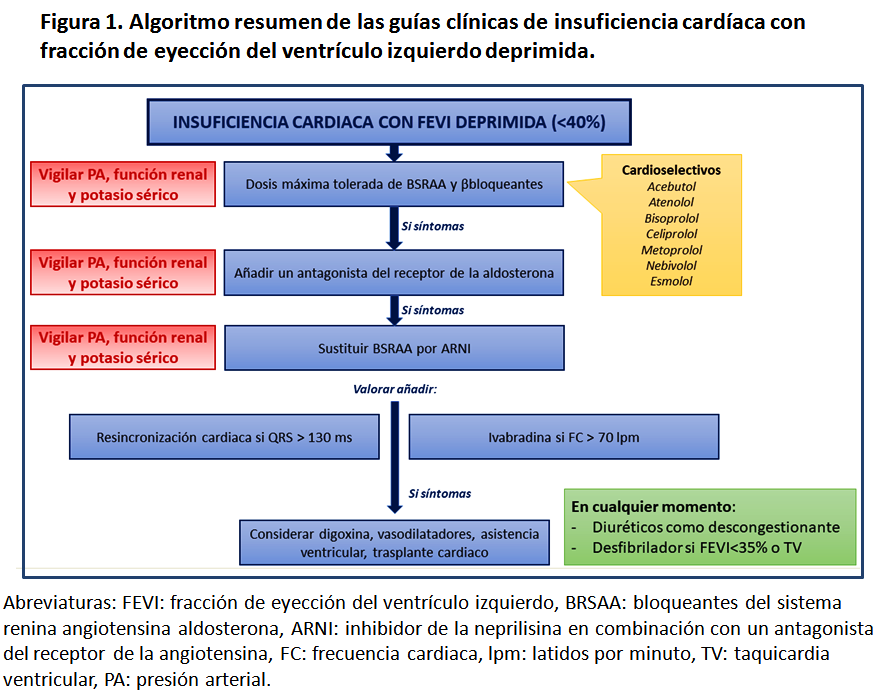
En la (Figura 1) se resume a modo de algoritmo las recomendaciones actuales de las guías de insuficiencia cardiaca [128] [35379504].
SÍNDROME CARDIORRENAL TIPO 3
Definición y epidemiología
En el SCR tipo 3 (también denominado renocardíaco), el daño renal agudo conduce a un daño cardiaco agudo, tal como infarto agudo de miocardio, insuficiencia cardiaca o arritmia [129].
Existen una serie de causas de FRA que pueden predisponer al desarrollo del SCR tipo 3 y que son relevantes para su susceptibilidad, duración y severidad. Entre ellas figuran el FRA precipitado por contraste radiológico o fármacos nefrotóxicos, la cirugía cardiaca o la cirugía mayor no cardiaca, la rabdomiolisis, la uropatía obstructiva, las glomerulonefritis y las pielonefritis [13].
En contraste con el SCR tipo 1, hay pocos datos relativos a la epidemiología del SCR tipo 3. Este último parece menos frecuente que el SCR tipo 1, aunque esto puede estar en relación con que no ha sido estudiado sistemáticamente. El FRA es una alteración creciente en hospitales. Cuando se aplican los criterios RIFLE, el FRA ha sido identificado en aproximadamente un 9% de los pacientes hospitalizados [130] aunque esta incidencia puede aumentar hasta un 20% cuando se aplican los criterios KDIGO [131].
Aunque existen pocos datos en la literatura sobre el papel del FRA en la aparición de eventos cardiacos y su pronóstico, algunos autores sugieren que la aparición de un FRA inducido por contraste se relaciona con un mayor riesgo de eventos cardiacos [132] [133] [134].
Fisiopatología
En general, existe una limitada información sobre la fisiopatología de cómo el FRA contribuye al daño cardiaco agudo y/o disfunción cardiaca. Un episodio de FRA puede tener efectos que afecten de manera directa o indirecta a la función y estructura cardiacas [6].
Por una parte, el daño renal agudo se asocia a activación neuroendocrina y del sistema inmunitario. La activación del sistema nervioso simpático es característica tanto en el FRA como en la insuficiencia cardiaca aguda [135]. El aumento de la actividad del sistema nervioso simpático renal y sus efectos en la liberación de noradrenalina durante el FRA pueden alterar la función miocárdica a través del efecto directo de la noradrenalina, alteraciones en la homeostasis del calcio en el miocardio, incremento en la demanda de oxígeno miocárdico y apoptosis de los miocardiocitos [136]. Asimismo, la activación del sistema nervioso simpático conlleva una estimulación del sistema renina-angiotensina-aldosterona que contribuye a la liberación de angiotensina II, vasoconstricción y alteración de la homeostasis del líquido extracelular. La angiotensina II puede también jugar un papel en la modificación de la estructura del miocardio y su función [137], contribuir a la hipertrofia celular y precipitar la apoptosis de los miocitos cardiacos [138]. La angiotensina II también es un potente estimulador de rutas intracelulares incluyendo aquellas involucradas en el estrés oxidativo, inflamación y regulación de la matriz extracelular [139]. El FRA estimula la activación del sistema inmune innato y adaptativo y en modelos animales aumenta la liberación de factores proinflamatorios que se acompañan de evidencias de apoptosis de células cardiacas y cambios funcionales en la ecocardiografía [140] [141]. Datos experimentales sugieren que el daño cardiaco puede ser inducido directamente por mediadores inflamatorios, estrés oxidativo, apoptosis y activación del sistema neuroendocrino. Varios estudios en modelos experimentales han demostrado que existen niveles elevados de citoquinas proinflamatorias que pueden tener efectos depresores directos sobre la función cardiaca [142] [143] [144] [145] [146].
Por otra parte, las funciones fisiológicas del riñón están comprometidas durante el FRA, lo que conduce a complicaciones graves que pueden afectar indirectamente al corazón, incluyendo la sobrecarga de volumen que contribuye al desarrollo de edema, sobrecarga cardiaca, hipertensión arterial, edema pulmonar y disfunción miocárdica; la hiperpotasemia y otras alteraciones de electrolitos pueden estar implicadas en el desarrollo de arritmias; la acidemia puede alterar el metabolismo del miocito y contribuir a la vasoconstricción pulmonar, aumentar la poscarga del ventrículo derecho y tener un efecto inotropo negativo; la acumulación de toxinas urémicas deprime la contracción miocárdica. La uremia no tratada puede afectar a la función miocárdica a través de factores que deprimen la contractilidad miocárdica [146] y se relacionan con inflamación pericárdica [147].
Prevención
La principal estrategia para minimizar las consecuencias del SCR tipo 3 es la prevención. Ya que se conoce que los principales factores involucrados en el desarrollo de un FRA son la edad mayor de 75 años, la presencia de filtrado glomerular inferior a 60 ml/min/1,73m2, la insuficiencia cardiaca, la enfermedad vascular periférica, la enfermedad hepática, la diabetes mellitus, la medicación nefrotóxica, la hipovolemia y la sepsis, en estos pacientes se aconseja evitar o minimizar el empleo de fármacos potencialmente nefrotóxicos, así como asegurar una adecuada perfusión de los órganos y un buen estado de hidratación [148].
El daño renal agudo relacionado con la administración de contraste se ha convertido en una situación frecuente, siendo sus factores de riesgo: ERC previa, diabetes, insuficiencia cardiaca crónica, hipotensión, edad avanzada y altas dosis de contraste. La evidencia apunta a la administración de fluidos isotónicos como la medida más efectiva para prevenir la nefropatía por contraste, mientras que otras opciones incluyen la administración de N-acetilcisteína o el uso de contrastes de baja osmolaridad y no iónicos (iopamidol) [149].
Tratamiento
Cuando el SCR tipo 3 ya se ha establecido, se aconseja la monitorización hemodinámica, buscar la causa del FRA por si tuviera un tratamiento específico y tratar las complicaciones que pudieran acontecer.
Lo más frecuente en el FRA que descompensa la función cardiaca es la retención de sodio y agua, por lo que un adecuado manejo del volumen para evitar la sobrecarga es importante [150]. Además, los cambios relacionados con la uremia, las alteraciones del metabolismo ácido base y de los electrolitos se acompañan de consecuencias adversas en la contractilidad cardiaca y su respuesta a las catecolaminas. Las alteraciones electrolíticas, tales como la hiperpotasemia y la hipopotasemia, deben corregirse para prevenir las arritmias y sus efectos hemodinámicos negativos. La corrección adecuada de estas alteraciones con tratamiento médico puede prevenir estas complicaciones [151]. En los casos en que el manejo médico no fuera efectivo, la lesión renal fuera severa o hubiera riesgo de desarrollar complicaciones amenazadoras para la vida del paciente, se debería considerar el tratamiento sustitutivo renal.
SÍNDROME CARDIORRENAL TIPO 4
Definición y epidemiología
El SCR (o renocardíaco) tipo 4 hace referencia a la enfermedad cardiovascular que acompaña a la ERC. La enfermedad cardiaca en pacientes con ERC es frecuente y la disfunción renal se asocia con un incremento de la mortalidad por eventos cardiovasculares de 10 a 30 veces superior en comparación con la población general [152] [153] [154] [155] [156].
La mortalidad cardiovascular y la progresión a ERC terminal son los dos principales problemas en los pacientes con ERC [157]. De hecho, los pacientes con ERC presentan un riesgo mayor de eventos cardiovasculares que de progresión a la ERC terminal [158].
La muerte súbita de origen cardiaco, la insuficiencia cardiaca y la enfermedad coronaria son las tres principales causas de mortalidad cardiovascular en los pacientes con ERC [159]. La incidencia de aterosclerosis acelerada es también mayor en estos pacientes, especialmente en los que están en diálisis [160].
Fisiopatología
Los factores de riesgo tradicionales son insuficientes para explicar la alta prevalencia de enfermedad cardiovascular en la población con ERC. Se ha demostrado que existen otros factores de riesgo no tradicionales relacionados con la ERC que contribuyen al desarrollo de la enfermedad cardiovascular, entre ellos:
• Anemia. La anemia relacionada con la ERC es frecuente en pacientes con SCR tipo 4 y se correlaciona con peor pronóstico [161]. El tratamiento con eritropoyetina exógena se ha demostrado que tiene un efecto beneficioso, no sólo por la corrección de la hemoglobina, sino también por efectos antiinflamatorios, antioxidantes y antiapoptóticos [162] [163].
• Estrés oxidativo. El incremento del estrés oxidativo juega un papel importante en múltiples vías activadas en la ERC. En un endotelio sano, el óxido nítrico estabiliza el tono vascular y previene la aterogénesis [164]. En la ERC, existe una disminución de la síntesis de óxido nítrico [164] y un incremento de la producción de radicales libres [165], que se relacionan con disfunción vascular y activación del sistema renina-angiotensina-aldosterona, y que intervienen en el desarrollo de la aterosclerosis y la lesión de órganos diana.
• Alteración del metabolismo calcio-fósforo. Las anormalidades del metabolismo calcio-fósforo están asociadas con la progresión de la ERC [166], así como con el desarrollo de complicaciones cardiovasculares. El hiperparatiriodismo está asociado con un incremento de mortalidad de origen cardiovascular [167]. La hiperfosfatemia es un factor independiente para eventos cardiovasculares, usualmente en fases avanzadas de la ERC [168]. Los niveles altos de fósforo están relacionados con calcificaciones vasculares y aumento de la fibrosis cardiaca en pacientes en hemodiálisis. El factor de crecimiento – 23 (FGF23), que regula la homeostasis del fósforo y la vitamina D, es un factor emergente relacionado con el desarrollo de enfermedad cardiovascular.
• Toxinas urémicas. El acúmulo de toxinas urémicas es un marcador de la disfunción renal. Las toxinas urémicas ligadas a proteínas pueden tener un importante papel en la progresión de la enfermedad cardiovascular en el contexto de la ERC. Tanto el indoxil-sulfato que tiene efectos cardiacos directos, siendo un potente agente fibrogénico y prohipertrófico, como efectos mediados por estrés oxidativo, parecen jugar un papel central en el daño renal y cardiaco [169] [170] [171].
• En los pacientes en programa de hemodiálisis no podemos olvidar el impacto sobre la comorbilidad cardiovascular que presentan la técnica utilizada (beneficio de la hemodiafiltración online sobre la hemodiálisis convencional), así como el acceso vascular (beneficio de la fístula arteriovenosa frente al catéter) [172] [173].
Prevención
El SCR tipo 4 es una entidad común ya que involucra la progresión de la ERC, a menudo debida a diabetes mellitus e hipertensión arterial, con aterosclerosis, hipertrofia de ventrículo izquierdo y disfunción sistólica y diastólica. Por ello, las medidas para prevenir el desarrollo del SCR tipo 4 deben estar orientadas a aquellos factores relacionados con la progresión de la ERC.
Tratamiento
El tratamiento de la ERC debería incluir un apropiado cumplimiento de las medidas dietéticas (restricción de sodio, potasio y proteínas) así como un adecuado control glucémico. La presión arterial debería controlarse utilizando IECAs, ARA II o betabloqueantes debido a sus efectos cardioprotectores demostrados. El desarrollo clínico de los SGLT2i ha expandido su prescripción a pacientes con ERC sin diabetes por lo que actualmente podría incluirse en la terapéutica del SCR tipo 4 (PMID: 36331190, PMID: 36331190).
La acidosis metabólica debe tratarse mediante la administración de bicarbonato sódico o citrato sódico. A este respecto, un reciente ensayo clínico ha sido capaz de demostrar que la reposición de bicarbonato en pacientes con ERC es capaz de mejorar la progresión de esta e incluso impacta en la supervivencia [174].
En relación con el manejo de la anemia en el SCR tipo 4 no hay consejos claros. Por una parte, la corrección de la anemia con tratamiento con factores estimulantes de la eritropoyesis y hierro en pacientes con insuficiencia cardiaca se asocia con mejoría de la función cardiaca, así como mejora en la función renal [175]. Por otra parte, una corrección rápida de la anemia en pacientes con ERC puede provocar eventos adversos como muerte, infarto agudo de miocardio, ictus e insuficiencia cardiaca aguda [176]. El estudio TREAT ha demostrado que el objetivo en pacientes con ERC debería ser mantener valores de hemoglobina de 11-12 g/dl sin exceder los 13 g/dl, con el objetivo de disminuir la morbilidad cardiovascular [177]. En caso de hemoglobina inferior a 10 g/dl se aconseja excluir la deficiencia de hierro antes de aplicar el tratamiento con factores estimulantes de la eritropoyesis.
SÍNDROME CARDIORRENAL TIPO 5
Definición y epidemiología
El SCR tipo 5 consiste en la lesión concomitante renal y cardiaca aguda o crónica secundaria a una enfermedad sistémica aguda o crónica. La causa más frecuente del SCR tipo 5 es la sepsis, donde la disfunción cardiaca y el deterioro de la función renal son inducidos por citoquinas proinflamatorias, endotoxinas, vasodilatación intrarrenal y sistémica y aumento de la permeabilidad vascular, hipoxia y disminución de la perfusión [178]. Otros ejemplos de situaciones que conducen a un SCR tipo 5 son el lupus eritematoso sistémico, la amiloidosis, la diabetes y otras enfermedades inflamatorias crónicas.
La información relacionada con la epidemiología del SCR tipo 5 es limitada debido a la gran cantidad de factores que pueden estar relacionados.
Prevención
Es preciso el tratamiento precoz de la enfermedad multisistémica que condicione la disfunción cardiaca y renal.
Tratamiento
Consiste en el tratamiento de la causa del SCR tipo 5 y el tratamiento de soporte de las funciones renal y cardiaca. El tratamiento precoz de la hipotensión sistémica mediante la reposición de volumen y el soporte inotropo y vasopresor son necesarios. En caso de deterioro renal persistente, la hemofiltración veno-venosa continua debe utilizarse para extraer citoquinas y mejorar la función renal sobre todo en el contexto de la sepsis [179].