Score VEXUS (Venous Excess Ultrasound Score) en el síndrome cardiorrenal
Palabras clave
Congestión venosa, puntuación escala Vexus, doppler color, doppler pulsado
Congestión venosa: Definición e importancia
La Insuficiencia Cardíaca Aguda (ICA) se define como la aparición de novo o cambio rápido de la situación cardiaca previa a que conduce a signos y síntomas de insuficiencia cardiaca que requieren atención médica y, con frecuencia, la hospitalización del paciente. La ICA es una entidad clínica caracterizada por la aparición o empeoramiento de sintomatología congestiva. La congestión sistémica se ha asociado con una mayor mortalidad, estancia hospitalaria o reingresos, principalmente en pacientes con síndrome cardiorrenal tipo 1 (SCR1) y en pacientes en unidades de críticos [1]. La definición tanto de las formas agudas como de las crónicas requiere la conjunción de los criterios diagnósticos establecidos por las guías para cada órgano implicado [Riñón-Corazón o viceversa): Kidney Disease Improving Global Outcomes [KDIGO) en Nefrología [2] o de la European Society of Cardiology [ESC) en Cardiología [3].
El concepto de congestión en el SCR1, ha evolucionado en los últimos años. Inicialmente la lesión renal aguda se atribuía a hipoperfusión renal por bajo gasto cardiaco (mecanismo anterógrado), sin embargo, este concepto no explicaba en su totalidad la fisiopatología del daño renal. Ahora sabemos que el aumento de la presión en cavidades derechas trasmitidas (mecanismo retrógrado) hacia el territorio venoso intraabdominal y a nivel de las venas renales aumenta la poscarga renal y la presión intrarrenal. Este incremento en la presión, en un órgano encapsulado como el riñón, disminuye la perfusión renal y el flujo intratubular dando lugar a un descenso del filtrado glomerular y a un incremento en la retención de sodio y agua, mediado por la activación del sistema renina-angiotensina-aldosterona y el sistema nervioso simpático, generando lo que actualmente se conoce como nefropatía congestiva [4].
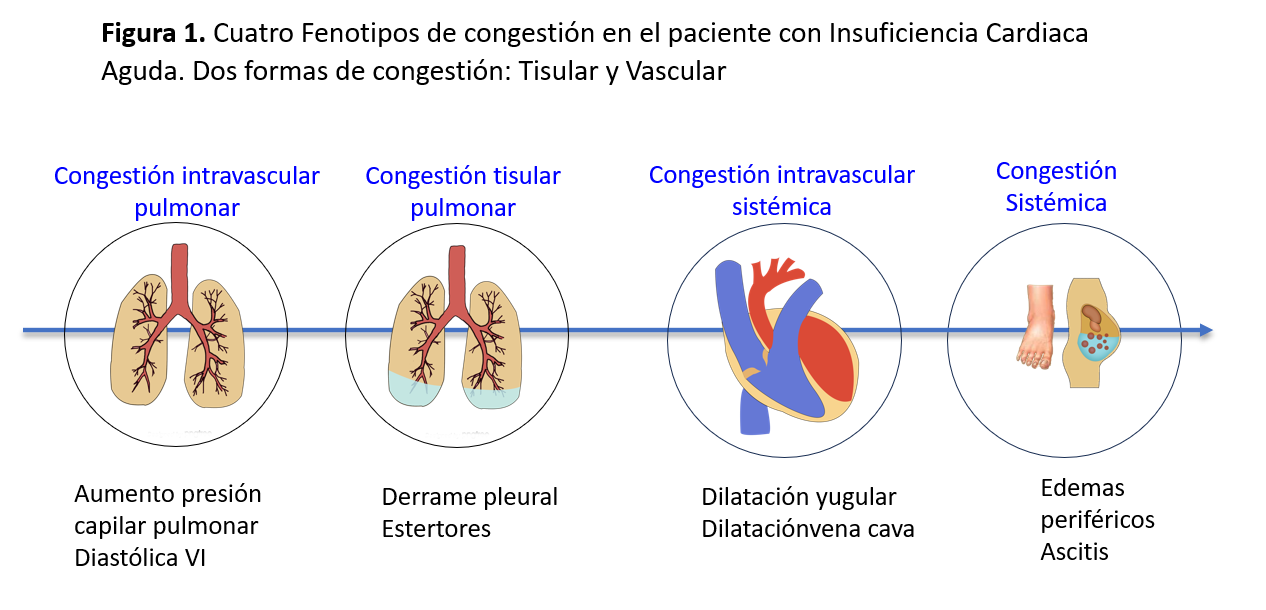
El estado congestivo sistémico se manifiesta clínicamente mediante signos y síntomas presentes en la anamnesis, la exploración física, el balance hídrico y el uso de pruebas complementarias básicas como la radiografía de tórax y biomarcadores como el péptido natriurético atrial o el antígeno CA-125 [5]. Es conocido que la norma de referencia para determinar correctamente el estado congestivo es la cateterización de la medida de la presión auricular derecha (PAD > 7 mmHg) y la presión de oclusión de la arteria pulmonar (POAP > 18 mmHg) [5], pero su uso está limitado a ciertos escenarios clínicos como el shock cardiogénico, la hipertensión pulmonar y las anomalías valvulares [6]. Por otro lado, los síntomas y la exploración física como disnea, ortopnea, ingurgitación yugular, edemas y crepitantes, son de escasa utilidad por su baja sensibilidad. Los estudios de imagen, como la radiografía de tórax, también tienen una baja sensibilidad, encontrando hasta en un 40% de los casos con ICA radiografías normales [7]. Estas limitaciones se ponen de manifiesto al momento de distinguir las dos formas de congestión: la tisular y la vascular. El acúmulo de líquido que se acompaña de fallo cardiaco se inicia en el espacio intravascular, mientras que el aumento de las presiones de los capilares por incremento de la presión hidrostática intracapilar, conlleva a la congestión tisular. La mayoría de los pacientes con ICA presentan combinación de congestión vascular y tisular, aunque puede diferenciarse la predominancia de un tipo de congestión sobre la otra. Esto ha hecho que recientemente se propongan 4 fenotipos de congestión en el paciente con ICA: pulmonar intravascular, pulmonar tisular, sistémica intravascular y sistémica (Figura 1) [8] cuyo objetivo es orientar adecuadamente el tratamiento descongestivo.
Recientemente se ha incorporado la ecografía a pie de cama o POCUS (point of care ultrasound), como una herramienta fundamental para la valoración de la congestión en los pacientes cardiorrenales. Según Romero-González et al.[4], la valoración de la congestión en el paciente congestivo mediante POCUS debería incluir las siguientes tres exploraciones: la ecografía pulmonar o ¨Lung Ultrasound¨ (LUS) para valorar de forma rápida y precisa la congestión pulmonar tisular (expresión del aumento de presiones en cavidades izquierdas), el estudio de la morfología y función cardiaca y valvular mediante la ecocardioscopia o ¨Focused Cardiac Ultrasound¨ (FOCUS) y la puntuación de la escala VExUS [Venous Excess Ultrasound Score) [9], para establecer el grado de congestión venosa a través del diámetro y la colapsabilidad de la vena cava inferior (VCI), así como los patrones Doppler de las ondas de la vena suprahepática (VSH), porta (VP) y renales (VR). De esta manera, valoraremos de forma más precisa el grado de congestión, tanto derecha como izquierda y optimizaremos el tratamiento diurético o dialítico en nuestro caso.
El protocolo VExUS
1. Principios básicos
Beaubien-Souligny y colaboradores [9] desarrollaron el protocolo VExUS, mediante la evaluación de la gravedad de la congestión en una cohorte de 145 pacientes sometidos a cirugía cardíaca, en el que se excluyeron aquellos con diagnóstico previo de insuficiencia renal aguda (IRA), delirium, cirrosis, trombosis portal o enfermedad renal grave (TFG < 15 mL/min o diálisis). A estos pacientes se les realizó una ecografía de la VCI, Doppler de VSH, VP y venas interlobulares renales a diario durante 3 días. Observaron que el score VExUS con congestión moderada y severa se relacionó con la aparición de lesión renal aguda.
2. Equipamiento necesario
Para la realización del VExUS necesitaremos un equipo de ecografía con Doppler color y pulsado. Respecto al transductor, debe ser de baja frecuencia, convexa o sectorial, con software para exploración abdominal.
3. Sistemática de realización
Colocaremos al paciente en decúbito supino con cabecero a 0º. El orden de la exploración será el siguiente:
3.1 Vena cava inferior (VCI)
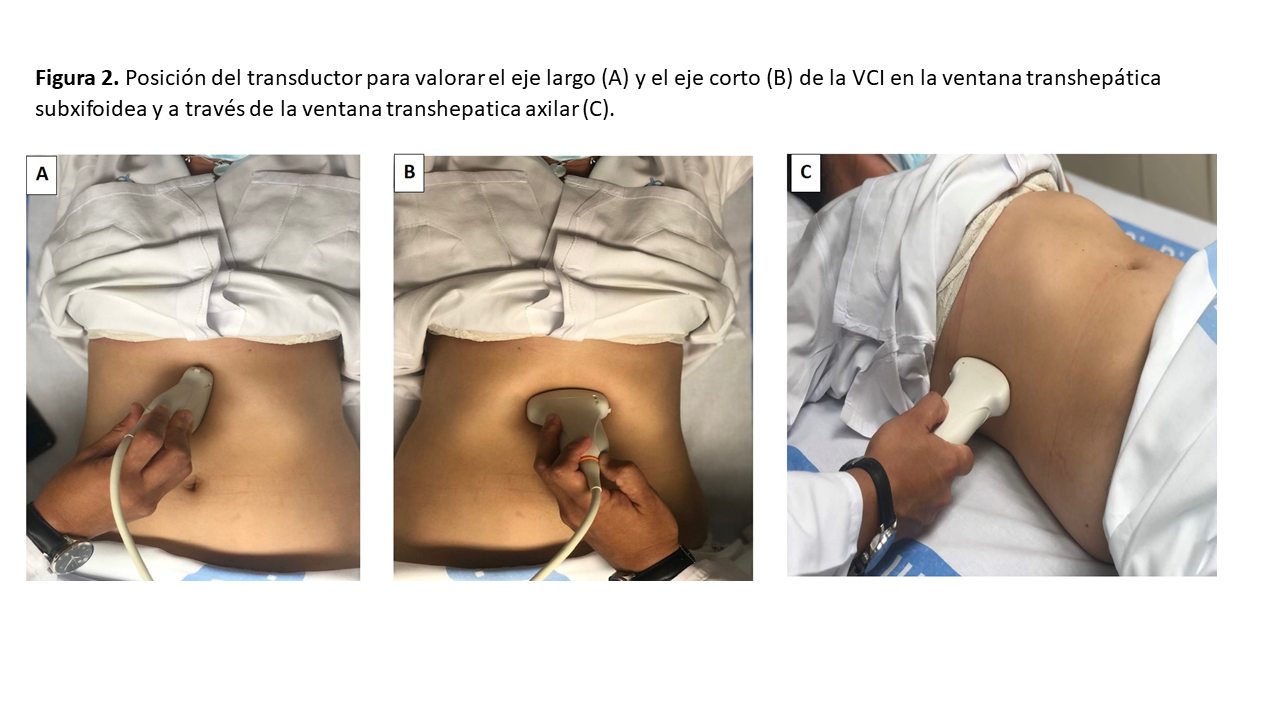
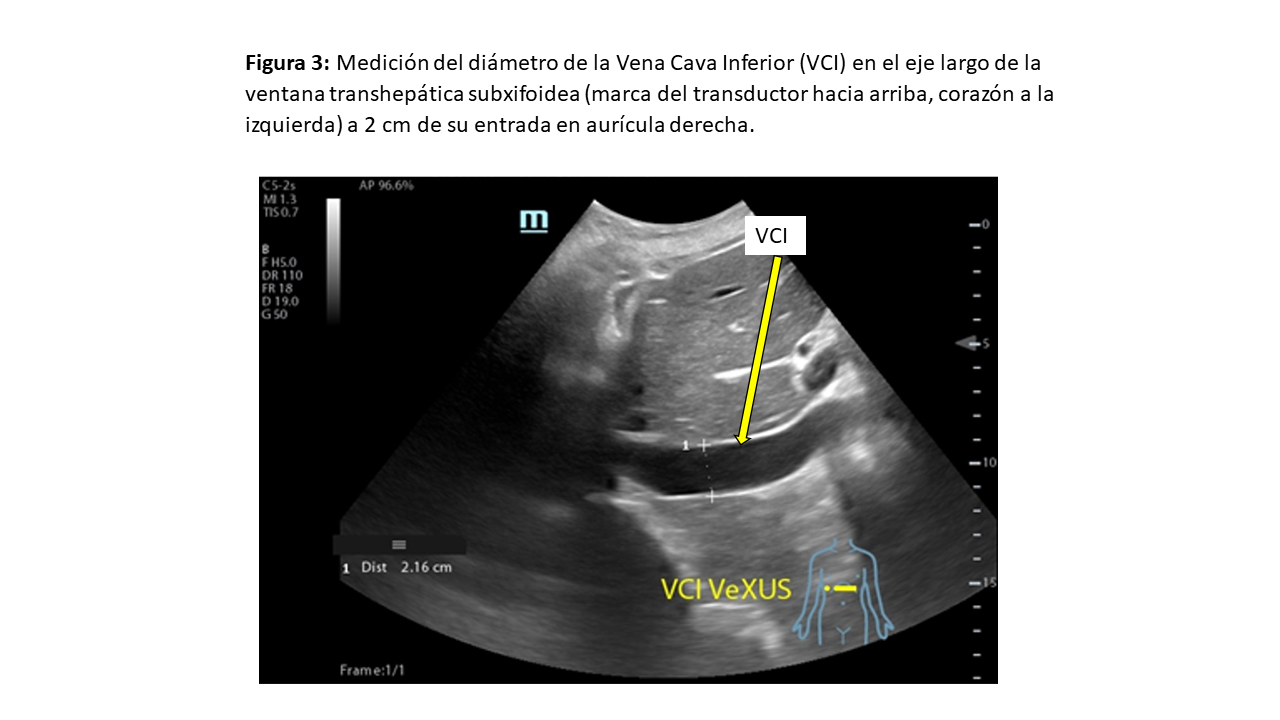
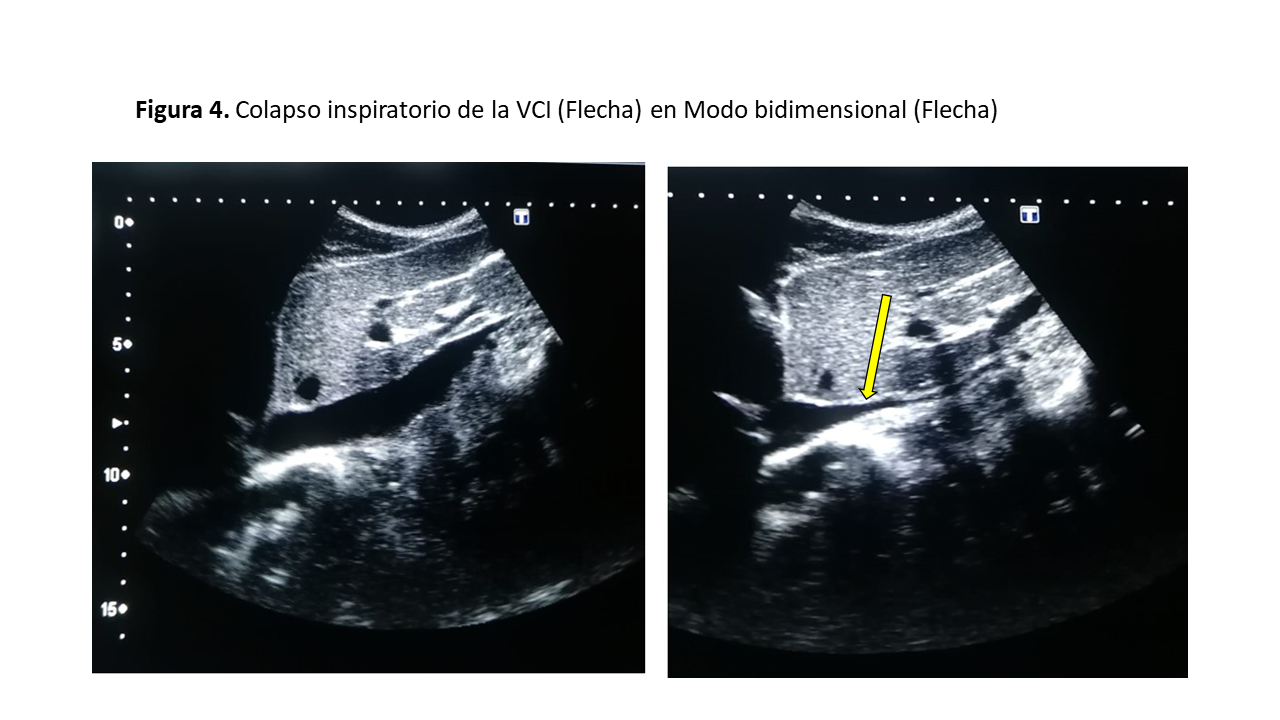
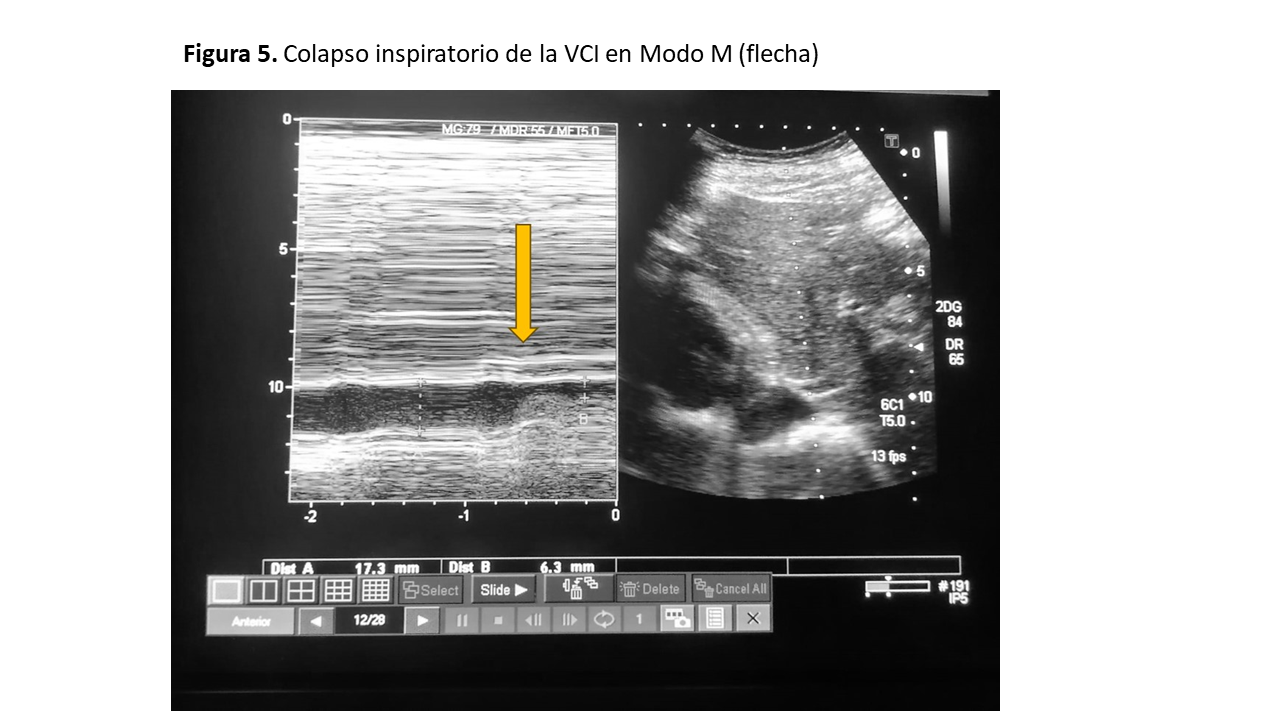
El primer paso consiste en la valoración de la VCI en su eje corto y/o largo, mediante ecografía bidimensional a través de las ventanas transhepática subxifoidea o axilar (Figura 2). Mediremos el diámetro de la VCI en su eje largo y/o eje corto, aproximadamente 2 cm por debajo de su entrada en la aurícula derecha (Figura 3). Posteriormente valoraremos su colapso inspiratorio que debe ser mayor al 50% (Figura 4). Para la medida del colapso inspiratorio de la VCI, el Modo M nos dará una imagen más gráfica (Figura 5). Si la VCI tiene un diámetro inferior a 2 cm y colapsa más del 50% se descarta congestión vascular y no continuamos con los siguientes pasos del protocolo VExUS.
Limitaciones sobre la medición de la vena cava inferior
- La evaluación de la VCI, se ha utilizado históricamente como marcador de la presión venosa central (PVC). Sin embargo, en los últimos años se ha documentado que la medición aislada de la VCI es un parámetro estático y con gran variabilidad subjetiva.
- La presión venosa central (PVC) no refleja con certeza la precarga real o congestión venosa del paciente. Así, la dilatación de la VCI (>2 cm) puede verse en algunas situaciones como la hipertensión pulmonar, determinadas valvulopatías, enfermedad pulmonar obstructiva crónica avanzada con hipertensión pulmonar o incluso en pacientes de complexión atlética y jóvenes, sin que existan datos de sobrecarga de volumen o aumento de la presión en la aurícula derecha.
- La dilatación de la VCI sólo da información de la presión y no cuantifica la cantidad de congestión venosa de otros órganos vitales como los pulmones, el hígado, el intestino y los riñones. Por lo tanto, si el diámetro de la VCI es mayor de 2 cm o presenta un colapso inspiratorio menor del 50%, es necesaria la valoración del resto del sistema venoso, cuyo objetivo será valorar y graduar el compromiso orgánico asociado a la congestión, así como descartar dilataciones de la VCI por causas no congestivas.
- Los pacientes con aumento de la presión intraabdominal elevada (ascitis cirrótica, diálisis peritoneal) pueden tener colapsada la VCI a pesar una elevada presión en aurícula derecha.
- Podemos confundir la VCI con la aorta abdominal (la aorta tiene pared hiperecoica y es pulsátil).
3.2 Venas suprahepáticas (VSH)
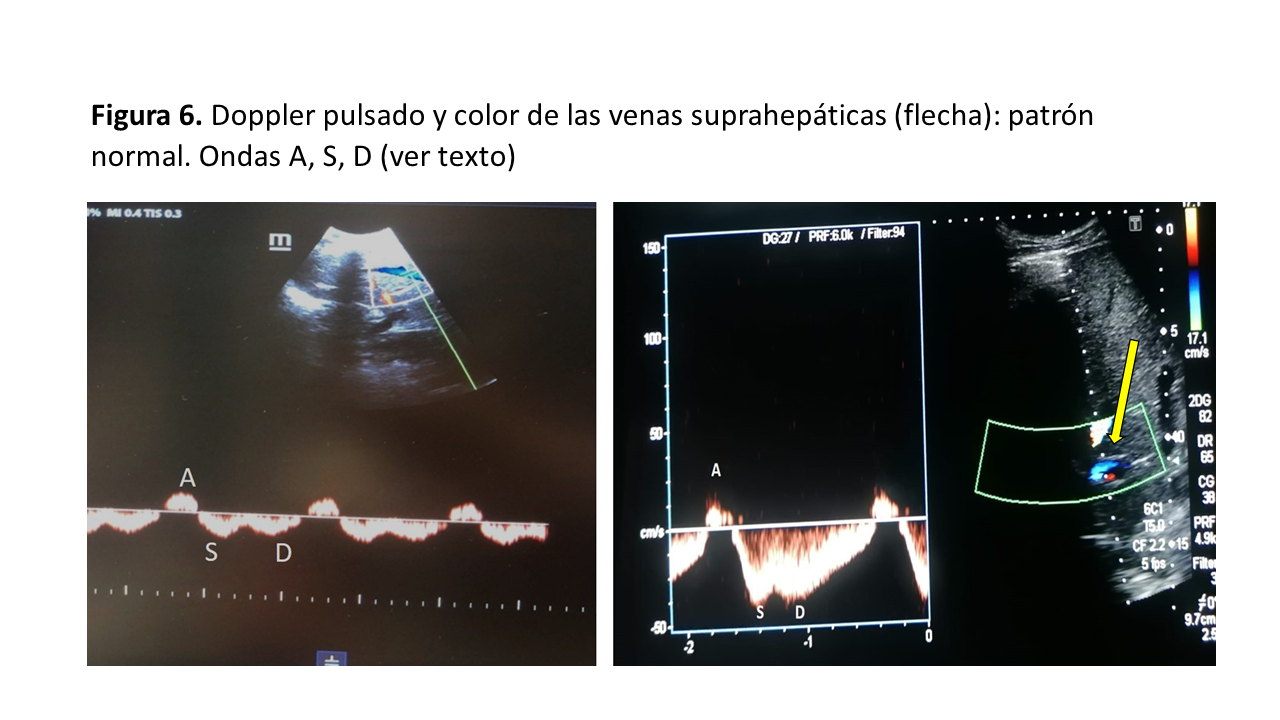
Para valorar el patrón Doppler de las principales VSH podemos utilizar la ventana transhepática subxifoidea o axilar media lateral con una ligera inclinación hacia abajo del transductor desde la ventana transhepática axilar media, visualizando la VSH justo antes de la entrada en la VCI. Con el Doppler color, la VSH normalmente aparece en color azul (flujo alejándose del transductor) [10]. El registro Doppler pulsado de las VSH, en condiciones normales, presenta 4 ondas visibles consecutivas (Figura 6):
Onda A: pequeña onda retrógrada debida a la contracción auricular
Onda S: onda anterógrada durante la sístole que representa la caída de la PAD durante el inicio e intermedio de la sístole cardíaca; la sangre se desplaza de forma anterógrada hacia la VSH debido a la relajación auricular.
Onda V: retrógrada que aparece entre las ondas S y D, al final de la sístole ventricular cuando el anillo tricúspide vuelve a su posición normal aumentando la PAD (no siempre es perceptible)
Onda D: onda anterógrada que representa otra caída de la presión en la AD durante la relajación ventricular en la diástole cardíaca, el flujo anterógrado se debe a la apertura de la válvula tricúspide.
Normalmente, la onda S es mayor que la onda D. Con la elevación de la PAD, la onda S se hace más pequeña que la onda D y en situaciones donde ocurre un aumento significativo de la PAD, la onda S se invierte. Un trazado electrocardiográfico (ECG) simultáneo es deseable para identificar con precisión los componentes de las ondas A, S y D que se producen inmediatamente después de las ondas P, R y T del ECG, respectivamente
Limitaciones sobre la medición del Doppler Color y Doppler Pulsado de las VSH
- Puede observarse una señal Doppler de la VSH anormal sin regurgitación tricuspídea en la disfunción del VD debido a la ausencia de movimiento anular.
- La forma de onda de la VSH puede simular congestión en las siguientes condiciones: cirrosis hepática, infiltración grasa hepática, linfoma hepático, maniobra de Valsalva en el compartimento abdominal o estenosis de la VCI.
- La fibrilación auricular conlleva la pérdida de la onda A y una onda S más pequeña (S< D) incluso en ausencia de elevación de la presión en la aurícula derecha.
- Las formas de las ondas A y V pueden ser picudas en hipertensión pulmonar.
- Las mediciones de los patrones de flujo de la VSH dependen de la experiencia del clínico y de los movimientos respiratorios del paciente, ya que la respiración rápida puede enmascarar u ocluir completamente la vena hepática y, por lo tanto, las mediciones pueden resultar difíciles.
3.3 Vena Porta
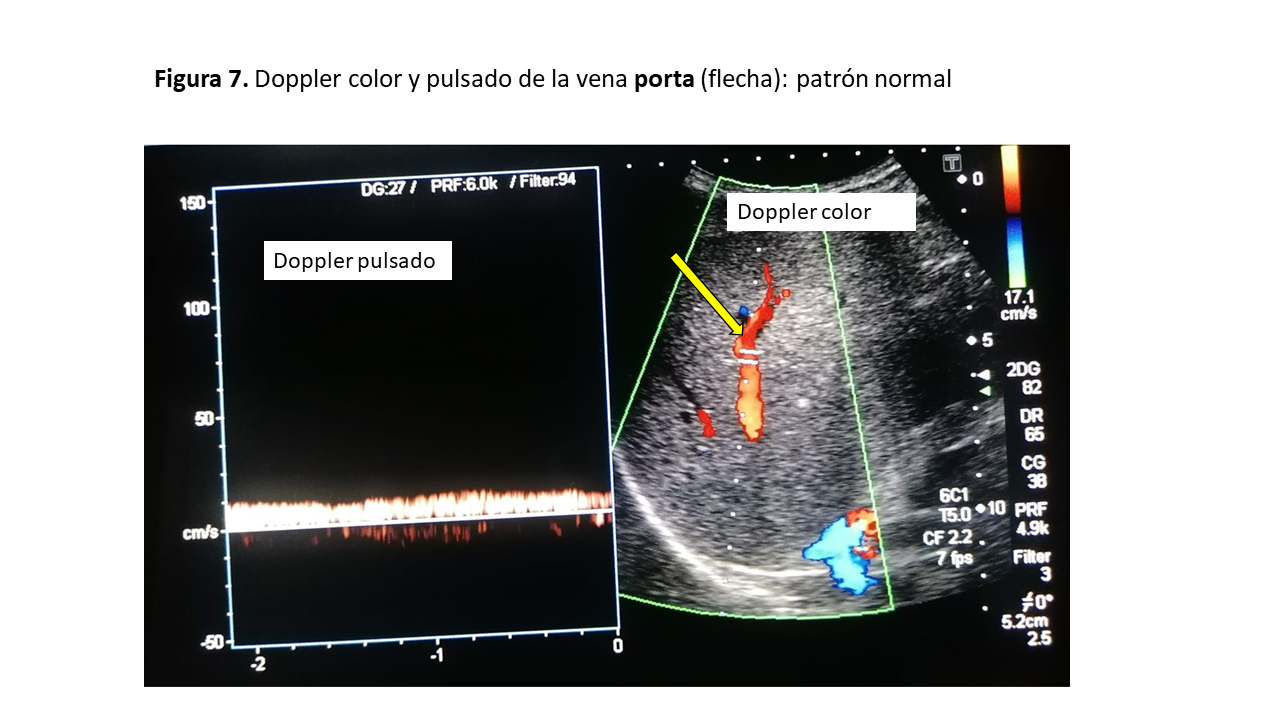
Tanto la vena porta como la vena renal (de la que hablaremos posteriormente) no tienen pulsatilidad mostrando un flujo continuo en condiciones normales por su distancia de los grandes vasos [11]. Veremos la porta, a través de las ventanas transhepáticas subxifoidea o lateral, siendo esta última más precisa, obteniendo una vista coronal. Con el Doppler color en condiciones normales la porta se ve de color rojo (flujo que se acerca al transductor) y con el Doppler pulsado el registro será monofásico continuo sin variación respiratoria ni pulsatilidad. Esto ocurre debido a que las sinusoides hepáticas y los shunts portales están relativamente aislados de la transmisión de la presión en la aurícula derecha provocando que la onda de pulso venoso se disipe por la resistencia al flujo ejercida por los capilares sinusoidales (Figura 7). Por ello, en estados congestivos se genera un flujo retrógrado con la contracción auricular que se transmite a los sinusoides hepáticos y a la vena porta, visualizándose un índice de pulsatilidad (IP) portal, que si es <50% correspondería a un estado congestivo moderado y si es >50% a un estado congestivo grave. Este IP se calcula mediante la siguiente la fórmula:
IP= [Velocidad máxima (Vmáx) – Velocidad mínima (Vmin)] x 100 / Velocidad máxima (Vmáx)
Donde Vmáx es la velocidad más alta y Vmin es la velocidad más baja durante el ciclo cardíaco. La pulsatilidad de las VP podría considerarse un signo de disfunción del corazón derecho y se asocia a una mala evolución de los pacientes con insuficiencia cardiaca derecha [12].
Limitaciones sobre la medición del Doppler de la vena porta
-Falsos positivos en pacientes delgados sanos, malformaciones arteriovenosas, donde es posible encontrar un aumento en el IP sin existir congestión [13].
-Falsos negativos en pacientes con cirrosis hepática, esteatosis hepática, trombosis portal, en los que la transmisión de la presión en la aurícula derecha es atenuada a nivel de las sinusoides hepáticos [14].
3.4 Vena renal:
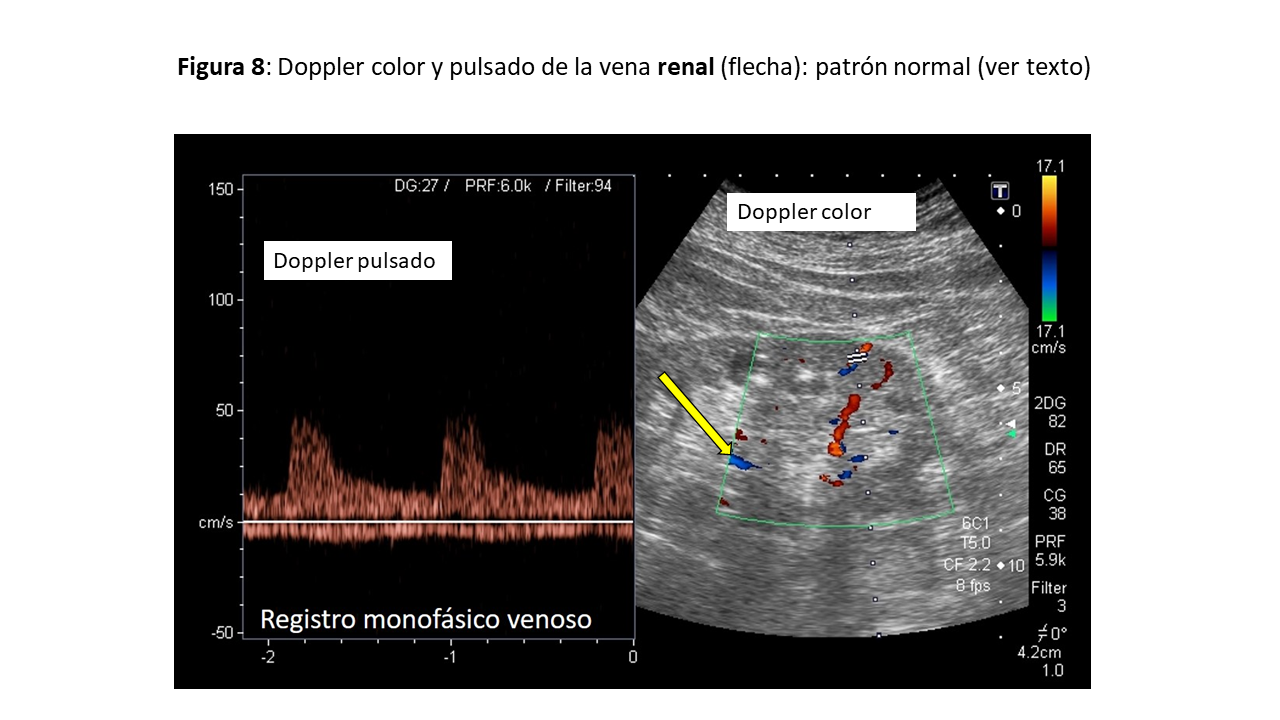
Finalmente, valoraremos el flujo en las venas intrarrenales que reflejan el efecto de la presión en aurícula derecha sobre el riñón, órgano encapsulado. En general, exploraremos solo el riñón derecho, asumiendo que los parámetros son iguales en ambos riñones. Colocaremos el transductor a nivel de la línea axilar posterior con el paciente en decúbito lateral izquierdo, obteniendo imágenes en una vista coronal. Situaremos la muestra del Doppler a nivel de la corteza renal para valorar las venas interlobulares (situadas entre las pirámides medulares renales). Se deben evitar las venas hiliares y arcuatas periféricas, puesto que sobrestiman la velocidad de flujo. En el Doppler color, las venas renales aparecen en azul y las arterias en rojo. Con el Doppler pulsado, el registro normal es monofásico continuo durante el ciclo cardiaco y aparece por debajo de la línea de base, mientras que por encima observamos el flujo arterial, lo que ayuda a identificar las fase del ciclo cardiaco (Figura 8).
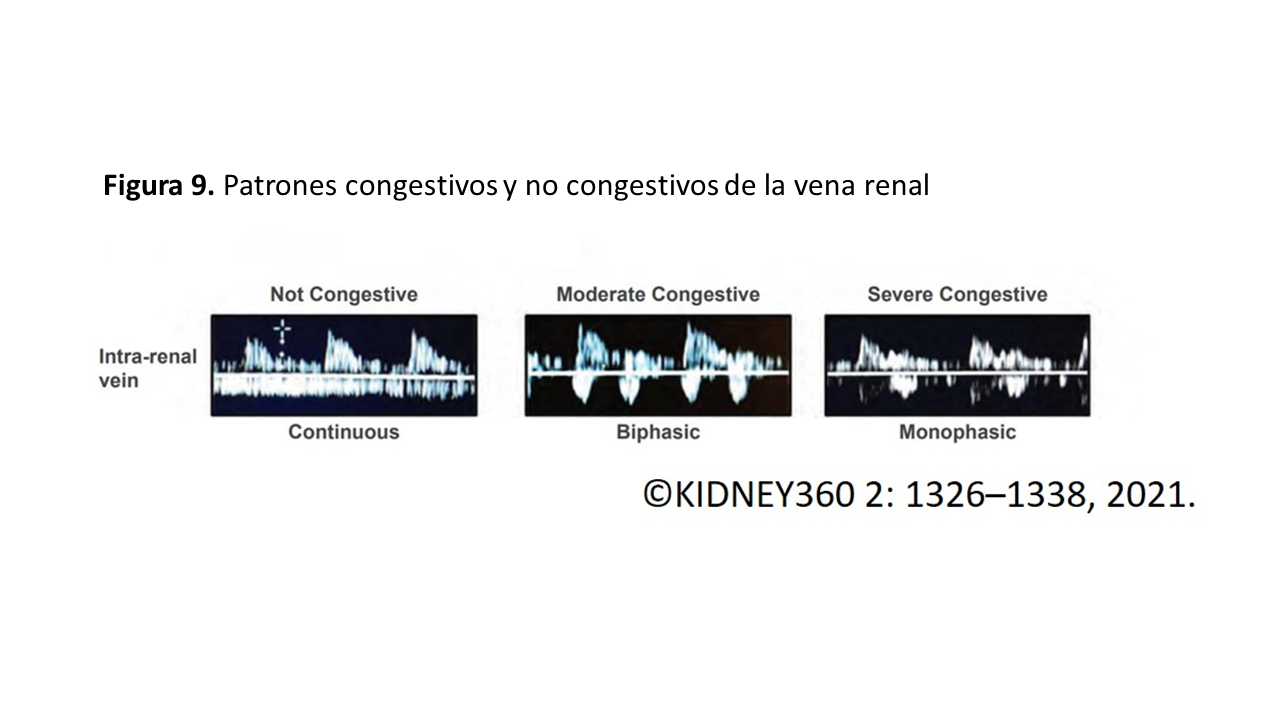
En congestión leve-moderada se observará un flujo bifásico con la aparición de dos ondas sistólica ¨S¨ y diastólica ¨D¨, que se correlacionan con las ondas S y D del flujo de las VSH mencionadas previamente. En presencia de congestión severa se observará un flujo monofásico discontinuo con dos o una sola onda ¨D¨ durante el ciclo cardiaco dependiendo de si la congestión es moderada o severa (Figura 9). La obtención del patrón de flujo de las venas intrarrenales es más complicada, y requiere cierta práctica, en comparación con las previas por el pequeño tamaño de los vasos. Es necesario pedir al paciente que realice una apnea o hacer la medición durante la espiración. La exploración del Doppler de los vasos renales permite además calcular el índice de resistividad arterial, que en situaciones de congestión puede alterarse y traducirse en aumento de las resistencias intrarrenales. Sin embargo, otras situaciones como la ateroesclerosis, las lesiones parenquimatosas, entre otras pueden alterarlas [15].
Limitaciones sobre la medición del Doppler de las venas intrarrenales
-Dentro de la principales limitaciones se encuentra la insuficiencia renal crónica avanzada [ERCA) [TFG < 15mL/min) o pacientes en diálisis, en los que es posible encontrar un flujo monofásico venoso sin presencia de congestión parenquimatosa [16].
- La evaluación de los vasos hiliares puede revelar un patrón pulsátil similar al patrón de la VSH incluso sin congestión venosa sistémica.
4. Patrones Doppler congestivos venosos
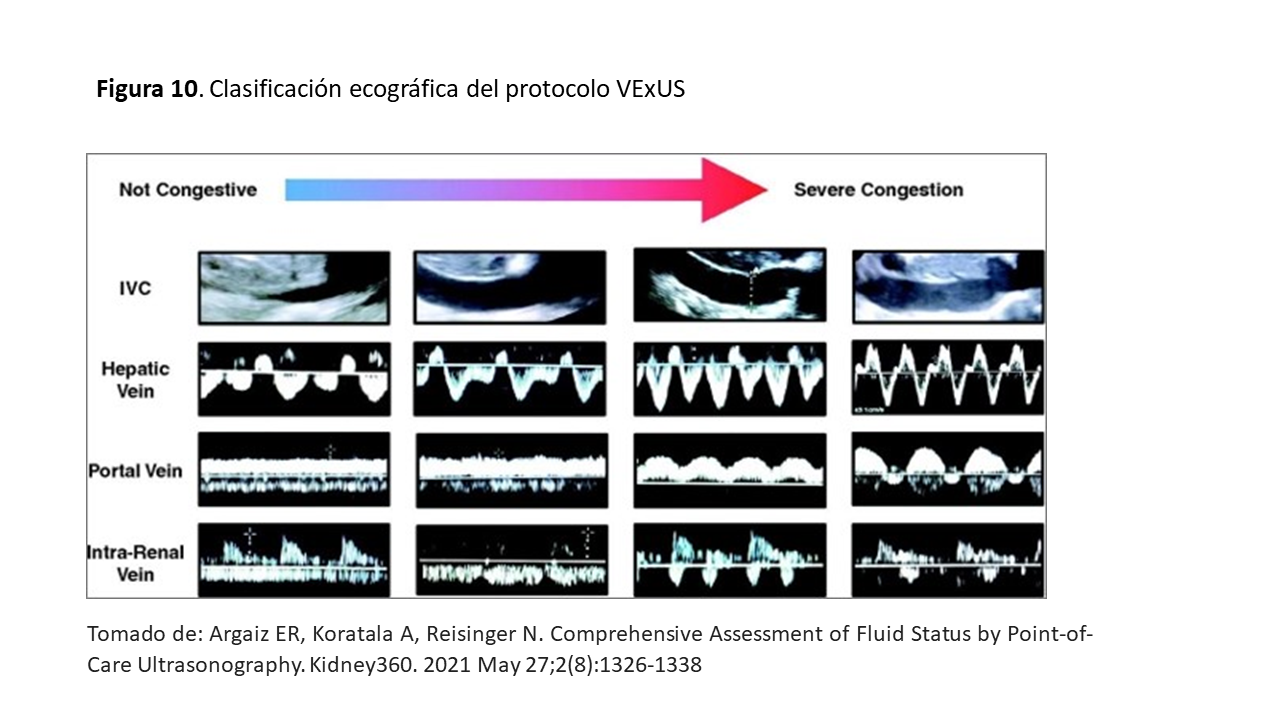
La congestión venosa modifica los patrones o registros normales del Doppler pulsado. En la (Figura 10), tomada de Argaiz et al [17] se representa la modificación de la curva Doppler desde la normalidad a la congestión venosa severa.
5. El score VExUS
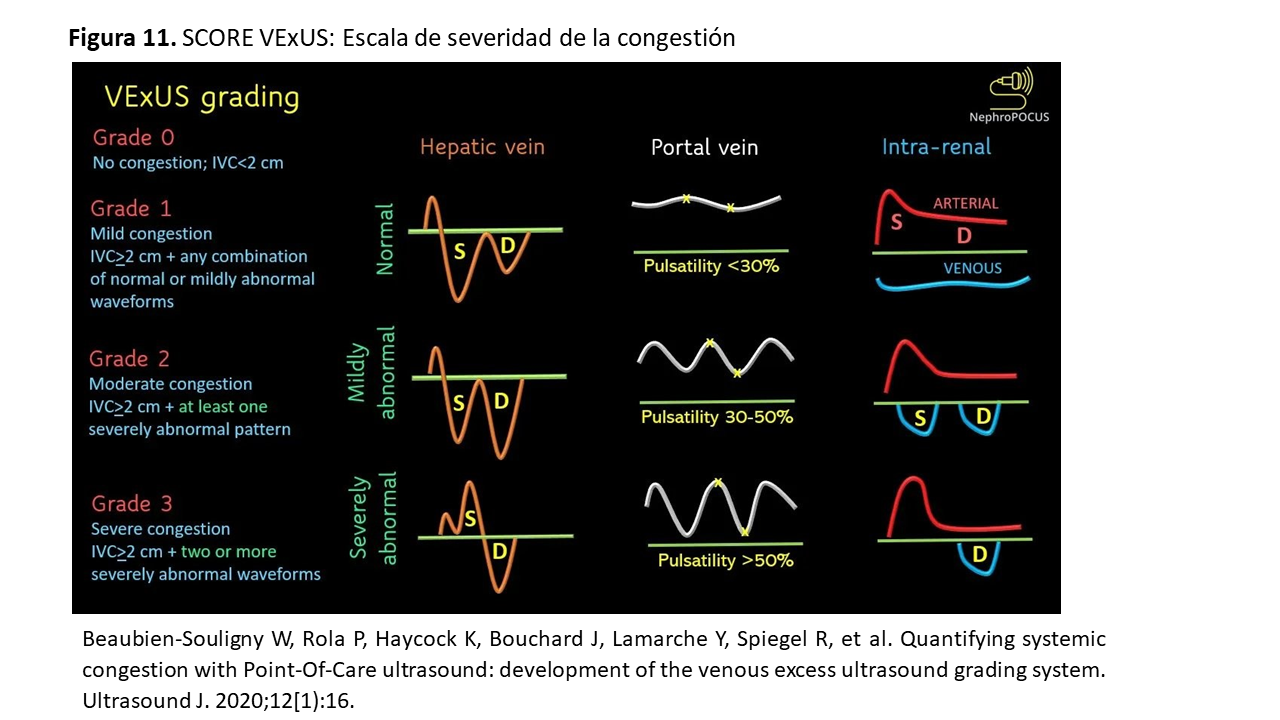
La visualización del diámetro y la colapsabilidad de la VCI conjuntamente con la valoración del Doppler color y pulsado de las VSH, porta e intrarrenales se integran en una escala de severidad de la congestión denominado score VExUS que tiene 4 grados (Figura 11):
Grado 0: Diámetro de la VCI < 2 cm. En este caso no hay congestión y no seguimos explorando el resto de territorios venosos
Grado 1: Diámetro de la VCI ≥2 cm y Doppler con patrones de normalidad o alteraciones leves
Grado 2: Diámetro de la VCI ≥2 cm con al menos un patrón de severidad en el Doppler Pulsado
Grado 3: VCI ≥2 cm, con dos o más patrones de severidad en el Doppler Pulsado
El score VExUS se ha validado principalmente en el SCR1 y en el paciente crítico. En la actualidad, este método se está introduciendo en las práctica habitual de la Nefrología ya que la información obtenida mediante el estudio ecográfico, aunque debe interpretarse en el contexto clínico, analítico, radiológico,etc.. puede ser en un futuro una guía para el tratamiento.
En el SCR1, el flujo de las venas intrarrenales mediante el Doppler demostró tener una mejor correlación con congestión que el índice de resistencia y se correlacionó con el aumento de la presión en aurícula derecha medida por cateterismo, acompañándose de peores desenlaces en los pacientes congestivos respecto a los que tenían congestión leve o los que no la tenían [12].
Ventajas y limitaciones del score VExUS
Como es sabido, la congestión por cualquier causa (presión o volumen) puede conducir a una nefropatía congestiva [18]. Una de sus principales fortalezas del score VExUS, es que nos permite realizar una interpretación cualitativa y estimativa de la congestión venosa, analizando los flujos venosos en el Doppler, sin necesidad de realizar mediciones directas, y cuantificando el grado de severidad. Con el protocolo VExUS, seremos capaces de guiar la reanimación con fluidos o identificar a los pacientes que más se puedan beneficiar de un tratamiento diurético o de su aumento de la dosis, lo que es clave para el manejo descongestivo del paciente con SCR [19]. Argaiz et al [20] objetivaron que la mejora del IP de la vena porta coincide con la mejora de la función renal en pacientes con ICA tratados con diuréticos.
Entre sus limitaciones, tenemos que no permite determinar la causa de la congestión venosa ni diferencia entre la sobrecarga de presión o volumen del VD. Por ejemplo, en pacientes con hipertensión pulmonar de larga evolución con un score de VExUS grave, debe evitarse una descongestión agresiva, puesto que el gasto cardíaco de estos pacientes a menudo depende de una precarga elevada. En este caso, la mejor respuesta se conseguiría con vasodilatadores pulmonares en el contexto de disfunción del VD. Otra limitación es que aún no se ha validado en múltiples escenarios como en la ERCA, trasplante renal, diálisis peritoneal y hemodiálisis, para poder extrapolarlo y estandarizarlo para el uso global de los pacientes para estimación de la volemia, ya que en el estudio original [9] se excluyeron pacientes con insuficiencia renal aguda. Además, el score VExUS no ayuda a predecir la respuesta a fluidos, tan necesario en los pacientes sépticos donde es primordial optimizar el volumen venoso y el gasto cardiaco.
El score VExUS en la práctica clínica
Aunque hasta la fecha no se han publicado grandes ensayos clínicos aleatorizados que demuestren su utilidad durante el seguimiento ambulatorio de pacientes con ICA tras un ingreso hospitalario, recientemente se ha publicado un estudio liderado por Torres-Arrese y cols [21] quienes evaluaron el pronóstico del uso del score VExUS y la ecografía de pulmón en 74 pacientes hospitalizados por ICA. Tanto el patrón monofásico de la vena renal, el IP de la VP > 50% y el score VExUS 3 fueron predictores de mortalidad durante la hospitalización. El diámetro de la VCI > 2 cm y la presencia de un patrón monofásico discontinuo de la vena renal en la visita a los 90 días tras el alta hospitalaria fue considerada predictor de reingreso hospitalario por ICA. Los autores concluyen que el protocolo VExUS es útil que el seguimiento precoz para mejorar el pronóstico de esta enfermedad tan prevalente.
Ecografía VExUS ampliada o VExUS-E
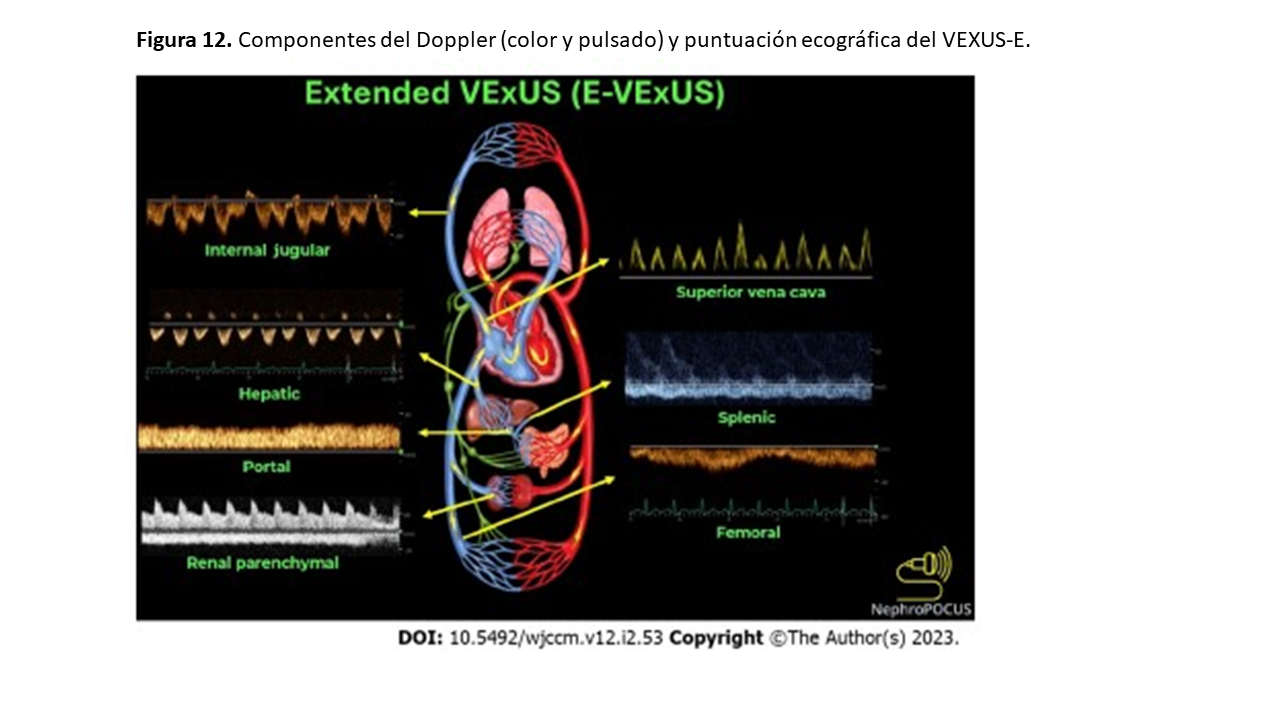
Recientemente se ha introducido el término ecografía VExUS ampliada o expandido (VExUS-E) para incluir el Doppler color y pulsado de venas adicionales como la yugular interna, la vena cava superior, esplénica y femoral en situaciones en las que las venas primarias (VSH, la porta en la cirrosis y renal en la ERCA) presentan limitaciones de acceso e interpretación [22] [23]. Podemos estimar la presión en aurícula derecha mediante ecografía de la yugular interna cuando la VCI no es accesible o su medición no es fiable (Figura 12) [24].Finalmente, el Doppler de la vena femoral está ganando atención debido a la relativa facilidad de adquisición de imágenes. En un estudio reciente la alteración del flujo de la femoral mostró un excelente rendimiento diagnóstico para detectar una elevada PAD [25]. Sin embargo, hay que tener cuidado a la hora de valorar el aumento de la PAD basándose únicamente en la femoral, ya que estudios anteriores mostraron una sensibilidad relativamente baja [26]. Por ahora, se necesitan más datos para establecer la utilidad en la práctica clínica diaria, con esta nueva modalidad del VExUS-E.
En resumen, podemos concluir que el score VExUS en combinación con la ecografía pulmonar, ecocardiografía, biomarcadores séricos cardiorrenales, anamnesis, exploración física y los parámetros de la bioimpedancia eléctrica integra la visión holística de la congestión vascular. Todo ello nos permitiría hacer un ajuste individualizado del tratamiento, así como servir de marcador pronóstico de la evolución de la enfermedad.