Glomerulonefritis fibrilar primaria de difícil diagnóstico
INTRODUCCIÓN
La glomerulonefritis fibrilar (GNF) es una entidad rara caracterizada por un depósito desorganizado en el glomérulo de fibrillas con un diámetro medio de 15-25 nanómetros en la microscopía electrónica. La expresión clínica es muy variable, pudiendo variar desde un síndrome nefrítico con deterioro de la función renal y hematuria hasta un síndrome nefrótico florido, o incluso una combinación de ambos cuadros. Asimismo, la expresión histológica también puede variar entre distintos patrones, lo que convierte el diagnóstico de esta patología en un auténtico reto.
Con este caso queremos mostrar las dificultades a las que nos enfrentamos en nuestro hospital a la hora de llegar al diagnóstico adecuado, así como el potencial mal pronóstico que puede tener esta enfermedad.
CASO CLÍNICO
Presentamos a un varón de 50 años derivado a nuestras consultas por edemas en el contexto de proteinuria en rango nefrótico de meses de evolución, acompañada de leve deterioro de la función renal. Como únicos antecedentes presenta hipertensión arterial (HTA) en tratamiento con olmesartán/hidroclorotiazida e infecciones urinarias de repetición. No toma otros tratamientos.
En la primera valoración en nuestras consultas objetivamos una creatinina sérica (Cr) de 1,76 mg/dL (basal 1,2), hipercolesterolemia de 482 mg/dL, hipoalbuminemia de 3,0 g/dL e hiperpotasemia de 5,7 mEq/L. En el proteinograma se objetiva una leve elevación de cadenas ligeras kappa (53,55 mg/L) y lambda (35,41 mg/L), con cociente normal (1,51). No hubo alteraciones significativas en el estudio inmunoglomerular y las serologías fueron negativas. En el análisis de orina de 24 h destaca una proteinuria de 8.550 mg/24 h con una albuminuria de 7.325 mg/24 h, junto a la presencia de 10–20 hematíes por campo, con un 35 % de hematíes dismórficos. La ecografía renal no mostró alteraciones significativas.
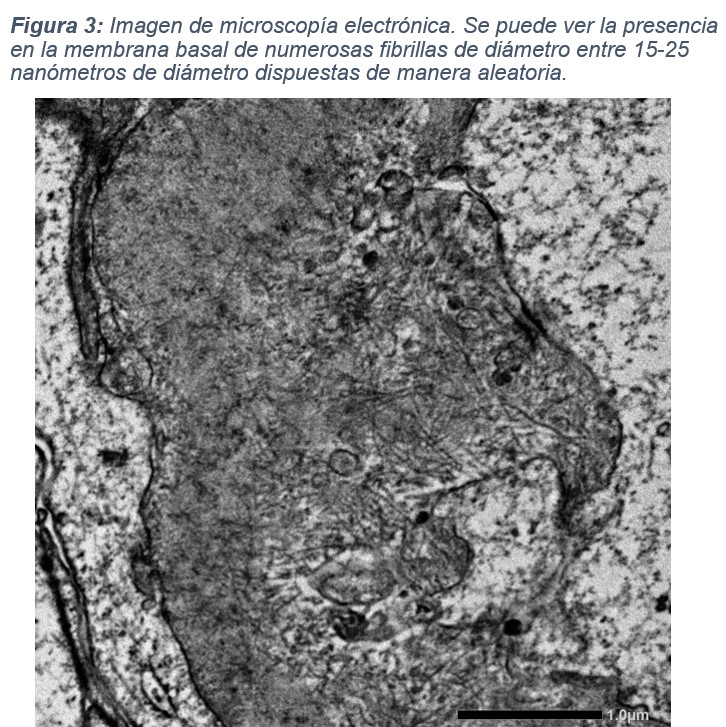
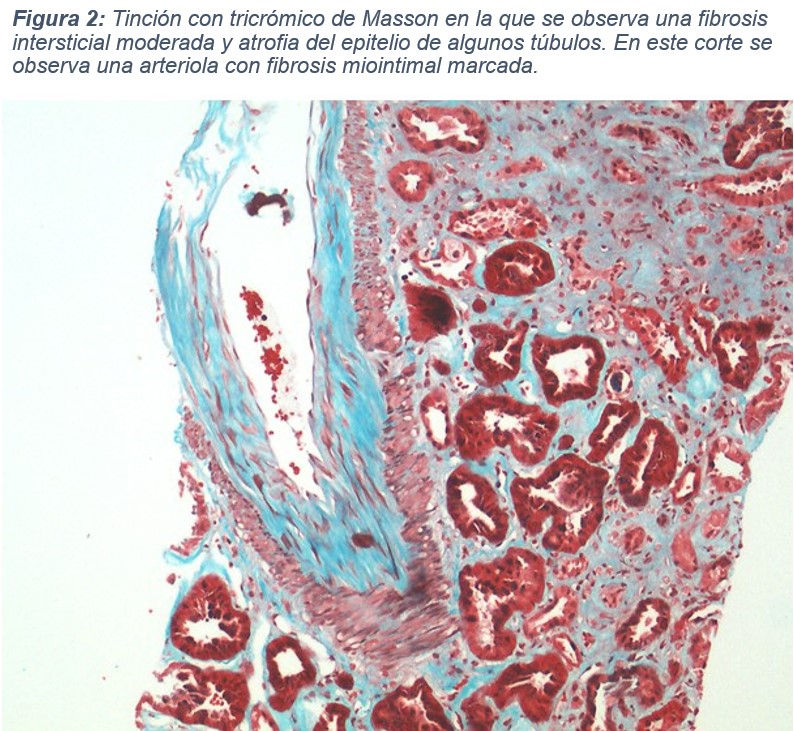
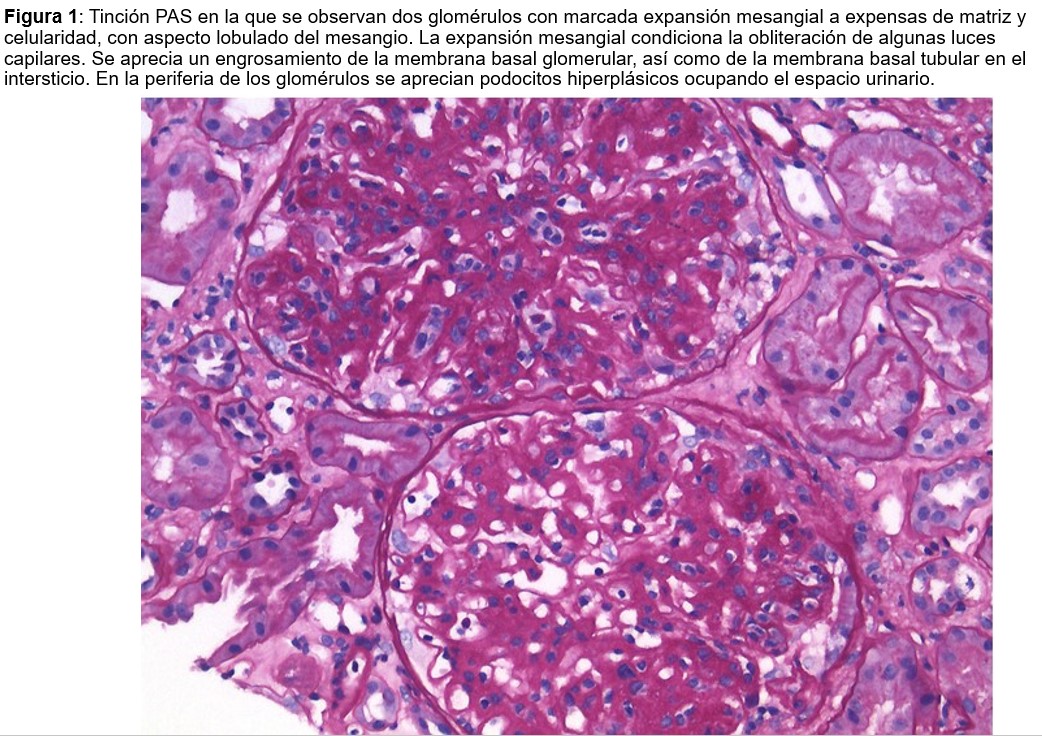
Con estos datos se decidió realizar una biopsia renal. En la muestra se obtienen 23 glomérulos para la microscopía óptica, 4 de ellos esclerosados (índice de esclerosis 17,4 %). No se observa celularidad extracapilar ni semilunas. En algunos glomérulos se visualizan nódulos escleróticos en la periferia, adheridos a la cápsula de Bowman, junto a marcada hiperplasia podocitaria. Hay un aumento del mesangio a expensas de la matriz mesangial. Las asas glomerulares presentan membranas basales engrosadas con ondulación y corrugación marcadas. En el intersticio se observa fibrosis y áreas de atrofia tubular, junto con infiltrado inflamatorio compuesto principalmente por linfocitos y, ocasionalmente, eosinófilos. También se aprecia engrosamiento de la membrana basal tubular. Las estructuras vasculares presentan fibrosis miointimal marcada. La técnica de Rojo Congo fue negativa. En cuanto a la inmunofluorescencia, se observa escaso depósito granular en asas y mesangio de IgM (+/+++) con el resto del estudio negativo. Se solicitó microscopía electrónica, en la que se informa ondulación y engrosamiento de la membrana basal glomerular con zonas de rotura y colapso de algunas asas capilares, asociando borramiento de procesos podocitarios. Con estos datos se informa un diagnóstico de enfermedad renovascular hipertensiva con extensa afectación glomerular.
La evolución del paciente fue mala en los meses siguientes, pese a la optimización del tratamiento antiproteinúrico, con aumento progresivo de la proteinuria hasta 17.351 mg/24 h, deterioro de la función renal con Cr de 2,44 mg/dL y hematuria en torno a 50–100 hematíes por campo. Dado que la clínica y evolución no eran congruentes con el diagnóstico histológico, se solicitó una segunda valoración en un centro externo. Allí se repitió la biopsia renal y se realizó espectrometría de masas, que mostró un depósito significativo de cadenas ligeras kappa.
Este hallazgo nos llevó a plantear como diagnóstico diferencial una enfermedad por depósito secundaria a una patología hematológica, si bien la elevación de cadenas ligeras en la analítica era muy leve y el cociente estaba en rango de normalidad.
Tras consultar con Hematología, se realizó una biopsia de médula ósea y, ante la mala evolución renal, se decidió iniciar tratamiento empírico con ciclofosfamida, bortezomib y dexametasona, aunque sólo se administró un ciclo. La biopsia de médula ósea no mostró alteraciones.
En este centro externo se repitió la biopsia renal, con hallazgos en la microscopía óptica similares a los de la primera biopsia, con patrón membranoproliferativo y escasa expresión en la inmunofluorescencia. Sin embargo, en esta ocasión se solicitó inmunohistoquímica para DNAJB9, que resultó positiva, permitiendo llegar finalmente al diagnóstico de glomerulonefritis fibrilar primaria. Tras este resultado, se revisaron de nuevo las imágenes de microscopía electrónica obtenidas en la primera biopsia, y en esta ocasión sí se pudieron identificar depósitos de fibrillas dispuestas aleatoriamente en la membrana basal glomerular.
A partir de una revisión bibliográfica se encontraron algunas series de casos que utilizan como tratamiento ciclofosfamida o rituximab (1). Se decidió iniciar tratamiento con rituximab, sin observarse respuesta clínica a los 6 meses. El paciente presentó un empeoramiento progresivo de la función renal, iniciando diálisis peritoneal en menos de un año desde su primera visita.
DISCUSIÓN
Nos encontramos ante una glomerulonefritis fibrilar con evolución clínica agresiva, cuyo diagnóstico fue complicado debido a la dificultad en la interpretación de la muestra histológica. Un dato atípico fue la inmunofluorescencia: habitualmente en esta entidad hay positividad intensa para IgG, C3, kappa y lambda, ya que las fibrillas están compuestas por un conglomerado de antígenos y anticuerpos. Sin embargo, en nuestro caso solo se observó positividad débil para IgM y cadenas ligeras kappa y lambda. Esta inmunofluorescencia poco expresiva, junto con la fibrosis miointimal marcada, fue lo que llevó a informar el caso inicialmente como una enfermedad renovascular hipertensiva.
No nos conformamos con este diagnóstico histológico por varios motivos. La presentación clínica y la evolución no son las habituales en una HTA, que en nuestro paciente no presentaba cifras elevadas ni mal controladas (oscilaba entre 130–150 mmHg de tensión sistólica). La proteinuria también era excesiva para atribuirla únicamente a la HTA. Tampoco parecía encajar el patrón membranoproliferativo descrito en la biopsia renal. Estas incongruencias nos motivaron a solicitar una segunda valoración para llegar al diagnóstico correcto. La posibilidad de utilizar la inmunohistoquímica para DNAJB9 ha supuesto un gran avance en el diagnóstico de esta entidad.
A pesar de que el patrón membranoproliferativo en la histología suele asociarse a un pronóstico intermedio, nuestro paciente tuvo una mala evolución, con pérdida completa de función renal en menos de un año e inicio de diálisis peritoneal. No se obtuvo respuesta a ninguno de los tratamientos administrados.
Este caso pone de manifiesto la importancia de reconsiderar el diagnóstico cuando existe discrepancia entre la clínica y los hallazgos histológicos de una biopsia renal. En tales situaciones, es fundamental ampliar el estudio para descartar otras patologías que puedan explicar el cuadro clínico. Para ello, el nefrólogo clínico debe contar con una formación básica en histología glomerular que le permita interpretar de forma crítica los distintos componentes de la biopsia, y no limitarse únicamente a la impresión diagnóstica inicial.
BIBLIOGRAFÍA
1. Rosenstock JL, Markowitz GS. Fibrillary glomerulonephritis: An update. Kidney Int Rep. 2019;4(7):917–22. Disponible en: http://dx.doi.org/10.1016/j.ekir.2019.04.013