Enfermedad Renal Crónica en la Diabetes Mellitus: Albuminuria y Progresión
INTRODUCCIÓN
Hasta en un tercio de las personas afectas de diabetes mellitus (DM) desarrollaran enfermedad renal crónica (ERC) a lo largo de su vida. La ERC se define como la pérdida de función renal alcanzando un filtrado glomerular estimado (FGe) 30 mg/ml y/o cociente albúmina/creatinina en orina (CAC≥30 mg/g)) [1]. El diagnóstico de esta patología es habitualmente clínico y en raras ocasiones suele confirmarse mediante biopsia renal. Por otra parte, el término nefropatía diabética se debería reservar a aquellos casos con afectación renal diabética confirmada histológicamente [1].
La historia natural evolutiva de la ERC en la DM se ha descrito tradicionalmente en los pacientes con diabetes tipo 1 en los que el diagnóstico de diabetes precede al desarrollo de la propia enfermedad renal. Así, se describe una fase subclínica inicial de hiperfiltración que se sigue de una pérdida leve-moderada de albumina (CAC 30-300 mg/g). A medida que la nefropatía progresa, las pérdidas de albumina se hacen más evidentes hasta desarrollar una albuminuria franca (CAC >300 mg/g) que se sigue de una pérdida progresiva del filtrado glomerular. Sin embargo, la experiencia ha demostrado que este modelo de progresión no es aplicable a personas con DM tipo 2, en los que a veces el diagnóstico de la diabetes puede ser simultáneo a la ERC, e incluso es de interés mencionar que algunos casos de DM tipo 1 no siguen este curso [2]. Así, un porcentaje considerable de personas afectas de DM tienen ERC sin albuminuria [3]. Además, se sabe que la presencia de albuminuria es reversible y que se puede ver modificada por otros muchos factores que convergen en las personas con DM como el propio control glucémico, la presión arterial, la dislipemia o el uso de determinados fármacos como los inhibidores del enzima conversor de angiotensina (IECA), los antagonistas del receptor de angiotensina tipo 2 (ARA2) o inhibidores del co-transportador de sodio glucosa tipo 2 (iSGLT2) [3][4].
ALBUMINURIA (Fisiopatología, Mecanismos en la diabetes)
La albuminuria se define como la pérdida de albumina en orina. Se trata de un hallazgo común a muchas patologías renales. El rango de excreción de albumina es altamente variable, siendo tradicionalmente considerado patológico un CAC >30mg/g. La albuminuria puede oscilar desde la pérdida de escasos miligramos a la pérdida franca de gramos de albumina en orina de 24 horas. Una baja excreción de albumina entre 30-300 mg/g por CAC o entre 30-300 mg en orina de 24 horas era clásicamente conocida como microalbuminuria. Este término está en desuso, ya que puede inducir a pensar que la albumina excretada es de menor tamaño, cuando no es así. Asimismo, una mayor pérdida de albumina superando los 300 mg/g era denominada macroalbuminuria. Actualmente se recomienda abandonar estos términos y emplear aquellos propuestos por las guías KDIGO para la ERC que clasifican la albuminuria en: albuminuria 1(A1) (<30 mg/g), albuminuria 2 (A2) (30-300 mg/g) y albuminuria A3 (>300 mg/g) [5].
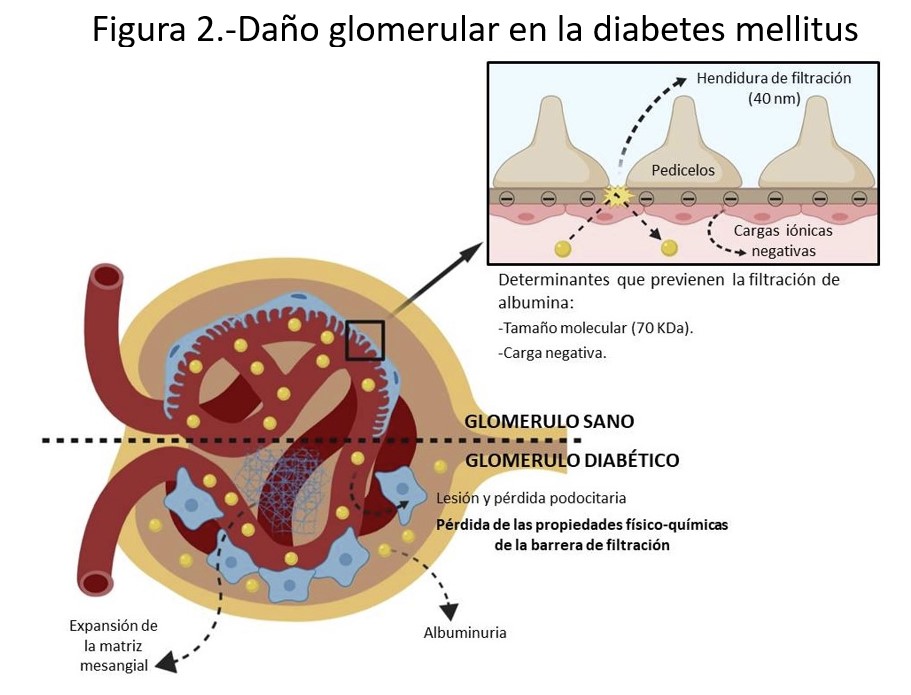
La hiperglucemia crónica secundaria a la diabetes es el eje etiopatogénico de los procesos que conducirán tanto al desarrollo de albuminuria como a la pérdida del filtrado glomerular y enfermedad renal terminal (Figura 1). Las vías que contribuyen a la aparición de ERC en la DM pueden clasificarse en dos grandes grupos: hemodinámica y metabólica [6]. La exposición de las células a niveles altos de glucosa estimula la cadena de respiración mitocondrial y favorece la formación de radicales libres de oxígeno, aumentando así el estrés oxidativo [2]. Además, la hiperglucemia facilita la glicosilación no enzimática de otras moléculas intracelulares como proteínas, lípidos o ácidos nucleicos dando lugar a la aparición de los denominados productos de glicosilación avanzada (AGEs). Los AGEs estimulan a su vez una serie de vías inflamatorias y profibróticas como el TFG-β1 o el NF-κB que conducen al aumento de la matriz extracelular y fibrosis renal. Igualmente, otro de los efectos de la hiperglucemia sobre la arquitectura glomerular es la pérdida de glucosaminoglicanos de la membrana basal glomerular, lo que reduce la carga negativa de esta última, que es necesaria para mantener moléculas electronegativas como las proteínas en el interior del compartimento plasmático.
En cuanto a la vía hemodinámica, la glucosuria secundaria a la hiperglucemia aumenta la reabsorción tanto de glucosa como de sodio a nivel tubular proximal, lo que disminuye el débito de este último al túbulo contorneado distal y activa la mácula densa. La activación de la mácula densa estimula el eje renina-angiotensina-aldosterona (RAA) que a su vez produce una vasoconstricción de la arteriola eferente y aumenta la presión intraglomerular. La activación del eje RAA, unida a otros factores, también facilitan la aparición de hipertensión sistémica, que incrementa el riesgo de progresión de la ERC.
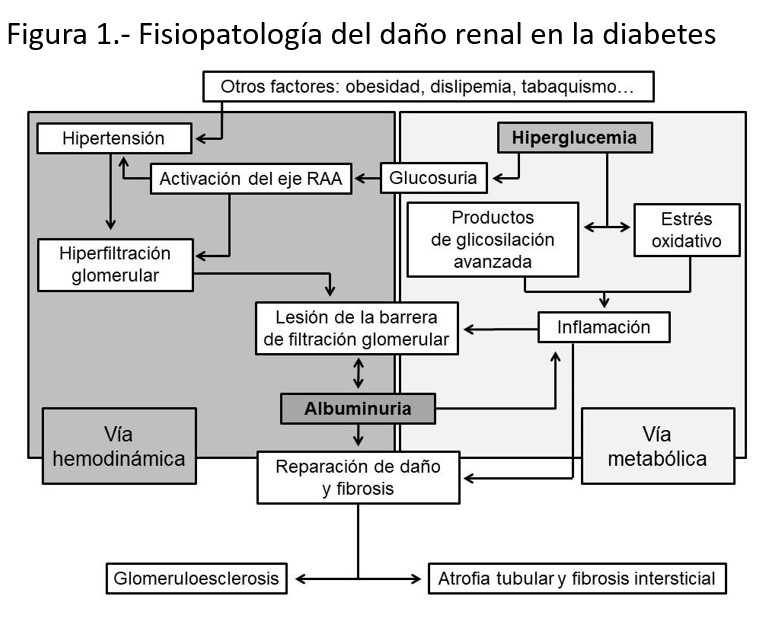
La convergencia de ambas vías patogénicas sobre el glomérulo termina dañando tanto a células endoteliales como a podocitos (células glomerulares epiteliales) y altera las propiedades de la membrana basal glomerular. Los cambios patológicos alteran las hendiduras de filtración y el daño sostenido puede incluso condicionar el despegamiento y pérdida de los podocitos del epitelio visceral [2]. Todo ello contribuye a la alteración de las características físico-químicas de la barrera de filtración glomerular. La albumina sérica tanto por su peso molecular (próximo a los 70 kDa) como por su carga iónica negativa queda confinada al espacio plasmático, ya que el tamaño y la electronegatividad no le permiten atravesar las hendiduras de filtración. Así, la membrana basal glomerular pierde las cargas iónicas negativas y tanto la lesión endotelial como podocitaria condicionan un aumento del tamaño de los poros, por lo que se pierde la selectividad del filtrado glomerular y permitiendo el paso de la albumina a la orina (Figura 2).
ALBUMINURIA y ENFERMEDAD CARDIOVASCULAR EN LA ENFERMEDAD RENAL CRÓNICA POR DIABETES MELLITUS
La albuminuria es un factor de riesgo independiente asociado a la enfermedad cardiovascular (CV). Así, pacientes con una excreción nula o despreciable de albumina tienen un menor riesgo CV que aquellos con una pérdida franca de albumina en orina [7]. El riesgo incrementa a medida que aumentan las pérdidas de albumina en orina y no sólo se limita a personas con patologías como la hipertensión o la diabetes, sino que en individuos aparentemente sanos que presentan pérdidas leves de albumina, ese riesgo también está incrementado [7]. Diferentes estudios como el PREVEND (Prevention of Renal and Vascular End Stage Disease), el HUNT (Nord-Trøndelag Health Study) o el MONICA (Monitoring Trends and Determinants of Cardiovascular Diseases) [8][9][10] han demostrado que la albuminuria es un factor de riesgo tanto de mortalidad por cualquier causa como de mortalidad CV y que es independiente de otros factores de riesgo CV ya conocidos. Además, estos estudios junto con otros como el de Klausen y cols. [11] pusieron en evidencia que cualquier pérdida de albumina, incluso valores urinarios inferiores a los considerados patológicos y en pacientes sin enfermedad evidente, ya se asocia a un incremento del riesgo CV. Ello convierte la excreción urinaria de albumina en un marcador continuo de riesgo CV, incrementando este último de forma proporcional a la albuminuria y sin límite inferior para la ausencia de riesgo.
La enfermedad renal, y la albuminuria como uno de los marcadores de esta última, están de hecho más asociadas al incremento del riesgo CV que la propia diabetes. En un estudio publicado por Afkarian y cols. donde analizan 15.046 pacientes de la población general estadounidense, la diabetes sin enfermedad renal y ajustada por edad, sexo y raza presentaron un incremento del riesgo absoluto de mortalidad CV del 4,1% respecto a la población de referencia. En personas con diabetes y albuminuria se observó un incremento de la mortalidad CV del 17,8%. La presencia de diabetes y alteración del FGe conllevó un incremento de la mortalidad CV del 23,9%. Es de interés mencionar que las personas afectas de diabetes con ambas alteraciones renales (albuminuria y alteración del FGe) presentaron un incremento de la mortalidad CV a los 10 años del 47%, un dato en nuestra opinión escandaloso, demostrando el elevado riesgo CV de los pacientes diabéticos con ERC [12]. Ello demuestra que el incremento del riesgo CV en población con diabetes se concentra fundamentalmente en aquellos que asocian ERC (CAC >30 mg/g o FGe <60 mL/min/m2), presentando más posibilidades de morir a lo largo de su evolución que de alcanzar la terapia renal sustitutiva [13]. Dichos resultados indican que las personas con DM y ERC precisan de un control exhaustivo de los factores de riesgo CV asociados.
ALBUMINURIA y PROGRESIÓN DE LA ENFERMEDAD RENAL CRÓNICA
Del mismo modo que la albuminuria se considera un factor de riesgo independiente asociado al incremento de la morbi-mortalidad CV, ésta también se ha relacionado con la progresión de la ERC en estudios realizados en diferentes poblaciones [14]. Se ha identificado como un factor de riesgo independiente y su presencia, especialmente con CAC superiores a 300 mg/g, implica una elevada probabilidad de progresión de la ERC. En individuos sanos, a partir de los 40 años se observa una disminución anual de FGe de 1 ml/min/1,73 m2. De hecho, la albuminuria es el marcador más fuertemente asociado a la pérdida de FGe anual: en casos con CAC >300mg/g la pérdida de filtrado anual es de 3 ml/min/1.73m2, mayor que respecto a la población diabética de referencia [15]. Así, personas con ERC y DM establecida pueden llegar a tener pérdidas de filtrado glomerular anuales de entre 10-20 ml/min/1.73m2 y alcanzar la enfermedad renal crónica terminal (ERCT) en menos de 7-8 años. En otro estudio realizado por Elley y cols. utilizando la New Zealand Diabetes Cohort Study comprobaron que el grado de albuminuria, la creatinina sérica, la etnia o la enfermedad cardiovascular previa eran importantes marcadores del futuro desarrollo de ERCT y la adición de esos 4 factores permitían crear modelos de predicción bastante precisos [16].
Estudios clásicos describieron que la albuminuria no solo incrementa el riesgo de pérdida de función renal, sino que también comporta una mayor probabilidad de evolucionar a un estadio avanzado de la ERC en los siguientes años tanto en personas con DM tipo 1 como tipo 2. Una persona sin albuminuria tiene una menor probabilidad de progresar a un estadio A2 (CAC 30-300 mg/g) que otro individuo que ya tiene albuminuria A2 progrese a un estadio A3. Del mismo modo, la población con albuminuria establecida A3 (CAC >300mg/g) tienen un mayor riesgo de pérdida de función renal y elevación de la creatinina plasmática que aquellos que no tienen albuminuria [13]. El modelo fue clásicamente descrito en la diabetes tipo 1 por Mogensen y cols. quienes describieron que en un periodo de 7-14 años sólo un 13-14% de personas sin albuminuria previa evolucionaba a un estadio A2, mientras que casi un 85% de pacientes con microalbuminuria (A2) habían desarrollado albuminuria establecida (A3) [17]. Este riesgo de progresión en base a la albuminuria es más reproducible en la DM tipo 1 que en la DM tipo 2, donde la variabilidad aumenta según las cohortes o poblaciones estudiadas. Así, en la población británica del UKPDS con diabetes tipo 2, aproximadamente un 11% desarrollaban microalbuminuria a los 6 años y un 13,7% a los 8 años [13], mientras que en otro estudio realizado en el Steno Diabetes Center (Dinamarca), más de un 20% habían desarrollado microalbuminuria al cabo de 5 años [18]. Dicha variabilidad probablemente se deba a otros factores que ya hemos descrito que influyen en la ERC en la DM como la etnia, la comorbilidad CV previa o el control glucémico y de presión arterial. Además, es menos probable que una persona diabética sin albuminuria previa progrese directamente a la pérdida de función renal y elevación de la creatinina sérica [13], aunque en diferentes series sí se han descrito frecuentes casos de ERC diabética no proteinúrica [19][20][21][22]. Por último, es importante destacar que al mismo tiempo que el desarrollo de albuminuria aumenta el riesgo de progresión de la ERC también aumenta el riesgo de mortalidad, siendo el incremento de este último mayor que el propio riesgo de progresión de la ERC. De este modo, tal y como se indica en el apartado anterior, las personas con DM y albuminuria A3 o/y disminución del FGe establecida tienen un mayor riesgo de fallecer que de alcanzar la ERCT [13].
VÍAS DE PROGRESIÓN de la ERC NO-PROTEINÚRICA EN LA DM
Se mencionaba en la introducción, que el paradigma aceptado desde los años 80 que clasificaba la diabetes en estadios de albuminuria previos al desarrollo de insuficiencia renal, no es siempre es reproducible en todas las personas con ERC y DM. Esta situación es especialmente evidente en diabéticos tipo 2 en los que se ha observado una gran variabilidad entre poblaciones y en los que la pérdida de filtrado glomerular y aumento de creatinina sérica puede desarrollarse incluso en ausencia de proteinuria [23]. Hasta la fecha, numerosos estudios de prevalencia y longitudinales han puesto en evidencia que aproximadamente entre un 20-50% de los pacientes con ERC y FG < 60 ml/min/1.73m2 no tienen albuminuria previa [19][20][21][22]. Ello reduce la utilidad de la albuminuria como marcador de progresión de la ERC y nos obliga a recordar que muchas personas con diabetes tipo 2 y ERC pueden progresar a la insuficiencia renal, aún en ausencia de proteinuria. Asimismo, la retinopatía que también ha sido otro signo clásico que precedía al desarrollo de ERC que no siempre está presente y es menos frecuente en pacientes con insuficiencia renal de causa diabética no-proteinúrica. En el estudio italiano RIACE (Renal Insufficiency And Cardiovascular Events) entre los pacientes con ERC (FG < 60 ml/min/1.73m2) sólo un 10% de los no-proteinúricos tenían retinopatía, mientras que un 22% de los pacientes con IRC más albuminuria A2 o A3 tenían proteinuria [21] En esta misma línea, se ha evidenciado en una cohorte multicéntrica española de personas con DM y ERC biopsiada, que aquellas afectas retinopatía y ERC tienen peor pronóstico renal, tanto en la nefropatía diabética como no-diabética [23].
Estudios recientes del grupo de Porrini y cols. demuestran que las personas con diabetes tipo 2 sin albuminuria presentan un elevado riesgo de progresión de la función renal por mecanismos independientes a la albuminuria y desconocidos en la actualidad que quizás podrían tener relación con mecanismos inflamatorios y lesiones a nivel del túbulo renal proximal, mediante la alteración del feedback túbulo glomerular [24]. Algunos de los factores que influyen sobre la variabilidad en la albuminuria y la progresión de la ERC en diabetes tipos 2 se han descrito a lo largo del texto. El sexo femenino, que en otras formas de ERC parece ejercer un efecto protector, se ha identificado como factor de riesgo independiente en la ERC de causa diabética. Además, en las mujeres parece que la ERC no-proteinúrica es más frecuente que en los hombres [24]. La etnia también es otro factor importante en el riesgo de desarrollo de la ERC en la DM y en su forma de presentación. De esta forma, la población coreana tiene una mayor prevalencia de albuminuria A2, mientras que la filipina tiene un mayor riesgo de presentar albuminuria A3 [25]. Del mismo modo, poblaciones de las islas del Pacífico tienen un mayor riesgo de progresión de la ERC [16] y esta variabilidad es evidente para cada etnia. La comorbilidad CV previa y los factores clásicos de riesgo CV influyen también en una más rápida progresión de la ERC que en muchos casos puede acontecer sin la presencia de proteinuria [24]. Así, aún en ausencia de albuminuria, la obesidad, la hipertrigliceridemia o el mal control de presión arterial o glucosa sanguínea, deben alertarnos del incremento del riesgo CV, progresión de ERD y mortalidad a la que está expuesto ese paciente.
En cuanto al tratamiento, el bloqueo del sistema renina-angiotensina, tanto los IECAs como los ARA2s han demostrado prevenir la progresión de la ERC y el desarrollo de albuminuria franca [26], por lo que actualmente son considerados un pilar terapéutico fundamental en pacientes con dicha patología. Ello hace que en muchos de los estudios longitudinales o de prevalencia sobre ERC su uso supere el 60-70%, pudiendo enmascarar la proteinuria real. De este modo, los IECAs y ARA2s sobrestimarían el número de pacientes con FG < 60 ml/min/1,73m2 y ausencia de albuminuria durante su evolución. No obstante, algunos estudios siguen sin encontrar diferencias en la distribución de la albuminuria incluso cuando retiran a los pacientes en tratamiento con IECA o ARA de los subanálisis [19]. También se observa que, pese a que disminuyen la progresión a peores estadios de albuminuria, su efecto protector en la ERC no-proteinúrica es más discutido. En un estudio que combinaba los resultados de los ensayos clínicos BENEDICT-B y DEMAND y que evaluaban la protección ejercida por el trandolapril y el delapril respectivamente en personas con diabetes tipo 2 con albuminuria A1 o A2, se objetivó que el uso de estos dos IECA no reducía la pérdida de filtrado glomerular independientemente del estadio de albuminuria [27]. Sin embargo, sí se observó en este estudio que los casos que no veían reducida su situación de hiperfiltración en los primeros 6 meses de seguimiento tenían peor pronóstico que aquellos en los que la hiperfiltración se controlaba al inicio del seguimiento. Además, la mejoría de la hiperfiltración en los 6 primeros meses se asoció significativamente a un mejor control de la presión arterial y de la glucemia, pero no al uso de IECAs o al estadio de albuminuria [27]. La aparición de los iSGLT2 ha representado un gran avance en la protección cardiorrenal en la ERC en los últimos años. La inhibición del cotransportador SGLT2 conlleva un aumento de la excreción urinaria de glucosa, disminuyendo la hiperglucemia a la vez que la hiperfiltración. Así, se ha evidenciado que el uso de SGLT2i en población con DM y ERC ha reducido la progresión de la enfermedad renal además de reducir la mortalidad y la aparición de eventos cardiovasculares [28] Más adelante, se demostró que el uso de estos en los pacientes con ERC y DM con o sin albuminuria, aportaba beneficios de protección cardiorrenal [29] [30]. Por todo ello, se consideran fármacos de primera elección para el tratamiento de la DM en personas con una función renal con un FGe >20 mL/min/m2 [31] [32]. Los análogos del péptido similar al glucagón-1 (GLP-1a) intervienen en la inflamación renal en la ERC existente, descrita previamente. En diversos ensayos clínicos se ha demostrado que el uso de GLP-1a redujo los eventos cardiovasculares y la mortalidad en población afecta de DM [33] [34] [35]. Además, el uso de dichos fármacos se asocia a pérdidas de peso significativas, con lo cual contribuyen al importante control metabólico en personas con DM. Recientemente, en el estudio FLOW se incluyeron pacientes con DM y ERC (FGe de 25-75 ml/min/1,73 m2 y albuminuria de 100-5.000 mg/g) se demostró que el uso de GLP-1a disminuyó los eventos renales, así como la mortalidad cardiovascular [36]. Por último, en aquellas personas afectas de DM y ERC con albuminuria, el uso de antagonistas no esteroideos del receptor mineralocorticoide (finerenona), inhibiendo la expresión de factores profibróticos y proinflamatorios, ha demostrado eficacia clínica en la reducción del deterioro de función renal [37] [38] [39].
ROL DEL COMPLEMENTO EN LA PROGRESIÓN DE LA ENFERMEDAD RENAL CRÓNICA Y DIABETES MELLITUS
Existe evidencia reciente publicada de la implicación de la vía del complemento en la progresión de la ERC en la DM. Mediante análisis con espectrometría de masas dirigida y no dirigida en cohortes de individuos con nefropatía diabética biopsiada, se observó a nivel urinario un aumento de algunos inhibidores del complemento (p. ej., factor H del complemento, clusterina y factor I del complemento) y una disminución de otros (p. ej., CD55 y CD59) en los pacientes con progresión rápida. El aumento de los inhibidores del complemento puede sugerir una respuesta compensatoria a una vía del complemento activada, lo que podría indicar un mecanismo regulador inadecuado que no es suficiente para contrarrestar la activación de la vía del complemento [40]. Así pues, estos hallazgos podrían ser el inicio para la búsqueda de biomarcadores de progresión y posibles dianas terapéuticas futuras.
COMENTARIO FINAL
La ERC en la DM es una patología clásicamente asociada a la aparición inicial de albuminuria y posterior deterioro de la función renal al cabo de años. El modelo secuencial de albuminuria A2 que incrementa hasta un estadio A3 y finalmente se asocia a un aumento de la creatinina sérica, es habitualmente constante en personas con DM tipo 1 pero presenta una mayor variabilidad en la DM tipo 2, donde la influencia de otros factores y comorbilidades (sexo, etnia, patología CV previa, hipertensión, control glucémico, obesidad o dislipemia) es evidente. Por tanto, es frecuente encontrar individuos con ERC y sin albuminuria, se asocian a un mayor riesgo de progresión de la ERC, pero este incremento de riesgo es menor respecto al incremento de mortalidad que supone progresar a una albuminuria franca (estadio A3). Finalmente, es importante recordar que existe un fenotipo de ERC en la DM no-proteinúrico e influido por los muchos factores que convergen en la DM. Por ello, es importante recordar que individuos que acumulan factores de riesgo CV clásicos como hipertensión, mal control de la glucosa sanguínea, obesidad o dislipemia, a pesar de que no manifiesten albuminuria o retinopatía, pueden estar expuestos al mismo riesgo de mortalidad y progresión de la ERD que pacientes con albuminuria establecida. Afortunadamente, disponemos de nuevos fármacos para el abordaje de la ERC en la DM que actúan sobre las vías de progresión renal. Por ello, es de suma importancia su utilización en esta población dado que se mejora su pronóstico renal y vital.