Clínica y Anatomía Patológica de la Nefropatía Diabética
1.- CLÍNICA DE LA ENFERMEDAD RENAL CRÓNICA EN LA DIABETES
Introducción
El desarrollo de enfermedad renal crónica (ERC) forma parte de las complicaciones microangiopáticas de la diabetes mellitus (DM). La microangiopatía diabética es la afectación de los pequeños vasos (arteriolas, capilares y vénulas) en la DM y contribuye a cambios patológicos y lesión de múltiples órganos y tejidos produciendo nefropatía, retinopatía y neuropatía.
En la actualidad, un total de 589 millones de personas están afectas de DM y se estima que en el año 2050 la cifra aumente a 853 millones [1]. La nefropatía diabética se desarrolla en aproximadamente el 30% de los pacientes con diabetes mellitus tipo 1 (DM1) y el 40% de los pacientes con diabetes mellitus tipo 2 (DM2). La DM supone la primera causa de enfermedad renal crónica y enfermedad renal terminal en el mundo, siendo la DM2 responsable de más del 90%. Ello da una idea acerca del enorme problema de salud que supone la afectación renal en la DM, especialmente en la DM2 [2].
La afectación renal de la diabetes inicia desde etapas tempranas y es crucial la detección precoz para poder actuar mediante estrategias y herramientas terapéuticas adecuadas para su prevención tratamiento.
Terminología
La ERC asociada a la DM es un síndrome clínico caracterizado por reducción progresiva del filtrado glomerular estimado (FGe <60 mL/min/1,73 m2) y/o cociente albúmina/creatinina en orina (≥30 mg/g), El término de "nefropatía diabética" se utiliza en los casos en los que hay constatación histológica de DM en la biopsia renal [3]. Si se dispone de un diagnóstico histológico, diferente de la DM, la afectación renal será definida como nefropatía no-diabética.
Detección de la ERC en la DM
La aparición de síntomas en órganos diana de la DM y de la ERC es tardía por lo que el diagnóstico se basará en la detección de albuminuria, mediante el cociente albúmina/creatinina (CAC) en una muestra de orina aislada, o disminución del FGe (preferiblemente CKD-EPI). La combinación de las dos variables, (FGe y el CAC en orina) han sido utilizadas por las guías KDIGO (Kidney Disease: Improving Global Outcomes) para establecer una tabla de riesgo en la que se incluye el de la mortalidad global, la mortalidad CV, el inicio de terapia sustitutiva renal, la insuficiencia renal aguda y la progresión renal [4] Las primeras manifestaciones de la ERC se detectarán a través de estos parámetros, pero es importante considerar que no siempre seguirán el patrón clásico de la DM tipo 1 de albuminuria, con progresión a proteinuria y posterior descenso del FGe.
Prevalencia de ERC asociada a la DM
En el estudio NHANES la prevalencia de ERC en población con diabetes (FGe menor 60 ml/min/1,73 m2 o CAC > 30 mg/g) fue del 25%, FGe < 60 ml/min/1,73m2: 12%, CAC > 30 mg/g: 16% y proteinuria (> 300mg/g) de 4,6%. En nuestro país, en el estudio PERCEDIME2, los porcentajes fueron: 27,9%, 18%, 13% y 2,4% respectivamente.
Progresión, regresión y remisión de la ERC en la DM
Se considera progresión de la enfermedad renal en el momento en el que la tasa de FGe disminuye > 5 ml/min/año. También se considera progresión a ERC establecida cuando el paciente presenta proteinuria (CAC > 300 mg/g). Los pacientes que presentan progresión de la ERC son aquellos con mayor probabilidad de requerir terapia sustitutiva renal.
El estudio UKPDS ofreció una oportunidad para observar la historia natural de la ERC en individuos con DM2 desde las primeras etapas de la evolución de la enfermedad. De las personas incluidas, aproximadamente el 2% por año progresó de grado A1 a A2 de albuminuria y de A2 a A3. A una mediana de 15 años después del diagnóstico, el 40% de los participantes desarrollaron albuminuria y el 30% duplicó la creatinina sérica o alcanzó un FGe< 60 ml/min/1,73 m2. Cabe destacar que el 60% de los que desarrollaron disminución del FGe no presentaban previamente albuminuria y el 40% nunca desarrolló albuminuria durante el estudio [5].
La remisión y progresión de la ERC son nuevos términos a tener en cuenta. Se define remisión de la ERC cuando la albuminuria desciende por debajo de 300 mg/g en dos determinaciones consecutivas. Es importante considerar la variabilidad de la proteinuria intrapersonal [4], por ello se requiere confirmación con una segunda muestra tal y como se realiza en los ensayos clínicos. Se considera regresión de la ERC cuando se alcanza la normalización en la tasa de disminución de FGe < 1 ml/min/año durante todo el período de observación, equivalente al proceso de envejecimiento natural en personas no afectas de diabetes sin enfermedad renal. Los individuos que consiguen tanto remisión como regresión tienen menos probabilidad de evolucionar hacia la enfermedad renal terminal [6].
Un análisis del estudio Steno-2 mostró que el 31% de los DM2 con albuminuria grado A2 progresaron a A3, mientras que el 31% regresó a grado A1 durante 7,8 años de seguimiento. El 38% permaneció con microalbuminuria durante este período de tiempo [7].
Los recientes ensayos clínicos con los inhibidores de cotransportador sodio-glucosa tipo 2 (iSGLT2) han mostrado beneficio renal con regresión y remisión de la ERC en un porcentaje considerable de los individuos de los estudios, estando incluso con tratamiento óptimo [8] [9].
Cambios en las formas de presentación de la ERC
La prevalencia de afectación de la ERC en la DM en el estudio UKPDS está cambiando con una evolución fluctuante y no siempre progresiva. Todo ello condicionado por el grado de control de los factores de riesgo que influyen en la evolución de la ERC, por los nuevos fármacos que disponemos que probablemente cambiarán en unos años la evolución de la enfermedad y por el efecto del envejecimiento en la imbricación de lesiones vasculares y nefrotóxicas en el paciente con ERC y DM.
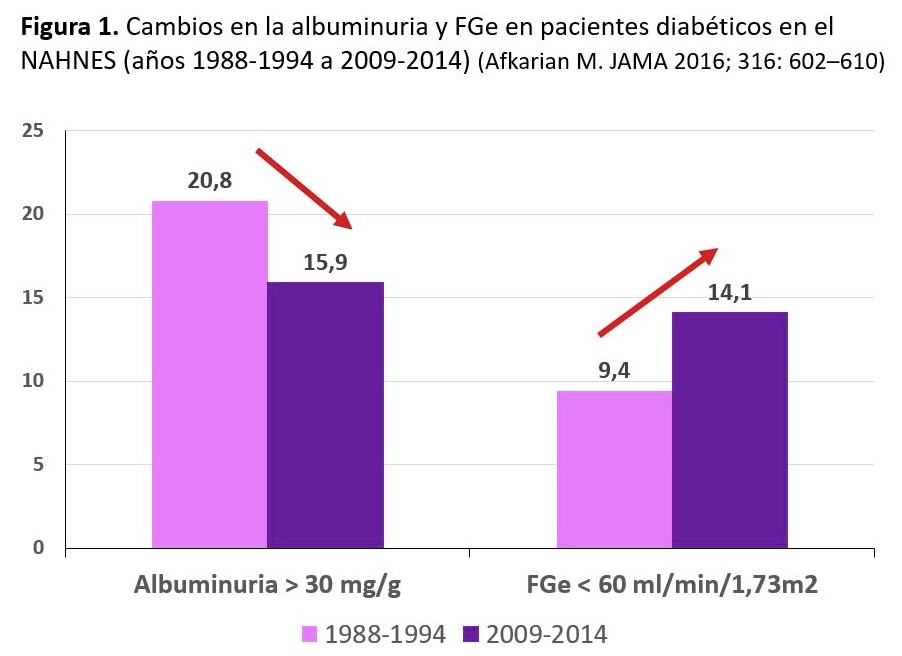
En un análisis de NHANES en el que se comparan las formas de presentación de la ERC en la DM en los periodos 1988-1994, 1999-2004 y 2005-2008 se observa que la prevalencia de la ERC en la población general americana fue del 2,2%, 2,8% y 3,2% en los tres periodos del estudio, pero quizá sea más de interés al cambio de perfil de la ERC en la DM a lo largo de los años, con un descenso en la prevalencia de la albuminuria a lo largo de los años y un aumento en el porcentaje de pacientes con FGe reducido (Figura 1). La prevalencia de la albuminuria como manifestación de la ERC disminuyó del 21% al 16%, el FGe < 60 ml/min/1,73m2 aumentó del 9% al 14%, aumentando los pacientes con FGe < 30 ml/min/1,73m2 del 1% al 3%. El mejor control de la DM2 y de la presión arterial, así como el envejecimiento de la población diabética pueden ser factores que hayan contribuido a estos hallazgos [10] [11].
ERC en la DM no proteinúrica
Aunque la albuminuria y la proteinuria forman parte de la historia natural de la DM1, esta situación no es exactamente así en el curso evolutivo de la nefropatía de la DM2. Los datos de la encuesta NHANES III sugieren que el 30 % de los diabéticos tipo 2 con insuficiencia renal tienen una enfermedad renal no diabética, como lo demuestra la ausencia de albuminuria y retinopatía en este subgrupo [12].
Por otra parte, se ha observado que algunos individuos con DM2 experimentan un deterioro progresivo de la función renal, debido a diabetes, sin desarrollar proteinuria significativa. Esto puede llegar a afectar al 50% de los pacientes con DM2 e insuficiencia renal. En una encuesta de la Federación International de Diabetes y la Sociedad Internacional de Nefrología, se incluyeron alrededor de 30.000 pacientes con DM2 de 33 países, y se observó que la prevalencia de albuminuria grado A1, A2 o A3 fue del 51, el 39 y el 10%, respectivamente [13]. Dichos hallazgos indican una carga sustancial de formas no proteinúricas de daño renal en la DM2.
En los casos sin albuminuria o con albuminuria leve son a menudo personas de edad avanzada que, generalmente, tienen antecedentes de enfermedad cardiovascular. La evolución a la enfermedad renal terminal es más lenta en esta población, aunque los análisis histológicos pueden mostrar lesiones glomerulares sorprendentemente avanzadas [14]. No está claro por qué algunos individuos presentan ERC convencional (con albuminuria grado A3) mientras que otros tienen una disminución más lenta de la función renal asociada con niveles normales de albuminuria o grado A2. Se espera que una nueva clasificación patológica de la nefropatía diabética ayude a comprender estas discrepancias.
En este sentido, los subestudios de los ensayos clínicos pueden ayudar a conocer la implicación de la progresión de la ERC no proteinúrica. En un análisis post hoc del estudio EMPA-REG OUTCOME (empagliflocina vs placebo), se observó que los beneficios renales fueron independientes del fenotipo de ERC (proteinúrico vs no proteinúrico), mostrando un beneficio tanto en el agravamiento de nefropatía (reducción del riesgo del 19%) como en la variable exploratoria compuesta (reducción del FGe del 40%, duplicación de la creatinina sérica o muerte renal), mostrando en este caso una reducción del riesgo en el 60% [15]. El estudio EMPA-KIDNEY, compara la empagliflozina frente a placebo en diabéticos y no diabéticos con FGe entre 20-45 mL/min/1,73 m2, sin necesidad de que presenten albuminuria, o FGe entre 20-45 mL/min/1,73 m2 con albuminuria > 300 mg/g. En el sub-grupo de individuos con un grado A1 de albuminuria, se evidenció un beneficio en el deterioro de función renal a favor del grupo en tratamiento con empagliflozina [16].
¿Cuándo sospechar una nefropatía no diabética en un individuo diabético?
La prevalencia de la DM2 en la población general en nuestro país es muy elevada, mostrando cifras del 13,8% [17], por lo que no es infrecuente que los individuos diabéticos puedan presentar nefropatías no diabéticas. En una serie de biopsias renales realizadas en diabéticos en nuestro país, el 61,8% de los pacientes diabéticos biopsiados presentaban nefropatía diferente a la DM2 [18]. Estos resultados se confirmaron más adelante con la mayor cohorte multicéntrica española, la mayor a nivel europeo de personas afectas de diabetes con biopsia renal. En ella, se evidenció que el 60.4 % eran afectos de nefropatía no-diabética. [19] Obviamente las indicaciones de biopsia renal estaban realizadas en base a una elevada sospecha de otra nefropatía.
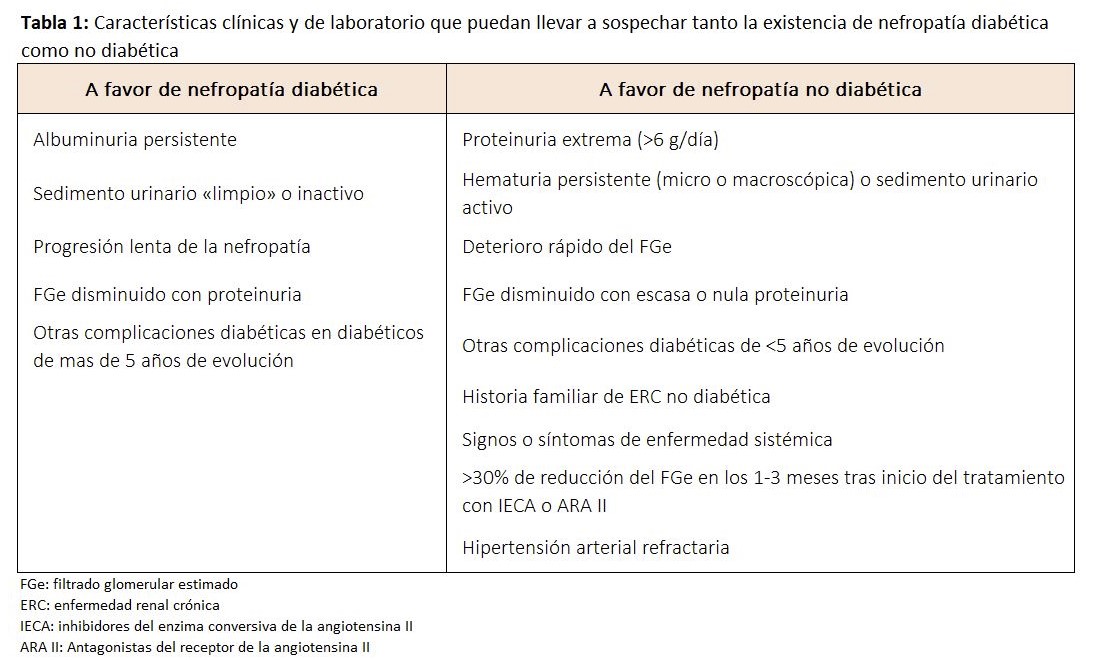
En la (Tabla 1) se muestran algunas características clínicas y de laboratorio que pueden llevar a sospechar tanto la existencia de nefropatía diabética como no diabética como causa de nefropatía, y que requerirían pruebas adicionales y quizá biopsia renal [20].
¿Cuándo realizar una biopsia renal en un paciente con diabetes mellitus?
La biopsia renal en individuos con ERC y DM sirve para el diagnóstico de otras nefropatías no diabéticas, pero también para un mejor conocimiento de la nefropatía diabética y de su pronóstico. Por el contrario, no se debe olvidar los posibles problemas relacionados con la propia biopsia renal en estos pacientes por las posibles complicaciones hemorrágicas, especialmente en pacientes con muchas comorbilidades y tratamientos crónicos antiagregantes o anticoagulantes previos. Afortunadamente los protocolos actuales de trabajo han logrado minimizar las complicaciones postbiopsia renal [21].
Las recomendaciones de realizar una biopsia renal en pacientes diabéticos están fundamentalmente relacionadas con la sospecha de nefropatía no diabética. Es importante identificar a las personas con diabetes afectos de nefropatía no-diabética dado que presentan un mejor pronóstico renal y mayor supervivencia [19]. Las recomendaciones de biopsias renales en individuos diabéticos se podrían resumir en la (Tabla 2) [22] [23].
Manifestaciones clínicas en otros órganos en pacientes con enfermedad renal y diabetes
En este sentido, se han publicado en los últimos años diversos modelos predictivos de nefropatía no –diabética en cohortes con personas afectas de diabetes y biopsia renal con la idea de ayudar a los clínicos a tomar la decisión de realizar biopsia renal en esta población [24] [25]. En dichos modelos predictivos, las variables que se consideraron a la hora de evaluar el riesgo de presentar nefropatía no-diabética son: peor función renal, la presencia de microhematúria, ausencia de retinopatía diabética, mayor edad, tratamiento sin insulina, menor proteinuria, menor tiempo de evolución de la DM y ausencia de vasculopatía periférica. Sin embargo, aún son necesarios más estudios con mayor número de participantes y con validación externa de los mismos.
La DM suele estar asociada a múltiples complicaciones, que en el individuo con ERC son más frecuentes “per se”. Por ello, el nefrólogo debe familiarizarse y conocer la existencia de otras complicaciones clínicas, que frecuentemente deberá manejar o a veces derivar al especialista adecuado. Estas complicaciones se pueden clasificar en:
Enfermedad macrovascular: Relacionada fundamentalmente con la arterioesclerosis y con fuerte impacto en la morbimortalidad del individuo con DM. En esta macroangiopatía se incluye la cardiopatía isquémica, insuficiencia cardiaca, enfermedad cerebrovascular y enfermedad vascular periférica.
Enfermedad microvascular: Además de la nefropatía se incluyen la retinopatía diabética y la neuropatía.
Las manifestaciones de la microangiopatía están vinculadas también a otras lesiones que pueden aparecer en la DM y que es importante tenerlas en cuenta.
Clásicamente se ha descrito un paralelismo en la afectación microangiopática en forma de retinopatía y nefropatía. De hecho, se ha evidenciado que los pacientes afectos de nefropatía diabética en la biopsia renal tenían mayor porcentaje de retinopatía diabética comparados con los que tienen nefropatía no-diabética [19]. Además, se ha demostrado que los individuos diabéticos con ERC biopsiada y retinopatía diabética, tienen peor pronóstico renal. Con lo cual, el hecho de padecer retinopatía diabética confiere mayor carga de complicaciones microvasculares que confieren peor pronóstico renal [26].
Otras manifestaciones clínicas de las complicaciones de la DM que pueden presentarse en el paciente con nefropatía.
Muchas de ellas están relacionadas con la presencia de neuropatía autonómica, ya que ésta está implicada en la función de muchos órganos [27]. Destacamos:
Pie diabético (resultado de la isquemia por vasculopatía periférica, neuropatía o infección)
Disfunción eréctil (en la que están implicados factores metabólicos, isquémicos, neuropáticos, psicológicos y fármacos)
Disfunción esofágica y gastrointestinal (atonía esofágica, gastroparesia, colecistopatía hipotónica, estreñimiento y diarrea): aunque su presentación de forma muy sintomática es poco frecuente, suponen una importante reducción en la calidad de vida del paciente destacando la gastroparesia y las alteraciones de la motilidad del tracto gastrointestinal.
Fallo autonómico relacionado con la hipoglucemia, con falta de respuesta adrenérgica a la hipoglucemia.
Neuropatía autonómica cardiovascular: con hipotensión ortostática, isquemia miocárdica silente e infarto de miocardio indoloro o escasamente sintomático.
Alteraciones óseas: mostrando un aumento en la fragilidad ósea con aumento en la incidencia de fracturas, reducción en la matriz ósea no mineralizada y enfermedad ósea de bajo recambio [28].
Alteraciones cutáneas (infecciones, dermatopatía diabética, necrobiosis lipoídica y lesiones relacionadas con isquemia y vasculopatía periférica).
Anemia en la nefropatía diabética: La anemia es más frecuente y precoz en la ERD que en otras etiologías. Son múltiples los mecanismos patogénicos entre los que destacan una mayor tendencia al sangrado por mayor disfunción plaquetar, menor detección de O2 debido a la neuropatía autónoma, uso de bloqueadores del SRAA, efecto inhibidor de citocinas inflamatorias y peor respuesta a la eritropoyetina [29].
2.- ANATOMIA PATOLOGICA DE LA NEFROPATIA DIABÉTICA
La ERC atribuida a la DM constituye la causa más frecuente (23-25%) de enfermedad subyacente en individuos con necesidad de tratamiento renal sustitutivo [2]. En su fisiopatología interviene la activación de una serie de mecanismos metabólicos, donde cabe destacar la formación de productos de glicosilación avanzada que interaccionan con receptores localizados en células endoteliales, mesangiales, musculares lisas y podocitos del riñón, desencadenando un estado proinflamatorio con activación de factores de crecimiento, aumento de la formación de especies reactivas de oxígeno y activación de la apoptosis de podocitos. Además, también intervienen una serie de factores hemodinámicos que desencadenan la vasodilatación de la arteriola aferente y vasoconstricción de la arteriola eferente, lo que conduce a una hiperfiltración glomerular. Todo esto contribuye al desarrollo y la progresión de la afectación renal en la DM y va a tener una traducción clínica y morfológica.
Características macroscópicas:
Los riñones están bilateralmente aumentados de tamaño excepto en la afectación terminal, donde ya presentan un tamaño normal o disminuido.
Se pueden asociar cicatrices corticales por nefropatía hipertensiva o pielonefritis (en el contexto de una diabetes crónica)
Características microscópicas:
(Figura 2) (Figura 3) (Figura 4)
No hay diferencias en los hallazgos histopatológicos de la nefropatía diabética debida a DM tipos 1y 2.
A nivel glomerular:
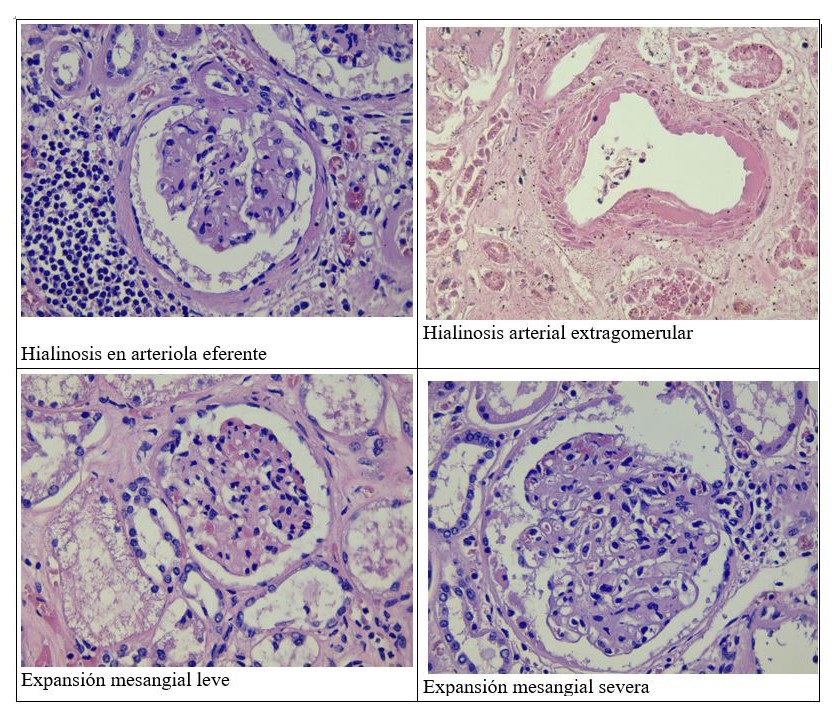
El cambio inicial es un engrosamiento difuso de la membrana basal glomerular (MBG), que puede observarse incluso en ausencia de proteinuria. Se requiere estudio ultraestructural para observar estos cambios, y empieza a ser reconocible en la microscopía óptica cuando el grosor está aumentado x4.
En estadios posteriores, los glomérulos muestran una expansión mesangial y esclerosis, donde puede observarse, además de aumento de la matriz, hipercelularidad difusa, sobre todo en la fase inicial.
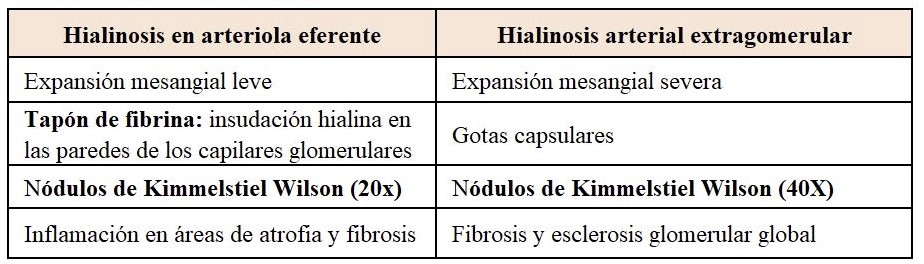
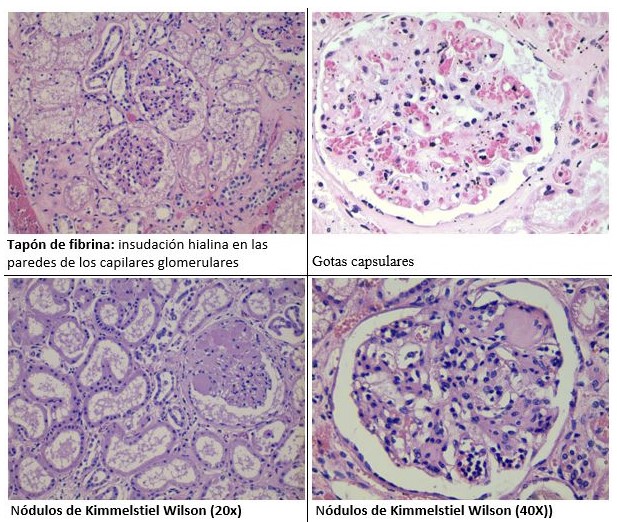
Con la evolución aparecen lesiones mesangiales nodulares de distribución irregular, centradas por matriz acelular y rodeadas por núcleos dispersos, que se tiñen con PAS y plata metenamina de Jones, siendo negativas para rojo congo (muy importante para el diagnóstico diferencial con la amiloidosis). Se denominan nódulos de Kimmelstiel Wilson. La esclerosis progresiva del mesangio va dando lugar a la obliteración de las luces capilares.
Otro hallazgo frecuente son los microaneurismas, que se asocian con la mesangiolisis (pérdida de densidad de la matriz), más frecuente en la periferia de los nódulos. Es infrecuente la formación de trombos, aunque se puede observar fragmentación de eritrocitos.
Otras lesiones características que se pueden observar en el glomérulo son la insudación hialina en las paredes de los capilares glomerulares (tapón de fibrina) y la gota capsular entre el epitelio parietal y la cápsula de Bowman (proteínas plasmáticas). Este hallazgo no es específico de la nefropatía diabética y puede observarse hasta en un 5% de biopsias de pacientes no diabéticos.
Las esclerosis segmentarias se inician por daño de los podocitos y la exposición de la MBG, creando adherencias entre el penacho capilar y la cápsula de Bowman y una cicatrización en forma de esclerosis y fibrosis, que se pone de relieve con las tinciones de PAS, tricrómico de Masson y plata metenamina. Cuando la esclerosis y cicatrización afectan al polo tubular dan lugar a lesiones de la punta, con glomérulos atubulares, sin continuidad con el túbulo contorneado proximal.
No se observan necrosis, cambios inflamatorios y raramente se han descrito semilunas, que podrían constituir una respuesta infrecuente a una proteinuria importante.
Los glomérulos van sufriendo una esclerosis global con la evolución de la enfermedad hacia formas terminales.
A nivel tubular:
En los casos en los que existe proteinuria importante se observan en los túbulos proximales gotículas de reabsorción de proteínas y de lípidos.
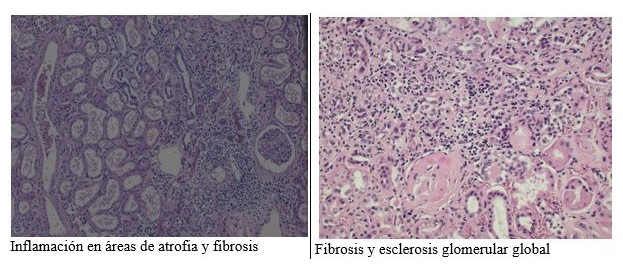
En la nefropatía diabética avanzada aumenta el grado de atrofia tubular, que se acompaña de fibrosis intersticial.
Las membranas basales tubulares (MBT) están engrosadas por depósito aumentado de colágeno, tanto en los túbulos atróficos como en los no atróficos.
En la cetoacidosis diabética aguda, los túbulos proximales contienen abundantes vacuolas claras de glucógeno.
A nivel intersticial:
Se puede observar un grado variable de inflamación, con linfocitos, eosinófilos y neutrófilos ocasionales, que no representan una pielonefritis, a no ser que el infiltrado intersticial sea prominente o con cilindros de neutrófilos asociados.
Compartimento vascular:
Las arterias de mayor calibre, incluidas las arcuatas, muestran fibrosis de la íntima.
En la nefropatía diabética grave puede verse también arterioesclerosis con depósitos lipídicos en arterias más pequeñas.
En las arteriolas, tanto aferentes como eferentes, suele verse hialinosis (Tabla 4).
También puede observarse insudación hialina (de proteínas plasmáticas) en arterias interlobulillares y arteriolas terminales, que puede afectar a la íntima y la media o ser transmural. En estos casos, si es transmural, causa una obstrucción de la luz que puede cursar con colapso isquémico y esclerosis de los glomérulos distales.
Pruebas complementarias:
Inmunofluorescencia directa:
Se puede ver una tinción lineal difusa con IgG de intensidad 2 o mayor en MBG y MBT. Se debe a un atrapamiento no inmunológico de proteínas a nivel de las membranas basales, anormalmente engrosadas. No hay depósito específico de cadenas ligeras (puede simular una nefritis anti-MBG).
Se pueden ver depósitos de IgM y C3 inespecíficos por atrapamiento en las zonas de esclerosis segmentaria.
No se observan inmunocomplejos específicos salvo que haya una glomerulonefritis superpuesta.
Las gotículas de reabsorción de proteínas en los túbulos se pueden teñir con albúmina.
Microscopía electrónica:
El hallazgo más precoz de la nefropatía diabética es un engrosamiento difuso de la lámina densa de la MBG, que alcanza un grosor > 600 nm. Puede empezar siendo segmentario, cerca de las zonas de microaneurisma.
Aumento de la matriz mesangial por:
• Material fibrilar fino (fibrilosis diabética, fibrillas de 10 nm de grosor)
• Mesangiolisis: focos transparentes de predominio en la periferia de los nódulos
• Restos celulares en los nódulos, pero no depósitos amorfos (no inmunocomplejos)
• Variable borramiento de procesos pedicelares (menos extensa que en podocitopatías)
• La MBT está engrosada y laminada
Pronóstico
La intensidad de la esclerosis mesangial, la glomeruloesclerosis renal y la fibrosis intersticial se correlacionan con la progresión de la enfermedad y el descenso de la función renal.
Los cilindros de neutrófilos y los neutrófilos intersticiales obligan a evaluar el cultivo de orina.
Informe anatomopatológico:
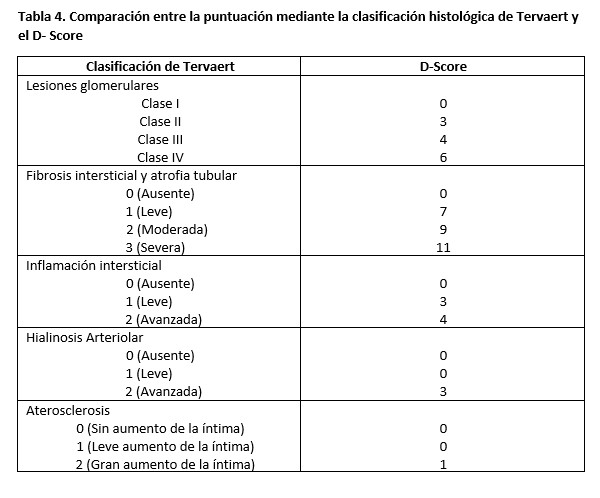
Debe incluir la clasificación de la nefropatía diabética (Clasificación de Tervaert 2010 [30], modificada en 2014 [31]).
Clase I: engrosamiento de la MBG (menor de 395 nm en mujeres y mayor de 430 nm en hombres)
Clase II: expansión mesangial: la anchura de la matriz mesangial es mayor de 2 núcleos de células mesangial en > 25% de las áreas mesangiales
IIa: leve, inferior al área media de la luz capilar
IIb: intensa, superior al área media de la luz capilar
Clase III: esclerosis nodular (nódulos de Kimmelstiel-Wilson), al menos un nódulo convincente.
Clase IV: glomeruloesclerosis diabética avanzada: glomeruloesclerosis global en > 50% de los glomérulos (resto con lesiones clase I-III).
Se informarán, además:
Intensidad de la fibrosis intersticial en 5 grados (0, 50%) y las lesiones vasculares (arterio y arterioloesclerosis, hialinosis).
*Inflamación intersticial (0: ausente, 1: asociada a atrofia tubular y fibrosis, 2: fuera de las áreas de atrofia tubular y fibrosis intersticial).
*Hialinosis arterioral (0: ausente; 1: al menos 1 área; 2: > 1 área).
*Arterioesclerosis: (NA: no hay vasos, 0: sin engrosamiento de la íntima; 1: íntima de grosor superior al de la media; 2: íntima de grosor mayor al de la media).
Posteriormente a la revisión de la clasificación de Tervaert de la nefropatía diabética, Hoshino y cols, propusieron una puntuación según los hallazgos en la histología de todos los compartimentos renales según la (Tabla 4) [32][33]. Así, se definió como punto de corte para el pronóstico renal el número 15: los individuos que obtuvieran una puntuación por encima de 15 presentaban peor pronóstico renal.