Ecografía Doppler y complicaciones vasculares del trasplante renal
INTRODUCCIÓN
La ecografía seriada sobre el injerto renal aporta una serie de datos que son de gran utilidad clínica a la hora de tomar decisiones sobre la evolución de los pacientes trasplantados.
El estudio Doppler no se puede separar de la ecografía bidimensional, interpretándose mejor los datos de manera conjunta. No obstante, dado que este capítulo trata específicamente del Doppler nos centraremos en este aspecto.
El estudio Doppler del injerto renal incluye Doppler color, power Doppler y Doppler pulsado, y ofrece información dinámica sobre la situación vascular del injerto renal tanto en la evaluación inicial del trasplante reciente como en el seguimiento. Es una prueba incruenta, eficiente y accesible que se puede realizar rápidamente a pie de cama [1]. Requiere la pericia de un explorador adecuadamente entrenado pero dentro de su complejidad presenta ciertas ventajas frente a su realización en un riñón nativo por su situación extraperitoneal (más próximo a la superficie) y a que no está tan condicionado por los movimientos respiratorios del paciente.
Con el Doppler podremos valorar la vascularización del injerto renal y ver las anastomosis, diagnosticaremos estenosis y trombosis de los vasos principales, podremos observar flujos anómalos en presencia de pseudoaneurismas o fístula arteriovenosa y nos ayudará a diferenciar vasos de otras estructuras no vasculares.
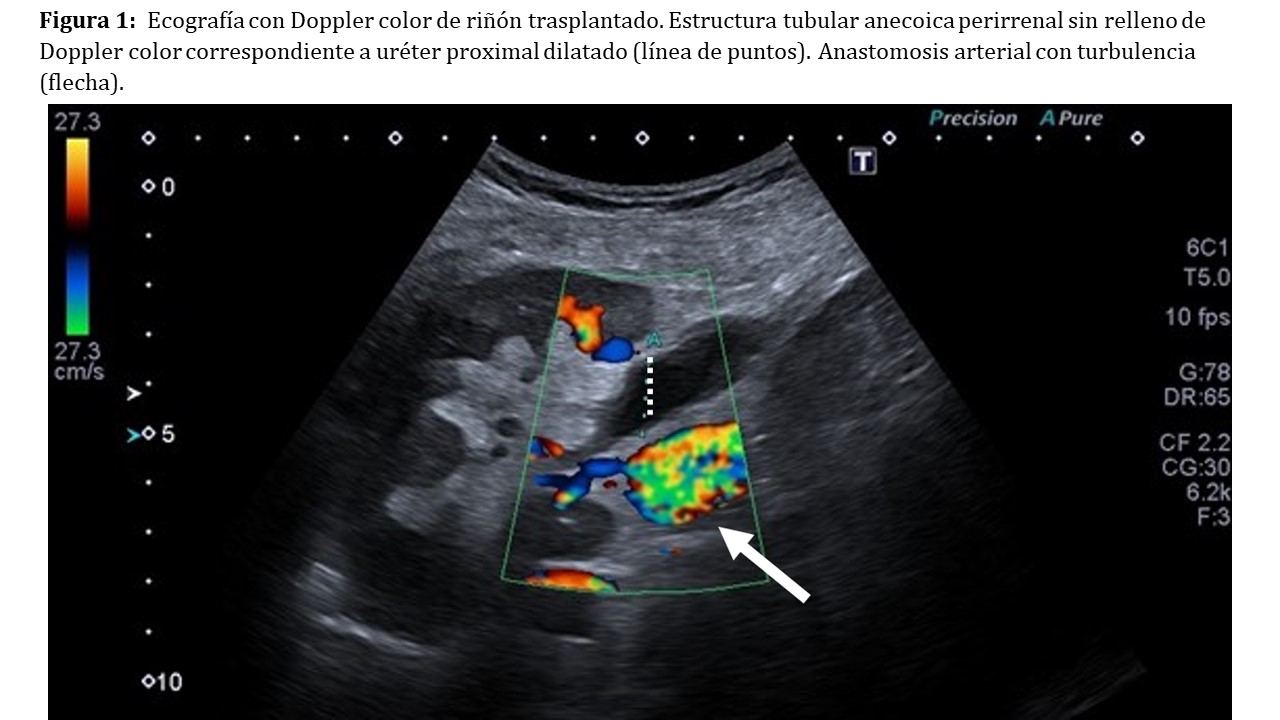
Además de detectar problemas vasculares, al igual que en el riñón nativo, nos será de utilidad en el diagnóstico de otras patologías no vasculares como la litiasis renal, el fracaso renal agudo, el rechazo agudo, la detección de masas renales y la uropatía obstructiva (Figura 1).
CONSIDERACIONES ANATÓMICAS GENERALES
El injerto suele estar ubicado en la fosa iliaca generalmente en el lado derecho cuando se trata de un primer trasplante, a excepción del trasplante ortotópico. Las anastomosis vasculares suelen ser termino-laterales a los vasos iliacos externos o a los iliacos comunes en circunstancias determinadas.
Cuando se trata de un donante cadáver, la arteria renal puede llevar un parche de aorta que se anastomosará a la arteria iliaca del receptor, dicha arteria renal puede ser única o múltiple, así que previo al comienzo de estudio Doppler debemos conocer los datos más relevantes del parte quirúrgico, de la cirugía de banco realizada y si se ha realizado biopsia del injerto, en cuyo caso deberemos conocer el polo o la región biopsiada. Estos datos serán de utilidad para una correcta interpretación de los resultados.
AJUSTES FUNDAMENTALES PARA LA MINIMIZACIÓN DE ERRORES
Un correcto ajuste de los parámetros antes de la exploración nos facilitará una mejor visualización tanto de la imagen bidimensional como del estudio Doppler. Esta configuración incluye la escala de grises, la ganancia, la profundidad del foco y el uso de armónicos.
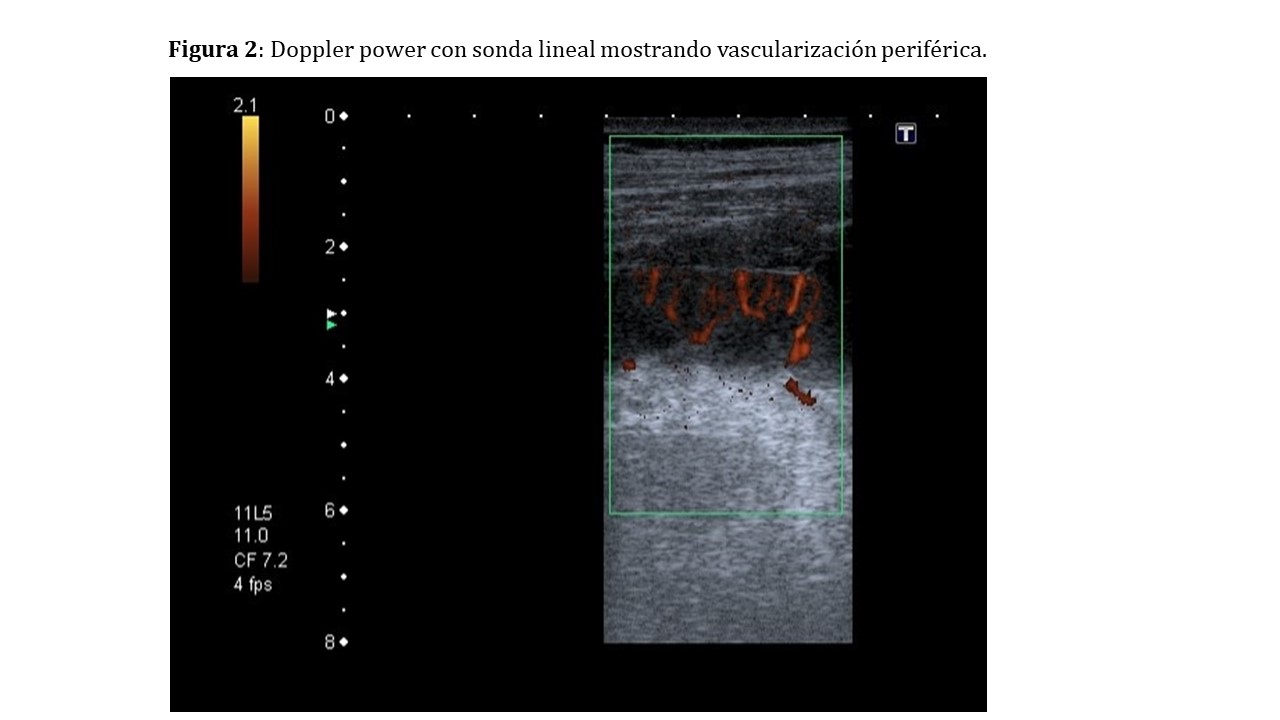
Aunque lo habitual es realizar el estudio con una sonda convexa de baja frecuencia (1-6 MHz), debido a su proximidad a la piel, el uso de una sonda de alta frecuencia nos puede complementar, aportando mayor resolución y detalle [2] para evaluar por ejemplo la circulación periférica (Figura 2).
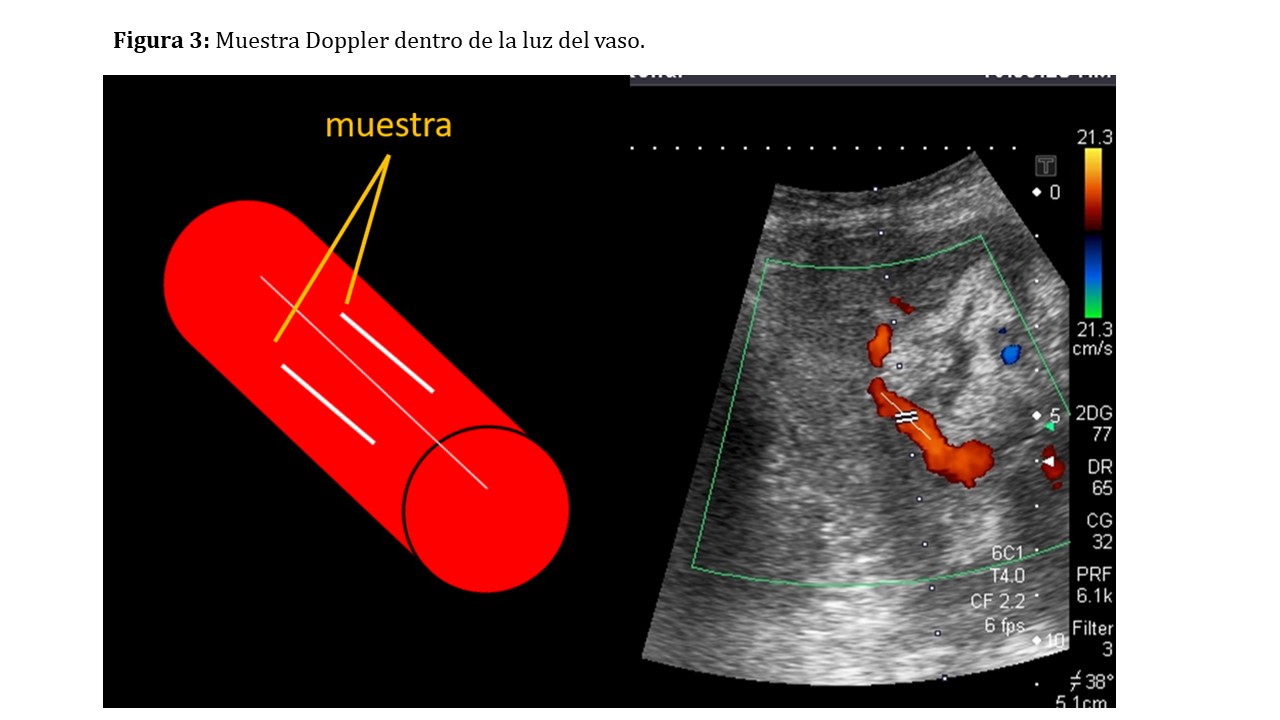
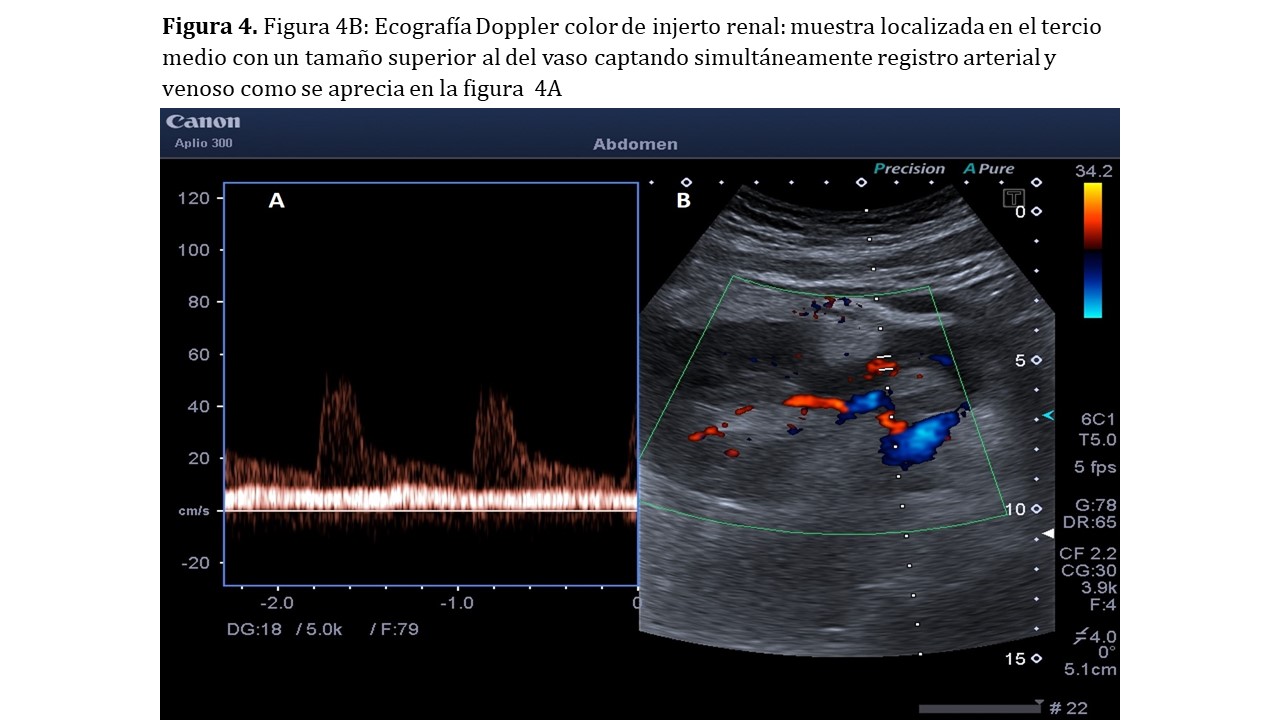
El tamaño de la muestra (Figura 3) debe ser inferior al del vaso que intentamos explorar, realizando la medición en el interior de las paredes vasculares y evitando, en la medida de lo posible, el contacto con ellas. Un tamaño excesivo podrá producir alteraciones en la medición al detectar varias estructuras vasculares simultáneamente (Figura 4).
SISTEMÁTICA DE LA EXPLORACIÓN DOPPLER SOBRE EL INJERTO RENAL
La mecánica de exploración será similar independientemente del momento evolutivo del trasplante renal. Debemos ser sistemáticos a la hora de tomar los registros para no obviar ningún área. Es importante dejar constancia, bien en un informe de ecografía o bien en la historia clínica del paciente, de los distintos hallazgos con sus descripciones y los valores numéricos obtenidos para poder llevar un registro objetivo del seguimiento ecográfico, lo que aportará un mayor valor a la hora de emitir un diagnóstico.
El trasplante renal en adultos se ubica generalmente en fosa iliaca, encontrándose el injerto, en la mayor parte de los casos paralelo a la cicatriz quirúrgica, con el hilio renal en dirección inferoposterior y medial. No obstante, en función de las condiciones anatómicas y quirúrgicas la situación del injerto puede cambiar considerablemente.
Comenzaremos el estudio colocando la sonda paralela a la cicatriz quirúrgica y externa a ella, ahí bascularemos hasta conseguir la imagen longitudinal del injerto. Con este abordaje, evitaremos mejor la interposición de gas intestinal, aunque es posible que a lo largo del estudio precisemos otras ventanas ecográficas. En ese momento activaremos la función Doppler color.
Estudio del parénquima renal
Doppler color
En primer lugar, deberemos valorar la perfusión global del injerto, si es homogénea en todo el parénquima o si, por el contrario, existen segmentos hipoperfundidos o con defectos focales.
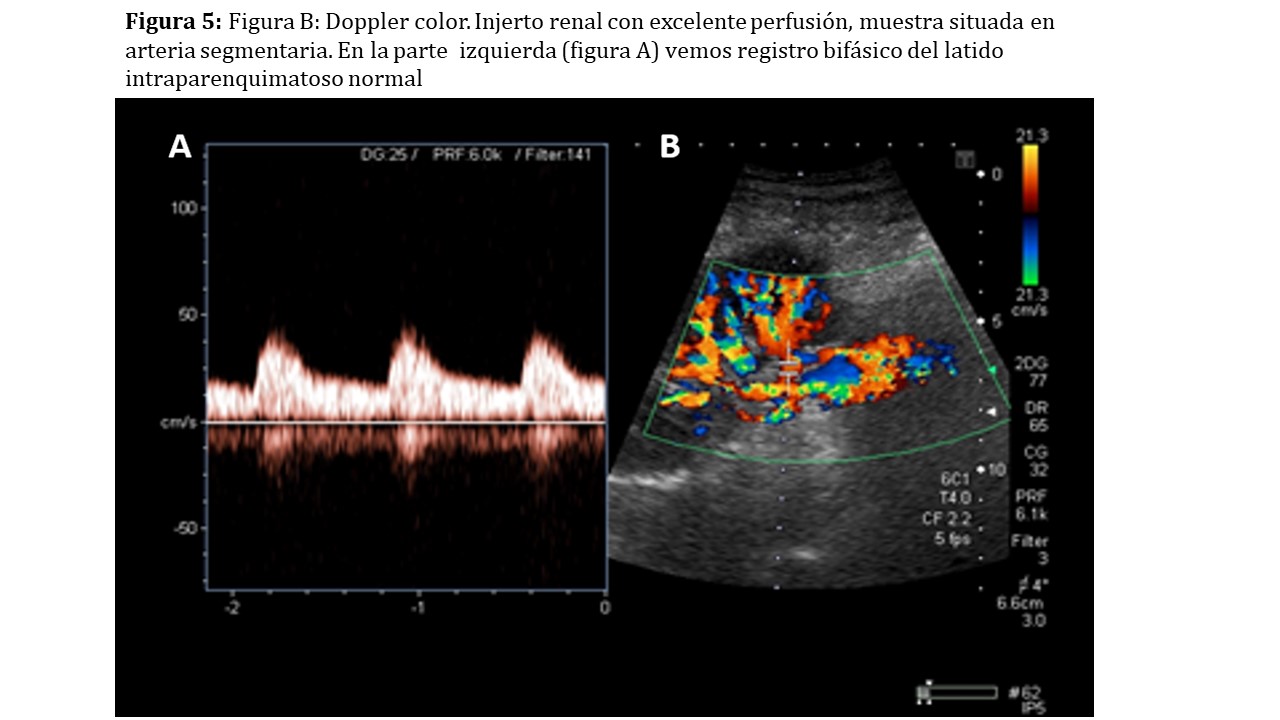
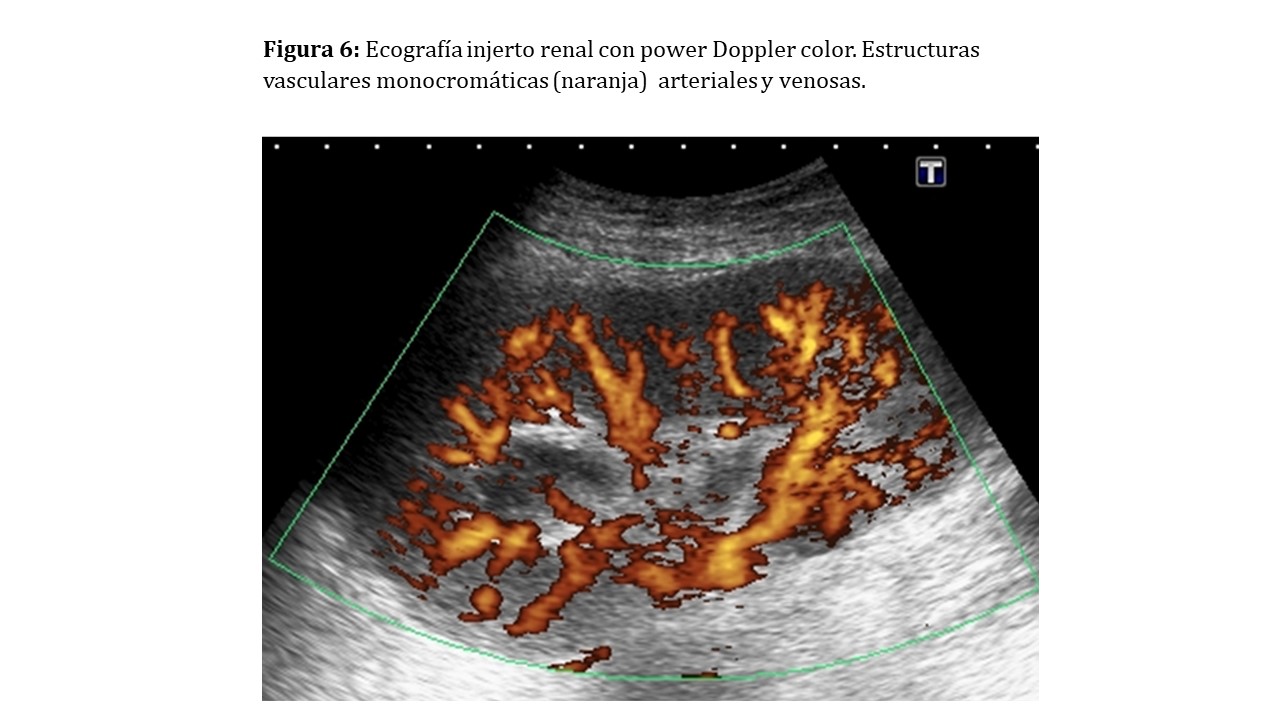
También evaluaremos el árbol vascular renal tratando de visualizar hasta los segmentos distales como arterias y venas interlobulillares y arcuatas (Figura 5). Para ello utilizaremos inicialmente el modo Doppler color y podremos ayudarnos del power Doppler, capaz de visualizar velocidades menores al no discriminar la dirección de los hematíes [3] (Figura 6).
Doppler pulsado
Con el Doppler pulsado observaremos la morfología del registro espectral, que es la representación gráfica de las distintas velocidades intravasculares. Valoraremos:
• La morfología de la onda arterial que debe corresponder con la de una arteria visceral, es decir, de baja resistencia o bifásica con un pico sistólico de ascenso vertical y una diástole suave manteniendo en todo momento velocidades en el rango positivo con valores superiores a cero (Figura 5)A.
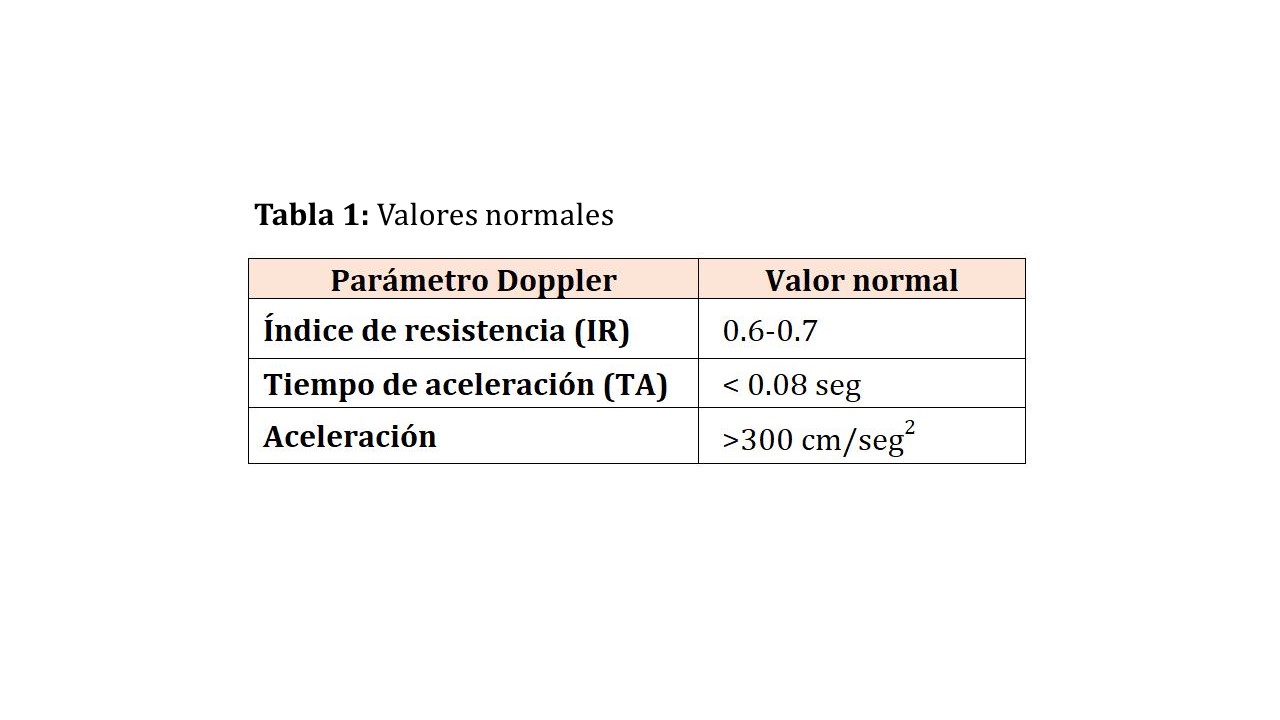
• Podremos calcular el índice de resistencia, el tiempo de aceleración y la aceleración cuyos valores normales se reflejan en la (Tabla 1). Para la correcta determinación de la aceleración hay que corregir el ángulo de insonación, que debe ser paralelo a la dirección del flujo en la arteria. El ángulo de insonación debe situarse entre 30-60º, siendo tanto más fiable cuanto más próximo este a 60º y, en cualquier caso, siempre debe ser < 60º. Las determinaciones las realizaremos, preferiblemente en territorio cortical, haciendo un mapeo de todo el parénquima renal desde polo superior, tercio medio-región interpolar hasta polo inferior.
Estudio Doppler de la arteria renal
Seguiremos la misma sistemática que para el parénquima: primero Doppler color y luego Doppler pulsado o espectral. Deberemos seguir el recorrido de la arteria renal desde la anastomosis. Observaremos su calibre con el Doppler color y la velocidad a lo largo del recorrido ajustando el ángulo. La velocidad del pico sistólico no debe exceder los 200 cm/seg en ningún punto. Elevaciones abruptas de la velocidad por encima de ese valor son sugestivas de estenosis.
Doppler de la anastomosis
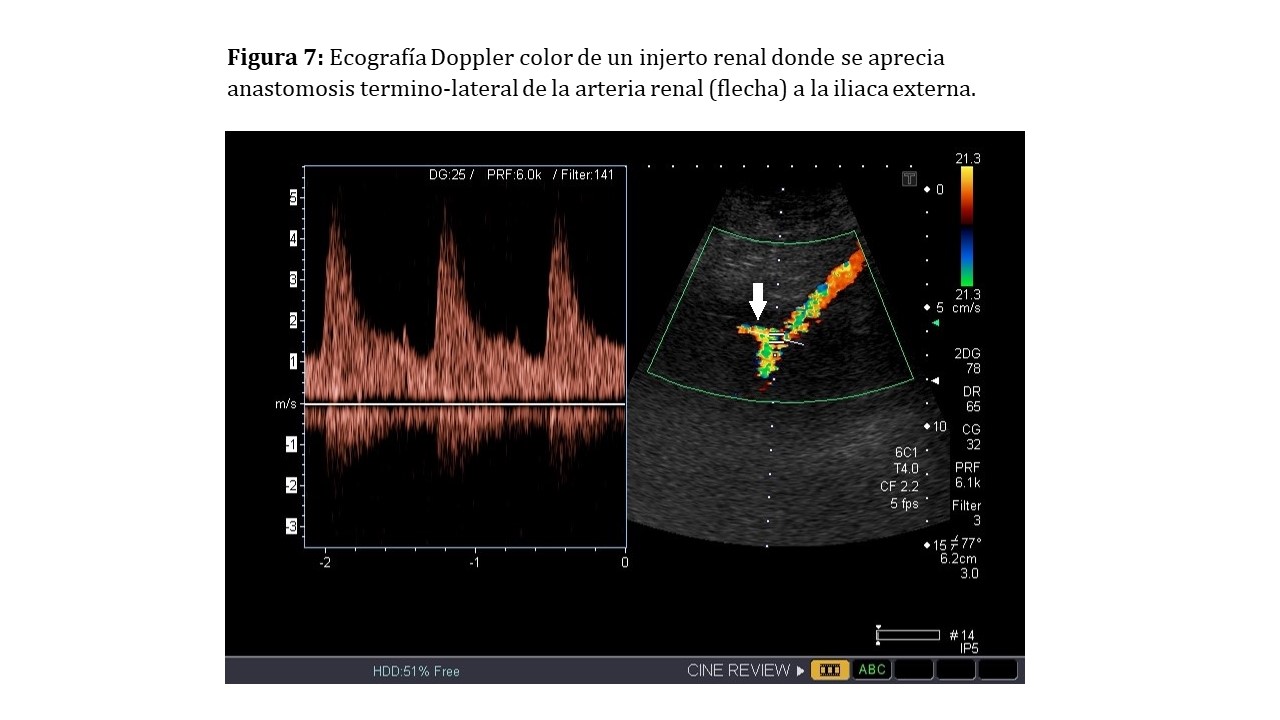
Como siempre, tras el Doppler color obtendremos el registro espectral con el Doppler pulsado. Determinaremos la velocidad del pico sistólico y el tiempo de aceleración. Para una correcta interpretación es necesario conocer los datos relevantes de la cirugía de banco y del parte quirúrgico, si se trata de una única arteria o múltiples en parche, el tipo de anastomosis, etc. [2].
Para obtener el registro en la anastomosis generalmente colocaremos la caja de Doppler color en la unión de la arteria renal con la arteria iliaca externa, ligeramente orientados hacia la arteria renal y corrigiendo el ángulo de insonación para que quede paralelo a la arteria renal. La muestra, como hemos comentado previamente, debe quedar en el interior de las paredes del vaso por lo que ajustaremos el tamaño (Figura 7).
Doppler de los vasos iliacos: Valoración arterial peri-injerto
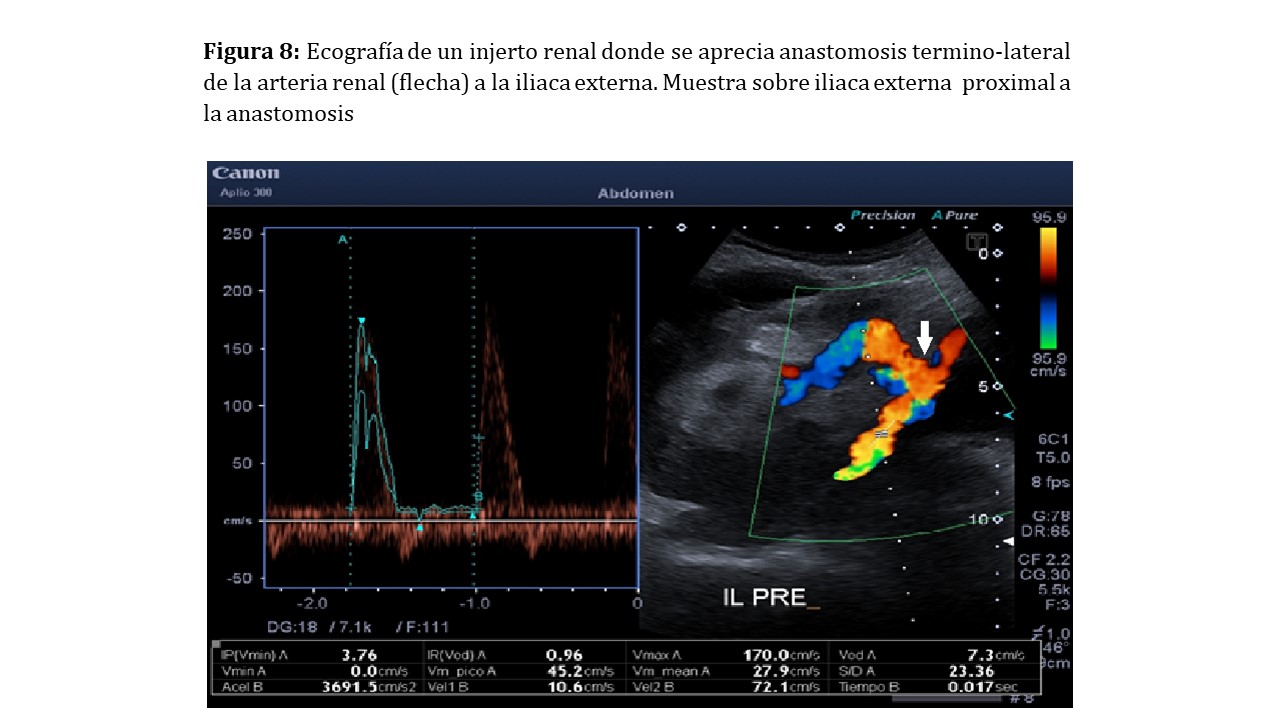
Los vasos que nutren a la arteria del injerto renal son en la mayoría de casos los vasos iliacos. Estos deben evaluarse con determinaciones tanto proximales como distales a la anastomosis.
El riñón trasplantado va a recoger una parte importante del flujo de dicha arteria, por lo que esa situación alterará la hemodinámica normal de dicho vaso. Las resistencias intravasculares serán inferiores a las habituales en las determinaciones proximales a la anastomosis, mientras que la hemodinámica no se verá alterada por el injerto en las determinaciones distales a la anastomosis (Figura 8).
Doppler del sistema venoso
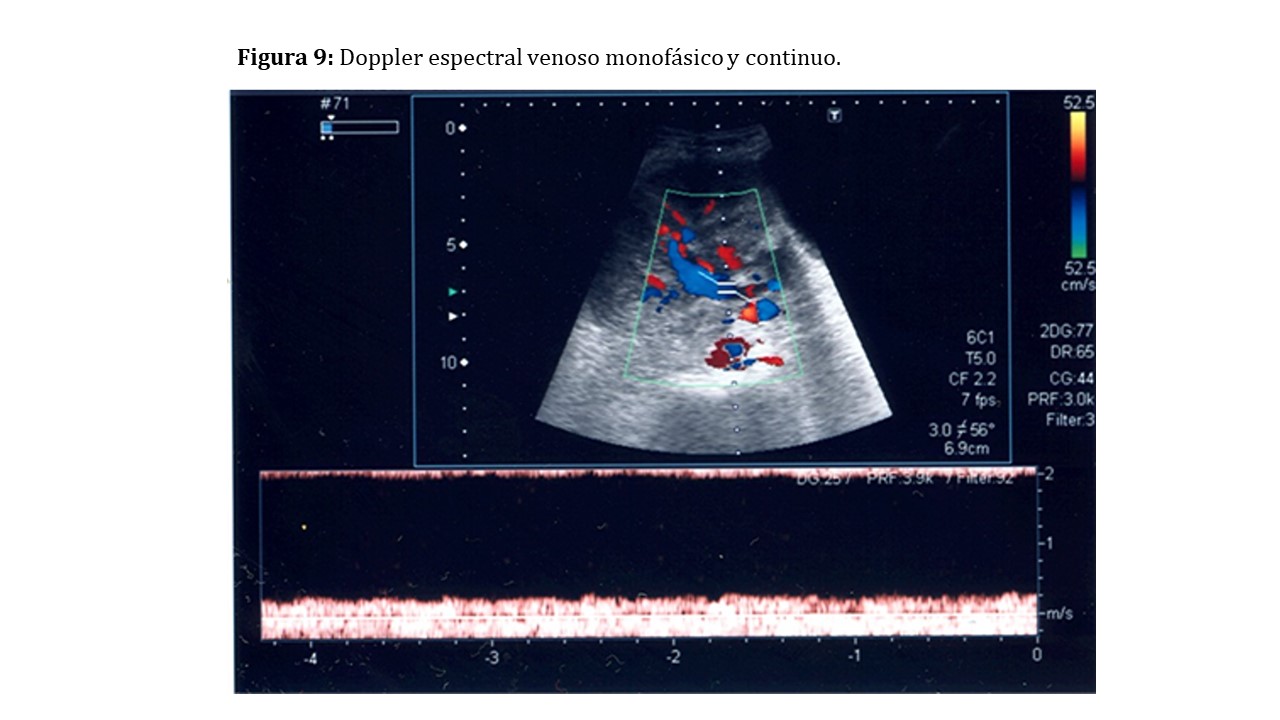
Deberemos realizar determinaciones venosas intraparenquimatosas y de la vena renal comprobando su permeabilidad. El registro venoso con el Doppler espectral es monofásico continuo (Figura 9).
COMPLICACIONES VASCULARES DEL INJERTO RENAL
Las complicaciones vasculares del injerto renal son de gran importancia de cara a la viabilidad del trasplante. Su frecuencia oscila entre el 1 y el 10% [4] [5]. Las complicaciones vasculares más frecuentes son: la estenosis de la arteria renal, la trombosis arterial y venosa, la fístula arterio-venosa y el pseudoaneurisma intrarrenal. Es esencial su diagnóstico precoz y el estudio Doppler es de gran utilidad en este campo [1].
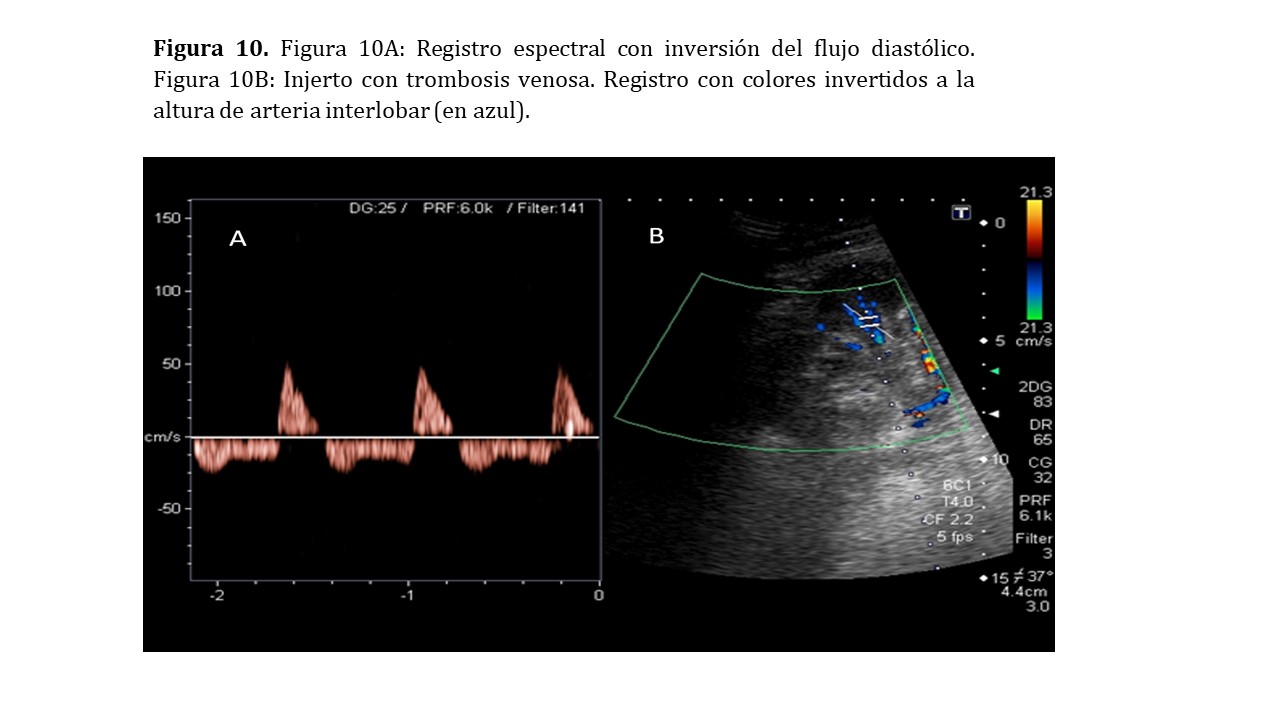
Trombosis venosa
La trombosis de la vena renal del injerto es una complicación infrecuente que tiene lugar en 1-4% de los trasplantes y suele darse en las primeras dos semanas post trasplante [4] [5]. Habitualmente se relaciona con compresión o acodamiento de la vena, hipoperfusión marcada o incluso con rechazo agudo del injerto.
Modo B: Frecuentemente el injerto presenta un aspecto normal, discretamente congestivo e hipoecoico
Doppler color: Ausencia de registros venosos intraparenquimatosos en caso de trombosis completa.
Doppler pulsado: En los flujos arteriales observaremos resistencias intraparenquimatosas muy elevadas, siendo característica la inversión del flujo diastólico (Figura 10).
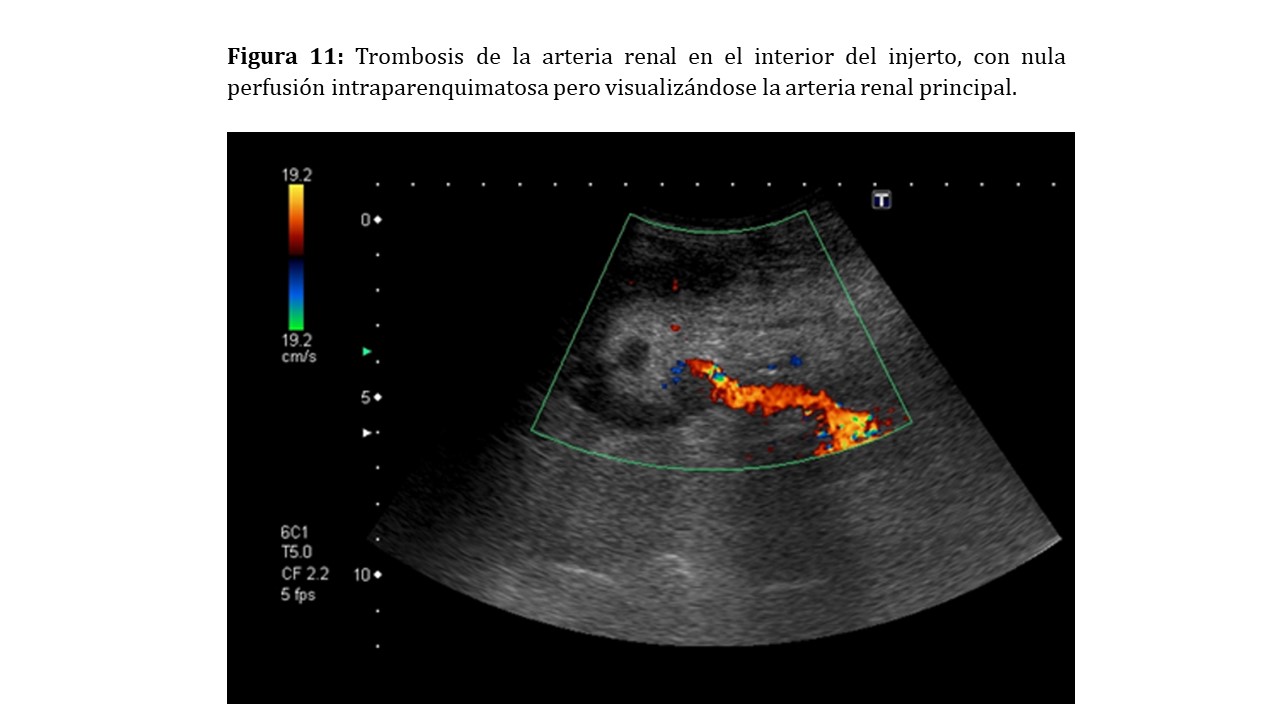
Trombosis arterial
La trombosis arterial es una complicación rara pero devastadora para la supervivencia del injerto. La frecuencia descrita es variable en las distintas series publicadas, oscilando entre un 0,2 y un 7% [5] [6] [7].
Suele producirse como complicación postquirúrgica debido a torsión de la arteria renal o disección de su pared debido a daño intimal [8]. De manera menos frecuente puede ser provocada tras compresión extrínseca por una colección perirrenal como un hematoma o un linfocele, estados de hipercoagulabilidad, rechazo agudo, toxicidad medicamentosa o hipotensión grave [5].
Modo B: En general, injerto de aspecto normal.
Doppler color y pulsado: Observaremos una ausencia completa de perfusión del injerto si la trombosis de la arteria renal principal es completa o parcial si es debida a la oclusión de alguna de sus ramas (Figura 11).
Estenosis de la arteria renal
La estenosis de la arteria renal (EAR) es causa de deterioro de la función renal e hipertensión arterial en el paciente trasplantado. Tiene una incidencia muy variable que oscila según las series publicadas entre el 0.8 y el 25% [9] [10] . Es más frecuente en el trasplante de cadáver [1] por lo que la preservación del injerto y el tiempo de isquemia pueden estar relacionados.
La localización más frecuente es la perianastomótica y suele relacionarse con lesión arterial del donante durante la extracción, clampaje o inadecuada sutura vascular [9] [11]. Lesiones arteriales más distales, difusas y de aparición tardía pueden corresponder con lesión endotelial inmunomediada entre otros factores [12].
La EAR puede ser apreciable desde el postrasplante inmediato aunque, en ocasiones, pueden darse circunstancias perioperatorias transitorias que afecten al calibre de la luz arterial sin repercusión parenquimatosa. En estos casos, la velocidad en la arteria es ligeramente superior a 200 cm/seg pero los registros intraparenquimatosos no cumplen criterios de estenosis. Si bien pueden manejarse con actitud expectante, ya que tienden a normalizarse [10], requiere la realización de exploraciones seriadas [13].
En el caso de una arteria renal larga puede existir un fenómeno de acodamiento o kinking, cuya presentación clínica y hallazgos en el Doppler pueden ser indistinguibles de la estenosis de la arteria renal.
Doppler de la EAR
-Método directo: exploración de la arteria renal
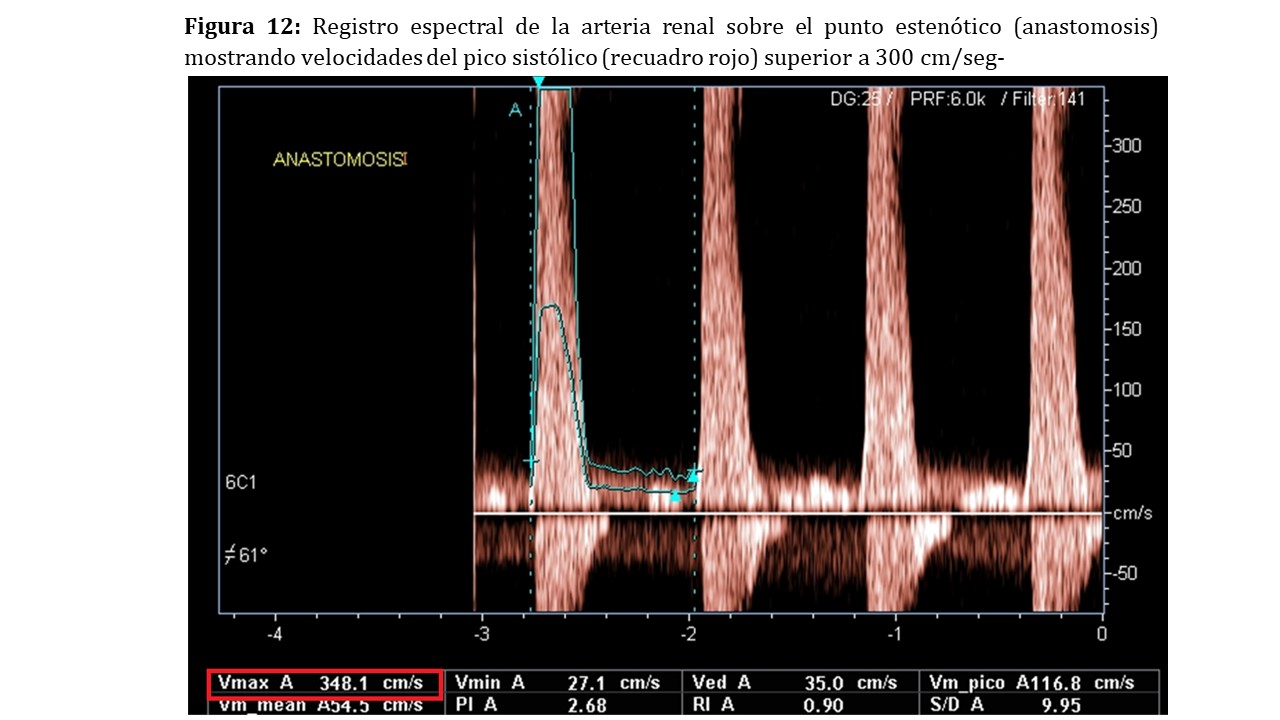
Doppler color: Mediante el método directo podremos observar una disminución del calibre de la arteria renal, con un flujo turbulento (aliasing) en la estenosis y en el recorrido postestenótico.
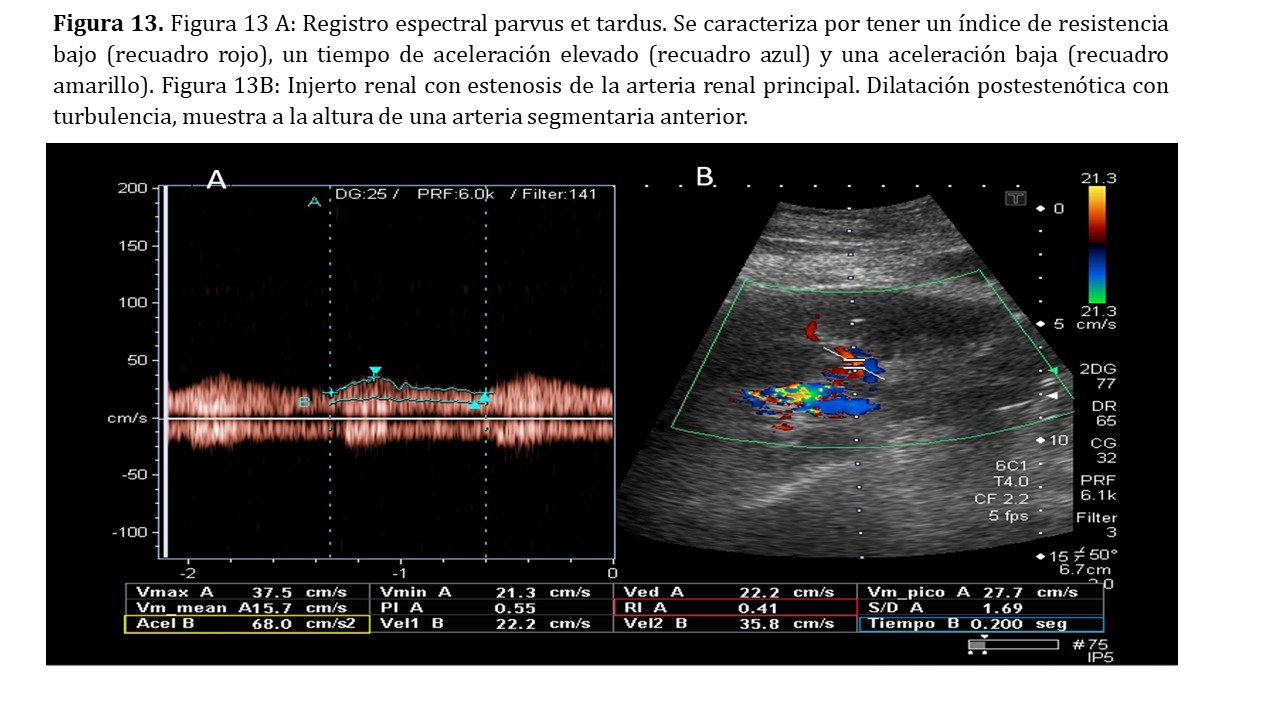
Doppler pulsado: valoraremos un aumento brusco de la velocidad en el punto estenótico, siendo sugestiva cuando es superior a 200 cm/seg y altamente sugestiva por encima de los 300 cm/seg. (Figura 12) Para una correcta evaluación, el ángulo de insonación debe estar comprendido entre 30-60º siendo tanto más fiable cuanto más próximo a 60º se encuentra. Conseguir esta situación a veces es complicado por lo que deberemos angular el transductor y en ocasiones cambiar el lugar de abordaje. En ocasiones no es posible conseguir un ángulo adecuado o detectar el punto estenótico, especialmente cuando la estenosis ocurre proximal a la anastomosis, en los vasos iliacos o aorta, pero sí podremos observar las consecuencias directas de la misma sobre la perfusión del parénquima renal. Por el efecto Venturi sabemos que cuando un fluido circula por un conducto cerrado, si éste disminuye de calibre como es en el caso de una estenosis arterial, aumenta la velocidad del fluido para mantener un flujo constante, esto implica una caída de la presión. Esta caída de la presión de perfusión se traduce en el Doppler pulsado de los vasos intrarrenales como un latido parvus et tardus. Se trata de un latido con un ascenso más suave, lo que implica una aceleración menor (<300cm/seg2), un tiempo de aceleración alargado (superior a 0.060 seg) y una relación entre el pico sistólico y el valle diastólico menor, generando un IR <0.5 (Figura 13).
-Método indirecto: exploración del parénquima renal: El método indirecto es menos observador dependiente y más fácil de realizar pero solo detecta estenosis superiores al 75-80%. [10] Los criterios de EAR en el método indirecto son: índice de resistencia <0.5, tiempo de aceleración > 0.060 segundos y aceleración < 300 cm/sg2 (Figura 13).
La combinación del método directo y el método indirecto aumenta la rentabilidad diagnóstica, con una sensibilidad de 87-100% y una especificidad de 90-100% [14].
El tratamiento de elección de una EAR suele ser percutáneo frente a la cirugía abierta reservada para situaciones especiales, teniendo la angioplastia con colocación de stent una menor tasa de reestenosis frente a la angioplastia aislada [15] [16].
Pseudoaneurisma
Es una complicación rara acontecida generalmente tras una biopsia renal aunque también puede suceder en el seno de una infección del injerto, traumatismo penetrante (p. ej. tras colocación de nefrostomía percutánea) u otros eventos en los que se produce daño y rotura de la pared arterial, quedando la hemorragia contenida en un falso saco [17].
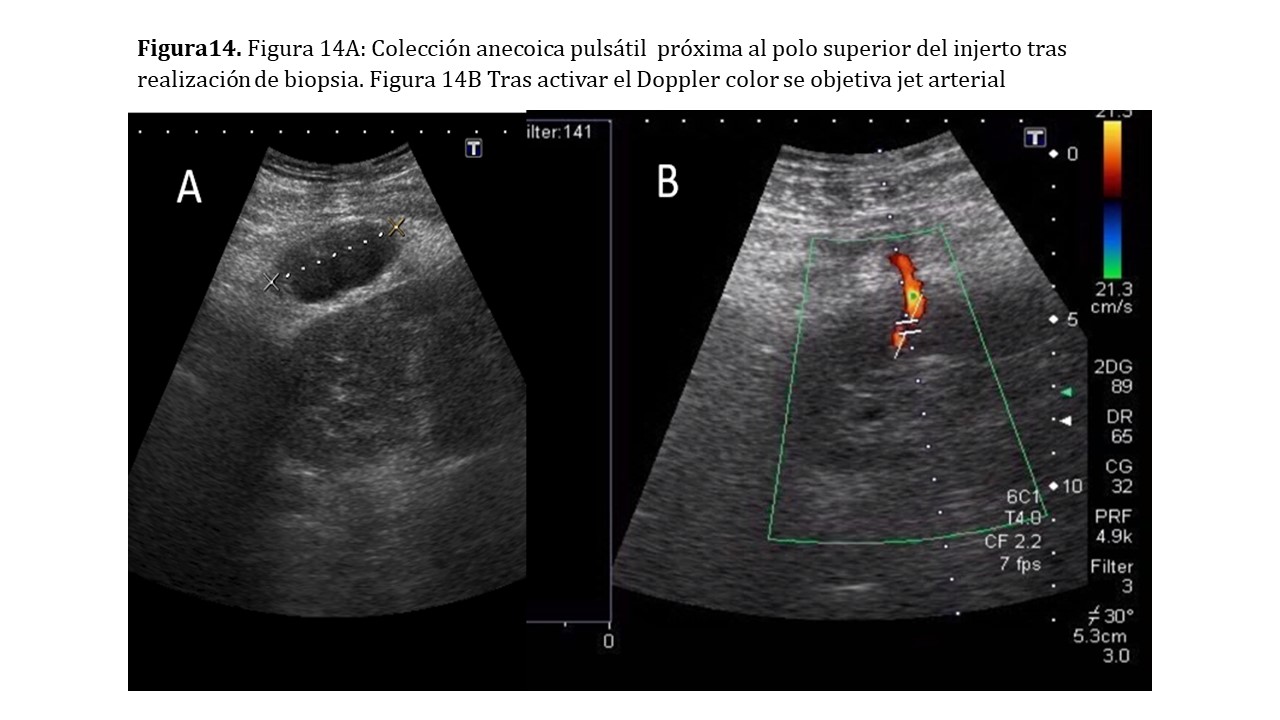
Modo B: Si son pequeños no se verán. Si alcanzan un cierto tamaño son indistinguibles de un quiste renal (si son parenquimatosos) o una colección hipoecoica correspondiendo a hematoma perirrenal (Figura 14)
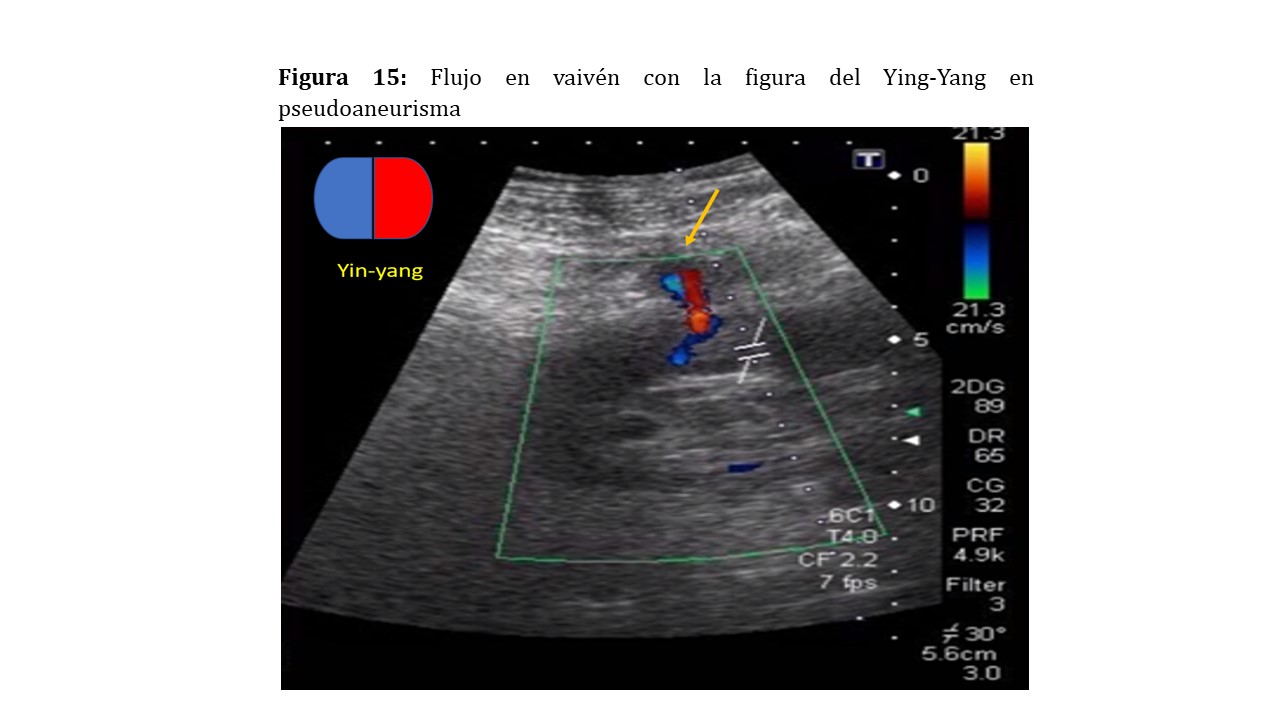
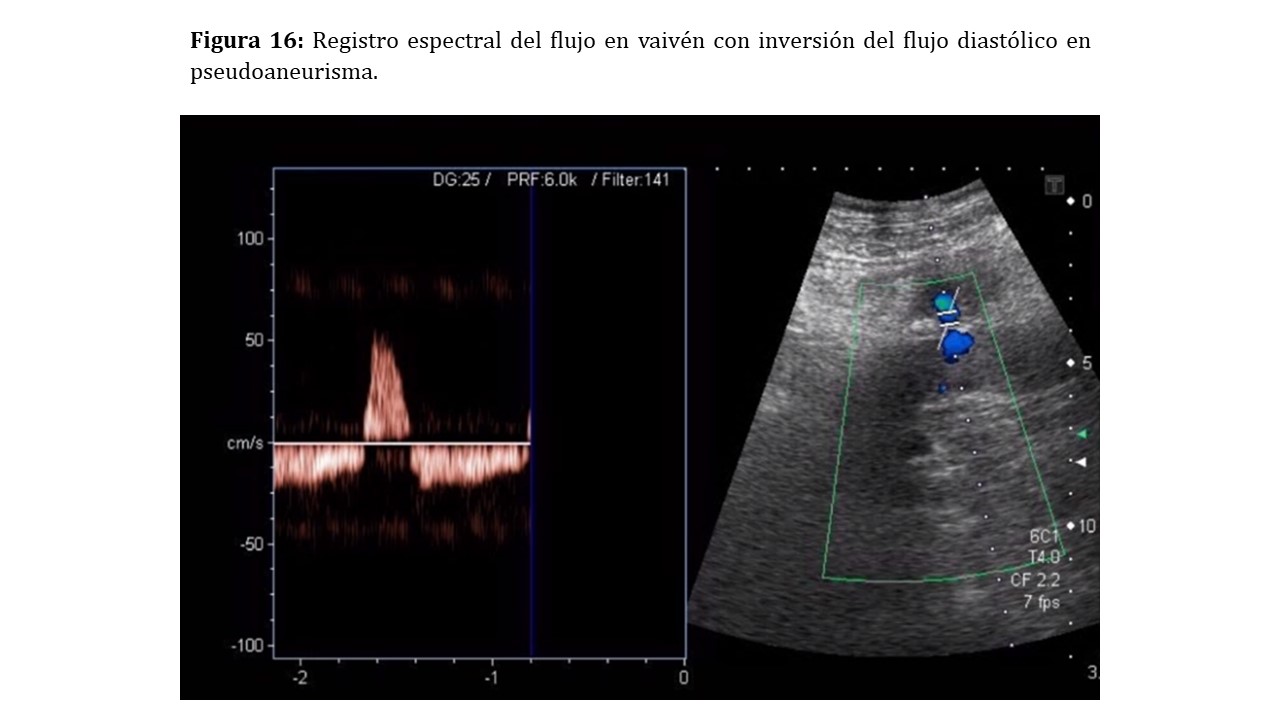
Doppler color: observaremos una eyección de alta velocidad desde la arteria nutricia con un remolino de sangre y la típica imagen del Yin-Yang. El cuello del pseudoaneurisma nos mostrará un flujo anterógrado y retrógrado en vaivén, cuya traducción en el Doppler pulsado será la de un pico sistólico, seguida de una inversión del flujo diastólico [17]. El tratamiento generalmente será la embolización percutánea del pseudoaneurisma (Figura 15) (Figura 16).
Fístula arterio-venosa
La fístula arterio-venosa (FAV) supone la unión de los flujos de una arteria y una vena dentro del parénquima renal. Las FAVs pueden surgir de forma espontánea (congénita), aunque generalmente es traumática tras la realización de un procedimiento invasivo, como pueden ser la realización de una biopsia renal o una nefrostomía. Su frecuencia es superior a la descrita en riñones nativos [18] pudiendo alcanzar el 18% cuando se realizan exploraciones rutinarias tras cada biopsia [18]. En un alto porcentaje son asintomáticas y se resuelven espontáneamente.
Modo B: normal. En ocasiones apreciaremos una imagen anecoica indistinguible de un quiste simple.
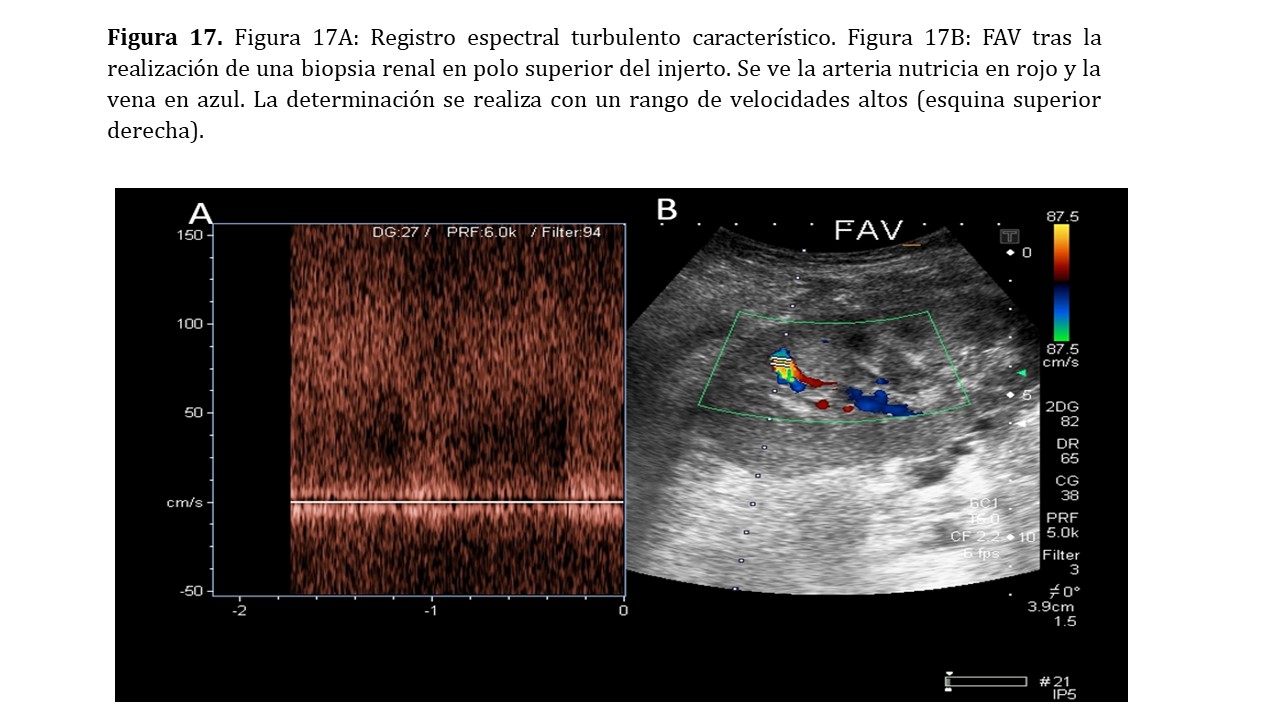
Doppler color: observaremos una zona redondeada de gran turbulencia con velocidades extremas que comunica tanto con una vena como con una arteria. La turbulencia generada produce vibración del parénquima adyacente, pudiendo detectarse dicho movimiento y magnificando el tamaño real de la fístula.
Para una correcta estimación del tamaño de la FAV y para un posterior seguimiento evolutivo, deberemos subir los PRF y registrar en el informe la velocidad a la que estamos midiendo.
Doppler pulsado: En el interior de la FAV observaremos un registro con múltiples velocidades que se acercan y se alejan del transductor y pueden llegar a ocupar la totalidad de la pantalla conformando un registro sistodiastólico continuo (Figura 17).
CUANDO HACER UN DOPPLER EN EL POSTRANSPLANTE
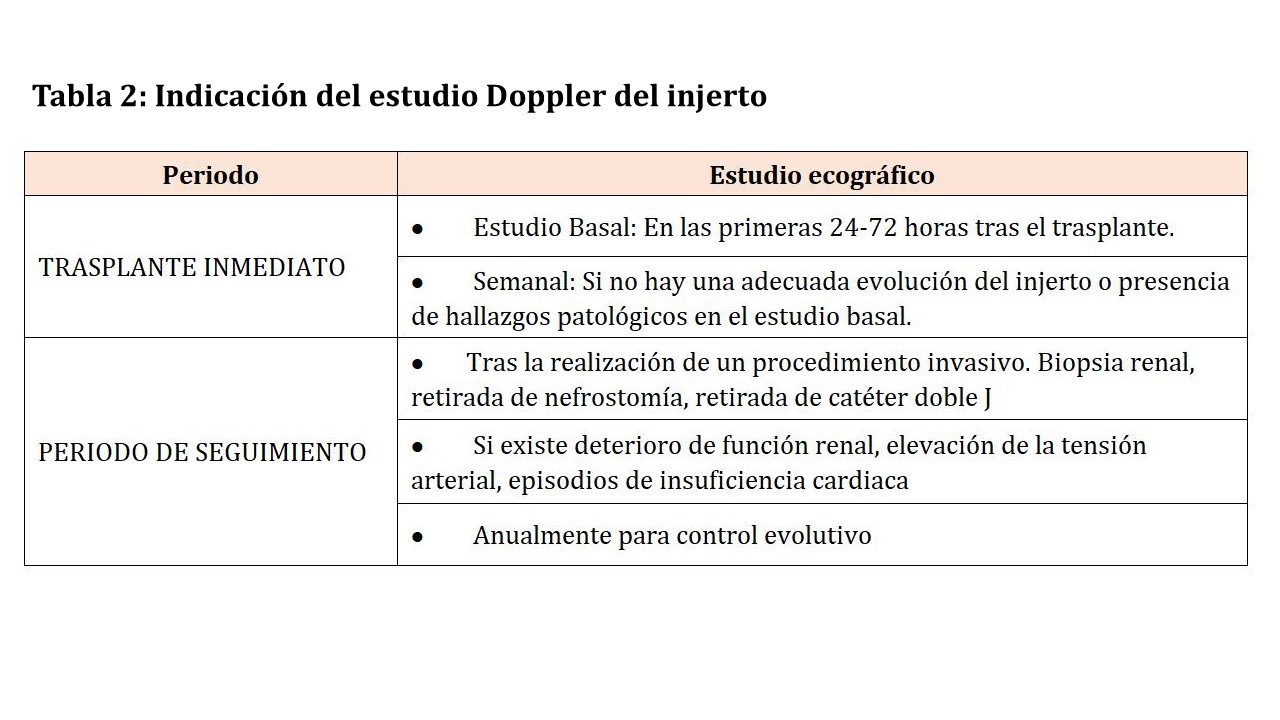
Dado que cuenta con una anastomosis vascular, la ecografía del trasplante renal no se considerará completa si no incluye el estudio con Doppler del injerto (Tabla 2).
La primera exploración ecográfica debemos realizarla en las primeras 24-48 horas post trasplante [8]. En ella evaluaremos la perfusión global del injerto con el Doppler color o power Doppler anotando si objetivamos registros distales en las distintas áreas del injerto. Con el Doppler pulsado evaluaremos la morfología del latido arterial intrarrenal representado en forma de registro espectral. Además, evaluaremos el índice de resistencia, cuyo valor será uno en los casos de diástole incompleta.
Las resistencias intraparenquimatosas elevadas indican algún grado de alteración parenquimatosa, siendo en las primeras horas post trasplante la necrosis tubular aguda la causa más frecuente, especialmente cuando se trata de donante cadáver.
La inversión del flujo diastólico es la máxima expresión de resistencias intrasvasculares elevadas y corresponde con las alteraciones más graves [19] [20].
Deberemos estudiar también la presencia de flujo venoso, así como el flujo en la anastomosis arterial y seguir el recorrido de la arteria renal principal desde la anastomosis hasta su entrada y bifurcación en el riñón.
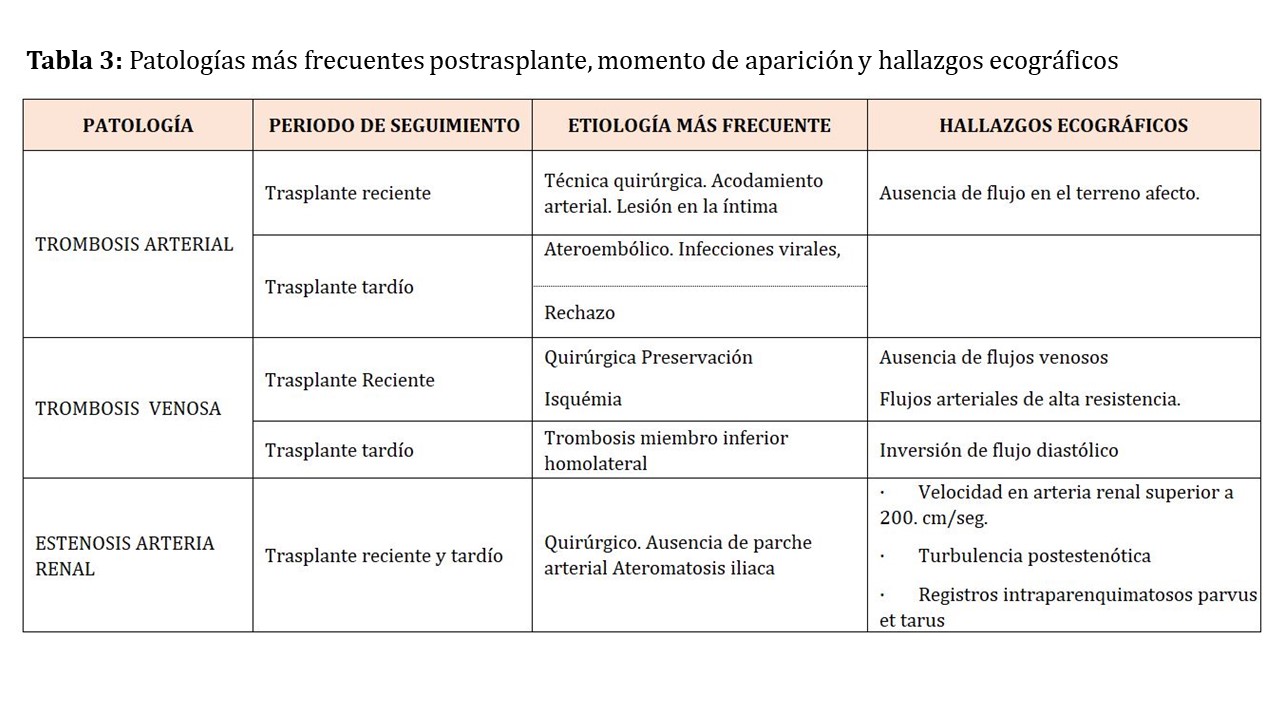
A modo de resumen la (Tabla 3) se presentn las patologías más frecuentes postrasplante, momento de aparición y hallazgos ecográficos.