Reacciones alérgicas a las membranas sintéticas en Hemodiálisis
Palabras clave
Hemodiálisis, alergia, membrana, polisulfona, triacetato de celulosa, sintética, PVP, degranulación de basófilos, triptasa.
INTRODUCCIÓN
A lo largo de la historia de la hemodiálisis se han descrito varios tipos de reacciones adversas, que aparecen durante la sesión de hemodiálisis (HD) y que han sido catalogadas como "alérgicas". Sin embargo, no siempre se han debido a mecanismos alérgicos. Algunas de ellas se producen como consecuencia de la interacción de la sangre con los componentes del circuito sanguíneo extracorpóreo, pudiéndose entender como una manifestación de la bioincompatibilidad de los materiales utilizados [1] [2] [3]. Con el tiempo, se han ido conociendo sus causas y en la mayoría de las veces, se han podido corregir.
Las primeras reacciones que se describieron estaban relacionadas con la utilización del óxido de etileno como esterilizarte de las líneas y dializadores [4] [5] [6]. Afortunadamente, se ha ido sustituyendo por otros sistemas de desinfección como el vapor de agua o los rayos gamma [6]. Las primeras membranas celulósicas, tipo Cuprophan, eran capaces de activar el complemento y provocar hipoxia por secuestro pulmonar leucocitario [1] [7] [8] [9]. Estas membranas fueron evolucionando hasta el triacetato de celulosa asimétrico (ATA) desapareciendo esta complicación [10]. El uso combinado de membranas de AN69 e IECAS condicionó la aparición de reacciones adversas asociadas a un aumento de bradiquininas. La modificación de la membrana al AN69-ST solucionó este problema [11] [12] [13]. Junto a estas reacciones asociadas a la bioincompatibilidad del material de diálisis, existen otras relacionadas con la medicación administrada intradiálisis y con los contaminantes del líquido de diálisis y que tienen una epidemiologia completamente distinta.
En los últimos años, se vienen describiendo reacciones asociadas al uso de membranas sintéticas, generalmente polisulfonas, que se han calificado de "alérgicas", "de hipersensibilidad" o "anafilácticas" [14] [15] [16] [17]. Como origen de las mismas, se han barajado posibles causas que se están intentando corregir.
CLÍNICA DE LAS REACCIONES ALÉRGICAS A LAS MEMBRANAS SINTÉTICAS DE HEMODIÁLISIS.
Las reacciones asociadas al uso de membranas sintéticas en HD (RAMS) pueden ser precoces o tardías, agudas o subagudas, graves o menos graves. Esto condiciona que la clasificación clínica clásica en tipo A / B no sea útil, llegando, incluso, a dificultar el diagnóstico.
Las formas de presentación, de más a menos frecuente, son: disnea, hipotensión, broncoespasmo, tos, vómitos u otra sintomatología digestiva, dolor precordial, prurito, urticaria, fiebre, cefalea y confusión. En los casos más graves se han descrito paradas cardiorrespiratorias e incluso la muerte [14] [16] [17]. Es frecuente que se acompañen de eosinofilia e hipoxia [17]; también se puede encontrar trombopenia [18]. En la mitad de los casos, aparece en la primera semana de la exposición al dializador causante [16], pero este intervalo puede alargarse hasta 36 meses. En 2/3 de los casos, los síntomas aparecen en los primeros 30 minutos de la sesión de HD, pero puede aparecer en cualquier momento de la misma [16]. Los pacientes que sufren una reacción aguda, grave y precoz, con disnea e hipotensión, son diagnosticados fácilmente. El problema radica en aquellos casos con sintomatología menos específica y tardía, que dificultan y enmascaran el diagnóstico, pudiendo pasar desapercibidas. En algunas unidades de hemodiálisis (UHD) donde se ha diagnosticado algún caso de RAMS, puede pasar a lo contrario, que se sobrediagnostique esta patología. En esta línea, destaca el estudio de Arenas y cols. [19] realizado sobre una población de 1161 pacientes, pertenecientes a 15 UHD. De ellos, 59 pacientes habían sido diagnosticados de RAMS, lo que representaba una incidencia del 5,8 %. Pudieron comprobar que, en 15 de los 59 casos, el diagnóstico era erróneo, pudiendo dializarse de nuevo con polisulfonas, sin complicaciones.
El prurito en los pacientes en HD es un síntoma frecuente y sus causas son múltiples [20]. Se han descrito pacientes en HD, en los que el prurito mejoró al cambiar de dializador. Por poner un ejemplo, en una serie de nueve pacientes en HD tratados con dializadores de polisulfona o PMMA que presentaban prurito persistente, no explicable por otras causas, después de cambiar el dializador a un dializador con membrana de triacetato de celulosa (TAC) el prurito mejoró en 7 de ellos [21].
En pacientes en HD, se ha descrito la existencia de fiebre de origen alérgico, que en ocasiones puede simular una infección. Mukaya JE et al, describen el caso de un paciente con un síndrome febril, que persistió meses hasta que se consiguió descartar un origen infeccioso y se sospechó una causa alérgica. Cuando se cambió el dializador de polisulfona a un dializador de TAC los síntomas del paciente desaparecieron [22].
El dolor precordial asociado a hipotensión intradiálisis es otro tipo de presentación de las RAMS. Delgado Córdova y cols. [23] describieron la historia de una paciente que presentaba episodios de hipotensión y dolor precordial intradiálisis. Tras el cambio de dializador a un BG 2.1 U ® de polimetilmetacrilato (PMMA), mejoró la tolerancia a las sesiones y con la posterior sustitución a una membrana de TAC, no volvió a presentar episodios hipotensivos. En la analítica presentaba discreta eosinofilia y trombocitopenia que también desaparecieron con el cambio de la membrana. Otro caso semejante es el descrito por Martín-Navarro y cols. [24]. Se trataba de un varón de 86 años, con importante comorbilidad, que se dializaba con un dializador Polyflux® y que durante un mes presentó episodios de hipotensión y clínica de angina intradiálisis. Posteriormente, con la exposición a varios dializadores con membranas sintéticas, comenzó con clínica cambiante: broncoespasmo, hipotensión arterial severa, sensación de quemazón generalizada y urticaria. Al cambiar a TAC (Sureflux ®), no presentó más RAMS.
La mayoría de las publicaciones sobre RAMS corresponden a casos aislados, como los que hemos presentado [18] [23] [24] [25] [26] [27] [28] [29] [30] [31] [32] [33] [34] [35] [36] [37]. Existen muy pocas publicaciones en las que se agrupen varios casos [14] [16] [17] [19].
En resumen, se debe sospechar una RAMS en aquellos pacientes en diálisis, en los que se utilicen dializadores con membranas sintéticas y que presenten una sintomatología aguda o crónica intradiálisis, no explicada por otras causas. La eosinofilia, el aumento de triptasa sérica o la hipocomplementemia ayudan al diagnóstico diferencial.
EPIDEMIOLOGÍA
Son muy pocos los estudios epidemiológicos publicados sobre las RAMS. En 1993, Simon y cols [38] realizaron un estudio con el objetivo de evaluar la incidencia de reacciones anafilactoides en HD, con membranas celulósicas y sintéticas y el papel de los IECAS en las mismas: estudiaron 1536 pacientes de 30 centros de diálisis (122694 sesiones) durante un periodo de 6 meses de observación. Encontraron una incidencia anual de 0.17/1000 sesiones con membranas celulósicas y 4.2/1000 sesiones con membranas sintéticas. La proporción de "reacciones alérgicas" era 10-20 veces mayor con las membranas sintéticas y 3-4 veces mayor en pacientes tratados con IECAS. La prevalencia de "reacciones alérgicas" graves era del 0.25% en el total de la población estudiada y del 0.5% en pacientes tratados con membranas sintéticas.
En un estudio realizado en España, entre 2015 y 2017 y en el que se recogen 1561 pacientes, pertenecientes a 9 unidades de HD, se encuentra una prevalencia de pacientes con RAMS del 2,37 % [17].
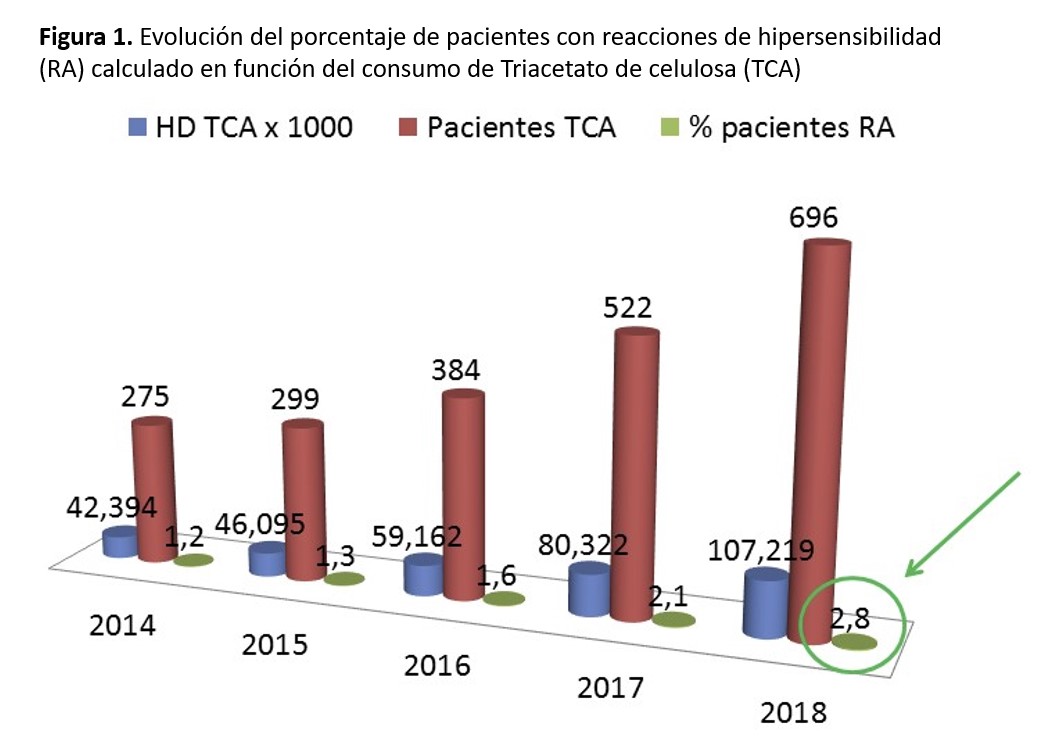
Cuando se estudia la incidencia/prevalencia de RAMS en una población en HD, se debe corregir por el número de pacientes incidentes o prevalentes en HD y no en función de las sesiones de HD. Esto es así porque el paciente diagnosticado de RAMS se comienza a dializar con TAC y no vuelve a tener reacciones alérgicas en las siguientes sesiones. En España, entre los años 2014 y 2018, los dializadores de TAC se han utilizado exclusivamente para dializar a los pacientes diagnosticados de RAMS. En muy pocas ocasiones, se han utilizado membranas de PMMA® o Evodial®. Con el dato de consumo de TAC en España durante estos años y los datos de prevalencia en HD del REER, hemos calculado la prevalencia de pacientes con RAMS. En la (Figura 1) observamos cómo hasta el año 2018, la prevalencia ha aumentado hasta un 2,8%. Esta proporción es semejante a la encontrada por Esteras y cols. [17]. En el estudio de Arenas y cols. [19] es un poco superior, 4,5 %, con una importante variabilidad entre las 15 UHD estudiadas.
CAUSAS DE LAS REACCIONES ALÉRGICAS A LAS MEMBRANAS SINTÉTICAS EN HEMODIÁLISIS
Las reacciones alérgicas a las membranas sintéticas de hemodiálisis se han descrito con la utilización de diferentes membranas: polisulfona, polietersulfona, polinefrona, poliaryletersulfona y poliacrilonitrilo [16] [17]. En algunos de los casos publicados, el paciente se había dializado con varias de estas membranas presentando con todas ellas RAMS, con diferente clínica. En cualquier caso, al pasar a dializarse con TAC no volvieron a presentar más reacciones [24].
En los últimos 20 años, se han realizado cambios en las membranas de polisulfona, con objeto de mejorar su rendimiento. Sin embargo, estos cambios han condicionado un empeoramiento de su biocompatibilidad. Se ha descrito que las RAMS serían más frecuente con las polisulfonas, pero hay que tener en cuenta que actualmente, son las membranas más utilizadas.
Todas las membranas implicadas en las RAMS tienen en común que contienen polivinilpirrolidona (PVP). Esta sustancia va incorporada en la membrana hidrofóbica para crear espacios hidrofílicos y mejorar la permeabilidad hidráulica. La cantidad de PVP y su situación en la membrana varía de unas membranas sintéticas a otras. El contenido de PVP y su elución difiere entre diferentes dializadores sintéticos: FX CorAL®, FX CorDiax® [Fresenius Medical Care]; Polyflux®, THERANOVA® [Baxter]; ELISIO® [Nipro]; Xevonta® [B. Braun], dependiendo del material de la membrana y del método de esterilización [39].
La duración de la incubación de la membrana de polisulfona en suero salino es determinante de la cantidad de PVP en el eluido. La metodología utilizada en el procedimiento del purgado y las condiciones de la circulación del suero salino influyen en la cantidad de PVP en el eluido de los dializadores de polisulfona [40].
Existen otras sustancias diferentes de la PVP que aparecen en el eluido de los dializadores de polisulfona y que también podrían estar implicadas en estas reacciones adversas. Entre ellas se encuentra el bisfenol A (BPA) [41].
Las diferencias en el comportamiento de las membranas con PVP respecto al TCA se encuentra una distinta interacción con la sangre [41][42]. La polisulfona adsorbe proteínas que participan en la interacción sangre-membrana, como la ficolina 2, fragmentos de fibrinógeno y proteínas procedentes de los hematíes, lo que puede contribuir a la activación del complemento, adhesión leucocitaria y coagulación sanguínea. Al contrario de otras membranas, el TAC carece de PVP y bisfenol A. Además, es capaz de adsorber gran cantidad de albúmina y apolipoproteínas, incrementando su biocompatibilidad y reduciendo la agregación plaquetaria. Se están desarrollando nuevas membranas sintéticas sin PVP o con modificaciones estructurales que podrían mejorar su biocompatibilidad [43] [44].
Se ha desarrollado un modelo matemático para predecir los biomarcadores inflamatorios liberados en los pacientes en HD, basado en la morfología, química y en el grado de afinidad de la membrana de diferentes dializadores [45].
MECANISMOS DE LAS REACCIONES ALÉRGICAS A LAS MEMBRANAS SINTÉTICAS EN HEMODIÁLISIS
Se entiende como reacción de hipersensibilidad la que ocurre cuando el sistema inmune reacciona de forma inapropiada y ocasiona un daño tisular. La anafilaxia es una reacción sistémica provocada por la liberación de mediadores después de la degranulación de mastocitos y basófilos. La anafilaxia puede deberse a un desencadenante inmunológico, dependiente de IgE, IgG o activación del complemento o a un desencadenante no inmunológico - MRGPRX2 [46][47].
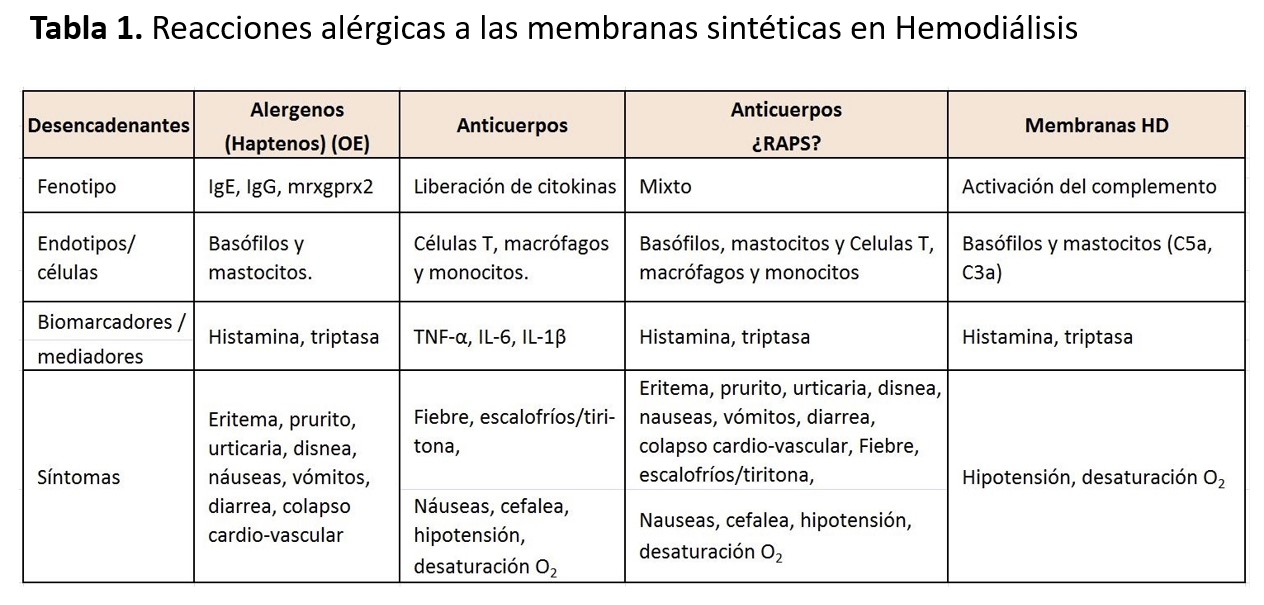
Se ha demostrado la presencia de basófilos y linfocitos T activados en sangre periférica de pacientes con reacciones de hipersensibilidad a la polisulfona, durante la reacción aguda [48]. También se ha visto que las concentraciones basales de triptasa estarían elevadas en pacientes alérgicos a dicha membrana [48]. Rodríguez-Sanz y cols. concluyen en su estudio que la degranulación de los basófilos y los niveles elevados de triptasa, que acontecen durante la reacción aguda en los pacientes alérgicos a las membranas sintéticas, demuestran la activación de los mastocitos y basófilos [48]. En ocasiones, se trataría de una reacción anafiláctica específica tipo I, mediada por IgE-basófilo o por activación del complemento; en otras ocasiones, se debería a la degranulación directa de los basófilos (Tabla 1). En algunos pacientes, se detecta activación del complemento e IL6. Podrían estar activados varios mediadores, lo que explicaría la clínica variable que presentan estos pacientes. Un componente expuesto o eluido de la membrana sería el responsable como adyuvante de la activación celular en los pacientes con RAMS [48][49].
TRATAMIENTO
El manejo va a depender de la severidad del cuadro clínico. Los casos agudos y graves se deben tratar parando la bomba sanguínea y desconectando las líneas sin retornar la sangre al paciente. Al mismo tiempo, se debe iniciar tratamiento sintomático: oxigenoterapia, esteroides intravenosos, antihistamínicos y broncodilatadores, según convenga. Si el paciente se estabiliza, se podría reiniciar la diálisis cambiando a un dializador de TAC. En los casos menos graves, el diagnóstico y tratamiento es ex juvantibus cambiando a un dializador de TAC. En la actualidad, existen dializadores de TAC de gran rendimiento y aptos para HDF-OL [10].
CONCLUSIONES
- Desde principios de este siglo se han descrito "reacciones alérgicas a las membranas sintéticas" (RAMS) en alrededor de un 3% de los pacientes en HD.
- Se deben sospechar ante la aparición de una sintomatología aguda o crónica durante la sesión de HD, no explicable por otras causas. La eosinofilia, el aumento de triptasa sérica o la hipocomplementemia ayudan al diagnóstico diferencial.
- La presencia de polivinilpirrolidona (PVP) en la membrana del dializador es un factor fundamental en su patogenia.
- El diagnóstico y tratamiento es ex juvantibus comprobando resultados al cambiar a una membrana de triacetato de celulosa (TAC).