Principios Físicos en Hemodiálisis
Palabras clave
Convección, Difusión, Ultrafiltración, Aclaramiento, Dialisancia, Retrofiltración
INTRODUCCIÓN
La hemodiálisis (HD) es una técnica de depuración extracorpórea de la sangre que suple parcialmente las funciones renales de excretar agua y solutos, y de regular el equilibrio ácido-básico y electrolítico. No suple las funciones endocrinas ni metabólicas renales.
Consiste en interponer entre 2 compartimientos líquidos (sangre y líquido de diálisis) una membrana semipermeable. Para ello se emplea un filtro o dializador (Véase Dializadores y membranas de diálisis).
La membrana semipermeable permite que circulen agua y solutos de pequeño y mediano peso molecular (PM), pero no proteínas o células sanguíneas, muy grandes como para atravesar los poros de la membrana.
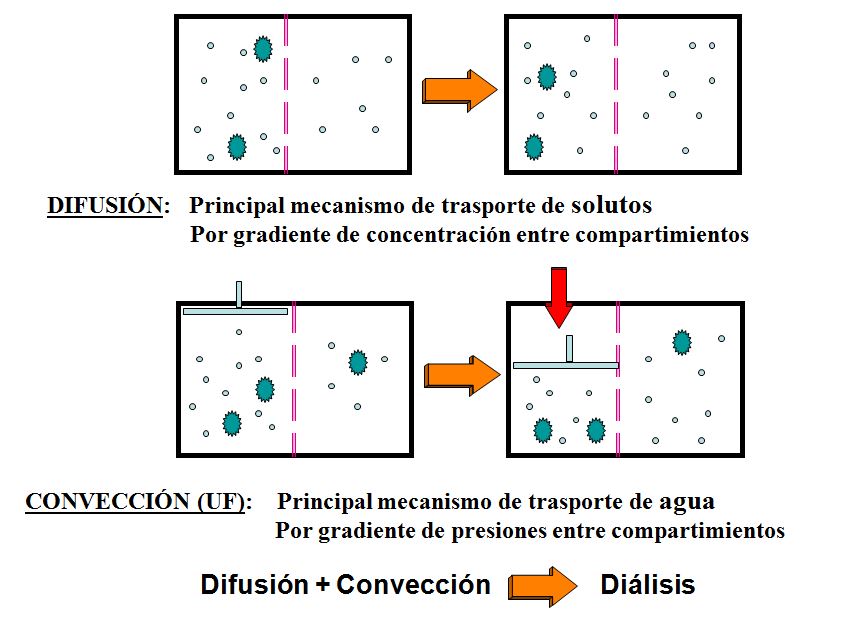
Los mecanismos físicos que regulan estas funciones son dos: la difusión o trasporte por conducción y la ultrafiltración o transporte por convección (Figura 1).
Las siguientes referencias bibliográficas describen pormenorizadamente los principios biofísicos en que se sustenta la técnica de diálisis:
1.- Frost T, Kerr DNS: Kinetics of hemodialysis: A theoretical study of the removal of solutes in chronic renal failure compared to normal health. Kidney Int 12: 41-50; 1977.
2.- Gotch FA, Sargent JA. A mechanistic analysis of the National Cooperative Dialysis Study. Kidney Int 1985;28:526–34.
3.- Keshaviah, P. Technology and clinical application of hemodialysis. In: The Principles and Practice of Nephrology, Jacobson, HR, Striker, GE, Klahr, S (Eds), BC Decker, Philadelphia, 1991, p. 740.
4.- Gotch FA: Kinetic modeling in hemodialysis, in Nissenson AR, Fine RN, Gentile DE (eds): Clinical Dialysis. Norwalk, CT, Appleton & Lange, pp 156-188, 1995
5.- Collins AJ, Keshaviah P: High-efficiency, high flux therapies in clinical dialysis. In Clinical Dialysis, edn 3. Edited by Nissenson AR. 1995:848–863
6.- Sargent J, Gotch F: Principles and biophysics of dialysis. En Jacobs C, Kjellstrand CM, Koch KM, Winchester JF (eds): Replacement of Renal Function by Dialysis (ed 4). Dordrecht, The Netherlands, Kluwer, pp 34-102, 1996.
7.- Collins AJ: High-flux, high-efficiency procedures. In Principles and Practice of Hemodialysis. Edited by Henrich W. Norwalk, CT: Appleton & Large; 1996:76–88.
8.- Hauk M et al: In Vivo Effects of Qd on Kt/V in MHD. Am J Kidney Dis 2000; 35:105-111.
9.- Leypoldt JK: Effect of increasing dialysate flow rate on KoA and dialyzer urea clearance. Semin Dial 11:195-196, 1998
10.- Daugirdas JT. Physiological principles and urea kinetic modeling. En: Daurgidas JT, Blake PG, Ing TS, eds. Handbook of dialysis, 4.ª ed. Little Brown, 2007; 25-58.
11.- Becker BN, Schulman BG. Chapter 77 - Technical Aspects of Hemodialysis. Therapy in Nephrology & Hypertension (Third Edition). A Companion to Brenner & Rector's The Kidney. 2008, Pages 845-858
12.- Ronco C, Cruz D. Adv Chronic Kidney Dis. 2007 Jul;14(3):231-43. Hemodiafiltration history, technology, and clinical results. Comprehensive Clinical Nephrology 2010, Pages 1053-1059
13.- Kotanko P, Kuhlmann MK, Levin NW. Chapter 89 - Hemodialysis: Principles and Techniques. Comprehensive Clinical Nephrology (Fourth Edition) 2010, Pages 1053-1059. https://doi.org/10.1016/B978-0-323-05876-6.00089-7
14.- Clinical Challenges and Technical Solutions. Krick G, Ronco C (eds): On- Line Hemodiafiltration: The Journey and the Vision. Contrib Nephrol. Basel, Karger, 2011, vol 175, pp 35–45
15.- A model to predict optimal dialysate flow. Alayoud A, Benyahia M, Montassir D, et al. Ther Apher Dial. 2012 Apr;16(2):152-8. doi: 10.1111/j.1744-9987. 2011.01040.x. Epub 2012 Feb 2.
16.- Tattersall JE, Ward RA; EUDIAL group. Online haemodiafiltration: definition, dose quantification and safety revisited. Nephrol Dial Transplant. 2013; 28(3): 542-50)
17.- Ronco C (ed): Expanded Hemodialysis: Innovative Clinical Approach in Dialysis. Contrib Nephrol. Basel, Karger, 2017, vol 191, pp 127–141 (DOI: 10.1159/000479261).
TRASPORTE POR DIFUSIÓN
Consiste en el trasporte pasivo de solutos a través de la membrana del dializador y se produce por la diferencia de concentración entre ambos compartimientos (Figura 1). La cantidad de un soluto que difunde a través de la membrana depende de dos factores:
Coeficiente de transferencia de masas del dializador (KoA)
Es el producto de la permeabilidad de dializador (Ko) por su superficie (A). Sus unidades son ml/min.
Está definido por la resistencia a la difusión de cada soluto (según su PM) en los 3 componentes del filtro: sanguíneo, membrana y dializado. A menor resistencia, mayor KoA y es específico de cada dializador.
El KoA es un indicador de la eficacia del dializador, es decir su máxima capacidad de extraer solutos. Es una propiedad intrínseca del dializador y es suministrado por el fabricante. Se calcula en función del flujo sanguíneo (Qb), del flujo de diálisis (Qd) y del aclaramiento (K), de acuerdo a la siguiente fórmula:
KoA = ((Qb*Qd)/(Qb-Qd)) * Ln ((1-K/Qb)/(1-K/Qd)) en ml/min
En HD, se emplea clásicamente el KoA de urea, proporcionando de esta manera el aclaramiento o depuración de urea en función del flujo de sangre y del líquido de diálisis. Tanto KoA como el K se expresan en ml/min. En otras palabras, el KoA es independiente del flujo de sangre o del dializador, pero conociendo el KoA, se puede estimar el K para determinado Qb.
Gradiente de concentración
Es la diferencia de concentración de un soluto entre el compartimiento sanguíneo y el del dializado. Este gradiente es óptimo cuando el líquido de diálisis circula sólo una vez (paso único), a contracorriente y paralelo al flujo de la sangre. Hoy en día todos los dializadores funcionan así.
TRASPORTE POR CONVECCIÓN O ULTRAFILTRACION (UF)
Consiste en el paso simultáneo a través de la membrana de diálisis del solvente (agua plasmática) acompañado de los solutos que pueden atravesar los poros de la membrana, bajo el efecto de un gradiente de presión hidrostática (Figura 1). El ultrafiltrado es el líquido extraído de la sangre a través de la membrana de diálisis por este mecanismo.
Su función es eliminar durante la sesión de diálisis el líquido retenido durante el período entrediálisis.
En sus origenes el trasporte por convección representaba una pequeña fracción de depuración de solutos y se empleaba principalmente para extraer exceso de agua en el menor tiempo posible, procurando minimizar los efectos hemodinámicos adversos. Con el advenimiento de nuevos dializadores, de mejor diseño y mayores tamaño y poro, se consiguieron mayores coeficientes de UF y de cribado para moléculas de mayor PM. Dado que esto se conseguía con mayor tasa de UF, surge la Hemodiafiltración en línea u on-line (HDF-OL), que expande las posibilidad de la diálisis combinando el alto flujo con mayor coeficiente de cribado.
El trasporte de solutos por UF depende de tres factores:
UF = SC * Cb * KUF * PTM
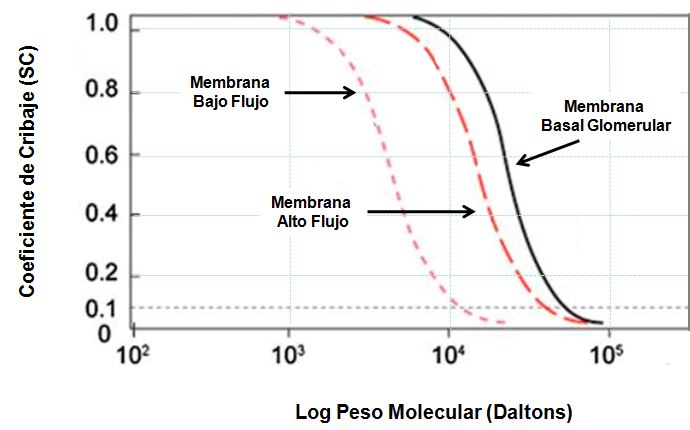
SC: coeficiente de cribado (sieving-coefficient) de la membrana para un soluto determinado, es la relación entre la concentración de un soluto en el ultrafiltrado y en el plasma. Para solutos de bajo PM (sodio, potasio y urea) es próximo a 1 (o sea, igual en el ultrafiltrado y en el plasma). A mayor PM, el SC disminuye dependiendo de la naturaleza de la membrana (Figura 2). La gama moderna de dializadores alcanza SC superiores a 0,80 para moléculas como la β2microglobulina.
Cb : concentración sanguínea del soluto.
KUF: es el coeficiente de UF y depende de la permeabilidad de la membrana y de su superficie. Es una propiedad física correspondiente a su capacidad de transferir solvente y se expresa como el número de ml de líquido que se filtran por hora y por cada mmHg de presión transmembrana.
PTM: la presión transmembrana corresponde al gradiente de presión que existe dentro del dializador entre el compartimento sanguíneo y el líquido de diálisis. Resulta de la diferencia entre la presión positiva del circuito sanguíneo y la negativa, nula o positiva del líquido de diálisis menos la presión osmótica sanguínea (ésta depende de la presión oncótica de las proteínas no dializables, que tiende a retener agua en el compartimiento sanguíneo y su valor medio es de 25-30 mmHg).
Las presiones en los compartimentos de la sangre y del dializador se estiman en general a partir de las presiones medidas en las líneas de salida de la sangre y del líquido de diálisis. Algunos monitores determinan la PTM mediante 3 y hasta 4 puntos. Los actuales monitores de hemodiálisis controlan directamente la cantidad de UF mediante un control volumétrico que permite mejorar la precisión de la UF, y utilizar con seguridad filtros de alta permeabilidad.
Los métodos actuales de control de ultrafiltración y el desarrollo de biosensores ha supuesto un considerable avance en el control de los parámetros hemodinámicos de pacientes cada vez más precarios.
TRANSFERENCIA DE MASAS (TM)
Se define como la cantidad de un soluto que es transferido desde un compartimiento al otro del dializador en determinado tiempo. En HD, se transfieren solutos urémicos desde la sangre al líquido de diálisis y tampones y calcio en sentido inverso.
El sentido de la transferencia se determina por las concentraciones respectivas de los solutos (difusión) y por las diferencias de presión entre ambos compartimientos (UF).
La transferencia de masa depende del coeficiente de cribado, ya que la depuración de solutos es en función de su peso molecular.
Se puede calcular desde el compartimiento sanguíneo o desde el líquido de diálisis:
TM (mg/min) = Qb * (Cbe - Cbs) = Cd * Qd
Qb : flujo sanguíneo (ml/min)
Cbe : Concentración del soluto en sangre a la entrada del dializador (mg/ml)
Cbs : Concentración del soluto en sangre a la salida del dializador (mg/ml)
Cd: Concentración del soluto en el líquido de diálisis (mg/ml).
Qd: flujo del líquido de diálisis (ml/min).
La TM global (durante toda la sesión de diálisis), la podemos estimar directamente del compartimiento sanguíneo, asumiendo, como es en el caso de la urea, que su volumen de distribución es el agua corporal total:
TM global (mg): (Cs1 * (VDU + ΔP)) - (Cs2 * VDU)
Cs1: Concentración del soluto prediálisis (mg/ml)
Cs2: Concentración del soluto posdiálisis (mg/ml)
VDU: Volumen de distribución de la urea: 58% peso corporal o fórmula de Watson:
Hombres: 2,447-(0,09516*Edad[años])+(0,1074*Talla [m])+(0,3362*Peso [Kg])
Mujeres: -2,097*(0,1069*Talla [m])*(0,2466* Peso [Kg])
ΔP: pérdida de peso durante la diálisis (ml)
Actualmente se ha constatado que estas rudimentarias ecuaciones se alejan bastante de la realidad, especialmente en pacientes cuyos parámetros antropométricos se alejan de los valores medios de la población. En este sentido, el empleo de equipos de bioimpedancia está demostrando una mejor precisión en la determinación de la composición corporal en general y del volumen de distribución de la urea en particular.
ACLARAMIENTO (K)
Se emplea para estimar la eficacia del dializador. Es la TM dividida (es decir corregida) por la concentración sanguínea del soluto y se calcula de forma similar al K renal:
K renal (ml/min) = Cu x Vo / Cs
Cu: concentración del soluto en orina (mg/ml)
Cs: concentración del soluto en sangre (mg/ml)
Vo: volumen minuto urinario (ml/min)
K del dializador (ml/min, medido desde el líquido de diálisis)
Se calcula de forma similar, midiendo su concentración en el líquido de diálisis y conociendo su volumen. Esta técnica es precisa, pero requiere la recogida completa del líquido de diálisis. Actualmente existen en el mercado monitores, que determinan la concentración de urea “on-line” en el líquido de diálisis o que permiten la colección en alícuotas del líquido de diálisis para la determinación de solutos y que ahorran la recogida completa del líquido de diálisis.
La fórmula es la siguiente: Cd * Vd / Cs
Cd: concentración del soluto en el líquido de diálisis (mg/ml)
Vd : volumen minuto del líquido de diálisis (ml/min)
Cs: concentración del soluto en sangre (mg/ml)
Cuando queremos medir el K total durante toda la sesión de diálisis, la Cs se obtiene de la siguiente forma:
Cs= (Cs1 - Cs2)/ Ln (Cs1/Cs2)
Cs1: Concentración del soluto prediálisis (mg/ml)
Cs2: Concentración del soluto posdiálisis (mg/ml)
Y la fórmula completa será:
K dializador (ml/min): Cd x Vd / ((Cs1 - Cs2)/ Ln (Cs1/Cs2))
Actualmente, muchos monitores permiten estimar el K de urea mediante la medida de la dialisancia iónica (Véase Monitores de Hemodiálisis y Biosensores).
K dializador (ml/min medido desde el compartimiento sanguíneo)
Se calcula el descenso del soluto tras su paso por el dializador. Se obtiene multiplicando el flujo sanguíneo por el porcentaje de descenso de la concentración de soluto a su paso por el dializador.
K dializador (ml/min): (Cse - Css)/Cse x Qb
Cse : concentración del soluto en sangre a la entrada del dializador (mg/ml)
Css : concentración del soluto en sangre a la salida del dializador (mg/ml)
Qb: flujo sanguíneo (ml/min)
Con esta fórmula se obtiene el K por mecanismo difusivo. Debemos añadirle el componente de K por UF, que se obtiene por la siguiente fórmula :
Css/Cse x FUF
FUF : flujo de ultrafiltración (ml/min)
El K total de un dializador será la suma de los K por difusión y UF y se expresa en ml/min.
[(Cse - Css)/Cse x Qb] + [Css/Cse x FUF]
También partiendo del K se puede medir la TM global durante una sesión de HD:
TM global: K * ((Cs1 - Cs2)/ Ln (Cs1/Cs2)) x Td
Td: tiempo en diálisis (min).
Dialisancia
La dialisancia iónica se define como la transferencia de iones a través de la membrana del dializador en ambos sentidos. Está basada en la medida de la conductividad en el líquido de diálisis a la entrada y a la salida. La conductividad a la entrada depende de la cantidad de iones disueltos en el líquido de diálisis, mientras que la conductividad a la salida depende del efecto que el intercambio de iones con el plasma ejerce sobre la conductividad a la entrada del líquido de diálisis. Asumiendo que la transferencia de iones es similar a la transferencia de urea, se puede concluir que la dialisancia iónica y el aclaramiento de urea son similares. Muchos de los modernos monitores de HD incluyen la determinación contínua de este parámetro, que se muestra en pantalla.
FACTORES QUE INFLUYEN EN LA EFICACIA DE LA DIALISIS
Superficie del dializador
A mayor superficie, mayor difusión. Un factor limitante es el volumen sanguíneo extracorpóreo. Se deben reducir los espacios muertos mediante un óptimo diseño de la geometría del dializador. La relación superficie eficaz/volumen sanguíneo es mejor en los dializadores capilares, actualmente de empleo universal. En este sentido se puede considerar óptimo un volumen en el compartimento sanguíneo < 120 ml, para 2 m2 y volumen de sangre residual < 1 ml.
Efecto del flujo sanguíneo (Qb)
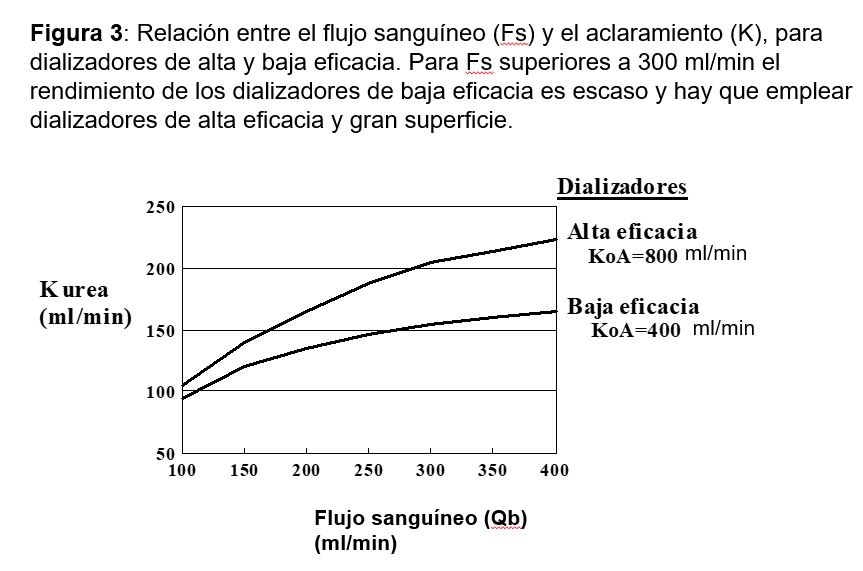
Para optimizar los Qb altos hay que utilizar dializadores de alta eficiencia que son aquellos que tienen un elevado KoA. Así, si para un dializador de moderada eficiencia el incremento de Qb de 200 ml/min a 400 ml/min implica un incremento de K de 25 %, mientras que para un dializador de elevada eficiencia este incremento será del 40 %.
Utilizando dializadores estándar tiene mínimas ventajas en términos de K aumentar el Qb por encima de 350 ml/min. Sin embargo, el advenimiento de dializadores de alto flujo, con elevado trasporte convectivo, ha modificado el esquema clásico, recomendándose por tanto Qb de 400-450 ml/min. Como concepto práctico, para un Qb >400 ml/min se debe utilizar agujas de calibre 15G o incluso 14G, para evitar elevadas presiones venosas.
Efecto del flujo del líquido (Qd) de diálisis
El aumento del K de solutos por difusión también depende del Qd. A mayor Qd, mayor K, aunque habitualmente no es muy importante. Para Qb entre 200-300 ml/min, los Qd óptimos son de unos 500 ml/min. Cuando se usan dializadores de alta eficiencia con Qb mayores de 350-400 ml/min, empleando Qd de 800 ml/min se consiguen incrementos de K urea del orden del 10%, aunque no aporta ventajas para el K de β2 microglobulina.
Contando con las prestaciones actuales de los dializadores, el Qd óptimo en HD y HDF-OL está entre 400 y 500 ml/min y no tiene justificación utilizar un Qd de 700 a 1000 ml/min. Algunos monitores modernos ajustan automáticamente el Qd en función del Qb con el objetivo de ahorrar líquido de diálisis.
Influencia del peso molecular (PM)
Cuanto menor es el PM mayor es su velocidad dentro de la fibra, colisionando más frecuentemente con la membrana, lo que facilita su transporte por difusión.
Para moléculas de bajo PM (urea=60 Daltons) la permeabilidad dependerá principalmente de la resistencia en la película de sangre y el líquido de diálisis, y será función, en gran medida, de los Qb y Qd.
Para moléculas de mediano PM (500-5000 daltons, ej: vitamina B12=1355 daltons) o incluso mayores, el principal factor limitante de la permeabilidad será la resistencia de la membrana, y dependerá de sus características (número y tamaño de los poros) y de la duración de la diálisis, en tanto que el Qb es menos importante.
Mientras que para solutos de pequeño PM la difusión es mucho más importante que la UF, para solutos de PM elevado la convección es el mecanismo más relevante.
Más allá del KoA, se valora la eficacia del dializador en su capacidad de extraer moléculas de mayor tamaño. Actualmente, se dispone de dializadores con SC para la β2microglobulina de hasta 0,8-0,9.
Efecto de la masa celular de la sangre
Los solutos que medimos para determinar los aclaramientos están disueltos en la parte líquida de la sangre, mientras que en el paquete celular la concentración de dichos solutos varía según su capacidad de movimiento a través de las membranas celulares.
Este concepto debe tenerse en cuenta cuando se comparan K de dializadores "in vitro" e "in vivo", así como para conocer el flujo sanguíneo efectivo dializable.
Por ejemplo, para un Qb de 300 ml/min, el flujo plasmático para un hematocrito del 30% será de 210 ml/min y el flujo del paquete hemático de 90 ml/min.
Los solutos como la urea, de rápida movilidad a través de la membrana del hematíe, están disueltos en el agua del plasma y de los hematíes. Aproximadamente el 93 % del plasma y el 80 % de los hematíes es el espacio de distribución para la urea. Si el flujo es de 300 mL/min y el hematocrito del 30%, el flujo correspondiente al componente acuoso de la sangre de donde se pueden extraer solutos en solución será el siguiente:
- Flujo de agua del plasma: 0.93 x 210 ml/min = 195 ml/min.
- Flujo de hematíes: 0.80 x 90 ml/min = 72 ml/min.
- Flujo del componente acuoso de la sangre = 267 mL/min. Así, para el supuesto de un hematocrito (Hto) del 30% el flujo sanguíneo susceptible de depuración dialítica de urea sería el 89 % del flujo sanguíneo programado.
La fórmula del flujo del componente acuoso de la sangre (Qca) queda de este modo:
Qca = Qb x (0,80 x Hto/100 + 0,93 x (1 - Hto/100)
El K total del dializador corregido para el componente acuoso de la sangre será el siguiente :
[(Cse - Css)/Cse x Qb x (0,80 x Hto/100 + 0,93 x (1 - Hto/100)] + [Css/Cse x FUF]
Con esta fórmula se corrige el efecto del agua plasmática y el hematocrito sobre el aclaramiento.
El incremento del hematocrito para solutos como la urea con un volumen de distribución parecido entre plasma y hematíe no supondrá un gran problema, pero para otros solutos como el fósforo si tiene cierta significación. Así, si el hematocrito pasa del 20 a 40% hay una reducción en la eliminación de fósforo de aproximadamente el 13 %. La importancia del hematocrito sobre los K, se ha hecho patente desde la introducción de la eritropoyetina.
DEFINICIONES
En base a los conceptos previos y con la llegada de nuevas tecnologías, se han ido acuñando conceptos que resumimos a continuación:
Diálisis de bajo y alto flujo
Se basa en la capacidad de UF, es decir, a la magnitud de la permeabilidad al solvente.
De forma orientativa se consideran
• De baja permeabilidad o bajo flujo: QUF < 20 ml/hora/mmHg.
• De permeabilidad intermedia: QUF 20-40 ml/hora/mmHg.
• De alta permeabilidad o alto flujo: QUF es > 40 ml/hora/mmHg. Hoy en día las prestaciones de los nuevos dializadores superan los 40 ml/hora/mmHg.
La introducción y expansión del empleo de altas tasas de UF, especialmente en la modalidad HDF-OL, ha actualizado la forma de expresar el trasporte convectivo. Un transporte convectivo efectivo se consigue cuando representa al menos el 20% del volumen total de sangre procesado, es decir la fracción de filtración (%) = tasa de ultrafiltración x 100 / Flujo sanguíneo debe superar el 20%. Efectivamente, se registran beneficios de la HDF cuando el volumen efectivo de convección es superior a los 20 L (Véase HDF en línea).
Diálisis de Baja Eficacia y diálisis de Alta Eficacia
La eficacia del dializador actualmente se basa, no solo en su capacidad de depurar moléculas pequeñas (urea) sino también moléculas de mediano tamaño.
En función de la depuración de moléculas pequeñas, representadas por la urea, la eficacia del dializador se expresa en términos de KoA (Figura 3).
• Baja eficacia: < 400 ml/min
• Alta eficacia: > 800 ml/min
La eficacia de depuración de moléculas medias del dializador se base en el SC. Actualmente el parámetro más utilizado para evaluarla es el SC de la β2 microglobulina (PM 11.800), que debería ser superior a 0,6 y compatible con un SC para la albúmina <0,01, y siempre con pérdidas menores de 4 gr/sesión. Dializadores modernos presentan un SC para β2 microglobulina >0,8 con pérdidas de albúmina cada vez más bajas.
Estos últimos objetivos solo se consiguen aplicando membranas de Alto flujo. Es decir la combinación de Alto Flujo y Alta Eficacia, siendo actualmente la HDF-OL la que aporta mejores resultados.
Conceptos de KT y KT/V
Estas sencillas ecuaciones basadas en el modelo cinético de la urea, se han empleado clásicamente para expresar la dosis de diálisis. El significado es para KT: K de urea multiplicado por el tiempo de HD; y para KT/V: KT dividido por el volumen de distribución de la urea.
Brevemente, las recomendaciones actuales de dosis de diálisis según las guías prácticas para HD americana, europea, canadiense, australiana o española, son de un KT/V mínimo de 1.2 y/o un PRU del 65%, recomendando un KT/V de 1.3 y un PRU del 70% para asegurar estos mínimos. Asimismo, las recomendaciones basadas en el KT, aconsejan alcanzar unos valores mínimos de 45 L (Véase Dosis de Diálisis).
Por último, el tiempo de HD es el elemento más importante y siempre eficaz sobre el que podemos influir para mejorar la dosis. La recomendación de las guías europeas y españolas es un tiempo mínimo de 12 horas semanales.
RETROFILTRACIÓN
Es la transferencia de soluto y solvente desde el líquido de diálisis a la sangre. Ocurre por transporte convectivo inverso en el último tramo del dializador cuando se invierte el gradiente de presión.
Clásicamente se consideraba un factor indeseable de la modalidad de diálisis de alto flujo, dado el riesgo de transferencia de endotoxinas bacterianas (1.000-15.000 daltons) desde el compartimento del líquido de diálisis hacia la sangre. Actualmente con el empleo de agua ultrapura con garantías, la retrofiltración resulta un factor de filtración inversa favorable que ayuda a mejorar el transporte convectivo y por tanto, la eficacia de diálisis. Funciona como mecanismo de reinfusión asociada a la HD, similar a lo que sucede en la modalidad de HDF-OL. El aprovechamiento de la retrofiltración se ha dado en llamar HDF interna. El empleo actual de dializadores con alta permeabilidad hidraúlica, altos SC para medianas moléculas y con menor diámetro interno de los capilares (inferior a 200 micras), consigue tasas de HDF interna elevadas, con eficacias en la depuración de medianas moléculas próximas a las de la HDF-OL. Este concepto se ha denominado “HD extendida ”.