Nutrición en la Enfermedad Renal Crónica
ÍNDICE
Introducción.
Resumen conceptual: necesidad de una dieta individualizada y no demasiado restrictiva.
Requerimientos nutricionales en la Enfermedad Renal Crónica estadios 3-5 no en diálisis (ERC-ND)
Hidratación
Ingesta salina
Balance energético y manejo del síndrome metabólico
Ingesta proteica: cantidad y calidad
Ingesta de Fósforo
Ingesta de Calcio
Ingesta de Potasio
Carga ácida y acidosis
Ingesta de fibra y probióticos
Patrones dietéticos y progresión renal
Conclusiones
INTRODUCCIÓN
La enfermedad renal crónica (ERC) es un trastorno sistémico asociado a alta mortalidad, mala calidad de vida y gran coste social. Su progresión depende de factores hemodinámicos y metabólicos —como hipertensión, hiperfiltración y proteinuria— estrechamente relacionados con la dieta [1] [2] [3]. Además, la incapacidad del riñón para mantener la homeostasis nutricional provoca sobrecarga de líquidos, alteraciones electrolíticas, acidosis, desregulación hormonal e inflamación [4]. Por ello, como parte de las medidas higiénico-dietéticas, el asesoramiento nutricional debe ser una medida clave para las personas con enfermedad renal crónica avanzada (ERCA) [5] [6]. Los cuidados dietéticos son fundamentales en esta población de pacientes, tanto como medida nefroprotectora, antiproteinúrica y preventiva del sobrepeso en la etapa prediálisis, como para evitar la desnutrición en todos los estadios, especialmente en las etapas de diálisis.
RESUMEN CONCEPTUAL: NECESIDAD DE UNA DIETA INDIVIDUALIZADA Y NO DEMASIADO RESTRICTIVA
Seguir una “dieta renal” puede resultar complejo debido al elevado número de restricciones que conlleva, lo que dificulta la adherencia del paciente. Es importante evitar limitaciones excesivas, ya que pueden comprometer la ingesta nutricional. En personas con una tasa de filtrado glomerular (FG) ≥60 ml/min/1.73 m², generalmente no son necesarias modificaciones dietéticas específicas; en estos casos, lo recomendable es mantener pautas similares a las de la población general: reducir el consumo de sodio y azúcares refinados, limitar carnes rojas y procesadas, y favorecer una dieta rica en frutas, verduras, legumbres, pescado, aves y cereales integrales [7]. En cambio, en los estadios más avanzados de la enfermedad renal, la alimentación debe adaptarse progresivamente, considerando tanto el tipo de tratamiento sustitutivo renal (cuando esté indicado) como la presencia de otras comorbilidades asociadas [4]. A la hora de realizar estas recomendaciones, nuestra primera premisa será garantizar un adecuado soporte calórico, proteico y mineral. Nunca el precio a pagar por una dieta nefroprotectora o hipocalórica debe ser una nutrición insuficiente. Además, las recomendaciones de nutrientes deben adecuarse al peso ideal -no real- y corregirse para el gasto energético y la actividad física del paciente. Dicho esto, conviene adelantar la siguiente reflexión: las recomendaciones dietéticas clásicamente impuestas al paciente anúrico en diálisis son muy restrictivas y en buena medida se han trasladado históricamente al paciente en estadios menos avanzados. Por ejemplo, si limitamos indiscriminadamente la ingesta de verduras y frutas por el temor a la aparición de hiperpotasemia, estaremos fomentando la adopción de dietas poco saludables donde se pierden los efectos positivos que tiene las vitaminas, los minerales y la fibra [8] [9] [10]. Del mismo modo, los ayunos prolongados que inducen insulinopenia, acidosis e hiperkalemia, puede resultar más perjudiciales que beneficiosos. A todo esto, debemos añadir que el riesgo de sobrecarga de volumen en pacientes con ERCA estadios 4 (E4) y 5 (E5) no en diálisis (ND), principalmente en pacientes cardiópatas, ha llevado a contener la ingesta líquida, en una población que naturalmente mantiene un alto flujo urinario. Por último, aunque las dietas bajas en proteínas son seguras incluso en población renal anciana y han demostrado beneficios para enlentecer la progresión renal y mejorar la calidad de vida, dicha dieta puede ser peligrosamente restrictiva si no se acompaña de un adecuado aporte energético [5] [11]. Por todo ello, y considerando la evidencia disponible, animamos a evitar modelos dietéticos demasiados estrictos, y valorar una individualización más flexible de las recomendaciones dietéticas, teniendo siempre presente el contexto clínico y el bienestar del paciente, así como el valor social y emocional que puede tener la alimentación en su calidad de vida.
Requerimientos nutricionales en la ERC-ND
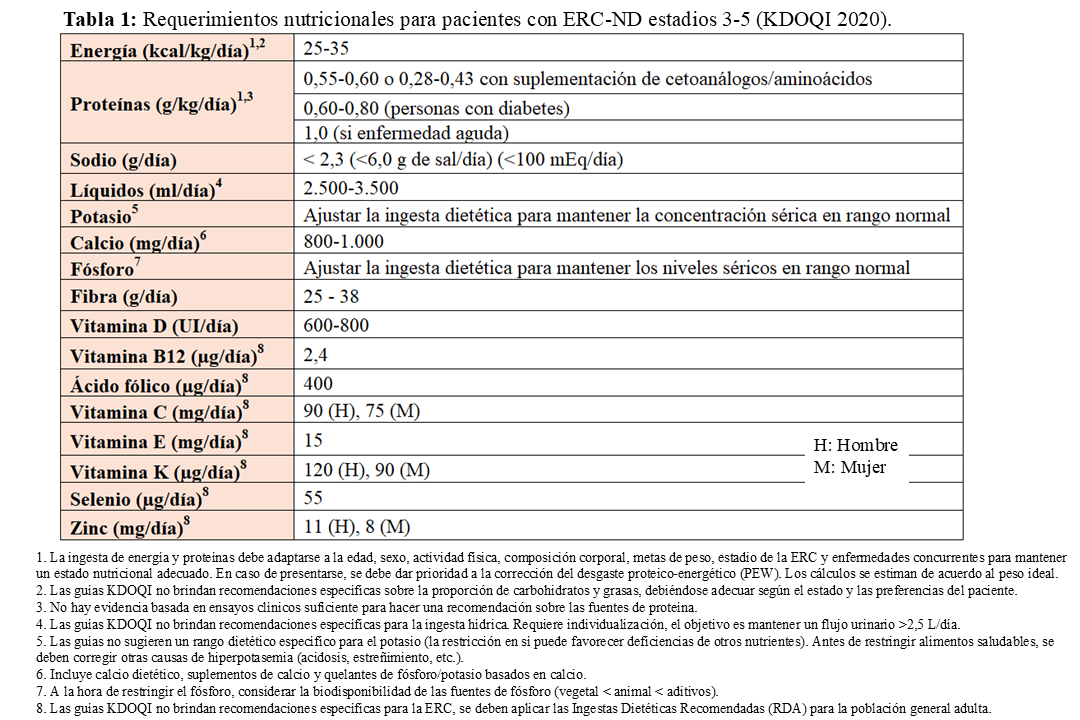
La (Tabla 1) resume las recomendaciones actuales sobre los requerimientos nutricionales en adultos con ERC-ND. En términos generales, se aconseja una ingesta energética de 25-35 kcal/kg/día, con el fin de compensar el aumento del gasto en reposo asociado a la inflamación y las comorbilidades y de mantener un balance nitrogenado neutro o positivo. No obstante, estas recomendaciones deben individualizarse según la edad, la masa magra (determinante principal del gasto energético), el nivel de actividad física y la causa subyacente de la enfermedad renal [12] [13]. En los últimos años, diversos estudios, ensayos clínicos y metaanálisis han evidenciado la eficacia de la restricción proteica y otras intervenciones nutricionales sobre los resultados renales [14] [15] [16] [17] [18] [19] [20]. Esta evidencia ha sido considerada suficiente para fortalecer las recomendaciones sobre el manejo nutricional de los pacientes con ERC en la actualización de las guías KDOQI de 2020 (evidencia 1A) [5]. Dichas guías establecen que los pacientes estables con ERC-ND en estadios 3-5 deberían consumir 0,55-0,60 g/kg/día de proteínas. Esta cifra puede reducirse hasta 0,28-0,43 g/kg/día siempre que se acompañe de 7-15 g/día de cetoanálogos (KAs) y aminoácidos (AA) esenciales. En pacientes con diabetes, se recomienda un aporte algo mayor, entre 0,6 y 0,8 g/kg/día, para favorecer el control glucémico. Es importante tener en cuenta que episodios catabólicos intercurrentes pueden exigir un incremento tanto de energía como de proteínas, independientemente del estadio de ERC [21].
En cuanto a la calidad proteica, aunque de acuerdo con las guías K-DOQI no existe evidencia concluyente derivada de ensayos clínicos que permitan recomendar un tipo particular de proteína (animal o vegetal) en personas con ERC, numerosos estudios observacionales han sugerido que las proteínas de origen vegetal pueden tener efectos más nefroprotectores que las proteínas de origen animal. Una dieta rica en proteínas de fuentes vegetales podría ralentizar la progresión renal y mejorar la acidosis metabólica, disminuyendo la proteinuria, la ingesta de fósforo, los niveles de toxinas urémicas y la producción endógena de ácido [22].
Entre las recomendaciones adicionales destacan:
- Sodio: limitarlo a <2.3 g/día para mejorar el control de volumen, reducir la presión arterial y disminuir la proteinuria, en sinergia con la terapia farmacológica. [23] [24].
- Fibra: se aconseja un consumo de 25-38 g/día o más, en línea con la población general.
- Potasio: la restricción estricta suele ser innecesaria hasta fases avanzadas de la ERC o si existe riesgo alto de hiperpotasemia. Antes de restringir alimentos saludables, se recomienda corregir otras causas de hiperpotasemia (como acidosis metabólica o uso de inhibidores del sistema RAAS) y evitar productos con alto potasio, pero bajo valor nutricional.
- Acidosis metabólica: dado que es un factor de riesgo en la progresión de la ERC, el consumo de frutas y verduras puede constituir una alternativa al bicarbonato oral, reduciendo el riesgo de retención de líquidos o hipertensión [25].
- Calcio y fósforo: en pacientes con ERC estadio 3-4, se recomienda limitar el calcio total (dieta + suplementos + quelantes cálcicos) a 800-1000 mg/día, especialmente si no reciben análogos de vitamina D. Para el fósforo, las guías actuales sugieren ajustar la ingesta para mantener niveles séricos normales, en lugar de aplicar una restricción universal. Se enfatiza evitar alimentos procesados con aditivos fosforados y fomentar preparaciones caseras con alimentos frescos, preferentemente vegetales [26].
- Vitamina D: la recomendación general es 600-800 UI/día, aunque los niveles séricos óptimos siguen siendo controvertidos, se sugiere mantenerlos entre 20 y 40 ng/mL [27].
HIDRATACIÓN
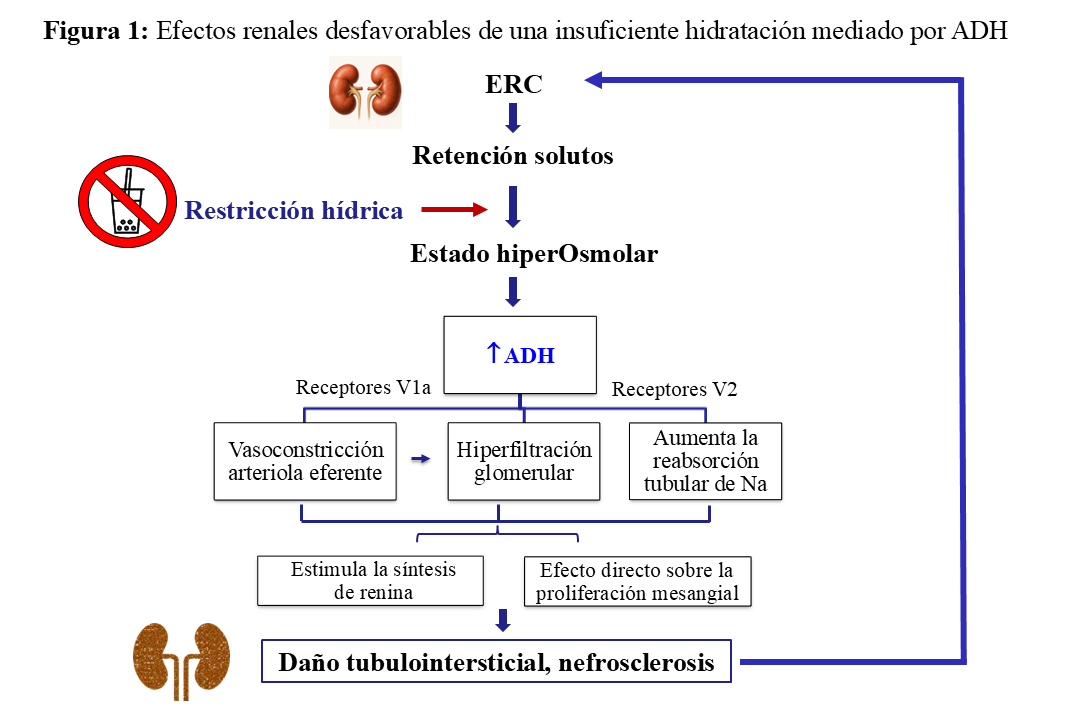
Existe un importante vacío de información en la Guías de manejo de la ERC sobre los potenciales beneficios de una adecuada hidratación para prevenir el daño renal. Aunque no hay evidencias concluyentes, estudios experimentales y poblacionales sugieren que la cantidad de líquido ingerida puede ser un factor de riesgo de ERC no establecido. Los efectos renales adversos de una insuficiente hidratación podrían estar mediados por el incremento de vasopresina (Figura 1). En este sentido, una ingesta hídrica generosa, al menos para eliminar la carga osmótica, puede ayudar a preservar la función renal en pacientes con ERC que conservan la capacidad de generar alto volumen de orina. Aunque siempre requiere individualización, el objetivo es mantener un flujo urinario >2,5 L/día. La hidratación en la ERCA se trata en formato extenso en otro apartado [28] [29] [30] [31] [32].
Los conceptos clave los resumimos a continuación (Tabla 2).
INGESTA SALINA
La ingesta de sodio es un factor modificable que influye en la progresión de la ERC y en el riesgo cardiovascular. El consumo elevado de sal favorece la sobrecarga de líquidos, la hipertensión y la proteinuria, y se asocia con menor supervivencia del injerto en trasplantados renales [33] [34] [35] [36] [37] [38]. La limitación de la ingesta salina es una indicación clásica, tanto en pacientes con ERCA, como en tratamiento renal sustitutivo [9] [11] [39] [40], estando incluso relacionada con la progresión acelerada del daño renal [23] [41] [42]. Es importante para prevenir la retención hidrosalina, coadyuvante en el control de la tensión arterial, e incluso reduce la proteinuria y facilita el efecto de los bloqueantes del eje renina angiotensina [43] [44] [45] [46] [47].
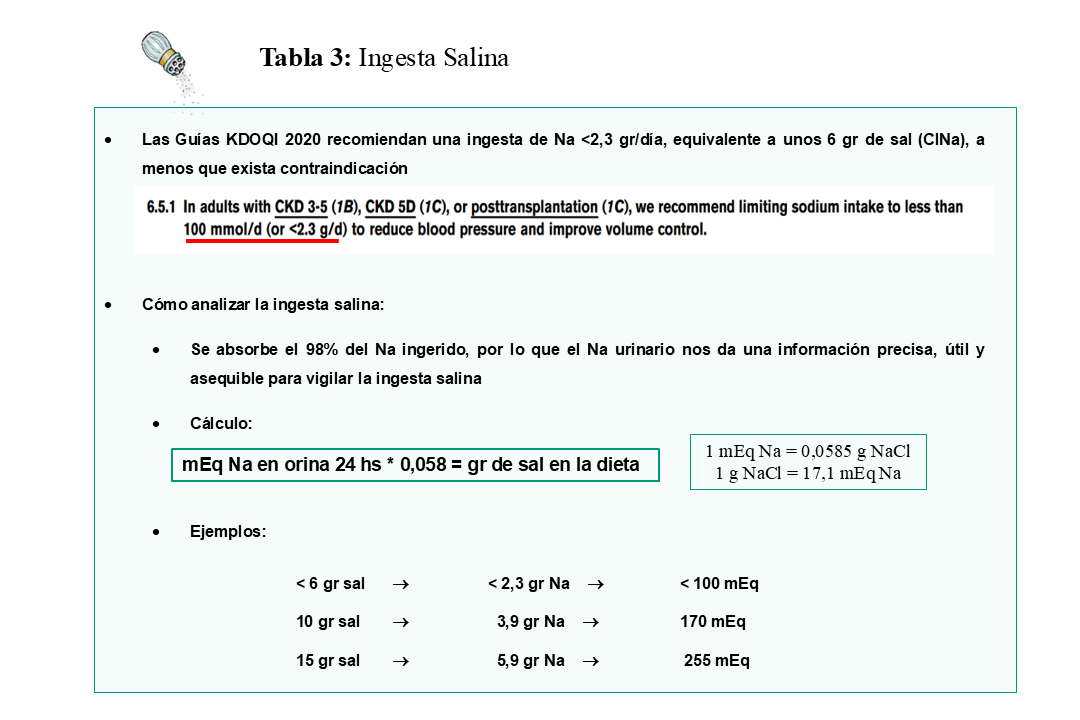
Debemos considerar como muy importante, el poder verificar objetivamente la ingesta salina para favorecer la adherencia a esta prescripción. El método más asequible para vigilar la ingesta salina es la eliminación urinaria de sodio y debemos hacer hincapié en la importancia de medir el sodio urinario durante las revisiones habituales en consulta. Ahora bien, ¿es útil el sodio urinario como indicador de la ingesta de sal? No es fácil encontrar respuesta en la literatura y la información debe buscarse en los libros clásicos de fisiología humana. En condiciones normales, la excreción fecal de sodio es inferior al 0,5% del contenido intestinal del ion, gracias a su rápida y efectiva absorción por la mucosa intestinal. Por lo tanto, si consideramos que casi la totalidad del sodio ingerido es absorbido por el intestino (98%), tenemos que la eliminación urinaria de sodio es un buen reflejo de la ingesta de sal. Aunque existe siempre el riesgo de una inadecuada recolección de orina de 24 horas, varios estudios han destacado que es el método más práctico para verificar la ingesta de sal [48] [49] [50] [51] [52]. Aunque la ingesta de sodio recomendada por la OMS para la población general es de < 2 gr/día, es decir < 5 gr de sal [53] https://www.who.int/news-room/fact-sheets/detail/sodium-reduction.
Las nuevas Guías KDOQI 2020 [54] sitúan la ingesta máxima diaria de Na en 2,3 gr (6 gr de sal, 100 mEq) (Tabla 3), con el fin de mejorar el control de volumen, reducir la presión arterial y disminuir la proteinuria. Sin embargo, la ingesta habitual de sal en la población general es de 9-12 gr/día, incluso mayor en muchas regiones; y que se corresponden con una eliminación urinaria de Na de 160-200 mEq/día o más [52]. Conseguir una ingesta salina de 6 gr al día, equivalente a una eliminación urinaria de Na de 80-100 mEq de sodio/día, es una opción posibilista, pero muy difícil de alcanzar, incluso cuando vigilamos a pacientes adherentes a las indicaciones.
BALANCE ENERGÉTICO
El gasto energético en pacientes con ERCA clínicamente estables es semejante a la población general y, por lo tanto, también lo son sus requerimientos calóricos. De este modo, se recomienda una ingesta calórica de 25 a 35 Kcal / kg ideal / día aproximadamente [24] [25] [26] [27] [55] [56] [57] [58]. Las guías KDOQI indican que el aporte calórico total debe completarse preferentemente con grasas e hidratos de carbono, pero sin especificar proporciones concretas (como lo hace, por ejemplo, la OMS o las guías dietéticas para la población general). Aunque no hay un desglose exacto del % de carbohidratos y grasas, se recomienda que el nutricionista realice un ajuste de forma individualizada, conforme al estado lipídico e hidrocarbonado y las preferencias del paciente, priorizando el consumo de grasas insaturadas, como las de origen vegetal (aceite de oliva, aguacate, frutos secos), evitando las grasas trans y limitando las saturadas. Los hidratos de carbono deben provenir preferentemente de fuentes complejas y con alto contenido en fibra, como verduras, frutas y cereales integrales, especialmente si no hay hiperpotasemia [9]. Recomendar un balance energético adecuado implica no sólo el control de la ingesta calórica, siendo también la modificación de los hábitos de vida. Además de recomendar la abstinencia de los hábitos tóxicos y la actividad física acorde; prevenir el déficit nutricional y el control del sobrepeso deben ser pautas prioritarias en el control de las personas con ERC [6].
La restricción calórica dietética y el ejercicio físico contribuyen a disminuir el estrés oxidativo y la inflamación, mientras que la pérdida de peso puede favorecer un mejor control de la presión arterial y reducir la hiperfiltración glomerular y la proteinuria asociada a la obesidad [59]. La obesidad (IMC > 30 Kg/m2) debe ser combatida de forma activa como medida reno y cardio protectora, para prevenir el síndrome metabólico, para enlentecer la progresión de la ERC, y también para facilitar la inclusión en lista de espera de trasplante renal. Dicha pérdida de peso, debe realizarse bajo control del nutricionista. De forma general, y a modo orientativo, se sugiere una restricción calórica diaria de 250-500 Kcal.
INGESTA PROTEICA: CANTIDAD Y CALIDAD
Conforme a la evidencia científica disponible y a las recomendaciones de las guías de práctica clínica en nutrición para la ERCA, el bajo contenido proteico constituye el pilar fundamental de la denominada “dieta renal”. Sin embargo, la adherencia limitada observada en la práctica clínica cotidiana genera una discrepancia significativa entre los hallazgos de estudios de alto nivel metodológico -como ensayos clínicos aleatorizados explicativos y metaanálisis- y los resultados procedentes de contextos más pragmáticos, incluidos los ensayos clínicos en condiciones reales y los estudios observacionales. Esta brecha se traduce, junto a la histórica falta de disponibilidad de nutricionistas en las consultas de ERCA en España, en un debate aún vigente acerca de la eficacia de las dietas hipoproteicas para enlentecer la progresión de la ERC en nuestro medio. No obstante, y como ya hemos comentado, existe un consenso sólido en las guías clínicas en torno a los beneficios metabólicos asociados al empleo de dietas bajas y muy bajas en proteínas en estadios moderados y avanzados de la enfermedad [54].
Fundamentos para la restricción proteica
El riñón es la vía natural de eliminación de los productos nitrogenados. La restricción proteica se fundamenta en la incapacidad del organismo en almacenar el exceso de proteínas en forma de masa muscular, y en el hecho de que el producto final del metabolismo proteico es el nitrógeno, que se elimina, tras su sufrir transformación hepática a urea, principalmente por vía renal.
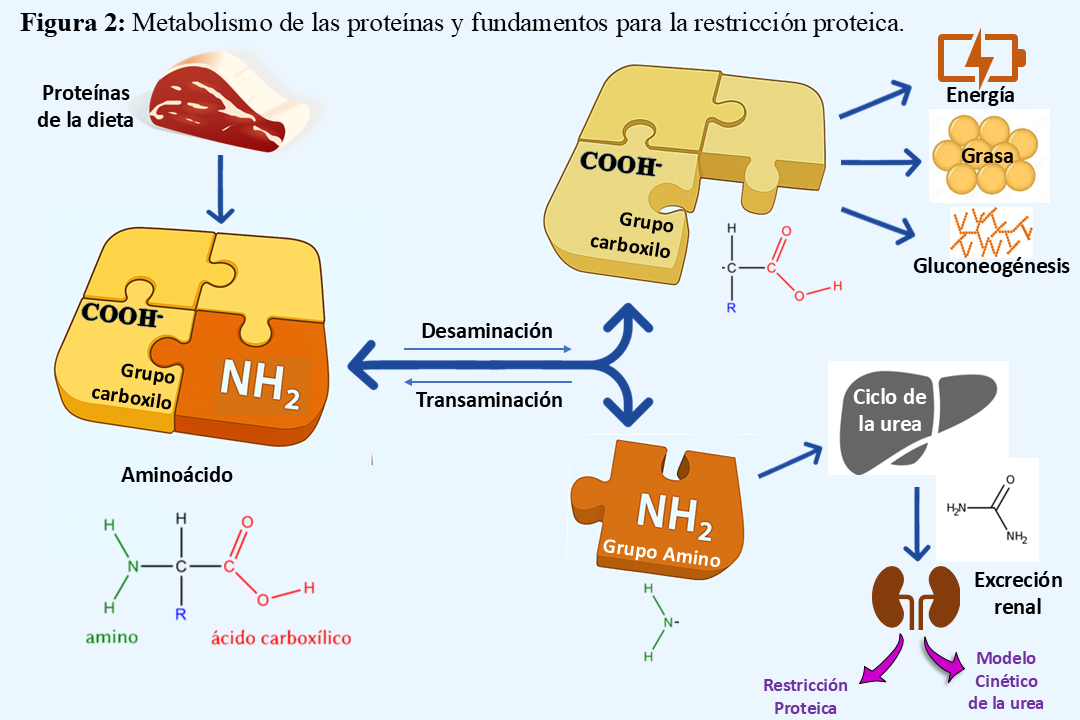
[60] [61]. Adicionalmente, a nivel glomerular, una carga nutricional excesiva de proteínas provoca la dilatación de la arteriola aferente, lo que incrementa la presión intraglomerular y produce una hiperfiltración glomerular, junto con un aumento del flujo plasmático renal, contribuyendo a la progresión de la ERC [60] [61] [62] [63] [64] [65] [66]. La digestión de las proteínas implica su descomposición AA, los cuales pueden utilizarse tanto para la síntesis de nuevas proteínas como como fuente de energía, especialmente en situaciones de ayuno [67]. Cuando la ingesta de AA excede los requerimientos nutricionales para la síntesis proteica y otras funciones esenciales, el organismo carece de un sistema de almacenamiento específico para estos compuestos, a diferencia de lo que ocurre con los carbohidratos o los lípidos. En consecuencia, los AA en exceso son metabolizados mediante una serie de procesos bioquímicos orientados a la eliminación del nitrógeno y al aprovechamiento del esqueleto carbonado, que incluyen (Figura 2).
1. Desaminación y eliminación del grupo amino. El primer paso en el catabolismo de los AA consiste en la eliminación del grupo amino (-NH4), proceso que ocurre predominantemente en el hígado por la acción de las transaminasas. Esta etapa incluye una reacción de transaminación en la que una aminotransferasa transfiere el grupo amino a una molécula aceptora, generalmente α-cetoglutarato, con la formación de glutamato. Posteriormente, la enzima glutamato deshidrogenasa cataliza la liberación del grupo amino en forma de amoníaco (NH4).
2. Utilización del esqueleto carbonado. Una vez separado del grupo amino, el esqueleto carbonado restante del aminoácido puede seguir diversas rutas metabólicas, dependiendo de su estructura. Algunos AA pueden ser convertidos en intermediarios del ciclo de Krebs para la producción de energía, mientras que otros actúan como precursores en la gluconeogénesis (AA glucogénicos) o en la cetogénesis (AA cetogénicos). En condiciones de superávit energético, estos esqueletos carbonados también pueden ser almacenados en forma de triglicéridos en el tejido adiposo.
3. Conversión del amoníaco en urea. Dado que el amoníaco es altamente tóxico para el organismo, su eliminación eficiente es crucial. En los hepatocitos, el amoníaco liberado se incorpora al ciclo de la urea, dando lugar a la síntesis de urea. Esta molécula, mucho menos tóxica, es transportada a través del torrente sanguíneo hacia los riñones, donde es excretada por la orina.
Por lo tanto, en condiciones de ingesta excesiva, los AA son desaminados en el hígado, con eliminación del nitrógeno en forma de urea y aprovechamiento del esqueleto carbonado como fuente energética, sustrato gluconeogénico o precursor lipídico. Este mecanismo permite al organismo mantener la homeostasis nitrogenada y energética, evitando la acumulación de compuestos nitrogenados tóxicos. Sin embargo, con la progresión de la insuficiencia renal estos productos nitrogenados se acumulan en proporción a la pérdida de la función renal [68], de manera que en personas con ERCA, una dieta rica en proteínas conduce a la acumulación de productos nitrogenados (junto a fosfatos, sulfatos y ácidos orgánicos), causando el síndrome urémico. Esto no solamente dio origen al principio de restricción de proteínas, sino también al modelo cinético de la urea para establecer la dosis de diálisis. De hecho, la restricción proteica ha prevalecido durante décadas (desde 1918) y ha sido la piedra angular del tratamiento cuando no existía la terapia renal sustitutiva.
Adaptación metabólica a la reducción de la ingesta de proteínas
De acuerdo con la OMS, la ingesta proteica mínima para mantener un balance proteico equilibrado en adultos sanos es de 0,6 gr/kg/día. Estas recomendaciones para la población general se han trasladado al paciente con ERC [69] en los que, en ausencia de enfermedades intercurrentes, los requerimientos proteicos en pacientes con ERC no difieren sustancialmente de los de sujetos sanos [70]. En esta línea, las Guías KDOQI 2020 [54] ajustan la recomendación de ingesta proteica a 0,55-0,60 gr/Kg/día, o incluso a 0,3-0,4 g/kg/día suplementada con AA esenciales y KAs, para lograr un balance nitrogenado adecuado y mantener un adecuado estado nutricional [71] [72]. Al igual que en los sujetos sanos, las personas con ERC pueden mejorar la utilización de AA y el balance nitrogenado durante una dieta baja (LPD) o muy baja en proteínas (VLPD) mediante respuestas adaptativas adecuadas [73]. Estas respuestas incluyen la supresión de la oxidación de AA como reacción anabólica a la restricción proteica, el estímulo de la síntesis proteica y la inhibición de la degradación durante la alimentación, así como el reciclaje de AA derivados del catabolismo proteico [74] [75]. Es importante destacar que estas dietas requieren un aporte calórico suficiente para permitir una utilización eficaz de las proteínas ingeridas [56].
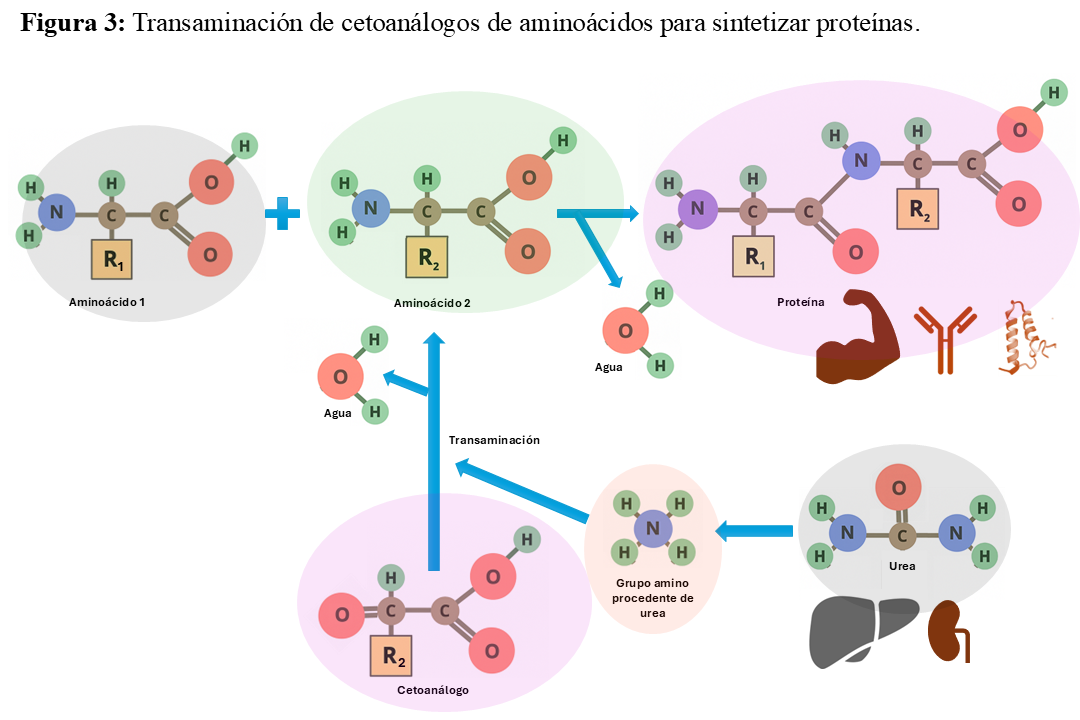
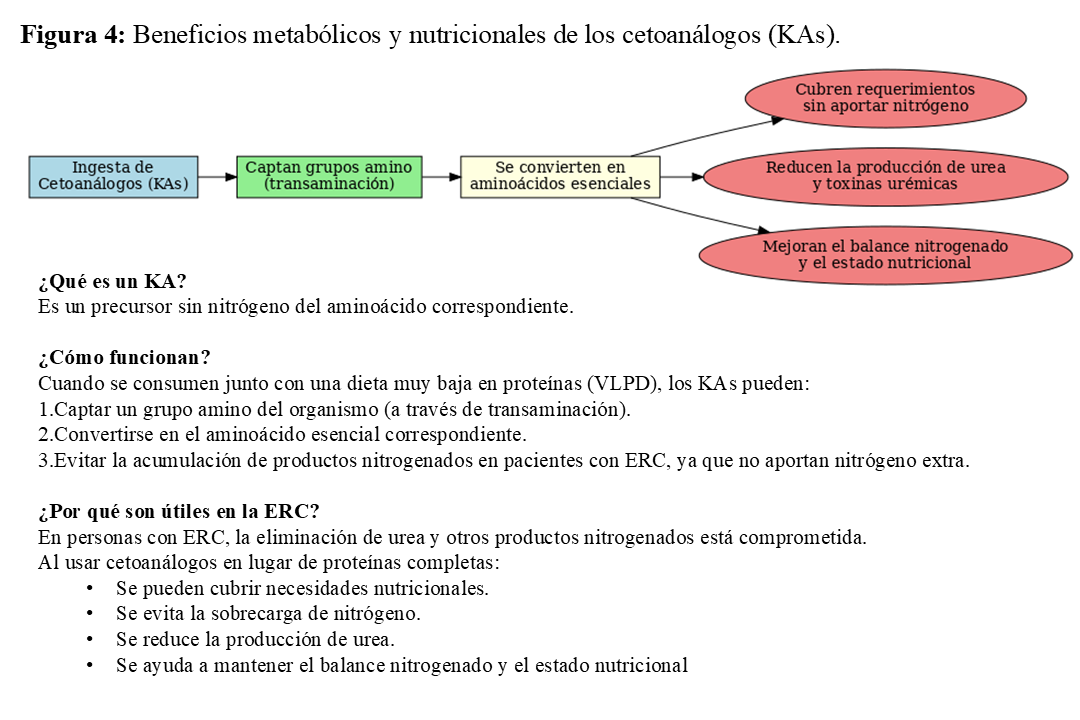
La adaptación y el mantenimiento de un buen estado nutricional pese a la restricción proteica se produce gracias a la bidireccionalidad de las reacciones de desaminación y transaminación de AA, lo que permite la síntesis de dichos AA a partir de nitrógeno endógeno y α-cetoácidos [76]. Un KA es un tipo específico de cetoácido que corresponde a un AA esencial, pero sin su grupo amino. Al igual que los cetoácidos, los KAs actúan como precursores sin nitrógeno de sus respectivos AA, pudiéndose transformar en estos a través del proceso de transaminación. Mediante dicha reacción química se produce la transferencia de un grupo amino a un cetoácido, permitiendo la síntesis de un nuevo AA a la vez que reciclan parte del nitrógeno endógeno, disminuyendo la producción de urea y toxinas asociadas al metabolismo de las proteínas, aliviando la excreción renal de nitrógeno, y sin dejar de proveer AA. (Figura 3). Gracias a esta conversión, los KAs pueden reemplazar a los AA esenciales en la dieta sin incrementar la carga de nitrógeno, reutilizando el nitrógeno que ya está presente en exceso en pacientes con ERCA. De este modo, el uso de KAs en lugar de proteínas completas permite a la vez cubrir necesidades nutricionales y evita la sobrecarga de nitrógeno, lo que disminuye la producción de urea y otras toxinas urémicas y ayuda a mantener el balance nitrogenado y el estado nutricional (Figura 4). Las dietas VLPD suplementadas con KAs se han propuesto como una estrategia nutricional eficaz para preservar el estado proteico sin agravar la sobrecarga nitrogenada en personas con ERCA.
Beneficios de la restricción proteica
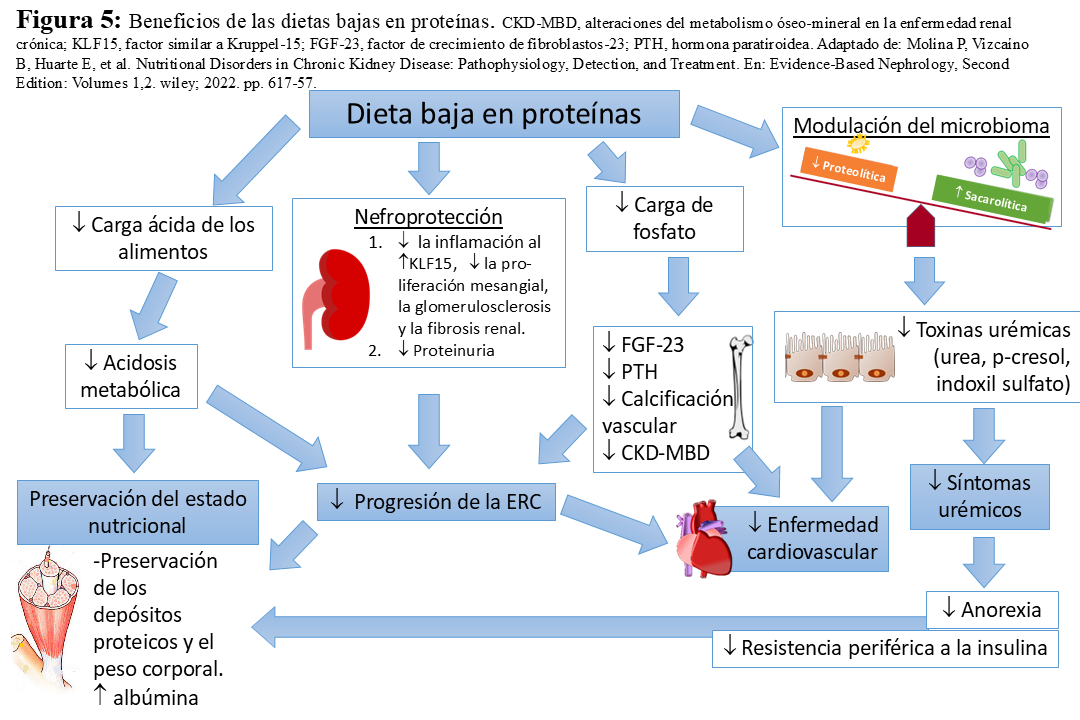
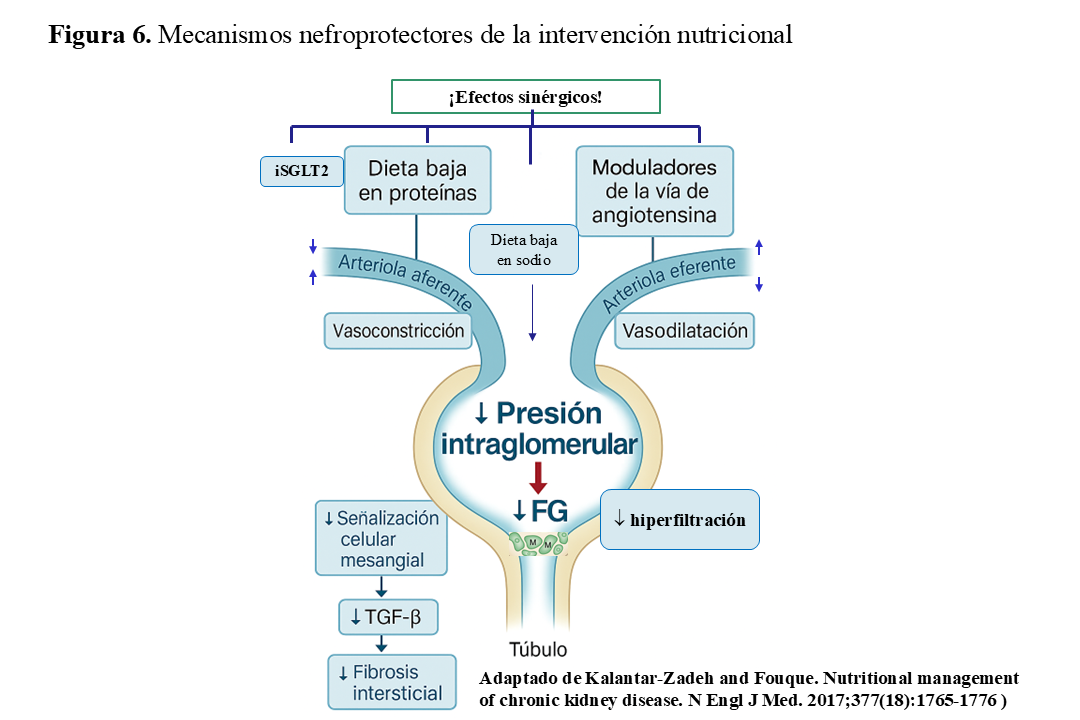
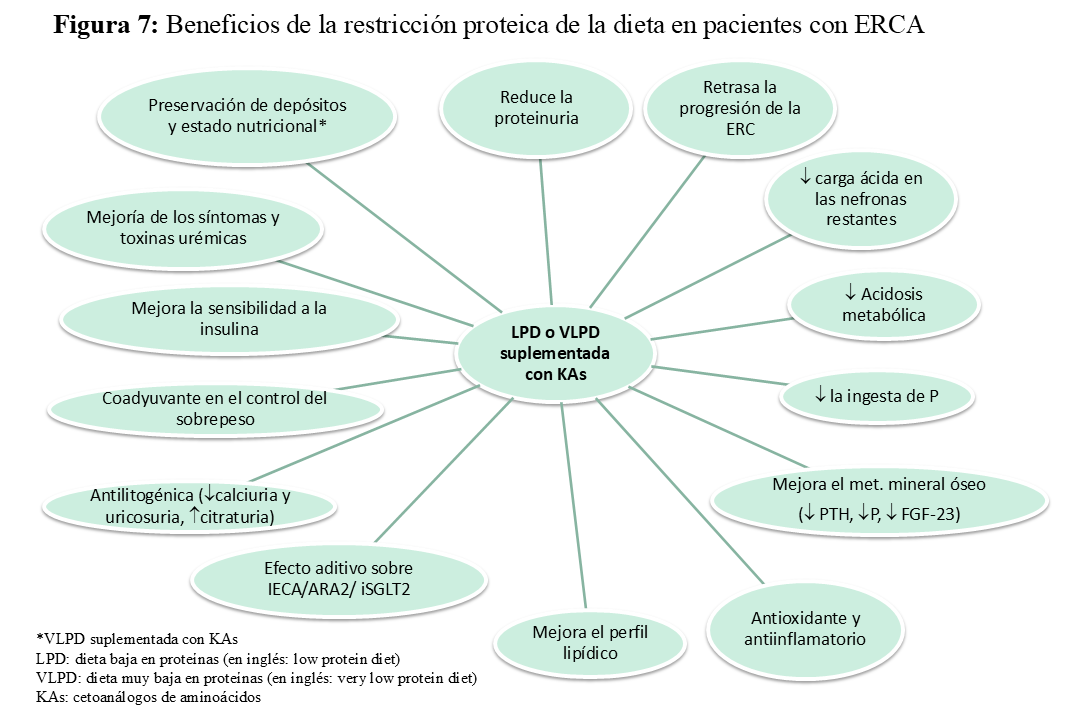
Los mecanismos nefroprotectores asociados a la restricción proteica son de dos tipos: 1) hemodinámicos, por reducción de la hiperfiltración al inducir una mayor vasoconstricción de la arteriola aferente [4] y 2) metabólicos, reduciendo la generación de citoquinas y activando genes implicados en producción de matriz mesangial [77]. La ingesta reducida de proteínas también se asocia con efectos favorables en parámetros de laboratorio y el metabolismo, incluyendo la disminución de toxinas urémicas y de la carga ácida, así como un mejor control de la hiperpotasemia e hiperfosfatemia. Dichos mecanismos contribuyen no sólo a la ralentización de la progresión de la ERC sino también a reducción de los síntomas urémicos (Figura 5) (Figura 6) [78]. En la (Figura 7) se resumen los beneficios de la restricción proteica en la dieta de las personas con ERC [79].
Cerca de veinte ensayos clínicos aleatorizados han evaluado los efectos de la restricción proteica sobre diferentes eventos renales, incluyendo la progresión de la ERC, la proteinuria, los niveles de fósforo, la acidosis y la presión arterial (PA), cuyos resultados han sido resumidos en recientes metaanálisis y varias revisiones Cochrane [14] [80] [81] [82] [83] [84] [85]. En conjunto, la evidencia sugiere un efecto beneficioso de la restricción proteica en la dieta. Las guías KDOQI 2020 recomiendan, en adultos no diabéticos con ERC estadios 3-5 metabólicamente estables, la restricción proteica para reducir el riesgo de progresión a enfermedad renal terminal y muerte (evidencia 1A), así como para mejorar la calidad de vida (1C). En adultos con ERC 3-5 que presentan diabetes, las guías sugieren (con un nivel de evidencia de “opinión”) una ingesta proteica ligeramente superior, de hasta 0,6–0,8 g/kg/día [54]. Posteriormente a la publicación de dichas guías, un nuevo metaanálisis y revisión sistemática ha confirmado la eficacia y seguridad de la VLPD suplementada con KAs, objetivando una estabilización de la pérdida de FG así como una reducción de la proteinuria, la tensión arterial, y los niveles séricos de fósforo, hormona paratiroidea y colesterol total. Además, el análisis por subgrupos mostró que la VLPD suplementada con KAs fue superior a la LPD en la tasa de descenso del FG [83], dato que se ha confirmado en un metaanálisis posterior [85].
Desafíos y riesgos de las dietas con restricción proteica
Históricamente, las principales preocupaciones en torno a las dietas restrictivas en proteínas son la adherencia y la seguridad [86] [87] [88]. La adherencia de los pacientes a estos regímenes dietéticos puede ser complicada, sobre todo a largo plazo, siendo fundamental tanto educar adecuadamente a los pacientes sobre el papel de la terapia dietética con restricción proteica en el tratamiento de la ERC, como considerar sus hábitos alimentarios y preferencias [89] [90]. En cuanto a la seguridad nutricional, se ha demostrado de manera concluyente que la LPD y la VLPD asociada a KAs son seguras en las personas con ERC clínicamente estables, incluso en ancianos [11] facilitando la ganancia de masa muscular incluso tras iniciar diálisis [91]. Además, en la ERC-ND el déficit proteico energético es raro siempre que la ingesta energética se mantenga en un rango normal-alto (30–35 kcal/kg/día), se aumente la ingesta proteica en caso de enfermedad aguda u hospitalización, y se lleve a cabo una evaluación nutricional periódica [87]. Por todo ello, y de acuerdo con las guías clínicas, se recomienda encarecidamente contar con personal capacitado (idealmente un nutricionista renal) para desarrollar programas dietéticos individualizados, realizar un seguimiento rutinario y asesorar a los pacientes con ERC [54] [87] [92].
Sin embargo, la ausencia de nutricionista no debe suponer una excusa para no asesorar nutricionalmente a las personas con ERC. Una alternativa para aquellos centros -la mayoría en España- en los que no se dispone de nutricionista, puede ser la realización de enfoques simplificados y prácticos para la prescripción de la restricción proteica [93] [94]. De hecho, incluso reducciones modestas en la ingesta proteica, de tan solo 0,2 g/kg/día, podrían retrasar la necesidad de iniciar diálisis [16] [95]. En estas unidades ERCA sin nutricionista, la ingesta proteica puede estimarse mediante la excreción urinaria de nitrógeno ureico, mientras que el peso corporal y otros métodos antropométricos como el diámetro de la pantorrilla o como la dinamometría de mano, así como la utilización periódica de la bioimpedanciometría pueden ser útiles para monitorizar el estado nutricional de los pacientes [93] [96]. En la (Tabla 4) se detalla cómo valorar la adherencia a la ingesta proteica a partir de la orina de 24h, así como un link a una APP para facilitar su cálculo a partir del peso real y la urea en orina de 24h del paciente [97] [98]. Una IP de 0,6-0,7 gr/Kg peso ideal/día es un objetivo posibilista que puede aportar importantes beneficios clínicos en pacientes con FG < 30 mL/min, siempre que se realice con una estrecha monitorización y colaboración del paciente, y se implemente progresivamente de manera escalonada, con un descenso progresivo de la ingesta de proteínas de 0,2 gr/Kg/d a lo largo de al menos tres visitas [99] [100]. El uso de concomitante de KAs -recientemente introducidos en España- nos puede permitir todavía dar más seguridad para disminuir la ingesta proteica a 0,4 g/kg/día [101].
Origen de las proteínas: la calidad también importa
Más allá de la cantidad ingerida, la calidad de las proteínas constituye un aspecto fundamental en el abordaje dietético de las personas con ERC-ND. En este sentido, diversos alimentos de origen animal difieren en su contenido de fósforo, mientras que el fósforo presente en alimentos de origen vegetal presenta una biodisponibilidad considerablemente menor. De igual manera, los productos vegetales contienen menores proporciones de compuestos ácidos y una mayor concentración de compuestos alcalinos, modulando de forma distinta el impacto sobre la acidosis metabólica asociada a la ERC [9] [10]. Aunque no disponemos de evidencia basada en ensayos aleatorizados, varios estudios observacionales han sugerido que las proteínas de origen vegetal podrían tener efectos más renoprotectores que las de origen animal. Una dieta rica en proteínas vegetales podría ralentizar la progresión de la ERC, disminuir la proteinuria, los niveles de toxinas urémicas, la ingesta de fósforo y la producción endógena de ácido [102] [103] [104] [105] [106] [107] [108] [109] [110] [111] [112]. Además, este tipo de dieta, podría potencialmente mejorar la supervivencia [113]. Aunque los factores de confusión inherentes a una dieta rica en proteínas vegetales -mayor consumo de fibra, vitaminas y antioxidantes- dificultan la posibilidad de establecer conclusiones definitivas en estudios observacionales [114] [115], en un ensayo clínico aleatorizado se comparó una dieta vegetariana VLPD suplementada con KAs frente a una LPD convencional en 207 pacientes con ERC. La probabilidad de precisar terapia renal sustitutiva o presentar una reducción del ≥50% del FG fue menor en el grupo con VLPD suplementada con KAs respecto al grupo con LPD [103].
INGESTA DE FÓSFORO
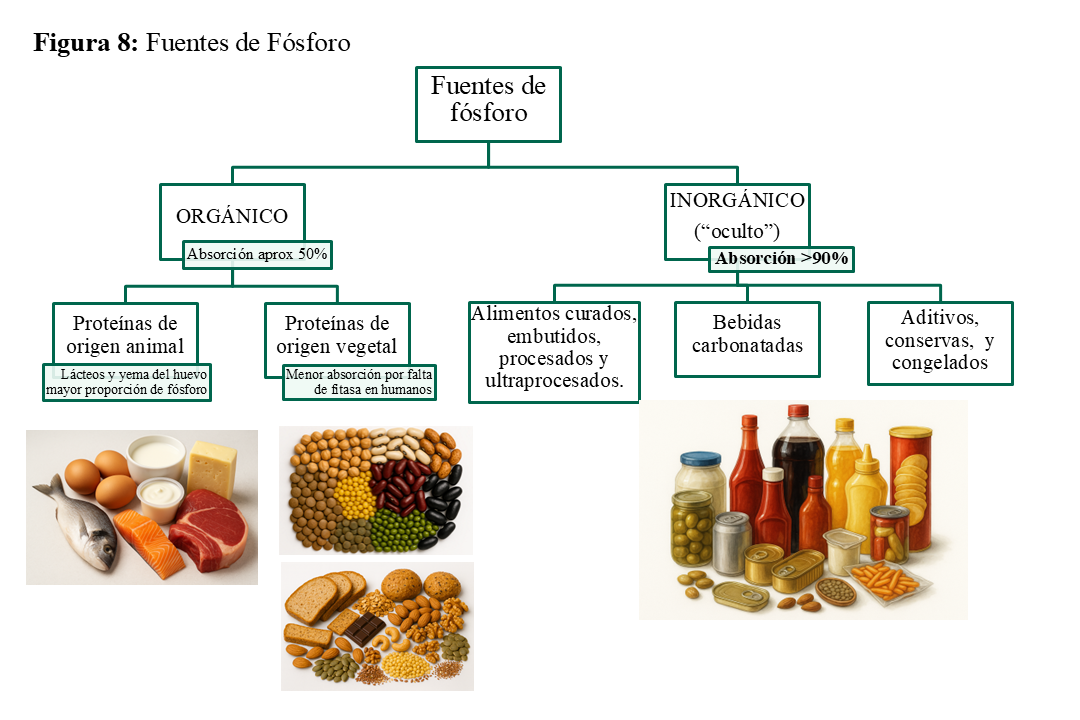
Aunque con evidencia aún limitada, un reciente metaanálisis ha demostrado que la terapia nutricional llevada a cabo por una nutricionista específicamente orientada para controlar el fósforo (P) permite reducir los niveles de P en personas con ERC [116]. De acuerdo con las guías K-DOQI, se recomienda ajustar la ingesta de P para mantener los niveles de fósforo sérico dentro del rango normal [54]. Dado que los aportes de P están muy relacionados con la ingesta proteica, así como con la eliminación urinaria de nitrógeno y P [57] [58] [117] [118], la restricción proteica recomendada por las guías, implica una restricción de P. Así, la recomendación de disminuir a 0,55-0,60 gr/kg/día o incluso menor la ingesta proteica, se corresponde con una ingesta de 600-800 mg de P [119] [120]. Por ello, es difícil conseguir la restricción del fósforo sin una restricción proteica, en particular de origen animal. En este sentido, el objetivo debe ser conseguir el nivel de P más bajo posible en la dieta, asegurando una ingesta proteica adecuada. Las guías K/DIGO del metabolismo mineral [121] [122] [123] recomiendan un aporte de P de 10 a 12 mg de P por gramo de proteína. Este cociente obtenido de un cuestionario de ingestas en pacientes en hemodiálisis, fue estudiado por Noori N et al [124], quienes hallaron una asociación directa entre este cociente y la supervivencia. Los autores destacaron que un cociente superior a 16 mg P/gr proteína incrementaba un 30% el riesgo de mortalidad.
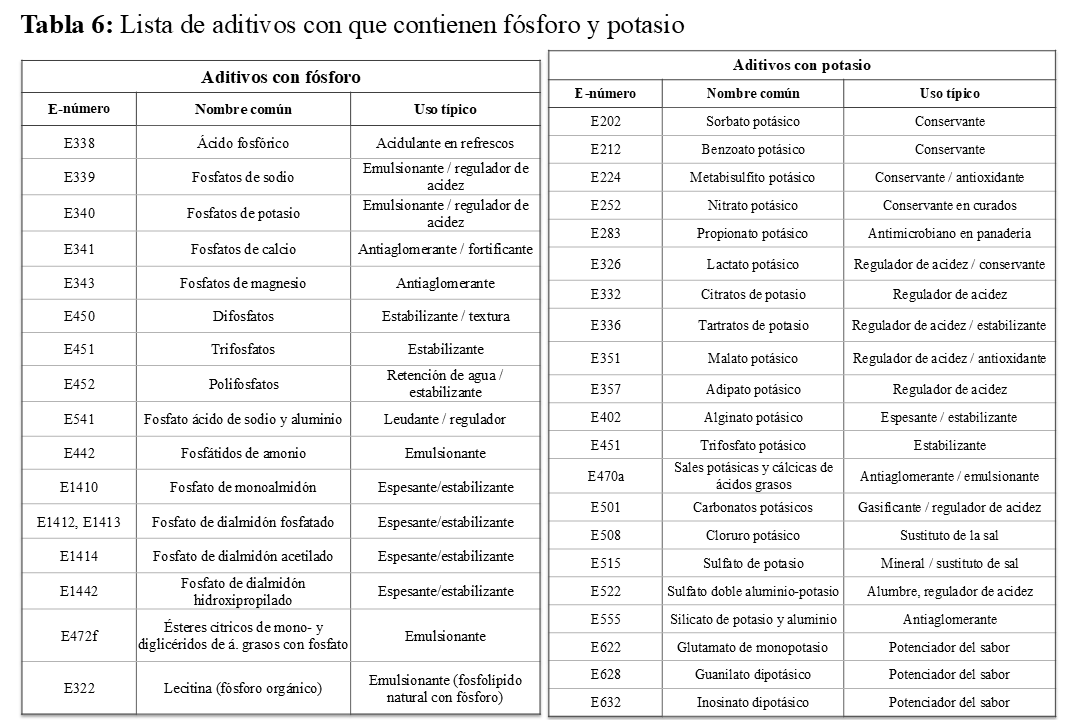
Mientras que se considera que el balance de P en un adulto normal se consigue con una dieta de P de 800-1.600 mg/día, en pacientes con ERCA la ingesta de P recomendada no debería superar los 800 mg/día en todos los estadios [125] [4] [122] [123] (Tabla 5). Una adherencia razonable a esta restricción de P se consigue con una restricción de proteínas animales, haciendo especialmente hincapié en la reducción de lácteos. Es destacable que el P orgánico se absorbe un 50%, y que la proporción absorbida es mayor en las proteínas de origen animal que vegetal [117] [120] [126]. Asimismo, el contenido de P es mayor en los lácteos que en los restantes nutrientes (Figura 8). De forma orientativa, digamos que los lácteos proporcionan »20 mg P/gr proteínas, las carnes y legumbres »10-15 mg P/gr proteína y algo menos los pescados y mariscos [117] [120]. Barril G. et al. [127] publicaron unas tablas de cociente P/proteínas de utilidad para la población española, que, aunque no incluye los aditivos de los alimentos, es de enorme utilidad para conocer los alimentos con menor contenido de P, respecto a la cantidad de proteínas. Estas tablas nos pueden ayudar a elegir productos con un bajo ratio P/proteínas (≤ 15 mg/g). Otra fuente importante de P es el elevado contenido en los aditivos, tales como las conservas, congelados y bebidas gaseosas [128]. Las carnes precocinadas, curadas o con aditivos son una fuente importante de P (además de Na). Adicionalmente, P contenido en los aditivos (P inorgánico) se absorbe en un 90 % y pueden aumentar la ingesta de fósforo entre 0,5-1,0 gr/día [63] (Figura 8) y (Tabla 6). La restricción de alimentos ricos en aditivos puede tener un claro efecto favorable en el control de la hiperfosforemia [129]. Las recomendaciones generales del manejo dietético del fósforo se ilustran en la (Tabla 5).
INGESTA DE CALCIO
Los requerimientos de calcio (Ca) en un adulto sano se han establecido entre 800 y 1.000 mg/día. En la ERC la absorción intestinal de Ca disminuye como consecuencia del déficit de calcitriol. Por lo tanto, se han postulado requerimientos algo mayores, aproximadamente de 1.200-1.600 mg/día. Asimismo, existen evidencias de que los suplementos de Ca se asocian a un incremento de las calcificaciones vasculares tanto en la población general [130] como en el paciente en diálisis [131], relacionando esta última con la ingesta de captores cálcicos. Por todo ello, progresivamente se han ido reduciendo las recomendaciones de ingesta cálcica o de la administración de suplementos.
Las Guías de práctica clínica han recomendado que la suma de todas las entradas de Ca elemento, incluidos los suplementos, debería ser de 800-1000 mg/día [54] [4] [128] (Tabla 5). En este sentido, en la ERCA la restricción proteica, especialmente de lácteos, ha contribuido a controlar la ingesta de P. Una ingesta proteica estándar para un enfermo ERCA, de 50-60 gr de proteínas, conlleva un aporte de Ca de 600-800 mg, en el límite bajo de las recomendaciones actuales.
INGESTA DE POTASIO
Al igual que con los niveles de P, las guías K-DOQI recomiendan ajustar la ingesta de K para mantener los niveles de K sérico dentro del rango normal, aunque una vez hayan sido descartada otras causas. Aunque la hiperpotasemia (K>5,5 mEq/L) es una complicación seria en los pacientes en diálisis, representando el 3-5% de las muertes en y una de cada cuatro emergencias esta población [132] [133], en pacientes con ERCA con diuresis conservada el desarrollo de hiperpotasemia no es tan frecuente. Sin embargo, cifras elevadas de K pueden constatarse en pacientes con ERC-ND con acidosis [134] [135], tomando IECA/ARA, betabloqueantes, y especialmente, diuréticos antialdosterónicos [72] [136]. Estas variables deberían ser tenida en cuenta antes de restringir el K de la dieta [8] [9] [10]. Aunque históricamente la transgresión dietética ha sido la causa más divulgada de hiperpotasemia en las personas con ERC, por lo que la restricción de alimentos ricos en K ha sido la norma, estudios posteriores han advertido que una excesiva restricción de alimentos ricos en K [4], puede reducir el consumo de frutas y verduras frescas, en favor de dietas más aterogénicas. La liberación prudente de verduras y frutas ha sido incluida en las recomendaciones de las Guías KDOQI 2020 [54], aunque las pautas no han sido establecidas. En cualquier caso, podemos afirmar que su uso juicioso y bajo vigilancia, puede ser una medida adicional, nutricionalmente saludable y renoprotectora. Es recomendable evitar fuentes ocultas de potasio (aditivos (Tabla 6), sales sin sodio, etc) o productos con alto contenido en potasio, pero bajo valor nutricional. Asimismo, puede contribuir a reducir la carga ácida, evitando o atenuando el uso de bicarbonato sódico [137].
Además de las anteriormente referidas, otra causa -históricamente poco atendida- de hiperpotasemia a descartar antes de restringir el potasio en la dieta incluye el ayuno. Aunque las guías de práctica clínica prestan escasa atención a esta circunstancia, varios estudios han advertido del riesgo de hiperpotasemia asociada al ayuno [138] [139] [140], especialmente en pacientes diabéticos. Es bien conocido que la insulinopenia y la acidosis metabólica, dos situaciones frecuentes y reversibles que se dan en caso de ayuno, contribuyen al desarrollo de hiperpotasemia. Las recomendaciones generales se ilustran en la (Tabla 7).
Respecto a la excreción urinaria de K, hay datos que sugieren una asociación entre mayor excreción y riesgo progresión de ERC, sin que estos datos se consideren concluyentes [41] [141]. Las guías KDOQI 2020 [54] no hacen sugerencias sobre la determinación de K urinario, ni recomendación de valores para tener en cuenta, aunque su determinación podría ser interesante para evaluar su ingesta y la carga ácida.
CARGA ÁCIDA Y ACIDOSIS
En paralelo con la restricción de potasio, la carga ácida puede tener un impacto nutricional adverso en el enfermo renal (Tabla 8). La producción alcalina de generación endógena proviene de aniones orgánicos como el citrato y el acetato, que están naturalmente ligados a cationes como el K y que se encuentran primariamente en los vegetales y frutas, mientras que la producción de ácidos no volátiles deriva principalmente de la ingesta de proteínas y de fósforo. La diferencia entre ambos produce la carga ácida, que normalmente se elimina por vía renal como amonio y acidez titulable [76]. La carga ácida de una dieta estándar es 1 mEq/kg/día y se estima de forma indirecta desde la ingesta de nutrientes o la eliminación urinaria de cationes y aniones.
En la ERC, con la reducción de la masa nefronal, se desarrollan mecanismos adaptativos como es el aumento de la amoniogénesis por nefrona y el aumento de la excreción distal de ácido mediado por el SRAA y endotelina-1, produciendo daño renal [137] [142] [143]. Asimismo, una elevada carga acida produce acidosis subclínica a pesar de bicarbonatemia normal.
Existe sostenida información en la literatura de la acidosis metabólica como factor de riesgo de progresión de ERC y de desnutrición [144] [145] [146] [147]. De hecho, las Guías KDIGO [121] [122] recomiendan dar suplementos orales de bicarbonato en caso de que la concentración sérica sea inferior a 22 mmol/L, mientras que las guías KDOQI 2020 recomiendan mantenerlo entre 22 y 25 mEq/L [54]. En este sentido, se postula que la manipulación de la producción endógena de ácidos a través de la dieta puede ser una estrategia adicional para disminuir la excreción ácida renal. La carga ácida está entonces determinada por el balance de los alimentos que inducen ácido (carnes, huevos, lácteos, cereales) y aquellos que inducen álcali (frutas y vegetales) [137] [148] [149]. Una mayor ingesta de frutas y vegetales puede contribuir a reducir la carga ácida sin la necesidad de una excesiva restricción proteica y aporte de bicarbonato [115] [150] [151] [152] [153].
Para el estudio de la carga ácida se han desarrollado ecuaciones basadas en la encuesta dietética o en la eliminación urinaria de moléculas y electrolitos [137] [148] [149] [150] [151] [152] [153] [154]. Scialla JJ et al [153] evaluaron la carga endógena de ácidos en base a la determinación de N y K urinario, como indicadores indirectos de la ingesta proteica y de la carga alcalina, respectivamente. La ecuación empleada fue la siguiente Carga ácida (mEq/día): -10.2+54.5 (ingesta proteica (gr/día)/ingesta de K (mEq/día) [83]. Los autores concluyeron que una mayor producción endógena de ácido (4º cuartil vs 1º cuartil) se asociaba a más rápido deterioro renal, a una tasa de 1,0 mL/min/año.
Sin embargo, los límites de la liberación de verduras y frutas no se han establecido. Goraya C. et al [151] [152]estudiaron en una población de pacientes con FG entre 15 y 29 mL/min, con niveles séricos de bicarbonato < 22 mEq/L, no diabéticos, en tratamiento con IECA/ARA más furosemida, y niveles de K < 4,4 mEq/L el efecto durante 1 año de bicarbonato 1 mEq/kg/día (n=35) frente a liberación de frutas y vegetales (n=36) con objeto de reducir la carga ácida un 50%, sin que se especificaran cantidades de alimentos. Aunque ambos grupos mejoraron igualmente la acidosis y presentaron niveles de K sérico similares, se observó un mejor control de la PA en el grupo “frutas y vegetales”. Adicionalmente, la carga ácida se redujo de 62 a 40 mEq/día y los niveles de K se mantuvieron estables en torno a 4,1 mEq/L. En resumen, aunque la seguridad y beneficios de una dieta basada en una mayor carga alcalina es una propuesta que debe ser verificada, una liberación prudente de verduras y frutas, junto a la restricción moderada de proteínas, es una medida nutricional razonablemente segura y que puede reducir la progresión del fallo renal, tal y como apuntan las Guías KDOQI [54] con el K. Al igual que sucede con el K urinario, dichas guías tampoco hacen hincapié en utilizar los parámetros urinarios para la evaluación de la carga ácida de las personas con ERC.
INGESTA DE FIBRA Y PROBIÓTICOS
Aunque existe evidencia creciente sobre los efectos positivos de la ingesta de fibra en la generación de toxinas urémicas [155] [156] [157], aún no está claro si el aumento en la ingesta de fibra con el objetivo de normalizar la microbiota intestinal podría retrasar la progresión de la ERC [9]. En cuanto al uso de probióticos, de acuerdo con un metaanálisis reciente que incluyó ocho estudios con 261 pacientes con ERC en estadios 3-5D, la suplementación con probióticos podría disminuir los niveles de p-cresol sulfato y aumentar los niveles de IL-6, lo que contribuiría a proteger la barrera epitelial intestinal en pacientes con ERC, aunque se desconoce su efecto a largo plazo en la función renal [158].
PATRONES DIETÉTICOS Y PROGRESIÓN DE LA ERC
Aunque históricamente, las investigaciones y recomendaciones clínicas se han centrado principalmente en modificar la ingesta individual de micronutrientes o macronutrientes [159], los hábitos alimentarios suelen mantenerse estables en el tiempo para cada individuo, por lo que el patrón dietético global puede ser más determinante para los pacientes que un exceso o déficit de un nutriente específico [114]. La adherencia a patrones de alimentación saludables, como la dieta Mediterránea y la dieta DASH (Enfoque Dietético para Detener la Hipertensión), se ha asociado con una menor velocidad de declive de la función renal y efectos favorables sobre la morbilidad y mortalidad cardiovascular en personas con ERC-ND, incluidos los receptores de trasplante renal [160] [161] [162]. Asimismo, las dietas basadas en alimentos de origen vegetal podrían contribuir a mitigar la acidosis metabólica en pacientes con ERC y, potencialmente, enlentecer la progresión de la enfermedad, aunque la evidencia disponible aún es limitada [9]. Por el contrario, seguir una dieta de estilo occidental (rica en grasas saturadas, carnes rojas y procesadas, y productos azucarados) se ha relacionado con un mayor riesgo de progresión de la ERC y de albuminuria [163]. Aunque todos estos estudios observacionales sugieren que los patrones alimentarios saludables pueden retrasar la progresión renal, la evidencia derivada de ensayos clínicos no es todavía concluyente [54].
CONCLUSIONES
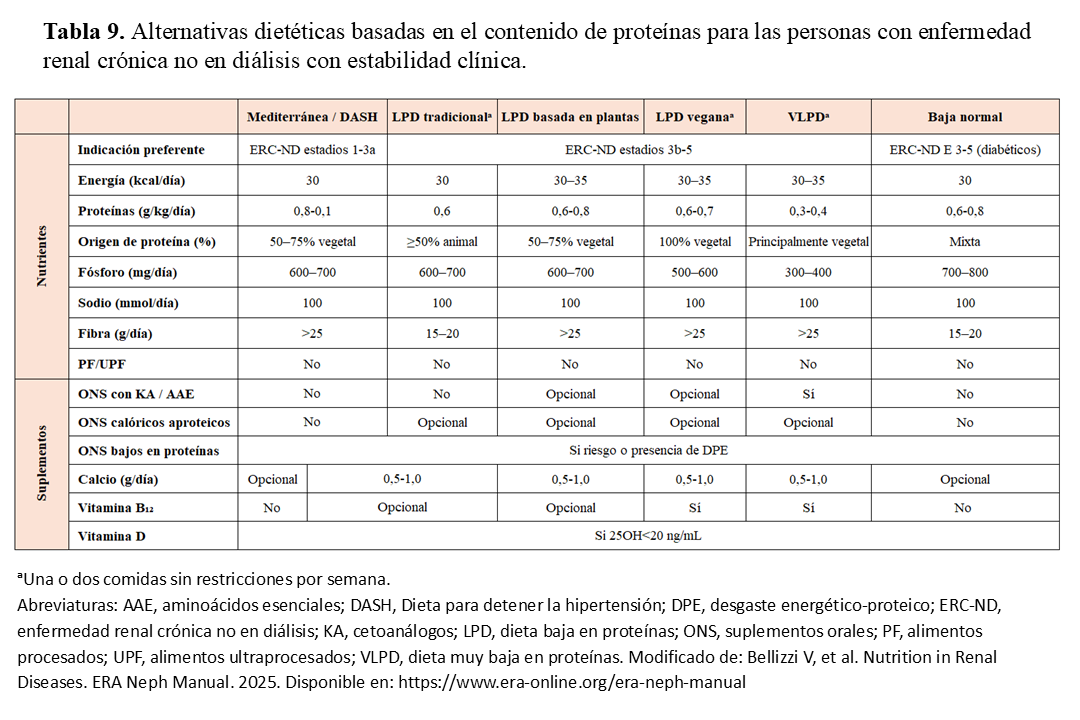
La dieta “renal” se fundamenta en la restricción proteica y en la reducción de solutos que tienden a acumularse en la ERC —entre ellos fósforo, ácidos y sodio—. Sin embargo, la selección del tipo de pauta dietética debe individualizarse, considerando tanto el perfil metabólico y el grado de alteraciones bioquímicas como las preferencias del paciente. De este modo, se dispone de distintas alternativas válidas que incluyen dietas saludables, hipoproteicas y muy bajas en proteínas. En la (Tabla 9) se muestran las opciones dietéticas disponibles más habituales para las personas con ERC-ND, según el contenido proteico [164]. El seguimiento cercano de la adherencia a las recomendaciones dietéticas, así como la evaluación frecuente del estado nutricional, son aspectos fundamentales en el manejo de los pacientes con ERC-ND ya que pueden influir en resultados clave para la salud, como la progresión de la enfermedad, la calidad de vida, la morbilidad y la mortalidad.
Dentro de estas medidas nutricionales, la restricción de sal, las LPD y las VLPD suplementadas con KAs han demostrado ser capaces de modificar la historia natural de la ERC, de acuerdo con recientes metaanálisis de ensayos clínicos aleatorizados. Estas intervenciones pueden retrasar el descenso del filtrado glomerular, reducir la proteinuria, los niveles de PA y los parámetros del trastorno mineral óseo, sin aumentar el riesgo de déficit proteico energético. A la hora de prescribir una LPD o VLPD, es esencial considerar las preferencias del paciente y su grado de cumplimiento para optimizar la adherencia. Otras medidas nutricionales para enlentecer la progresión de la ERC —algunas aún consideradas experimentales— pueden incluir la limitación del fósforo y las calorías, el aumento de la ingesta de fibra y la promoción de patrones dietéticos saludables.