Nefropatia Tubulointersticial Autosómica Dominante por Mutación en el Gen UMOD
INTRODUCCIÓN
Las nefropatías tubulointersticiales autosómicas dominantes (NTAD) son un subgrupo de nefropatías tubulointersticiales (NTI) de carácter familiar, es decir de causa genética (concretamente monogénica con patrón de herencia autosómica dominante), de las que se han identificado hasta la fecha mutaciones en 5 genes responsables, que codifican respectivamente las proteínas UMOD, MUC1, HFN1B, REN o SEC61A1 (NAD: Nefropatía tubulointersticial autosómica dominante). Se caracterizan por fibrosis tubulointersticial progresiva y evolución lenta a estadios finales de enfermedad renal. Las alteraciones clínicas tubulares, a pesar de ser una NTI, no suelen ser habituales. La penetrancia de la enfermedad es muy elevada, pero el curso clínico es muy variable entre los familiares afectados y puede haber mutaciones de novo. Esta enfermedad era previamente conocida con otras terminologías (enfermedad renal quística medular, nefronoptisis, nefropatía hiperuricémica familiar…). El grupo de trabajo de las Guías KDIGO estableció la terminología actual para unificar este grupo de enfermedades y evitar confusiones [1].
CASO CLÍNICO
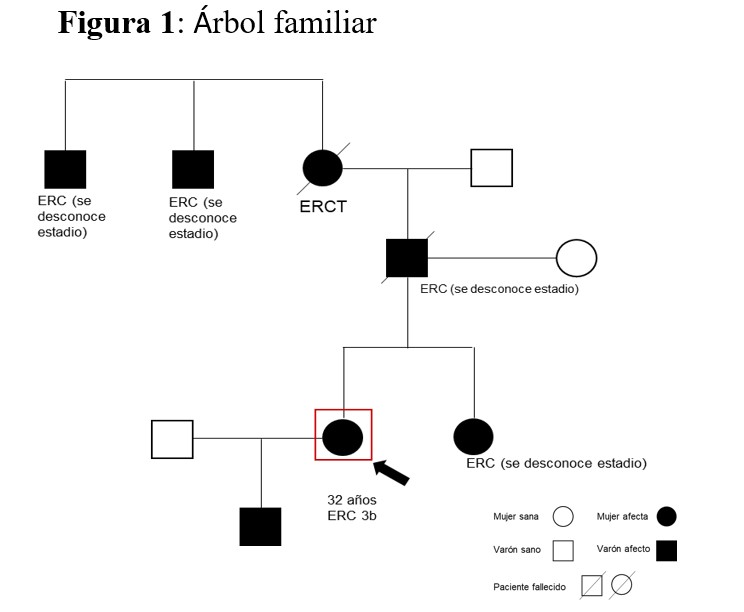
Mujer de 32 años de origen alemán remitida por su médico de atención primaria (MAP) por enfermedad renal crónica (ERC) en 2013. Presentaba antecedentes de enfermedad renal en varios familiares, todos residentes en Alemania. Aportaba informes de algunos de ellos: abuela paterna con antecedentes de gota y tratamiento con diálisis, ya fallecida, 2 tíos abuelos paternos con enfermedad renal; padre con enfermedad renal y en tratamiento con alopurinol, que falleció joven por problemas relacionados con alcoholismo crónico; hermana con hiperuricemia desde la infancia y enfermedad renal (no sabemos estadio) (Figura 1). Ella tenía antecedentes de hiperuricemia ya en tratamiento, pero nunca había tenido crisis de gota o cólicos nefríticos; además hipertensión arterial desde hacía más de 10 años.
El tratamiento a su llegada a las consultas de nefrología era: manidipino 10 mg, bisoprolol 5 mg, rosuvastatina 10 mg y alopurinol 100 mg.
En esa primera visita aportaba los análisis de su MAP: creatinina 1.6 mg/dl, aclaramiento de creatinina 49 ml/min, sin albuminuria y sedimento normal, densidad urinaria 1010, hemoglobina 13.2 g/dl, ácido úrico 6 mg/dl. Análisis de 2 años ya mostraban creatinina 1.8 mg/dl. Entregó también una ecografía realizada en centro privado, con riñones de pequeño tamaño y con alteración y aumento difuso de la ecogenicidad, además de disminución de la diferenciación córtico-medular, sin quistes ni litiasis.
En el análisis de control en la consulta se confirma la ERC en estadio 3b (creatinina 1.74 mg/dl, filtrado glomerular estimado CKD-EPI 38 ml/min/1.73m2) y se objetiva una disminución en la excreción fraccional de ácido úrico (3.4%) y un hiperparatiroidismo secundario (PTH 315 pg/ml) con déficit de vitamina D (16.8 ng/ml), fósforo 4 mg/dl, calcio 9 mg/dl. Se ajustó tratamiento con losartán (suspendiendo betabloqueante por mala tolerancia), estatina para mantener LDL en objetivo por su ERC, colecalciferol y paricalcitol, además de las recomendaciones dietéticas de restricción de fósforo. Más adelante precisó además tratamiento con captores del fósforo.
Se sospechó desde el primer momento una NTI familiar por lo que se realizó estudio genético en base a la nefropatía familiar con hiperuricemia, con el siguiente resultado: portador heterocigoto del cambio c. 539T>C (p.Leu180Pro) en el gen UMOD.
Durante el seguimiento, ha presentado un descenso lento pero progresivo de la función renal, sin aparición de proteinuria ni episodios de gota. Tuvo un embarazo que cursó con preeclampsia. El hijo se ha comprobado que es portador de la misma mutación. Nueve años despúes de la fecha del diagnóstico presentaba un FG de 21 ml/min/1.73m2.
COMENTARIOS
En el caso que presentamos, la existencia de varios familiares con enfermedad renal con un patrón autosómico dominante, la hiperuricemia y la ausencia de proteinuria o alteraciones en el sedimento de orina fueron las claves clínicas que llevaron a la sospecha inicial de esta enfermedad. La realización de un árbol familiar es muy útil como se demostró en este caso (NAD: Enfoque clínico de las enfermedades renales hereditarias). La hiperuricemia nos guiaba hacia la mutación en concreto en el gen UMOD. Se solicitó estudio genético, único método para la confirmación diagnóstica, según las recomendaciones de la (Tabla 4, NAD ) confirmándose la mutación en el gen UMOD. No obstante, siempre hay que tener en cuenta, que un resultado negativo en el estudio genético en una familia no ha de excluir totalmente el diagnóstico, dado que no se han identificado todos los genes causantes y las técnicas no tienen una sensibilidad del 100%. Las características clínicas de esta enfermedad, y en concreto de la mutación que encontramos en esta paciente fueron, además del descenso del FG, la disminución en la excreción fraccional de ácido úrico, la hiperuricemia y la densidad en orina compatible con probable defecto en la capacidad de concentración de la orina. No presentaba quistes renales (de hecho, ya no se les considera un criterio diagnóstico de esta enfermedad).
La mutación en el gen UMOD fue la primera que se identificó asociada a este tipo de enfermedad, y junto a la mutación en MUC1 son las responsables de la mayoría de los casos. El gen UMOD es responsable de la expresión de la proteína de Tamm-Horsfall o uromodulina, que se produce en las células tubulares de la porción ascendente gruesa del asa de Henle. La proteína mutada se acumula en el retículo endoplásmico de las células. Además se reduce el cotransportador Na+-K+-2Cl- del asa de Henle, con lo que disminuye la reabsorción de Na+, se produce una depleción de volumen y esto conlleva la reabsorción proximal de ácido úrico, con lo que es frecuente la hiperuricemia, a veces con episodios de gota. Lo llamativo suele ser que esta hiperuricemia es desproporcionada al grado de insuficiencia renal y puede preceder a la misma. En nuestro caso, cuando llegó a la consulta presentaba unas cifras de ácido úrico normales, ya que estaba en tratamiento con alopurinol y desconocemos los valores iniciales.
Estos pacientes presentan una progresión hacia enfermedad renal crónica estadio 5, que ocurre a una edad variable entre los 25-70 años, siendo más precoz entre los que presentan gota. En este caso, ha tenido una disminución del FG de unos 2 ml/min/año aproximadamente en el cómputo global, teniendo durante este tiempo buen control de los factores generales de progresión (peso, PA…). El hecho de haber tenido un embarazo con preeclampsia (complicación posible en el seno de un embarazo con ERC) condicionó un mayor deterioro del FG tras el mismo.
Los pacientes con mutación identificada deben recibir consejo genético sobre el riesgo de transmisión de la enfermedad y también se debe ofrecer la posibilidad del estudio genético a otros familiares. En nuestro caso, la paciente no tenía familia aquí y antes del embarazo, se remitió a la unidad de Genética de referencia, recibiendo toda la información respecto al riesgo de transmisión.
Respecto al tratamiento, no hay ninguno específico de la enfermedad. Dado que los ataques de gota pueden repetirse, se pueden prevenir con alopurinol y, si éste no se tolera, con febuxostat. Algunos estudios han mostrado enlentecimiento en la progresión de la enfermedad renal con febuxostat, no estando claro este efecto con alopurinol (Ácido Úrico y Enfermedad Renal Crónica | Nefrología al día (nefrologiaaldia.org). Se desconoce si la dieta baja en purinas puede tener algún beneficio. Deben controlarse los factores de riesgo que puedan influir en la progresión del daño renal, como la hipertensión arterial, la obesidad, etc. No se recomienda la restricción de sal y los diuréticos deben usarse con precaución, ya que esto puede agravar la depleción de volumen y la hiperuricemia. No existe consenso respecto a los beneficios que pueda aportar el bloqueo del sistema renina-angiotensina-aldosterona en la progresión del daño renal, pero si se usa, se recomienda el losartán si existe hiperuricemia, por su efecto uricosúrico. En los estadios finales de la enfermedad, el tratamiento de elección es el trasplante renal, ya que la enfermedad renal no recurre en el injerto.
Como conclusiones hay que destacar la importancia de evaluar los antecedentes familiares de enfermedad renal y el perfil fenotípico de dicha afectación, dado que, pueden ser la clave para el diagnóstico. Además, con los avances de los estudios genéticos cada vez vamos a poder identificar más este tipo de enfermedades y se podrán plantear otros abordajes.
REFERENCIAS BIBLIOGRÁFICAS
1. Eckardt K, Alper SL, Antignac C, Bleyer AJ, Chauveau D, Dahan K, et al. Autosomal dominant tubulointerstitial kidney disease: diagnosis, classification and management-A KDIGO consensus report. Kidney International 2015; 88: 676-683