Nefronoptisis
Palabras clave
Enfermedad quistica medular, nefropatía tubulointersticial autosómica dominante, ciliopatías
GENERALIDADES
La primera descripción de la nefronoptisis como enfermedad se atribuye a Smith y Graham en 1945 [1], aunque un año antes ya Thorn publicaba un caso de la enfermedad que describió como una nefritis pierde sal que simulaba una insuficiencia suprarrenal [2]. A pesar de ello no fue hasta 1951 cuando el célebre Guido Fanconi acuñó el término de “nefronoptisis familiar juvenil” para describir los casos encontrados en dos familias que presentaban características clínicas atribuibles a la forma juvenil “clásica”, la más frecuente actualmente de la enfermedad, producida por mutaciones en el gen NPHP1 [3]. El estudio genético posterior de las diferentes familias afectas, desde 1993 (año del descubrimiento del locus responsable en la mayoría de las familias descritas, situado en la región 2q12-q13 [4] [5]) hasta la actualidad, ha permitido la caracterización de más de 20 genes implicados en entidades con afectación diversa, pero con la alteración renal como nexo común [6].
Bajo el concepto de nefronoptisis (NPHP), conocido también antiguamente como complejo nefronoptisis-enfermedad quística medular (NPHP-MCKD) y actualmente como ciliopatías relacionadas con la nefronoptisis (NPHP-RC), encontramos un grupo de enfermedades que presentan características histológicas, clínicas y fisiopatológicas comunes y que son consecuencia de mutaciones en múltiples genes que codifican proteínas implicadas en la composición y el correcto funcionamiento del aparato ciliar (cuerpos basales, cilios primarios y centrosomas) [7][8].
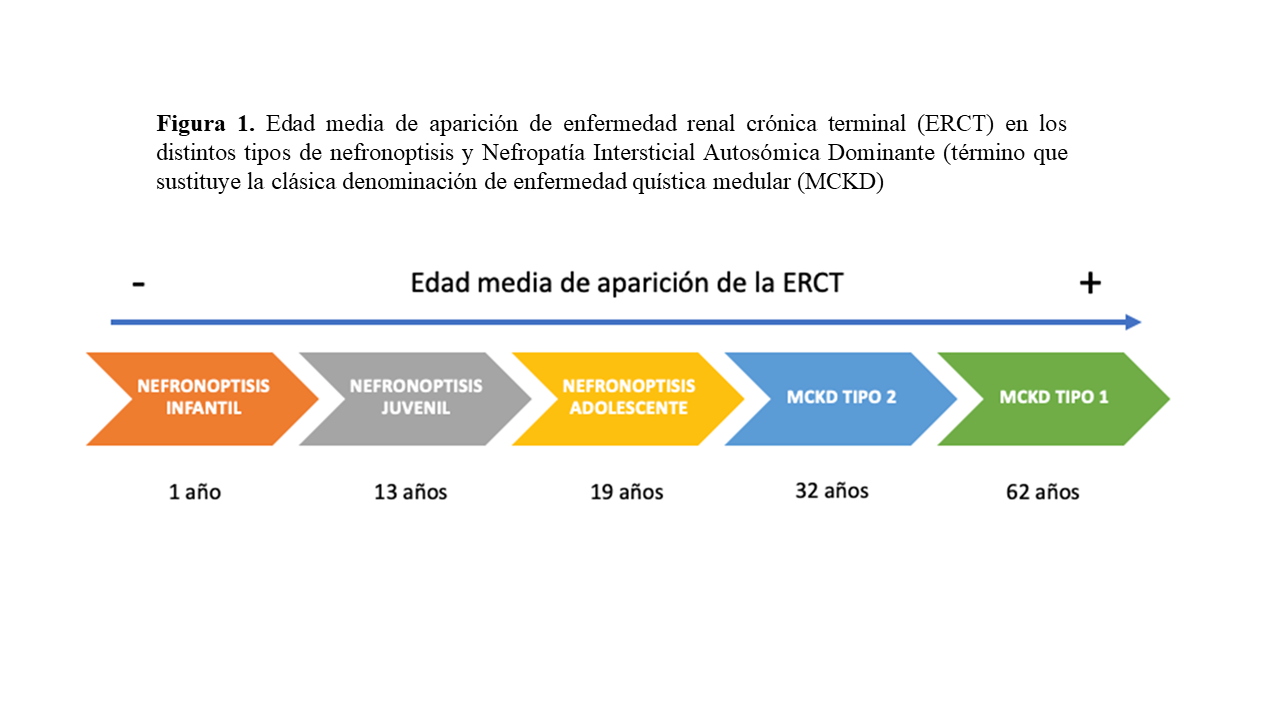
Estas mutaciones, clásicamente monogénicas y de herencia autosómica recesiva darán lugar al desarrollo de enfermedades quísticas renales asociadas o no a manifestaciones en otros órganos y con una progresión típicamente hacia la enfermedad renal crónica terminal (ERCT) en las primeras dos décadas de la vida [9]. Debido a las diferencias clínicas, genéticas y en las implicaciones pronósticas asociadas a la edad de debut de la enfermedad se ha llevado a cabo una clasificación basada en la edad media en la que se desarrolla la ERCT [10], dividiéndola así en tres tipos (Figura 1).
Infantil: al año de vida
Juvenil: a los 13 años
Adolescente: a los 19 años
Cada una de ellas asocia defectos genéticos específicos y tienen como factor común el desarrollo de una nefritis tubulointersticial crónica con alteración en la capacidad de concentración urinaria, junto a déficit de reabsorción de sodio en algunos casos, y manteniendo típicamente en todas ellas al inicio un sedimento urinario sin alteraciones (leve proteinuria de bajo peso molecular inicial en algunos pacientes).
En contraste con la nefronoptisis, la enfermedad quística medular (MCKD) posee como ya hemos nombrado un patrón de herencia autosómico dominante y generalmente presenta un curso más paucisintomático con una progresión lenta hacia la ERCT en la edad adulta [11] [12] [14] [7]. Los característicos quistes renales de la unión corticomedular que dan nombre a la enfermedad, sin embargo, pueden no aparecer.
El término Enfermedad Quística Medular se aplicó a las formas adultas con herencia autosómica dominante. El mayor conocimiento de los genes implicados, y la presencia muy inconstante de quistes, ha determinado la evolución de estos conceptos. El término Nefropatía Tubulointersticial Autosómica Dominante (NTAD) ha sido recientemente establecido por las guías KDIGO utilizando la sigla en inglés ADTKD, sustituyendo al de Enfermedad Quística Medular [13]
(Véase Capítulo Nefropatía Tubulointersticial Autosómica Dominante).
EPIDEMIOLOGÍA
La NPHP es una enfermedad poco común, al igual que los registros epidemiológicos que existen de ella en la actualidad, siendo la mayoría de los estudios realizados en base a la forma más frecuente de la enfermedad, la juvenil (NPHP 1).
Estudios epidemiológicos realizados en Finlandia y Canadá estiman una prevalencia para la forma juvenil de entre 0,1-0,2 por cada 10.000 recién nacidos vivos [9] [15]. Igualmente la nefronoptisis es la responsable de entre el 2,4-15% de los casos de ERCT en niños, según estudios epidemiológicos realizados en EEUU [16] y Europa [17] respectivamente, sin diferencias entre sexos y con una prevalencia mucho mayor en la raza blanca. En su gran mayoría son enfermedades autosómicas recesivas y presentan una gran penetrancia, con diferentes series que revelan la presencia de la enfermedad en familiares entre el 35-50% [18]. Sin obviar que se trata de una enfermedad poco común, se sitúa como un de las causas genéticas más frecuentes de ERCT en la infancia.
FISOPATOGENIA DE LA ENFERMEDAD
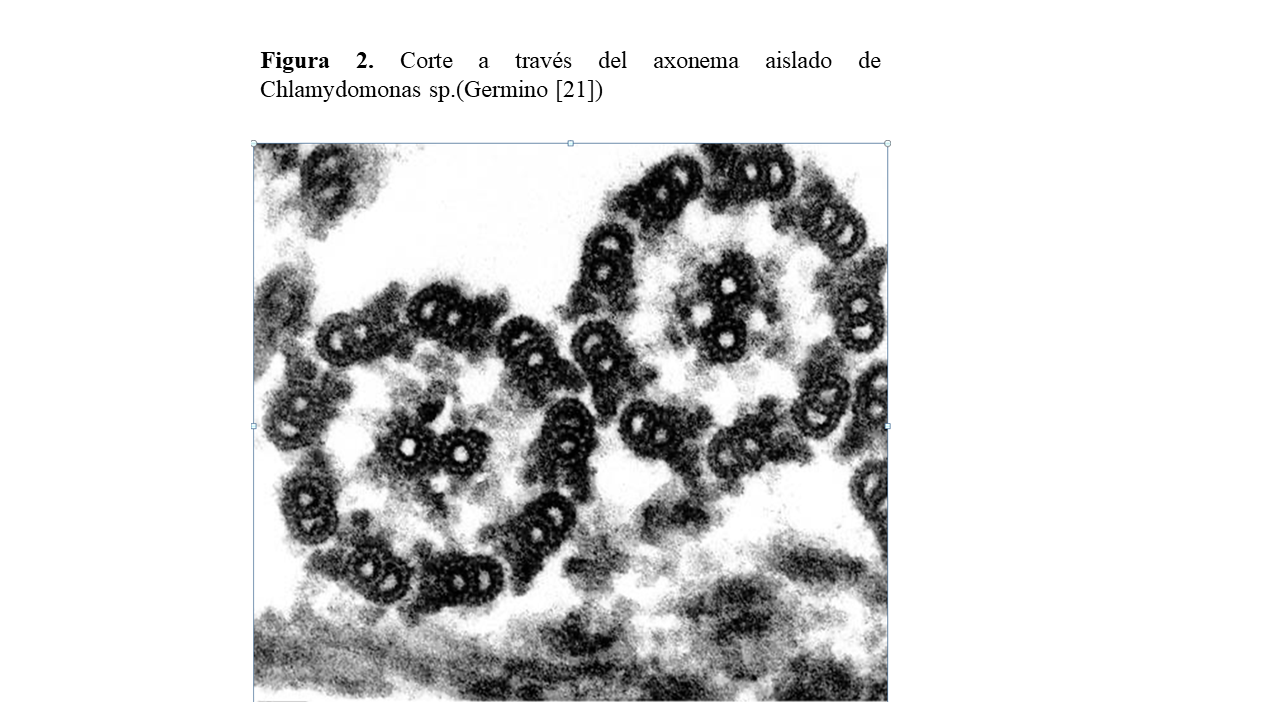
Para entender la fisiopatogenia de las NPHP-RC es importante conocer el mecanismo de polarización celular, el funcionamiento del aparato ciliar y el transporte intraflagelar (Figura 2), ya que mutaciones que afecten a diferentes proteínas y vías de señalización implicadas en este complejo son las que van a determinar el desarrollo de la enfermedad.
Aparato ciliar
Las formaciones ciliares en las células de los vertebrados se forman a partir del cuerpo basal, una estructura derivada del centro organizador de microtúbulos (MTOC) o centrosoma. Este es un orgánulo situado en las proximidades del núcleo en el que penetran los extremos negativos de los microtúbulos y encargado de la nucleación de estos, de la formación del huso mitótico durante la división celular y de, como hemos referido, la conformación de los cuerpos basales de cilios y flagelos (extremos positivos).
Cada una de estas formaciones ciliares están constituidas por un tallo cilíndrico cubierto de una membrana plasmática especializada que contiene el axonema: complejo formado por nueve dobletes periféricos de microtúbulos y un par central (9+2) (Figura 2), aunque también puede carecer de la pareja de microtúbulos centrales (9+0) y una zona de transición, que actúa como “filtro” de las moléculas que pueden pasar hacia el cilio o fuera de éste y que une el tallo al cuerpo. Durante la ciliogénesis, el cilio crece mediante la adhesión de nuevas subunidades axonemales desde el cuerpo basal hasta la punta distal.
Los cilios 9+2 poseen habitualmente brazos de dineína que unen los dobletes de microtúbulos y que le dan movilidad, mientras que los cilios 9+0 suelen carecer de ellos y son inmóviles, denominándose éstos últimos cilios primarios [19].
Polarización celular
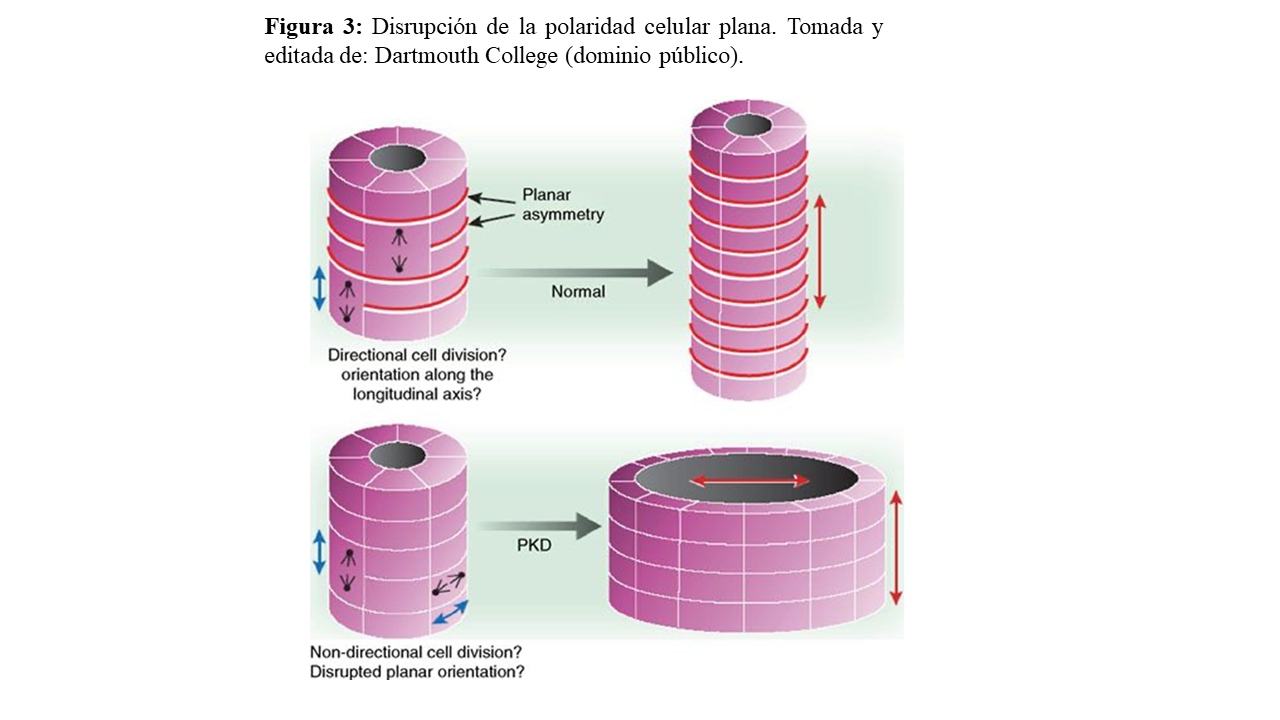
La polarización celular está controlada por los centrosomas. La correcta orientación de éstos y el huso mitótico durante la división celular con respecto al eje longitudinal del túbulo es un punto crítico para conseguir una adecuada polaridad celular plana (orientación tridimensional de una capa célula epitelial). Esta polaridad se encuentra regulada por las vías de señalización Wnt (canónica y no canónica) y Sonic Hedgehog (Shh) durante la morfogénesis tubular renal.
Se ha demostrado en modelos animales que la sobreexpresión de β-Catenina (activada mediante la vía de señalización Wnt no canónica) puede llevar al desarrollo de quistes renales en modelos de ratones [20].
Por ello, la disrupción de esta orientación longitudinal sería el mecanismo de desarrollo de las dilataciones tubulares o quistes presentes en la enfermedad (Figura 3) [21].
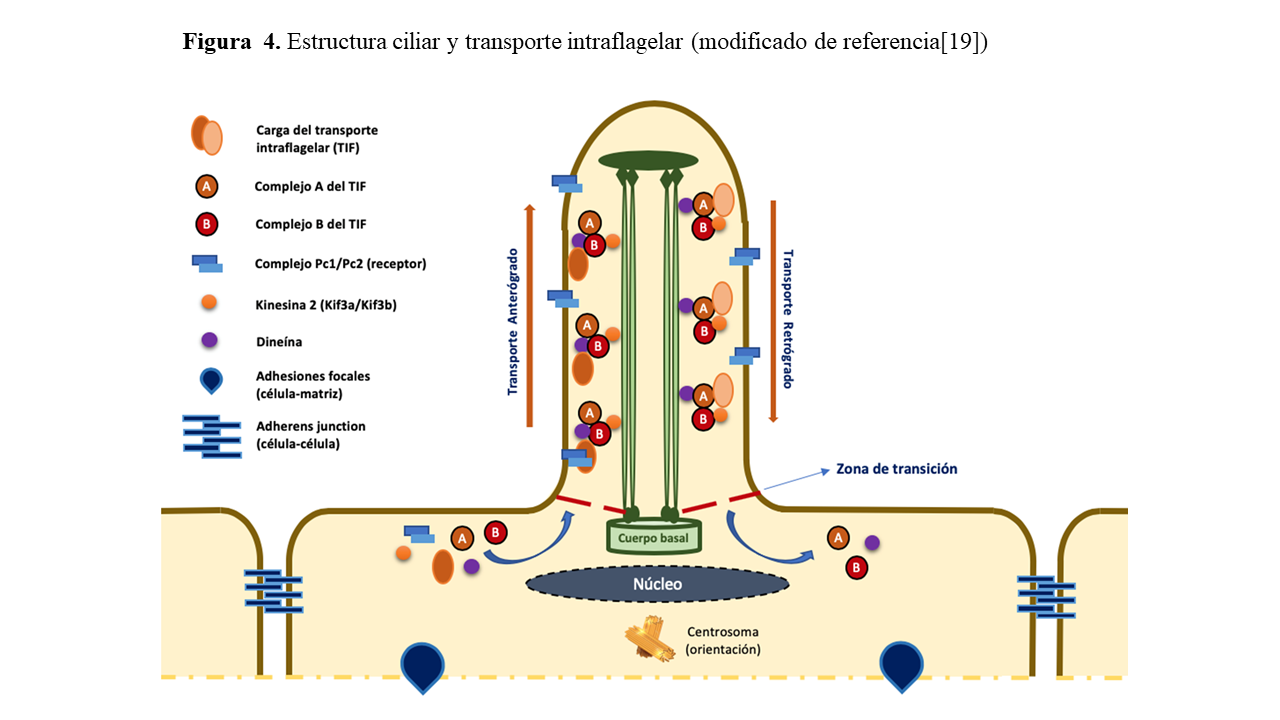
Transporte intraflagelar (TIF)
Los componentes encargados de la formación y reciclado de la membrana ciliar y el axonema son transportados en macromoléculas de “carga” (complejos A y B) por el llamado TIF a través de los dobletes de microtúbulos [22]. El transporte anterógrado (hacia la punta distal) es conducido por la Kinesina heterotrimérica 2 (formada por dos subunidades motoras: Kif3a y Kif3b y una subunidad no motora). El transporte retrógrado (nuevamente hacia la célula), en cambio, se encuentra regulado por la proteína citoplasmática motora Dineína 1B [23].
Patogenia de las ciliopatías renales
“Cistoproteínas” o “Nefrocistinas” es el nombre que se ha dado a las proteínas codificadas por los genes implicados en las enfermedades renales quísticas, tanto en humanos como en modelos animales. Estas se sitúan en los cilios primarios, cuerpos basales, el huso mitótico, centrosomas, adherens junctions, retículo endoplásmico o las adhesiones focales y cambian su localización dependiendo de la fase del ciclo celular en el que se encuentra la célula [24] (Figura 4).
Un ejemplo son las DAPs (Distal Appendage Proteins), apéndices distales que se proyectan radialmente desde el extremo distal del centriolo madre que desempeñan un papel crucial en el acoplamiento de la vesícula ciliar primaria y en el inicio de la ciliogénesis. Las mutaciones en los genes que codifican estas proteínas (CEP83, CEP164 o SCLT1) pueden provocar una pérdida completa del cilio primario, una formación ciliar anormal o una señalización ciliar defectuosa, dando lugar (tanto en humanos como en ratones) a fenotipos de nefronoptisis [25].
Las ciliopatías renales son producidas por mutaciones que modificarán tanto la localización subcelular de estas cistoproteínas como su interacción funcional con otras proteínas del complejo. Esto conlleva alteraciones en las vías de señalización intracelular (célula-célula y célula-matriz) con incapacidad por parte de los mecanosensores ciliares para detectar correctamente el flujo de fluido luminal [26] debido a la disfunción ciliar, lo que llevará a una disregulación del crecimiento tisular y a la formación de los quistes renales.
GENÉTICA
Como hemos comentado anteriormente, todos los genes implicados en la NPHP codifican componentes del aparato ciliar: cilios primarios, cuerpos basales o centrosomas [7] [8].
De todos ellos el más común con mucha diferencia es el NPHP1, responsable de aproximadamente el 20% de los casos de NPHP [6] [27]. El resto de los más de 50 genes que han sido descritos en la base de datos OMIM® (Online Mendelian Inheritance in Man) como implicados, son responsables de menos de un 3% de los casos cada uno [9]. Igualmente, cabe destacar que hasta en un 30% [28] de los pacientes con NPHP aún no se ha identificado ninguna mutación genética responsable.
Hasta el 25% de las mutaciones en NPHP1 son delecciones homocigotas [9], aunque han sido descritas también delecciones heterocigotas acompañadas de mutaciones puntuales del segundo alelo. A pesar de ser el gen que con más frecuencia produce la forma juvenil de NPHP existe una importantísima variabilidad genotipo-fenotipo de la enfermedad, habiéndose descrito pacientes con delecciones homocigotas de NPHP1 que desarrollan la ERCT tardíamente en la edad adulta (0,5%) [29].
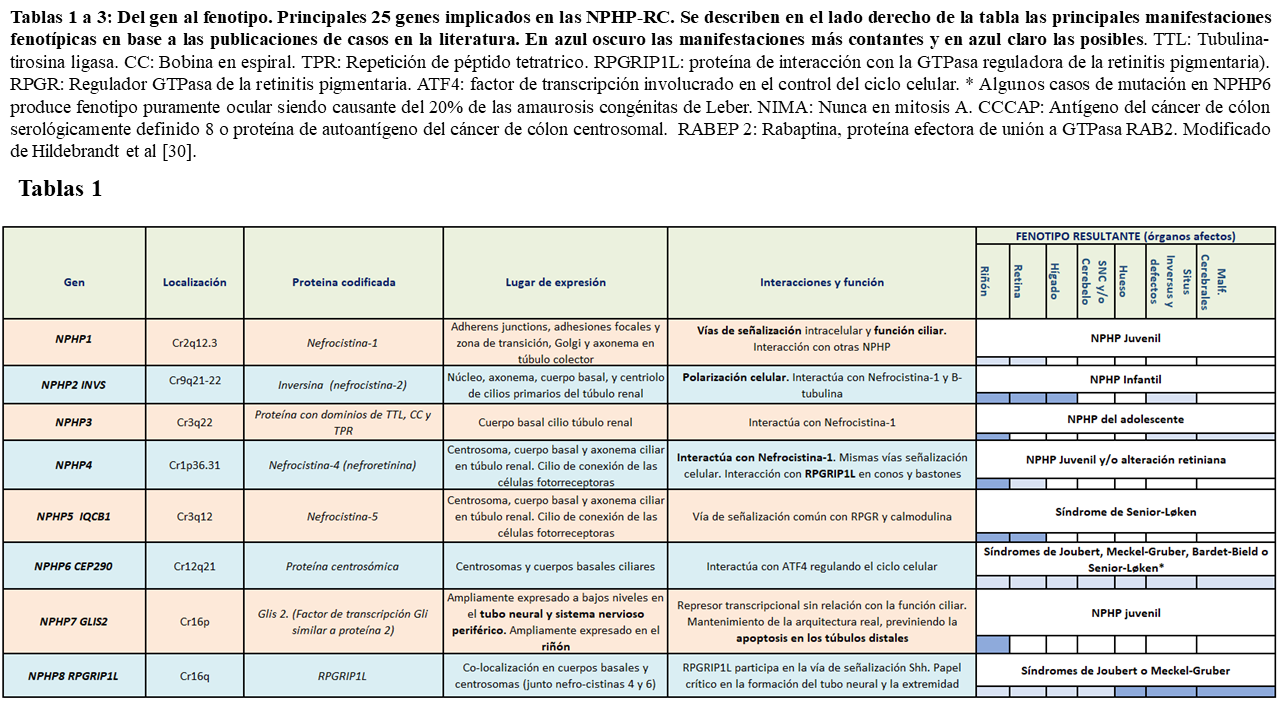
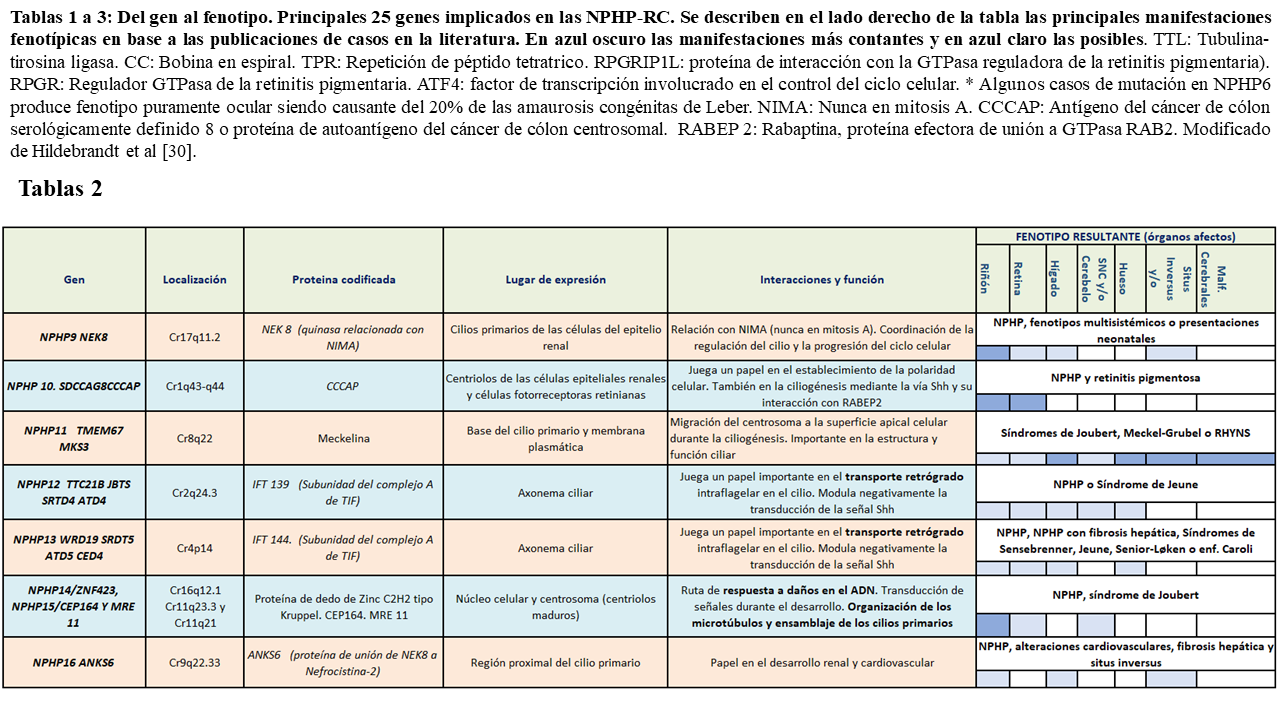
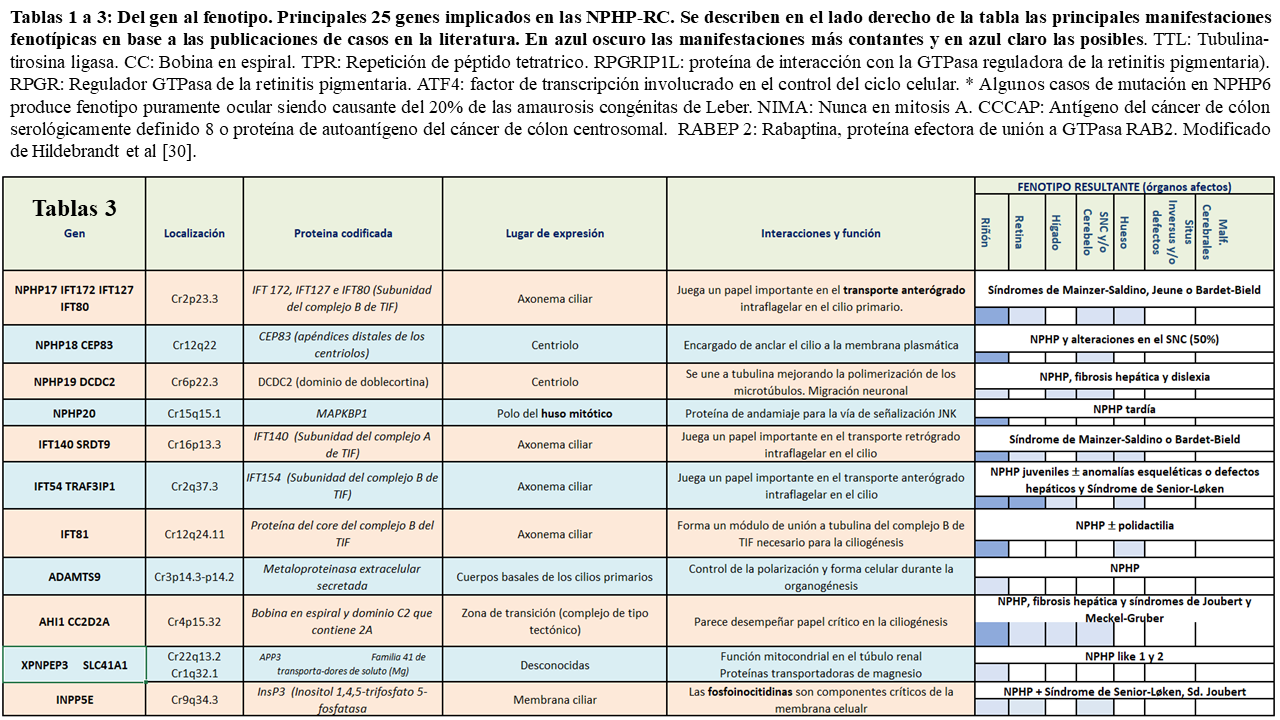
En la siguiente tablas (Tabla 1) (Tabla 2) (Tabla 3) quedan reflejados los 26 principales fenotipos y los genes implicados identificados hasta el momento actual, así como su localización, las proteínas que codifican y los posibles fenotipos resultantes:
Como podemos ver en las tablas, las diferentes nefrocistinas pueden interaccionar entre si participando en múltiples vías de señalización intracelular que incluyen la función ciliar, pudiendo presentar fenotipos similares.
De hecho la NPHP juvenil está asociada con mutaciones en prácticamente todos los genes NPHP salvo con NPHP2, que produce la forma infantil de NPHP (distinta en prácticamente todo al resto de nefronoptisis como luego veremos) y NPHP 3, que produce la forma del adolescente, con evolución más lenta a la ERCT [31].
Los productos génicos de algunos NPHP se encuentran en los cilios de otros órganos. Por ello, cuando estos sufren una mutación, dan lugar a NPHP que asocian manifestaciones extrarrenales o en el contexto de síndromes, como es el caso de NPHP5 (asociado con retinitis pigmentosa y el síndrome de Senior-Løken), NPHP6 o NPHP8 (asociados ambos a degeneración retiniana y aplasia del vermis cerebeloso en el síndrome de Joubert o el síndrome de Meckel-Gruber) entre otros. Muchos de los genes actualmente relacionados con la NPHP solo han podido ser estudiados en unas pocas familias afectas (como NPHP10, 16 ó 18), por lo que las manifestaciones descritas en ellos hasta el momento, debido a la amplia variabilidad fenotípica presente en la enfermedad, están por confirmar.
NPHP 7 es causado por mutaciones en genes que codifican el factor de transcripción Glis2. Estudios en ratones con pérdida de función de Glis2 muestran senescencia de las células tubulares renales que en este estado secretan moléculas proinflamatorias e inducen daño progresivo orgánico a través de varias vías de señalización (como NF-κB). Mutaciones en este gen han sido implicadas en desarrollo de nefronoptisis de inicio precoz [32]. La importancia del conocimiento de este mecanismo patogénico reside en que se ha demostrado como la activación genética del receptor toll-like (TLR)/IL-1 o la eliminación farmacológica de las células senescentes (terapia senolítica) reduce el daño tubular, la fibrosis y la apoptosis en modelos de ratón Glis2 de NPHP, pudiendo esto retrasar la progresión de la enfermedad renal en la NPHP tipo 7 [33].
Existen entidades con fenotipos puramente renales y de desarrollo más tardío denominadas NPHPL (nefropatías NPHP like) de la que se han caracterizado dos tipos: el 1, producido por variantes en el gen XPNPEP3 y el tipo 2, producido por mutaciones en el gen SLC41A1 [34]. A pesar de ello, se han descrito mutaciones recientes en homocigosis con afectación del marco de lectura (c.719_790insA; p.Q241Tfs*31) causando formas de nefronoptisis de desarrollo precoz en la infancia [35]. Pacientes con mutaciones en MAPKBP1 pueden presentar también fenotipos leves renales y por lo tanto deben ser consideradas en adultos con enfermedad renal crónica de causa desconocida [36].
En el caso del NPHP 12 (TTC21B), curiosamente, ha sido descrita una rara mutación de pérdida de sentido en homocigosis (p.P209L) en 14 familias del norte de África y Portugal, y en heterocigosis en otras 5 familias, que dan lugar a proteinuria y glomeruloesclerosis focal y segmentaria (GSFS) junto a estrechamiento de la membrana basal tubular. Estos pacientes desarrollaron HTA junto a proteinuria tubular tardía y progresión a ERCT entre los 15-32 años, aunque se han descrito fenotipos precoces [37]. También se han descrito como causantes de este fenotipo mutaciones en heterocigosis compuestas (c.450G>A y c.626C>T) en los exones 5 y 6 [38]. Este curioso caso demuestra como genes ciliares pueden estar implicados también en la patogenia de enfermedades glomerulares [39] (TTC21B, NPHP4 y CRB2) ha sido también descrita recientemente en una paciente de 6 años con una mutación en heterocigosis compuesta del gen CC2D2A (que codifica una proteína esencial del centrosoma ciliar de distribución ubicua pero sin expresión en podocitos), dando lugar a un cuadro de GSFS, polidactilia axial, nefronoptisis, respiración atáxica y retraso mental con desarrollo rápido de ERCT y necesidad de diálisis a los 8 meses del diagnóstico [40].
Cabe destacar el hallazgo en diferentes familias de herencia oligogénica, con pacientes afectos de NPHP que presentaron mutaciones en diferentes genes NPHP simultáneamente (1, 3 y 4) [41] o pacientes con síndrome de Joubert con mutaciones en los genes NPHP 1 y 6 [42]. El número de pacientes con herencia oligénica es demasiado pequeño para sacar conclusiones de la correlación genotipo/fenotipo como que la presencia de múltiples mutaciones o el tipo de mutación aumente la severidad de los hallazgos clínicos.
MANIFESTACIONES CLÍNICAS
Los pacientes con nefronoptisis uniformemente progresan a la ERCT antes de los 20 años de vida, con diferencias como ya hemos referido según la forma clínica presente.
Los síntomas iniciales son relativamente leves (salvo en el caso de pacientes con formas de NPHP infantil) e insidiosos, derivados de la afectación tubulointersticial.
Éstos consisten en un déficit de concentración urinaria que se expresa en forma de poliuria, polidipsia, ingesta regular de líquidos en la noche, nicturia y, en ocasiones, enuresis nocturna. También la anemia puede estar presente dentro de los signos iniciales de la enfermedad debido a una deficiencia en la síntesis de eritropoyetina [43].
Posteriormente los síntomas irán asociados a la uremia y la progresión de la enfermedad renal crónica. A diferencia de otras enfermedades que progresan a ERCT, la mayoría de los pacientes con NPHP permanecen normotensos (salvo aquellos con formas infantiles NPHP2), seguramente debido a la hipovolemia causada por la pérdida de concentración urinaria y a la pérdida salina [44]. Las principales diferencias entre las 3 formas de presentación más frecuentes de NPHP se exponen en la siguiente tabla (Tabla 4):
Igualmente el sedimento urinario suele ser inactivo sin proteinuria o con una proteinuria de origen tubular que aparece en algunas ocasiones. En etapas avanzadas de la enfermedad y coincidiendo con el desarrollo de la glomerulosclerosis secundaria, aparecerá la proteinuria glomerular [45]. Se observa retraso del crecimiento relacionado con la hipovolemia crónica inicialmente y posteriormente en el contexto de la ERCT.
Rararmente, debido a mutaciones en los genes ARHGDIA, FATI o NUP93, puede observarse un fenotipo clínico de “overlapping” que se presenta como una combinación de NPHP-RC y síndrome nefrótico [9].
Manifestaciones extrarrenales
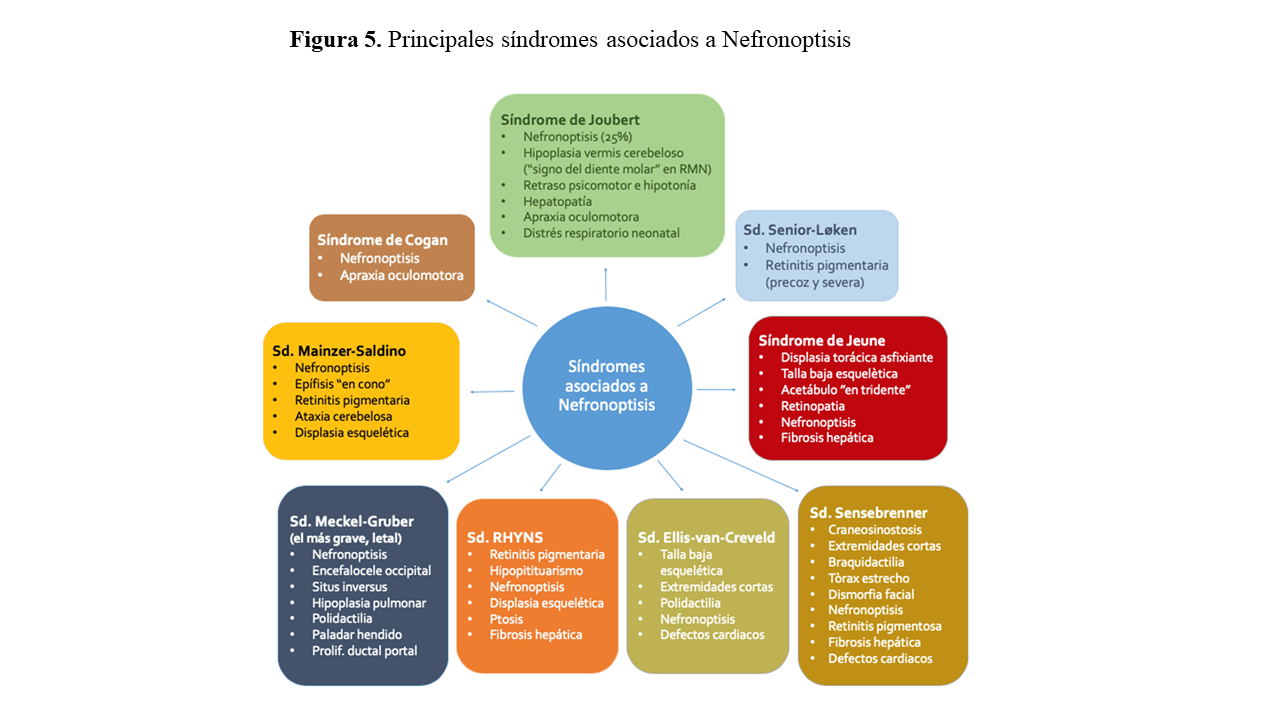
Una característica destacada de la NPHP es la afectación de múltiples órganos (pleiotropía) aparte del riñón, debido a la expresión en los mismos de la disfunción ciliar, ocurriendo aproximadamente entre el 10-20% de los casos (hasta 80% de los casos en el NPHP2). Estas manifestaciones pueden presentarse asociadas a la forma renal por separado o formando parte de distintas asociaciones que dan lugar a síndromes característicos (Figura 5). Los órganos principalmente afectados serán: hígado, ojo, cerebro, hueso y corazón, con la posible asociación de situs inversus. Los defectos posibles asociados a los diferentes órganos serán los siguientes:
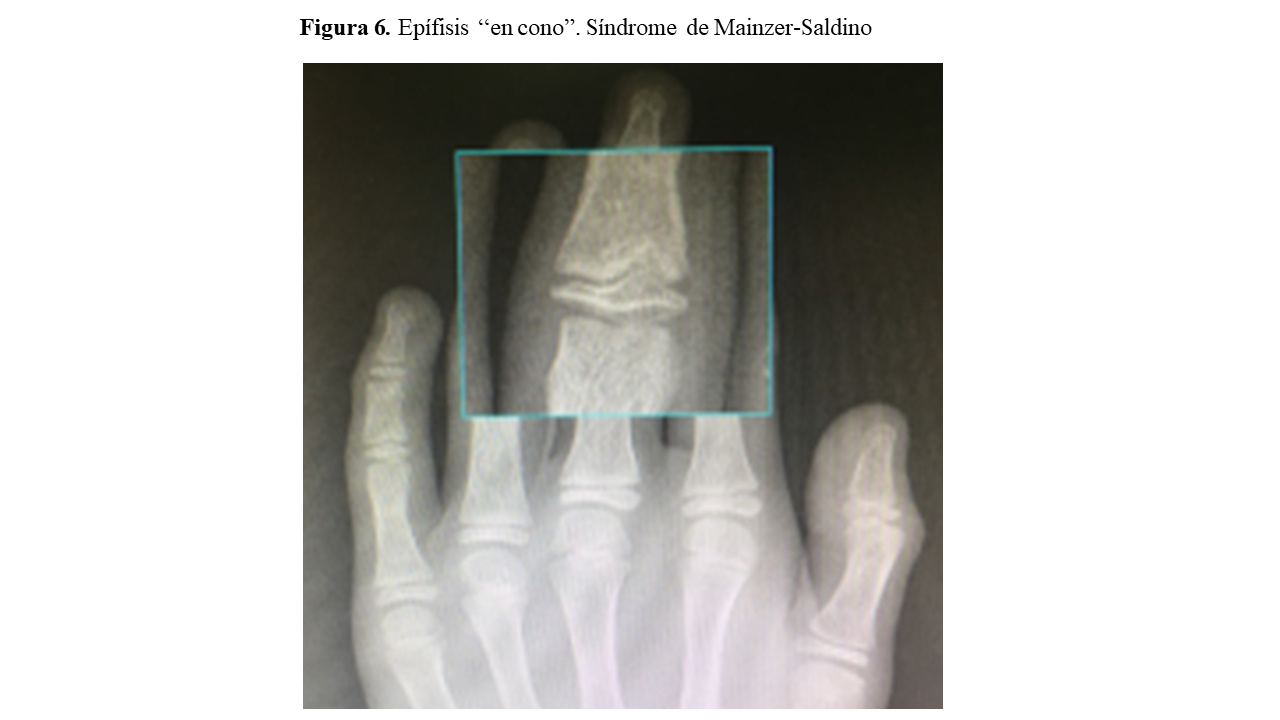
- Defectos esqueléticos: Acortamiento de costillas y extremidades, escoliosis, polidactilia, braquidactilia, craniosinostosis o epífisis “en cono” (síndrome de Mainzer-Saldino)
- Ojo: Retinitis pigmentaria o degeneración tapetoretinal con disminución de la capacidad visual progresiva, coloboma, microftalmia o apraxia oculomotora congénita (ausencia o defecto en el control voluntario del ojo, con incapacidad para los movimientos oculares horizontales que mejora en los primeros años de vida)
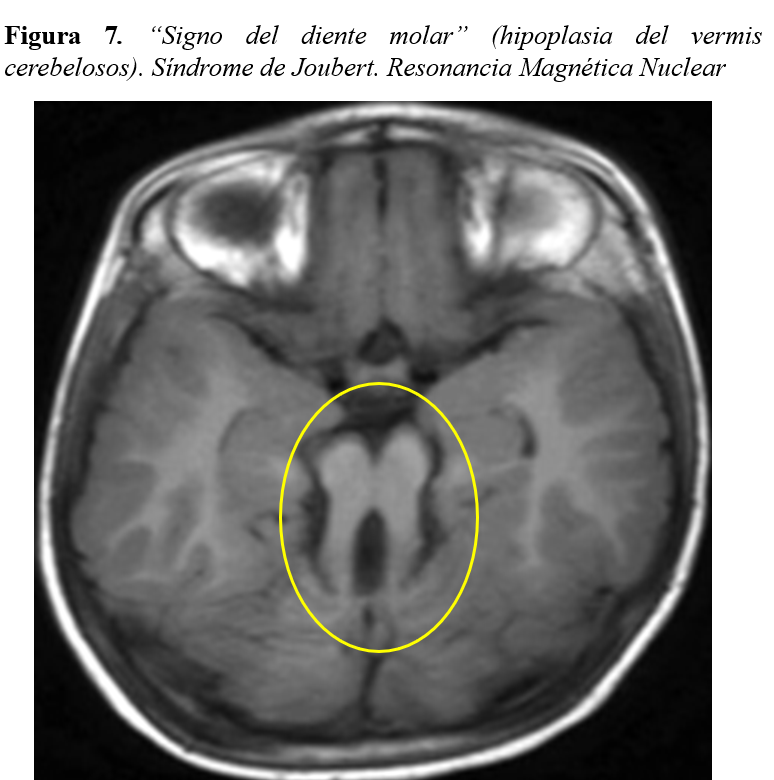
- Cerebro: Malformaciones cerebrales (encefalocele o hipoplasia del vermis cerebeloso). Pueden presentar clínica de ataxia, hipotonía o retraso del desarrollo en grado variable.
- Hígado: Hepatoesplenomegalia y fibrosis portal sin o con mínima proliferación de los ductos biliares (esto lo diferencia de la afectación hepática en la poliquistosis renal y de la fibrosis hepática congénita)
- Corazón: Defectos valvulares o septales ventriculares cardiacos congénitos
Nefropatía Tubulo Intersticial Autosómica Dominante (NTIAD)
DIAGNÓSTICO
A pesar de la posibilidad de aparición de múltiples signos y síntomas de la enfermedad en pacientes con NPHP-RC, la mayoría de las veces la detección de la patología (debido a su inicio paucisintomático) se lleva a cabo por el hallazgo accidental de un aumento de la creatinina sérica.
En estos pacientes, una vez ahondamos en la historia clínica, encontramos antecedentes de nicturia, enuresis nocturna, poliuria, polidipsia e hipostenuria de manera habitual. Los exámenes de laboratorio nos mostrarán un aumento de los parámetros relacionados con la insuficiencia renal según el grado: anemia, hiperfosforemia, aumento de creatinina y urea, acidosis metabólica, etc. También se recomienda una evaluación funcional hepática mediante análisis sérico al diagnóstico en todos los pacientes.
En la actualidad, el diagnóstico precoz de la enfermedad es limitado debido a la ausencia de marcadores de laboratorio específicos para la patología. En este aspecto, un interesante trabajo de Stokman y colaboradores [46] en el que mediante análisis proteómico de vesículas extracelulares urinarias de pacientes con nefronoptisis se identificaron 156 proteínas con una expresión alterada respecto a controles sanos, abre una prometedora vía en la determinación de marcadores no invasivos pronósticos y de diagnóstico precoz en la enfermedad.
Además de una exploración clínica cuidadosa en busca de signos de displasias esqueléticas o malformaciones del sistema nervioso central (ataxia, nistagmo, apraxia oculomotora, hipotonía…). El examen ocular mediante oftalmoscopia se recomienda realizarlo a todos los pacientes al diagnóstico debido a la frecuente asociación de la enfermedad renal en las NPHP-RC con problemas oculares como la retinitis pigmentosa ( si se detectan, la ectrorretinografía y la electrooculografía, permiten valorar la severidad ocular).
Igualmente, una ecografía renal y hepática nos ayudará a facilitar la detección de pacientes con fibrosis hepática y a nivel renal nos mostrará las características ecográficas de la enfermedad: tamaño renal normal o reducido, hiperecogenicidad cortical, pérdida de la diferenciación corticomedular y, finalmente, la formación de quistes en el borde cortico-medular del riñón [47] (este hallazgo inconstante, que a veces debe ser demostrado mediante resonancia magnética nuclear o tomografía axial computerizada) [48].
Una valoración radiográfica ósea completa (serie ósea) nos permitirá detectar signos característicos de enfermedades del complejo NPHP-RC, como las epífisis en “cono” (Sd. Mainzer-Saldino) (Figura 6) o el acetábulo “en tridente” (Sd. Jeune). La realización de una resonancia magnética cerebral en aquellos pacientes que presenten sintomatología del SNC puede ayudarnos a detectar igualmente la hipoplasia del vermis cerebeloso y su característico “signo del diente molar” (Sd. Joubert) (Figura 7).
A pesar de que el diagnóstico de las NPHP-RC se sugiere por los hallazgos clínicos, ecográficos y las típicas manifestaciones extrarrenales, deben ser confirmados por técnicas de genética molecular en todos los casos mediante el examen de los posibles genes responsables.
En caso de no poder realizar el examen molecular o que con este no hayamos detectado la mutación responsable de la enfermedad (la detectamos hasta en el 60-70% de los casos mediante el uso de paneles genéticos de secuenciación masiva), la biopsia renal puede ayudarnos a sugerir el diagnóstico a través de característicos cambios histológicos comunes en las NPHP-RC (no patognomónicos).
El aspecto macroscópico de los riñones será el de una superficie con apariencia finamente granular, debido a la protrusión de los túbulos colectores corticales dilatados (5-50 quistes de 1-15 mm de diámetro en el borde cortico-medular). Éstos proceden de los túbulos contorneados distales y colectores medulares [49]. A diferencia de otras patologías quísticas renales, estos parecen producirse ex vacuo, por la pérdida del tejido renal circundante.
Del mismo modo, los quistes solo están presentes en el 70% de las autopsias [50] en la enfermedad y su aparición en muchos casos es tardía, no siendo necesarios por tanto para el diagnóstico de la misma. No se han descrito la aparición de quistes en localizaciones extrarrenales.
En el aspecto microscópico destaca característicamente el engrosamiento y desflecamiento de la membrana basal tubular (más prominente en túbulos distales), seguido de infiltración peritubular por histiocitos y linfocitos, atrofia y dilatación tortuosa de los túbulos y finalmente nefropatía tubulointersticial esclerosante. A nivel glomerular puede aparecer fibrosis periglomerular y en pacientes con nefronas destruidas secundariamente a las alteraciones tubulares, incluso glomeruloesclerosis.
DIAGNÓSTICO DIFERENCIAL
Para llevar a cabo el diagnóstico diferencial de las NPHP-RC con otras patologías se tendrán en cuenta parámetros histológicos, la presencia o no de manifestaciones extrarrenales, la actividad del sedimento urinario, una historia familiar positiva y el resultado de pruebas como la ecografía y por supuesto, test genéticos.
La histología nos ayudará a diferenciar las NPHP-RC de otras nefropatías túbulo-intersticiales como la pielonefritis crónica o la nefrotoxicidad farmacológica.
Mediante la medición del tamaño y volumen renal las diferenciaremos de patología como la displasia oligomeganefrónica o hipodisplasia renal, presentando estas últimas unos riñones de un tamaño muy pequeño (< de -2DS) en comparación con los riñones normales o levemente disminuidos de tamaño que vemos en las NPHP-RC. En el caso de las poliquistosis (AD y AR) el tamaño puede llevarnos a equívoco (aunque en estas habitualmente los riñones estarán llamativamente aumentados de tamaño), por lo que la presencia de una historia familiar positiva desequilibrará la balanza hacia la poliquistosis o la NTIAD enfermedad quística medular en estos casos sobre las NPHP-RC.
A pesar de que en la NPHP podemos observar un aumento del tamaño vesical y leves dilataciones pielocaliciales debido a la poliuria crónica, la presencia de hidronefrosis nos puede hacer pensar más claramente en cuadros de uropatía obstructiva.
Por otra parte, aunque la clínica y la presencia de manifestaciones extrarrenales características de los síndromes asociados a NPHP pueden ayudarnos, no hay que olvidar que la hipodisplasia renal se observa en más de 200 enfermedades sindrómicas con afectación multisistémica, por lo que afectación extrarrenal no asociada habitualmente con la NPHP podría ayudarnos a diferenciar entre estas dos enfermedades.
TRATAMIENTO
No existe actualmente tratamiento etiológico para la enfermedad. El tratamiento es sintomático y de soporte de las complicaciones asociadas a la ERC o al tipo de NPHP (HTA, hiperparatiroidismo, desequilibrios metabólicos, corrección del equilibrio ácido-base y diselectrolitemias…), tratando de mantener un buen balance de fluidos para prevenir episodios de hipovolemia (asegurar adecuada ingesta de sal), tratar la anemia cuando esta aparezca (suplementos de hierro y eritropoyetina) y promoviendo un crecimiento adecuado, a veces mediante la administración de hormona de crecimiento.
Cuando los pacientes desarrollan la ERCT esperable de la enfermedad, la terapia renal sustitutiva preferida es el trasplante renal, ya que los resultados documentados son excelentes en estos pacientes, sin haberse reportado ningún caso de recurrencia de la enfermedad en el riñón trasplantado. Se observan unos resultados mejores en el trasplante que en la población pediátrica general trasplantada, sobre todo, en pacientes que reciben riñones de donante vivo [51]. Cobra especial importancia un manejo multidisciplinar de la patología mediante la colaboración de nutricionistas, psicólogos y otros especialistas a las diferentes manifestaciones extrarrenales que presente el paciente.
Tanto en ratones pcy como pkd2 con fenotipo de riñón quístico (equivalente en humanos a la NPHP3) se ha visto como este puede ser fuertemente mitigado o incluso revertido mediante el tratamiento con el antagonista del receptor de vasopresina V2 OPC31260 [52]. El tratamiento con roscovitina [53] ha sido otra interesante aproximación terapéutica realizada en modelos de ratones afectos de NPHP-RC.
Un reciente trabajo ha demostrado la implicación de la vía de las prostaglandinas en el desarrollo de la enfermedad en modelos in vitro e in vivo: se analizó la capacidad de la prostaglandina E1 (PGE1) para rescatar los defectos de ciliogénesis en células tubulares renales inmortalizadas derivadas de la orina de pacientes con NPHP1, consiguiendo mejorar los fenotipos ciliar y renal en modelos de pez cebra y ratones Nphp1-/-. Además, en este mismo trabajo, se demostró como taprenepag, un agonista no prostanoide de la prostaglandina E2, consiguió mejorar la retinopatía grave observada en estos ratones abriendo una potencial vía de desarrollo terapéutico [54].
Como ocurre en otras patologías renales, el aumento progresivo de la comprensión de la fisiopatología de la enfermedad probablemente nos guíe hacia el desarrollo de terapias guiadas a la misma con la que consigamos un mejor manejo de los pacientes con NPHP-RC.