Nefritis Intersticial aguda tratada con Micofenolato, una alternativa para pacientes frágiles
INTRODUCCIÓN
La nefritis intersticial aguda (NIA) es la tercera causa de lesión renal aguda (LRA) en pacientes hospitalizados[1] y del 15-27% de las biopsias por LRA[2]. Existen varias causas de NIA, siendo la más frecuente la inducida por fármacos (NIA-IF)[2], con un aumento de la incidencia en los últimos años, especialmente en pacientes ancianos polimedicados (NAD: Nefropatías intersticiales). Aunque en algunos casos presentan una clínica característica como la tríada clásica (fiebre, rash cutáneo y eosinofilia), actualmente predominan las formas oligosintomáticas por lo que ante la sospecha clínica, es importante realizar una biopsia renal que aporte el diagnóstico definitivo. El tratamiento consiste en la retirada del fármaco responsable y el tratamiento precoz con corticoides. Sin embargo, la evidencia respecto al uso de otros fármacos como el micofenolato mofetilo (MMF) es escasa, siendo interesante su uso al minimizar los efectos secundarios de los corticoides (Ver Nefrología al Día, Nefritis Intersticiales).
Se presenta el caso de una paciente anciana con NIA-IF en que se utilizó como tratamiento de mantenimiento MMF con buenos resultados.
CASO CLÍNICO
Mujer de 89 años con antecedentes de hipertensión arterial en tratamiento con telmisartan y amlodipino, diabetes mellitus tipo 2 (DM2), osteoporosis y enfermedad renal crónica (ERC) estadio 3a A1 (creatinina plasmática, (CrP) 1 mg/dL). Se derivó a urgencias por naúseas, vómitos y astenia sin fiebre. Una semana antes había recibido amoxicilina-clavulánico por una infección cutánea, cambiándose tres días después a ciprofloxacino por intolerancia digestiva.
En urgencias, presentaba PA 157/63 mmHg, Tª 36,5ºC, sin signos congestivos ni lesiones cutáneas. Analíticamente, leucocitosis con neutrofilia, sin eosinofilia, ionograma sin alteraciones y LRA AKI-III (CrP 6.4 mg/dL). Sedimento urinario activo con leucocituria estéril, microhematuria y proteinuria con cociente 1700 mg/g. No se observó eosinofiluria.
Por sospecha inicial de LRA por depleción de volumen se intensificó sueroterapia al ingreso. Sin embargo, continuó el deterioro de la función renal hasta alcanzar Cr 10.7 mg/dL con oliguria y requiriendo a los diez días de exposición al fármaco (dos días desde el ingreso) hemodiálisis por sobrecarga de volumen durante dos días consecutivos.
Se amplió estudio con serologías, anticuerpos antinucleares (ANA), antiSSa, anti-SSb, ANCA PR3 y MPO negativos. Complemento normal, factor reumatoide < 10 UI/mL y proteinograma sin alteraciones.
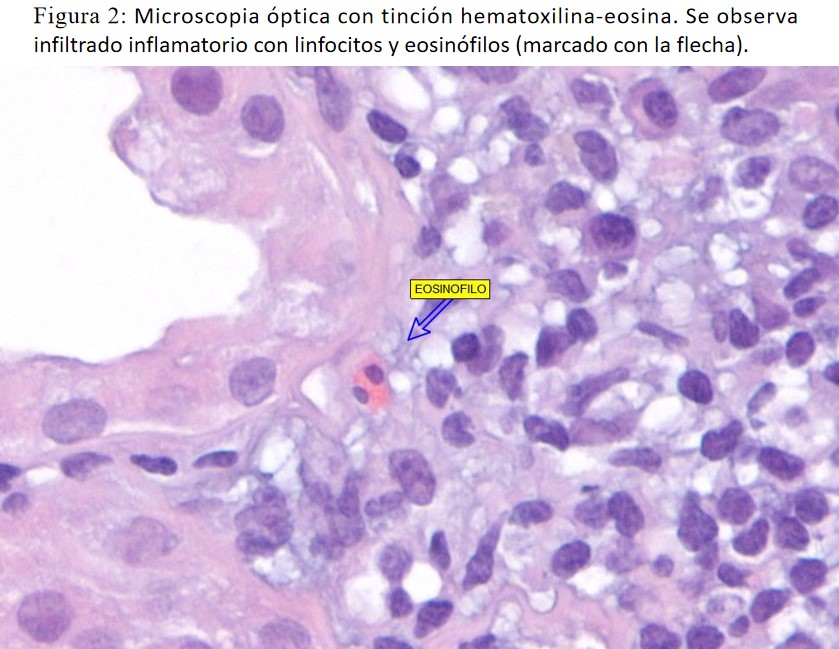
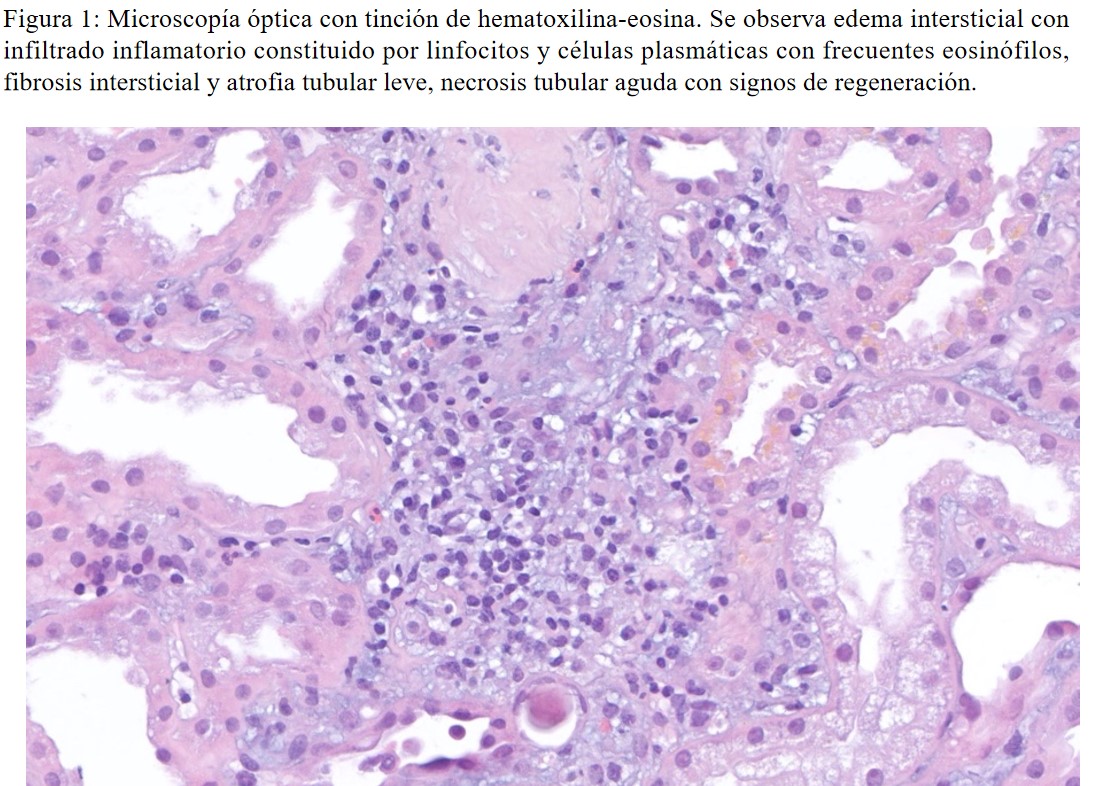
Finalmente se realizó una biopsia renal, que mostró edema intersticial con moderado infiltrado inflamatorio constituido por linfocitos y células plasmáticas con frecuentes eosinófilos, fibrosis intersticial y atrofia tubular leve (20% de la corteza renal), necrosis tubular aguda con signos de regeneración y arterioesclerosis severa. Inmunofluorescencia negativa. Todo ello compatible con nefritis tubulointersticial aguda de mecanismo inmunoalérgico (Figura 1) (Figura 2).
El día del ingreso se retiró tratamiento antibiótico y con los hallazgos en la biopsia se inició tratamiento con tres bolus de 250 mg de metilprednisona (14 días después del inicio de los síntomas) seguidos de prednisona a 1 mg/kg (dosis total de 50 kg) durante tres días. Al alta se cambió el tratamiento de mantenimiento a MMF 720 mg/12h con CrP 3.06 mg/dL. En la visita de control al mes presenta CrP 0.9mg/dL.
COMENTARIOS
Presentamos un caso de una NIA-IF. La NIA es una lesión renal caracterizada por la presencia de infiltrados inflamatorios, edema y tubulitis en el compartimento intersticial y que puede condicionar LRA. La causa más frecuente es la NIA-IF (70%) pero también puede ser provocada por enfermedades sistémicas (10-15%), infecciones (5-10%) e idiopática[2]. La NIA-IF se trata de una reacción de hipersensibilidad tipo IV dosis independiente que ocurre tras la exposición a un fármaco y suele aparecer a los 7-10 días de la exposición. Existen una gran de variedad de fármacos responsables, siendo los más frecuentes los antibióticos (beta-lactámicos y quinolonas), los inhibidores de bomba de protones y los antiinflamatorios no esteroideos.
Siempre que se sospeche el diagnóstico de NIA se debe hacer un estudio completo para descartar enfermedades infecciosas o sistémicas subyacentes, que debe incluir serologías, ANA, ANCA, complemento, Anti-Ro/SSa y Anti-LA/SSb, enzima convertidora de angiotensina y proteinograma.
En nuestro caso se sospechó inicialmente que la LRA era por depleción de volumen, sin embargo, por la evolución clínica, analítica, el antecedente farmacológico, la cronología y la edad de la paciente replanteó el diagnóstico diferencial hacía necrosis tubular aguda, NIA-IF o vasculitis.
La forma de presentación clínica habitual de la NIA-IF es inespecífica, con síntomas como náuseas, vómitos, diarreas y artralgias. La triada clásica de la NIA se observa con mayor frecuencia en reacciones de hipersensibilidad relacionadas con fármacos, pero actualmente constituyen menos del 10%[2]. Analíticamente cursa con un deterioro agudo de la función renal que puede ser tanto gradual como rápidamente progresivo, con diuresis preservada aunque también están descritas las formas oligonanúricas. La eosinofilia periférica puede ayudar a sospechar en NIA-IF, pero sólo está presente entre 25-35% de las veces y su presencia puede encontrarse en otras patologías. Lo mismo ocurre con la eosinofiluria (>1% total leucocitos urinarios) que aunque su presencia es sugestiva de NIA-IF, estudios recientes ponen en duda su utilidad diagnóstica. El sedimento de orina suele presentar leucocituria estéril acompañado de un grado variable de proteinuria no nefrótica y microhematuria. Sin embargo, un sedimento urinario no activo no excluye el diagnóstico de NIA.
En nuestro caso presentó una clínica inespecífica con un rápido deterioro de la función renal, con un sedimento activo compatible con una NIA-IF. La ausencia de la tríada clásica o la eosinofiluria no excluyó dicha posibilidad diagnóstica, dada su escasa frecuencia.
El diagnóstico definitivo de NIA lo aporta la biopsia renal, como ocurrió en nuestro caso. Se observa edema e infiltrado intersticial compuesto por linfocitos y monocitos que pueden acompañarse de un número variable de eosinófilos, células plasmáticas y neutrófilos. También se puede encontrar tubulitis cuando la membrana basal tubular es invadida por las células inflamatorias. Un predominio de eosinófilos sugiere NIA-IF. En nuestro caso tanto la amoxicilina-clavulánico como el ciprofloxacino podían ser responsables, y no podemos saber con certeza cuál de los dos fue el desencadenante aunque por la cronología clínica es más probable que se deba a la amoxicilina-clavulánico.
En la fase aguda, hasta el 20% requieren de hemodiálisis transitoria de soporte, como nuestra paciente. El tratamiento específico de la NIA-IF se basa en una rápida detección y retirada del fármaco responsable. Nosotros tuvimos suerte, porque hasta en un 30% de los casos no es posible identificar el fármaco por la polifarmacia, más en pacientes ancianos, y es difícil de demostrar la temporalidad entre el inicio de un fármaco y la aparición de NIA-IF. El inicio precoz de tratamiento con corticoides se ha asociado con mayor probabilidad de recuperación de la función renal. Esto se debe a que retrasar el tratamiento favorece la transformación de los infiltrados intersticiales en áreas de fibrosis. Un estudio multicéntrico demostró que no existe diferencia en el pronóstico de la función renal entre iniciar el tratamiento con bolus de esteroides comparado con prednisona oral (0.8 +/- 0.2 mg/kg/día). Tampoco en prolongar dosis máximas más de 3 semanas ni disminuir gradualmente la dosis más allá de 5 semanas. Un posible esquema de tratamiento sería 3 bolus de 125-250 mg/día, 0.5-1 mg/kg durante 1-2 semanas y posteriormente disminuir progresivamente en 4-6 semanas hasta retirar[1]. Sin embargo, si en las dos primeras semanas no mejora la función renal debería suspenderse para evitar efectos secundarios.
En la literatura se describen series de casos donde se postula la utilidad del MMF en NIA recurrentes, por enfermedades como Sjo¿egren y sarcoidosis, tras la retirada de corticoides. También en una serie de casos de NIA corticodependientes que incluían 2 NIA-IF[3] y en una cohorte retrospectiva de 22 pacientes con recurrencia de 2 pacientes con NIA-IF[4] se trataron con MMF como ahorrador de corticoides con buena tolerancia y evolución de la función renal, evitando los posibles efectos secundarios en pacientes ancianos y con fragilidad.
Así dado que se trataba de una paciente anciana y con patologías que podrían agravarse por los corticoides (DM2 y osteoporosis) se decidió tras 3 bolus de corticoides y una tanda corta de prednisona, realizar terapia de mantenimiento con MMF. En la literatura no está descrito el tratamiento con MMF en NIA-IF de primera línea, pero podría ser una opción terapéutica de la que podrían beneficiarse pacientes seleccionados, como nuestro caso.
El pronóstico de las NIA-IF es variable. En el estudio mencionado anteriormente el inicio precoz del tratamiento, menos 15-21 días desde la exposición al fármaco, recuperaron la función renal basal el 75% de los casos mientras que solo el 25% de los que retrasaron el tratamiento recuperaron función renal. A nuestra paciente se le inició el tratamiento a los 14 días consiguiendo una recuperación completa de su función renal.
En resumen, presentamos un caso de NIA-IF que debutó como LRA con clínica inespecífica y sedimento urinario activo. El diagnóstico se basó en la sospecha clínica y fue confirmado por la biopsia renal. Se retiró precozmente el fármaco responsable y se inició tratamiento inicial con corticoides rápidamente y utilizándose MMF como terapia de mantenimiento con buena evolución clínica y de la función renal.
BIBLIOGRAFÍA
[1] G. Fernandez-Juarez et al., “Duration of treatment with corticosteroids and recovery of kidney function in acute interstitial nephritis,” Clinical Journal of the American Society of Nephrology, vol. 13, no. 12, pp. 1851–1858, Dec. 2018, doi: 10.2215/CJN.01390118.
[2] M. Praga, A. Sevillano, P. Aunon, and E. Gonzalez, “Changes in the aetiology, clinical presentation and management of acute interstitial nephritis, an increasingly common cause of acute kidney injury,” Nephrology Dialysis Transplantation, vol. 30, no. 9. Oxford University Press, pp. 1472–1479, Sep. 01, 2015. doi: 10.1093/ndt/gfu326.
[3] D. C. Preddie et al., “Mycophenolate mofetil for the treatment of interstitial nephritis.,” Clin J Am Soc Nephrol, vol. 1, no. 4, pp. 718–722, 2006, doi: 10.2215/CJN.01711105.
[4] F. Caravaca-Fontan et al., “Recurrent acute interstitial nephritis: What lies beneath,” Clin Kidney J, vol. 14, no. 1, pp. 197–204, Jan. 2021, doi: 10.1093/ckj/sfaa018.