Lesión Renal Aguda Postcontraste Yodado
Palabras clave
Contraste iodado
ACTUALIZACIÓN
La siguientes Guías han revisado exhaustivamente el impacto renal de los contrastes yodados
Guías ESUR 2022 sobre Agentes de Contraste. Sociedad Europea de Radiología Urogenital
https://www.esur.org/wp-content/uploads/2023/04/ESUR_Guidelines_10.0_Final_Version en ESPAÑOL_2022.pdf
Esta 10ª versión de las Guías incluye una sección actualizada acerca de la Lesión Renal Aguda Poscontraste
ACR Manual on Contrast Media 2024. American College of Radiology. Documento en Inglés
https://edge.sitecorecloud.io/americancoldf5f-acrorgf92a-productioncb02-3650/media/ACR/Files/Clinical/Contrast-Manual/ACR-Manual-on-Contrast-Media.pdf
Documento de Consenso de la evidencia científica y la experiencia clínica con respecto al uso de medios de contraste.
Se hace hincapié en las sugerencias para la evaluación del paciente, la premedicación, el reconocimiento de reacciones adversas y el tratamiento de emergencia de dichas reacciones."
LOS ASPECTOS MÁS RELEVANTES SE RESUMEN AL FINAL DEL CAPÍTULO
¿Es la creatinina plasmática el mejor método de evaluación de la función renal?
Tenemos que iniciar este informe resaltando la dificultad de determinar la función renal en rutina diaria sin pruebas isotópicas. La creatinina plasmática es un buen parámetro de seguimiento de la evolución del filtrado, pero no lo es para conocer los valores de filtrado glomerular (FG). Cuando la población envejece, especialmente en mujeres, se produce una reducción de la masa muscular que condiciona una distorsión muy importante en esta relación creatinina sérica–FG de suerte que puede perderse la mitad del filtrado sin que la creatinina plasmática ascienda.
Un importante porcentaje de hombres y especialmente de mujeres presentan reducciones en el FG con creatininas séricas normales, y lo que aún es peor, en el rango de creatininas entre 1.3 y 2.5 mg/dl, encontramos porcentajes importantes de insuficiencias renales graves (inferiores a 30 mL/min) [1].
En la actualidad se determina el valor del FG mediante ecuaciones obtenidas de estudios en los que el FG ha sido estudiado con métodos isotópicos como MDRD (realizado en pacientes con función renal < 60 mL/min y por consiguiente solo permite valores inferiores a 60 mL/min) o CKDEPI (que permite valores de FG> 60 mL/min) que es la ecuación internacionalmente recomendada.
Por consiguiente ante la realización de una exploración con contraste yodado es conveniente obtener el FG mediante estas ecuaciones que aparecen en la mayoría de los resultados analíticos o que pueden obtenerse de aplicaciones en internet.
¿Cuál es la definición de la lesión renal aguda postcontraste yodado?
La lesión renal aguda por contraste yodado se define por un aumento en la creatinina sérica de al menos 0.3 mg/dl a las 48 horas o 50 % por encima de la basal durante los siguientes siete días o por reducción de volumen urinario de 0,5 ml/kg/h durante 6 horas [2]. Sin embargo esta definición no comprende el llamado daño subclínico que se caracteriza por daño estructural sin elevación de la creatinina y que veremos más adelante.
¿Con qué frecuencia se produce la lesión renal aguda postcontraste?
Los datos dependen de la población estudiada, de las medidas preventivas, del tipo y dosis de contraste, de la vía de administración intravenosa o intraarterial y de las comorbilidades asociadas como insuficiencia renal o diabetes. Ocurre en menos del 1% de la población general [3] en más del 5% de pacientes con insuficiencia renal y si a ello se asocia diabetes en cifras cercanas al 20 % [4]. La incidencia de lesión renal aguda en pacientes con cáncer es mayor que en la población general. En una serie de pacientes daneses que incluyó 37.267 pacientes con cáncer, el riesgo de presentación de lesión renal aguda en el primer año del diagnóstico fue del 17.5% [5].
Otro estudio observacional de inclusión prospectiva, estudió a más de 3500 pacientes del centro MD Anderson de EEUU, con al menos una determinación de Cr al ingreso y otra durante la estancia hospitalaria. La incidencia global de lesión renal fue del 12% (criterio de elevación de Cr >50%). Se encontraron diversos factores relacionados (antibióticos, quimioterapia, diabetes, hiponatremia, ingreso en UCI y administración repetida de contrastes IV). El análisis multivariante comparado de los factores mostró que el uso de MC era el más relacionado con la aparición de lesión renal aguda (OR 4.55 (CI 3.51-5.89). La incidencia de lesión renal aguda fue mayor al 15% en determinados tumores como esófago, riñón, hígado, páncreas, útero, linfoma, leucemia o mieloma múltiple [6].
¿Cuál es la evolución de la utilización de medios de contraste yodado?
Han aumentado de forma muy importante. Han aparecido nuevas técnicas de diagnóstico y tratamiento como la reposición de válvula aórtica transcatéter, procedimientos neurovasculares y oncología intervencionista que han elevado hasta > 75 millones de dosis de contraste anuales [7].
Uno de las razones que han llevado a un mayor uso seguro de los contrastes es la propia evolución de estos en tres generaciones, desde los contrastes originales, de alta osmolaridad (5-8 veces superior a la del plasma) cuyos efectos adversos a nivel cardiaco, renal, etc…eran importantes a contrastes más seguros como los denominados de baja osmolaridad (cuya osmolaridad en realidad es 2-3 veces la del plasma); y los más recientes basados en dímeros no iónicos (iodixanol), que permiten conseguir formulaciones isoosmolares, es decir con la misma osmolaridad que el plasma en las distintas concentraciones de yodo [8] [9].
¿Tiene consecuencias la aparición de lesión renal aguda postcontraste yodado?
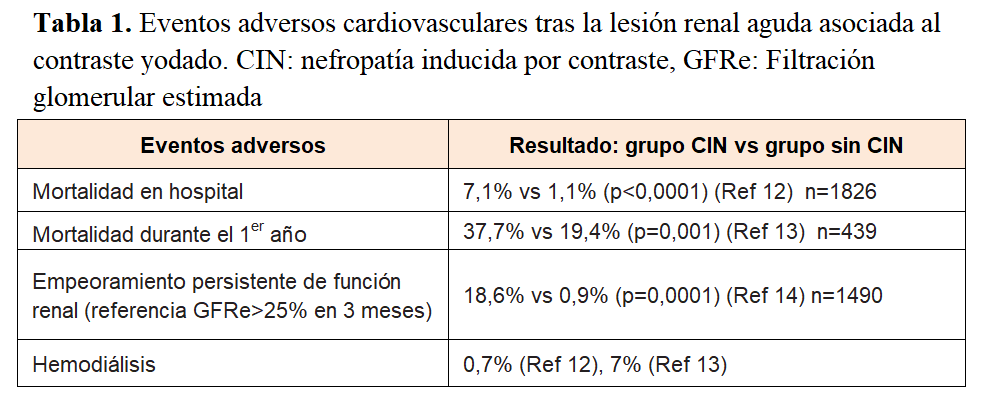
En un estudio unicéntrico de 8,268 pacientes expuestos a medio de contraste durante la intervención percutánea coronaria, la hospitalización fue superior en aquellos que desarrollaron lesión renal aguda comparados con los que no desarrollaron esta complicación (9,6 versus 4,9 días en general y 2,3 versus 0,3 en UCI) [10].
En un análisis de cohortes de 16,248 pacientes que recibieron medios de contraste entre 1987 y 1989, Levy et al identificaron 183 pacientes con elevación de la creatinina sérica >25% y hasta 2mg/dl a los dos días de la administración. Estos pacientes fueron comparados con 174 pacientes con similar edad, creatinina sérica y procedimientos con contraste que no presentaron elevación de la creatinina. En estos la mortalidad intrahospitalaria fue del 7% comparada con el 34% en aquellos con elevación de la creatinina (OR 6.5; p<0.001) que presentaron sepsis, hemorragias e insuficiencia respiratoria. Según los investigadores el fallo renal aumentó el riesgo de complicaciones [11].
En la (Tabla 1) podemos observar como otros estudios más recientes concluyen con similares resultados.
¿En aquellos casos en los que la creatinina sérica vuelve a su valor basal hay datos pronósticos?
Usando datos de un registro prospectivo de un solo centro de pacientes después de un infarto agudo de miocardio [15], encontraron que incluso la lesión renal aguda inducida por contraste transitoria, después de la intervención coronaria percutánea aumenta el riesgo de muerte, diálisis y admisión para eventos cardiovasculares (incluido infarto de miocardio, insuficiencia cardíaca, accidente cerebrovascular y necesidad de revascularización).
La lesión renal aguda se definió como un aumento en el nivel de creatinina sérica de más de 25% o más de 0,5 mg/dl dentro de los 2 días posteriores a la administración de medio de contraste yodado en ausencia de otros insultos renales. La lesión renal aguda transitoria se definió como la recuperación parcial o completa de la función renal (es decir, a menos del 25% o 0,5 mg dl por encima del nivel basal) en 1 mes.
Los datos se basan en todos los pacientes de al menos 20 años sometidos a intervención coronaria percutánea entre mayo de 2005 y julio de 2009, 1.041 fueron elegibles para el análisis. Su edad promedio fue de 62.7 años. En general, se registró lesión renal aguda asociada a contraste en 148 pacientes, de los cuales 80 tuvieron una recuperación parcial o completa de la función renal en 1 mes, mientras que la función renal permaneció sin cambios en los 68 pacientes restantes. Las características basales no difirieron entre los dos subgrupos, Los pacientes con daño renal persistente tuvieron la tasa más alta de muerte, diálisis o ingreso hospitalario debido a eventos cardiovasculares (42.1%), que se redujo a 22.9% en aquellos con lesión renal aguda transitoria. Sin embargo, incluso esta tasa fue significativamente más alta que la observada en pacientes sin lesión renal aguda (16,7%).
¿Hay estudios económicos sobre las consecuencias de la lesión renal aguda postcontraste yodado?
Los costos de atención médica a largo plazo aumentan con el nivel de riesgo de lesión renal aguda. Los pacientes con mayor riesgo probablemente incurran en costos considerables a largo plazo, porque son más propensos que los pacientes sin lesión renal aguda a experimentar eventos adversos, someterse a diálisis prolongada, tener más días de hospitalización y de cuidados intensivos y tasas de mortalidad más altas. Según un modelo desarrollado por Subramanian et al basado en 10 estudios con tasa de lesión renal aguda oscilando entre desde el 2% hasta el 16,5% [16], el mayor factor de costo es la mayor duración de la estancia y luego la diálisis y las intervenciones para manejar eventos cardiacos adversos mayores. Así se constató igualmente en un análisis de impacto presupuestario sobre medios de contrastes realizado con datos españoles, estimándose un coste añadido para el hospital de cada NIC, por aumento de estancia y tratamientos, de unos 4100€ por caso en paciente de riesgo. El uso de contrastes que reducen la incidencia de NIC supondría un ahorro total de costes para el sistema sanitario de hasta el 33%, aun teniendo en cuenta diferentes costes de adquisición de los medios contraste [17]. En el estudio del MD Anderson Cancer Center previamente citado, aquellos pacientes intrahospitalarios que desarrollan lesión renal aguda, tuvieron una significativamente mayor estancia media (incremento 100%), coste (106%) y odds ratio de mortalidad (4.7 veces) respecto a aquellos sin lesión renal aguda [6].
El concepto de reserva funcional renal (RFR)
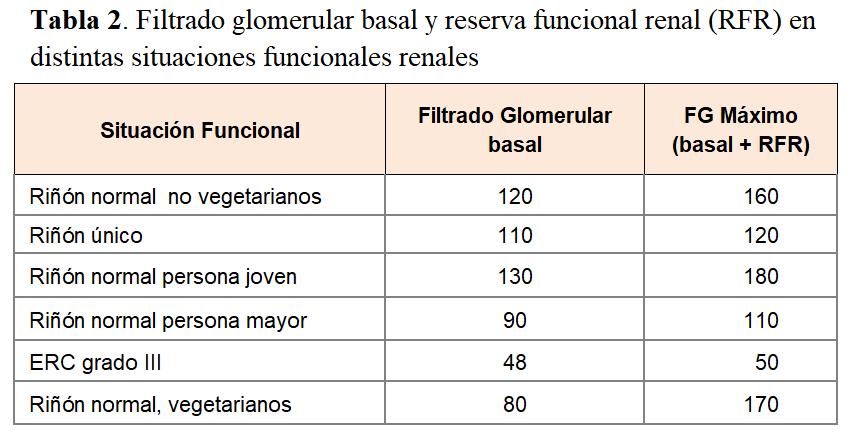
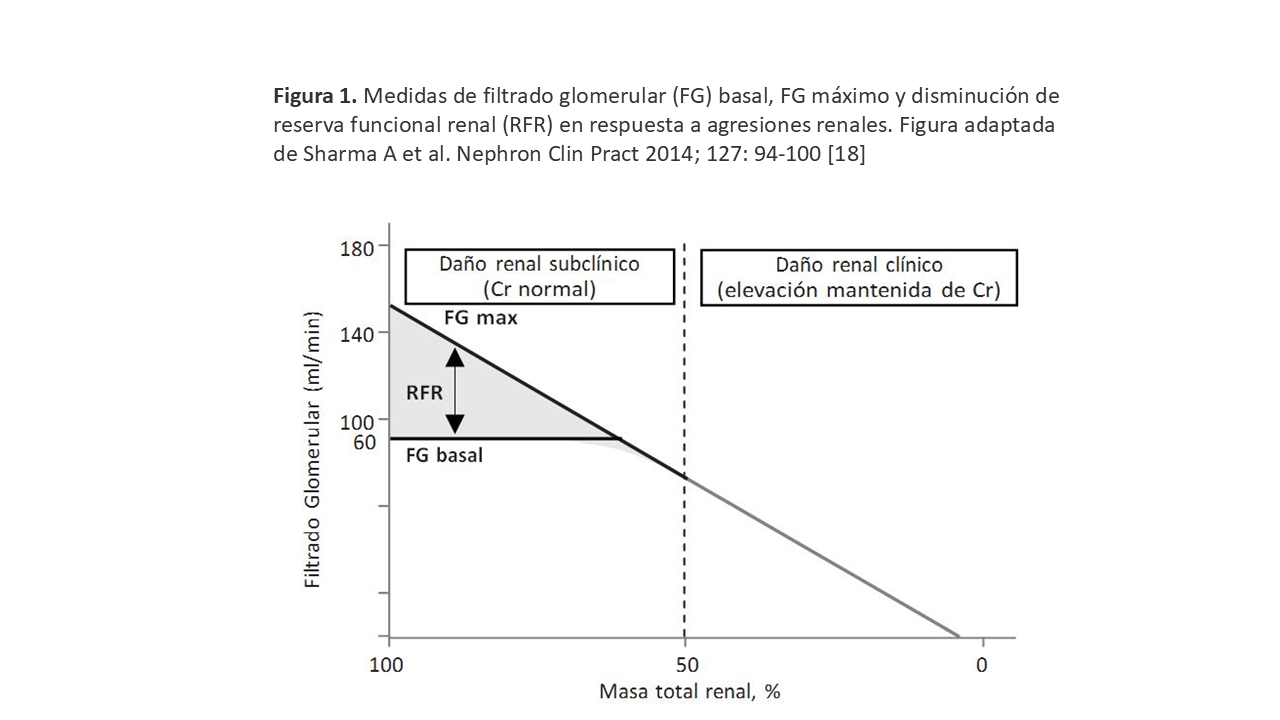
Veamos el ejemplo del corazón. Se denomina reserva cardiaca al trabajo que es capaz de realizar el corazón, más allá del requerido para las circunstancias de la vida normal. El gasto cardiaco aumenta durante el ejercicio de 5-5.5 L/min hasta 20- 25 L/min (incluso más en atletas entrenados que durante un ejercicio extremo pueden llegar a 36 L/min). Pues igualmente la Reserva Funcional Renal. Cada individuo tiene un FG basal que depende de muchos factores incluyendo dieta e ingesta liquida. La RFR representa la capacidad del riñón para aumentar el FG en respuesta a ciertos estímulos fisiológicos o patológicos (por ejemplo ante una ingesta importante de proteínas o ante una perfusión de aminoácidos, o en la primera fase de la diabetes). La diferencia entre el máximo FG y el filtrado basal es lo que representa la RFR que desciende de una forma linear con el descenso del FG.
En la (Tabla 2) tomada de Sharma et al [18] podemos ver como dependiendo de las diferentes circunstancias se modifica la reserva funcional renal.
¿Puede haber daño renal sin elevación de la creatinina sérica?
La medida de la creatinina sérica no identifica la lesión renal aguda con preservación de la función renal. Cuando hay un daño renal, la pérdida del FG se compensa por nefronas intactas y por el uso de la reserva funcional renal de manera que no se eleva la creatinina. Sin embargo, la reparación completa y la vuelta a la condición basal no está garantizada. El daño renal puede destruir un número variable de nefronas (Figura 1) y en una persona con una RFR intacta, pueden perderse hasta un 50% de las nefronas sin ningún impacto en el FG basal o en la creatinina sérica. Cuando hay una agresión renal repetida (descompensación de insuficiencia cardiaca, isquemia/reperfusión, uso de contraste yodado o fármacos nefrotóxicos) se pierde la RFR resultando en progresión de la enfermedad renal crónica. Por tanto, en ausencia de elevación de la creatinina sérica no puede descartarse lesión renal aguda y la posibilidad de daño renal subclínico no puede ser descartado tras varias agresiones renales [18].
¿Cómo podemos pues diagnosticar daño renal sin elevación de la creatinina? Biomarcadores de lesión renal aguda
La elevación de la creatinina sérica sería un marcador de daño funcional. Al igual que la troponina cardiaca es válida en el infarto agudo de miocardio sin elevación del ST son precisos marcadores de daño renal estructural en casos de lesión renal aguda sin elevación de la creatinina sérica.
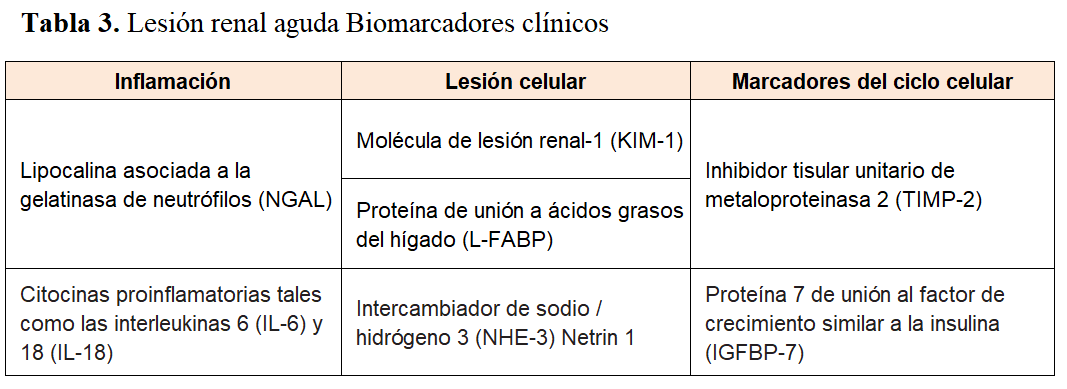
Básicamente, se han identificado tres tipos de biomarcadores en el área del la lesión renal aguda (Tabla 3). El primer grupo son los biomarcadores inflamatorios, que incluyen la lipocalina asociada a la gelatinasa de neutrófilos (NGAL) y las citoquinas proinflamatorias, como la interleucina-6 (IL-6) y la IL-18. El segundo grupo incluye biomarcadores de lesión celular como la molécula 1 de lesión renal (KIM-1), la proteína hepática de unión a ácidos grasos (L-FABP), el intercambiador de sodio / hidrógeno 3 (NHE-3) y la netrina 1. El tercer grupo, identificado recientemente, consiste en marcadores del ciclo celular, como el inhibidor del tejido urinario de la metaloproteinasa 2 (TIMP-2) y la proteína 7 de unión al factor de crecimiento similar a la insulina (IGFBP-7). Idealmente, estos marcadores podrían facilitar, más temprano y / o más exactamente que la creatinina sérica y el flujo urinario, el diagnóstico y diagnóstico diferencial de la lesión renal aguda y podrían predecir el pronóstico a corto y largo plazo [19] [20] [21] [22]. Muchas revisiones exhaustivas recientes han resumido las características, ventajas y limitaciones de los primeros dos grupos de biomarcadores [22] [23] [24].
Por consiguiente, la creatinina sérica es un pobre marcador del FG y necesitamos estas y otras nuevas“troponinas renales” como válidos marcadores para descubrir episodios silentes de AKI o identificar tempranamente los pacientes de alto riesgo.
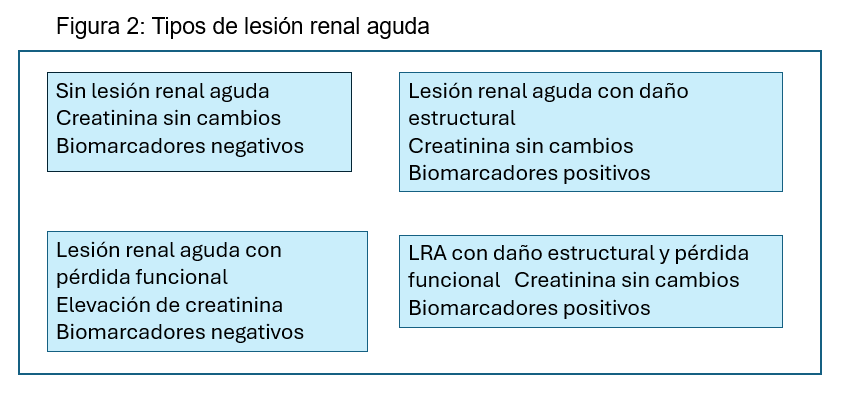
Lesión renal aguda funcional, estructural o mixta
Considerando los aspectos de lesión renal aguda funcional (elevación de la creatinina sérica) o estructural (elevación de los biomarcadores) o mixta (ambos) podremos clasificar la lesión renal aguda en cuatro subgrupos de pacientes incluidos aquellos de lesión renal aguda subclínica (Figura 2). Un diagnóstico más precoz basado en los biomarcadores podría facilitar como hemos comentado aspectos preventivos y de clasificación diagnóstica [25].
Contrastes yodados y lesión renal aguda: importancia de la osmolaridad
Todos los medios de contraste se eliminan únicamente por FG. La excreción extrarrenal constituye menos del 1% de la función renal normal. Se ha demostrado que aproximadamente el 100% de los medios de contraste se excretan dentro de las primeras 24 horas después de la administración en pacientes con función renal suficiente. Por el contrario, en pacientes con función renal reducida, la semivida de eliminación puede aumentar hasta 40 horas o más.
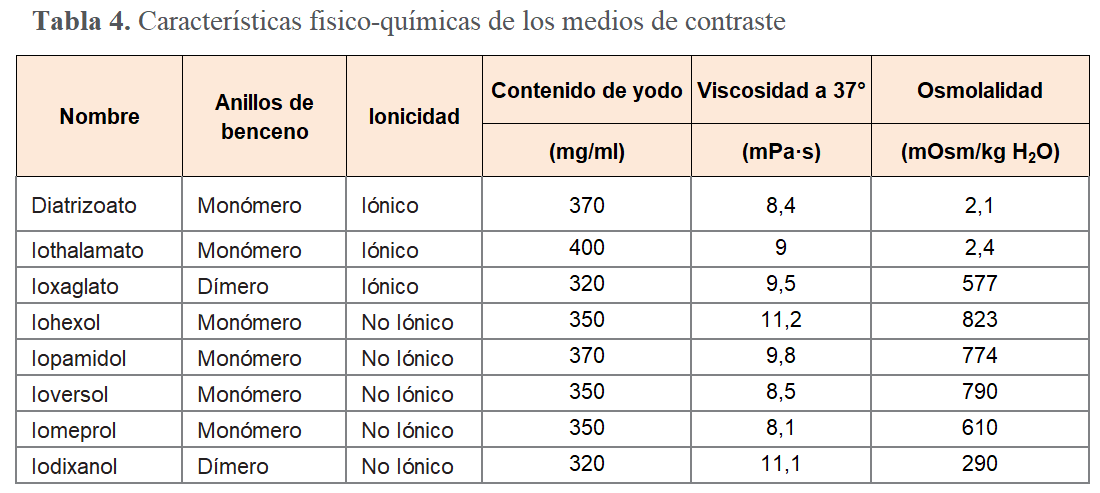
Como podemos ver en la (Tabla 4) cada CM tiene sus propias características farmacológicas [26]. La característica más importante que afecta el riesgo de lesión renal aguda postcontraste parece ser la osmolalidad, con el riesgo de ser mayor en pacientes que reciben agentes con osmolalidad aumentada en relación con aquel isoosmolar que tiene la misma osmolaridad que la sangre [25].
Por ejemplo, con la administración intraarterial, se realizó un metaanálisis que incluyó 15 ensayos clínicos que cumplieron los requisitos de calidad metodológica, prospectivos doble ciego y aleatorizados. El riesgo relativo (RR) de lesión renal aguda (aumento de SCr =0,5 mg/dL) después de iodixanol isoosmolar versus un medio de contraste con osmolalidad aumentada fue de 0,46 (intervalo de confianza del 95% ( IC) 0.27-0.79; P = 0.004) lo que indicaría que al menos la mitad de los casos de lesión renal aguda son evitables en base a la osmolaridad del medio de contraste elegido [27]. Estas diferencias parecen ser importantes para la administración intraarterial mientras que con la intravenosa los estudios aleatorizados y metaanálisis son menos concluyentes estadísticamente, debido al menor número de sujetos incluidos y a que la incidencia se limitó en muchos casos por la inclusión de pacientes sin factores de riesgo. En ese sentido, algunos de los estudios con administración intravenosa centrados en población de riesgo, como aquellos con insuficiencia renal preexistente o en pacientes sin insuficiencia renal con cáncer como factor de riesgo han mostrado también reducción del riesgo relativo de lesión renal aguda [28] [29].
No se cree que otras características farmacológicas de los medios de contraste, como la viscosidad, que se relacionan principalmente con el tamaño en lugar del número de partículas, tengan un impacto clínico en el riesgo de lesión renal aguda. Todos los CM son más viscosos que el plasma, y a pesar de que los agentes con osmolalidad aumentada tienen una viscosidad más baja pueden provocar lesión renal aguda.
¿Es importante el volumen de contraste administrado en el riesgo de lesión renal aguda?
El riesgo de lesión renal aguda parece ser proporcional al volumen de medio de contraste, particularmente después de la angiografía coronaria. Varios estudios en ese campo han demostrado que cada 100 ml de contraste aumentan significativamente el riesgo de lesión renal aguda [30] [31]. Se estima que el riesgo de lesión renal aguda aumenta significativamente en pacientes en quienes el volumen de contraste excedió 3 veces el aclaramiento de creatinina [32]. Así pues, tanto para imagen vascular como para imagen de parénquima parece lógico utilizar la mínima cantidad de volumen de contraste y concentración de yodo que sea suficiente para lograr una imagen eficaz.
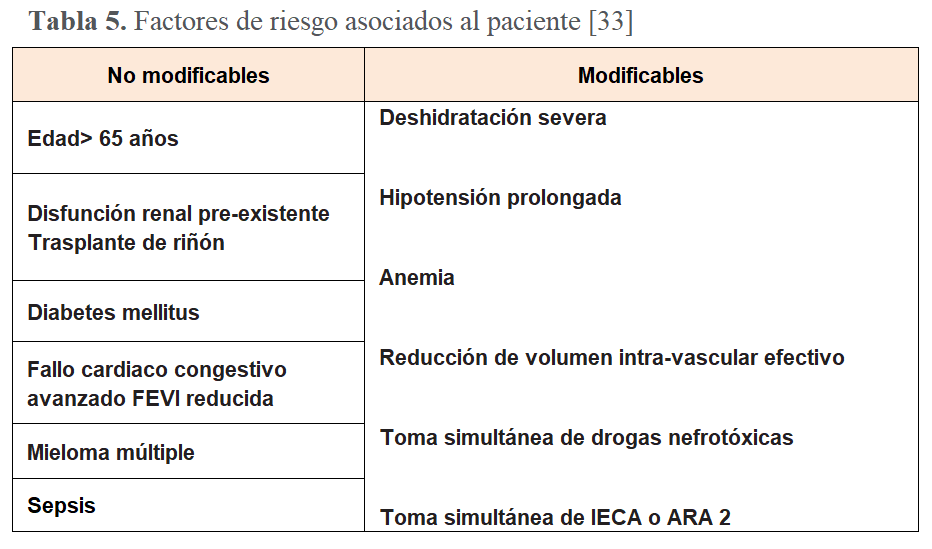
¿Cuáles son los factores de riesgo del paciente para el desarrollo de lesión renal aguda postcontraste yodado?
Son fundamentalmente edad avanzada, enfermedad renal previa, diabetes, tratamiento con fármacos y quimioterapia nefrotóxica, o situaciones y fármacos que alteran la hemodinámica renal [33] (Tabla 5).
• El Riesgo Relativo de desarrollar lesión renal aguda (aumento de SCr de 0.5 mg/dL o 25% a 48-72 h) en pacientes mayores de 70 años sometidos a procedimientos con contraste vs. procedimientos sin contraste es de 1.35 (P<0,0001) [34]. Por otra parte los pacientes mayores de 65 años que desarrollan lesión renal aguda dentro de los 3 días posteriores a la angiografía también tienen riesgo de disfunción renal al año, con una OR de 1.88 (IC 95% 1.11-3.21, P = 0.02) vs pacientes más jóvenes [35].
• La enfermedad renal preexistente aumenta el riesgo de lesión renal aguda inducida por contraste después de con una OR para de 2,89, (P <0.0001) entre pacientes con ERC subyacente en comparación con aquellos sin ERC [36].
• La diabetes también parece ampliar el riesgo de lesión renal aguda en pacientes con ERC: la diabetes afecta al 52% de los pacientes después de intervención coronaria percutánea que desarrollan lesión renal aguda en comparación con 36% con ERC pero sin lesión renal aguda (P <0,0001) y 26% sin ERC ni lesión renal aguda postcontraste (P <0,0001) [37].
• Los pacientes que requieren quimioterapia nefrotóxica tienen un riesgo significativamente mayor de lesión renal aguda después de las imágenes con contraste, especialmente si hay un corto período de tiempo entre la administración de quimioterapia y el uso de contraste. Incluso antes de la quimioterapia: la tasa de lesión renal aguda aumentó significativamente en pacientes expuestos a contraste de baja osmolaridad dentro de 1 semana antes del tratamiento con cisplatino (46%) frente a aquellos no expuestos a contraste (19%; P = 0.01) o expuestos > 1 semana antes del cisplatino (25%; P = 0.02) [38].
• Otros fármacos que pueden tener efectos nefrotóxicos incluyen aminoglucósidos, ciclosporina A, anfotericina, dipiridamol y fármacos antiinflamatorios no esteroideos. Aunque la inhibición del SRA a largo plazo es beneficiosa, la inhibición intensa (con IECAS y ARA2) y la inhibición directa de renina parecen tener una toxicidad renal excesiva después de administración intraarterial. Por lo tanto, parece razonable interrumpir la inhibición del SRA antes de la angiografía coronaria en pacientes con un riesgo moderado o mayor de lesión renal aguda [39].
• Cualquier situación que pueda reducir el volumen intravascular efectivo (p.e deshidratación severa, insuficiencia cardiaca congestiva o la cirrosis hepática) constituye un riesgo per sé para lesión renal aguda que además incrementa el riesgo de toxicidad con la administración de contraste [33]
¿Tiene importancia para el desarrollo de lesión renal aguda postcontraste la vía de administración (intraarterial o intravenosa)?
Es un aspecto conflictivo aunque en general admitamos que hay menor riesgo con la administración intravenosa. Claro que ello pudiera ser porque aquellos que reciben medio de contraste intraarterial tienen más comorbilidades o que se administran dosis mayores. No obstante la administración intraarterial produce una mayor concentración de contraste en la vasculatura renal. En cualquier caso no podemos menospreciar la importancia de la vía intravenosa en pacientes que requieren exploraciones repetidas o tienen factores de riesgo adicionales [40].
En oncología puede ocurrir que se repitan las exploraciones con contraste yodado ¿puede condicionar un mayor riesgo de daño renal?
La dosis acumulativa de contraste yodado con procedimientos repetidos aumenta el riesgo de lesión renal y reduce la supervivencia. En 1274 pacientes que requirieron imágenes radiográficas repetidas para enfermedad vascular oclusiva o aneurisma, la exposición acumulada intravenosa a CM fue un predictor independiente para el desarrollo de ERC en estadio 4 ó 5 y aumento de la mortalidad [41]. En pacientes con cáncer que requirieron TAC con contraste en una situación de emergencia, la odds ratio (OR) de lesión renal aguda fue de 4.09 (IC 95% 1.34-12.56) en pacientes que requirieron examen en días consecutivos vs. aquellos a los que se realizó un solo TAC [42]. En las guías KDIGO, se recomienda retrasar la exposición repetida durante 48 h en pacientes sin factores de riesgo para lesión renal aguda postcontraste y durante 72 h en aquellos con diabetes mellitus o ERC preexistente. Si se desarrolla una disfunción renal aguda después de la administración de contraste, la exposición repetida preferiblemente debe retrasarse hasta que el nivel de creatinina sérica haya regresado al valor basal [2].
¿Cuáles son los mecanismos por los que un medio de contraste puede producir daño renal?
En condiciones fisiológicas de reposo, el 25% del gasto cardíaco se dirige a los riñones. La mayoría del flujo sanguíneo se canaliza hacia la corteza para optimizar la filtración glomerular y la reabsorción de agua y sales. El flujo sanguíneo medular renal es, por el contrario, bajo. Esto hace que la médula renal sea propensa a lesión isquémica, daño celular y, en consecuencia, lesión renal aguda) La fisiopatología exacta de CIN no se conoce bien.
Aunque el mecanismo de la lesión renal aguda postcontraste no se entiende completamente, los datos de modelos animales indican que una variedad de factores median el impacto de la hiperosmolalidad en la función renal, que incluyen [43] :
• Efecto diurético que estimula un mecanismo de retroalimentación tubuloglomerular, que conduce a una menor tasa de filtración glomerular y un empeoramiento de la función renal.
• Reducción del flujo sanguíneo renal debido a alteraciones de la vasoconstricción mediadas por adenosina, endotelina y óxido nítrico.
• Morfología alterada de los eritrocitos que conduce a una disminución de la perfusión capilar.
Ya hemos comentado que o se cree que otras características farmacológicas de los contrastes yodados, como la viscosidad, que se relacionan principalmente con el tamaño en lugar del número de partículas, tengan un impacto clínico en el riesgo de lesión renal aguda. Todos los contrastes son más viscosos que el plasma, y los agentes con osmolalidad aumentada que tienen una viscosidad más baja pueden provocar lesión renal aguda.
¿Debemos rechazar el estudio con contraste yodado a un paciente de alto riesgo por la posibilidad de daño renal?
Obviamente no, aunque lo primero que hay que evaluar es si la indicación de la exploración o intervención es oportuna y necesaria para el paciente, pero si se aplican todas las medidas de prevención se puede limitar el riesgo razonablemente [44] [45]. Es muy aconsejable la participación de nefrólogos en pacientes con riesgo y la existencia previa de un protocolo consensuado que evalué los pacientes con riesgo para aplicar las medidas preventivas.
¿Cuáles son las medidas de prevención aconsejables para evitar el daño renal postcontraste yodado?
En la (Tabla 6) podemos ver las recomendaciones universalmente aceptadas según el FG y la vía de administración. Lo predominante es la correcta hidratación y la reducción de eventuales nefrotóxicos así como la recomendación de contraste isosmolar en determinadas circunstancias. El lector echará en falta tres ausencias: N-acetilcisteína, suero bicarbonatado y estatinas.
Un muy reciente estudio (Preserve) ha demostrado que entre los pacientes con alto riesgo de complicaciones renales sometidos a angiografía, no hubo beneficio con bicarbonato sódico intravenoso sobre cloruro sódico intravenoso o de acetilcisteína oral sobre placebo para la prevención de muerte, necesidad de diálisis o disminución persistente de la función renal a los 90 días o para la prevención de la lesión renal aguda postcontraste [46]. Existen muchos otros estudios previos con las mismas conclusiones que se resumen en que ni el tipo de líquidos administrados durante el procedimiento ni el uso de terapia antioxidante parecen afectar significativamente los resultados, especialmente en alteración de la función renal en esta población.
Respecto a la administración de estatinas en la prevención del daño renal postcontraste hay abundante literatura. Se han sugerido varios mecanismos que proporcionan alguna justificación para el uso de estatinas en pacientes que requieren una angiografía coronaria, incluida la inhibición de la captación de medio de contraste en las células tubulares renales, la atenuación de la disfunción endotelial y el estrés oxidativo, el efecto antiinflamatorio, la antiproliferación de las células mesangiales y la protección de los podocitos [47].
Recientemente en un metaanálisis Singh et al [48] que incluyó nueve ensayos controlados aleatorios con 5.143 pacientes, 2.559 de los cuales recibieron estatinas y 2.584 placebo, todos sometidos a inyección de contraste. Concluyeron que el pretratamiento con estatinas indujo una reducción significativa del riesgo de lesión renal aguda postcontraste, tanto en pacientes con función renal normal como en pacientes con función renal alterada Patti et al [49] demostraron que una dosis alta a corto plazo de atorvastatina (80 mg, 12 horas antes de la intervención seguida de otra dosis de 40 mg antes del procedimiento) disminuía la incidencia de lesión renal aguda postcontraste en pacientes sometidos a intervenciones coronarias percutáneas.
Sin embargo, los datos sobre el beneficio de las estatinas en pacientes de riesgo son contradictorios. Más recientemente, un ensayo clínico aleatorizado en el contexto de cirugía cardiaca no encontró ningún efecto preventivo de la atorvastatina perioperatoria a altas dosis en la ocurrencia de lesión renal aguda [50]. En otro ensayo Clínico reciente se ha visto que la rosuvastatina administrada en el perioperatorio cardíaco podría al contrario incrementar el riesgo de lesión renal aguda [51]. Por último, el uso de rosuvastatina en un ensayo clínico en pacientes críticos se asoció con una mayor evidencia de insuficiencia renal y daño hepático, motivando en parte la suspensión de dicho ensayo clínico [52].
Guías ESUR 2022 sobre Agentes de Contraste. Sociedad Europea de Radiología Urogenital
Definiciones
Medición de la Función Renal
Factores de Riesgo para LRA-PC
Actitud en el Momento de la Solicitar la exploración
Exploración programada
Exploración urgente
Actitud antes de la exploración
Exploración programada o urgente
Actitud en el momento de la exploración
Actitud tras la exploración
Pacientes con Mieloma Múltiple
Aportaciones del ACR Manual on Contrast Media 2024. American College of Radiology
1. Definiciones Clave
2. Patogenia y Factores de Riesgo
3. Diagnóstico: Criterios KDIGO
4. Vías de Administración de Contraste y Riesgo de CI-AKI
5. Prevención de CI-AKI
6. Poblaciones Especiales
7. Morbilidad y Mortalidad
8. Medios de Contraste y Selección
9. Recomendaciones Finales
Uso de Metformina en el Contexto de Contrastes Radiológicos [55] [56]
La metformina es un fármaco hipoglucemiante de uso habitual en pacientes con diabetes mellitus tipo 2. Su principal mecanismo de acción consiste en reducir la producción hepática de glucosa y mejorar la captación periférica de glucosa. Aunque su perfil de seguridad es generalmente favorable, la complicación más grave asociada a su uso es la acidosis láctica, un evento extremadamente raro pero con una elevada tasa de mortalidad, que puede superar el 50%. Esta complicación suele presentarse en pacientes con comorbilidades no reconocidas, especialmente cardiovasculares o renales. La metformina se elimina del organismo sin cambios a través de la excreción renal, por lo que la presencia de insuficiencia renal incrementa significativamente el riesgo de acidosis láctica.
En relación con la administración de contrastes, especialmente los contrastes iodados, el manejo de la metformina debe seguir ciertas pautas.
• Si eGFR ≥30 mL/min/1.73 m² y sin insuficiencia renal aguda, no es necesario suspender la metformina ni reevaluar la función renal tras el contraste.
• Si eGFR <30 mL/min/1.73 m² e insuficiencia renal aguda o procedimientos con riesgo de embolias renales, suspender metformina antes o al momento del procedimiento y no reiniciar hasta 48 h después, confirmando función renal normal
Uso de Gadolinio en el Contexto de Contrastes Radiológicos
En cuanto a los agentes de contraste basados en gadolinio, su uso ha sido objeto de especial atención en los últimos años debido a ciertos efectos adversos, aunque la incidencia de reacciones agudas es baja. Estas reacciones, que incluyen síntomas como náuseas, cefalea y sensación de frío en el sitio de la inyección, son generalmente leves y se presentan en un rango de frecuencia entre el 0.07% y el 2.4%. Las reacciones alérgicas graves son extremadamente infrecuentes, con una incidencia que varía entre el 0.001% y el 0.01%.
Un aspecto que ha generado preocupación es la retención cerebral de gadolinio. Se ha observado que, incluso en pacientes sin enfermedad renal o hepática, pueden producirse depósitos de gadolinio en áreas específicas del cerebro. Hasta la fecha, no se han demostrado efectos clínicos adversos asociados a esta retención, pero se recomienda actuar con prudencia, especialmente en pacientes pediátricos y en aquellos que requieran estudios radiológicos repetidos.
Otra complicación asociada a los contrastes con gadolinio es la Fibrosis Sistémica Nefrogénica (NSF). La incidencia de NSF ha disminuido de forma notable desde que se implementaron restricciones en el uso de los agentes de contraste basados en el gadolinio (GBCAs) del grupo I, que son los más relacionados con esta complicación.
Recomendaciones frente a la Fibrosis Sistemica Nefrogénica
• Riesgo en pacientes con eGFR <30 mL/min/1.73 m² o con insuficiencia renal aguda.
• La incidencia de NSF ha disminuido de forma notable desde que se implementaron restricciones en el uso de los agentes de contraste basados en el gadolinio (GBCAs) del grupo I, que son los más relacionados con esta complicación.
Por tanto, se recomienda valorar siempre el balance riesgo-beneficio antes de la administración de gadolinio, especialmente en poblaciones de mayor riesgo como los pacientes pediátricos y aquellos con función renal comprometida. Además, se debe registrar en la historia clínica la dosis y el tipo de agente de contraste utilizado en cada procedimiento.