Fragilidad y Sarcopenia en la Enfermedad Renal Crónica
1.- INTRODUCCIÓN
El envejecimiento es un proceso biológico que comporta una serie de cambios estructurales y funcionales, que aparecen con el paso del tiempo y no son consecuencia de enfermedades ni accidentes. Estos cambios no son lineales ni uniformes, y su vinculación con la edad cronológica de la persona es más bien relativa [1]. Son cambios complejos y se asocian a un acumulo de gran variedad de daños moleculares y celulares que con el paso de los años reducen gradualmente las reservas fisiológicas del individuo, aumentando el riesgo de enfermedades y disminuyendo su capacidad [2]. La heterogenicidad del proceso de envejecimiento ha llevado a acuñar el termino de envejecimiento saludable, definido por la OMS como como el proceso de fomentar y mantener la capacidad funcional que permite el bienestar en la vejez, entendiendo por capacidad aquellos atributos relacionados con la salud que permiten a una persona ser y hacer lo que es importante para ella. El envejecimiento fisiológico es el producto de la interacción de factores genéticos y factores ambientales que conduce a un declive progresivo de las funciones físicas, cognitivas y metabólicas. Ello puede conducir a un envejecimiento exitoso, cuya definición y detección cobra cada vez mayor relevancia debido al aumento significativo de la esperanza de vida de la población. Su definición se basa en la existencia de una baja probabilidad de enfermedad o de discapacidad, elevada capacidad física y cognitiva y un compromiso activo con la vida [3]. La evolución del envejecimiento normal hacia un envejecimiento no exitoso conllevará un aumento en el riesgo de discapacidad, dependencia y fallecimiento. Detectar de forma precoz aquellas personas mayores que están en mayor riesgo de presentar episodios adversos graves como la pérdida funcional y de la autonomía, hospitalización, institucionalización o muerte es de suma importancia [4]. Es en este ámbito en donde el diagnostico de fragilidad como antesala de la discapacidad y la dependencia cobra una especial relevancia. Su importancia no solo radica en constituir un importante factor pronóstico, sino en que se caracteriza por ser una situación tratable y reversible [5][6].
2.- CONCEPTO DE FRAGILIDAD
Desde hace varias décadas, se ha ido gestando el concepto de fragilidad como una situación que precede a la discapacidad y qu e, al contrario que ella, sería reversible, de ahí la especial importancia en su diagnóstico. Es un síndrome clínico que representa un continuo entre el adul to mayor saludable hasta aquel extremadamente vulnerable en alto riesgo de morir y con bajas posibilidades de recuperación. Con el paso de los años se ha ido dando forma a este concepto [7][8][9][10]. La discapacidad es la dificultad que presenta una persona a la hora de llevar a cabo actividades esenciales que le impiden vi vir de forma independiente, incluyendo actividades básicas de la vida diaria y tareas de autocuidado, vivir en su domicilio de forma independiente y realizar activi dades importantes para la calidad de vida [11]. A la discapacidad se puede llegar de forma abrupta por un evento clínico mayor, la llamada discapacidad catastrófica, o de forma lenta y progresiva por pérdida de sistemas reguladores de la homeostasis, conduciendo a la denominada discapacidad no catastrófica, que es la más frecuente en el ancian o. Esta evolución progresiva que conduce a la discapacidad no catastrófica supone el paso por diferentes etapas desde la robustez hasta la situación de discapacidad. Una d e ellas, en la que no hay discapacidad o es mínima, pero donde el riesgo de llegar a la discapacidad es máximo, constituirá la situación de fragilidad. Existe una relación clara y conocida entre fragilidad, discapacidad y comorbilidad, pero es importante resaltar las diferencias conceptuales entre ellas, siendo la fragilidad el principal precurs or independiente de mortalidad y discapacidad en los ancianos, por encima de la cronicidad y la multimorbilidad [12]. La definición de fragilidad más aceptada en la actualidad es la propuesta por Linda Fried en 2001, tras el análisis de los pa cientes mayores de 65 años del Cardiovascular Health Study, que la define como un síndrome biológico asociado a la edad, caracterizado por la disminución de las reservas biol ógicas y la resistencia a los factores de estrés como resultado del declive acumulado en múltiples sistemas fisiológicos, que causa vulnerabilidad e incrementa el riesgo de sufrir eventos adversos tales como discapacidad, caídas, aumento de morbilidad y mortalidad [13] [14]. Además de la definición de fragilidad, Fried propone un fenotipo clínico basado en la evaluación de varios factores fácilmente identificables que permitían una gran reproductibilidad en el diagnóstico. Basado en ello, encuentran en la p oblación analizada una prevalencia de fragilidad de un 7-10% y de población prefrágil cercana al 45%. Su frecuencia se incrementa c on la edad, superando el 25 % en mayores de 85 años. Tanto la fragilidad como la prefragilidad son predictores de discapacidad, aparición de caídas, hospitalización y muerte [14]. Esta definición de fragilidad ha ido evolucionado con el tiempo, diferenciándose claramente de la discapacidad, pero resaltan do el incremento que supone sobre la vulnerabilidad del individuo [15]. También se propone una definición basada en el concepto de resiliencia. La salud se concibe como la resiliencia o la capac idad de soportar, mantener o restaurar la propia integridad, equilibrio y sensación de bienestar. La fragilidad surgiría a part ir de la pérdida de resiliencia o debilitación de la salud [16]. Se entiende por sarcopenia aquella situación que se acompaña de una pérdida de masa y fuerza muscular que aparece con el enve jecimiento y que incrementa el riesgo de producir efectos adversos, tales como discapacidad física, empeoramiento en la calidad de vida y muerte [17][18]. El balance de la masa y actividad muscular en el organismo está controlado por mecanismos neurológicos, endocrinos e inmunológicos y depende en gran medida de la activ idad muscular y la correcta nutrición. Cualquier alteración en algunas de las variables conducirá a una pérdida de masa muscular. El fenotipo de fragilidad se acompaña de pér dida de masa muscular y sarcopenia. Ello probablemente esté en relación con la pre sencia en este fenotipo de resistencia a la insulina y disregulación de la respuesta inflamatoria, con liberación de citoquin as que activan la rotura muscular como interleukina 6 y TNF alfa [19]. Las personas tienden a perder masa muscular a partir de los 50 años, a un ritmo de 1-2% por año, lo que contribuye a un descenso progresivo de la capacidad muscular. Varios mecanismos se han involucrado en la aparición y progresi ón de la sarcopenia, como malnutrición, alteraciones hormonales, déficit de vitamina D, proteólisis, alteraciones neuromusculares,… [19] [20].
3.- DIAGNÓSTICO DE FRAGILIDAD
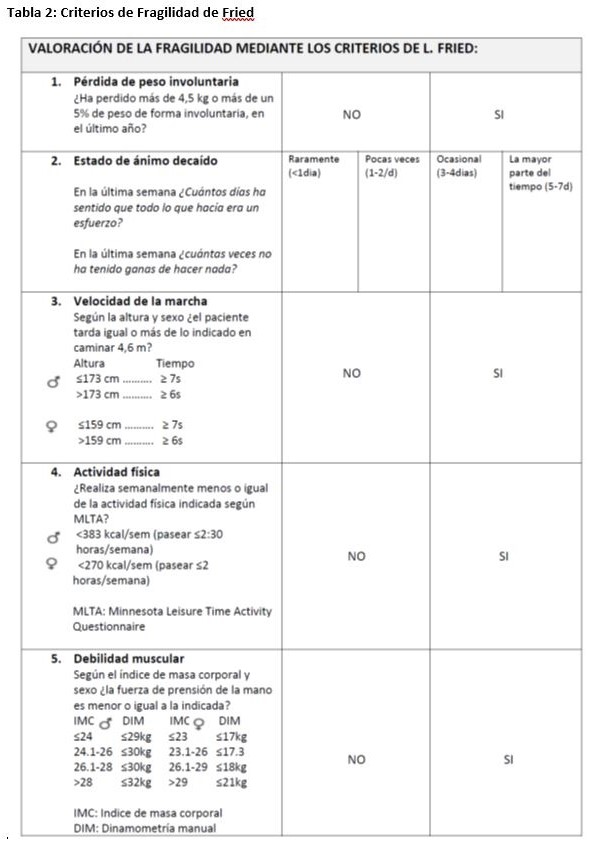
Al concepto de fragilidad nos podemos acercar desde dos puntos de vista distintos que surgen de grandes estudios poblacionales. El propuesto por Rockwood a partir de los datos del Canadian Study of Health and Aging [21] y el propuesto por Fried a partir del Cardiovascular Health Study [14]. Una primera forma de ver la fragilidad es el modelo descrito por Rockwood y Mitnitski. Se concibe la fragilidad como un acúmulo de déficits. Así como los procesos fisiológicos y biológicos van sumando déficits con el envejecimiento, con la edad, las personas sufren enfermedades y situaciones que van a condicionar su relación con el medio. El acúmulo de más o menos déficits condicionará la respuesta a estresores externos y el tiempo hasta la muerte [22]. Para el diagnóstico de este síndrome de fragilidad, se identifican una serie de ítems dentro de un espectro muy amplio que incluye diferentes dimensiones del individuo como situación cognitiva, emocional, nutricional, funcional, movilidad, sueño, presencia de enfermedades, … [23]. Los autores encuentran una relación entre la fragilidad definida de esta forma y la posibilidad de institucionalización [23] y de mortalidad [24]. Este y otros modelos parecidos generan un índice de fragilidad que se basa en el acumulo de déficits. Este índice se construye en base a un cociente entre los déficits acumulados sobre el total de déficits posibles [25]. Cuanto más déficit se acumulan más vulnerable es una persona, pudiéndose afirmar que existe una relación exponencial entre la posibilidad de morir y el número de déficits acumulados y la velocidad a la que se acumulan [26] [27]. Por consenso, se acepta que se empieza a considerar como frágil a una persona cuando el índice está por encima de 0.2 y se acepta como puntuación submáxima la de 0.7, por encima de la cual no se puede hacer frente a más déficit y morimos [28] [29]. Basados en este concepto de índice de fragilidad, Rockwood et al. definen un índice inicialmente con 92 items [23], que en versiones posteriores reducen a 70 [23] y finalmente a 40 [30]. Posteriormente se han descrito otros índices de fragilidad [31][27][32]. La creación de un índice de fragilidad aporta la ventaja de crear una variable continua, no dicotómica (fragilidad sí o no) con un rango que va desde no fragilidad hasta fragilidad avanzada, permitiendo cuantificar el grado de fragilidad. Frente a esto, se requiere una valoración compleja del paciente dentro de una valoración geriátrica integral [29]. Además, esta forma de concebir la fragilidad tiene otros inconvenientes, fundamentalmente el que la inclusión de déficits funcionales dentro del concepto de fragilidad hace que dentro de este síndrome así definido se incluyan situaciones de discapacidad, por lo que se aleja del concepto de fragilidad como síndrome precursor de discapacidad sobre el cual queremos actuar para prevenir la aparición de esta [22]. Basado en el índice de fragilidad, Rockwood propone una valoración más sencilla con la Escala Clínica de Fragilidad [23]. En ella se clasifican a los pacientes en siete grados en función de una simple valoración, de forma que el grado 1 sería el anciano robusto y activo y el grado 7 sería el anciano severamente frágil, que algunos autores han incrementado posteriormente hasta 9 grados (Tabla 1). La segunda forma de definir la fragilidad es la propuesta por Waltston y Fried [13][14], cuyas bases son la presencia de sarcopenia y disbalance energético. Con ello definen un fenotipo de fragilidad que constituiría un síndrome clínico caracterizado por la pérdida de masa corporal, debilidad y disminución de fuerza y resistencia al ejercicio. Estos autores proponen cinco dimensiones sobre las que construir un fenotipo de fragilidad: debilidad, baja resistencia al esfuerzo, lentitud, baja actividad física y pérdida de peso. Estas cinco dimensiones se valorarían mediante el análisis de las siguientes circunstancias: • Fuerza de presión palmar
• Presencia de fatiga
• Disminución de la actividad física
• Velocidad de la marcha
• Pérdida de peso no intencionada
Lo materializan en unos criterios diagnósticos para cada uno de ellos que permite un diagnóstico objetivo y reproducible de cada una de las alteraciones (Tabla 2). Con estos criterios se clasifica a los ancianos como frágiles si presentan tres o más criterios, pre-frágiles si presentan uno o dos criterios y no frágiles si no presentan ninguno de ellos. Como ya hemos comentado previamente, encuentran relación entre la fragilidad y la prefragilidad y la existencia de eventos adversos como hospitalización, aparición de caídas, discapacidad, dependencia y muerte. La respuesta a cada uno de los factores analizados es dicotómica (SI o NO), por lo cual el anciano se clasifica en frágil, prefrágil o sano, y no se establece una gradación de la fragilidad, por lo que es difícil valorar empeoramiento o mejoría de esta en un determinado paciente. Sin emb argo, este fenotipo de fragilidad tiene la ventaja de basar su diagnóstico sobre datos obje tivos y reproducibles, lo que ha permitido su aplicación en múltiples estudios. Así mismo, cumple con el criterio de consider ar la fragilidad como precursora de múltiples síndromes geriátricos y de discapacidad. Un inconveniente que presenta es que en personal no entrenado puede requerir un tiempo algo elevado para su realización. Basado en este fenotipo de Fried y usando criterios muy parecidos, se describe la escala FRAIL que analiza fatiga, pérdida de peso, deambulación, resistencia y comorbilidad y que ha sido validada en el African American Health Study [33] (Tabla 3). Existe una clara evidencia de la asociación entre fragilidad y mal pronóstico independientemente de la forma en que se valore. Así, en un meta-análisis que valora estudios en los que se mide la fragilidad por diferentes métodos, tanto por índice de fragilidad como por fenotipo de fragilidad, se observa que esta se asocia a un mayor riesgo de mortalidad, hospitalización prolongada, institucionalización, discapacidad para las actividades básicas de la vida diaria, caídas, fracturas, deterioro cognitivo y mayor consumo de recursos [34]. Estos datos han sido corroborados por otros autores [35] [36]. Dentro de los posibles test individuales para valorar la situación clínica del anciano, si no es posible realizar una valoración adecuada de la fragilidad, es de suma utilidad la medición de la velocidad de la marcha, que ha demostrado una asociación clara con mortalidad en el anciano. Veloc idades de la marcha superiores a 1 m/s se a socian a un envejecimiento saludable, mientras que inferiores a 0.6 m/s predicen una mala evolución clínica. Se ha propuesto como pu nto de corte predictor una velocidad de 0.8 m/s [37].
4.- LA FRAGILIDAD EN LA ENFERMEDAD RENAL CRÓNICA
Existe una clara asociación entre fragilidad y enfermedad renal crónica (ERC). Son múltiples los estudios en los que se demuestra un incremento significativo de la prevalencia de fragilidad según progresa la ERC. Así, por ejemplo, Roshanravan et al. describen una frecuencia en aumento de la presencia de fragilidad en pacientes mayores con ERC, desde un 8% cuando el filtrado glomerular es superior a 60 ml/min/1.73 m2 hasta casi un 20% en pacientes con filtrado glomerular inferior a 30 ml/min/1.73 m2. Así mismo, encuentran una asociación clara con la albuminuria, de forma que en aquellos pacientes con filtrado glomerular inferior a 45 ml/min/1.73 m2 y albuminuria superior a 300 mg/g encuentran una frecuencia de fragilidad de más de un 26% [38]. Estos datos son confirmados por varios estudios en los que se evidencia que la ERC es un factor muy importante para el desarrollo de fragilidad [39] [40]. En los pacientes en terapia renal sustitutiva, se incrementa de forma muy significativa la presencia de fragilidad. Aunque existe una amplia variación entre los diferentes estudios que puede oscilar entre un 30 y un 70% [41], todos ellos coinciden en que la fragilidad es muy frecuente en los pacientes en diálisis, mucho más que en la población general y que en los pacientes con ERC sin necesidad de terapia renal sustitutiva. En general, se acepta que su frecuencia ronda alrededor del 50% [41]. La presencia de fragilidad en los pacientes con ERC, al igual que en la población general, es un fuerte predictor de la aparición de eventos adversos, como caídas, fracturas, deterioro cognitivo, disminución de caída de vida, complicaciones cardiovasculares y mortalidad [42]. Se ha relacionado la presencia de fragilidad con una peor evolución del paciente en diálisis, pudiendo ser un dato añadido a valorar a la hora de decidir la idoneidad de iniciar una terapia renal sustitutiva o si estaría más indicado el tratamiento conservador en un determinado paciente [43]. También se ha relacionado la fragilidad con la evolución del acceso vascular, los pacientes frágiles presentaría una mayor tasas de fallo del acceso vascular [44]. Así mismo, la presencia de fragilidad en los pacientes disminuye su probabilidad de trasplante [45] y empeora su evolución [46]. Aunque no están claramente dilucidados los mecanismos que sustentan la asociación entre fragilidad y ERC, ambas entidades comparten ciertas alteraciones fisiopatológicas que, unidas al envejecimiento, serían las responsables de la elevada frecuencia de fragilidad en la ERC. Así, la aparición de fenómenos inflamatorios, estrés oxidativo, deterioro cognitivo, alteraciones metabólicas, la anemia, la enfermedad vascular y la disminución de la masa ósea característicos de la ERC contribuirían al incremento de la frecuencia de fragilidad en esta entidad [47]. La malnutrición es una patología que presenta una elevada frecuencia en la ERC. La anorexia, junto a las restricciones proteicas impuestas a estos pacientes, la pérdida de nutrientes por la orina y las diferentes forma de diálisis y el estado de inflamación crónico que acompaña a la ERC contribuyen de forma significativa a la malnutrición. Asociado a ello, el síndrome de desgaste proteico-energético descrito en ellos contribuye a incrementarla. Existe una clara asociación entre malnutrición y sarcopenia, que lleva a la aparición de fragilidad [48]. Además, el sedentarismo, problema muy frecuente en los pacientes con ERC, contribuye de forma significativa al desarrollo de sarcopenia y ya hemos comentado previamente la importancia de la sarcopenia en el desarrollo de fragilidad. La frecuencia de fragilidad tan elevada en la ERC es comparable a la de población anciana muy mayor. Así, en el estudio de Fried [14], para encontrar cifras de fragilidad superiores al 25% tenemos que ir al rango de edad superior a 90 años. Sin embargo, en población con ERC encontramos estas cifras o superiores en poblaciones mucho más jóvenes [45], incluso por debajo de los 65 años. Parecería que, como han descrito algunos autores, la ERC constituyera un estado de envejecimiento metabólico acelerado, al que contribuye el estado de inflamación crónico, el acúmulo de productos avanzados de la glicosilación, estrés oxidativo, resistencia a la insulina, calcificación vascular y osteoporosis [49]. Hay una gran variedad de escalas para evaluar la fragilidad en los ancianos, cada una con sus particularidades. Sin embargo, es importante reseñar que independientemente de la escala por la que se valore, con todas ellas el diagnóstico de fragilidad se asocia a la aparición de eventos adversos. La escala que elijamos debería ser segura, poco costosa y fácil de realizar y los resultados obtenidos deberían ser válidos y reproducibles. La escala más usada es la del fenotipo de fragilidad de Fried, pero otras escalas sencillas, como la Escala Clínica de Fragilidad son igualmente útiles y pueden ser aplicadas fácilmente. También se han validado para detectar fragilidad en la ERC otros indicadores como el Frailty Index, la escala de fragilidad de Gronigen, el Short Physical Performance Battery o la escala FRAIL.
5.- SARCOPENIA.
Como hemos comentado, existe una clara asociación entre fragilidad y sarcopenia, de forma que para algunos autores, la sarcopenia podría ser el sustrato físico de la fragilidad. La sarcopenia la podemos definir como un síndrome caracterizado por la pérdida progresiva y generalizada de masa y fuerza muscular que ocurre con la edad y que conduce a un riesgo de aparición de eventos adversos, discapacidad, disminución de calidad de vida y muerte [18] [50] [50] [51]. La pérdida de masa muscular, especialmente esquelética, se asocia directamente con una pérdida de fuerza muscular y de forma indirecta conduce a una peor calidad de vida y aumenta la vulnerabilidad para la aparición de eventos adversos como caídas, pérdida de independencia, hospitalización y muerte [52]. Su diagnóstico se basa en la demostración concomitante de una baja masa muscular (mediante medidas de cantidad de músculo) y una baja función muscular (a través de la medida de la fuerza muscular o la actividad física) [51]. Existe una clara evidencia de que con el paso de los años se produce una pérdida progresiva de masa muscular, de forma que a partir de los 50 años se pierde aproximadamente un 1-2 % de masa muscular al año, aumentándose esta pérdida a partir de los 70 años [53]. Se puede distinguir una sarcopenia primaria relacionada con el envejecimiento y una sarcopenia secundaria como resultado de la actuación de determinados factores que pueden ser concomitantes con la edad o aparecer mucho antes en la vida del paciente. Mientras que la primaria aparece de forma progresiva y continua a lo largo de los años, la secundaria se asocia no solo a la edad, sino a otras circunstancias que conducen un incremento en la degradación proteica, ocasionando un mayor grado de pérdida muscular que el que correspondería a su edad. En la ERC, existe una frecuencia elevada de sarcopenia, que podríamos considerar como sarcopenia secundaria, existiendo una clara diferencia con la sarcopenia propia de la edad. En la ERC nos encontramos con una elevada degradación muscular, mientras que la síntesis muscular esta disminuida, presentando atrofia de las fibras musculares tipo I y II [51]. Factores relacionados con la propia ERC son los responsables de la elevada frecuencia de sarcopenia. Tanto la etiología de la ERC, como la diálisis y el estado proinflamatorio característico de estos pacientes conduce a una disminución de la síntesis proteica y a una mayor degradación ocasionando un balance proteico negativo [54]. Otros factores no inflamatorios relacionados con la pérdida de la función renal, como la acidosis, resistencia a insulina o el déficit de vitamina D pueden también contribuir a esta alteración [55]. Además, ciertas alteraciones hormonales (testosterona, factor de crecimiento insulínico o resistencia a la GH), pérdida de aminoácidos durante la HD y una reducción de la ingesta proteica y energética pueden agravar este proceso [56]. En los últimos tiempos, también se ha implicado a la disbiosis intestinal que aparece en la uremia en la génesis de la sarcopenia a través de un aumento en la fermentación proteica y un acúmulo de metabolitos de esta como amonio, tioles, fenoles e índoles así como exposición a endotoxinas [57]. Todos estos factores, unidos al envejecimiento de la población con ERC, hacen que la presencia de sarcopenia en estos pacientes sea cada vez más frecuente. Por ello, su detección unida al diagnóstico de fragilidad es cada vez más importante con vistas a poner en marcha medidas que puedan estabilizar o incluso revertir este cuadro.
6.- INTERVENCION SOBRE LA FRAGILIDAD.
Como afirmábamos previamente, la detección de la fragilidad es importante no solo por su influencia sobre la aparición de complicaciones, sino porque se trata de una situación parcialmente reversible. Por ello, una vez diagnosticada, debemos intentar actuar sobre el anciano para intentar mejorar su situación. Existen muy pocos estudios que analicen la evolución de la fragilidad en los pacientes con ERC. En pacientes en diálisis, existe una gran variabilidad en el comportamiento de la fragilidad. Así, en un estudio de Johansen, se observa que aproximadamente la mitad de pacientes en diálisis mejoran su fragilidad a lo largo de un año de observación, mientras que el resto empeoran [58]. La mejoría se asociaba con un aumento de los niveles de albúmina sérica. En la población general, se han descrito algunas maniobras que se pueden asociar a una mejoría de la fragilidad:
• Ejercicio físico: Se considera una de las medidas más efectivas para evitar el declive muscular. Se recomienda un programa de ejercicio físico multicompetente, que incluya ejercicios de resistencia junto a ejercicios aeróbicos, de flexibilidad y de equilibrio [59] [60]. Este tipo de tratamiento mejora el estatus de salud, reduce la fragilidad, mejora la calidad de vida, mejora la masa muscular y previene la aparición de discapacidad [61]. En pacientes con ERC, las guías KDIGO recomiendan intentar alcanzar un programa de ejercicio con una duración de 30 minutos 5 veces por semana [62]. En pacientes en hemodiálisis, en los que a veces es difícil conseguir que realicen programas de ejercicio interdiálisis, una alternativa muy válida es el ejercicio intradiálisis. Este ha demostrado mejorar la adherencia al seguimiento del ejercicio programado siendo una actividad segura y que mejora la calidad de vida de los pacientes [63] [64].
• Soporte nutricional calórico y proteico adecuado: La ingesta adecuada de nutrientes es una de las estrategias más efectivas para el manejo de la fragilidad. En el anciano, se recomienda una ingesta proteica de 1.2 g/kg para mantener una función física adecuada, que se debe incrementar hasta 1.5 g/kg en situaciones de enfermedad aguda o malnutrición [65]. Las dietas ricas en proteínas asociados a programas de ejercicio físico han demostrado mejorar la síntesis proteica y la masa muscular [48]. En el caso de pacientes con ERC avanzada se debe manejar con cuidado el incremento en la ingesta proteica, pero en presencia de fragilidad no debemos ser demasiado restrictivos. La suplementación con algunos micronutrientes como selenio o ciertas vitaminas antioxidantes como vitamina C y E o ácidos grasos polinsaturados omega 3 podrían aportar beneficio en el paciente frágil [66].
• Suplementación con Vitamina D: Es uno de los nutrientes que se ha relacionado con sarcopenia y fragilidad. La suplementación con vitamina D ha demostrado disminuir el número de caídas, mejorar el equilibrio y la estabilidad postural, con un importante papel en la mejoría de la función física y en la presencia de fracturas. En la actualidad, en presencia de fragilidad y déficit de vitamina D se aconseja su suplementación [67].
• Reducción de la polifarmacia: La polifarmacia, entendida como el uso de 5 o más fármacos se ha asociado a la presencia de varios síndromes geriátricos, mortalidad y mayor frecuencia de fragilidad. Esta situación, muy frecuente en el anciano con ERC debe ser evitada en la medida de lo posible, optimizando el consumo adecuado de fármacos [68].