Evaluación del Donante para Trasplante Renal con Criterios Expandidos
ÍNDICE
1.- Evaluación del donante fallecido en muerte encefálica con criterios expandidos
1.1.- Índices clínicos
1.2.- Índices histológicos
1.3.- Sistemas de preservación y tratamientos peritrasplante
2.- Consideraciones especiales del donante en asistolia con criterios expandidos
3.- Donante vivo con criterios expandidos
ABREVIATURAS
DCE: donante con criterio expandido
FRI: función retrasada del injerto
SV: supervivencia
ACV: accidente cerebro vascular
FRA: fracaso renal agudo
AKI: acute kidney injury
OPTN: Organ Procurement Transplant Network
UNOS: United Network for Organ Sharing
GS: glomeruloesclerosis
BR: biopsia renal
HTA: hipertensión arterial
IMC: índice de masa corporal
KDRI: Kidney Donor Risk Index
KDPI: Kidney Donor Profile Index
INTRODUCCIÓN
El aumento del número de potenciales receptores en las listas de espera de trasplante renal, a pesar de contar con altas tasas de donación, ha llevado a realizar esfuerzos por aumentar el número de donantes, expandiendo los límites de aceptación basados en resultados aceptables en términos de supervivencia del paciente y del injerto.
La evaluación de la calidad de un riñón para ser implantado sigue siendo controvertida y forma parte de la práctica clínica habitual de todos los equipos de trasplante. Conocer las variables en relación con el donante que son predictoras de la evolución postrasplante es fundamental para realizar una correcta selección de los órganos potencialmente implantables, intentando reducir las tasas de descarte de órganos. Además, conocer estas características nos permite realizar una selección adecuada del receptor al que le ofrecemos un beneficio en su supervivencia frente a permanecer en diálisis sin recibir un injerto renal.
El objetivo de este documento de consenso es revisar la evidencia científica en relación con las herramientas para la evaluación de donantes con criterios expandidos.
1.- Evaluación del donante fallecido en muerte encefálica con criterios expandidos.
En este apartado, revisamos la evidencia sobre los índices clínicos e histológicos y los sistemas de preservación y maniobras disponibles en el mantenimiento del donante fallecido en muerte encefálica. El foco de esta revisión se centra en el grupo de donantes expandidos.
Definición de donantes con criterios expandidos en muerte encefálica
En 2002, la UNOS (United Network for Organ Sharing)/OPTN (Organ Procurement and Transplantation Network) adoptan la definición de donante con criterio expandido (DCE) para su política de asignación de órganos en EEUU. Se define DCE los donantes con más de 60 años o entre 50 y 59 años con al menos 2 de los siguientes criterios: antecedentes de hipertensión arterial (HTA), creatinina sérica >1.5 mg/dl o accidente cerebro-vascular (ACV) como causa de muerte [1] [2].
1.1.- Índices clínicos
a) Edad del donante
No existe límite de edad para descartar un potencial donante solo por su edad. Sabemos que la edad del donante es un factor que limita la supervivencia del injerto renal [3]. Sin embargo, los donantes de edad muy avanzada, incluidos los donantes mayores de 80 años, son válidos porque ofrecen buenos resultados tanto a corto como a medio-largo plazo si se comparan con trasplantes procedentes de donantes con criterios estándar o con donantes con criterios expandidos [4] [5] [6] [7] [8] [9] [10] [11] [12] [13], ya que presentan una función retrasada del injerto (FRI) similar, un mayor riesgo de pérdida de injerto a 1 y 5 años, y una mayor mortalidad al año, con datos controvertidos con respecto a la supervivencia a 5 años.
Los donantes de edad muy avanzada (incluso donantes mayores de 80 años) también son válidos porque ofrecen una supervivencia del paciente mejor o similar, en receptores muy añosos, que permanecer en lista de espera de trasplante en diálisis [14] [15] [16] [17] [18] [19] [20] [21] [22] [23] [24] [25] [26].
b) Donante con criterios expandidos
Los receptores con injertos renales procedentes de DCE (según la definición “clásica” de DCE) presentaron mayor tasa de FRI [27] [7], de no función primaria del injerto [27] [28] y peor función renal cuando se comparan donantes con criterios estándar [7] [29]. Sin embargo, la supervivencia del paciente y del injerto a 5 años es similar cuando se compara con donantes con criterios estándar [7] [29]. Es importante reseñar, que el uso de estos injertos expandidos ofrece ventajas en supervivencia del paciente y del injerto cuando se compara con pacientes candidatos a trasplante que permanecen en diálisis esperando un trasplante renal [7] [30] [31].
c) Kidney Donor Risk Index (KDRI) / Kidney Donor Profile Index (KDPI)
Recientemente, los índices KDRI y KDPI se introducen en EEUU como un nuevo sistema de asignación de órganos para mejorar la definición clásica de DCE [32]. KDPI/KDRI son índices basados en diez variables relacionadas con el donante que se asocian a la supervivencia del injerto y estima el riesgo de fracaso del injerto en relación con los resultados del año previo en EEUU [33] [34]:
•El KDRI calcula el riesgo relativo de fallo del injerto con respecto a los resultados del año anterior (oscila de 0.5 a 3.5] y atribuye el valor 1.00 al valor mediano (percentil 50]
•El KDPI es una extrapolación acumulada del KDRI en escala del 0 al 100%. Por ejemplo, un KDPI=80%; significa que el 80% de los injertos renales del año anterior tienen mejor supervivencia que este.
Así, donantes con KDPI mayores del 85% se consideran equivalentes a donantes con criterios expandidos [35].
Las diez variables del donante que se incluyen en el KDPI/KDRI son:
1) Edad
2) Peso
3) Talla
4) Raza
5) Antecedentes de HTA
6) Antecedentes de diabetes
7) Causa de la muerte
8) Creatinina sérica
9) Hepatitis por virus C
10) Muerte en asistolia
Algunas consideraciones acerca de esta puntuación son [36] [37] [38] [39]:
- Es una puntuación fácilmente aplicable
- Está disponible online en el siguiente enlace web
https://optn.transplant.hrsa.gov/resources/allocation-calculators/kdpi-calculator/
- No se debe considerar como único criterio para descartar injertos renales.
- No existe ningún umbral de KDPI/KDRI para aceptar o descartar un órgano.
Su aplicación en EEUU ha demostrado que los pacientes que se trasplantan con injerto renal con KDRI elevado presentan una menor supervivencia del injerto. Sin embargo, los que se trasplantan con este tipo de injertos tienen una mejor supervivencia que los controles que permanecen en diálisis [36] [37] [38].
La aplicación de KDPI/KDRI en cohortes europeas (Alemania [40], Holanda [41], Bélgica [42]) ha demostrado ser útil como herramienta para valorar la calidad de los órganos, pero las diferencias en las características de los donantes en Europa con respecto a EEUU hacen que se necesiten índices adaptados al entorno europeo. Lo fundamental es la asignación del órgano en el receptor adecuado. Hay injertos renales con elevado KDPI implantados en receptores de edad avanzada, o con ciertas comorbilidades, que presentan aceptables tasas de supervivencia a largo plazo [40].
En nuestro país, esta puntuación por sí solo no ha demostrado ser válido para descartar órganos. Tampoco existe un umbral de KDPI útil para no aceptar injertos con KDPI elevados. Se ha demostrado que esta puntuación tiene una moderada concordancia y correlación con índices histológicos y usar ambos combinados puede ayudar a tomar decisiones individualizadas [43] [44] [45].
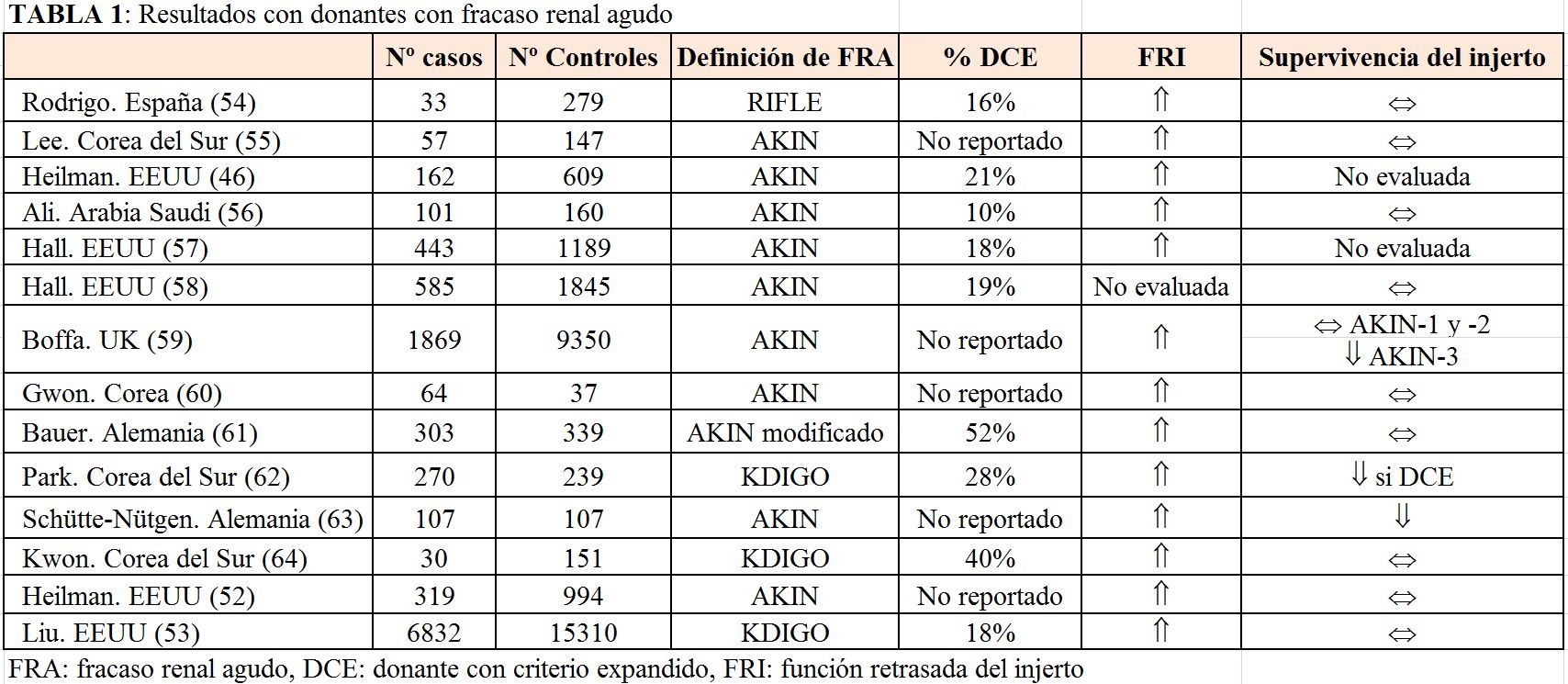
d) Donantes con fracaso renal agudo
Los donantes con fracaso renal agudo (FRA) deben ser evaluados y no se deben descartar a priori solo por este motivo [46] [47]. Se han utilizado diferentes definiciones de FRA en donantes renales:
• Acute Kidney Injury Network (AKIN) [48]
• Kidney Disease: Improving Global Outcomes (KDIGO) [49]
• RIFLE (Risk, Injury, Failure, Loss y End Stage Kidney Disease) [50]
De estas, la más utilizada es la clasificación AKIN. De acuerdo a esta clasificación, se diferencian distintos grados de FRA [48]:
• AKIN-1: aumento de la creatinina sérica de 1,5-2 veces comparada con la creatinina al ingreso o aumento de creatinina = 0,3 mg/dL.
• AKIN-2: aumento de la creatinina sérica de 2-3 veces comparada con la creatinina al ingreso.
• AKIN-3: aumento de la creatinina sérica > 3 veces comparada con la creatinina al ingreso o creatinina sérica = 4,0 mg/dL con aumento de = 0,5 mg/dL.
En la actualidad, se recomienda el uso del término Acute Kidney Injury (AKI) que se define como oliguria durante más de 6 horas, aumento de creatinina sérica mayor a 0,3 mg/dL en 2 días o más del 50% en 1 semana. Se diferencian 3 estadios en función de la creatinina sérica y la diuresis [51].
En cuanto a la evolución de estos injertos renales con FRA no existen herramientas que nos ayuden a predecirla, incluida la biopsia preimplante que tiene un dudoso valor como predictora de resultados en este tipo de donantes [52].
Los injertos renales con FRA presentan más riesgo de función retrasada del injerto comparados con injertos sin alteración aguda de la función renal, pero sin impacto en la supervivencia del injerto a largo plazo [47] [53]. De hecho, la supervivencia del injerto con donantes con criterios expandidos que tienen fracaso renal agudo (AKIN-1 y AKIN-2] es similar a la supervivencia del injerto con donantes sin fracaso renal agudo. Respecto a injertos con FRA grado AKIN-3, la mayor parte de los estudios apoyan el uso de estos si existe una selección adecuada del resto de variables relacionadas con el donante y receptor [52] [54] [55] [56] [57] [58] [59] [60] [61] [62] [63] [64] [29] [53]. En la (Tabla 1) se resume la evidencia en relación con los donantes con FRA y sus resultados después del trasplante.
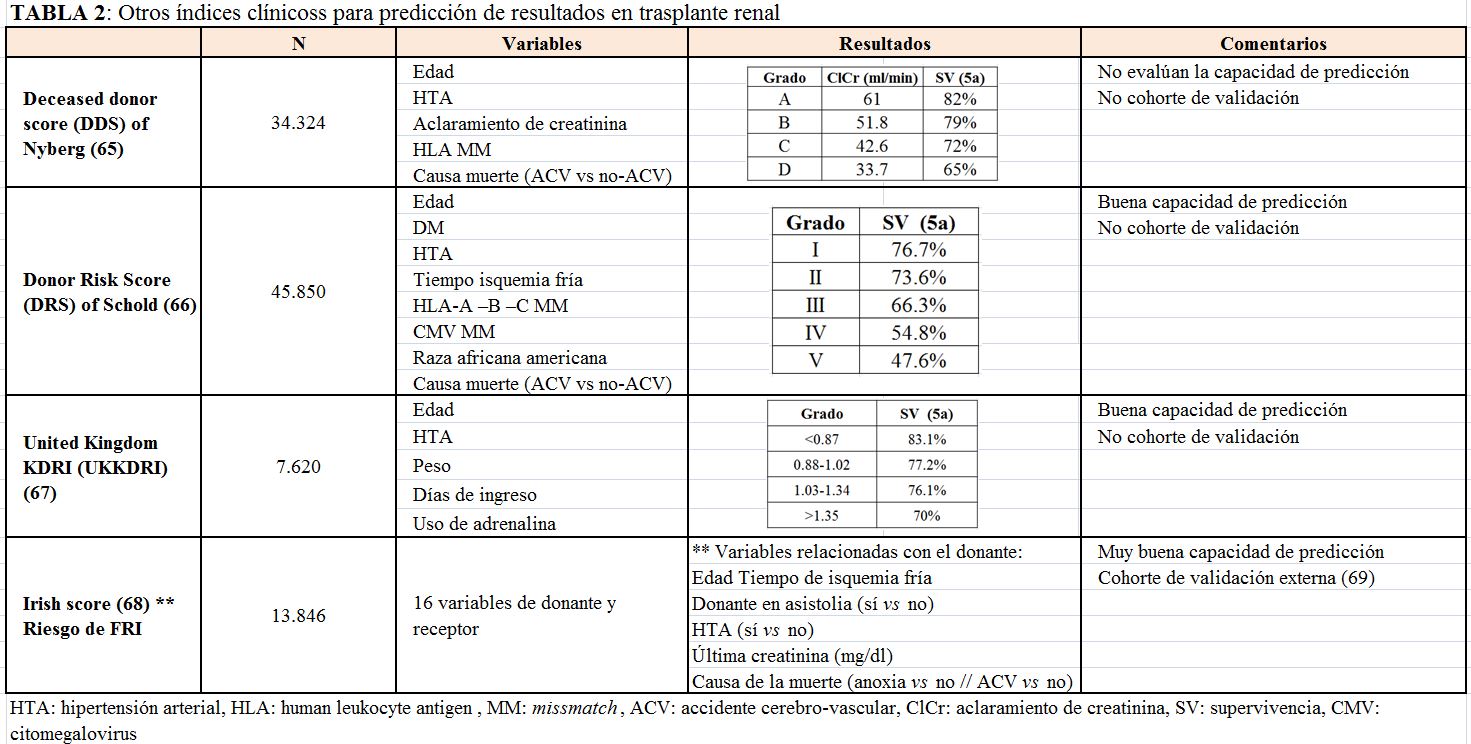
e) Otros índices clínicos
Disponemos de otros índices que tienen una aceptable capacidad de predicción de la evolución del trasplante, aunque en algunos de ellos faltan validaciones en poblaciones más amplias. Los principales índices clínicos que se han utilizado para tratar de predecir resultados en trasplante renal se muestran en la (Tabla 2) [65] [66] [67] [68] [69].
f) Otras herramientas para valoración del donante
Valoración macroscópica del injerto renal
La valoración macroscópica que realiza el cirujano es muy utilizada en la práctica clínica habitual para aceptar o descartar injertos renales. Existen algunos trabajos que reportan herramientas para estandarización de esta valoración macroscópica [70]. Sin embargo, no hay estudios que evalúen de forma sistemática esta valoración ni el valor predictivo en la evolución postrasplante [70] [71] [72].
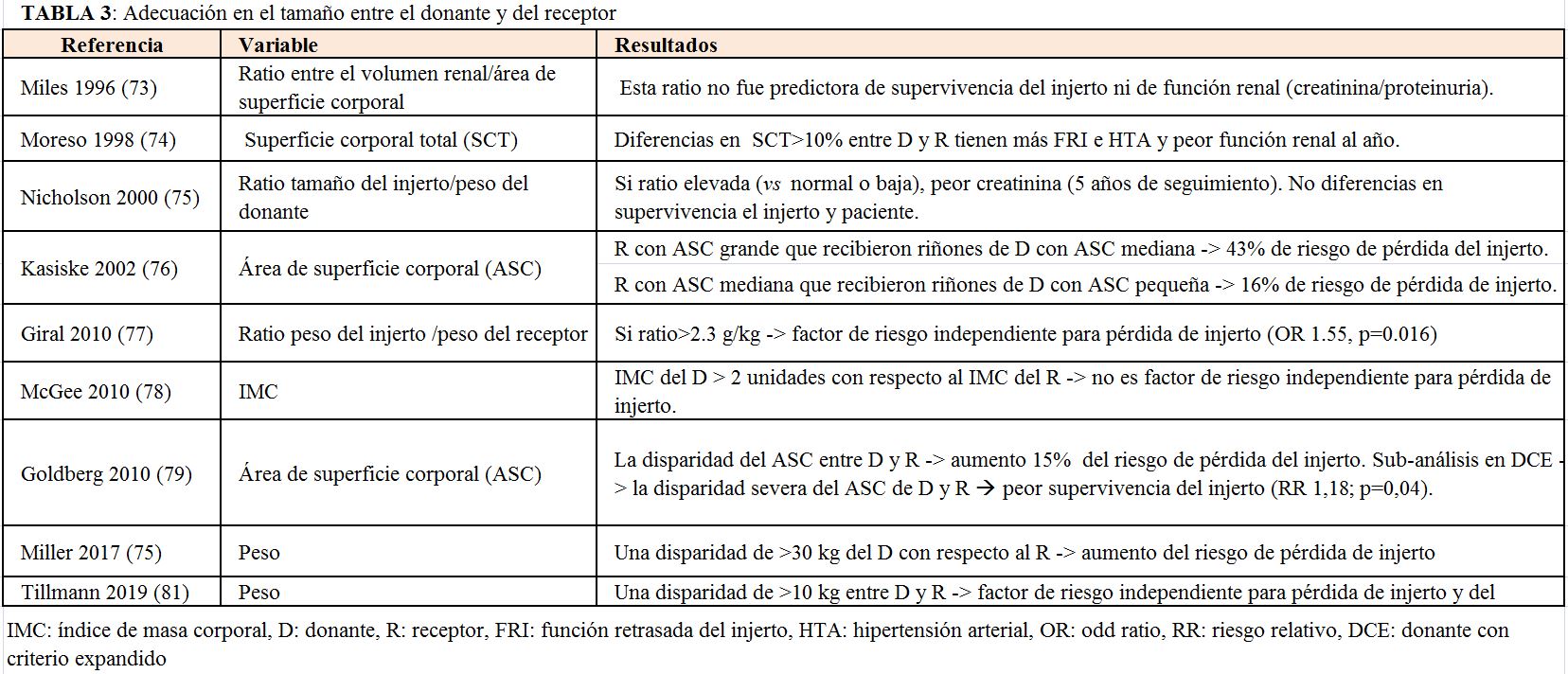
Adecuación de tamaño y sexo entre donante y receptor
Se debe conseguir una adecuación del tamaño entre donante y receptor ya que la disparidad en tamaño entre donante y receptor impacta en la supervivencia del injerto. La (Tabla 3) muestra los principales estudios que han abordado esta disparidad en el tamaño entre la pareja donante-receptor y su impacto postrasplante [73] [74] [75] [76] [77] [78] [79] [80] [81].
De forma similar ocurre con la adecuación de sexo entre donante y receptor. La no adecuación en este sentido también se ha asociado a una peor supervivencia del injerto y este efecto parece ser independiente del peso [80] [81] [82].
EVIDENCIAS
- No existe límite de edad para descartar un donante solo por este motivo [ALTA]
- Los donantes en muerte encefálica de edad avanzada son válidos porque ofrecen mejor supervivencia del paciente que permanecer en diálisis [MODERADA]
- Los donantes con fracaso renal agudo no deben ser descartados [ALTA]
- Los receptores de donantes con fracaso renal agudo (AKIN-1 y AKIN-2] tienen similar supervivencia que los receptores sin fracaso renal agudo [MODERADA]
- Los índices clínicos tienen significación pronostica, aunque no se deben utilizar como herramienta para descartar injertos renales. En la actualidad, KDRI/KDPI es el más utilizado [BAJA]
- Otros índices clínicos, como DRS, UKKDRI o Irish score, no deberían utilizarse como herramienta única para descartar riñones [BAJA]
- La valoración macroscópica del órgano por el cirujano es útil e imprescindible en práctica clínica habitual [BAJA]
- Se debe adecuar el tamaño del donante y el receptor (MODERADA)
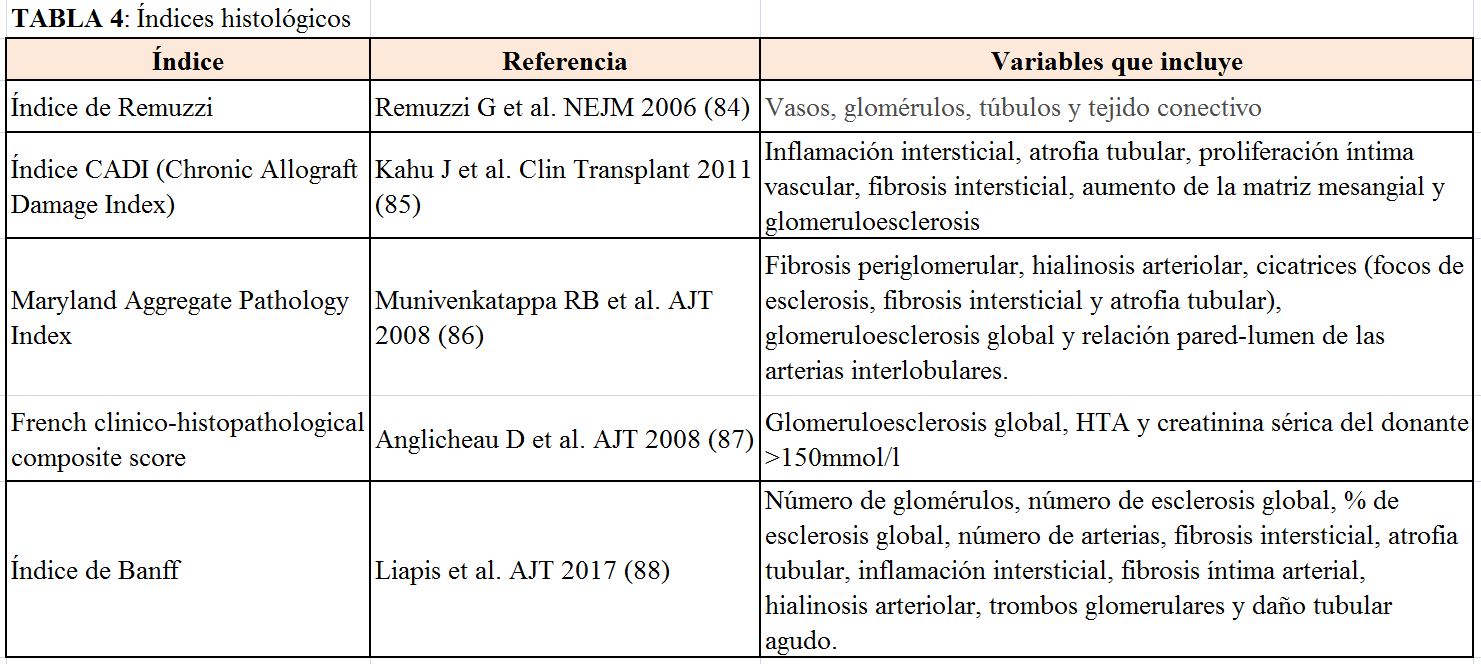
1.2.- Índices histológicos
La biopsia renal (BR) preimplante es una herramienta útil para valorar la calidad de los injertos renales procedentes de donantes con criterios expandidos, pero su uso como único método para descartar órganos es controvertido [4] [83].
Existe una gran heterogeneidad entre los índices histológicos que se aplican en la práctica clínica habitual. En la (Tabla 4) se muestran los más utilizados actualmente [84] [85] [86] [87] [88].
Estos índices histológicos son útiles para predecir la función del injerto a corto (3 meses) [89] [90] y medio-largo plazo (1, 3 y 5 años) [85] [87] [91] [92] [93], pero no predicen FRI [94] ni supervivencia del injerto [83].
Para la evaluación de la biopsia preimplante, el Grupo de Banff (grupo de trabajo de la biopsia preimplante) propone unas recomendaciones para el estudio, valoración y procesamiento de las muestras histológicas procedentes de los donantes renales [88]. Serón et al. publicaron en 2008 un documento de consenso español para la evaluación de las biopsias en donantes renales [95]. Se recomienda que la evaluación de las biopsias preimplante se realice por patólogos expertos en histología renal [88] [91].
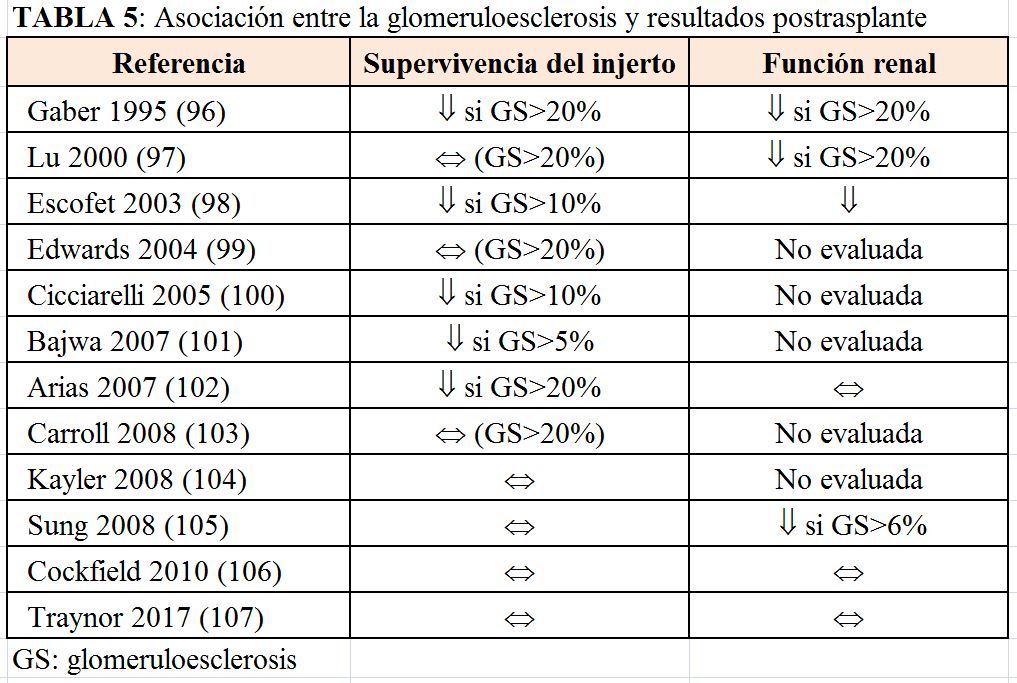
La glomeruloesclerosis es el hallazgo que más se podría asociar a la evolución postrasplante a largo plazo. Algunos estudios han establecido un grado de glomeruloesclerosis mayor al 20% como umbral para descartar injertos subóptimos. Sin embargo, no se ha demostrado que exista una correlación entre el grado de glomeruloesclerosis con la función renal a largo plazo ni con la supervivencia del injerto [96] [97] [98] [99] [100] [101] [102] [103] [104] [105] [106] [107] (Tabla 5). Por tanto, un grado de esclerosis glomerular mayor del 20% no debe utilizarse como único parámetro para descartar riñones [88].
La supervivencia del paciente con injertos renales “subóptimos” desde el punto de vista histológico puede ser óptima en receptores adecuadamente seleccionados [88].
EVIDENCIAS
- La biopsia renal preimplante es una herramienta que aporta información cuando valoramos un donante renal [ALTA]
- No se recomienda utilizar la biopsia como único método de valoración para desestimar órganos [MODERADA]
- Ningún compartimento histológico por si solo ha demostrado tener una buena correlación con los resultados del trasplante renal [MODERADA]
- Para la evaluación de las biopsias de donantes renales deben seguirse las recomendaciones del consenso de Banff y la valoración la debe realizar un patólogo con experiencia [BAJA]
1.3.- Sistemas de preservación y tratamiento peritrasplante
Los injertos renales se pueden preservar hasta su implante almacenados en frío o en máquinas de perfusión [108].
Cuando comparamos ambos sistemas de preservación y su impacto en FRI, la máquina de perfusión hipotérmica mejora la FRI [109]. Esta reducción del riesgo de FRI es mayor cuando los tiempos de isquemia fría son largos (más de 24 horas) [110] y es menor o inexistente cuando los tiempos de isquemia fría son cortos (menos de 24 horas) [111] [112]. El uso de máquina de perfusión hipotérmica en el subgrupo de donantes con criterios expandidos también reduce la incidencia de FRI [111] [112]. Dado que el uso de la máquina de perfusión reduce la FRI, esto implica también una reducción en los costes derivados de la menor necesidad de diálisis y, probablemente, también en la reducción de los días de hospitalización (EEUU [113] y Europa [114]).
La utilización de la máquina de perfusión como sistema de preservación ha demostrado que mejora la supervivencia del injerto a medio plazo (1 y 3 años), especialmente en el grupo de donantes con criterios expandidos [111], pero no ha demostrado mejorar la supervivencia del paciente. La supervivencia del paciente a medio (1 y 3 años) [110] [111] [115] y largo plazo (10 años) [111] es similar con ambos sistemas de preservación.
No existen estudios controlados y randomizados que evalúen los resultados comparando la máquina de perfusión normotérmica con hipotérmica y con preservación en frío [109] [116].
Se han evaluado diversas maniobras de mantenimiento del donante para mejorar los resultados postrasplante. Entre ellas, la infusión de dopamina en el donante [117] o la perfusión del donante con un coctel de ARN [118], que no han demostrado beneficios en el seguimiento después del trasplante. También se ha evaluado el impacto de la hipotermia en el donante (34-35ºC vs 36.5-37.5ºC), demostrando que mejora la FRI y la supervivencia del injerto a corto plazo (1 año postrasplante), pero no se han reportado resultados a medio-largo plazo [119].
Respecto a los líquidos de perfusión utilizados actualmente en trasplante renal, ninguno ha demostrado ofrecer ventajas por mejorar los resultados en función renal o supervivencia del paciente o del injerto [120] [121].
EVIDENCIAS
- La máquina de perfusión hipotérmica con respecto a la conservación en frio mejora la función retrasada del injerto [ALTA]
- El uso de máquina de perfusión hipotérmica no mejora los resultados del trasplante a medio/largo plazo [ALTA]
- No hay diferencias en los líquidos de perfusión que se utilizan en la actualidad [BAJA]
2.- Evaluación del donante en asistolia con criterios expandidos
En los últimos años, hemos asistido a un incremento significativo del número de donantes en asistolia, fundamentalmente a expensas del aumento en el número de donantes en asistolia controlada o Maastricht III. En España, este tipo de donantes supuso en 2018 un 26% del total de trasplantes fallecidos [122]. El objetivo de este apartado es revisar algunas consideraciones especiales acerca este tipo de donantes con criterios expandidos.
2.1- Donantes en asistolia controlada
Los donantes en asistolia controlada con criterios expandidos son una fuente potencial de órganos [123] [124].
El uso de este tipo de donantes en asistolia controlada con criterios expandidos presenta mayor FRI y fallo primario del injerto cuando se compara con donantes con criterios estándar [125]. La función renal a medio plazo [2 años) es peor en donantes con donantes en asistolia con criterios estándar [126].
Los injertos renales en asistolia controlada con menos de 65 años tienen una supervivencia similar a los donantes equivalentes en muerte encefálica [127] [128]. En los receptores mayores de 65 años trasplantados con donantes en asistolia controlada mayores de 65 años, la mortalidad a 5 años es similar respecto a permanecer en diálisis [129] [130].
El tiempo de isquemia fría prolongado en este tipo de donantes es uno de los factores modificables que se asocia a peores resultados postrasplante [123] [124] [131]. En la experiencia española multicéntrica que publica el grupo GEODAS, el tiempo de isquemia fría superior a 17 horas es un factor de riesgo independiente para fallo en la función primaria del injerto [132]. Otros grupos también han demostrado que un tiempo de isquemia fría superior a 14 horas es un factor de riesgo para FRI y supervivencia del injerto [133]. Este impacto no es tan relevante en donantes en muerte encefálica [134]. En donantes en asistolia mayores de 60 años con tiempos de isquemia fría mayores de 19 horas, la supervivencia del injerto a 5 años es menor cuando se compara con un grupo similar de donantes en muerte encefálica [131]. También se ha descrito que tiempos de isquemia caliente prolongados impactan en la evolución postrasplante [135]. Con datos de población de Eurotransplant, se ha demostrado que un tiempo de isquemia caliente superior a 17 minutos es un factor de riesgo independiente para supervivencia del injerto (muerte censurada) a 5 años, incluso cuando se ajusta por KDRI [136].
En cuanto al uso de la máquina de perfusión en este tipo de donantes parece que no ofrece beneficios en supervivencia del paciente y del injerto a medio/largo plazo, a pesar de disminuir la FRI [137].
2.2- Donantes en asistolia no controlada
Los donantes en asistolia no controlada también son una fuente potencial de órganos, pero se limita a donantes con menos de 55-60 años y sin patología cardiovascular. Por tanto, los donantes en asistolia no controlada expandidos no se consideran como donantes aunque se podría evaluar de forma individual donantes con algún criterio expandido aislado [138] [139].
EVIDENCIAS
- Los donantes en asistolia controlada expandidos son válidos para ser considerados como donantes y en la actualidad son una fuente importante de órganos. [MODERADA]
- Los donantes en asistolia menores de 65 años presentan similar supervivencia del injerto que los donantes en muerte encefálica. [BAJA-MODERADA]
- El tiempo de isquemia fría en este tipo de donantes debe ser inferior a 17-19 horas porque de lo contrario, se asocia a peores resultados postrasplante [BAJA-MODERADA]
- Tampoco deben superarse tiempos de isquemia caliente mayores a 17 minutos por su impacto en la supervivencia del injerto a medio plazo [BAJA]
- El uso de máquina de perfusión en donantes en asistolia controlada reduce la FRI, pero no ofrece beneficios en supervivencia del injerto y del paciente [BAJA]
3.- Evaluación del donante vivo con criterios expandidos
El número de donantes vivos con criterios expandidos está aumentando en los últimos años. No existe una definición establecida para el donante vivo con criterios expandidos. Se suele considerar como criterio expandido a aquel donante “límite”, “complejo” o “marginal”, que era descartado en el pasado como donante renal y actualmente se está aceptando como donante.
Dentro de esta definición se encuentran los donantes añosos, obesos, con HTA u otros factores de riesgo cardiovascular y/o filtrado glomerular reducido [140] [141] [142].
3.1- La edad
La edad avanzada por sí sola no es una contraindicación absoluta para la donación renal de vivo. La edad del donante no influye en la supervivencia del paciente que recibe el injerto renal [143] [144].
Los resultados en la supervivencia del injerto de los receptores de un donante vivo añoso [mayor de 60 años [144], mayor de 65 años [143] [145], mayor de 70 años [143] [146] son heterogéneos, y dependen fundamentalmente del grupo control con el que se comparen (donante vivo joven, donante en muerte encefálica o permanecer en lista de espera). En general, la supervivencia del injerto es superior o similar cuando se comparan con donante con muerte encefálica tanto con criterios estándar como expandidos [147].
3.2- La hipertensión arterial (HTA)
Se aceptan como donantes vivos aquellos pacientes con HTA controlada con uno o dos fármacos sin lesión de órgano diana [140] [148] [142].
La HTA en el donante no impacta en la función renal del receptor (salvo si el receptor desarrolla HTA que asocia con peor supervivencia del injerto) ni en la supervivencia del paciente [149] [150] [151].
Se desconoce la progresión de las lesiones histológicas de cronicidad en injertos renales procedentes de donantes vivos con HTA [152].
3.3- La obesidad
La aceptación de donantes obesos (IMC > 30 kg/m2] debe ser individualizada y no se recomienda la aceptación de donantes obesos con otros factores de riesgo cardiovascular [140] [141] [142].
La obesidad mórbida (IMC > 35 kg/m2] se considera una contraindicación para la donación renal de vivo debido al incremento de riesgo de complicaciones a corto y largo plazo en el donante [153] [154].
La obesidad del donante vivo no influye en la supervivencia del injerto. El IMC extremo del donante es factor de riesgo para una peor supervivencia del injerto [155].
3.4- La función renal
No existe una definición de “función renal límite” para el donante vivo, ya que no existen unos criterios uniformes establecidos por las diferentes guías de recomendación [156].
Los donantes con función renal límite son aquellos que presentan una función renal que está en el límite para la aceptación y el descarte como potencial donante y se debe hacer una valoración individualizada:
o UNOS (2019): 60 a 90 mL/min/1,73 m2 [157]
o Canadá (2019): no especifica límites de función renal [158]
o UK (2018): según edad [142]
o KDIGO (2017): 60 a 89 mL/min/1.73 m2 [148]
o Europa (2015): función renal “normal” según edad [159]
o Australia (2010): < 80 mL/min/1.73 m2 [160]
o España (2010): según edad [161]
EVIDENCIAS
- El donante vivo expandido siempre debe evaluarse como potencial donante [ALTA]
- El receptor de donante vivo añoso presenta mejor supervivencia del injerto que el donante fallecido con criterio expandido [MODERADA]
- La HTA del donante no impacta en la función del receptor [BAJA]
- La obesidad del donante, salvo en casos de índice de masa corporal extremos, no parece tener repercusión en la función renal del receptor [BAJA]
- No existe consenso en la definición de función renal límite para un donante vivo [BAJA]