Epidemiología y factores de riesgo. Diagnóstico y tratamiento de la recidiva de la nefropatía IgA
AUTORES
Marta Artamendi Larrañaga, Lorena Castillo Eraso, Sonia Cillero Rego, Antonio Franco Esteve, Constantino Fernández Rivera, Teresa García Álvarez, Román Hernández Gallego, María Jesús Izquierdo Orti, Thais López Alba, Francisco Llamas Fuentes, Alicia Mendiluce Herrero, Miguel Ángel Muñoz Cepeda, María Dolores Navarro Cabello, Miguel Angel Pérez Valdivia, Ana Ramos Verde, Dolores Redondo Pachón, Asunción Sancho Calabuig, Emilio Rodrigo Calabia.
Grupo PROMETEO 2021
Abstract:
La recidiva de la enfermedad renal primaria se considera la tercera causa de pérdida del injerto renal tras la muerte con injerto funcionante y el rechazo crónico, por lo que es del mayor interés conocer con precisión su epidemiología y sus factores de riesgo. La nefropatía IgA es la glomerulonefritis que más recidiva postrasplante en números absolutos y contribuye a la pérdida del injerto renal principalmente a largo plazo.
Se llevó a cabo una actualización de la epidemiología y de los factores de riesgo de la recidiva de las enfermedades renales primarias en general y, específicamente, de la nefropatía IgA revisando las publicaciones científicas más relevantes sobre el tema.
1. Epidemiología de la recidiva de la enfermedad renal primaria y factores de riesgo globales.
1.1. Introducción
A partir de los datos disponibles en distintos registros, principalmente del registro australiano-neozelandés (ANZDATA), se estima que aproximadamente un 38-45% de los receptores de trasplante renal tienen una glomerulonefritis (GN) primaria como causa de la enfermedad renal crónica (ERC) [1] [2] [3]. Entre todas las GN primarias, la que tiene más probabilidades de recibir un trasplante es la nefropatía IgA (NIgA) [2] [3] [4] [5]. Los pacientes con GN primaria como causa de la ERC que reciben un trasplante renal suelen ser más jóvenes, más frecuentemente varones y suelen recibir con más frecuencia un trasplante de vivo que los receptores con otras etiologías de la enfermedad de base [6] [7].
Es difícil extraer conclusiones precisas, a partir de la literatura disponible, para conocer el riesgo de recidiva de las enfermedades renales primarias, sus factores de riesgo y su influencia sobre la supervivencia del injerto debido a la gran variabilidad en las características de cada estudio. Esta variabilidad se debe a:
1. Número pequeño de pacientes analizados en cada estudio [8] [9]
2. Ausencia de diagnóstico de certeza histológico pretrasplante [8]
3. Patología glomerular presente en el donante [10]
4. Duración del seguimiento postrasplante corto y variable [8] [9]
5. Falta de estudio sistemático de la proteinuria y el sedimento urinario postrasplante [11]
6. Ausencia de un abordaje unificado en el uso de las herramientas diagnosticas de la recidiva de GN: biopsia de protocolo vs. por indicación y diferencias en las indicaciones de la biopsia postrasplante. Por ejemplo, la biopsia de protocolo permite el diagnóstico precoz de la recidiva histológica ya que esta puede permanecer silente durante años, por lo que no sería detectable mediante biopsias por indicación) [8] [9] [11] [12]
7. Tipo de evaluación histológica que puede incluir o no, además del estudio mediante microscopía óptica (MO), microscopía electrónica (ME) y inmunofluorescencia (IF) [8] [9] [11]
8. Presentación histológica atípica de la recidiva [10] [12]
9. Dificultad para diferenciar la recidiva del daño aloinmune [11]
10. Diagnósticos concurrentes [10]
La complejidad inherente a estos estudios ha hecho incluso que distintas publicaciones no hayan utilizado las mismas definiciones de recidiva, lo que complica aún más estudiar su epidemiología, factores de riesgo y repercusión. Para resolver este problema, algunos autores han propuesto utilizar denominaciones comunes para poder consensuar los diagnósticos [9] [11]:
1. “Recidiva confirmada”: el mismo diagnóstico confirmado por biopsia en riñón nativo y trasplantado.
2. “Enfermedad glomerular en el trasplante con enfermedad primaria desconocida”: es, posiblemente, la misma enfermedad, pero no se puede asegurar.
3. “De novo”: la enfermedad demostrada por biopsia en el trasplante es diferente de la enfermedad nativa.
4. GN trasmitida del donante: hallazgos en la biopsia precoz del receptor detectados previamente en la biopsia del donante.
1.2. Epidemiología de la recidiva de la enfermedad renal primaria
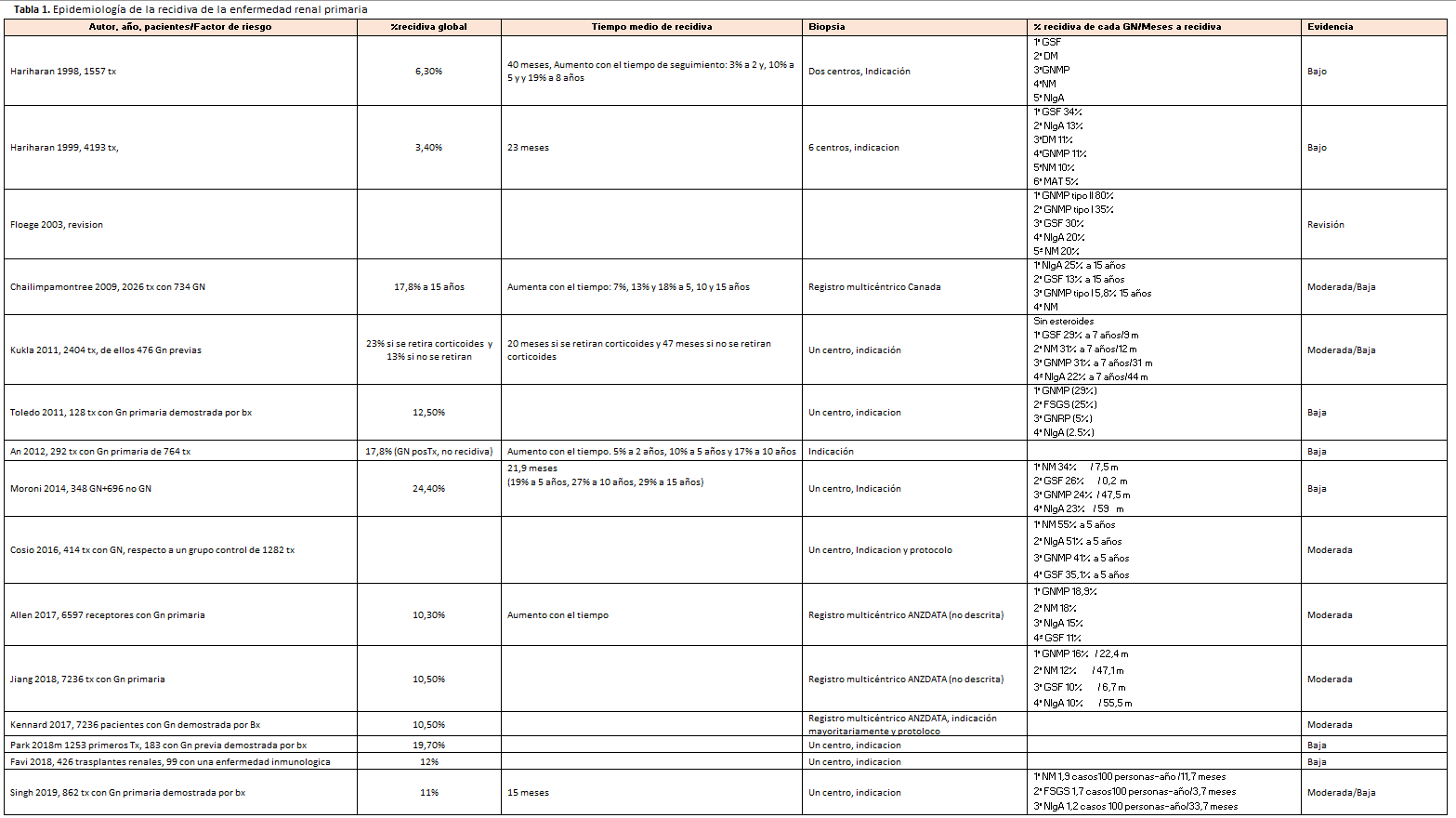
Los estudios de registros y de series grandes han observado que la incidencia de la recidiva aumenta con el tiempo postrasplante: 7%, 13% y 18% a 5, 10 y 15 años, respectivamente, en el registro canadiense [7]. La incidencia a 5 años oscilaba entre 7%-19% [3] [7] [8] [13] y a 10 años oscilaba entre 13%-27% [3] [7] [8] (Tabla 1).
Entre las distintas GN primarias, en números absolutos la que recurre con mayor frecuencia es la NIgA [2] [5] [7]. Para cada GN primaria, las que tienen más riesgo de recidiva son la glomerulonefritis membrano-proliferativa (GNMP) y la glomerulosclerosis segmentaria y focal (GSF) idiopática [2] [5], siendo el riesgo de recidiva máximo (∼ 90%) para las glomerulopatías C3, especialmente la enfermedad por depósitos densos (DDD) [10]. La GN primaria que recurre de forma más precoz es la GSF idiopática, seguida de la GNMP. Recurren más tardíamente la nefropatía membranosa (NM) y la NIgA [2] [14] [15] (Tabla 1).
1.3. Factores de riesgo de las GN primarias en conjunto
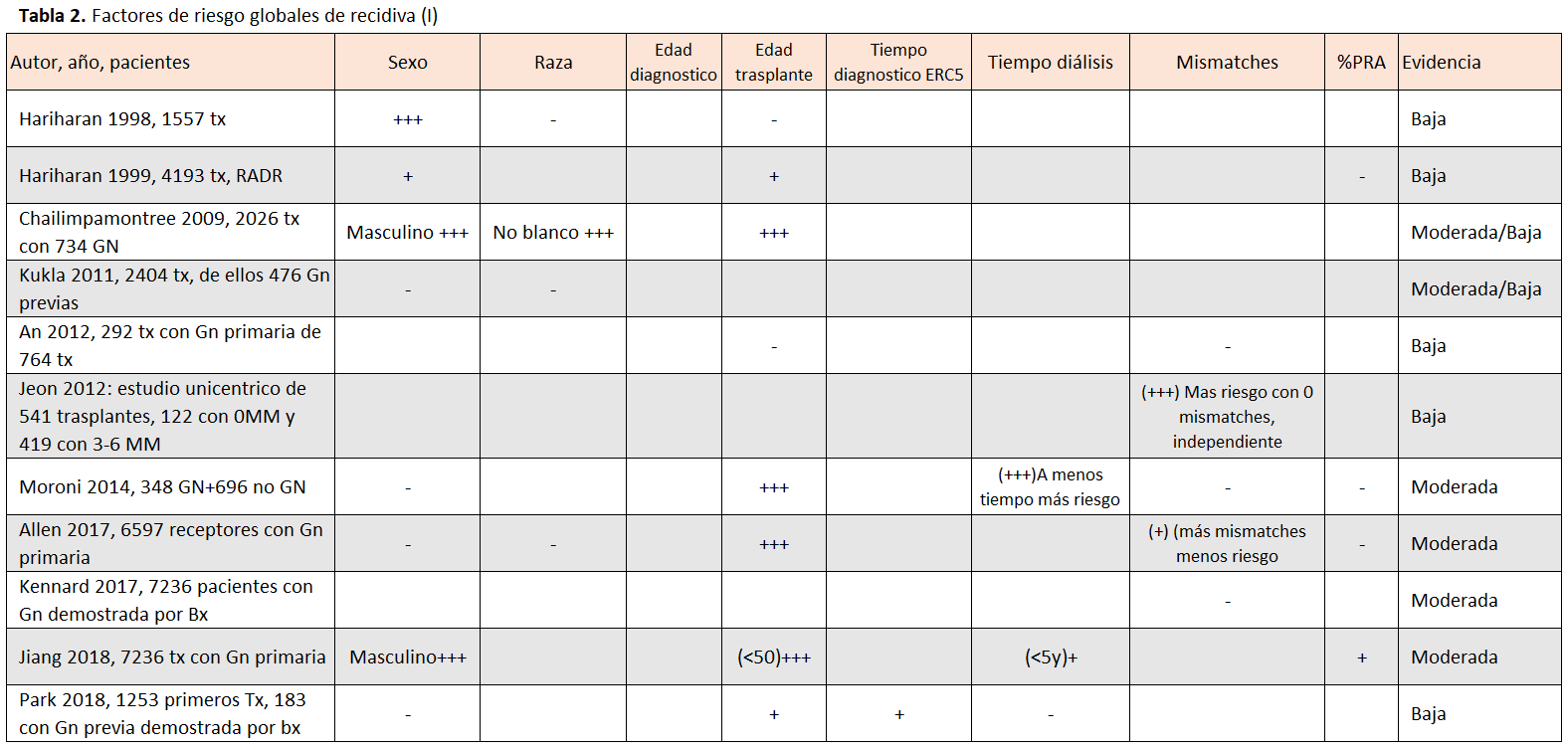
Se han estudiado múltiples factores de riesgo relacionados con el riesgo de recidiva de las GN primarias, siendo los más consistentemente relacionados con la recidiva (estudios de registros, análisis multivariante):
- Menor edad del receptor al trasplante.
- Sexo masculino.
- Tiempo de seguimiento postrasplante.
- Trasplante de vivo emparentado.
- Suspensión de esteroides.
- Menor duración del tiempo en tratamiento sustitutivo renal [1] [2].
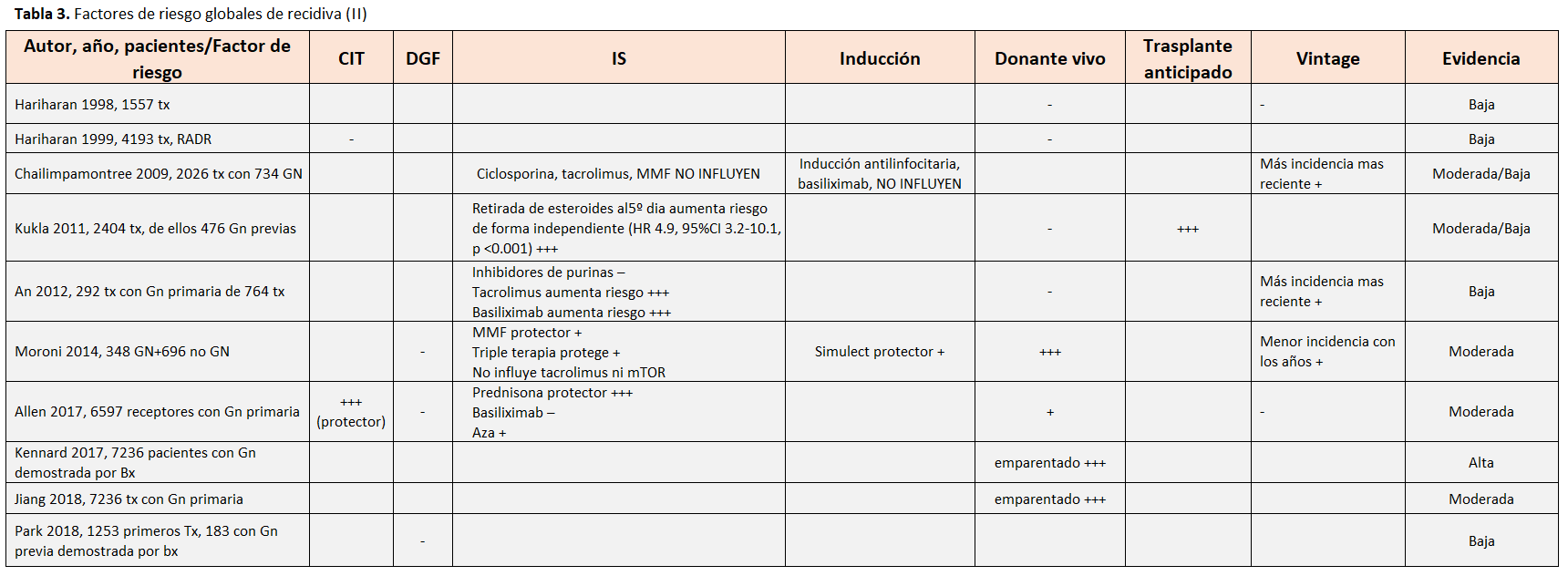
Los factores de riesgo analizados en los distintos estudios se han resumido en las (Tabla 2) y (Tabla 3). Entre estos factores destacamos algunos datos relevantes:
- Tras una recidiva previa la GN que tiene más riesgo de recidiva es la GSF [1].
- El riesgo de recidiva (especialmente para NIgA y GSF) fue significativamente mayor para los trasplantes de vivo emparentado comparados con los de donante cadáver (HR 1,7, 95% CI 1,4–2,1, p <0,00001) o los de vivo no emparentado (HR 1,6, 95% CI 1,05–2,4, p = 0,03). A pesar de la recidiva más frecuente, la supervivencia del injerto censurada para muerte fue superior para la donación de vivo, tanto emparentado como no emparentado, que de cadáver [16].
- Un estudio unicéntrico comparando pacientes con retirada precoz de esteroides (< 5 días) versus un grupo control previo observó que la suspensión rápida de esteroides aumentaba el riesgo de recidiva para todas las GN primarias (HR 4,86; 95%CI 2,34 –10,07, p <0,0001) y hacía que la recidiva fuera más precoz (20 meses vs. 47 meses) [15].
- La aparición de proteinuria a partir del 3º mes es un marcador de desarrollo de patología glomerular postrasplante [17].
- Aparte del posible efecto protector de los esteroides en el riesgo global de recidiva, no hay datos consistentes sobre el papel del tratamiento inmunosupresor, incluyendo la inducción, en el riesgo de recidiva [2] [3] [7] [8] [15] [18].
RECOMENDACIONES relacionadas con la epidemiología de la recidiva de la enfermedad renal primaria y factores de riesgo globales
1. Obtener un diagnóstico histológico de la enfermedad primaria siempre que sea posible. FUERTE.
2. Realizar una biopsia renal cuando hay una elevación inexplicada y persistente de la creatinina y/o aparición de proteinuria por encima de 500-1000 mg/g para clarificar siempre la causa de disfunción del injerto. DÉBIL.
3. Evaluación histológica completa de la biopsia del injerto incluyendo MO/IF/ME, especialmente en los pacientes con riesgo de recidiva de la enfermedad primaria. FUERTE.
4. Aunque no se dispone de evidencias, se recomienda la revisión sistemática periódica del sedimento urinario en el seguimiento de los trasplantes renales. DÉBIL.
5. En pacientes con GN primaria se recomienda no retirar los esteroides, especialmente en los que tienen mayor riesgo de recidiva (jóvenes, varones, trasplante de vivo emparentado y tiempo corto en TRS). DÉBIL.
6. En pacientes con riesgo de recidiva de GN primaria no se puede hacer una recomendación específica sobre el tratamiento inmunosupresor de base para reducir la recidiva.
Repercusión de la recidiva en la en la evolución del trasplante renal.
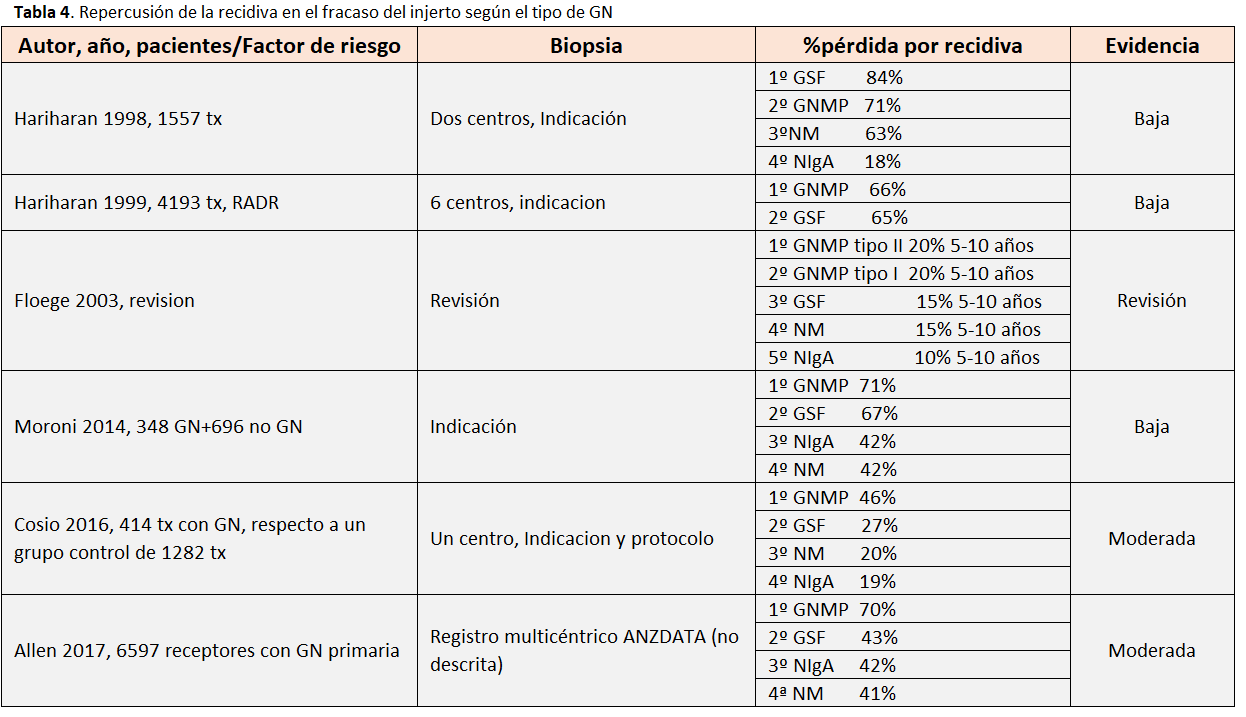
Si tenemos en cuenta la causa de la ERC, los receptores de un trasplante renal cuya enfermedad causante de ERC es una GN primaria tienen una peor supervivencia del injerto censurando por muerte que pacientes con etiologías sin riesgo de recidiva, de forma independiente de otras variables [8] [19]. Dentro de las GN primarias, la que tiene una peor supervivencia del injerto censurando por muerte es la GNMP, y la segunda peor es la GSF, siendo la que mejor supervivencia tiene la NIgA [6] [19] [20] (Tabla 4).
La supervivencia de los receptores de un trasplante renal cuya enfermedad causante de ERC es una GN primaria es similar a la de los pacientes con poliquistosis renal autosómica dominante (PQRAD), aunque tienen peor función renal a 10 años [6] [20] [21]. Dentro de las GN primarias, los receptores cuya enfermedad causante de ERC es una NIgA tienen menor mortalidad que el resto de GN primarias y secundarias (HR para GSF 1,6, HR para MN 1,5, HR para GNMP 1,8, HR para nefritis lúpica LN 1,8 y HR para vasculitis 1,6) [20].
La recidiva de las GN primarias es la tercera causa de pérdida de los injertos renales tras la muerte con injerto funcionante y el rechazo mediado por anticuerpos [12] [22] [23] [24] [25]. Además, en los pacientes con recidiva ésta es la primera causa de fracaso del injerto [1] [2]. La recidiva de la GN es un factor de fracaso del injerto renal censurando por muerte independiente del resto de variables, oscilando el riesgo en los distintos estudios entre 1,9 y 5,3 veces [1] [2] [3] [8] [14] [21] [24] [26]. De forma más precisa, los estudios de registro han documentado que la recidiva de GN aumenta en tres veces el riesgo de fracaso del injerto censurando muerte y en dos veces la de fracaso del injerto [2].
Ningún inmunosupresor (Aza vs. MMF, CsA vs. Tac) se ha asociado a un mayor riesgo de pérdida por recidiva [27] [28].
Comparando las distintas GN, en el estudio de registro ANZDATA, la tasa de supervivencia del injerto a 5 años DESPUÉS de la recidiva fue 30% para GNMP, 57% para GSF, 58% para NIgA y 59% para NM [2]. La mayoría de estudios han observado que, tras la recidiva, la GN que produce más fracaso del injerto es la GNMP (20-71%), 2º GSF (15-84%), 3º NM (15-63%), 4º NIgA (10-42%) [2] [8] [9] [12] [13] [14] [29]. Así, el tipo de GN a la recidiva es un factor independiente de fracaso del injerto renal [1] [12] [22]. Este mayor riesgo de recidiva se traduce también en una mayor precocidad en la pérdida del injerto tras la recidiva para GNMP y GSF que para NIgA y NM [14] [22].
RECOMENDACIONES relacionadas con la repercusión de la recidiva en la en la evolución del trasplante renal.
Tras la recidiva de una GN primaria postrasplante no se puede hacer ninguna recomendación específica sobre la inmunosupresión de base para mejorar la supervivencia del injerto.
3. Porcentaje de recidiva de la nefropatía IgA y factores de riesgo de la recidiva.
3.1. Incidencia de la recidiva de la NIgA y forma de presentación
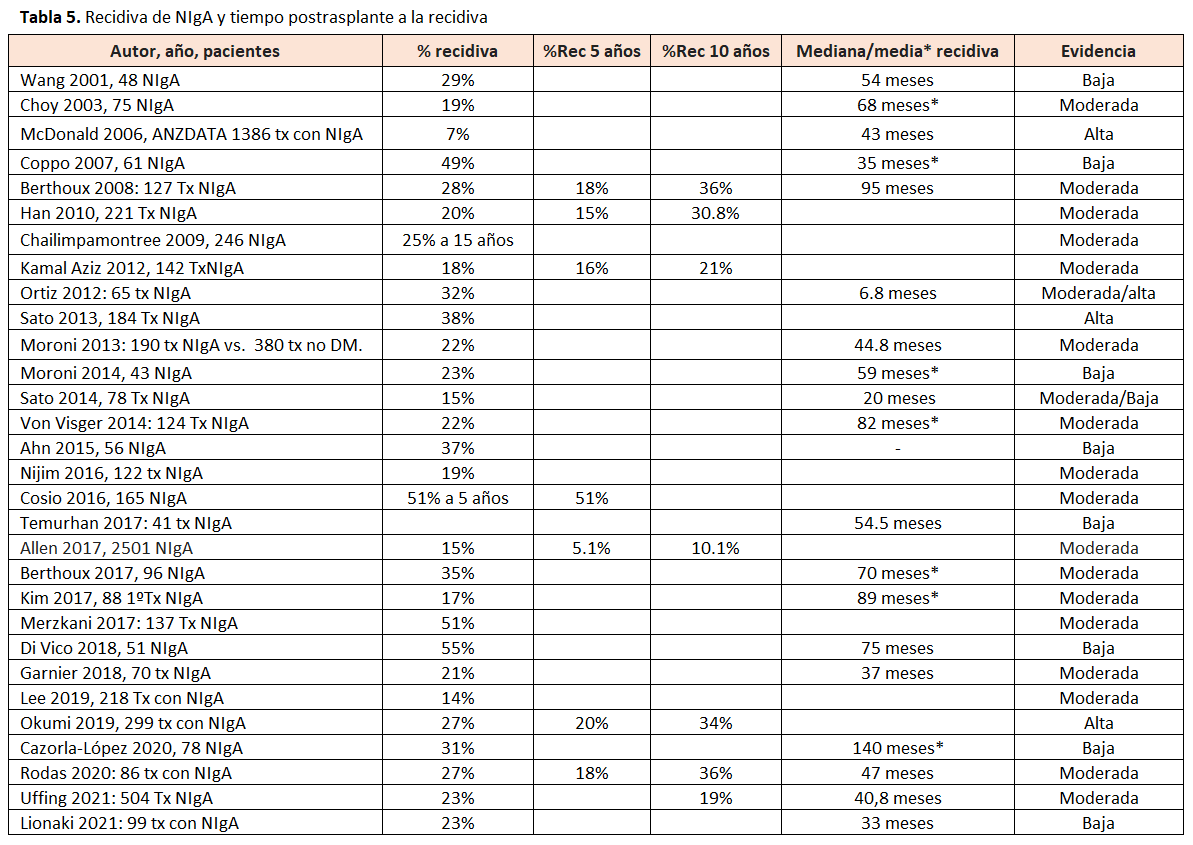
La GN primaria que más frecuentemente recibe un trasplante renal es la NIgA, llegando a representar aproximadamente un tercio de los casos en el registro ANZDATA [1] [2]. Los pacientes trasplantados con NIgA de base eran más frecuentemente varones y más jóvenes [30] [31]. La incidencia de recidiva de NIgA en el registro ANZDATA fue de 5%, 10%, y 15% a 5, 10 y 15 años, respectivamente [2]. El tiempo medio a la recidiva diagnosticada mediante biopsia de indicación osciló entre 20 y 140 meses en los distintos estudios, siendo de 43 meses en el registro ANZDATA [32] (Tabla 5).
La forma de presentación de la recidiva de la NIgA es variable. Puede presentarse como proteinuria y/o hematuria [33] [34] [35] o, habitualmente de forma más tardía, como deterioro de la función renal [36]. Si se utilizan biopsias de protocolo, la recidiva histológica subclínica es más común (hasta el 32% al 2º año), aparece de forma más precoz y con frecuencia de forma silente, la mitad de las veces sin alteraciones urinarias ni deterioro de la función renal [31] [37].
Los distintos estudios han utilizado definiciones diferentes de la recidiva de la NIgA, considerando o no si, junto con el depósito IgA mesangial por inmunofluorescencia, había o no otras manifestaciones histológicas (ej: expansión y proliferación mesangial) o si incorporaba al diagnóstico manifestaciones analíticas como deterioro de función renal, hematuria y/o proteinuria. En opinión del grupo PROMETEO que ha hecho la revisión, se debe considerar como recidiva el depósito IgA aislado con o sin expresión clínica.
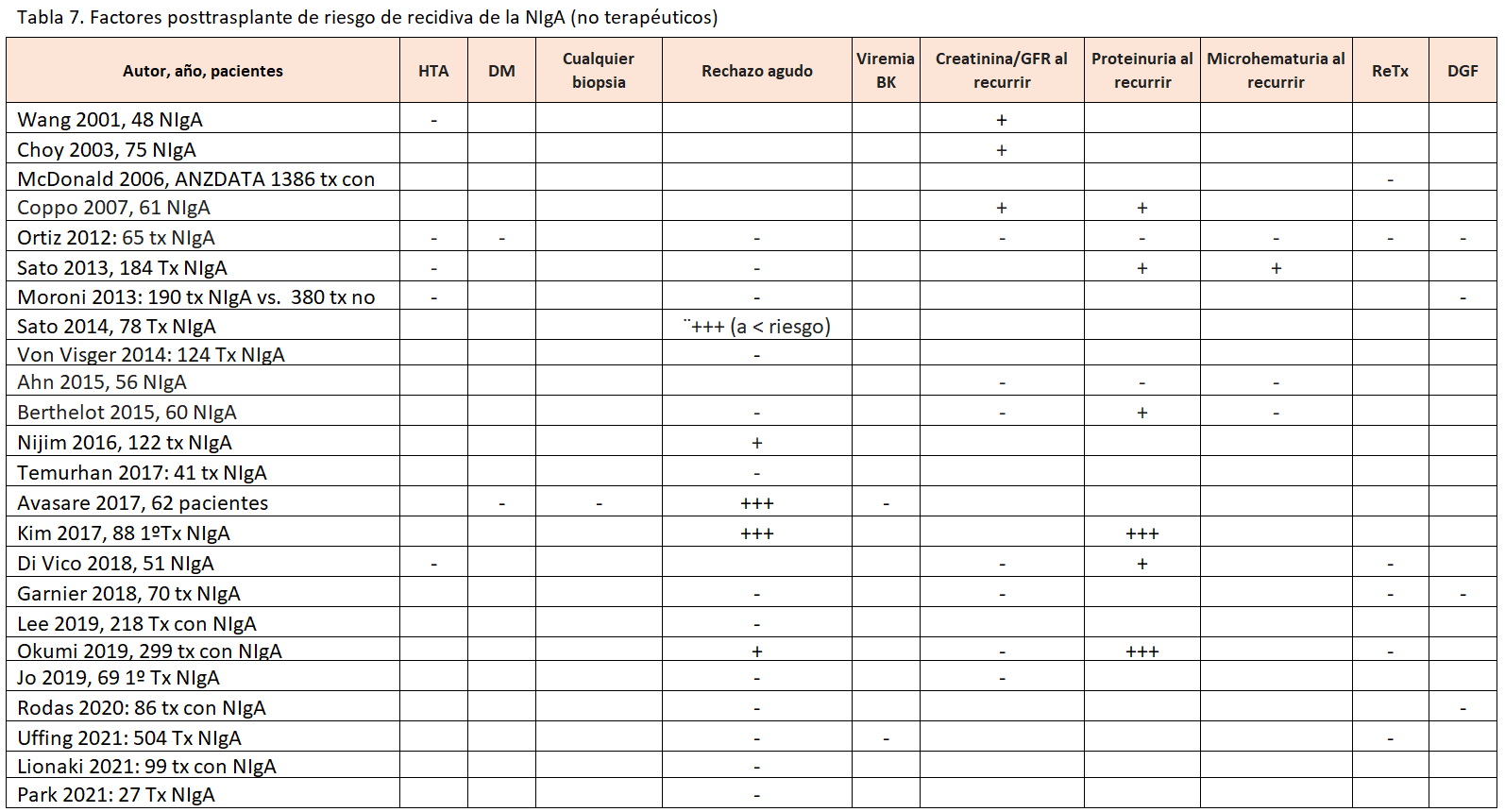
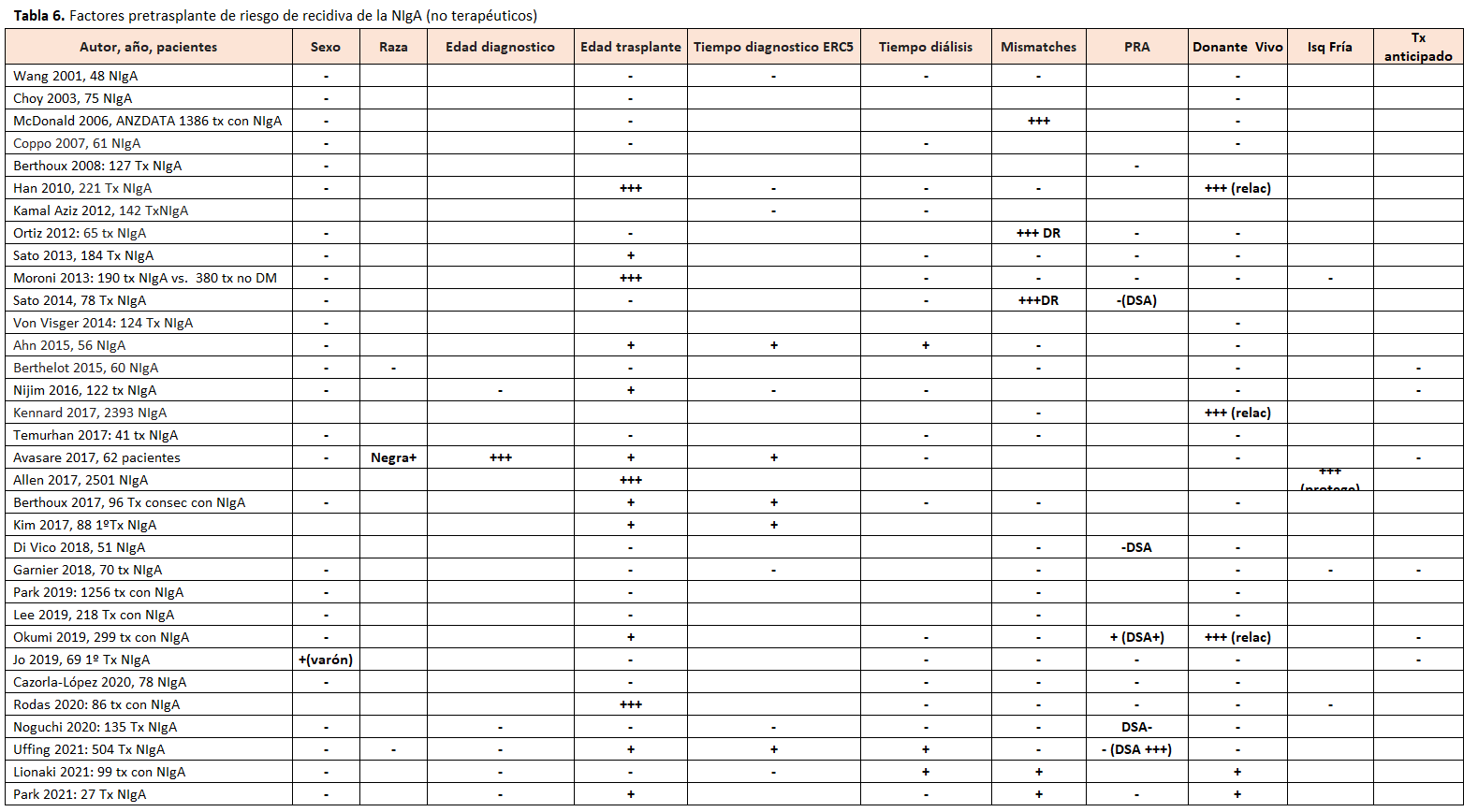
3.2. Factores de riesgo de recidiva de NIgA no relacionados con el tratamiento inmunosupresor
El extraer conclusiones definitivas sobre los factores de riesgo de la recidiva de la NIgA más relevantes se ve dificultado porque cada estudio ha analizado factores de riesgo distintos y utilizado definiciones diferentes de la recidiva (Tablas 6) y (Tabla 7). Factores que se han asociado con mayor riesgo de recidiva son la edad del receptor [2] [35] [38] [39] [40] [41] [42] [43], el tiempo postrasplante [9] [34] [43], el sexo masculino del receptor [44], el donante vivo emparentado [16] [35] [39], un menor número de incompatibilidades HLA [32] [37] [41] [45], ciertos HLA [46], la presencia de depósitos IgA en la biopsia preimplante [47], la presencia de semilunas en el riñón nativo [48], el menor tiempo en diálisis [43] [45] [49], el menor tiempo entre el diagnóstico y el grado 5 de la ERC [38] [43] [49], el rechazo agudo [33] [34] [40], la no tonsilectomia pretrasplante en los estudios japoneses [35], el trasplante anticipado [43] y la presencia de DSA pre o postrasplante [35] [43]. Dentro de estos factores de riesgo, los que se han relacionado de forma más consistente con un mayor riesgo de recidiva en estudios de amplios o en registros con análisis multivariante han sido: la edad del receptor [2], el tiempo postrasplante [9] y el donante vivo emparentado [16] [35] [39]. Se pueden agrupar en relación con:
• Agresividad de la enfermedad de base:
• Edad más joven del receptor
• Menor tiempo en diálisis
• Menor tiempo entre el diagnóstico y el grado 5 de la ERC
• Semilunas en la biopsia basal
• Tiempo dependiente
• Factores del donante:
• Proximidad genética del donante: donante vivo emparentado, menor número de incompatiblidades
De forma relevante, a pesar de que la recidiva de NIgA era más frecuente en los receptores de injerto de un donante vivo emparentado, la supervivencia del injerto censurada para muerte fue superior para donación de vivo, tanto emparentado como no emparentado, que la de cadáver [16], por lo que el diagnóstico previo de NIgA no es una contraindicación para recibir un trasplante renal de un donante vivo emparentado.
Hasta el momento actual, no se dispone de marcadores serológicos pretrasplante que permitan identificar con certeza qué pacientes están en mayor riesgo de recurrencia. Los resultados disponibles sobre la utilidad de la IgA1-galactosil-deficiente (IgA1-Gd) sérica pretrasplante o otros marcadores no son concluyentes [38] [50]. La IgA1-Gd sérica postrasplante se relaciona con más riesgo de recidiva, pero con poca utilidad en la clínica [51] [52].
RECOMENDACIONES sobre la incidencia de la recidiva de la nefropatía IgA y sus factores de riesgo.
1. La recidiva de la NIgA solo se puede diagnosticar mediante una biopsia renal. FUERTE.
2. No hay marcadores validados séricos ni urinarios de la recidiva de la NIgA (pretrasplante, ni postrasplante). FUERTE.
3. Se recomienda definir tipo de recidiva de NIgA como: DÉBIL
• “Recidiva SUBCLÍNICA”: Depósito IgA + No proteinuria/hematuria ni elevación de creatinina.
• “Recidiva CLÍNICO-PATOLÓGICA”: Depósito IgA + Proteinuria/hematuria y/o elevación de creatinina.
4. Se recomienda identificar al grupo de pacientes con “alto riesgo de recidiva” de la NIgA: DÉBIL
• Mayor agresividad de la enfermedad de base:
• Edad del receptor
• Menor tiempo en diálisis
• Menor tiempo entre el diagnóstico y ERC-5
• Semilunas en la biopsia del riñón nativo
• Factores del donante: Proximidad genética del donante: donante vivo emparentado, menor número de incompatiblidades
4. Influencia de la recidiva de la nefropatía IgA en la pérdida del injerto renal.
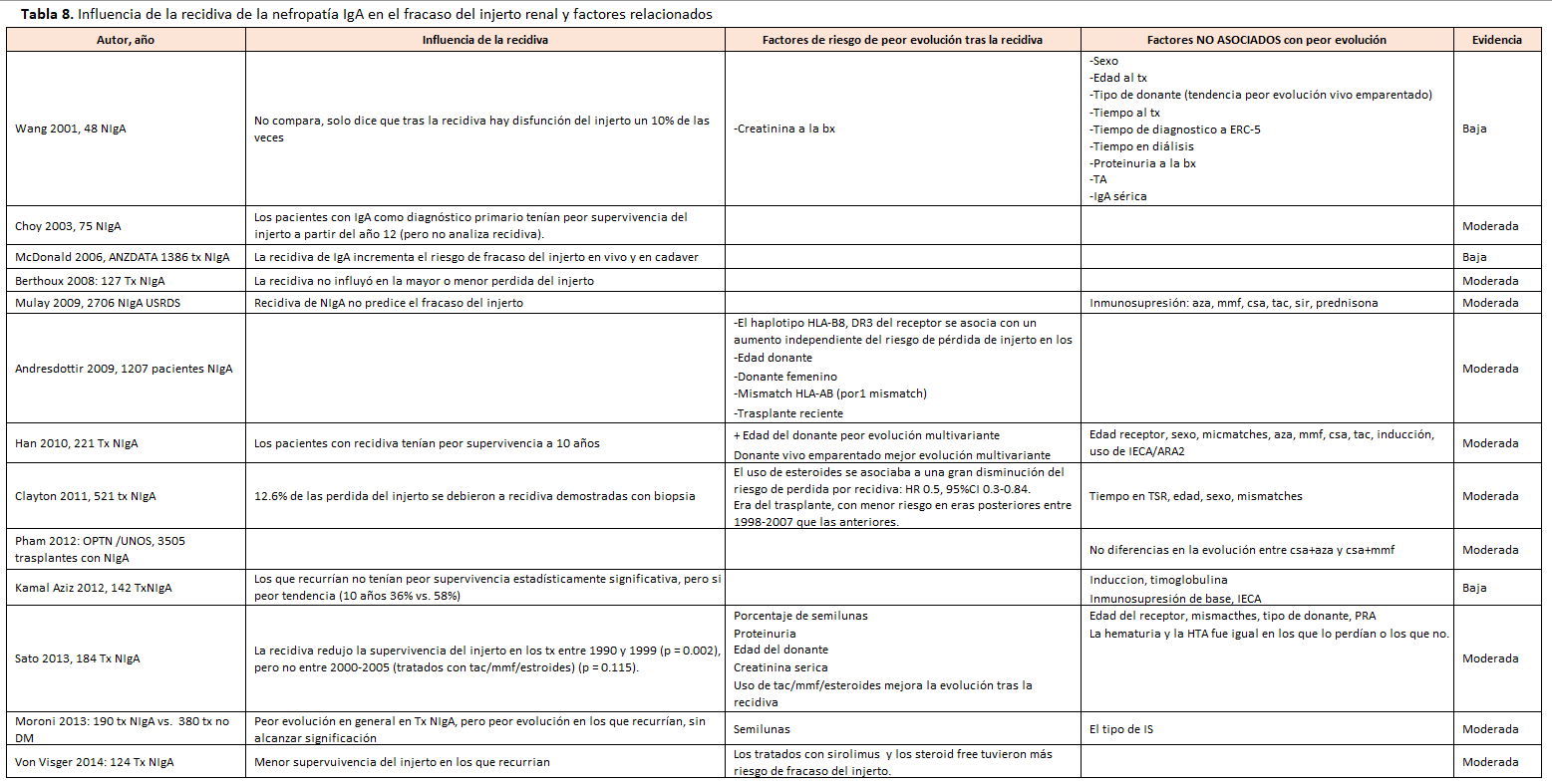
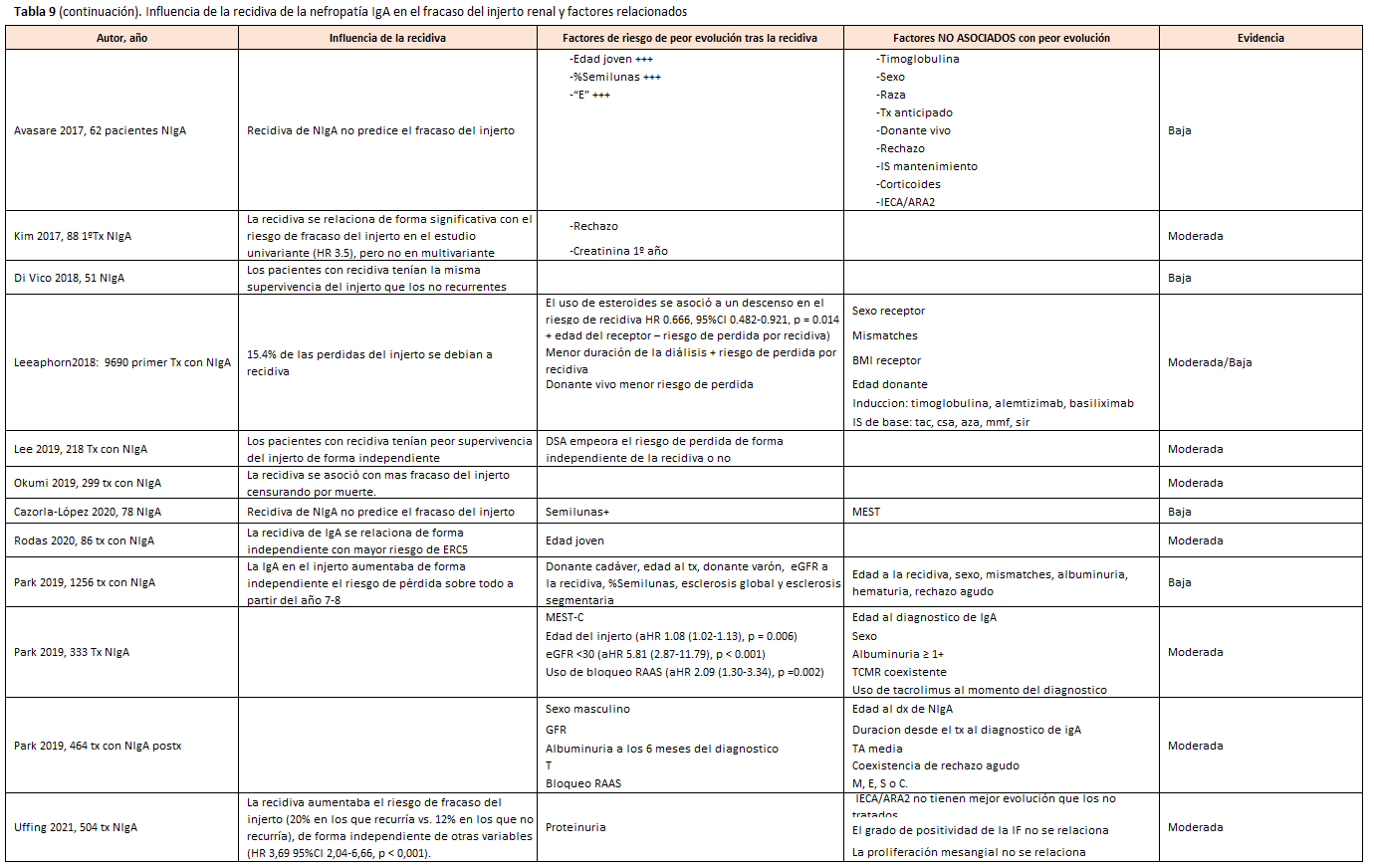
Los receptores con NIgA como enfermedad de base, independientemente de si recidiva o no, no tienen más riesgo de fracaso del injerto censurando muerte durante los primeros 5-10 años postrasplante, comparando con pacientes con poliquistosis o con otras enfermedades primarias, aunque el riesgo de pérdida aumenta posteriormente [19] [27] [30] [36] [53]. De forma similar, los trasplantes con recidiva de la NIgA no tenían un aumento del riesgo de fracaso del injerto censurando muerte los primeros 5-10 años postrasplante, pero sí posteriormente, de forma independiente de otras variables [39] [42] [43] [54] [55] (Tabla 8) y (Tabla 9). En general, se considera que, en estos pacientes, la recidiva de la NIgA es la tercera causa de fracaso del injerto tras la disfunción crónica y la muerte con injerto funcionante [56]. Cuando recurre, un 67% de las pérdidas del injerto son debidas a la recidiva [35].
Se han identificado diversos factores relacionados con una peor evolución tras la recidiva, que revisamos a continuación y se exponen en la (Tabla 8) y (Tabla 9):
- Los hallazgos histológicos en la biopsia diagnóstica de la recidiva como la presencia de semilunas > 10% [33] [42] [54] y el M, E, S, T se asocian a peor supervivencia del injerto [42] [57].
- El tratamiento inmunosupresor no ha demostrado un efecto consistente en los distintos artículos sobre la evolución del injerto tras la recidiva. El uso de inducción no modifica el riesgo de fracaso del injerto censurando muerte tras la recidiva [39], 59] [59]. Así mismo, los distintos regímenes inmunosupresores de mantenimiento no cambian el riesgo de fracaso del injerto censurando muerte tras la recidiva [39], 59] [59]. Dos artículos han identificado que el uso de esteroides se asocia a una disminución del riesgo de pérdida por recidiva [56] [59], pero otros no han confirmado este hallazgo.
- Los donantes de vivo emparentado tienen mejor supervivencia del injerto censurando muerte que los de cadáver, a pesar del mayor riesgo de recidiva [39] y aunque la recidiva empeora en ambos el riesgo de fracaso del injerto censurando muerte [32].
- Se ha descrito que, tras la recidiva, una menor edad del receptor puede empeorar el riesgo de fracaso del injerto censurando muerte [55] [41].
- Una mayor proteinuria [33] [43] [60] y una peor función renal en el momento de la recidiva aumentan el riesgo de fracaso del injerto censurando muerte [33] [60].
- Solo en un estudio se ha demostrado que si baja la proteinuria con el bloqueo RAAS mejora el pronóstico [60].
RECOMENDACIONES relacionadas con la influencia de la recidiva de la nefropatía IgA en el fracaso del injerto renal
1. KDIGO 2021: Se recomienda clasificar la afectación histológica utilizando la clasificación de Oxford: MEST-C.
DÉBIL.
2. Los siguientes factores ayudan a reconocer al grupo de pacientes con “alto riesgo de mala evolución” tras la
recidiva postrasplante: DÉBIL
a. MEST-C (cada componente por separado y su combinación)
b. Receptor joven
c. Mayor edad donante
d. Proteinuria al diagnóstico de la recidiva
e. Peor función renal al diagnóstico de la recidiva
f. Ausencia de tratamiento esteroideo
5. Prevención y tratamiento de la recidiva de la nefropatía IgA.
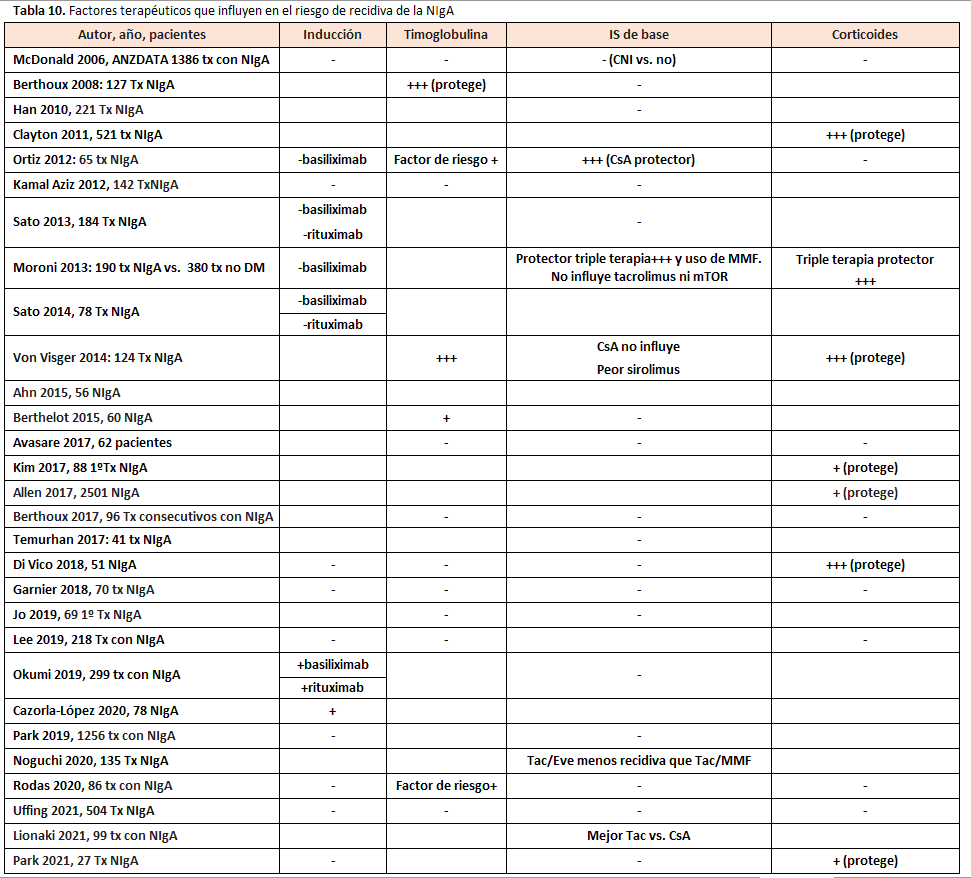
En relación con las medidas terapéuticas dirigidas a reducir el riesgo de recidiva no se ha podido identificar en la literatura revisada ninguna medida que reduzca este riesgo de forma consistente (Tabla 10):
- El uso de inducción en general no disminuye el riesgo de recidiva [33] [43] [51] [55] [61].
- No se ha demostrado ninguna tendencia a lo largo de los años de que los cambios ocurridos en el tratamiento inmunosupresor habitual influyen en un mayor o menor riesgo de recidiva [32] [35] [43] [56] [58] [62]. Estudios comparativos no han encontrado relación entre la IS de base y la incidencia de recidiva de NIgA [49]. No hay diferencia en el riesgo de recidiva comparando Tac vs. CsA, Aza vs. MMF, esteroides si/no [32] [38] [39] [41] [43] [44] [45] [49] [51] [55] [58] [62] [63] [64]. No hay datos suficientes para conocer la influencia del uso de inhibidores de mTOR en la recidiva [41] [65] [66]. Aunque algunos estudios han relacionado el mantenimiento del tratamiento con esteroides con un menor riesgo de recidiva [2] [34] [62] [65] y de fracaso del injerto tras la recidiva [56] [59], los resultados contrarios de otros estudios [38] [43] [51] [63] [67] no permiten confirmar ni descartar que el uso de esteroides reduzca la recurrencia ni mejoren la evolución del injerto tras la misma.
- El uso de IECA/ARA2 no influye en un menor riesgo de recidiva [37] [41] [51] [58] [65] [68].
En cuanto al tratamiento de la recidiva de la NIgA, no se ha observado que el tratamiento inmunosupresor en el momento del diagnóstico influya en una mejor o peor supervivencia del injerto [28]. Tampoco se ha demostrado el beneficio a largo plazo de tratar a los pacientes con recidiva con IECA/ARA2 [43] [68], aunque sí que estos fármacos reducen la proteinuria en los pacientes con recidiva [69]. De forma interesante, un estudio retrospectivo ha demostrado que los pacientes con recidiva con proliferación endocapilar y proteinuria > 1000 mg/g con poco daño crónico histólogico tenían mejor evolución (más remisión completa a 12 meses, más remisión parcial y mejor supervivencia del injerto) si recibían 4 dosis de rituximab añadido al tratamiento convencional [70]. La falta de evidencias sobre la forma más adecuada de tratar las recidivas de la NIgA hace que, para poder establecer unas recomendaciones, se extrapolen a partir de las últimas evidencias y recomendaciones [71] [72].
Recomendaciones sobre la prevención de la recidiva de la nefropatía IgA.
1. En los pacientes de “alto riesgo de recidiva” el mantenimento del tratamiento esteroideo podría disminuir la recidiva. DÉBIL.
2. Ni la inducción ni ningún tratamiento inmunosupresor de base han demostrado beneficio en la reducción del riesgo de recidiva de la NIgA. FUERTE.
Recomendaciones sobre el tratamiento de la recidiva de la nefropatía IgA.
1. Considerar pasar de doble a triple terapia para optimizar el tratamiento inmunosupresor en los que tienen recidiva de la NIgA. DÉBIL.
2. El tratamiento inicial de la recidiva es optimizar el tratamiento de soporte adaptando las recomendaciones de KDIGO 2021 al trasplante renal: DÉBIL
a. Objetivo de TAS es <120 mmHg
b. Si el paciente tiene proteinuria > 500 mg/g, con o sin hipertensión, recomendamos que el tratamiento inicial sea con IECA/ARA2
3. Considerar el tratamiento con dapagliflozina y potencialmente otros inhibidores de SGLT-2 en pacientes con FG > 25 ml/min con proteinuria a pesar del tratamiento previo. DÉBIL.
4. No hay evidencias para basar el tratamiento en el MEST-C o en el número de semilunas. DÉBIL.
5. En los pacientes con recidiva de la NIgA con mayor riesgo de progresión se recomienda seguir las pautas de KDIGO 2021 adaptadas al trasplante renal: DÉBIL
a. Considerar iniciar un curso de tratamiento de 6 meses con glucocorticoides (prednisona ≥0,5 mg/kg x 1 mes y pauta descendente posterior en los pacientes con proteinuria > 1000 mg/g tras 90 días de tratamiento óptimo, en función del FG y la comorbilidad del paciente.
b. A los pacientes con NIgA rápidamente progresiva definida como una disminución de ≥ 50% en FG durante ≤ 3 meses se puede plantear tratamiento con ciclofosfamida (retirando MMF/AZA/inh m-TOR) y corticoides de acuerdo con las pautas para vasculitis asociada a ANCA.