Diabetes tras el Trasplante Renal
Palabras clave
Trasplante renal, diabetes postrasplante, sobrecarga oral de glucosa
INDICE:
1. Definición y criterios diagnósticos
2. Incidencia
3. Factores de riesgo:
3.1 Factores de riesgo pretrasplante
3.2 Inmunosupresión y riesgo de Diabetes Mellitus Postrasplante (DMPT)
3.3 Otros factores de riesgo relacionados con el trasplante
4. Patogénesis
5. Diabetes postrasplante y resultados del trasplante renal
6. Prevención
6.1 Identificación de los pacientes de riesgo en lista de espera
6.2 Prevención tras el Trasplante Renal
Adaptación de la Inmunosupresión
Detección de la hiperglucemia
Reducción de glucotoxicidad de la célula beta.
Detección y control de la prediabetes
7. Tratamiento
7.1 Hiperglucemia precoz
7.2 Agentes hipoglucemiantes
7.3 Tratamiento integral
7.4 Manejo de las comorbilidades
7.5 Manejo de la Prediabetes
8. Bibliografía
ABREVIATURAS:
DMPT: Diabetes postrasplante renal
TR: Trasplante renal
ADA: American Diabetes Association
SOG: Sobrecarga oral de glucosa
CsA: Ciclosporina A
mTOR: Mammalian target of rapamycin.
CMV: Citomegalovirus
MMF: Micofenolato mofetil.
MTF: Metformina
SU: Sulfonilureas
TZD: Tiazolidindionas
iDPP-4: Inhibidoress de DPP-4
arGLP-1: Agonistas del receptor de GLP-1
iSGLT2: Inhibidores del co-transporte sodio-glucosa.
1. DEFINICIÓN Y CRITERIOS DIAGNÓSTICOS.
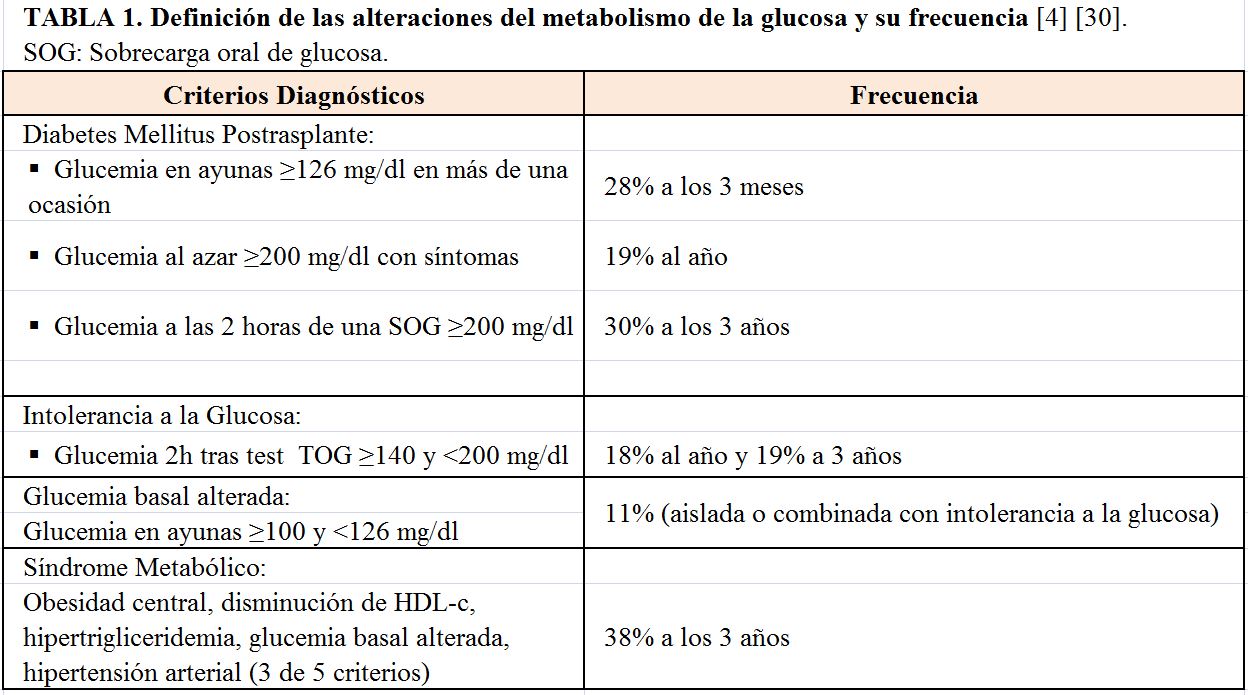
Se entiende por Diabetes postrasplante aquella que es “diagnosticada” tras el trasplante renal (TR) o de otro órgano sólido. Sin embargo, entre un 5-8% de los pacientes en lista de espera para TR, sin Diabetes conocida, tiene una diabetes desenmascarada con una sobrecarga oral de glucosa [1]. Por esta razón el Documento de Consenso Internacional recomienda utilizar el término Diabetes postrasplante renal (DMPT) en lugar de diabetes de novo [2]. Adicionalmente, recomienda no establecer un diagnóstico de DMPT basado en hiperglucemias detectadas en los primeros 45 días, generalmente transitorias, y asociadas a una mayor exposición a los inmunosupresores, infecciones, o tratamiento del rechazo agudo. Finalmente, también existe consenso en utilizar los criterios de la Sociedad Americana de Diabetes (ADA) para definir las distintas alteraciones del metabolismo de la glucosa postrasplante (Tabla 1) [2] [3]. La única excepción es el criterio de la HbA1c que se ve modificada por la anemia, disfunción renal, y por el uso de agentes estimuladores de la eritropoyesis. Por esta razón no debe usarse como criterio para el despistaje diagnóstico al menos hasta 6-12 meses del TR [2].
2. INCIDENCIA.
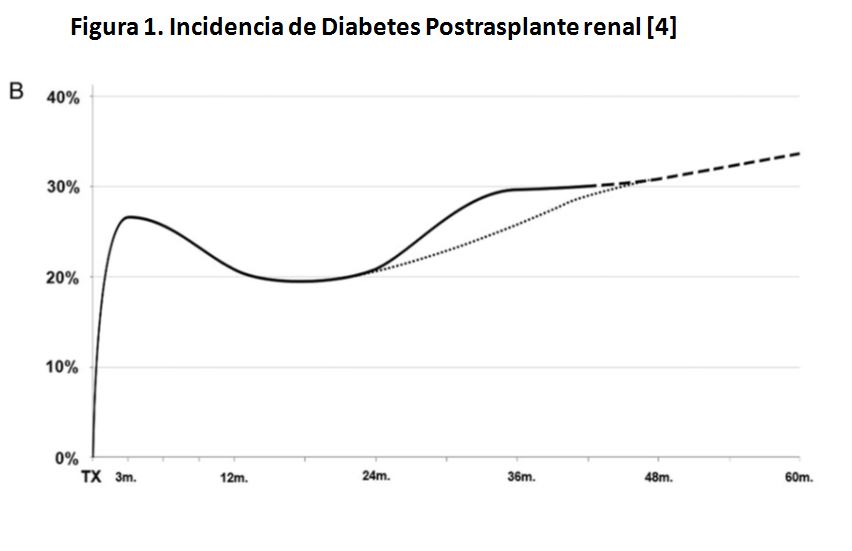
Esta ha quedado bien establecida en un estudio multicéntrico español que incluyó más de 600 pacientes. Se realizó una sobrecarga oral de glucosa (SOG) a los 3 y 12 meses postrasplante, y luego anualmente [4]. La incidencia de DMPT mostró un pico inicial a los 3 meses afectando al 28% de los receptores. Posteriormente, y coincidiendo con la reducción de la inmunosupresión, revierte espontáneamente en el 31% de los casos. Finalmente, existe un segundo incremento tardío de tal manera que el 30% de los receptores muestra DMPT a los 3 años (Figura 1). A esto se añade un 19% de pacientes con intolerancia a la glucosa [4]. En conjunto, el 50% de los receptores de un TR muestra algún trastorno del metabolismo de la glucosa a los 3 años [4].
3. FACTORES DE RIESGO.
3.1 Factores de riesgo pretrasplante.
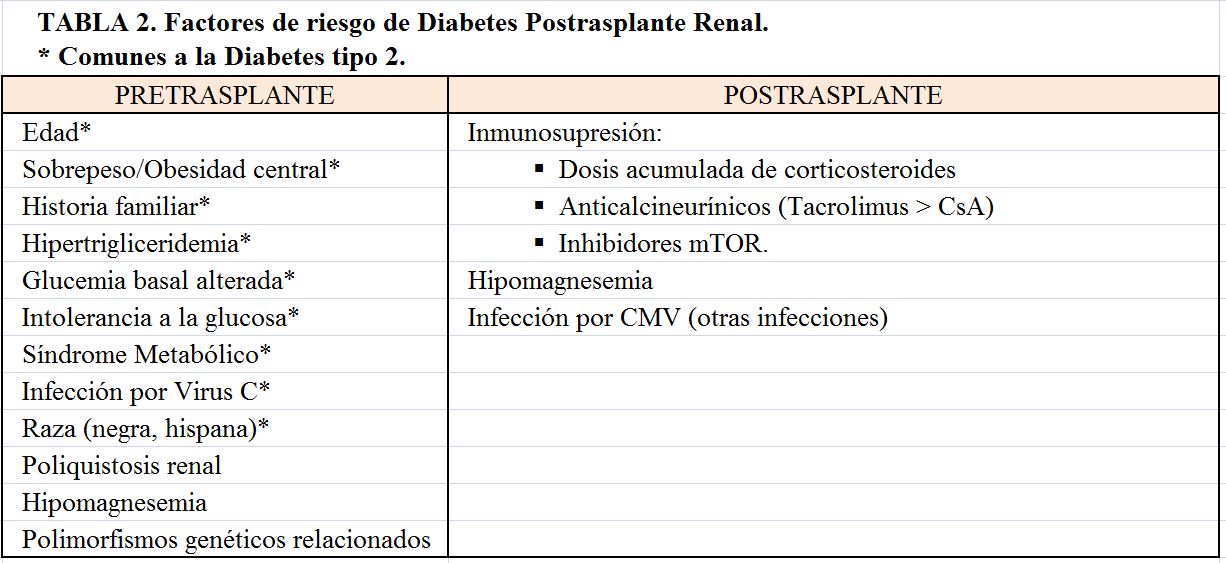
Los factores más importantes de riesgo de DMPT antes del TR son comunes a los de la Diabetes tipo 2: edad, sobrepeso/obesidad central, historia familiar de diabetes, hipertrigliceridemia, glucemia basal alterada, síndrome metabólico, infección por virus de la hepatitis C, y la raza (negra e hispana) [1]. El riesgo se incrementa a medida que lo hace el número de factores de riesgo [5]. Así mismo, la intolerancia a la glucosa en lista de espera, detectable mediante una SOG, multiplica por 2.5 el riesgo de DMPT [6]. También se ha podido asociar el desarrollo de DMPT a una puntuación de riesgo poligénico de la Diabetes tipo 2 en la población general [7], que sugiere una patogénesis similar. Finalmente, un metaanálisis también ha asociado la poliquistosis renal con el desarrollo de DMPT [8].
3.2. Inmunosupresión y riesgo de DMPT.
Se estima que la inmunosupresión explica el 75% del riesgo de desarrollar DMPT [9]. Por tanto, es un factor modificable de importancia para la prevención de la DMPT, siempre que no se incremente el riesgo de rechazo agudo.
Los glucocorticoides inducen resistencia periférica y hepática a la insulina [1] por lo que, en general, una exposición reducida a los mismos es una estrategia útil para prevenir la DMPT. Esto se ha demostrado en la clínica pues una reducción de la dosis de prednisolona de 10 mg/día a 5 mg/día, mejora la sensibilidad a la insulina (medida con el clamp hiperinsulinémico-euglucémico). Sin embargo, su retirada no produjo una mejora adicional en la sensibilidad a la insulina [10]. Esto puede explicar los resultados dispares obtenidos con el efecto de la supresión total de los corticosteroides sobre el metabolismo de la glucosa tras el TR.
Tanto in vitro como in vivo, los fármacos anticalcineurínicos, ciclosporina (CsA) y tacrolimus, han demostrado ser potencialmente diabetógenos [11]. De hecho, la inhibición de la calcineurina evita la traslocación de NFAT (Nuclear Factor of Activated T cells) al núcleo de la célula beta, resultando en una inhibición de la trancripción del gen de la insulina y de otros relacionados con la proliferación celular [12]. En el primer ensayo clínico randomizado que comparó el efecto de CsA y tacrolimus sobre la incidencia de DMPT, se observó que el tratamiento con hipoglucemiantes fue más frecuente en el brazo de tacrolimus (16.8% vs 8.9) [13]. Algo similar se ha observado en ensayos posteriores como el Symphony, aunque la DMPT no era un objetivo primario del estudio [14]. Esto hizo sospechar que tacrolimus tiene efectos tóxicos sobre la célula beta independientemente de su efecto inhibidor de la calcineurina. Posteriormente, Porrini E y col [15] en un estudio retrospectivo observaron que el exceso de DMPT con tacrolimus frente a CsA ocurre en pacientes con un fenotipo de insulinorresistencia antes del TR (hipertrigliceridemia >200 mg/dl). Esto pudo corroborarse en un estudio experimental que comparó los efectos de tacrolimus y CsA en ratas Zucker delgadas insulinosensibles, u obesas con resistencia a la insulina y síndrome metabólico [11] [16]. En las ratas delgadas la administración de CsA o tacrolimus durante 11 días, no indujo modificaciones de la glucemia. En cambio, en las ratas obesas tacrolimus indujo diabetes en el 100% de los animales, y la CsA en el 40% [11] [16]. Estudios in vitro posteriores demostraron que tacrolimus exacerba a nivel del núcleo de la célula beta, los cambios moleculares inducidos por la glucolipotoxicidad inherente a la resistencia a la insulina, haciendo así disminuir su secreción. Estos efectos de tacrolimus son reversibles y mejoran con la sustitución de tacrolimus por CsA [17].
Tacrolimus tiene una estructura química similar a rapamicina, y ambas comparten la misma inmunofilina (FKBP10). Recientemente se ha demostrado que tacrolimus tiene además un efecto inhibidor sobre la vía mTOR, pero solo cuando ésta ha sido previamente estimulada por glucolipotoxicidad. Por tanto, la inhibición de mTOR puede ser un mecanismo adicional de daño a la célula beta inducido por tacrolimus en situaciones de resistencia a la insulina [18].
Los inhibidores de mTOR (rapamicina y everolimus) también se han asociado al desarrollo de alteraciones del metabolismo de la glucosa postrasplante renal [1], especialmente cuando se asocian a anticalcineurínicos [19]. Un estudio experimental ha demostrado que sirolimus reduce la proliferación de la célula beta, así como la producción y secreción de insulina, en situaciones de mayor demanda de insulina como en la insulinorresistencia [20]. Los efectos de una exposición reducida a tacrolimus y everolimus, como la utilizada en el ensayo TRANSFORM [21] sobre la incidencia de DMPT en pacientes con fenotipo de insulinorresistencia no han sido descritos. Por último, el micofenolato, la azatioprina, y el belatacept no tienen efectos negativos sobre el metabolismo de la glucosa.
3.3. Otros factores de riesgo relacionados con el trasplante.
La hipomagnesemia en el primer mes postrasplante, un hallazgo frecuente con el uso de anticalcineurínicos, se ha asociado de manera independiente al desarrollo de DMPT [22]. También la DMPT es más frecuente en los pacientes con niveles de magnesio <2 mg/dl antes del trasplante [23]. La hipomagnesemia reduce la sensibilidad a la insulina en la diabetes tipo 2 y la suplementación de magnesio la mejora [24]. Sin embargo, la suplementación de magnesio en pacientes con niveles de magnesio < 1.7 mg/dl en las dos primeras semanas del TR, no mejoró la resistencia a la insulina ni los niveles de glucosa durante una SOG, con respecto al grupo control [25]. En receptores con hipomagnesemia persistente después de los 4 meses del trasplante, la suplementación de magnesio tampoco mejoró la glucemia, la HbA1c, ni la secreción o resistencia insulínica con respecto al grupo control [26]. Sin embargo, la hipomagnesemia persistente en cualquiera de los dos grupos durante el estudio, se asoció a una menor secreción de insulina así como intolerancia a la glucosa [26]. En resumen, estos estudios sugieren que la hipomagnesemia es más un marcador que una causa de DMPT aunque se requieren estudios donde el brazo de suplementación logre realmente normalizar los niveles de magnesio. Hasta entonces se recomienda medir los niveles de Mg en las primeras semanas del trasplante y corregir la hipomagnesemia con suplementos.
La infección por CMV (y probablemente otras infecciones víricas) también se ha asociado al desarrollo de DMPT pudiendo jugar un papel importante el estado proinflamatorio que genera [1]. La (Tabla 2) resume los factores de riesgo.
4. PATOGÉNESIS.
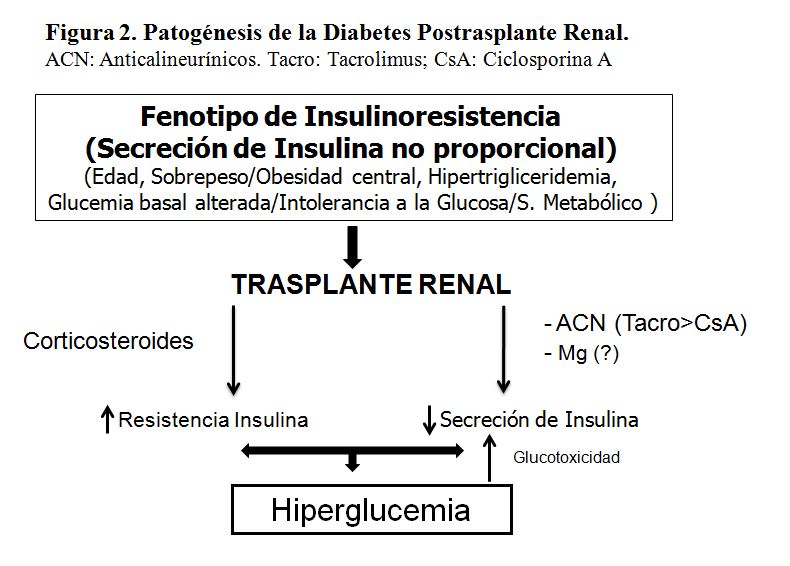
El patrón del paciente en lista de espera de trasplante que va a desarrollar DMPT es típicamente el de un paciente con fenotipo de insulinorresistencia (edad > 45-50 años, sobrepeso/obesidad central, hipertrigliceridemia, glucemia basal alterada o intolerancia a la glucosa, síndrome metabólico, o infección por virus de la hepatitis C) en el que, por efecto de la glucolipotoxicidad sobre la célula beta, la secreción de insulina no es proporcional a la resistencia periférica a la misma. Al exponer a este perfil de pacientes a los inmunosupresores, por un lado empeora la resistencia a la insulina por efecto de los glucocorticoides, y por otro disminuye su secreción por efecto de los anticalcineurínicos (especialmente por tacrolimus) y por el estrés de la cirugía. La hiperglucemia resultante puede ejercer un efecto “glucotóxico” directo sobre la célula beta empeorando aún más la secreción de insulina. Por tanto, la DMPT puede ser considerada una forma acelerada de diabetes tipo 2 (Figura 2), como sugiere el hecho de que compartan los mismos marcadores poligénicos de riesgo [7].
5. DMPT Y RESULTADOS DEL TRASPLANTE RENAL.
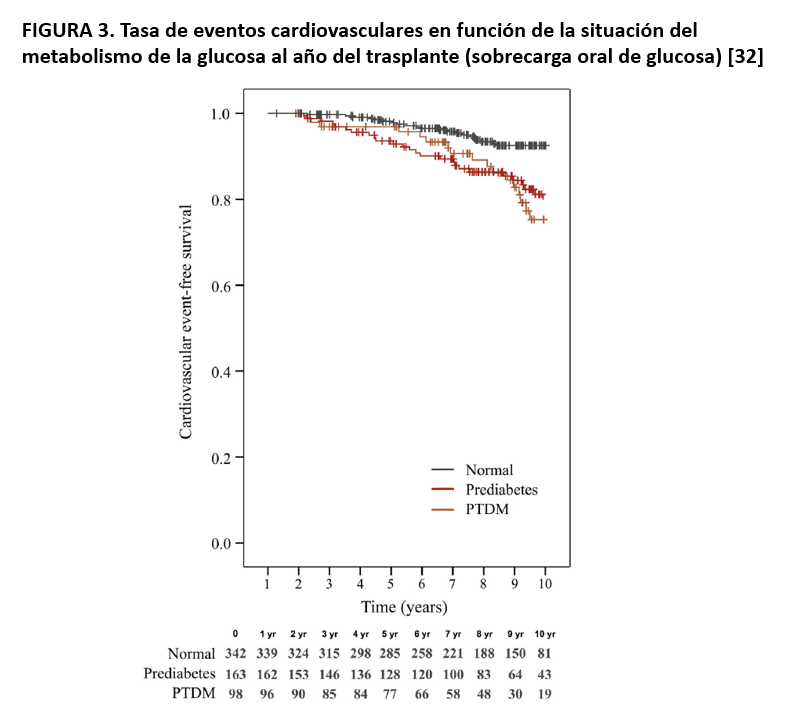
Diferentes estudios retrospectivos han demostrado que la DMPT es un factor de riesgo independiente de mortalidad de cualquier causa [1] [27] [28] [29] aunque no de pérdida de injerto [30]. Un estudio prospectivo que incluyó más de 600 receptores de TR de 7 centros españoles, demostró que la DMPT diagnosticada al año del TR, duplicó el riesgo de eventos cardiovasculares con respecto a la tolerancia normal a la glucosa (HR 2.24; IC 95%: 1.11-4.52) tras ajustar por los diferentes factores de riesgo [31]. Además, este estudio demuestra por primera vez que los receptores diagnosticados de “prediabetes” al año del TR, definida como glucosa basal alterada o/y una SOG patológica, tuvieron un riesgo similar a los pacientes con DMPT (HR 2.11; IC 95%: 1.14-3.93) (Figura 3). La explicación de este hallazgo puede residir en que la prediabetes, un factor de riesgo cardiovascular reconocido, pasa desapercibida en la mayoría de los casos si no se realiza una SOG, no dando opción a las intervenciones necesarias. En suma, estos resultados demuestran que la prevención y el tratamiento de la prediabetes y de la DMPT son importantes para reducir el riesgo cardiovascular y mejorar la supervivencia después del TR.
Finalmente, en esta misma cohorte española se ha demostrado una relación independiente entre DMPT y cáncer renal (OR 2.92; IC95%: 1.03-8.27) aunque no con otros tipos de cáncer [32].
6. PREVENCIÓN.
6.1 Identificación de los pacientes en riesgo en la lista de espera de trasplante.
En los pacientes con alguno de los factores de riesgo comunes a la diabetes tipo 2 (Tabla 2), en especial cuando se acumula más de uno, el riesgo de desarrollar prediabetes o DMPT se incrementa considerablemente [5]. Un estudio prospectivo reciente ha puesto en evidencia que el índice de masa corporal (IMC) pretrasplante es una variable robusta para predecir la existencia de prediabetes o DMPT al año del trasplante, con una similar capacidad diagnóstica que la glucemia a los 120 min de una SOG [33]. Mediante curvas ROC se pudo demostrar que un IMC de 28.5 Kg/m2 fue el punto de corte idóneo, permitiendo el diagnóstico de 10 casos de prediabetes o DMPT por cada 25 sujetos testados antes del trasplante (nº necesario para diagnosticar de 2.5) [33]. Estos resultados sugieren que las intervenciones para reducir el IMC en lista de espera de trasplante renal pueden ser un área de mejora para reducir de manera relevante el riesgo. En este sentido, se necesitan estudios de intervención bien diseñados, escalonando actividad física y dieta con nuevos fármacos como los arGLP-1.
En casos de obesidad refractaria que suponga un obstáculo para el TR (IMC>=35 Kg/m2) se podría recurrir a los agonistas duales de los receptores de GLP-1 y GIP (Tirzepatida) aunque aún no existe suficiente experiencia en esta población, y la cirugía bariátrica tipo gastrectomía en manga ha demostrado buenos resultados [34].
6.2 Prevención tras el TR
6.2.1 Adaptación de la inmunosupresión: Una vez que un paciente de riesgo llega al TR debe procurarse una inmunosupresión adaptada a reducir el riesgo de DMPT sin que implique un aumento del riesgo de rechazo agudo. En este sentido los resultados de un ensayo clínico multicéntrico español aportan información útil [9]. Se incluyeron 128 pacientes con TR de novo, de bajo riesgo inmunológico, aleatorizados a 3 brazos: a) Tacrolimus y micofenolato mofetil (MMF) con retirada rápida de corticosteroides en una semana; b) Tacrolimus y MMF con exposición reducida a corticosteroides (descenso rápido hasta llegar a los 5 mg/día de prednisona en la 5ª semana del TR, con la opción de supresión a partir del 6º mes); y c) Cislosporina A (CsA) y MMF con exposición reducida a corticosteroides. Los 3 brazos recibieron 2 dosis de basiliximab como inducción. Al año del TR la tasa más baja de DMPT se observó en el brazo de CsA (9.7%) pero a expensas de una mayor tasa de rechazo agudo (21%). Por otro lado, el brazo de tacrolimus con retirada rápida de corticosteroides no ofreció ventajas con respecto al de tacrolimus y minimización de corticosteroides en términos de incidencia al año de DMPT (37.8% vs 27.5%, respectivamente) o de rechazo agudo (11.4% vs 4.8%, respectivamente) [9]. En resumen, la inducción con basiliximab junto con tacrolimus, MMF, y exposición reducida a corticosteroides, parece ser la pauta de inmunosupresión que aporta el mejor balance entre DMPT y rechazo agudo en pacientes identificados como de alto riesgo de DMPT, y bajo riesgo inmunológico.
Un aspecto poco explorado es si las diferencias farmacocinéticas entre distintas formulaciones de tacrolimus tienen alguna influencia sobre el daño a la célula beta y la frecuencia de alteraciones del metabolismo de la glucosa postrasplante en pacientes con riesgo elevado. En un estudio piloto, randomizado y abierto, se compararon tacrolimus de liberación inmediata (2 dosis/día; n=27) que da lugar a un pico temprano de niveles post-dosis, frente a LCPT de absorción prolongada, que muestra una curva tiempo concentración más suave y mayor biodisponibilidad (n=25). No se encontraron diferencias significativas en la incidencia de Prediabetes o DMPT a los 3 meses. Sin embargo, a pesar de una mayor exposición a tacrolimus en el brazo LCPT, la incidencia de tolerancia normal a la glucosa fue un 15% superior, mientras que la tasa de rechazo agudo comprobado con biopsia fue menor (0 vs 3 eventos) frente a tacrolimus de absorción inmediata [35]. Se necesitan estudios con adecuado poder estadístico que demuestren estas diferencias observadas en el estudio piloto.
6.2.2 Detección de la hiperglucemia: Los pacientes con mayor riesgo de DMPT se benefician de una mayor vigilancia y control de la glucemia durante la hospitalización y los tres primeros meses del TR. Una vez de alta de hospitalización se recomienda la automedida de la glucemia capilar vespertina pues el mayor efecto de los corticosteroides sobre la glucemia se observa a las 8-12 horas de su administración. Una glucemia capilar aleatoria vespertina >=200 mg/dl es más sensible que la glucemia en ayunas para el diagnóstico de DMPT [36]. No se recomienda el uso de la HbA1c para el despistaje de la DMPT hasta que pasen 6-12 meses del trasplante por las razones ya comentadas.
6.2.3 Reducción de la “glucotoxicidad” de la célula beta: Se ha sugerido que la hiperglucemia, detectada con frecuencia durante la hospitalización del implante, puede por sí misma ser tóxica para la célula beta, y favorecer la aparición de DMPT. El control precoz de la glucemia con tratamiento insulínico podría permitir el “reposo” de la célula beta durante la primera semana, fase de más estrés del posoperatorio. Los resultados de un ensayo clínico aleatorizado y controlado que incluyó 104 pacientes sugiere que el control glucémico intensivo perioperatorio (glucemias diana de 70-110 mg/dl durante 3 días) puede ser incluso perjudicial asociándose a una mayor tasa de hipoglucemias y rechazo agudo a largo plazo, comparado con el estándar de práctica clínica (glucemia diana <180 mg/dl) [37]. Otro ensayo clínico comparó 130 pacientes aleatorizados a recibir tratamiento insulínico intensivo (insulina NPH si la glucemia vespertina al tercer día era ≥140 mg/dl) desde el posoperatorio, con 133 tratados según el estándar de práctica clínica [38]. Por intención de tratar la tasa de DMPT al año fue similar en ambos grupos (12.2 vs 14.7%) [38]. Solo por protocolo y ajustando por Poliquistosis Renal se observó una diferencia significativa a favor de grupo de intervención que por otro lado sufrió más episodios de hipoglucemia [38]. Aunque se trata de un estudio no concluyente, nosotros recomendamos durante la hospitalización del TR iniciar tratamiento con insulina rápida cuando la glucemia capilar es ≥ 180 mg/dl y en los pacientes de riesgo cuando es ≥ 160 mg/dl.
6.2.4 Detección y control de la prediabetes tras el TR: Finalmente, una SOG al año del TR puede ser una herramienta útil para capturar todo el espectro de pacientes con prediabetes (Tabla 1), realizar las intervenciones adecuadas, y reducir la enfermedad cardiovascular [31] [39]. También un “Indice Triglicéridos-Glucosa” (Ln [TG (mg/dL) × glucosa)/2] después del año del TR, un marcador subrogado de resistencia a la insulina, incrementa 2.1 veces el riesgo de eventos cardiovasculares [40].
7. TRATAMIENTO.
7.1 Hiperglucemia precoz (primeras semanas)
En los pacientes que desarrollan hiperglucemia en los primeros días del TR es razonable comenzar tratamiento con insulina rápida cuando la glucemia capilar es ≥ 180 mg/dl como recomienda la ADA [41]. Como las consecuencias de la glucotoxicidad para la célula beta pueden ser peores en los pacientes de riesgo, en estos casos recomendamos comenzar la insulina cuando la glucemia capilar es ≥160 mg/dl. Con esta estrategia la mayoría de los pacientes van reduciendo sus glucemias y tras los primeros días del estrés de la cirugía no requieren insulina ni otros antidiabéticos. En otros pacientes el perfil de glucemia capilar permite disminuir las dosis de insulina prefiriéndose pasar a otros antidiabéticos cuando se requieran menos de 20 U de insulina al día. En general, debe medirse la glucemia preprandial y el pico postprandial siendo las dianas de 80-130 mg/dl y <180 mg/dl, respectivamente. No se recomienda utilizar en esta fase la HbA1c como diana de control glucémico. El ajuste más importante de la inmunosupresión en pacientes con factores de riesgo de DMPT y de bajo riesgo inmunológico, es el inicio de la reducción progresiva de los corticosteroides hasta alcanzar los 5 mg/día de prednisona a la 5ª semana del TR [9]. También en este grupo de pacientes es relevante evitar niveles de tacrolimus que superen los 12 ng/ml. Con la reducción paulatina de la inmunosupresión un porcentaje significativo de pacientes con hiperglucemia revierten a partir de los 3 meses del trasplante (Figura 1).
7.2 Agentes hipoglucemiantes:
7.2.1 Insulina: el tratamiento con insulina es necesario cuando existe un deterioro importante de su secreción. Puesto que los pacientes con DMPT muestran con frecuencia un pico de hiperglucemia por la tarde seguido por glucemias en ayunas normales, las insulinas de acción intermedia pueden ser más apropiadas al menos cuando se reciben dosis más elevadas de corticosteroides [42]. En los enfermos con enfermedad cardiovascular establecida, o frágiles, con riesgo de hipoglucemias, se recomienda la insulina glargina o degludec. La dosis calculada de insulina basal debe reducirse un 25% cuando el eGFR es de 15-60 ml/mn y del 50% cuando es < 15 ml/mn.
7.2.2 Metformina (MTF): la MTF, si no está contraindicada y es bien tolerada, sigue siendo un fármaco de primera línea para el tratamiento de la Diabetes tipo 2 [3] [41] [42]. La MTF disminuye la producción hepática de glucosa y actúa en el intestino incrementando la utilización de la glucosa, la producción de GLP-1, y alterando favorablemente el microbioma [42]. La mejoría de la sensibilidad a la insulina, que se encuentra disminuida en los pacientes con prediabetes o DMPT [33] y la ausencia de interacciones con los inmunosupresores, la hacen un fármaco apropiado en esta circunstancia. Sus mayores efectos secundarios son los digestivos que pueden sumarse a los del micofenolato mofetil, así como la acidosis láctica. La MTF es de eliminación renal y no debe utilizarse con filtrados inferiores a 30 ml/mn, o en las primeras semanas del trasplante que pueden estar sujetas a cambios bruscos de la función renal. Se dispone de información insuficiente sobre la eficacia de la MTF en el trasplante renal. La dosis máxima de MTF debe reducirse con filtrados entre 45-59 ml/mn/1.73 m2, y se debe reducir en un 50% entre 30-45 ml/mn/1.73m2.
7.2.3 Sulfonilureas (SU): Las SU estimulan la secreción de insulina de manera independiente a los niveles de glucosa por lo que se asocian a una mayor incidencia de hipoglucemias. Estudios experimentales han mostrado además efectos nocivos sobre la célula beta. Las SU que no se acumulan con el deterioro de función renal son la glipizida y la glimepirida.
7.2.4 Glinidas: Las glinidas también estimulan la secreción de insulina pero tienen una acción más corta que las SU. Pueden producir hipoglucemia pero con menor frecuencia que las SU. La repaglinida es la más útil de este grupo en la DMPT pues es de eliminación principalmente hepática, ha demostrado ser eficaz en el control glucémico, y no interfiere con los inmunosupresores [43]. En los pacientes con filtrado ≥40 ml/mn no se precisan ajustes de dosis y se puede comenzar con 0.5 mg antes de cada comida. Existe poca información sobre repaglinida en pacientes con filtrados < 20 ml/mn, y también hay que considerar que puede inducir aumento de peso.
7.2.5 Tiazolidindionas (TZD): Las TZD mejoran la sensibilidad hepática y periférica a la insulina, no necesitan ajuste de dosis en la insuficiencia renal, y no interfieren con el metabolismo de los inmunosupresores. Sin embargo, sus efectos secundarios como la retención hidrosalina y el riesgo de fracturas las hacen de poca utilidad para el tratamiento de la DMPT [42].
7.2.6 Inhibidores de DPP-4 (iDPP-4): a través de la inhibición de DPP-4, enzima responsable de la degradación de las incretinas (GLP-1 y GIP), estos fármacos incrementan la secreción de insulina dependiente de glucosa. Excepto la Linagliptina, que es eliminada por vía biliar, los iDPP-4 son eliminados por el riñón y requieren ajuste de dosis con deterioros moderados severos de la función renal. Los iDPP-4 tienen un efecto neutro sobre los eventos CV, la insuficiencia cardíaca, y el peso, y no producen hipoglucemias. La Linagliptina ha demostrado reducir la progresión de la albuminuria [44]. Los iDPP-4 no tienen un efecto significativo sobre en el metabolismo de tacrolimus y los anti-mTOR, a excepción de la sitagliptina que incrementa los niveles de CsA y la vildagliptina que disminuye los de tacrolimus [45]. En estos casos deben vigilarse los niveles de anticalcineurínicos tras iniciar el tratamiento. En diferentes estudios la linagliptina, la sitagliptina, y la vildagliptina han demostrado reducciones de la glucemia en ayunas y postprandial, y de la HbA1c, en pacientes con DMPT [46] [47] [48]. Una revisión sistemática y metaanálisis de cinco estudios en pacientes con DMPT demostró que los iDPP-4 tienen un efecto glicémico favorable en comparación con placebo u otros agentes hipoglucemiantes tras 6 meses de tratamiento [49]. Finalmente, en un estudio controlado con placebo se investigó si una intervención temprana con sitagliptina durante los primeros 3 meses del TR previene la DMPT o su severidad. No se demostró una reducción significativa de la glucemia a los 120 mn de una SOG, a los 3 o 6 meses del TR [50].
7.2.7 Nuevos tratamientos de la Diabetes tipo 2 en la DMPT:
- Inhibidores del cotransporte sodio-glucosa (iSGLT2): los iSGLT2 incrementan la excreción urinaria de glucosa y han demostrado reducir la glucemia y HbA1c. Aunque su efecto hipoglucemiante se reduce con filtrados <60 ml/mn, su eficacia se mantiene hasta un filtrado de 30 ml/mn [51] [52]. En numerosos ensayos clínicos controlados, con un elevado número de pacientes con DM tipo 2, los iSGLT2 han demostrado reducir el peso, la tensión arterial, los eventos cardiovasculares, la muerte de cualquier causa, y las hospitalizaciones por insuficiencia cardíaca, y prevenir la progresión de la enfermedad renal [51] [52] [53]. Este efecto nefroprotector también se ha demostrado en la ERC proteinúrica no diabética [53]. Si estos beneficios se proyectasen a los receptores de un TR, el impacto sobre la supervivencia del paciente e injerto puede ser significativo. En el ámbito de pacientes inmunosuprimidos, debe tenerse especial cuidado con las infecciones genitales, cuyo riesgo se ve incrementado 3 veces con respecto al placebo en los pacientes tratados con iSGLT2 [54]. En varias revisiones sistemáticas y metaanálisis los iSGLT2 como grupo, no incrementaron el riesgo (o solo se observó una tendencia) de infecciones urinarias frente a placebo o comparador activo [54] [55] [56]. Sin embargo, en la mayoría de los ensayos clínicos con iSGLT2, no se han comunicado por separado las infecciones urinarias no complicadas y complicadas. Por tanto, no se aconseja utilizar este grupo de fármacos en los receptores de TR en su fase de mayor inmunosupresión (primeros 3-6 meses), o con riesgo de infecciones urinarias (complicaciones urológicas, sondajes prolongados, catéteres doble J, o antecedentes de infecciones urinarias especialmente por gérmenes multirresistentes) o genitales.
Solo se ha publicado un único estudio randomizado, controlado y doble ciego en el que se incluyeron 44 pacientes con DMPT y filtrado >30 ml/mn, que recibieron empaglifozina o placebo, durante 24 semanas [57]. El grupo de empaglifozina mostró una mejoría del control glucémico y descenso de peso, sin cambios en el filtrado ni en los niveles de tacrolimus. Tampoco existieron diferencias en los efectos adversos, especialmente las infecciones urinarias o genitales, aunque se trata de un estudio con un número de pacientes y seguimiento limitados. En un estudio retrospectivo multicéntrico reciente se compararon 1.857 pacientes con DM pre o postrasplante tratados sin iSGLT2 con 226 que lo recibieron durante 90 días o más, con un período de seguimiento medio de 63 meses [58]. En el análisis multivariante, después de emparejar 1:3 por índice de propensión, se observó que el uso de iSGLT2 mejoró la variable compuesta de mortalidad de cualquier causa, pérdida de injerto censurada para la muerte del paciente, y duplicación de la creatinina plasmática [58]. No se observaron diferencias entre los grupos en la tasa de infecciones urinarias bacterianas o fúngicas, pero los autores no mostraron la tasa de infecciones micóticas genitales [58]. En resumen, estos resultados sugieren que los efectos beneficiosos descritos en población no trasplantada se mantienen en los receptores de un TR. Es interesante resaltar que un 15.6% de los pacientes con iSGLT2 experimentaron un descenso agudo reversible del filtrado siendo los factores de riesgo un menor tiempo postrasplante y unos niveles de tacrolimus más elevados [57]. Esto sugiere que para evitar este factor de confusión, sería más apropiado iniciar los iSGLT2 una vez se estabilicen la función renal y los niveles de tacrolimus. Sin embargo, estudios recientes han puesto de manifiesto que los iSGLT2 pueden ser de hecho protectores frente al daño renal agudo [59]. Esta es sin duda un área de interés donde se precisan estudios controlados futuros. Finalmente, un estudio multicéntrico español analizó la eficacia y seguridad de los iSGLT2 en 339 receptores de TR tratados durante 6 meses; se observó una reducción del peso, TA, HbA1c (0.36%) y de la proteinuria [60]. La tasa de infecciones urinarias fue del 14%, y un 10% de pacientes suspendió el tratamiento por este motivo. Finalmente la tasa de infecciones micóticas genitales fue del 1.5%. En resumen, estos estudios demuestran la seguridad de estos nuevos antidiabéticos en el TR, y su perfil de efectos adversos.
- Agonistas del receptor de GLP-1 (arGLP-1): estimulan la secreción de insulina mediada por glucosa, reducen el vaciamiento gástrico, disminuyen el apetito y el peso, y ejercen efectos protectores sobre la célula beta mejorando el control glucémico en la diabetes tipo 2 [61]. Otro efecto beneficioso es la reducción de la tensión arterial, de la mortalidad de cualquier causa, mortalidad cardiovascular, infarto de miocardio no fatal, y la insuficiencia renal [61]. Existen dos diferencias notables entre los iSGLT2 y los arGLP-1: los iSGLT2 reducen los ingresos hospitalarios por insuficiencia cardíaca más que los arGLP-1, mientras que estos reducen más que los iSGLT2 el ictus no fatal (sobre los que no parecen tener ningún efecto los iSGLT2) [61]. En general los arGLP-1 son especialmente útiles en pacientes con obesidad o sobrepeso con comorbilidades relacionadas con el mismo. En la DM PT, además de un defecto de secreción de insulina, existe un defecto en la inhibición de la secreción de glucagón mediada por glucosa. Al mejorar ambos defectos, los ar-GLP-1 son un tratamiento muy atractivo en la DMPT [42] [62] [63]. Aunque los arGLP-1 tienen un aclaramiento renal, la liraglutida, semaglutida, y dulaglutida pueden utilizarse hasta un filtrado de 15 ml/mn. En España los arGLP-1 solo están financiados si el IMC es > 30 Kg/m2. La experiencia publicada en pacientes con DMPT es limitada no existiendo estudios randomizados y controlados. La dulaglutida ha demostrado ser beneficiosa en receptores de TR reduciendo el peso, la HbA1c, y los requerimientos de insulina [64]. En un estudio más amplio que incluyó 118 pacientes con trasplante de órgano sólido se observó que los arGLP-1 reducen la HbA1c (-0.8%) y el peso con una baja incidencia de efectos adversos [65]. Los niveles de tacrolimus no se ven modificados con estos fármacos [66].
7.3 Manejo integral de la DMPT
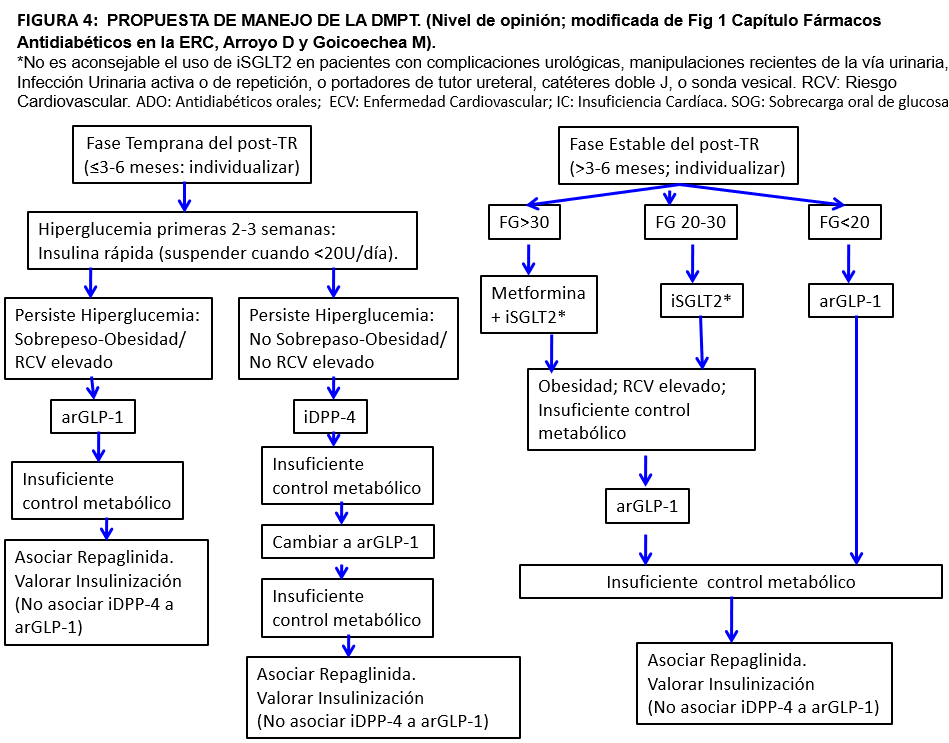
El objetivo del control de la DM tipo 2 en la población general es prevenir las complicaciones microvasculares que tardan 10-15 años en desarrollarse. En la DMPT, sin embargo, el objetivo es prevenir los eventos cardiovasculares que comienzan a hacerse evidentes, con respecto a los receptores con tolerancia normal a la glucosa, a partir de los 3-5 años del TR (Figura 3). Por tanto, la extrapolación de los resultados de los ensayos clínicos con nuevos fármacos antidiabéticos (iSGLT2 y arGLP-1) en población diabética no trasplantada a los receptores de TR, puede significar una mejoría notable en los resultados. Por otro lado, y aunque no existen estudios randomizados y controlados, la información disponible sobre la seguridad de estos fármacos en el contexto de pacientes inmunosuprimidos con TR resulta tranquilizadora. Adicionalmente, tanto los iSGLT2 como los arGLP-1, tienen efectos protectores tanto in vitro como in vivo, sobre la toxicidad de tacrolimus a nivel de la célula beta [66] [67]. Finalmente, el 70% de los receptores de TR en su fase estable, tienen un filtrado menor de 60 ml/mn/1.73m2 [68]. Por todas estas razones resulta conveniente aplicar la nueva Guía de Práctica Clínica KDIGO 2022 sobre el manejo de la DM en la ERC [69] haciendo salvedades puntuales por las características del paciente trasplantado (Figura 4).
También puede consultarse el Capítulo de Nefrología al Día sobre Fármacos Antidiabéticos en la ERC (Arroyo D, Goicoechea-Diezandino M).
Estilo de vida: Debe incluir el control de la dieta, ejercicio físico regular, control del peso y cese del tabaco.
Elección de los hipoglucemiantes: Siguiendo la Guía KDIGO 2022, como primera línea se recomienda un iSGLT-2, siempre que el filtrado sea ≥20 ml/mn/1.73m2, más Metformina cuando el filtrado sea >30 ml/mn/1.73m2. En las primeras semanas o meses del TR la metformina puede producir alteraciones digestivas que pueden sumarse a las del micofenolato mofetil y existe más riesgo de cambios bruscos del filtrado. Por otro lado, el uso de iSGLT2 en estas etapas iniciales aumenta el riesgo de inducir un descenso hemodinámico del filtrado [58] y la mayor intensidad de la inmunosupresión puede favorecer las infecciones urinarias y genitales. Los iSGLT2 tampoco deben iniciarse en pacientes con infecciones urinarias frecuentes, manipulaciones recientes de la vía urinaria, o con complicaciones urológicas (portadores de tutor ureteral, catéter doble J, o sonda vesical). La alternativa aconsejada en esta fase es un arGLP-1, especialmente en caso de obesidad, riesgo cardiovascular elevado o insuficiente control metabólico, o un iDPP-4, además de insulina si fuera necesaria para el control glucémico (Figura 4).
7.4 Manejo de las comorbilidades:
Al tratarse de una población con elevado riesgo cardiovascular, las comorbilidades y los factores de riesgo cardiovascular deben tratarse de manera agresiva. La educación diabetológica y los cambios en el estilo de vida propios de la diabetes de la población general son básicos, y se recomienda el uso de ácido acetilsalicílico como prevención primaria [42]. La dislipidemia debe tratarse para alcanzar una diana de LDL-c <100 mg/dl ó <130 mg/dl de no-HDL-colesterol mediante cambios en el estilo de vida, y estatinas con eventual adición de ezetimiba. Aunque las estatinas tienen un efecto diabetógeno, los beneficios cardiovasculares exceden el riesgo de empeorar el metabolismo de la glucosa. La hipertrigliceridemia debe tratarse con ácidos omega y cambios de estilo de vida pues los fibratos pueden empeorar la función renal en pacientes con deterioro previo de la misma. La diana de tensión arterial debe ser ≤130/80 mmHg recomendándose en las primeras fases del trasplante los calcioantagonistas. Una vez estabilizada la función renal, los IECA o ARA son muy eficaces especialmente en los pacientes con proteinuria.
7.5 Manejo de la Prediabetes.
La “Prediabetes” detectada al año del trasplante es un factor de riesgo cardiovascular similar al de la propia DMPT [31] (Figura 3). Por tanto, recomendamos el uso de una sobrecarga oral de glucosa en ese punto con el fin de captar los enfermos con intolerancia a la glucosa.
No existen estudios que demuestren cómo deben ser tratados estos pacientes. El estudio randomizado CAVIAR, comparó una intervención consistente en cambios nutricionales y de la conducta, frente a estándar de práctica clínica [70]. Después de 6 meses no se observaron diferencias significativas en los distintos parámetros del metabolismo de la glucosa. La mayor limitación de este estudio es que solamente el 23% de los pacientes mostraba intolerancia a la glucosa al comienzo del mismo. En nuestro centro se ha finalizado un estudio prospectivo utilizando una intervención estructurada, incremental y supervisada, de actividad física en pacientes diagnosticados de Prediabetes mediante SOG [71]. Sus resultados preliminares demuestran que el 60% de los pacientes revirtieron a tolerancia normal a la glucosa a los 6 meses [72]. Bajo el punto de vista del tratamiento farmacológico son muy interesantes las posibilidades de los fármacos antidiabéticos que han demostrado efectos cardioprotectores, como los iSGLT2 y los ar-GLP1, aunque aún no existen estudios disponibles, ni la prediabetes figura como indicación en su ficha técnica. Hasta que se disponga de más información sobre el manejo de la Prediabetes postrasplante renal, recomendamos una intervención cardioprotectora intensiva multidiana con cambios en el estilo de vida y control intensivo de la hipertensión y dislipidemia.