Coronavirus y riñón. Actualización enero 2022
1. Introducción
2. Enfermedades por coronavirus
3. Fisiopatología de la infección COVID-19
4. Aspectos clínicos generales de la enfermedad COVID-19
5. Estadios de la enfermedad COVID-19
6. Afectación orgánica de la enfermedad COVID-19
6.1. Afectación pulmonar
6.2. Enfermedad cardiovascular
6.3. Afectación renal
6.3.1. Epidemiología del daño renal en la infección por Sars-Cov-2
6.3.2. Datos histológicos renales en la infección por Sars-Cov-2
6.3.3. Fisiopatología del daño renal en la infección por Sars-Cov-2
6.3.4. Insuficiencia renal aguda asociada a las interacciones de órganos
6.3.5. Daño renal a largo plazo: fibrosis renal post Covid-19
7. Vacunas
7.1 Tipos de vacunas y respuestas frente al Sars-Cov-2
7.2 Datos obtenidos de la experiencia clínica durante 2020-2021
7.3 Pérdida de eficacia de la vacuna mRNA
7.4 Tercera dosis (booster shot): claramente necesaria y eficaz
7.5 Vacunación heteróloga
7.6 Vacunación en adolescentes
7.7 Vacunación en niños
7.8 Miocarditis y vacunas
7.9 Vacunación en pacientes con enfermedad renal crónica
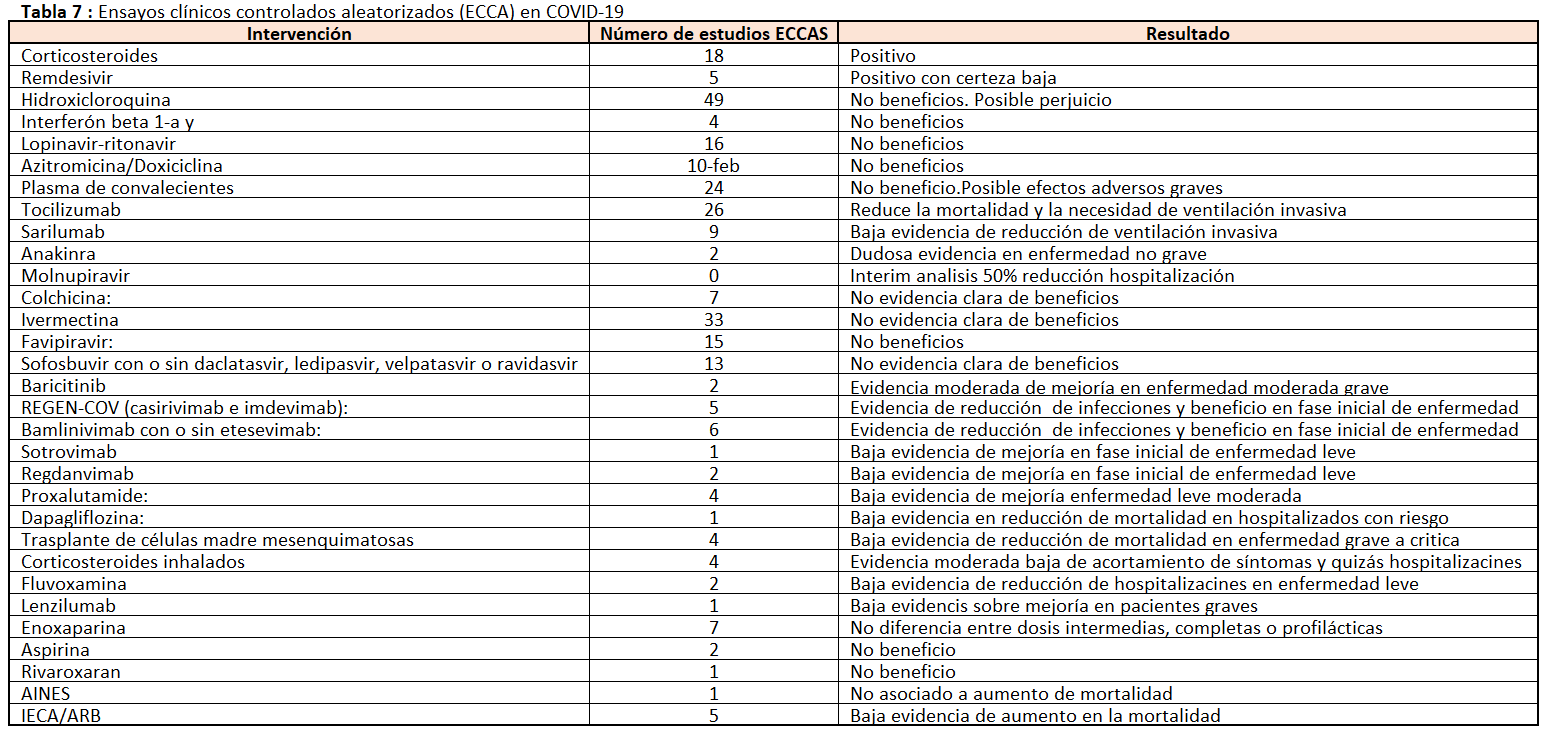
8. Tratamientos de la infección COVID-19
9. Ómicron
10. COVID persistente y enfermedad renal
11. Próximo y urgente reto : Vacunas universales contra coronavirus
RESUMEN
La enfermedad por coronavirus Covid-19 está originada por el virus SARS-CoV-2 y ya ha afectado a más de 300 millones de personas en el mundo con 5,5 millones de muertos cuando actualizamos este capítulo. Se transmite por las gotitas-aerosoles exhaladas al hablar o toser tanto por personas asintomáticas como sintomáticas con un periodo medio de incubación de cinco días. El diagnóstico se hace por PCR aunque hay falsos negativos hasta un 40% dependiendo de la fase de la enfermedad y de los errores técnicos en la obtención y transporte de la muestra. Hay hasta un 40% de pacientes asintomáticos y otro 40% con síntomas leves. Inicialmente un 20% precisaban ingreso hospitalario con sepsis e insuficiencia respiratoria y un 5% soporte respiratorio en la UVI con una mortalidad en estos de un 50%, datos que se han reducido a medida que avanzaba la pandemia con hasta seis olas diferentes y se introducía la vacunación.
La clínica más frecuente es fiebre, malestar de garganta, tos seca y dificultad para respirar, aunque tras diversas olas y variantes la clínica se ha ido modificando en parte. Las anomalías radiográficas y de laboratorio, como linfopenia y elevación de lactato deshidrogenasa son comunes, pero inespecíficas. La afectación neumónica inicial fue lo más frecuente en variantes iniciales por infección de los neumocitos tipo 2, activación de macrófagos y alveolitis. Hay en casos graves una respuesta inflamatoria severa que conduce junto a la agresión endotelial directa del virus al desarrollo de microtrombosis arteriolar y trombosis venosa. En estadios graves, la afectación es multisistémica con miocarditis, ictus, daño renal agudo, alteraciones hepáticas e incluso, síndrome multinflamatorio en niños.
El diagnóstico se hace mediante PCR o test de antígenos que pueden ser negativos durante los 3-5 primeros días después del contagio. El resultado positivo de una prueba de antígeno se considera preciso cuando las instrucciones se siguen detenidamente. Un resultado negativo significa que es posible que no tenga una infección. Repetir la prueba con al menos 24 horas aumentará la confianza de que no está infectado.
El tratamiento para individuos con COVID-19 moderado-grave incluye el manejo de apoyo de la insuficiencia respiratoria hipóxica aguda. La dexametasona reduce la mortalidad a los 28 días en pacientes que requieren oxígeno suplementario (21,6% frente a 24,6%). El remdesivir parece mejorar el tiempo para recuperación de 15 a 10 días y disminuye la mortalidad del 11,9% a 7,1% pero con otros estudios como el de la OMS no tan favorables. Datos más recientes apoyan un beneficio de remdesivir aplicado los primeros días. Estudios observacionales sobre anticoagulación también han resultado positivos. La EMA ha recomendado la autorización de varios anticuerpos monoclonales frente al coronavirus. Se trata de tratamientos que han de utilizarse durante las primeras fases de la infección, en pacientes de riesgo que no requieran oxigeno suplementario. La última variante ómicron con más de 30 mutaciones en el pico parece alterar la respuesta a estos anticuerpos monoclonales con excepción del sotrovimab y también resiste al plasma convaleciente.
Hay centenares de estudios en marcha con inmunoglobulinas, antivirales, suero de convalecientes y otros. Dos antivirales orales han sido aprobados de emergencia, sin terminar el estudio, en pacientes de riesgo en fase inicial de la enfermedad con disminución de hospitalización en un 30% (Molnupiravir, Merck ) o 89% (Paxlovid, Pfizer). La llegada de las vacunas a finales de 2020 y particularmente aquellas basadas en mRNA, muy innovadoras, ha cambiado totalmente la evolución de la pandemia. No obstante, parecen necesarias más de dos dosis por pérdida de efectividad a los 4-6 meses, por lo que se requiere un booster o tercera dosis y una cuarta dosis en pacientes inmunosuprimidos. Los métodos principales para reducir la propagación continúan siendo las mascarillas de FFP2, el distanciamiento social, los tests y el rastreo de contactos. Una pandemia global precisa de una solución global pero aunque en este momento ya se han administrado casi 10.000 millones de vacunas aún estamos lejos de esa solución global, pues su reparto no es equitativo con respecto a países en desarrollo. Y eso es lo que puede modificar la evolución de la pandemia con la variante sudafricana ómicron ya dispersa por el mundo y que parece ser menos virulenta en un mundo vacunado, pero resistente a vacunación de dos dosis. El contagio de millones de `personas con ómicron puede favorecer una inmunización colectiva y quizás con nuevas vacunas esterilizantes intranasales y terapia precoz antiviral entre otras medidas pueda favorecer el paso de pandemia a endemia. Como decimos al final, es necesaria una vacuna universal contra todos los coronavirus. Ese es el reto.
1. INTRODUCCIÓN
En diciembre de 2019 fue reconocido un nuevo coronavirus SARS-CoV2 o 2019-nCoV, identificado como causante de la enfermedad respiratoria aguda denominada COVID-19 y reportada en 27 pacientes con neumonía de causa no filiada en Hubei (China) [1]. Este virus, un virus RNA betacoronavirus, está muy relacionado con el virus causante de síndrome respiratorio agudo severo (SARS) [2], que apareció en 2002 y 2003, y con el síndrome respiratorio del Medio Oriente (MERS) en 2012 [3]. Se trata de una enfermedad que condiciona muchos retos de prevención y control ya que es fácilmente transmisible y se complica en más de la mitad de los casos con procesos respiratorios agudos de neumonía. La evolución en el mundo de esta pandemia ha ido creciendo exponencialmente. Los datos actualizados epidemiológicos de forma permanente se ofrecen en Worldometer Coronavirus Uptdate Johns Hopkins Coronavirus Resources [4] que en enero 2022 muestra 300 millones de personas infectadas en el mundo con casi 6 millones de muertos.
La afectación de la infección por SARS-CoV2 es multiorgánica y tiene varias fases en las que puede verse afectación renal. El interés en nefrología no sólo se centra en las alteraciones renales ocurridas durante la enfermedad Covid 19, como microtrombosis, infarto renal o insuficiencia renal aguda (IRA) entre otras, sino en la importancia de la enfermedad en pacientes en tratamiento renal sustitutivo. Nos referimos a pacientes en diálisis y a aquellos aspectos relacionados con el trasplante renal, tanto desde la vertiente de la enfermedad en el paciente trasplantado inmunosuprimido como en aquellos relacionados con la donación de órganos. Asimismo en la posibilidad de enfermedad renal crónica durante el Covid persistente.
Para evitar confusiones, a lo largo del texto usaremos los términos SARS, MERS y COVID-19 cuando hagamos referencia a las afecciones mencionadas, sea el nombre del virus o el nombre de la enfermedad.
2. ENFERMEDADES POR CORONAVIRUS
2.1 SARS COV 1
En febrero de 2003, la Organización Mundial de la Salud (OMS) acuñó una nueva enfermedad como síndrome respiratorio agudo severo (SARS) que emergió en Cantón (China). El SARS es una enfermedad altamente contagiosa y predominantemente neumónica causada por un nuevo coronavirus (CoV) ahora conocido comúnmente como SARS-CoV 1. Se cree que el SARS es un virus animal, de un reservorio animal aún incierto, tal vez murciélagos, que se propagó a otros animales y humanos. A los pocos meses, la enfermedad se extendió a 32 países de América, Europa y Asia antes de que se pudiera contener el brote global de 2003. Según la OMS, un total de 8.098 personas en todo el mundo enfermaron del SARS durante el brote de 2003. De esta cifra, 774 personas murieron. Uno de los aspectos importantes en la contención de la enfermedad fue la coincidencia de la carga viral con el inicio de la sintomatología, algo que como veremos no ha ocurrido con el Covid-19 en el que la sintomatología aparece tres o cuatro días después, periodo durante el que el paciente es contagioso sin saberlo. Aunque la insuficiencia respiratoria aguda debido al daño alveolar difuso se asoció con la mayor mortalidad [2], los pulmones no fueron los únicos órganos involucrados. Diarrea severa y disfunción hepática fueron los síntomas de presentación en algunos pacientes con SARS. Pero también aparecieron en algunos casos episodios de IRA. El R0 (número reproductivo básico) estima la velocidad con que una enfermedad puede propagarse en una población. Brevemente, nos dice el número de personas que es capaz de infectar una persona contagiada (alcanzar un R0 menor de 1 es un objetivo importante en una epidemia). El R0 del SARS era 1,8-2,5. Significa que una persona puede infectar a dos o tres.
2.2 MERS
El Síndrome Respiratorio del Medio Oriente (MERS) es una enfermedad del sistema respiratorio, causada por el coronavirus MERS-CoV. Este virus fue primero reportado en 2012 en Arabia Saudita y probablemente, también provenía de murciélago a través de un mamífero intermediario que pudo ser el dromedario. Hasta el momento, se han reportado más de 2000 casos [3]. El MERS causa síntomas similares a los del SARS pero con un curso clínico distinto y una alta tasa de letalidad (35-50%). La mayoría de los casos se presentan con síntomas de enfermedad similar a la gripe como fiebre, tos (predominantemente seca), malestar, mialgia, dolor de garganta, dolor de cabeza, rinorrea, náuseas, vómitos, dolor abdominal y diarrea. La disnea es una queja frecuente, la mayoría de los pacientes desarrollan neumonía (70%) y finalmente, requieren ingreso en una unidad de cuidados intensivos. El R0, número reproductivo básico del MERS era 0,3-1,3.
2.3 SARS- COV-2 (COVID-19)
Nombrado 2019-nCoV por la OMS y SARS-CoV-2 por el Comité Internacional de Taxonomía de Virus [1], este virus es un nuevo betacoronavirus que infecta a humanos con una enfermedad eventualmente multisistémica llamada Covid 19. Debido a la proximidad genética a dos coronavirus similares al SARS derivados de murciélagos, lo más probable es que también se haya originado en murciélagos. Seguramente, haya un huésped intermedio entre murciélagos y humanos, y los datos preliminares sugieren que es el pangolín (un oso hormiguero), un mamífero en peligro de extinción y comúnmente traficado. El virus utiliza una proteína pico (S) densamente glicosilada para ingresar en las células huésped humano y se une con alta afinidad al receptor de la enzima convertidora de angiotensina 2 (ACE2 o ECA 2, en terminología anglosajona que utilizaremos indistintamente) de una manera similar al SARS. Esos receptores se encuentran en pulmón, riñón, corazón, tubo digestivo y, muy importante, en el endotelio vascular.
Se presume que la principal vía de transmisión de la infección, al igual que el SARS, son las gotas respiratorias exhaladas al hablar o toser y los aerosoles. Sin embargo, el virus también es detectable en otros fluidos corporales y excreciones. Hay estudios previos de estabilidad del virus SARS-Cov2 a diferentes temperaturas y humedad relativa en superficies lisas. El virus seco en superficies lisas retuvo su viabilidad durante más de 5 días a temperaturas de 22-25°C y humedad relativa de 40-50%, es decir, ambientes típicos con aire acondicionado. Sin embargo, la viabilidad del virus se perdió rápidamente a temperaturas más altas y humedad relativa más alta (por ejemplo, 38°C y humedad relativa > 95%). Estos hallazgos, que han sido muy discutidos en lo que respecta a superficies, son similares a los encontrados con SARS, en los cuales estas formas de transmisión se asociaron con propagación nosocomial. Quedan muchas preguntas que tienen implicaciones clínicas y de salud pública tales cómo surgió este virus, por qué es más fácil de transmitir que el SARS o MERS, y cuáles son su tratamiento y los efectos a largo plazo de la vacunación. Comentaremos más adelante lo que conocemos sobre los tratamientos y las respuestas a la vacunación después de un año. El COVID-19 es altamente contagioso con un R0 de 2,4-3,8. Nuevas variantes como la variante delta, que llegó a mediados de 2021, son mucho más contagiosas aún con R0 de 5-9. En el momento de escribir esta actualización, la variante ómicron surgida en Sudáfrica parece aún más contagiosa y en los próximos meses reemplazará a la omega.
3. FISIOPATOLOGÍA DE LA INFECCION COVID-19
Es importante decir que aunque los mecanismos fisiopatológicos que vamos a describir son globales para todas las variantes de Sars-Cov2, su expresión fisiopatológica varía si los pacientes están adecuadamente vacunados y también por el tipo de variante. Comentaremos no obstante la expresión del primer año 2019-2020 cuando no existían las vacunas.
La infección COVID-19 tiene fundamentalmente cuatro aspectos que en su conjunto van a definir su fisiopatología: infección pulmonar con alveolitis predominantemente, daño endotelial generalizado con presencia de microtrombos, hipercoagulabilidad con fenómenos tromboembólicos y respuesta inflamatoria citoquínica en algunos casos extremos.
Estos cuatro aspectos se sincronizan de la siguiente forma: el virus entra en el alveolo, infecta los macrófagos, los neumocitos tipo 2 y el endotelio, y se genera un efecto llamada con liberación de citoquinas de las células inflamatorias que están en el torrente circulatorio. Llegan monocitos activados, neutrófilos, a defender contra el virus en el alveolo pulmonar y liberan en grandes cantidades de enzimas que dañan todavía mucho más las células del epitelio alveolar. El endotelio, al estar dañado, les permite más fácilmente el paso y el líquido intravascular pasa al alveolo y se produce un edema, que es el mecanismo del distrés respiratorio. El alveolo está lleno de líquido y células inflamatorias que dañan el pulmón, necesitando asistencia respiratoria en muchos casos.
Además, con el daño endotelial, las plaquetas se activan y el sistema de la coagulación también, lo que da lugar a la producción microtrombos. Respecto a estos microtrombos alveolares se ha observado que eran 9 veces más prevalentes que los encontrados en estudios postmortem de pacientes con síndrome de distrés respiratorio del adulto (SDRA) con influenza, lo cual puede explicar una evolución mucho más desfavorable en el Covid19. Así pues, hay dos componentes esenciales: la liberación de citoquinas y el síndrome de distrés respiratorio, y por otro lado, la activación de la coagulación y la microtrombosis.
Una de las incógnitas que presenta la infección por Sars-Cov2 es la diferencia en el grado de afectación que presentan algunos pacientes. Probablemente, para explicar esa diferencia, haya muchos factores implicados pero, una de las teorías que toma un gran interés, probablemente por sus implicaciones terapéuticas, es la de un mecanismo de respuesta inmunitaria excesiva, una hiperinflamación conocida como tormenta de citoquinas que pudiera explicar buenos resultados con dexametasona antes de su inicio como veremos en la parte de tratamientos. Esta respuesta excesiva estaría provocada por una disregulación de mediadores proinflamatorios como IL-1b, IL-6, NF-kb, TGF-ß, IFN 1b entre otros, y daría lugar a un daño orgánico excesivo que sobrepasaría la respuesta antiviral fisiológica. La activación de la respuesta inmunitaria inespecífica generaría un daño orgánico inflamatorio inicial excesivo y posteriormente fibrosis tisular.
Varios de los marcadores de mal pronóstico en la infección por virus COVID-19 son precisamente estos mediadores inflamatorios (IL-1, IL-6, PCR, dímero-D), lo que podría significar que dichos mediadores sean precisamente los causantes del daño. De esta manera, el cuadro de afectación pulmonar severa del COVID-19, que produce SDRA y necesidad de intubación, estaría mediado por esta tormenta de citoquinas, dando lugar a una respuesta inmunitaria excesiva que lesionaría todo el tejido pulmonar más allá de los neumocitos tipo II, que son los hospedadores naturales del virus. No obstante, tampoco podemos dejar de tener en cuenta que dichos marcadores inflamatorios podrían no tener una implicación causal y ser biomarcadores de mayor agresividad del propio cuadro viral, sin responsabilidad patogénica.
La activación inmunitaria inespecífica secundaria a la respuesta hiperinflamatoria podría ser, además, la responsable del daño en otros órganos afectados. Dentro del espectro de respuestas inflamatorias patológicas sistémicas conocidas, estaría el síndrome hemofagocítico secundario (sHLH). En este caso estaría asociado al cuadro viral de linfocitosis hemofagocítica ampliamente descrito en otros agentes víricos como el de la gripe. El sHLH podría ser el responsable, en ocasiones, del fallo multiorgánico y daría lugar a un cuadro consistente principalmente en fiebre alta, linfopenia, hiperferritinemia y esplenomegalia. El sHLH supone un importante reto diagnóstico al compartir semejanzas con cualquier estado de gravedad secundaria a Síndrome de Respuesta Inflamatoria Sistémica (SIRS) o a sepsis. Existen escalas (como el HScore) validados que pueden ayudarnos en el diagnóstico del cuadro.
Por tanto, podríamos decir, con la prudencia que permite la evidencia disponible, que el cuadro viral propio del COVID-19 no debería de ser tan agresivo si no agrediera al endotelio vascular y si no implicase una respuesta inflamatoria excesiva del paciente.
Datos obtenidos de necropsias en pacientes fallecidos por COVID-19, se han encontrado lesiones de microangiopatía trombótica (MAT), si bien es cierto que no se observan en general ni trombopenia ni hemólisis. Una teoría podría ser que el SARS-Cov2 entraría a la célula endotelial por el receptor ECA2 y además de aumentar la replicación viral, induciría un aumento de la expresión de citoquinas, factores de transmisión y moléculas de adhesión. Todo ello va a favorecer la quimiotaxis de células inflamatorias, que contribuirán a la lisis de la célula endotelial y a la activación plaquetaria y de la coagulación, con la consecuente formación de trombos en la microvasculatura como se ha visto en autopsias [5] [6] [7].
Como conclusión, podemos señalar que el problema fundamental, en relación con esta hipótesis, a que se enfrentan los profesionales a cargo de pacientes con cuadros severos de Covid-19, es saber en qué momento la afectación orgánica está causada en mayor medida por una respuesta inflamatoria exagerada y no por los propios mecanismos patogénicos del agente viral. Asimismo, clarificar cual es la importancia de los fenómenos de CID y trombóticos y del daño endotelial con lesiones compatibles con MAT.
Se han comparado los datos de pacientes fallecidos con Covid19 y aquellos por gripe H1N1 encontrando similitudes: ambas enfermedades tienen daño alveolar difuso y linfocitos perivasculares infiltrantes y un mayor número de células ECA-2 positivas en los pulmones (y predominantemente en las células endoteliales capilares). Sin embargo, COVID-19 difiere de H1N1 especialmente en la afectación vascular: daño endotelial severo con membranas celulares endoteliales alteradas, trombosis vascular generalizada con microangiopatía y oclusión de capilares alveolares (9 veces más frecuente en comparación con H1N1) y más crecimiento de vasos nuevos (neo angiogénesis).
4. ASPECTOS CLÍNICOS GENERALES DE LA ENFERMEDAD COVID-19
La transmisión se hace por las gotitas expulsadas al hablar o estornudar (2 metros) y sobre todo por aerosoles. Un 40-50% de las transmisiones se hacen por personas asintomáticas. De hecho, la anosmia en pacientes asintomáticos sin obstrucción nasal puede ser considerado como signo de infección, aunque con ómicron es muy infrecuente. También el paciente recuperado puede transmitir hasta dos semanas después de superar la enfermedad pero con ómicron es muy muy poco probable a partir del quinto día. La transmisión a través de heces oral-fecal parece improbable. No se ha detectado transmisión perinatal.
El periodo de incubación medio es de 5 días oscilando de 2 a 14 días (el 98% de los pacientes) aunque ha habido casos hasta 24 días. El tiempo desde el inicio hasta el desarrollo de la enfermedad grave (incluida la hipoxia): 1 semana. En el inicio de la pandemia en España se observó en un 20% de los casos que a los 7-9 días del inicio de la enfermedad, se produce un agravamiento brusco con desaturación requiriendo ingreso urgente hospitalario y parece ser que, en un porcentaje menor, pero en algunos jóvenes es aún más rápido. Un 5-6% de esos pacientes precisan ingreso en unidades de cuidados intensivos. Estas cifras se han reducido claramente durante la sexta ola con un 90% de personas vacunadas.
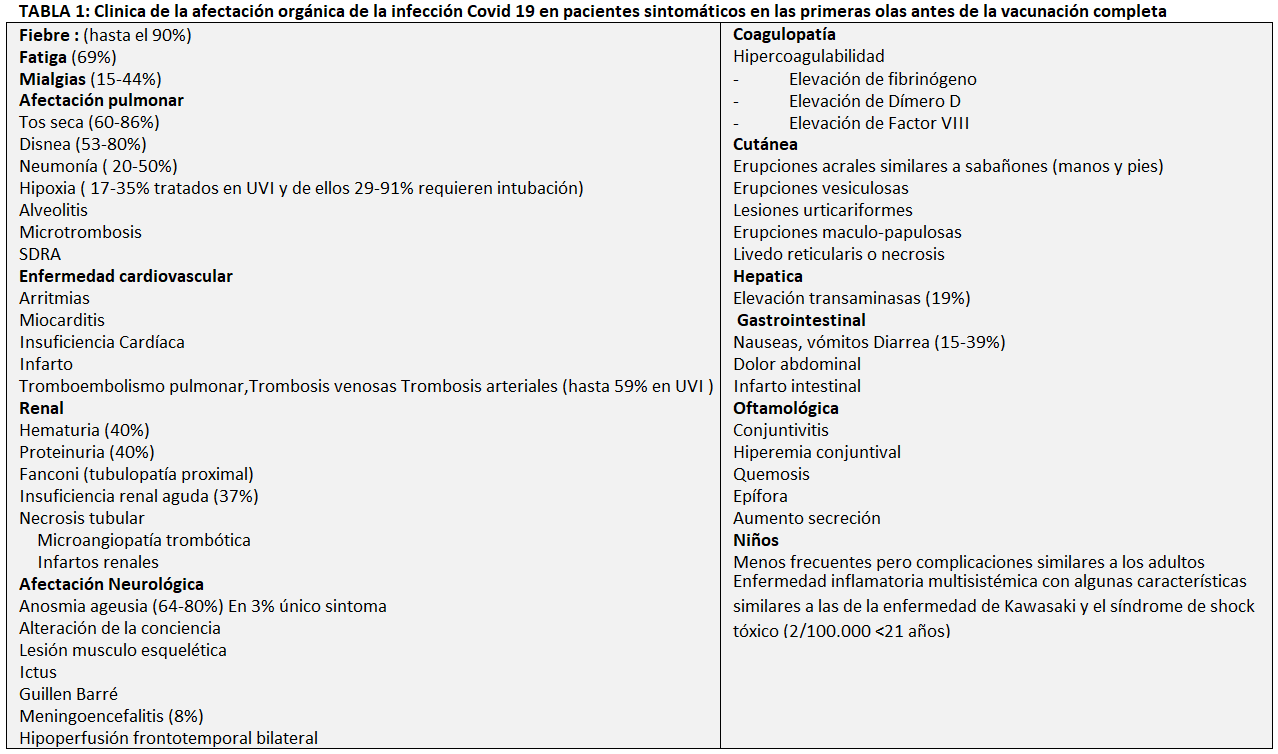
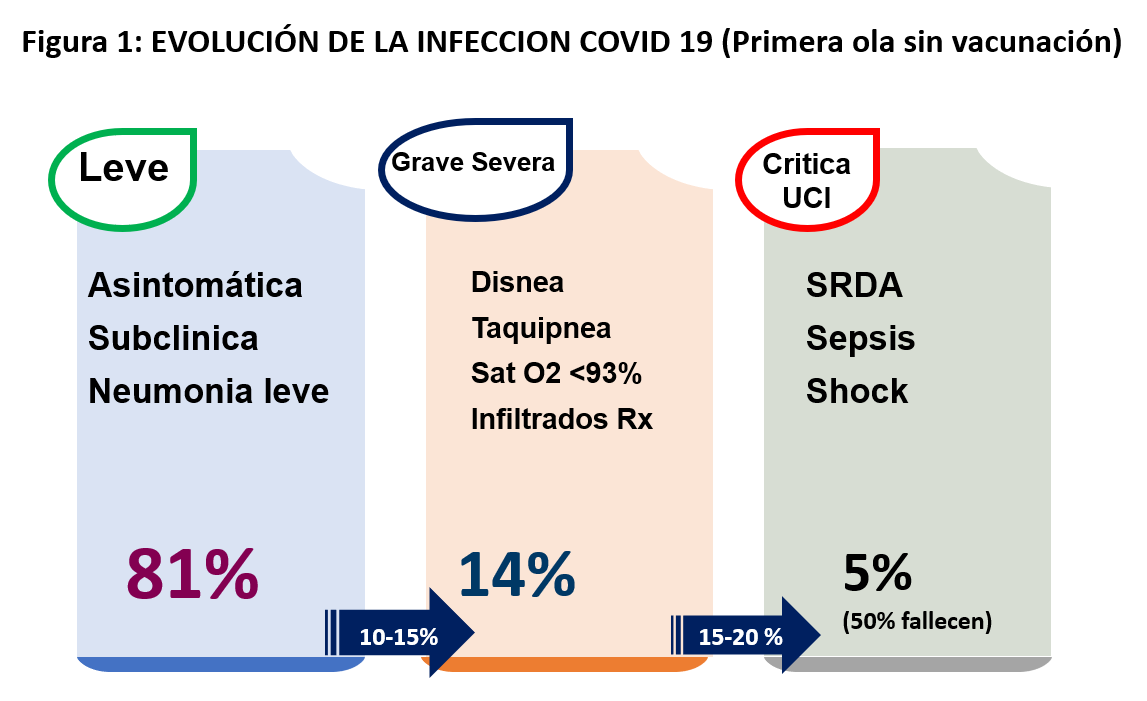
La sintomatología es variable. Los datos en China de Zhu y cols. [8] y en España de Casas Rojo y cols. [9] resumen los posibles síntomas clínicos de la Covid 19 en pacientes sintomáticos (Tabla 1). Durante la primera ola, el 81% eran de naturaleza leve y el 14% moderada, pero un pequeño subgrupo del 5% presentaba insuficiencia respiratoria, shock séptico y disfunción multiorgánica con una mortalidad del 50% (Figura 1). Aquellos con edad inferior a 18 años tan solo 2-5% están afectados, con síntomas generalmente leves y predominantemente respiratorios, con excepción de un muy infrecuente síndrome inflamatorio multisistémico similar a la enfermedad de Kawasaki. Con la aparición de las vacunas las subsiguientes olas han reducido mucho la mortalidad que no supera el 1% de los pacientes hospitalizados.
También hemos visto variaciones con ómicron que llega en un momento de alta vacunación. Es rara la presencia de anosmia, reducida afectación neumónica y cuadro global más benigno en los vacunados.
- Casos asintomáticos. En el barco Diamond Princess, que estuvo en cuarentena en Japón, se realizaron pruebas diagnósticas a 3.700 pasajeros, el 46% de los 712 que tuvieron resultados positivos estaban asintomáticos, aunque tras 14 días de observación la mayoría desarrollaron síntomas, siendo el porcentaje de verdaderos asintomáticos de 18%. Los casos asintomáticos son más frecuentes en niños. Datos de diferentes estudios más recientes basados en millones de personas por el CDC americano encuentran un porcentaje de asintomáticos entre el 30 y el 50%. Se ha observado no obstante en algunos pacientes asintomáticos que se estudiaron radiológicamente imágenes de neumonía.
- Casos sintomáticos. En los datos unificados de la (Tabla 1) hay que destacar que a menudo se presenta sin fiebre inicial, y algunos con radiologia normal (17,9% con enfermedad no grave y 2,9% con enfermedad grave), lo que condiciona una dificultad para el control epidemiológico. Los autores concluyen que las características clínicas de COVID-19 imitan las de SARS. La fiebre y la tos fueron los síntomas dominantes y los síntomas gastrointestinales fueron poco frecuentes, lo que les sugiere una diferencia en el tropismo viral en comparación con el SARS, MERS y la gripe estacional. La ausencia de fiebre en COVID-19 es más frecuente que en la infección por SARS (1%) y MERS (2%), por lo que la detección de fiebre puede no ser un signo excluyente para el diagnóstico. La linfocitopenia fue común y en algunos casos grave, con una tasa de mortalidad del 1,4%. En algunos pacientes, particularmente los ancianos y otros con otras afecciones de salud crónicas, los síntomas pueden avanzar a neumonía bilateral con disnea. No obstante, se ven casos sin antecedentes y en personas jóvenes que también evolucionan hacia la gravedad. El 80,9% de las infecciones reportadas son leves (con síntomas similares a la gripe) y pueden recuperarse en el hogar. Últimamente, la infección en personas vacunadas ha aumentado el porcentaje de mínimamente sintomáticos.
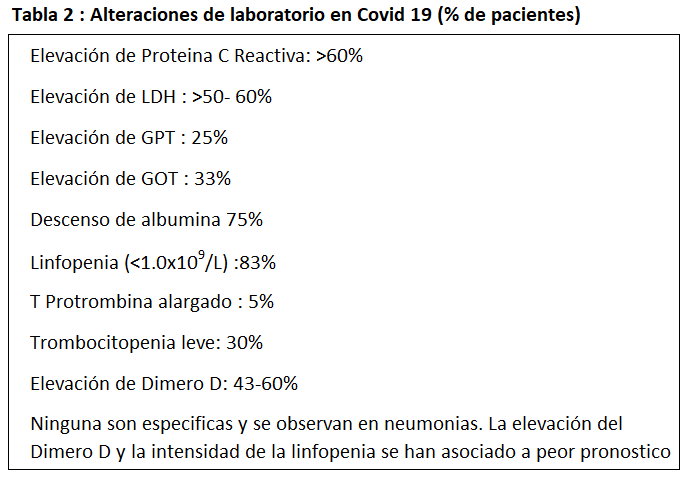
- Casos hospitalizados. Los síntomas más frecuentes en el momento del ingreso en todas las series son la fiebre, la astenia y la tos. El patrón radiológico más frecuente en todas las series fue el infiltrado alveolar. Para el diagnóstico por imagen, el TAC es mucho más sensible (86%) que la placa de tórax (59%) para la detección de imágenes con patrón de vidrio deslustrado, a veces en parches, siendo infrecuente el patrón intersticial. En los hallazgos de laboratorio (Tabla 2) el marcador de inflamación fue la proteína C reactiva. Las alteraciones en la coagulación, especialmente del dímero D y del tiempo de protrombina fueron más frecuentes en pacientes con mayor gravedad. Alrededor de un tercio de los casos también tuvieron marcadores positivos de citolisis hepática. La linfopenia grave fue el hallazgo hematológico más frecuente en los pacientes críticos (mediana 630/mm3).
El crecimiento ha sido exponencial. El coronavirus vivo se desprende claramente a altas concentraciones de la cavidad nasal, incluso antes del desarrollo de los síntomas, por lo que se explican las diferencias con la epidemia anterior del SARS del 2002 pues en esta la carga viral aparecía a la vez que los síntomas. En 8 meses, el SARS se controló después de haber infectado a aproximadamente 8.100 personas en áreas geográficas limitadas. En dos años, el Sars-Cov2 infectó a más de 300 millones de personas, alcanzando en el momento que escribimos (enero 2022) cerca de los 6 millones de fallecidos en el mundo. Así pues, la detección basada en síntomas por sí sola no pudo detectar una alta proporción de casos infecciosos y no fue suficiente para controlar la transmisión. Incluso en la sexta ola en España con cerca de un 90% de la población vacunada, la transmisión continúa debido a que las vacunas protegen de la enfermedad, no son esterilizantes y por tanto no protegen de la infección, disminuyen la protección a los cuatro meses y hay nuevas variantes muy transmisibles como delta y ómicron.
La recuperación en casos leves desde el comienzo de los síntomas es aproximadamente de 2 semanas y con enfermedad grave o crítica, de 3 a 6 semanas. Los aspectos residuales de la infección, aún están en evaluación, pero hay datos que apuntan hacia la fibrosis pulmonar en algunos casos. Hay un porcentaje de casos que continúan con un síndrome clínico muy profundo, Covid de larga duración, que está evaluándose en la actualidad pero que afecta a un 30% de personas.
Factores de riesgo de mortalidad por Covid-19: Los factores detectados en las diferentes series son: edad avanzada (mayor de 65 años), diabetes, obesidad, tabaquismo, EPOC y antecedentes de enfermedad cardiovascular. También concentraciones de dímero-D superiores a 1 µg/ml y alta puntuación SOFA (Sepsis-related Organ Failure Assessment). Se ha descrito que IL-6, troponina I cardíaca de alta sensibilidad y LDH elevadas junto a linfopenia fueron más frecuentes en la enfermedad grave de COVID-19. Se observó que la detección viral sostenida en muestras de garganta no se diferenció entre supervivientes y fallecidos.
El riesgo de muerte aumenta con la edad del paciente y varía con la capacidad de detección de los países y la etapa de la epidemia: desde casi un 10% en pacientes hospitalizados en algunos países al inicio de la epidemia, ahora con un 90% de personas vacunadas, ha pasado al 0,1%.
5.-ESTADIOS DE LA ENFERMEDAD COVID-19
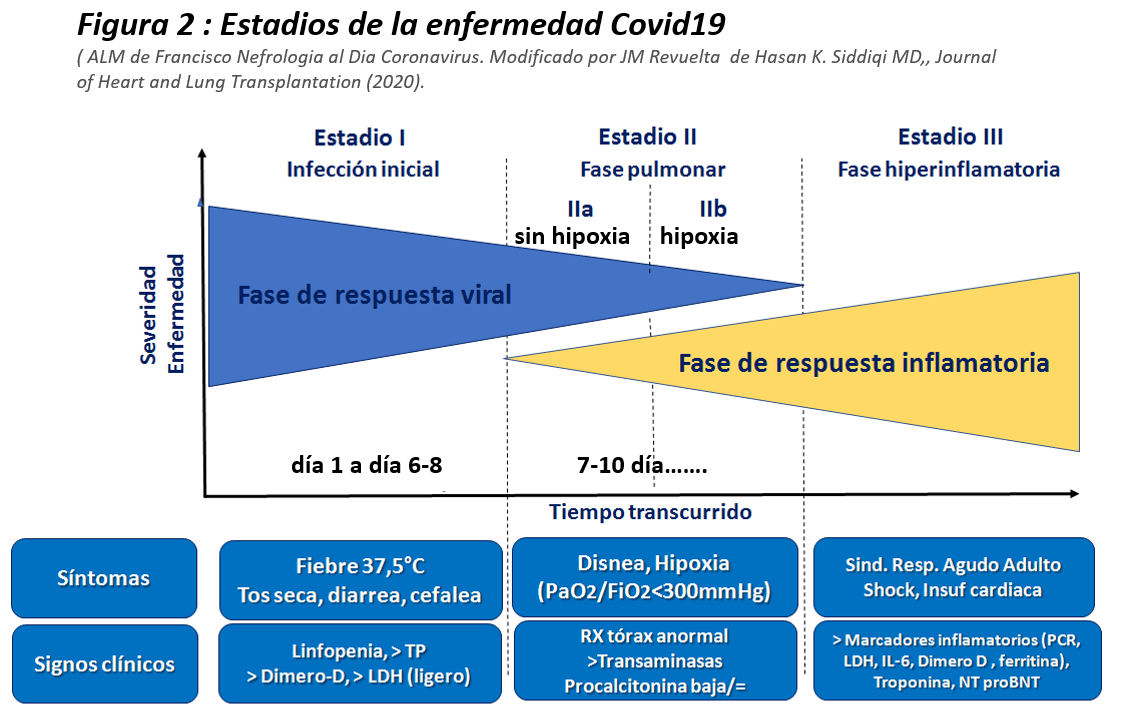
Siddiqi y cols. [10] han propuesto un importante sistema de clasificación de 3 etapas, reconociendo que la enfermedad COVID-19 exhibe tres grados de gravedad creciente, que corresponden con hallazgos clínicos distintos y diferentes respuestas al tratamiento (Figura 2).
FASE I: Infección temprana (día 1 a día 6-8). Gran carga viral en secreciones rinofaríngeas
• La etapa inicial ocurre en el momento de la inoculación y el establecimiento temprano de la enfermedad. Para la mayoría de las personas, esto implica un período de incubación asociado con síntomas leves y a menudo no específicos, como malestar general, fiebre y tos seca. Durante este período, el COVID-19 se multiplica y establece la residencia en el huésped, centrándose principalmente en el sistema respiratorio, uniéndose a las células utilizando el receptor ACE2 (pulmón, intestino delgado, riñón y endotelio vascular). Como resultado del método de transmisión por aire, así como la afinidad por los receptores ACE2 del pulmón, la infección generalmente se presenta con síntomas respiratorios y sistémicos leves.
• El diagnóstico en esta etapa incluye PCR de muestra respiratoria, análisis de suero para IgG e IgM de COVID-19, junto con imágenes de tórax, hemograma completo (linfopenia y neutrofilia) y pruebas de función hepática.
• El tratamiento está dirigido principalmente al alivio sintomático, pero como es la fase de una gran carga viral, es el momento de intentar tratamientos con antivirales, y anticuerpos monoclonales. En aquellos pacientes que pueden mantener el virus limitado a esta etapa de COVID-19, el pronóstico y la recuperación son excelentes.
Fase II: Inflamatoria pulmonar (moderada): afectación pulmonar sin hipoxia (IIa) y con hipoxia (IIb) (7-10 día)
• Es la etapa de afectación inflamatoria pulmonar. Los pacientes desarrollan una neumonía viral, con tos, fiebre y posiblemente hipoxia (definido como un PaO2 / FiO2 < 300 mmHg). Se observan infiltrados bilaterales u opacidades en vidrio esmerilado (con más precisión en TAC que en Rx tórax). Los análisis de sangre revelan una agravación de la linfopenia, junto con elevación de transaminasas y a veces procalcitonina baja. Los marcadores de inflamación sistémica pueden estar elevados, pero no notablemente. En esta etapa es cuando los pacientes necesitarían ser hospitalizados para una observación y tratamiento cercanos.
• El tratamiento consistiría principalmente en medidas de apoyo y terapias antivirales disponibles En la etapa temprana IIa (sin hipoxia significativa) no parecen indicados el uso de corticosteroides. Sin embargo si se produce hipoxia (IIb), es probable que los pacientes progresen a ventilación mecánica y en esa situación, los corticosteroides han demostrado eficacia como veremos en tratamiento.
Fase III: Inflamación sistémica extrapulmonar
Una minoría de pacientes con COVID-19 pasará a la tercera y más grave etapa de la enfermedad, que se manifiesta como un síndrome de hiperinflamación sistémica extrapulmonar. En esta etapa, se elevan los marcadores como la IL-2, IL-6, IL-7, el factor estimulante de colonias de granulocitos, la proteína inflamatoria de macrófagos 1-alfa, el factor de necrosis tumoral-alfa, la PCR, la ferritina y el dímero-D. Están significativamente más elevados en aquellos pacientes con enfermedad más grave. La troponina y el péptido natriurético de tipo B N-terminal pro (NT-proBNP) también pueden estar elevados.
En esta etapa, puede presentarse un sHLH, shock, vasoplejia, insuficiencia respiratoria e incluso, fracaso multiorgánico con afectación sistémica, incluida miocarditis. El tratamiento en el estadio III comprende el uso de corticosteroides y otros posibles como remdesivir junto a inhibidores de citoquinas, como tocilizumab (inhibidor de IL-6) o anakinra (antagonista del receptor de IL-1), e inmunoglobulina (IGIV) para modulación de un sistema inmune. En general, el pronóstico es grave y la recuperación de esta etapa crítica de la enfermedad es pobre.
6.- AFECTACIÓN ORGÁNICA DE LA ENFERMEDAD COVID-19
COVID-19 es una enfermedad multisistémica con afectación predominantemente endotelial. Aunque la clínica fundamental de la enfermedad por COVID-19 es respiratoria, también hay complicaciones cardiovasculares, renales, neurológicas, digestivas y de otros órganos.
6.1 Afectación pulmonar
Las manifestaciones clínicas características son la tos y la disnea progresiva puede llegar a SDRA con necesidad de ventilación. A veces la oxigenación invasiva con ventilador no es suficiente porque hay daño en pequeñas arteriolas que impiden una correcta oxigenación por lo que sería necesario ECMO (oxigenación con membrana extracorpórea). Para comprender mejor la fisiopatología respiratoria del Covid19, nada más preciso que los datos histológicos en los que se comprueban los daños alveolares junto a la presencia de microtrombos capilares que lógicamente alteraran gravemente la ventilación/perfusión.
6.1.1 Hallazgos necrópsicos en pulmón
Los datos que los diferentes estudios necrópsicos [11][12][13] han encontrado pueden resumirse así: el proceso dominante en todos los casos es consistente con congestión capilar severa acompañada de membranas hialinas, cambios reactivos en neumocitos activados y células sincitiales, correspondientes a daño alveolar difuso exudativo, con una moderada leve respuesta mononuclear que consiste en notables agregados CD4+ alrededor de capilares trombosados y hemorragia asociada significativa, es decir una microangiopatía trombótica (MAT). Los pulmones de pacientes con Covid-19 también mostraron lesiones endoteliales severas asociadas con la presencia de virus intracelular y membranas celulares alteradas.
6.1.2 La hipoxia silenciosa: fenotipo L y fenotipo H
Existe con la tormenta inflamatoria una vasoplejia que impide la distribución del riego a zonas del pulmón más funcionantes, pero a diferencia del SDRA clásico, el SDRA del Covid-19 es diferente.
Fenotipo L: Al inicio, el paciente mantiene la "compliance" pulmonar y está hipóxico pero sereno, sin agitación por falta de aire, la llamada “hipoxia silenciosa”. Los infiltrados a menudo son de extensión limitada y generalmente se caracterizan por un patrón de vidrio esmerilado en el TAC, lo que significa edema intersticial en lugar de alveolar. Son "tipo L", caracterizado por una baja elastancia pulmonar (alta compliance) y baja respuesta a una presión elevada al final de la espiración (PEEP). La enfermedad puede estabilizarse en esta etapa sin deterioro, pero otros pacientes, ya sea por la gravedad de la enfermedad y la respuesta del huésped o el manejo subóptimo, pueden pasar a un cuadro clínico más característico del SDRA típico fase H. Se aconseja por este motivo el control de saturación de O2 con pulsioxímetro aunque en realidad no refleje con precisión la PO2.
Fenotipo H: Con el avance de la enfermedad, el pulmón comienza a comportarse ya como un SRDA clásico, pierde la compliance, acumula líquido y el paciente se agita con tiraje respiratorio. Esto es lo que se denomina tipo H, es decir High elastancia pulmonar, o sea, baja compliance y buena respuesta a una presión elevada con el ventilador al final de la espiración (PEEP). Estos dos tipos condicionan un tratamiento ventilatorio diferente, en discusión por los intensivistas.
Estas observaciones [14] indican los papeles fundamentales que desempeña el daño endotelial que interrumpe la vasorregulación pulmonar, promueve el desajuste de ventilación-perfusión (la causa principal de la hipoxemia inicial) y fomenta la trombogénesis.
6.2 Enfermedad cardiovascular
La afectación cardiaca en el Covid-19 es diversa y también con implicaciones terapéuticas relacionadas con la hipertensión arterial que fueron muy debatidas en los primeros dos meses de la pandemia.
6.2.1 IECAS y ARA2
Ya hemos comentado que la infección se desencadena por la unión de la proteína del virus a ECA2, que se expresa altamente en el corazón, endotelio, riñón y pulmones. ECA2 está involucrado en la función cardíaca y desarrollo de hipertensión y diabetes mellitus. El COVID-19 invade principalmente las células epiteliales alveolares, concretamente los receptores ECA2 de los neumocitos alveolares y es especialmente grave en pacientes con enfermedad cardiovascular, en los que se ha visto una mayor secreción de ECA2. Los inhibidores de la ECA aumentan los ECA2, que al ser receptores funcionales para el coronavirus pueden complicar más aún los efectos de la infección. Así que se especuló sobre si aquellos pacientes con infección activa que recibían IECAs o ARA2 quizás deberían cambiar a otro fármaco aunque no hay evidencia sobre este tema y ha sido descartado por diferentes Sociedades Científicas [15] [16] Diferentes estudios no han encontrado asociación entre IECA/ARA 2 y gravedad o mortalidad [17].
6.2.2 Miocarditis
Al igual que otras enfermedades virales, se ha informado que la miocarditis aguda está asociada con la infección por COVID-19 con una prevalencia de 11,5/100.000. Hay estudios que reflejan elevaciones de troponina cardiaca como expresión biológica de miocarditis, pero en muchos casos se trata de pacientes con daño miocárdico previo o la elevación fue durante la agravación y por lo tanto, aún no es posible determinar si la lesión miocárdica es un marcador de riesgo independiente en COVID-19 o si el riesgo asociado con él está relacionado con la carga de enfermedad cardiovascular preexistente o fallo multiorgánico, por lo que no puede atribuirse con certeza al virus [18]. Hay que comentar que con la vacuna mRNA, especialmente Moderna pero también Pfizer, se han descrito miocarditis en jóvenes [19].
6.2.3 Insuficiencia cardíaca
En pacientes hospitalizados, se evidencia insuficiencia cardiaca en alrededor del 50 % de los pacientes fallecidos y en el 5-10% de los recuperados. No obstante, como en todos los aspectos que estamos discutiendo, los trastornos cardiológicos en plena tormenta citoquínica e inestabilidad hemodinámica son muy difíciles de evaluar.
6.2.4 Tromboembolismo arterial y venoso
En una serie retrospectiva de 1114 pacientes con COVID-19 las frecuencias de tromboembolismo arterial o venoso mayor, eventos adversos cardiovasculares mayores y tromboembolismo venoso sintomático fueron más altas en la cohorte de cuidados intensivos (35,3%, 45,9% y 27,0%, respectivamente), seguida de la cohorte de cuidados no intensivos hospitalizados (2,6%, 6,1% y 2,2%, respectivamente) y la cohorte de pacientes ambulatorios (0% para todos). Y todo ello con un 85% de tromboprofilaxis [20].
Existen recomendaciones muy claras de realización de TC con contraste en paciente con COVID-19 [21]: en pacientes con un dímero-D < 1000 µg/L al ingreso con un aumento significativo durante la estancia hospitalaria a > 2000-4000 µg/L, se deben considerar las imágenes para TVP (ecografía doppler) o TEP (TC torácico), en particular cuando los signos sugieren una hipercoagulabilidad clínicamente relevante como congestión venosa, la coagulación de los circuitos extracorpóreos, o cuando los pacientes se deterioran clínicamente (por ejemplo, hipoxemia refractaria o taquicardia o hipotensión de inicio nuevo sin explicación) Se recomienda iniciar la dosis profiláctica de heparina de bajo peso molecular en todos los pacientes con (sospecha) COVID-19 ingresados en el hospital, independientemente de los factores de riesgo.
Se han descrito casos de ictus isquémico agudo por obstrucción arterial de grandes vasos con incidencia muy superior a la habitual en algún centro y en gente joven [22]. Asimismo, se han comunicado casos de pacientes jóvenes y aparentemente sanos con COVID-19 que presentaron isquemia aguda de las extremidades y se han evidenciado infartos renales, esplénicos o intestinales [23].
6.2.5 Trombosis microvascular
Ya hemos visto como los estudios de autopsia en algunas personas que han muerto por COVID-19 han demostrado trombosis microvascular en los pulmones. Y también se han observados múltiples infartos cerebrales pequeños, sin nada en el corazón que lo cause, probablemente por microangiopatía COVID-19. Asimismo microangiopatía con microtrombosis en los riñones.
El mecanismo no está claro y puede implicar hipercoagulabilidad, lesión endotelial directa, activación del complemento u otros procesos. Existen estudios en marcha sobre aspectos relacionados con la MAT o tratamientos relacionados con estas hipótesis como eculizimab o plasmaféresis [24].
6.3 Afectación renal
El estudio de la afectación renal en el Covid19 requiere inicialmente conocer su importancia epidemiológica y los datos histológicos encontrados para comprender los mecanismos que originan esas lesiones.
6.3.1 Epidemiología del daño renal en la infección por Sars-Cov-2
Aunque el riñón puede afectarse con diferentes expresiones histológicas, la IRA con lesión tubular aguda es la afectación más frecuente aunque muy variable dependiendo de la población estudiada.
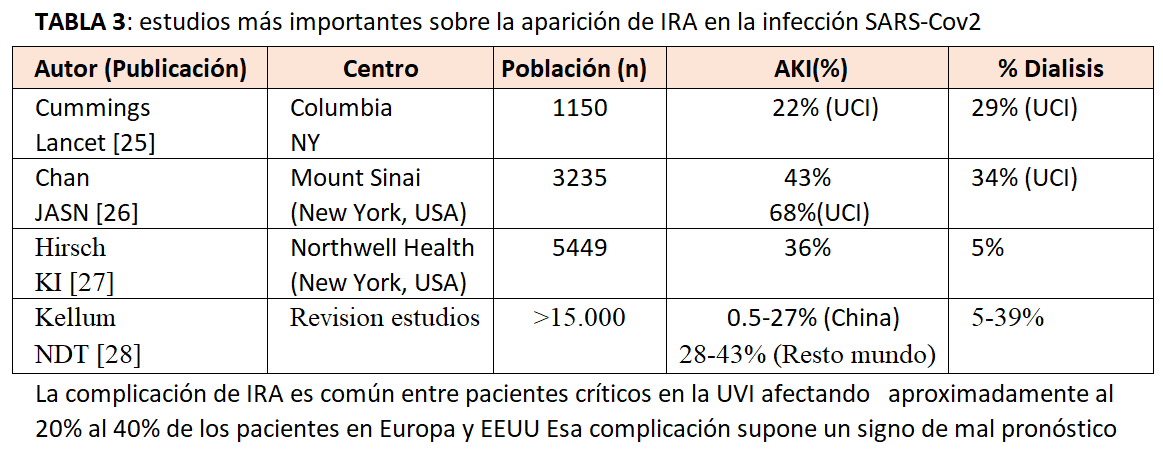
En las publicaciones iniciales, con pocos pacientes, se comunicó una incidencia baja de IRA pero en series más avanzadas es común entre los pacientes críticos con COVID-19. En la (Tabla 3) pueden observarse los estudios más importantes sobre la aparición de IRA en la infección SARS-Cov2. Como podemos observar es común entre pacientes críticos en la UVI afectando aproximadamente al 20% al 40% de los pacientes en Europa y EEUU [25] [26] [27] [28]. Esa complicación supone un signo de mal pronóstico pues se asocia con una mortalidad hospitalaria del 45% en comparación con una mortalidad del 7% entre los que no tenían IRA [26].
La IRA raramente es grave en aquellos que no precisan ventilación asistida La mayoría de los pacientes en los que se desarrolla IRA se encuentran con insuficiencia respiratoria y particularmente se produce en relación al momento de la ventilación. En el estudio de Hirsh y cols.[27], sobre más de 5000 pacientes ingresados con COVID-19, el 89,7% de los pacientes con respiración mecánica desarrollaron IRA en comparación con el 21,7% de los pacientes sin respirador. Un 96,8% de los pacientes que requirieron tratamiento sustitutivo renal estaban con respiradores. De los pacientes que requirieron ventilación y desarrollaron IRA, el 52,2% desarrolló la IRA dentro de las 24 horas posteriores a la intubación.
Los factores de riesgo para IRA incluyeron edad avanzada, diabetes mellitus, enfermedad cardiovascular, raza negra, hipertensión, necesidad de ventilación mecánica (invasiva y no invasiva) y de medicamentos vasopresores y diuréticos [27].
En datos del Registro de la Sociedad Española de Nefrología [29] sobre 300 pacientes, la mayoría de los pacientes registrados con IRA eran varones (69,9%), con una edad media de 69 años. Requirieron ingreso en UCI 182 pacientes, frente a 118 que desarrollaron IRA en grado leve en la planta de hospitalización. Prácticamente, la totalidad de los pacientes en UCI habían desarrollado neumonía, precisando soporte ventilatorio, y un 84,9% precisó tratamiento sustitutorio de la función renal vs. el 12% en el grupo que permaneció hospitalizado en planta. Mientras en el grupo ingresado en planta, la práctica totalidad recupera función renal y tan solo un 3,5% permanece en diálisis crónica, en el grupo ingresado en UCI prácticamente la mitad de los supervivientes permanece en diálisis.
Por consiguiente, podemos concluir que la IRA en el COVID19 se da en pacientes graves hospitalizados y especialmente precisando respiración asistida en la UCI. En su conjunto dada la gravedad del paciente la mortalidad es elevada.
6.3.2 Datos histológicos renales en la infección por Sars-Cov 2
En líneas generales, como ha sido comentado, la infección por COVID-19 tiene fundamentalmente cuatro aspectos que en su conjunto van a definir su fisiopatología [30]: infección pulmonar con alveolitis predominantemente, daño endotelial generalizado con presencia de microtrombos, hipercoagulabilidad con fenómenos tromboembólicos y respuesta hiperinflamatoria citoquínica en algunos casos extremos.
En la (Tabla 4) podemos encontrar el conjunto de los datos histológicos renales que pueden observarse en pacientes Covid-19. Una de las primeras publicaciones [31] estudia los datos histológicos renales de 26 pacientes fallecidos por COVID-19, con una edad media de 69 años. Nueve de los 26 mostraron signos clínicos de lesión renal que incluyó un aumento de la creatinina sérica y/o proteinuria. Lo más destacado además de la necrosis tubular, es que no había evidencia de vasculitis, ni nefritis intersticial, ni hemorragia. Se vieron algunos agregados de eritrocitos que obstruyen la luz de los capilares pero sin plaquetas o material fibrinoide. El examen por microscopía electrónica mostró partículas de coronavirus en el epitelio tubular y en los podocitos. Además se encontró aumento del receptor de COVID-19, el ACE2. La inmunotinción con el anticuerpo de nucleoproteína SARS fue positiva en túbulos, concluyendo que existe una invasión de COVID-19 en el tejido renal.
Después de esta publicación, han aparecido algunos más que son bastante coincidentes. En un estudio necrópsico de 12 pacientes fallecidos por COVID-19 con mediana de edad de 73 años (rango 52-87 años), la autopsia reveló que al igual que en los pacientes con SARS, se detectó ARN viral con títulos altos en otros órganos (hígado, riñón y corazón) en 5 pacientes. Estos datos sugieren que el COVID-19 puede propagarse a través del torrente sanguíneo e infectar otros órganos. No detallan datos histológicos renales salvo aquellos derivados de daño por mala perfusión [32].
Otra interesante publicación [9] de datos necrópsicos refiere como hallazgos renales en 18 pacientes de 76 años (rango 53-96), una lesión tubular aguda difusa con epitelio tubular aplanado y edema intersticial. Tres de estos 18 pacientes mostraron signos de coagulación intravascular diseminada con pequeños trombos de fibrina en capilares glomerulares. Uno de estos casos también se presentó con un infarto renal. No se observaron trombos en otros vasos o cambios vasculíticos. Un infiltrado inflamatorio crónico focal y escaso estuvo presente en algunos casos en áreas con fibrosis intersticial y atrofia tubular. Los cambios crónicos preexistentes, como la arteriolosclerosis, la fibrosis intimal de las arterias y la cicatrización vascular relacionada con la hipertensión y / o el envejecimiento estuvieron presentes en la mayoría de los casos. La microscopía electrónica se realizó en dos casos con un período postmortem corto (< 12 horas). En ambos casos, observaron una activación prominente de podocitos y células endoteliales. El citoplasma de los podocitos contenía múltiples vesículas, algunas con ribosomas unidos y membranas dobles. Ocasionalmente, se detectaron partículas similares a virus (70-110 nm) con gránulos densos en electrones dentro de estas vesículas. Esporádicamente, estas partículas estaban presentes en células endoteliales y células epiteliales tubulares proximales.
Tres de los 18 casos investigados contenían microtrombos en capilares glomerulares, típicamente observados en el contexto de coagulación intravascular diseminada y generalmente atribuibles al shock generalizado. Sin embargo, la replicación renal de COVID-19 podría haber contribuido a la lesión renal aguda en esta cohorte, pues a juicio de los autores se detectaron grandes cantidades de ARN viral en muestras de riñón; también por la presencia de esas partículas similares a virus y porque los pacientes desarrollaron microtrombos a pesar de la anticoagulación oportuna. Detectaron partículas similares a virus dentro de las vesículas y no en el citoplasma, de acuerdo con el ciclo de replicación del coronavirus y los estudios ultraestructurales de cultivos celulares infectados.
6.3.3 Fisiopatologia del daño renal en la infección por Sars-CoV-2
Aunque se han realizado estudios en animales sobre la patogénesis de COVID-19 en macacos, hurones, ratones y hámsteres [33] [34] la mayor parte de ellos tienen su foco de observación en las alteraciones pulmonares y no hay estudios sobre la fisiopatología del daño renal y la IRA. Todos los datos se obtienen de estudios clínicos y exámenes autópsicos.
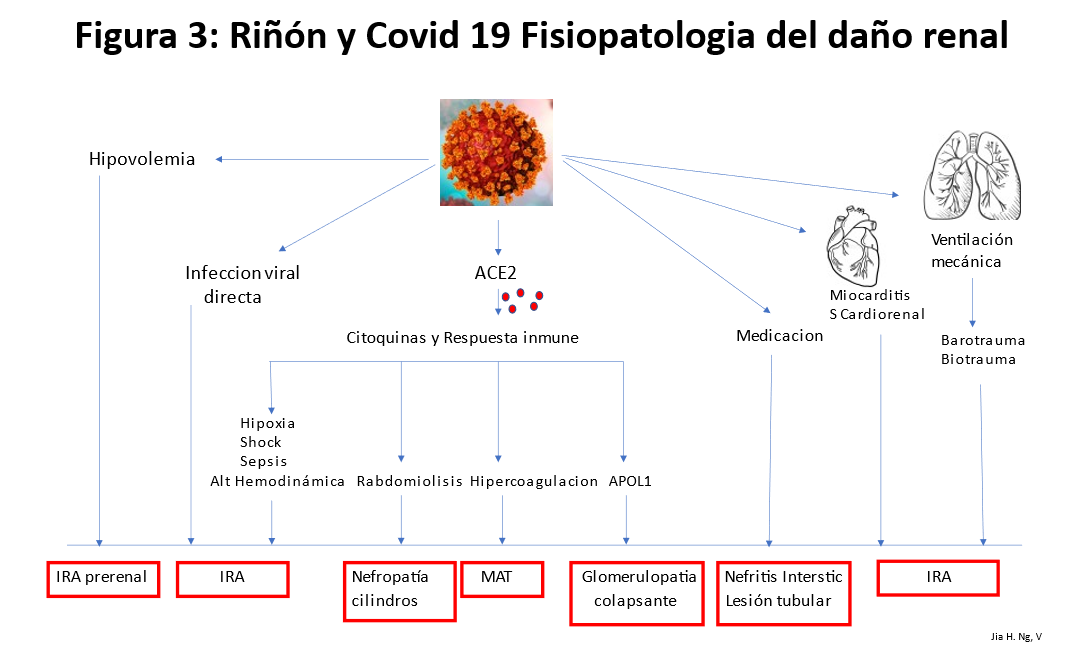
La afectación renal del COVID-19 puede ser causada por múltiples factores patogénicos (Figura 3) (Tabla 5).
• Hipovolemia: inducida por múltiples causas.
• El impacto inicial podría ser el efecto directo del virus sobre los receptores tubulares ACE2 que son el principal sitio de unión del SARS-CoV-2.
• Regulación negativa de ACE2.
• IRA asociada a la respuesta a la infección por SARS-CoV-2 Las alteraciones inmunológicas y la respuesta inflamatoria citoquínica pueden explicar muchos de los mecanismos de IRA en el COVID-19 que pueden inducir directa o indirectamente sepsis, shock, hipoxia, microtrombos y rabdomiolisis.
• Asimismo, las interacciones de órganos entre corazón pulmón y riñón serían otras posibles causas de IRA inducida por Covid-19
• Sepsis.
Hipovolemia e IRA prerrenal
La reducción del volumen efectivo circulante se produce por múltiples causas posibles.
- Los pacientes con COVID-19 a menudo presentan fiebre y eventualmente sepsis viral y vasoplejia que condicionan reducción del volumen efectivo circulante. Además, alrededor del 10% de los pacientes con COVID-19 experimentaron al menos un síntoma gastrointestinal (náuseas, vómitos o diarrea), todo lo cual contribuye a la pérdida de líquidos. En un estudio el 66% de los pacientes con IRA tenían una orina con una concentración de sodio Na < 35 mmol / L, sugestivo de un estado prerrenal o disminución del volumen de sangre arterial eficaz por insuficiencia cardíaca. Basado en un estudio de Mohamed y cols, la uremia prerrenal representó el 9-10% de la IRA en los pacientes con COVID-19 [35].
- Algunos casos de IRA se debieron a síndrome cardiorrenal asociado con COVID-19:
• Insuficiencia cardiaca derecha por neumonía y microtrombos que producen cor pulmonale agudo con hiperpresión venosa renal y caída del filtrado glomerular.
• Insuficiencia cardiaca izquierda por daño viral directo o tormenta citoquínica.
Daño renal directo asociado al virus
Los receptores ACE2 son el principal sitio de unión del SARS-CoV-2. El ACE2 humano se expresa en el riñón en la membrana apical del borde en cepillo de los túbulos proximales y en menor grado en los podocitos [36]. Es posible que el virus entre en las arteriolas y capilares glomerulares e inicialmente infecte las células endoteliales glomerulares. Luego, se infectan los podocitos y el virus entra al líquido tubular uniéndose a sus receptores en los túbulos proximales.
Existe evidencia del ataque del SARS-CoV-2 a las células renales. Se ha observado hematuria y proteinuria hasta en el 40% de los pacientes con Covid-19 [37]. En un estudio realizado por Cheng y cols [38], 44% de los 710 pacientes hospitalizados con Covid-19 presentaba hematuria y proteinuria, mientras que el 27% de ellos presentó hematuria en el momento del ingreso.
a) Mecanismos patogénicos del daño renal directo. Aunque hay mecanismos diferentes para el desarrollo de IRA, el daño viral directo al túbulo es uno de los eventuales mecanismos patogénicos. El daño directo tubular se basa en tres hechos [39].
• La presencia de fragmentos virales en la orina indica una interacción directa del coronavirus con los túbulos renales o una posible exposición de los túbulos al virus.
• Dado que los receptores ACE2 están altamente expresados en la célula tubular proximal, la entrada de SARS-CoV se realiza por la activación de estos receptores.
• Entre la segunda y la tercera semana de infección relacionada con la aparición de IRA, se detectó SARS-CoV-2 en la orina
Los datos que evidencian un ataque directo del virus al riñón se basan en el hallazgo en inmunohistoquímica del antígeno proteico de nucleocápside de SARS-CoV2 en los tubulos renales, de partículas similares al virus en el examen de microscopía electrónica [40] y la observación de glomerulopatía colapsante en seis pacientes [41]. Se ha observado asimismo RNA de SARS-CoV-2 en el riñón al igual que en otros órganos (pulmón, faringe, corazón, hígado y cerebro) mediante hibridación in situ, aunque no se realizó localización ultraestructural [42]. No obstante no hay evidencia definitiva de esta infección renal directa y se precisan datos de autopsias comparativas con pacientes no Covid y multiples técnicas de detección.
b) Patologías específicas del daño renal directo asociado al virus SARS-Cov-2 son:
• Daño tubular. Síndrome de Fanconi: Se han observado: proteinuria no nefrótica en 88%, fosfaturia en 55%, hiperuricosuria en 55% y glucosuria normoglicémica en 30% y se ha relacionado con el eventual desarrollo posterior de IRA. Estos hallazgos desaparecen en la fase de recuperación [43].
• Lesión glomerular: Glomeruloesclerosis segmentaria y focal colapsante. Se trata de una lesión como la encontrada en pacientes HIV que se ha observado en afroamericanos con infección COVID-19 portadores de alelos de riesgo APOL1. En un estudio [44], se observaron inclusiones tubulorreticulares que pueden asociarse con infecciones virales. Es posible que el efecto viral directo o el aumento de citocinas con respuesta inflamatoria sistémica, o ambas, pudieran ser explicar esta lesión glomerular.
Regulación negativa de ACE2 [37]
De forma general, la entrada del SARS-CoV-2 reduce significativamente la expresión de ACE2 y, por lo tanto, inhibe sus funciones protectoras, disminuye los efectos antiinflamatorios y aumenta los efectos de la angiotensina II en pacientes infectados. Estos efectos perjudiciales se producen como resultado de la unión de la angiotensina II a los receptores de angiotensina tipo 1 (AT1) que provocan inflamación y coagulación pulmonar. Es importante considerar que la deficiencia de ACE2 se ha visto en pacientes con SARS-CoV-2 con diferentes características como hipertensión, enfermedades cardiovasculares, diabetes y edad avanzada. Por tanto, la regulación negativa de ACE2 relacionada con el virus podría ser particularmente dañina para los individuos con déficit de ACE2 basal y que podrían ser subsidiarios de mayor susceptibilidad al daño renal.
Además, el metabolito activo de la bradicinina se hidroliza e inactiva mediante ACE2. Los ACE2 disminuidos por la infección viral dan como resultado la activación del sistema kalicreína-cinina a través del receptor de bradicinina B1 que a su vez induce cambios hemodinámicos de mala perfusión, aumenta el reclutamiento de leucocitos y la extravasación de líquidos preferentemente en los pulmones [45].
Insuficiencia renal aguda asociada a la alteración de la respuesta inmune a la infección por SARS-CoV-2
El SARS-CoV-2 puede inducir la respuesta inmunitaria en dos fases: una respuesta inmune adquirida temprana específica para erradicar el virus y controlar la progresión de la enfermedad y una respuesta inflamatoria antiviral que puede ser descontrolada y muy dañina para los pacientes. En casos de enfermedad severa una liberación de citoquinas conduce a la destrucción apoptosis de células T, con descenso de CD4 y CD8 y elevación de los niveles de IL2, IL.6, IL10 y TNF-alfa. De hecho la linfopenia es una característica común de COVID-19 grave, que se caracteriza por un número absoluto drásticamente reducido de linfocitos T CD4 + y particularmente CD8+ y este descenso se correlaciona con la gravedad de COVID-19 y la mortalidad asociada. Los macrófagos renales juegan un papel fundamental en la defensa inmune ya que son las células predominantes contra el virus y activan las señales fagocíticas y citoquínicas. También existe una agresión directa del virus SARS-Cov-2 a la célula tubular lo que asimismo propaga la respuesta inmune.
a) IRA en COVID-19 inducida por la respuesta citoquínica
Las consecuencias clínicas de un alto nivel de citoquinas pueden converger en cambios profundos en los tejidos diana y la fisiología del huésped, donde no se salva ni un solo órgano y la supervivencia del huésped se ve amenazada. Un sello distintivo de una tormenta de citocinas es la fiebre persistente y los síntomas constitucionales inespecíficos (pérdida de peso, dolor articular y muscular, fatiga, dolor de cabeza). La inflamación sistémica generalizada progresiva conduce a una pérdida del tono vascular que se manifiesta como una caída de la presión arterial, shock vasodilatador e insuficiencia orgánica progresiva. En este contexto, la insuficiencia respiratoria es la más destacada, pero también afectará al corazón, el sistema nervioso central y los riñones. Algunas de las manifestaciones clínicas se han asociado a citocinas específicas: IL-6 y TNF se relacionan con fiebre y con síntomas constitucionales. Se cree que el síndrome de fuga capilar, que se refiere a un aumento de la permeabilidad capilar a las proteínas y que se manifiesta clínicamente por hipotensión, edema, insuficiencia respiratoria aguda y lesión renal, está provocado por la IL-2 [46]. Las citocinas proinflamatorias también pueden inducir la producción de trombosis, que puede dar lugar a una coagulación intravascular diseminada [47].
La infección viral produce infiltración celular de macrófagos CD68+, natural killers CD-56+ y células T CD-4 +en el intersticio tubular y la secreción de citoquinas proinflamatorias dañan los túbulos [48]. Hay que añadir a todo ello, como patogenia de la IRA en la infección por SARS-CoV-2 la posibilidad de infecciones superpuestas. La generación de endotoxinas en infecciones por gram negativos pueden resultar en shock séptico responsable también del daño renal.
b) Activación del complemento en el COVID-19
En el COVID-19 hay activación del complemento por la vía de las lecitinas y la vía alterna. Se producen anafilotoxinas C3a y C5a. Las anafilatoxinas se unen a sus receptores específicos y estimulan la producción de histamina, leucotrienos y prostaglandinas que conducen a los principales síntomas de hipersensibilidad como vasodilatación, hipotensión e hipoxia.
La afectación pulmonar temprana de COVID-19 se caracteriza por una vasculopatía trombogénica con depósitos prominentes del componente terminal del complemento C5b-9, C4d. Este patrón de daño vascular pulmonar con depósito de complemento también es una característica de la microvasculatura cutánea y renal. Diao y cols [40] en datos de autopsia de seis pacientes con COVID-19 grave encontraron que los virus infectan directamente los túbulos renales humanos para inducir daño tubular agudo. Los virus no solo tienen citotoxicidad directa, sino que también inician el macrófago CD68 + junto con la deposición del complemento C5b-9 para mediar en la patogénesis tubular. Laurence y col [49] mostraron que el tratamiento con eculizumab, anti C5, puede ser un tratamiento eficaz para algunos pacientes con COVID-19.
Con respecto al complicado papel del sistema del complemento en patogénesis de la lesión pulmonar aguda, actualmente se están realizando ensayos y estudios clínicos para analizar el efecto del bloqueo del sistema del complemento en pacientes críticos con Covid-19. Los complejos inmunes formados por antígenos y anticuerpos virales pueden activar C1 e iniciar la activación del complemento. En pacientes con infección por SARS-CoV-1, el desarrollo de autoanticuerpos contra células epiteliales pulmonares humanas y células endoteliales está mediada por citotoxicidad dependiente del complemento; sin embargo, se desconoce si este proceso también se activa después de la infección por SARS-CoV-2.
Aunque los conocimientos clínicos sobre la activación del complemento después de la infección por SARS-CoV-2 son limitados, los hallazgos anteriores indican que la activación del complemento desenfrenada, principalmente en las fases terminales de la cascada del complemento, puede contribuir a la lesión de las células endoteliales, la trombosis y la coagulación intravascular, lo que en última instancia conduce a la insuficiencia orgánica multisistémica en pacientes con COVID-19 [50].
c) Hipercoagulabilidad en la infección COVID-19
Durante la infección por COVID-19 muchos factores son responsables de la hipercoagulabilidad que en casos moderados graves producirá trombosis-microtrombosis y que pueden inducir IRA. Estos factores son: la activación de macrófagos, el inicio de la tormenta de citocinas, la hiperferritinemia, la liberación de proteínas moleculares asociadas al daño y la activación de factores de coagulación. La activación del sistema del complemento conduce a la lesión y muerte de las células endoteliales con la posterior denudación vascular y exposición de la membrana basal trombogénica, lo que impulsa la activación de las cascadas de coagulación. Estos eventos dan como resultado inflamación, trombosis microvascular, edema de vasos y secuelas hemorrágicas, todas las cuales son características destacadas de la patología pulmonar de los pacientes con neumonía asociada a COVID-19.
En estudios de autopsia, los hallazgos patológicos renales incluyen la pérdida del borde en cepillo y la degeneración vacuolar en las células epiteliales tubulares, con restos compuestos de epitelio necrótico en las luces tubulares. Como se observa en el pulmón, el examen post mortem de muestras renales en el estudio de Diao y cols [40], también identificó el depósito de C5b-9 en las células de los túbulos y la infiltración intersticial masiva de macrófagos como características distintivas de las complicaciones renales en pacientes con enfermedad grave. La relevancia de la trombosis microvascular en el riñón es todavía un tema de investigación.
La hipercoagulación podría favorecer la evolución de la necrosis tubular aguda a necrosis cortical y, por lo tanto, inducir un daño renal irreversible en el Covid19 severo. Además, los microtrombos y la microangiopatía pueden elevar el riesgo de microinfartos en diferentes órganos tales como corazón, hígado y riñón.
d) Rabdomiolisis
Los informes de casos de la epidemia de SARS de 2003 describieron rabdomiólisis de presunta etiología viral e IRA, pero faltaron pruebas de la causalidad. El análisis histopatológico renal postmortem de pacientes con COVID-19 mostró cilindros pigmentados en los túbulos renales y aumento de la CPK, posiblemente representando rabdomiólisis de etiología discutida.
Hay varias hipótesis posibles que explican la patogenia de la rabdomiólisis en la infección por SARS-CoV-2 inducida por virus que puede producir IRA. La invasión viral directa puede provocar rabdomiólisis. También una sólida respuesta inmune a los virus que resulta en tormentas de citocinas y daña los tejidos musculares. Asimismo las toxinas virales circulantes pueden destruir directamente las membranas de las células musculares. Ocasionalmente puede estar asociado a fármacos como por ejemplo el meropenem que se asocia con rabdomiólisis al inducir hipomagnesemia e hipopotasemia graves. Por otro lado, la combinación de hipoxia e hipercoagulabilidad pueden inducir un evento isquémico que inhiba el flujo sanguíneo a los músculos involucrados, desencadenando rabdomiólisis [51].
6.3.4 Insuficiencia renal aguda asociada a las interacciones de órganos con el riñón
a) Corazón/riñón
El SARS-CoV-2 ataca directamente al corazón ocasionando miocarditis, infarto de miocardio e insuficiencia cardíaca. La miocarditis inducida por COVID-19 afecta el gasto cardíaco y compromete la perfusión renal. Asimismo, por la disfunción ventricular derecha concomitante, crea disfunción diastólica y congestión venosa que transmite hacia atrás al riñón y compromete aún más la perfusión por congestión renal.
La neumonía inducida por COVID-19 puede producir insuficiencia del ventrículo derecho. El daño miocárdico por infarto disfunción ventricular izquierda y mala perfusión renal.
b) Pulmón /riñón
Los pacientes con lesión pulmonar aguda tienen un mayor riesgo de IRA por cambios hemodinámicos, hipoxia y presencia de citocinas inflamatorias. La ventilación mecánica puede potencialmente inducir IRA al provocar alteraciones del flujo sanguíneo intrarrenal por cambios neurohumorales y otros cambios hemodinámicos que deterioran la perfusión renal, y mediante la inducción de mediadores inflamatorios sistémicos como consecuencia de la lesión pulmonar inducida por el ventilador [52].
La sobreproducción de citocinas está involucrada en el daño bidireccional pulmón-riñón. El epitelio tubular renal lesionado promueve la regulación positiva de IL-6, y en estudios en humanos y animales, el aumento de la concentración sérica de IL-6 en la IRA se asoció con una mayor permeabilidad alveolo-capilar y hemorragia pulmonar [53]. El mecanismo directo de la lesión de IL-6 en las células epiteliales y endoteliales del pulmón queda por explorar más a fondo. El SDRA también puede causar hipoxia medular renal, que es un daño adicional a las células tubulares
La importante relación entre IRA e insuficiencia respiratoria está muy bien expresada en el estudio de Hirsh y cols [27]. En primer lugar, la IRA grave se produjo con mayor frecuencia en una proximidad temporal cercana al momento de la intubación y la ventilación mecánica. En segundo lugar, la tasa de IRA fue del 89,7% entre los pacientes con ventiladores en comparación con el 21,7% entre otros pacientes. En tercer lugar, la IRA grave (estadios 2 y 3) se produjo en el 65,5% de los pacientes con ventiladores en comparación con el 6,7% de los pacientes no ventilados. Por último, casi todos los pacientes que requirieron diálisis estaban en soporte ventilatorio (276 de 285 [96,8%]). Tomados en conjunto, estos datos sugieren fuertemente que la IRA, particularmente cuando es grave, es una afección que ocurre entre los pacientes con COVID-19 que también tienen insuficiencia respiratoria.
c) Sepsis
La sepsis, debida a una infección viral o bacteriana, está asociada con un mayor riesgo de IRA. Se han sugerido daños tisulares como mecanismos de IRA en la sepsis, junto con hipoperfusión que afecta a la microcirculación renal. Zhou et al [54] encontraron que el 59% de los pacientes hospitalizados con COVID-19 desarrollaron sepsis, 20% desarrolló shock séptico y el 15% desarrolló infección secundaria.
6.3.5 Daño renal a largo plazo: fibrosis renal post Covid-19
En muestras de autopsias, se ha observado que el SARS-CoV-2 infecta directamente las células renales y se asocia con un aumento de la fibrosis renal túbulo-intersticial. Hay un estudio en Stem Cell, que estudian los efectos directos del virus en el riñón independientemente de los efectos sistémicos. Para ello, infectan con SARS-CoV-2 organoides renales derivados de células madre pluripotentes humanas. La secuenciación RNA unicelular indicó lesión y desdiferenciación de las células infectadas con activación de vías de señalización profibróticas. La infección por SARS-CoV-2 también condujo a un aumento de la expresión de la proteína del colágeno 1 en los organoides. El inhibidor de la proteasa del SARS-CoV-2 pudo mejorar la infección de las células renales por el SARS CoV-2. Estos resultados sugieren que el SARS-CoV-2 puede infectar directamente las células renales e inducir lesión con fibrosis subsiguiente. Estos datos podrían explicar tanto la lesión renal aguda en pacientes con COVID 19 como el desarrollo de enfermedad renal crónica en long-COVID [55].
7. VACUNAS
7.1 Tipos de vacunas y respuesta frente a Sars-CoV-2
En una carrera sin precedentes, se han conseguido vacunas efectivas que protegen contra el Covid19 moderado severo aunque no previenen la infección pues no son esterilizantes de las mucosas. Nunca antes se habían desarrollado vacunas con tanta rapidez, y mucho menos preparadas para un uso generalizado. Hay por el momento más de 300 vacunas en desarrollo, de las que un tercio están en fase de ensayos clínicos. Varias han sido aprobadas por los reguladores.
Son de varios tipos:
• Vacunas con ARN y ADN: un enfoque pionero que utiliza ARN o ADN genéticamente modificados para generar una proteína que por sí sola desencadena una respuesta inmunitaria.
• Vacunas con vectores víricos: utilizan un virus genéticamente modificado que no causa la enfermedad, pero da lugar a proteínas coronavíricas que inducen una respuesta inmunitaria.
• Vacunas basadas en proteínas: utilizan fragmentos inocuos de proteínas o estructuras proteínicas que imitan el virus causante de la Covid19 con el fin de generar una respuesta inmunitaria.
• Vacunas con virus inactivados o atenuados: utilizan un virus previamente inactivado o atenuado, de modo que no provoca la enfermedad, pero aun así genera una respuesta inmunitaria.
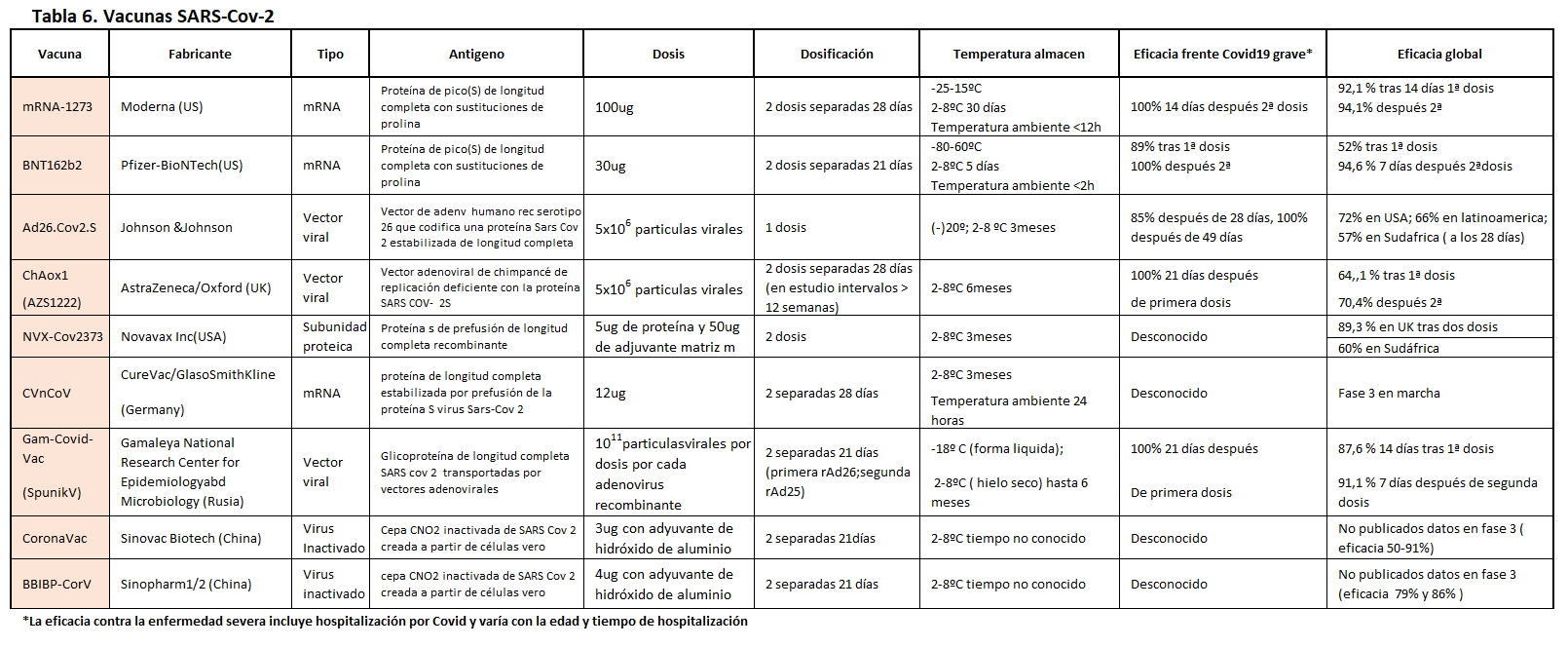
Hasta enero 2022, cinco vacunas COVID19 han sido aprobadas o autorizadas para su uso de emergencia (Pfizer y Moderna definitivo) en la UE o en los EE.UU (Tabla 6). Una explicación más detallada de las vacunas están en otro apartado de Nefrología al Día [56].
• La vacuna de BioNTech/Pfizer, nombre comercial: Comirnaty™ (tozinameran, antes conocido como BNT162b2).
• La vacuna Moderna, también conocida como mRNA-1273.
• La vacuna de AstraZeneca/Universidad de Oxford, nombre comercial: Vaxzevria™/Covishield™ (anteriormente conocida como ChAdOx1 nCoV-19, AZD1222).
• La vacuna de Johnson & Johnson (Janssen), también conocida como Ad26.COV2.
• La vacuna Novavax de subunidad proteica conocida como NVX-CoV 2373.
7.2 Datos obtenidos de la experiencia clínica durante 2020-2021
Los datos que tenemos sobre vacunación son los siguientes recogidos de informes del CDC americano:
• Todas las vacunas COVID-19 actualmente aprobadas de emergencia o autorizadas en los Estados Unidos y Europa (Pfizer-BioNTech / Comirnaty, Moderna, Janssen [Johnson & Johnson] y Oxford Astra Zeneca) son efectivas contra COVID19, incluso contra enfermedades graves, hospitalización y muerte.
• La evidencia disponible sugiere que las vacunas COVID19 actualmente aprobadas o autorizadas son altamente efectivas contra la hospitalización y la muerte por una variedad de cepas, incluidas alfa (B.1.1.7), beta (B.1.351), gamma (P.1), y delta (B.1.617.2); los datos sugieren una menor efectividad contra la infección confirmada y la enfermedad sintomática causada por las variantes beta, gamma y delta en comparación con la cepa ancestral y la variante alpha. Es necesario realizar un seguimiento continuo de la eficacia de la vacuna frente a variantes. No conocemos aún el efecto sobre ómicron.
• Los datos limitados disponibles sugieren una menor efectividad de la vacuna contra la enfermedad COVID19 y la hospitalización entre personas inmunodeprimidas. Además, numerosos estudios han demostrado una respuesta inmunológica reducida a la vacunación con COVID19 entre personas con diversas afecciones inmunodeficientes.
• El riesgo de infección por SARS-CoV-2 en personas completamente vacunadas no puede eliminarse por completo mientras exista una transmisión comunitaria continua del virus. Los primeros datos sugieren que las infecciones en personas completamente vacunadas se observan con mayor frecuencia con la variante delta que con otras variantes del SARS-CoV-2. Sin embargo, los datos muestran que las personas completamente vacunadas tienen menos probabilidades que las personas no vacunadas de adquirir SARS-CoV-2, y las infecciones con la variante delta en personas completamente vacunadas se asocian con resultados clínicos menos graves. Las infecciones con la variante delta en personas vacunadas tienen potencialmente una transmisibilidad más reducida que las infecciones en personas no vacunadas, aunque se necesitan estudios adicionales. De momento ómicron parece mucho más transmisible.
• La indicación de vacunación en adolescentes ha demostrado ser segura y eficaz y la de niños de 5-11 años los primeros datos han confirmado lo mismo habiendo sido ya autorizado.
• La vacunación completa frente ómicron con dos dosis (o una de Janssen) es insuficiente, siendo necesaria una tercera dosis o booster y una cuarta en inmunosuprimidos.
7.3 Pérdida de eficacia de la vacuna mRNA
Cuatro grandes estudios muestran una disminución de la inmunidad contra el SARS-CoV-2 unos meses después de la segunda dosis de la vacuna BNT162b2. Un estudio en Qatar sobre 947.035 personas [57] encuentra que la efectividad estimada de BNT162b2 contra cualquier infección por SARS-CoV-2 fue insignificante en las primeras 2 semanas después de la primera dosis, aumentó al 36,8% en la tercera semana después de la primera dosis y alcanzó su pico de 77,5% en el primer mes después de la segunda dosis. La eficacia disminuyó gradualmente a partir de entonces y la disminución se aceleró después del cuarto mes para alcanzar aproximadamente el 20% en los meses 5 a 7 después de la segunda dosis No obstante la protección contra la hospitalización y la muerte persistió 6 meses después de la segunda dosis.
Otros dos trabajos [58][59] encuentran también una disminución similar de los anticuerpos neutralizantes a la vacuna BNT162b2 4-6 meses después de la vacunación. Un estudio en la revista Science sobre 780.000 personas en EEUU señala que la protección de las vacunas de Pfizer, Moderna y Janssen frente a la infección cayó, como media, del 87,9% al 48,1 % entre febrero y octubre de 2021, siendo la monodosis de Janssen la que más perdió (hasta el 13,1 %) [60].
Y también tenemos datos en España [61], que de nuevo evidencian pérdida de la efectividad de la vacuna (EV) en residentes en centros de mayores de 65 años que se vacunaron en marzo respecto a los vacunados en mayo (síntomas entre 1 de julio y 15 de agosto de 2021). En los vacunados en marzo, la EV disminuye a 58%, 64%, 65% y 77%, para infección, infección sintomática, hospitalización y defunción respectivamente.
7.4 Tercera dosis (booster shot): claramente necesaria y eficaz
La pérdida de efectividad vacunal comentada ha conducido a la indicación de una tercera dosis de la vacuna. Ya conocíamos que en muchos estudios se había evidenciado que en las personas inmunodeprimidas la efectividad de la vacuna es menor en comparación con los pacientes inmunocompetentes. De hecho las personas inmunodeprimidas que reciben vacunas de ARNm deben recibir 3 dosis y un refuerzo 6 meses después de la tercera dosis, de acuerdo con las recomendaciones de los CDC [62].
Hay varios estudios que demuestran como una tercera dosis protege contra infección, hospitalización y muerte. Un estudio en Israel sobre 4.696.865 personas mayores de 16 años que habían recibido dos dosis de BNT162b2 al menos 5 meses antes, demuestra que la tasa de infección fué menor en el grupo que recibió tercera dosis que en el grupo sin refuerzo con un factor de aproximadamente 10 (rango en cinco grupos de edad, 9 a 17,2). Las tasas de enfermedad grave fueron menor en el grupo de refuerzo por un factor de 17,9 entre los mayores de 60 años y por un factor de 21,7 entre los de 40 a 59 años. Entre los mayores de 60 años o más, la mortalidad fue menor con un factor de 14,7 [63]. Otra publicación [64] encuentran una muy importante elevación de anticuerpos neutralizantes después de la tercera dosis 15-20 veces superior a lo obtenido con la segunda dosis para cualquier rango de edad.
Finalmente hay un importante estudio que compara las consecuencias clínicas de la vacunación con una tercera dosis respecto a los vacunados con dos dosis. Estudian 1.158.269 individuos (mayores de 12 años) divididos en dos grupos de 728.321. La evaluación de la eficacia de la vacuna 7 días después de recibir la tercera dosis, en comparación con solo dos al menos 5 meses antes, se estimó en una reducción del 93% para el ingreso hospitalario, 92% para enfermedad grave y 81% para muerte por Covid19 [65].
Por consiguiente, la tercera dosis de vacuna es eficaz para reducir las complicaciones graves relacionadas con el COVID19 en pacientes que han recibido dos dosis de la vacuna al menos 5 meses antes.
7.5 Vacunación heteróloga
Un número cada vez mayor de estudios clínicos, respaldados por evidencia en mundo real, ahora han analizado la posibilidad de usar dos vacunas COVID19 diferentes, ya sea para la primera y segunda dosis que se conoce como vacunación primaria heteróloga, o usar una tercera dosis de una vacuna COVID19 diferente como refuerzo de 3 a 6 meses después de un ciclo de vacunación primaria (refuerzo heterólogo).
La evidencia de estudios sobre vacunación heteróloga sugiere que la combinación de vacunas de vector viral y vacunas de ARNm produce buenos niveles de anticuerpos contra el virus COVID19 y una respuesta de células T más alta que usando la misma vacuna (vacunación homóloga) ya sea en régimen primario o de refuerzo. En general, los regímenes heterólogos fueron bien tolerados.
Podría considerarse la administración de una vacuna de vector adenoviral como segunda dosis después de una vacuna de ARNm si existe un problema con la disponibilidad de vacunas de ARNm, pero según los datos limitados disponibles, puede ser menos ventajoso desde un punto de vista inmunológico que la secuencia opuesta.
Las recomendaciones técnicas y consejos sobre vacunación primaria y de recuerdo heteróloga de COVID-19 pueden encontrarse en las informaciones de la EMA y CDC [66].
7.6 Vacunación en adolescentes
La vacunación en adolescentes ya se ha completado en millones de jóvenes Dos estudios prospectivos aleatorizados con vacuna de Pfizer [67] en 2260 y Moderna [68] en 3732 han demostrado que las vacunas BNT162b2 y mRNA-1273 y tuvieron un perfil de seguridad aceptable en adolescentes. La respuesta inmune fue similar a la de los adultos jóvenes y la vacuna fue 100% eficaz para prevenir Covid-19.
7.7 Vacunación en niños
La vacunación en niños pequeños con un tercio de la dosis de adolescentes ha sido objeto de mucha controversia basada en que los niños no tienen enfermedad grave y el balance riesgo beneficio pudiera estar discutido. De hecho solamente 0,1% a 1,9% de los niños que tienen COVID-19 necesitan hospitalización en Estados Unidos. No obstante, muchos niños todavía padecen enfermedades graves a causa del COVID-19 y hay cantidades significativas de hospitalizaciones de niños. El mejor pronóstico en niños se ha explicado por una menor expresión de la ECA2 en los sistemas respiratorio y vascular.
Los factores de riesgo para que un niño desarrolle COVID-19 grave o fallezca, son:
• Edad menor a un año.
• Sobrepeso u obesidad en adolescentes.
• Comorbilidades, enfermedades cardiacas, pulmonares, metabólicas, inmunodeficiencias, cáncer.
• Síndrome de Down.
• Bajo nivel socioeconómico.
Además hay muchas preocupaciones sobre las consecuencias a largo plazo en los niños de una infección grave por COVID19, es decir, daño pulmonar o cardíaco o daño a algún otro órgano. La vacunación de los niños reduce las transmisiones y facilita mantener las escuelas abiertas.
La FDA y los asesores de los CDC analizaron las relaciones riesgo-beneficio de la vacunación en niños y las respuestas fueron rotundamente sí (tan solo una abstención de 30).
A diferencia de la vacuna para personas mayores de 12 años esta vacuna de tapón naranja tiene una mayor estabilidad. Se puede almacenar en el refrigerador hasta 10 semanas y no requiere almacenamiento ultrafrío pues aunque la formulación ha cambiado, el ingrediente activo sigue siendo el mismo.
Los estudios para niños de 5-11 años se han realizado con la vacuna de Pfizer. En el ensayo de fase 2-3, los participantes fueron asignados al azar en una proporción de 2:1 para recibir dos dosis de la vacuna BNT162b2 en dosis de 10 microgramos identificadas en la fase 1. Las respuestas inmunitarias 1 mes después de la segunda dosis de BNT162b2 se vincularon inmunológicamente con las de los jóvenes de 16 a 25 años que recibieron dos dosis de 30 μg de BNT162b2. Se evaluó la eficacia de la vacuna contra Covid19 a los 7 días o más después de la segunda dosis. Se asignó al azar a un total de 2268 niños para recibir la vacuna BNT162b2 (1517 niños) o placebo (751 niños). En el punto de corte de los datos, la mediana de seguimiento fue de 2,3 meses. En los niños de 5 a 11 años, como en otros grupos de edad, la vacuna BNT162b2 tuvo un perfil de seguridad favorable. No se observaron eventos adversos graves relacionados con la vacuna. Un mes después de la segunda dosis, la relación media geométrica de los títulos neutralizantes del coronavirus 2 (SARS-CoV-2) del síndrome respiratorio agudo severo en niños de 5 a 11 años con respecto a los de 16 a 25 años fue 1,04 (intervalo de confianza [IC] del 95%, 0,93 a 1,18). Se informó infección con Covid-19 con inicio 7 días o más después de la segunda dosis en tres receptores de la vacuna BNT162b2 y en 16 receptores de placebo (eficacia de la vacuna, 90,7%; IC del 95%, 67,7 a 98,3). Se encontró que un régimen de vacunación Covid19, que consiste en dos dosis de 10 μg de BNT162b2 administradas con 21 días de diferencia, es seguro, inmunogénico y eficaz en niños de 5 a 11 años de edad [69].
7.8 Miocarditis y vacunas
El CDC informó que algunas vacunas ARNm están asociadas con miocarditis, principalmente en individuos masculinos más jóvenes unos días después de la segunda vacunación, con una incidencia de aproximadamente 8 casos por millón con Pfizer y 19,8 con Moderna [70]. Un estudio de 884.828 personas en Israel encuentra 27 / millón de población en personas vacunadas con BNT162b2 [71].
Un estudio de serie de casos realizado en Inglaterra en mayores de 16 años vacunados 1 a 18 dias antes contra COVID19 con adenovirus (ChAdOx1, n = 20.615.911) o con ARN mensajero (BNT162b2, n = 16.993.389; ARNm-1273, n = 1.006.191) se comparó con aquellos con una prueba positiva para el SARS-CoV-2 (n = 3.028.867). Encontraron mayores riesgos de miocarditis asociados con la primera dosis de vacunas ChAdOx1 y BNT162b2 y la primera y segunda dosis de la vacuna mRNA-1273 durante el período de 1 a 28 días después de la vacunación y después de una prueba positiva de SARS-CoV-2. Estimaron dos (ChAdOx1), uno (BNT162b2) y seis (ARNm-1273) eventos de miocarditis por 1 millón personas vacunadas, en los 28 días posteriores a una primera dosis y diez eventos de miocarditis por millón de vacunados en los 28 días posteriores a una segunda dosis de ARNm-1273. Esto comparado con 40 eventos de miocarditis adicionales por 1 millón de pacientes en los 28 días posteriores a una prueba positiva de SARS-CoV-2.También observaron un mayor riesgo de pericarditis y arritmias cardíacas después de una prueba de SARS-CoV-2 positiva. Los análisis de subgrupos por edad mostraron un mayor riesgo de miocarditis asociado con las dos vacunas de ARNm solo en los menores de 40 años [70].
Existen varias teorías sobre la causa de estas miocarditis en un pequeño grupo de receptores.
• La proteína de pico en sí misma podría ser la culpable, ya que tiene algunas similitudes con las proteínas del músculo cardíaco; pudiera ser que los anticuerpos neutralizantes creados en respuesta a la vacunación pueden comenzar a atacar esas proteínas cardíacas. O podría involucrar el procesamiento de ARNm en las células del músculo cardíaco.
• Otra teoría es que si la vacuna se inyecta directamente en una vena, puede ir directamente al músculo cardíaco y provocar una respuesta inflamatoria. La inyección intravenosa de la vacuna Pfizer / BioNTech en ratones indujo miocarditis y pericarditis.
• Dado que la miocarditis ocurre con más frecuencia entre los hombres más jóvenes, los investigadores también han especulado que la testosterona también puede desempeñar un papel, aumentando la respuesta inflamatoria dado que los hombres jóvenes tienen niveles más altos de la hormona.
La presentación clínica de miocarditis es generalmente leve, con resolución en la mayoría de los casos, a juzgar por los síntomas clínicos, los marcadores inflamatorios, la elevación de la troponina, la normalización electrocardiográfica y ecocardiográfica y una duración relativamente corta de estancia en el hospital. La fracción de eyección fue normal o levemente reducida en la mayoría de las personas pero severamente reducida en un 3% de las personas en alguna serie [72].
7.9 Vacunación en pacientes con enfermedad renal crónica
Entre los pacientes con enfermedad renal crónica (ERC), el porcentaje de pacientes con enfermedad crítica por Covid19 en la primera ola fue superior al de los otros grupos debido a las múltiples comorbilidades y a su sistema inmunológico deteriorado incluso en pacientes sometidos a trasplante renal. Se han redactado multiples guías y normas nacionales e internacionales en relación con Covid19 y pacientes renales. El lector puede encontrar una amplia información en el apartado Información actualizada sobre el Covid19 de la Sociedad Española de Nefrologia [73] y así como en las publicaciones en Nefrología de Sequera y cols, Arenas y cols, López y cols, y Sánchez Alvarez y cols [74][75][76][77].
Hay muchos estudios sobre la vacunación en estos pacientes pero queremos resaltar el estudio SENCOVAC, de la Sociedad Española de Nefrología [78]. Se trata de un estudio prospectivo y multicéntrico en el que incluyeron cuatro cohortes de pacientes: receptores de trasplante renal (TR), hemodiálisis (HD), diálisis peritoneal (DP) y ERC no diálisis de 50 centros españoles. Al inicio del estudio y el día 28 después de la última dosis de vacuna, se midieron los anticuerpos anti-Spike y se compararon entre las cohortes. Se analizaron los factores asociados con el desarrollo de anticuerpos anti-Spike. El estudio comprende 1746 participantes: 1116 HD, 171 DP, 176 pacientes con ERC no diálisis y 283 receptores de TR. La mayoría de los pacientes (98%) recibieron vacunas de ARNm. Al menos una reacción a la vacuna se desarrolló después de la primera dosis en 763 (53,5%) y después de la segunda dosis en 741 (54,5%). Los anticuerpos anti-Spike se midieron en los primeros 301 pacientes. A los 28 días, el 95% de los pacientes habían desarrollado anticuerpos: 79% de TR, 98% de HD, 99% de DP y 100% de pacientes con ERC no diálisis (p <0,001). En un análisis multivariado ajustado, la ausencia de una respuesta de anticuerpos se asoció de forma independiente a TR (OR 20,56, p = 0,001) y a la vacuna BNT162b2 (Pfizer) (OR 6,03, p = 0,023). Los autores concluyen que la tasa de desarrollo de anticuerpos anti-Spike después de la vacunación en pacientes con TR fue baja, pero en otros pacientes con ERC se acercó al 100%; lo que sugiere que los pacientes con TR que reciben antimetabolitos requieren medidas de aislamiento persistentes y dosis de refuerzo de la vacuna Covid19.
El estudio RECOVAC [79] es un estudio multicéntrico prospectivo, controlado, que incluyó a 162 participantes con ERC en estadios 4/5 (TFGe < 30 ml/min/1,73 m2), 159 participantes en diálisis, 288 receptores de TR y 191 controles. Los participantes recibieron 2 dosis de la vacuna mRNA-1273 COVID-19 (Moderna). Los receptores de trasplantes tuvieron una tasa de seroconversión significativamente más baja en comparación con los controles (56,9 % versus 100 %, P < 0,001), especialmente poco respondedores aquellos con ácido micofenólico, pero también una edad más alta, una concentración más baja de linfocitos, una TFGe más baja y un tiempo más corto después del trasplante Los receptores de trasplantes también mostraron títulos significativamente más bajos de anticuerpos neutralizantes y respuestas de células T en comparación con los controles. Aunque se observó una alta tasa de seroconversión para los participantes con ERC 4/5 (100 %) y en diálisis (99,4 %), las concentraciones medias de anticuerpos en la cohorte ERC 4/5 y la cohorte de diálisis fueron más bajas que en los controles (2405 [IC 1287 -4524] y 1650 [698-3024] frente a 3186 [1896-4911] BAU/ml, P = 0,06 y P < 0,001, respectivamente). No se observaron problemas de seguridad específicos.
Un metanálisis de 32 estudios encuentra que la tasa de inmunogenicidad entre los pacientes que recibieron diálisis fue del 41% después de la primera dosis y del 89% después de la segunda dosis. La diabetes puede ser un factor de riesgo de falta de respuesta en la población en diálisis [80].
Por tanto, parece concluirse con estos estudios que la respuesta inmunitaria tras la vacunación en pacientes con ERC y en diálisis es casi comparable a la de los controles. Por el contrario, los receptores de TR tienen una respuesta pobre. En este último caso, se justifica el desarrollo de grupos de pacientes de estrategias alternativas de vacunación, lo que indicará seguramente una cuarta vacunación de refuerzo.
8. TRATAMIENTOS DE LA INFECCIÓN COVID-19
Desde el inicio de la pandemia, ha habido multiples informaciones sobre eficacia de diferentes tratamientos. En la (Tabla 7) se encuentran los estudios prospectivos aleatorizados hasta el 30 de septiembre de 2021 informados por la OMS (Pan American Health Organization) [81]. Comentamos solo alguno de los más importantes [82].
Corticosteroides
El conjunto de evidencia sobre los corticosteroides incluye 18 ensayos clínicos controlados aleatorizados (ECCA) y muestra que la administración de dosis bajas y moderadas (la dosis utilizada en el estudio RECOVERY fue dexametasona 6 mg diarios por vía oral o intravenosa durante 10 días) probablemente reducen la mortalidad en pacientes con infección grave por COVID19. Los resultados se mantuvieron uniformes tras agregar al análisis estudios en los que pacientes con SDRA de otras etiologías recibieron corticosteroides o manejo estándar de forma aleatoria. Esquemas con dosis más altas (por ejemplo dexametasona 12 mg por día) probablemente resulten más efectivos pero no ha sido demostrado [83] [84].
Corticosteroides inhalados
Los resultados de cuatro ECCA sugieren que los corticosteroides inhalados probablemente mejoran el tiempo de resolución de los síntomas y podrían reducir las hospitalizaciones. Sin embargo, la certeza en la evidencia es de moderada a baja y sus efectos sobre otros desenlaces importantes son inciertos. Se necesita más información.
Anticoagulación
Se trata de una aproximación racional teniendo en cuenta que las complicaciones trombóticas (arteriales y venosas) son comunes en pacientes hospitalizados con COVID-19 y son un predictor independiente de mal pronóstico. Asimismo los trombos microvasculares también contribuyen a la disfunción orgánica, incluido el SDRA. La patogénesis de la trombosis en COVID19 está íntimamente relacionada con la respuesta inflamatoria al virus, la infección endotelial, la activación y la lesión, así como con la hipercoagulabilidad.
Para los pacientes no críticos hospitalizados con COVID-19, la heparina en dosis terapéuticas parece beneficiosa, con una alta probabilidad de reducir la necesidad de soporte de órganos y la progresión a la intubación y muerte, independientemente de los resultados del dímero-D [85]. Los resultados de más ensayos controlados aleatorios posteriores también han respaldado el papel de la heparina en dosis terapéuticas en esta cohorte. Por el contrario, en pacientes en estado crítico, la heparina en dosis terapéuticas no mejoró los resultados y hubo una alta probabilidad de daño [86]. El ensayo INSPIRATION no demostró el beneficio de las dosis intermedias de heparina en comparación con las dosis bajas convencionales en este grupo de pacientes en estado crítico [87].
No está clara la anticoagulación prolongada después del alta hospitalaria. En pacientes no seleccionados hospitalizados con COVID19, las tasas de tromboembolismo venoso (TEV) notificadas después del alta hospitalaria fueron bajas, lo que, junto con el riesgo de hemorragia, arroja dudas sobre si la tromboprofilaxis posterior al alta está justificada. No obstante el ensayo MICHELLE ha informado que en pacientes con un alto riesgo de TEV y un bajo riesgo de hemorragia, el rivaroxabán en dosis bajas después del alta es eficaz para reducir los eventos trombóticos y la muerte relacionada con la trombosis con un bajo riesgo de hemorragia mayor [88].
Ivermectina
Es un medicamento muy conocido que está aprobado como antiparasitario Se usa ampliamente en países de ingresos bajos y medianos para tratar infecciones por gusanos. También se usa para el tratamiento de sarna y piojos, es uno de los medicamentos esenciales de la OMS. La ivermectina en las dosis usuales (0,2–0,4 mg/kg) se considera extremadamente segura para su uso en humanos. Además de su actividad antiparasitaria, se ha observado que tiene propiedades antivirales y antiinflamatorias, lo que lleva a una lista cada vez mayor de indicaciones terapéuticas.
Aunque hay muchos estudios y metanálisis sobre el beneficio de la ivermectina en el COVID19 no ha sido aún aprobada para esta indicación y de hecho la OMS solo la considera para estudios prospectivos.
El más reciente metanálisis de 15 ensayos encontró que la ivermectina redujo el riesgo de muerte en comparación con la ausencia de ivermectina (cociente de riesgos promedio 0,38, intervalo de confianza del 95 % 0,19–0,73; n = 2438; I2 5 49%; evidencia de certeza moderada). Este resultado se confirmó en diferentes métodos de análisis. Con una evidencia de certeza baja el metanálisis encontró que la profilaxis con ivermectina redujo la infección por COVID19 en un promedio del 86 % (95 % de confianza intervalo 79%–91%). No hay efecto beneficioso sobre la necesidad de ventilación mecánica [89].
Tocilizumab (RoActemra, Roche Pharma AG)
Es un mAb IgG1 humanizado recombinante que se une específicamente a receptores unidos a la membrana para IL-6 (sIL-6R y mIL-6R), por lo que inhibiendo esta vía de señalización reduce la actividad proinflamatoria de la IL6.
Malgie y cols. en un metanálisis de 10 estudios observacionales totalizando 1.358 pacientes que evaluaron el efecto de tocilizumab en la mortalidad de pacientes con COVID19, mostraron que la mortalidad fue un 12 % menor en el grupo de pacientes que recibieron tocilizumab aunque estos resultados requieren confirmación en ensayos controlados aleatorios (ECA) [90]. En otra revisión de Arthur y cols., los investigadores analizaron 10 ECA: Los resultados demostraron que el uso de tocilizumab se asoció con una disminución de la mortalidad de 24,4 % vs. 29,0. También tocilizumab redujo la necesidad de ventilación mecánica pero no el número de admisiones en la UCI [91]. Sin embargo, los resultados de un ensayo de fase 3 fueron contradictorios. El estudio NCT04320615 no presentó diferencia entre los grupos de tocilizumab y placebo [la mortalidad al día 28 fue 19,7 % – el grupo de tocilizumab y 19,4 % – el grupo de placebo [92].
En general se considera el uso de tocilizumab en pacientes hospitalizados con COVID19 con hipoxia y signos de laboratorio de inflamación significativa.
Remdesivir
Es un inhibidor de la replicación viral, aprobado por la FDA para el tratamiento de pacientes hospitalizados con neumonía COVID-19. En el estudio Solidaridad de la OMS, el remdesivir no tuvo un efecto clínicamente relevante sobre la mortalidad global, la necesidad de ventilación mecánica invasiva o la duración de la estancia hospitalaria. En este estudio también se vio ausencia de efecto clínico de hydroxicloroquina, lopinavir, e interferón [93]. Tras combinar dichos resultados con otros cuatro ECCA, se observó que el remdesivir podría reducir la mortalidad, la necesidad de ventilación mecánica invasiva y mejorar el tiempo de resolución de los síntomas [94]. Sin embargo, la certeza en la evidencia es baja y se necesitaba más información para confirmar estas conclusiones.
Hay un estudio más reciente aleatorizado, doble ciego, controlado con placebo en pacientes no hospitalizados con Covid19 que habían comenzado los síntomas en los 7 días anteriores y que tenían al menos un factor de riesgo para la progresión de la enfermedad (edad ≥60 años, obesidad o ciertas condiciones médicas coexistentes). Los pacientes fueron asignados al azar para recibir remdesivir intravenoso (200 mg el día 1 y 100 mg los días 2 y 3) o placebo. El criterio principal de valoración de la eficacia fue una combinación de hospitalización o muerte por cualquier causa relacionada con la COVID19 en el día 28. Los resultados fueron hospitalizaciones o muertes por cualquier causa relacionadas con la COVID19 en 2 pacientes (0,7 %) en el grupo de remdesivir y en 15 (5,3 %) en el grupo de placebo concluyendo un riesgo 87% menor de hospitalización o muerte que el placebo [95].
No obstante, la necesidad de administrar remdesivir por vía intravenosa durante 3 días consecutivos plantea importantes obstáculos logísticos para un sistema sanitario que ya está sometido a estrés. No conocemos los efectos sobre ómicron.
Hidroxicloroquina, interferón beta 1-a, lopinavir-ritonavir y plasma de convalecientes
El conjunto de evidencia no muestra beneficios. Incluso la evidencia sobre hidroxicloroquina sugiere que su utilización probablemente genere un incremento en la mortalidad [93].
Los resultados de 24 ECA que evaluaron el uso de plasma de convalecientes en pacientes con COVID19, incluido el estudio RECOVERY que incorpora 11.558 pacientes [96] mostraron ausencia de reducción de la mortalidad, ausencia de reducción en la necesidad de ventilación mecánica invasiva y ausencia de mejoría en el tiempo de resolución de los síntomas con certeza moderada. En pacientes leves, el plasma de convalecientes podría no reducir las hospitalizaciones con certeza baja. El plasma de convalecientes probablemente se asocia a un aumento en los eventos adversos graves con certeza moderada. No se observó un efecto diferencial entre aquellos pacientes tratados rápidamente (menos de 4 días desde el inicio de los síntomas) y aquellos con enfermedad más avanzada al iniciar dicho tratamiento [97] [98].
Anticuerpos monoclonales:
Bamlanivimab/etesevimab (Lilly), casirivimab/imdevimab(Regeneron), sotrovimab (GSK/Vir), evusheld (AZ)
Actúan sobre el pico S del virus. La EMA ha recomendado la autorización. Se trata de tratamientos que han de utilizarse durante las primeras fases de la infección, en pacientes de riesgo que no requieran oxigeno suplementario. Deben administrarse por via intravenosa o subcutánea (Ronapreve) En los estudios sobre ómicron tan solo sotromivab (GSK) parece ser efectivo y quizás también evusheld [99] [100] [101] [102] [103].
ANTIVIRALES
Molnupiravir (Lagevrio, Merck)
Es un análogo de nucleósido que induce mutaciones fatales en el genoma SARS-CoV-2; también ha demostrado actividad in vitro contra todas las variantes virales clínicamente significativas. En un estudio respaldado por el fabricante de pacientes adultos no vacunados de alto riesgo con COVID19 leve a moderado, el medicamento redujo las tasas de hospitalización o mortalidad por todas las causas en aproximadamente un 30% [104]. Debido a la preocupación sobre la posible mutagenicidad, no se recomienda molnupiravir durante el embarazo; y debido a la posible toxicidad para los huesos, cartílagos o ambos, el medicamento no ha sido autorizado para niños o adolescentes menores de 18 años. La dosis es de cuatro cápsulas de 200 mg dos veces al día durante 5 días. Los efectos secundarios se han limitado a una leve disminución de la hemoglobina.. No son necesarios ajustes renales o hepáticos y no se han identificado interacciones farmacológicas. Un comité asesor de la FDA también expresó sus preocupaciones sobre la capacidad potencial del fármaco para generar mutantes virales preocupantes. De hecho el molnupiravir preocupa en particular a la FDA y sus asesores lo suficiente como para que la agencia haya indicado a los médicos que lo usen solo si los agentes alternativos están contraindicados o no están disponibles. Este consejo presumiblemente coloca al molnupiravir como la última opción actual entre los agentes disponibles.
Nirmatrelvir (Paxlovid, Pfizer)
Es un inhibidor de la proteasa viral con actividad in vitro esperada contra todas las variantes del SARS-CoV-2 clínicamente significativas hasta la fecha. En estudio inédito financiado por el fabricante, nirmatrelvir reforzado con ritonavir, inhibidor de CYP3A, redujo las tasas de hospitalización o muerte por cualquier causa en casi un 90% entre los pacientes adultos no vacunados de alto riesgo ambulatorios con COVID19 leve a moderado confirmado. Se está llevando a cabo un estudio en el que participaron adultos vacunados de riesgo estándar. El medicamento también ha sido autorizado para niños y adolescentes no vacunados de 12 años o más. El régimen de dosificación consta de dos comprimidos de nirmatrelvir de 150 mg y un comprimido de ritonavir de 100 mg tomados juntos dos veces al día durante 5 días. La insuficiencia renal requiere una reducción de la dosis; los pacientes con enfermedad hepática o renal grave no deben recibir tratamiento. La coadministración con fármacos metabolizados por CYP3A o aquellos que inducen la enzima puede ser peligrosa. Dado que tanto la ciclosporina, el tacrolimus y los mTORi (sirolimus y everolimus) dependen en gran medida del metabolismo de CYP3A, sus niveles plasmáticos tras la exposición a ritonavir aumentarán significativa y rápidamente. Hasta la fecha, no se han asociado efectos adversos específicos con nirmatrelvir más ritonavir [105] [106].
9. ÓMICRON
Recientemente apareció una nueva variante que nos obliga a precisar algunos datos con un apartado al final de esta publicación. A fines de noviembre de 2021, la identificación de la variante ómicron del SARS-CoV-2 en Sudáfrica y Botswana, ha vuelto a cambiar la trayectoria de la pandemia. Los datos confirman que esta variante es sustancialmente más transmisible que la variante delta provocando un aumento exponencial de casos en todo el mundo. Además es capaz de una evasión inmune significativa (es decir, evade la protección inmune proporcionada por anticuerpos de vacunas o infección por CoV-2). Desde que se identificó inicialmente, ómicron se ha detectado en más de 90 países acumula más de 50 mutaciones, incluidas aproximadamente 32 en las proteínas de la espícula que es la que reconocen los anticuerpos disminuyendo potencialmente la inmunidad.
En datos de Pfizer, pero también de Moderna, se ha visto que la reducción en la protección en personas vacunadas con dos dosis se corrigió casi totalmente con una tercera dosis así que es posible obtener una buena protección contra esta nueva variante al recibir una vacuna de refuerzo [107]. Aun así, dos dosis de la vacuna BNT162b2 (Pfizer-BioNTech) brindan un 70% de protección contra las complicaciones graves de COVID-19 que requieren hospitalización, pero solo un 33% de protección contra la infección sintomática confirmada por laboratorio del SARS-CoV-2 (basado en datos de un informe revisado por pares de 581 casos de ómicron sintomáticos, 56.439 casos delta y 130.867 controles negativos en la prueba) [108]. Esta variante asimismo parece resistente a anticuerpos monoclonales con la excepción del sotrovimab y al plasma de convalecientes que se han recuperado de la infección.
Es importante el hecho de que la variante de ómicron no tiene mutaciones en partes de su genoma que son los objetivos de otros aspectos de la inmunidad inducida por la vacuna, incluyendo células T Estas células son parte de la segunda línea de defensa del cuerpo y generalmente son más difíciles de escapar para los virus. Si bien las células T no pueden prevenir la infección, ayudan a proteger contra enfermedades más graves y la muerte. Se ha visto en algunos estudios que la variante ómicron se replica 70 veces más rápido en tráquea y bronquios y 10 veces menos en tejido pulmonar que la delta a las 24 horas de la infección, lo que podría indicar una menor severidad de la enfermedad [109]. De hecho en los datos que tenemos hasta el momento la enfermedad por ómicron raramente requiere asistencia respiratoria con bajo número de pacientes con neumonía y una estancia hospitalaria de 2-3 días comparado con 8 días en las variantes anteriores. Un ejemplo en Sudáfrica de las complicaciones comparativas de las variantes beta, delta y ómicron puede verse en la (Figura 4), tanto para admitidos en hospital, como para necesidades de oxígeno, enfermedad severa o muerte [110]. Estos datos han sido corroborados en diferentes países. Así en el Reino Unido el riesgo de acudir a urgencias o ser admitido en el hospital es un 50% más bajo con ómicron que con delta y el riesgo de ser admitido en la UCI un 83% menor en un estudio canadiense. En pacientes no vacunados se ha visto enfermedad moderada severa con más prevalencia.
Ómicron, con su grado extraordinario y sin precedentes de eficiencia de transmisibilidad, finalmente infectará a casi todos.
10. COVID19 PERSISTENTE
Las secuelas del Covid19 afectan a las personas que lo han padecido aunque no necesariamente hayan sido hospitalizadas. Múltiples síntomas como disnea, fatiga, cansancio, tos, pérdida de concentración, mialgias, parestesias….. etc. no se comprenden aún bien y de ahí la importancia de una consulta interdisciplinar En parte pueden ser debidas al efecto directo del virus (citoquinas, hipoxia, inflamación, neurotropismo..) o también a efectos indirectos sobre la salud mental [111].
La COVID19 aguda suele durar hasta 4 semanas desde el inicio de los síntomas, más allá de las cuales la replicación competente del SARS-CoV-2 no ha sido aislado. La COVID19 postaguda o persistente se define como síntomas persistentes y/o complicaciones tardías o a largo plazo más allá de las 4 semanas desde el inicio de los síntomas.
Entre las personas con un diagnóstico previo de COVID19, las estimaciones de la prevalencia de secuelas oscilan entre el 5 % entre las personas no hospitalizadas y el 80 % entre las personas hospitalizadas.
10.1. Síntomas frecuentes del Covid19 persistente
En la (Figura 5), se resumen los síntomas comunes observados en el post-agudo de COVID19. Se pueden experimentar diferentes combinaciones de los siguientes síntomas :
• Cansancio o fatiga
• Dificultad para pensar o concentrarse (a veces denominada "niebla mental")
• Dolor de cabeza
• Pérdida del olfato o del gusto
• Mareos al estar de pie
• Palpitaciones del corazón (latidos rápidos o fuertes)
• Dolor en el pecho
• Dificultad para respirar
• Tos
• Dolor articular o muscular
• Depresión o ansiedad
• Caída de pelo
• Fiebre
• Malestar post-esfuerzo (síntomas que empeoran después de actividades físicas o mentales)
10.2. Fisiopatología de los síntomas del Covid19 persistente
Ya hemos visto que los mecanismos fisiopatológicos predominantes de la COVID19 aguda incluyen: toxicidad viral directa; daño endotelial y lesión microvascular; desregulación del sistema inmunitario y estimulación de un estado hiperinflamatorio; hipercoagulabilidad con microtrombosis y macrotrombosis.
Los posibles mecanismos que contribuyen a la fisiopatología de la COVID19 persistente incluyen los cambios en la fisiopatología específica del virus, alteraciones inmunológicas habiéndose descritos autoanticuerpos y daño inflamatorio consecuencia de la infección aguda y finalmente secuelas esperadas de enfermedad postcrítica tras estancias en la UCIs con alteraciones físicas, cognitivas y psiquiátricas después de la enfermedad. Además, similar a estudios previos de pacientes que tuvieron SARS 25-30% de los cuales experimentaron infecciones secundarias los sobrevivientes de COVID19 agudo pueden tener un mayor riesgo de infecciones con bacterias, hongos (aspergilosis pulmonar) u otros patógenos. Sin embargo, estas infecciones secundarias no explican las secuelas persistentes y prolongadas del COVID19 de larga duración.
10.3. Covid19 persistente y enfermedad renal
Ya hemos comentado como la IRA con sustitución de la función renal ocurre en 5% de todos los pacientes hospitalizados y 20-31% de los pacientes en estado crítico con COVID19 agudo, particularmente entre aquellos con infecciones graves que requieren ventilación mecánica. Los primeros estudios con seguimiento a corto plazo en pacientes que requieren diálisis mostraron que 27-64% eran independientes de diálisis a los 28 días o al alta de la UCI [112] [113] [114]. Un estudio de EE. UU. que utilizó registros de salud electrónicos de la Administración de Salud de Veteranos (VHA) para realizar una evaluación integral de la COVID prolongada informó que la COVID-19 aumentó el riesgo de ERC y que este riesgo fue mayor entre quienes tenían una enfermedad grave [115].
La afectación renal es común en pacientes con infección aguda por SARS-CoV-2, y la inflamación y lesión subclínicas pueden persistir durante muchos meses, lo que da como resultado una disminución progresiva de la función renal que conduce a una ERC. El COVID19 podría afectar al riñón de múltiples formas y la contribución de estos factores podría variar con el tiempo. Muchos de los efectos directos e indirectos del virus SARS-CoV-2 podrían persistir durante la recuperación después del alta hospitalaria y podrían dar lugar a episodios repetidos de sepsis, IRA recurrente y mayor riesgo de ERC. Pero también es probable que la relación entre COVID19 y ERC sea bidireccional. La ERC leve podría aumentar el riesgo de COVID-19 y IRA asociada, mientras que la mayor gravedad de la IRA podría estar asociada con disfunción renal persistente, recuperación retrasada y/o necesidad de diálisis a largo plazo.
Los estudios preclínicos han demostrado el desarrollo y la persistencia de la inflamación, la fibrosis renal, los perfiles de expresión génica anormales del riñón y los déficits funcionales después de la lesión renal isquémica, a pesar del retorno de las concentraciones séricas de creatinina a los valores normales. Se trata de un asunto muy importante para los servicios de Nefrología pues puede que la creatinina sérica vuelva a cifras normales pero con disminución de la reserva funcional renal. Es importante el seguimiento de estos pacientes con información de biomarcadores de lesión renal. La nefrología debe estar presente en las clínicas de Covid19 persistente.
11. PRÓXIMO Y URGENTE RETO: VACUNAS UNIVERSALES CONTRA CORONAVIRUS
Los primeros trabajos publicados sobre las vacunas mRNA en New Eng J Med demostraron que protegían un 95% de la enfermedad moderada severa que era el objetivo primario del estudio. No que protegieran de la infección pues no son vacunas esterilizantes del tracto nasofaríngeo. Y así se ha visto a medida que ha ido avanzando la vacunación.
La aparición en Sudáfrica de la variante ómicron con 32 mutaciones en su proteína del pico, ha complicado la pandemia pues su número R0 ha llegado hasta 1,8, es decir, altísimamente contagiosa ocasionando una sexta oleada de crecimiento exponencial. Si bien parece que esta variante, como hemos visto, es menos agresiva, ha sobrecargado nuestros servicios sanitarios, pero afortunadamente la vacunación, de la tercera dosis especialmente, nos ha protegido ampliamente de enfermedad moderada severa, de ingresos hospitalarios y de muertes.
El virus ha mutado lo suficiente como para escapar de las defensas inmunitarias de primera línea, específicamente los anticuerpos, y por eso vemos las infecciones en personas vacunadas. La evolución la sabremos mejor cuando conozcamos en el tiempo la duración de las respuestas inmunitarias de los individuos incluidas la de las células T. Es cierto que la variante ómicron agregará mucha más inmunidad a nuestra población y, además, hay estudios que sugieren que los anticuerpos neutralizantes producidos por la infección por ómicron siguen siendo efectivos contra la variante delta, lo que reduce el riesgo de infecciones delta con el tiempo. Con la tercera dosis (y la cuarta para los inmunosuprimidos), los antivirales orales (Paxlovid de Pfizer especialmente), la inmunización generada por ómicron y la progresiva vacunación mundial es posible que podamos controlar la pandemia Además aparecerán vacunas en spray nasal esterilizantes así como vacunas combinadas y puede que la pandemia se haga endémica de manera que el coronavirus sea uno más de los virus estacionales de invierno, junto al VSR y la gripe.
Pero tenemos datos para pensar que no podremos eliminar el Sars-Cov-2 aunque sea posible su erradicación. Por importantes que sean las vacunas, sin embargo, su eficacia protectora disminuye con el tiempo, lo que requiere dosis de refuerzo. La vacunación tampoco ha sido capaz de prevenir infecciones lo que permite la transmisión subsiguiente a otras personas incluso cuando la vacuna previene enfermedades graves y mortales. Las personas que se han infectado de forma natural con el SARS-CoV-2 pueden reinfectarse naturalmente, como se ha demostrado con virus corona endémicos, virus de influenza, virus respiratorio sincitial (RSV) muchos otros virus respiratorios.
Además, la inmunidad conseguida con la infección natural con SARS-CoV-2, combinado con la inmunidad inducida por la vacuna no ha conseguido hasta ahora impedir la aparición y rápida propagación de variantes virales como el delta o ómicron altamente transmisibles.
La evidencia científica y la realidad ecológica apuntan a la aparición de nuevas variantes de coronavirus que amenacen a la población mundial. Los betacoronavirus que han causado estas epidemias se distribuyen globalmente en numerosas especies de murciélago y se desconoce el reservorio de la extensión virológica y geográfica completa de este proceso infeccioso animal continuado. Necesitamos investigar este universo de coronavirus en múltiples especies, caracterizar la historia natural y la patogenia de los coronavirus en animales de laboratorio y en humanos, y aplicar esta información en el desarrollo de vacunas “universales” ampliamente protectoras contra todos los virus betacorona, e idealmente contra todos los coronavirus [116].
En palabras del Dr. Anthony Fauci, director del Instituto Nacional de Alergia y Enfermedades Infecciosas de EEUU (NIAID), nuestra experiencia con la pandemia actual de Covid-19, junto con la amenaza siempre presente de la aparición de otros coronavirus potencialmente pandémicos, requiere el desarrollo de vacunas universales contra el coronavirus seguras y de amplia protección. Este es un desafío que ahora debemos comprometernos plenamente a abordar [117].