Enfermedad renal en procesos hematológicos malignos y aumento de cáncer después del trasplante de riñón (2020)
La relación bidireccional entre cáncer y la enfermedad renal crónica (ERC) es compleja. Los pacientes con cáncer particularmente aquellos con neoplasias hematológicas como mieloma múltiple y linfoma, tienen un elevado riesgo de desarrollar insuficiencia renal aguda y ERC. Por otro lado, hay evidencia creciente en análisis de grandes registros observacionales que han demostrado consistentemente que el riesgo de cáncer aumenta al menos 2 a 3 veces en receptores de trasplantes renales y este aumento de riesgo observado ocurre no solo en aquellos que han recibido un trasplante de riñón, sino también en aquellos en diálisis y con ERC leve o moderada. Las interacciones entre el cáncer y la ERC han planteado importantes desafíos en el manejo de estos pacientes. Dada la magnitud del problema y las incertidumbres, y controversias actuales dentro de la evidencia existente, KDIGO reunió un panel global de expertos clínicos y científicos multidisciplinarios en una conferencia de controversias sobre onconefrología para identificar los problemas clave de gestión en nefrología en relación con malignidad. Esta publicación cubre las controversias discutidas en enfermedades hematológicas malignas y en cáncer después de trasplante de riñón. Se discuten asimismo con una visión general las prioridades de investigación futuras.
El cáncer está siendo reconocido como una complicación importante en pacientes con enfermedad renal crónica (ERC). La magnitud del aumento del riesgo varía según la gravedad de la ERC, con mayor riesgo entre los receptores de trasplante de riñón. La evidencia de los análisis observacionales longitudinales ha sugerido que el riesgo excesivo de cáncer y muerte relacionada con el cáncer en los receptores de trasplante de riñón es al menos 2 veces mayor que la población general ajustada por sexo y edad [1][2]. Específicamente, el riesgo excesivo de cánceres relacionados con virus como la enfermedad linfoproliferativa y el sarcoma de Kaposi es 10 veces mayor [1]. La malignidad hematológica u oncológica también se asocia con una plétora de problemas renales, como ERC, lesión renal aguda (IRA), alteraciones electrolíticas, glomerulonefritis y púrpura trombocitopénica trombótica. Tanto la ERC como la IRA pueden ser causadas por procesos relacionados con la malignidad o los tratamientos para ella [3]. En pacientes con neoplasias hematológicas, la ERC puede resultar de una lesión directa por células cancerosas o una lesión indirecta a través de mecanismos mediados inmunológicamente, como ocurre con la nefropatía membranosa [4]. La IRA en pacientes con malignidad puede ser causada por infiltración linfomatosa de los riñones, nefropatía por cilindros (cast) en el mieloma múltiple y gammapatías monoclonales, y síndrome de lisis tumoral (SLT), y estos ocurren principalmente en neoplasias malignas con alta carga tumoral y rápido recambio celular [4][5][6]. En pacientes tratados con trasplante de células hematopoyéticas, existen varias causas tanto de IRA como de ERC [7]. El riesgo de IRA puede verse potenciado por varios factores: deshidratación debido a vómitos, diarrea, obstrucción de las vías urinarias alteraciones del tracto, líquidos y electrolitos, administración de agentes de contraste, antiinflamatorios no esteroideos, antibióticos nefrotóxicos y toxicidad renal de fármacos quimioterapéuticos o dirigidos [4][5][6]. Se ha estimado que la incidencia de IRA en pacientes con neoplasias hematológicas de alto grado alcanza el 68,5% utilizando los criterios RIFLE (riesgo, lesión, fallo, pérdida de función, enfermedad renal en etapa terminal [ERT]), con más del 90% de los casos resultantes por hipoperfusión, necrosis tubular aguda, SLT, nefrotoxinas o linfohistiocitosis hemofagocítica [8].
La mejora de los resultados del cáncer a través de mejores diagnósticos y terapias personalizadas, como medicamentos selectivos para el genoma y para el sistema inmunológico, ha dado como resultado una población creciente de sobrevivientes de cáncer [9] que tienen un mayor riesgo de enfermedad renal. El cuidado de pacientes oncológicos se ha vuelto más especializado e interdisciplinario, requiriendo actualmente la colaboración entre especialistas en nefrología, medicina de trasplantes, oncología médica, cuidados críticos, farmacología/farmacia clínica y cuidados paliativos, además de cirujanos y urólogos. Para identificar las claves del manejo nefrológico de los pacientes con neoplasias, KDIGO (Kidney Disease: Improving Global Outcomes) reunió un panel global multidisciplinar de expertos clínicos y científicos en una conferencia de controversias sobre onconefrología en Milán, Italia, en diciembre de 2018. El informe resultante aborda los problemas relacionados con el riñón en las neoplasias hematológicas y analiza la magnitud el problema del cáncer en los receptores de trasplante renal.
ENFERMEDAD RENAL EN HEMATOLOGÍA
Reconocimiento y prevención del síndrome de lisis tumoral (SLT)
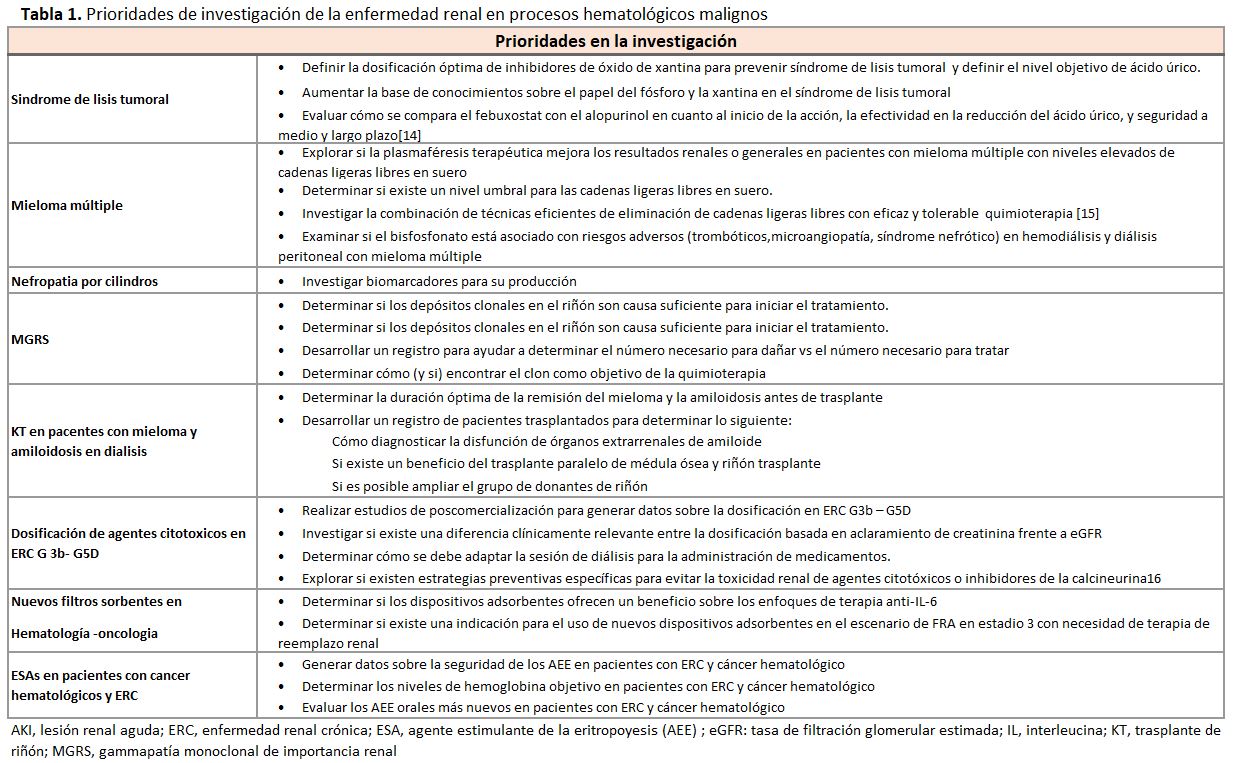
El SLT es una emergencia hemato-oncológica que se produce por la muerte de células tumorales, espontánea o inducida por quimioterapia. Puede clasificarse como una forma de laboratorio o una forma clínica en la que las alteraciones metabólicas pueden sobrepasar la capacidad homeostática y tener consecuencias clínicas graves. El desarrollo de nuevos fármacos oncológicos ha superado a la investigación relativa al SLT y, por tanto, la incidencia y la prevalencia del SLT no están bien definidas. El riesgo de SLT depende del tipo de tumor, la carga tumoral, las características del paciente y el tipo de terapia. En la definición comúnmente utilizada de SLT [10] se utiliza un criterio de lesión renal desactualizado que debe actualizarse a la definición actual de AKI de KDIGO [11].
Para evaluar el riesgo de SLT debe efectuarse en todos los pacientes una medición basal de electrolitos (sodio, potasio, fósforo, magnesio y calcio), filtrado glomerular estimado (FGe) y ácido úrico. La frecuencia de las mediciones de laboratorio depende del perfil de riesgo. El papel predictivo del valor basal del ácido úrico para el SLT se desconoce. Con la creciente disponibilidad de nuevas terapias dirigidas contra dianas moleculares y células inmunes, tales como anticuerpos monoclonales, inhibidores de la quinasa dependiente de ciclina, inhibidores del proteasoma, agentes proapoptóticos y terapia de células T con receptor de antígeno quimérico (células CAR-T), el espectro de neoplasias con riesgo de SLT está expandiéndose y ahora incluye leucemia linfocítica crónica, leucemia mieloide crónica, mieloma múltiple y varios tumores sólidos. [12][13].
Los inhibidores de la xantina oxidasa (IXO) son los fármacos de elección para prevenir el SLT, aunque no se han definido la dosis y el nivel objetivo de ácido úrico (Tabla 1)[14][15][16 ][17]. Para los pacientes con SLT establecido y función renal normal, el alopurinol es el IXO preferido. El febuxostat es una alternativa para reducir el ácido úrico; en el ensayo FLORENCE, una dosis fija de febuxostat iniciada 2 días antes del inicio de la quimioterapia y mantenida durante 7 a 9 días logró un control de ácido úrico sérico significativamente superior al obtenido con alopurinol, con un perfil de seguridad y una preservación de la función renal comparables. Para tratamientos más prolongados (como en la gota), el perfil de seguridad de febuxostat sigue siendo incierto. La administración de febuxostat durante un periodo corto puede ser una buena alternativa, especialmente considerando que se puede lograr una respuesta rápida [14][15][16][17][18]. Aunque el febuxostat es ahora genérico y su costo ha disminuido, sigue siendo más caro que el alopurinol, haciendo que el coste sea un factor a tener en cuenta en muchas regiones. Por otra parte, la rasburicasa es un tratamiento muy eficaz para el SLT [19], aunque se desconoce su dosis y frecuencia óptimas, y la disponibilidad y el costo pueden ser prohibitivos. Publicaciones recientes indican que la rasburicasa en dosis única es eficiente para prevenir y controlar el SLT [20], lo que podría ampliar la accesibilidad. La terapia secuencial con rasburicasa y un IXO ha mostrado ser eficaz [21].
La evidencia con respecto a la prevención del SLT es limitada. En los ensayos de leucemia aguda, las tasas descritas de SLT fueron del 42% y 53% con alvocidib (con citarabina y mitoxantrona secuencial) y del 15% con dinaciclib. Venetoclax se asocia al mayor riesgo de SLT en la leucemia linfocítica crónica (8,3% y 8,9% en 2 ensayos), mientras que la incidencia de SLT es <5% con brentuximab vedotin (para linfoma anaplásico de células grandes), carfilzomib y lenalidomida (para mieloma múltiple), dasatinib (para leucemia linfoblástica aguda) y oprozomib (para diversas neoplasias hematológicas) [22]. Aunque el papel predictivo del ácido úrico basal para el SLT todavía se debate, las guías para el SLT pediátrico y adulto sugieren que el riesgo de desarrollar SLT y eventos renales aumenta 1,75 y 2,21 veces respectivamente por cada mg/dl de incremento del ácido úrico sérico [23].
Aspectos relacionados con el mieloma múltiple
Tratamiento extracorpóreo para el manejo de la nefropatía por cilindros del mieloma múltiple.
Si se utilizan tratamientos extracorpóreos, se deben monitorizar los niveles de cadenas ligeras libres (CLL) en suero. Los niveles elevados de CLL se asocian con una menor supervivencia global y libre de eventos [24], mientras que su reducción rápida conlleva una mejor supervivencia renal y global [25]. El tratamiento de soporte y la quimioterapia deben iniciarse siempre lo antes posible, antes que la plasmaféresis terapéutica (PT o TPE por sus siglas en inglés) o la hemodiálisis con dializadores de poro grueso (high cut-off hemodialysis o HCO-HD). Se desconoce si la PT mejora el resultado global o renal en pacientes con mieloma múltiple y CLL elevadas (Tabla 1). La mayoría de los ensayos de PT en la nefropatía por cilindros son de la era pre-bortezomib. En un ensayo publicado en 1988 que incluyó a 29 participantes, la PT demostró eficacia para eliminar las cadenas ligeras de la circulación y mejorar los resultados [26]. Sin embargo, en una población con mayor número de pacientes sometidos a quimioterapia (n=104), antes de la introducción de bortezomib, la PT no demostró mayor eficacia respecto a un endpoint compuesto de muerte, dependencia de diálisis o tasa de filtración glomerular
Se desconoce el valor de los niveles de CLL para iniciar o suspender el tratamiento extracorpóreo. La HCO-HD puede eliminar eficazmente las cadenas ligeras [29] y también se ha mostrado que puede eliminar agentes citotóxicos [30] y analgésicos [31]. Ensayos no controlados sugieren que el uso de HCO-HD puede mejorar la respuesta renal [32][32][33]. Sin embargo, en un estudio de pacientes con nefropatía por cilindros de mieloma tratados con un régimen quimioterápico basado en bortezomib, el uso de HCO-HD en comparación con la hemodiálisis convencional no mostró una diferencia estadísticamente significativa en cuanto a independencia de hemodiálisis a los 3 meses [34]. Durante un seguimiento durante 2 años de los 90 pacientes incluidos en el ensayo EuLITE (estudio controlado aleatorizado de fase 2), se notificaron 98 eventos adversos graves en el grupo HCO-HD y 82 en el de hemodiálisis de alto flujo (HF-HD) [35]. Los eventos adversos graves más comunes fueron infecciones, eventos cardiovasculares, trombóticos, y los relacionados con el sistema musculoesquelético. Durante los primeros 90 días, se notificaron 26 infecciones (incluyendo 14 pulmonares) en el grupo HCO-HD, y 13 (incluyendo 3 pulmonares) en el grupo HF-HD [35]. En base a estos resultados no se ha propuesto la realización de ensayos en fase 3 con HCO-HD. Sin embargo, la necesidad de mejorar las estrategias terapéuticas frente a la nefropatía por cilindros (riñón del mieloma), nos obliga a investigar el efecto de la combinación de técnicas eficientes de eliminación de CLL con esquemas de quimioterapia eficaces y tolerables [15].
En el 2012, un estudio en modelos animales identificó un péptido cíclico que interfiere con la unión de las cadenas ligeras con la proteína Tamm-Horsfall [36], su interés radica en que podría evitar el empleo de técnicas extracorpóreas para la eliminación de estas cadenas. Sin embargo, por el momento no se han realizado estudios en humanos.
Manejo de la enfermedad ósea relacionada con el mieloma múltiple.
Aunque los bisfosfonatos están contraindicados en pacientes con enfermedad renal avanzada, el pamidronato en monodosis (30 mg) no requiere ajuste de dosis si FGe es > 30 ml/min por 1,73 m2. Los datos de un estudio a doce meses indican que el pamidronato también se puede utilizar en pacientes con hemodiálisis [37].
Elegir entre bisfosfonato o denosumab.
En el mieloma múltiple de inicio, denosumab no fue inferior al ácido zoledrónico en relación con eventos esqueléticos y mostró una menor toxicidad renal [38]. No obstante, existen pocos datos sobre la no inferioridad en seguridad de denosumab frente al empleo de alendronato en pacientes con hemodiálisis, especialmente en relación con el riesgo de hipocalcemia grave [39]. Lo mismo parece ocurrir en los pacientes en diálisis peritoneal [40]. Es necesario analizar si el bisfosfonato pudiera estar asociado a eventos adversos (Tabla 1).
Manejo de inhibidores de la calcineurina.
En los receptores de trasplante de células madre alogénicas, tacrolimus mostró una menor probabilidad de IRA que la ciclosporina. Los niveles sanguíneos de estos fármacos deben medirse de manera regular. Se desconoce si la disminución de los niveles de inhibidores de la calcineurina para reducir el riesgo de IRA podría aumentar el riesgo de enfermedad de injerto contra huésped. Sin embargo, en los trasplantes de células madre hematopoyéticas alogénicas, la presencia de niveles de ciclosporina > 195 mg/l en el 10º día posterior al trasplante, se asoció con una reducción significativa de enfermedad aguda de injerto contra huésped [41]. No está clara la utilidad de la biopsia renal en pacientes con IRA en tratamiento con inhibidores de la calcineurina. Debido a que estos fármacos pueden causar microangiopatía trombótica, se debe considerar esta entidad ante la presencia de hipertensión, trombocitopenia y elevación de lactato deshidrogenasa.
El papel de la biopsia renal en la nefropatía por cilindros. Se recomienda la realización de la biopsia renal en la IRA que se produce tras el inicio de la quimioterapia para confirmar la presencia de una nefropatía por cilindros. Mientras se esperan los resultados de la biopsia no se debe retrasar el inicio del tratamiento. No hay evidencias de un mayor riesgo de sangrado en estos pacientes [42]. Se desconoce la proporción de otro tipo de nefropatías en los pacientes con sospecha de nefropatía por cilindros. Sería interesante disponer de posibles biomarcadores para predecir el riesgo de desarrollar una nefropatía por cilindros. En el 2014, el International Myeloma Working Group actualizó los criterios para el diagnóstico de mieloma múltiple y definió la nefropatía por cilindros como un hallazgo definitivo de mieloma y lo identificó como biomarcador valido de malignidad [43].
Determinar qué pacientes con gammapatía monoclonal de significado renal deben recibir tratamiento
A todos los pacientes con gammapatía monoclonal de significado renal (GMSR) (por ejemplo, amiloidosis de cadena ligeras, enfermedad por depósitos de cadenas ligeras, glomerulopatía C3, síndromes linfoproliferativos tras el trasplante, inmunotacidoide, etc.) se les debe ofrecer tratamiento. En el consenso del International Kidney and Monoclonal Gammapathy Research Group (IKMG) [44], se redefinió la GMSR como un trastorno proliferativo clonal que produce una Ig monoclonal nefrotóxica y que no cumple criterios hematológicos para tratamiento como una enfermedad maligna. El diagnóstico de la enfermedad relacionada con GMSR se establece mediante técnicas de inmunofluorescencia en la biopsia renal que permitan identificar los depósitos de Ig (aunque estos depósitos son mínimos en pacientes con glomerulopatía C3 o microangiopatía trombótica). Por tanto, el IKMG recomienda realizar una biopsia renal en casos sospechosos de GMSR; también es necesario realizar electroforesis en sangre y orina, inmunofijación, así como los análisis de CLL en suero, para identificar la Ig monoclonal responsable. Por último, se debe realizar aspirado y biopsia de médula ósea para identificar el clon linfoproliferativo. La citometría de flujo puede ser útil para identificar pequeños clones. Las pruebas genéticas adicionales y los estudios de hibridación fluorescente in situ (FISH) son útiles para la identificación clonal y para generar recomendaciones de tratamiento. Sin embargo, existen dificultades en todo el proceso diagnóstico, y todavía se requiere un alto grado de sospecha clínica para diagnosticar una GMSR [45]. Por el momento, la indicación y el momento para iniciar el tratamiento sigue siendo controvertido (Tabla 1), por lo que sería recomendable compartir esta decisión entre hematólogos, nefrólogos y pacientes.
Quimioterapia para el tratamiento de la gammapatía monoclonal de significado renal
El tratamiento de la GMSR generalmente incluye un inhibidor del proteasoma, aunque se desconoce la combinación óptima de agentes [46]. Los parámetros que se deben evaluar para conocer el efecto del tratamiento sobre el riñón son el cambio en la FGe y el grado de proteinuria.
Candidatos a trasplante renal en pacientes con mieloma múltiple y amiloidosis en diálisis
Informes anecdóticos [47] sugieren que puede considerarse el trasplante renal en pacientes con mieloma múltiple en remisión [48], y que puede intentarse, una vez que se consiga la remisión completa hematológica en la amiloidosis. Sin embargo, la duración óptima de la remisión antes del trasplante es desconocida (Tabla 1). La ausencia de disfunción orgánica extrarrenal por amiloide se considera un prerrequisito para el trasplante. El propéptido natriurético N-terminal como marcador de fallo cardíaco es de uso limitado en la ERC avanzada.
Dosis de agentes citotóxicos en pacientes con ERC G3b-G5D
Los estudios de dosificación en pacientes con ERC G3b-G5D no son parte del proceso regulatorio de aprobación de fármacos en Estados Unidos ni en Europa. Por lo tanto, se carece de estudios que determinen la dosificación óptima de la mayoría de los agentes citotóxicos en pacientes con ERC G3b-G5D [49]. Las agencias reguladoras deberían abordar este problema y una estrategia podría ser realizar estudios poscomercialización) obligatorios (Tabla 1).
Papel de las nuevas terapias adsorbentes en pacientes de Hematología/Oncología
No existe beneficio probado de usar las nuevas terapias adsorbentes en pacientes de Hematología/Oncología [50]. Se desconoce si las terapias adsorbentes ofrecen beneficios sobre la terapia anti-interleuquina 6 o si hay alguna indicación para el uso de las nuevas terapias adsorbentes en el contexto del fracaso renal agudo estadio 3 (IRA estadio 3) con necesidad de tratamiento sustitutivo renal.
Analgésicos para el manejo de dolor a largo plazo en pacientes con ERC y dolor asociado al cáncer
El tratamiento apropiado del dolor en pacientes con cáncer continúa siendo un tema sin resolver. Evitar de forma general los opioides no está justificado en pacientes con neoplasias. Los fármacos antiinflamatorios no esteroideos deben usarse con precaución en pacientes con ERC avanzada o con riesgo elevado de padecerla. El ratio riesgo beneficio de gabapentina y pregabalina debería valorarse de forma individualizada. Deberían considerarse todos los componentes de las guías recomendadas por la OMS [51].
Determinar qué pacientes con cáncer hematológico y ERC pueden recibir agentes estimulantes de la eritropoyesis (AEE)
En pacientes con cáncer hematológico, el estatus férrico debería optimizarse antes de iniciar tratamiento con AEE. Los datos sobre los potenciales efectos adversos de los AEE en pacientes con tumores sólidos no pueden ser aplicados a pacientes hematológicos. Los AEE tienen un potencial riesgo de promover la actividad tumoral, y este riesgo debería sopesarse frente a los beneficios. Además, los niveles objetivo de la hemoglobina no están claros. Los nuevos AEE orales no han sido evaluados en esta población de pacientes.
Toma de decisiones para iniciar o suspender el tratamiento sustitutivo renal
Las expectativas de lo que la diálisis puede aportar de forma razonable a pacientes con cáncer hematológico son en ocasiones irrealmente elevadas, tanto en los pacientes como en sus cuidadores [52]. Es mandatorio realizar una estimación de pronóstico general basado en el estatus integral del paciente (incluyendo edad, estado funcional basal, fragilidad, malnutrición, comorbilidades y comedicaciones). Es necesaria una valoración por un equipo multidisciplinar y una comunicación fluida entre hematólogos/oncólogos y nefrólogos, para facilitar la discusión del inicio de tratamiento sustitutivo renal. Además, es necesaria una comunicación de la información de forma empática, realizando una toma de decisiones compartida, que respete la autonomía del paciente y sea compatible con los objetivos y valores personales del paciente [53].
No se dispone de predictores de supervivencia a corto plazo tras el inicio de tratamiento sustitutivo renal de pacientes con cáncer hematológico. No iniciar tratamiento sustitutivo renal es una opción válida, pues el pronóstico puede ser similar a la terapia con diálisis, con una mejor calidad de vida. En general, las declaraciones de voluntades previas (testamento vital) están infrautilizadas, y es posible que el consejo en declaraciones anticipadas pueda ser una estrategia efectiva para evitar la toma de decisiones en circunstancias de emergencia. Para pacientes que no inician diálisis o que discontinúan diálisis, deberían considerarse y ofrecerse cuidados paliativos. Otra posible opción es un período de prueba de tratamiento sustitutivo renal en la unidad de cuidados intensivos y ver evolución.
CÁNCER EN PACIENTES TRASPLANTADOS RENALES
Epidemiología
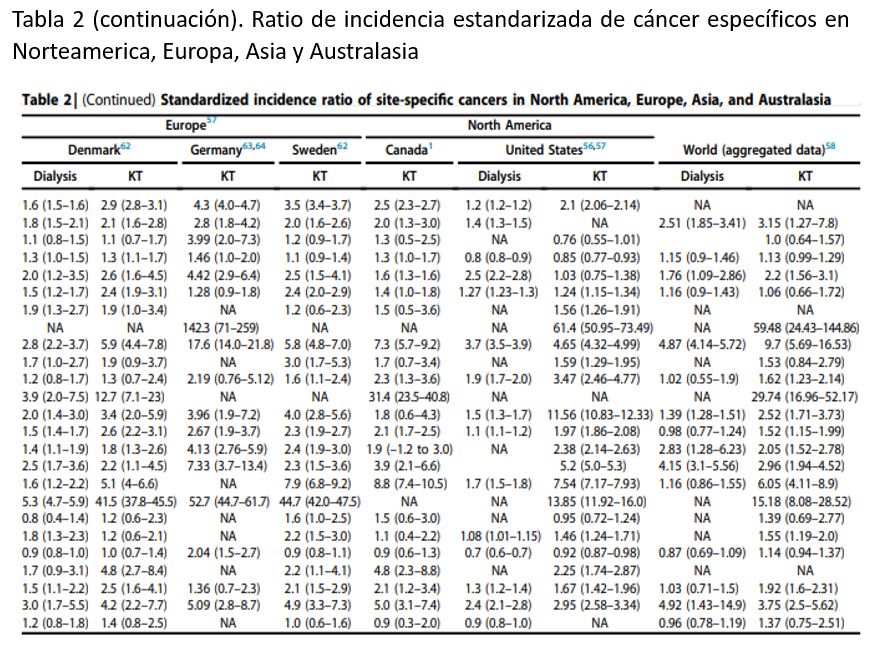
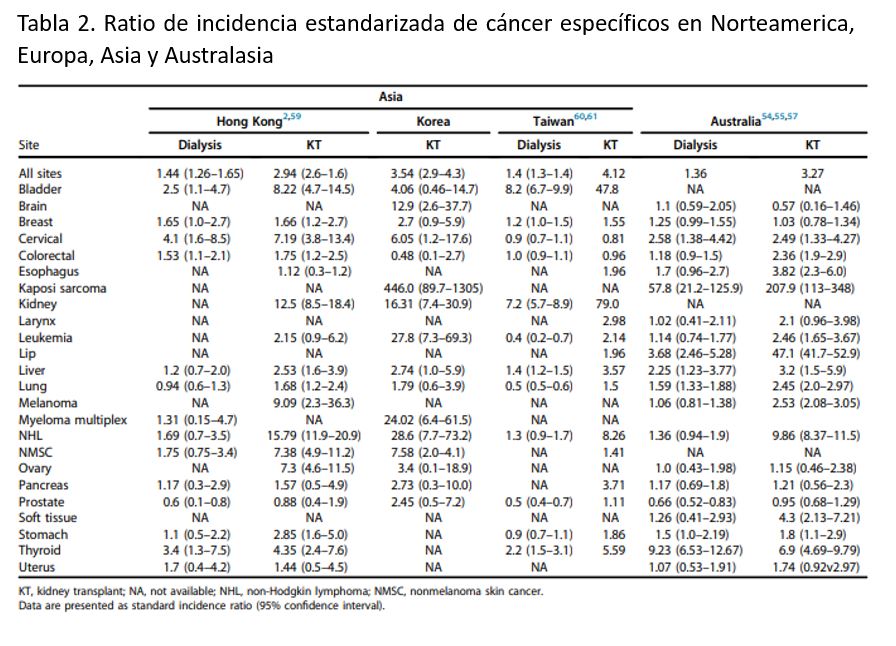
Un registro robusto y contundente de datos indica que el riesgo general de cáncer en pacientes trasplantados renales está aumentado al menos 2-2.5 veces comparado con la población general, ajustado por edad y género (Tabla 2) y (Tabla 3) [1][2][54][55][56][57][58][59][60][61][62][63][64]. Los pacientes que tienen el mayor riesgo son aquellos con un cáncer relacionado con virus, como sarcoma de Kaposi (20 veces superior), cáncer cervical (5 a 10 veces superior) y enfermedad linfoproliferativa postrasplante [1][54]. Otras neoplasias de órgano sólido como cáncer colorrectal o de pulmón (aproximadamente 2-3 veces superior) tienen un incremento modesto de la incidencia comparado con la población general, ajustados por edad y género [1][54]. Otros tumores como el de mama o próstata no suponen un exceso de riesgo en pacientes trasplantados. El riesgo aumentado de cáncer también ha sido demostrado en pacientes en diálisis y aquellos con ERC leve-moderada, por lo que este riesgo aumentado no parece estar relacionado sólo con la inmunosupresión, sino también puede ser debido a condiciones asociadas a la ERC, como la uremia y la inflamación crónica [57][59][62].
El cáncer es la principal causa de incremento de mortalidad entre pacientes trasplantados [2]. Los datos sugieren que el riesgo de muerte en pacientes trasplantados renales está incrementado al menos 2-3 veces comparado con la población general, ajustados por edad y género [63]. Las causas de este elevado riesgo no están claras pero pueden resultar de alteraciones en la biología del tumor en el contexto de la inmunosupresión y/o diferencias en los enfoques quimioterápicos, particularmente en receptores con comorbilidades coexistentes. El riesgo incrementado de cáncer y mortalidad relacionada con cáncer, observados en los pacientes trasplantados, se atribuye predominantemente a cáncer relacionados con virus, tales como la enfermedad linfoproliferativa postrasplante (virus Epstein-Barr), sarcoma de Kaposi, derrame primario de linfoma primario (virus herpes humano tipo 8) piel, orofaringe, lengua, cáncer anogenital (cérvix, vagina, vulva, ano, pene (virus papiloma humano), carcinoma de células de Merkel (poliomavirus células de Merkel) y carcinoma hepatocelular (hepatitis B y C) [61][64].
Los datos epidemiológicos sobre la incidencia y los desenlaces de los receptores de trasplante con cáncer provienen del análisis de datos recogidos en registros observacionales. Informar a estos registros es fundamentalmente voluntario, y este hecho ha generado dudas sobre la integridad de los datos recogidos [60]. Las preocupaciones específicas se centran en como se han comprobado los resultados, si los datos se informan de forma precisa y completa, la falta de detalles relacionados con la histología, el estadio y los desenlaces a más largo plazo; la falta de un estándar de referencia sólido (por ejemplo, vinculación de datos con registros de cáncer donde la recopilación de datos es obligatoria); y la falta de un sistema universal de codificación que defina los desenlaces del cáncer. La mayoría de los registros de receptores de trasplante se desarrollan en paises de ingresos altos. Es fundamental apoyar el desarrollo de registros de diálisis y trasplante sólidos y transparentes en paises con ingresos medios y bajos.
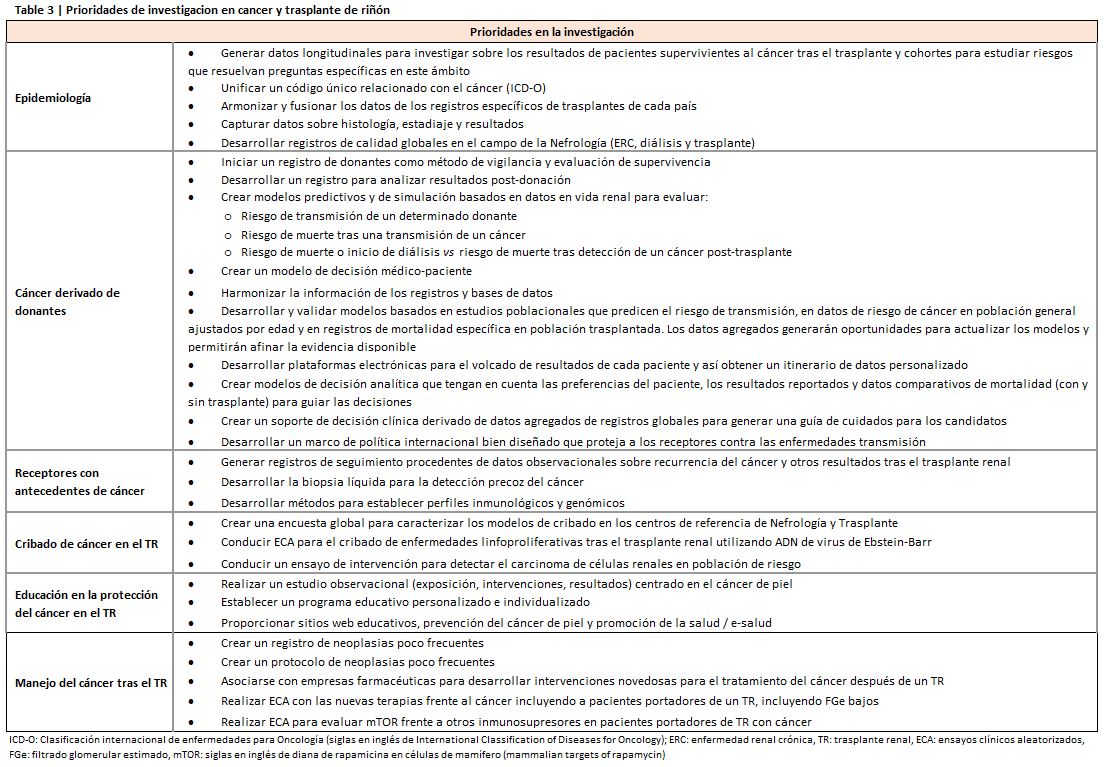
En la (Tabla 4) se enumeran las oportunidades y prioridades de investigación en este contexto.
Transmisión de cáncer de donantes a receptores de trasplante
La transmisión del cáncer de donantes es rara. La tasa estimada de trasmisión de enfermedades (tanto de donantes vivos como de fallecidos) varía entre 1 y 2 casos por cada 10.000 receptores de trasplantes, aunque estas estimaciones están alteradas por sesgos de notificación [58] y la incidencia actual de la enfermedad puede estar infravalorada. El riesgo de transmisión depende del tipo de cáncer, varía entre menos del 0,1% en las neoplasias in situ (no invasivos) hasta más del 10% en el caso del melanoma [2]. Aunque la trasmisión de neoplasias es poco frecuente, puede ser un evento devastador para los pacientes, sus familias y el equipo de trasplante, porque el pronóstico de los receptores con enfermedades transmitidas por el donante es generalmente malo [65]. Las muertes asociadas con enfermedades transmitidas por donantes son frecuentemente publicadas en los medios de comunicación, lo que suscita preocupaciones y temores dentro de la comunidad.
La mediana del tiempo desde el trasplante hasta el diagnóstico de cáncer es de aproximadamente 8 meses (rango intercuartílico 3-13 meses) pero varía en función del tipo de cáncer [58]. Entre los receptores con cánceres transmitidos por donantes, el riesgo de muerte es mayor entre aquellos en los que las neoplasia transmitida es un cáncer de pulmón o un melanoma, y menos del 50% sobrevive 2 años después del diagnóstico. Por tanto, se necesitan estrategias de prevención y detección eficaces y eficientes para minimizar cualquier riesgo de transmisión de enfermedad. Es obligatorio que todos los donantes fallecidos y potenciales donantes vivos se sometan a pruebas de detección de enfermedades infecciosas y neoplasias. La red de unidades coordinación de trasplantes, la Sociedad Británica de Trasplantes, la Dirección Europea para la calidad de los cuidados en salud y la Sociedad de Trasplantes de Australia y Nueva Zelanda han desarrollado normas y requisitos para la evaluación de órganos provenientes de donantes vivos y fallecidos.
A pesar de estas recomendaciones, existen variaciones en la práctica habitual. Dado el número creciente de pacientes en la lista de espera activa de trasplante de riñón y a una tasa de mortalidad anual en la lista de espera general de aproximadamente el 5%, es imperativo maximizar la utilización de los órganos disponibles para trasplante. Los pacientes deben estar bien informados sobre el riesgo proyectado de transmisión de la enfermedad con donantes de mayor riesgo comparado con el riesgo de muerte prematura en diálisis. Es prioritario desarrollar e implementar un abordaje de toma de decisiones estructurado, personalizado y compartido que permita mejorar la calidad de la atención para los potenciales receptores de un trasplante.
El trasplante renal en pacientes con antecedentes de cáncer
Las recomendaciones de inclusión en la lista de espera para trasplante de los pacientes con un cáncer previo especifican que los candidatos potenciales deben estar en remisión completa después de la terapia oncológica y sin evidencia de enfermedad activa. Sin embargo, los tiempos previos a la inclusión en la lista varían considerablemente entre diferentes guías de práctica clínica [66].
Existe evidencia de calidad limitada para guiar la toma de estas decisiones. El tiempo de espera desde la remisión completa hasta la inclusión en la lista depende del riesgo de recurrencia y de la supervivencia de la enfermedad oncológica después del tratamiento. Revisiones sistemáticas recientes, confirman que algunos estudios han demostrado que el riesgo de muerte específica por cáncer entre receptores con antecedentes de cáncer es al menos 3 veces mayor que el de aquellos sin antecedentes de cáncer [67]. Datos emergentes sugieren que el tiempo de espera no es un factor determinante del riesgo de recurrencia de la neoplasia después del trasplante [68]; sin embargo, estos datos deben ser interpretados con cautela ya que están sujetos a posibles sesgos de selección y efectos de época.
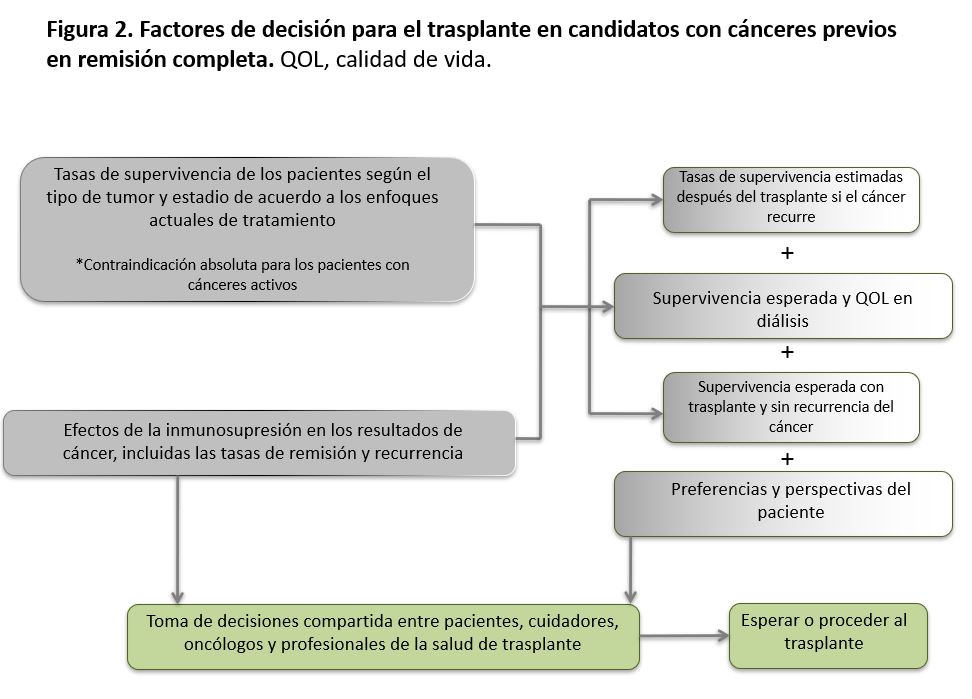
Dadas las características cambiantes del paciente y el advenimiento de nuevos tratamientos como las nuevas terapias dirigidas, los inhibidores de check-point, o una combinación de estos 2 abordajes terapéuticos; los criterios para la inclusión en la lista no deben ser fijos, como históricamente se habían establecido (Figura 1) [69]. Más bien, estos criterios deben ser dinámicos e individualizados, considerar las preferencias del paciente y poner en la balanza la mejoría en la calidad de vida, el aumento de la supervivencia con el trasplante y la probabilidad de muerte durante la diálisis con el riesgo de recurrencia de la enfermedad y de muerte relacionada con el cáncer después del trasplante (Figura 2).
Detección de cáncer en receptores de trasplante renal
El cribado previo a un trasplante renal brinda la oportunidad de detectar y tratar lesiones pre-malignas. Las guías en la población trasplantada están, en gran medida extrapoladas y adaptadas de las de la población general, y no hay evidencia basada en ensayos clínicos que las respalde [70] [71].
Los riesgos, beneficios y el rendimiento diagnóstico de las pruebas realizadas en el cribado en la población de trasplantes podrían ser diferentes a los de la población general. Un estudio reciente de detección de cáncer colorrectal en población con ERC avanzada (incluidos los receptores de trasplante renal) utilizando pruebas de diagnóstico inmunoquímico fecal ha demostrado un rendimiento diagnostico favorable, pero un número elevado de complicaciones mayores asociadas con la realización de colonoscopias [72]. También hay variaciones considerables en las prácticas de detección precoz en los principales centros de trasplantes del mundo. Los programas de cribado para la detección de cáncer de cuello uterino, colorrectal, mamario y próstata son universales en la mayoría de los países con altos ingresos. Debido al aumento de casos de otros tipos de tumores como el cáncer renal, las enfermedades linfoproliferativas post-trasplante o las neoplasias de pulmón o piel, algunos países han comenzado el cribado de estos. Sin embargo, la evidencia para avalar la frecuencia, modalidad y población diana del cribado es, por el momento, incierta. A pesar de las recomendaciones de detección actuales, la inclusión en lista de espera de trasplante de un cáncer mamario y cervical sigue siendo baja [73]. Las bajas tasas de implementación son múltiples. Algunos trabajos demuestran que a pesar de que los pacientes son conscientes de su elevado riesgo, prefieren priorizar otros asuntos asociados a la función renal o al propio trasplante [74]. Los pacientes incluso presentan preocupación acerca de los costes o de las exploraciones que se han de realizar para estos cribados [75][76]. A pesar de que se requiere un avance en la evidencia científica a este respecto, en la (Tabla 4) se resumen algunos aspectos para tener en cuenta para avanzar en la investigación.
Educación del paciente
Las estrategias de educación para prevenir el desarrollo de cáncer en los pacientes receptores de un trasplante renal sólo existen para los tumores de piel pero no para otros tipos de tumores sólidos. La educación del paciente debería comenzar temprano, es decir, antes o durante la identificación de la ERC progresiva. Un programa educativo debe también respetar las expectativas y preferencias de los pacientes. Los sitios web de e-salud podrían servir para proporcionar una educación completa en un nivel básico de lectura.
Manejo del cáncer después del trasplante renal
El tratamiento del cáncer después del trasplante renal es complejo. Para los pacientes que desarrollan cáncer después de un trasplante de riñón, el enfoque se ha centrado tradicionalmente en reducir la inmunosupresión de manera general, con la administración de quimioterápicos por parte del oncólogo médico. Es probable que la reducción de la dosis del tratamiento inmunosupresor después del trasplante dependa del tipo de cáncer, de su estadio y de otros muchos factores. Sin embargo, este enfoque debe equilibrarse cuidadosamente con el riesgo de rechazo del injerto. Faltan datos basados en ensayos prospectivos sobre el manejo de la inmunosupresión, incluyendo la reducción de la dosis y/o la suspensión de esta. Los inhibidores del receptor de rapamicina (sirolimus y everolimus) pueden tener un papel prometedor en el manejo del cáncer después del trasplante (particularmente en neoplasias de piel no melanocíticas y sarcomas de Kaposi) debido a sus efectos simultáneos inmunosupresores y anticancerígenos [77][78][79].
Ahora se dispone de nuevas terapias contra el cáncer dirigidas que incluyen a los inhibidores de los puntos de control (-check-point inhibitors-) y otras inmunoterapias para tratar tumores de órgano sólido en estadio avanzado y enfermedades hematológicas malignas. En múltiples tipos de tumores, estas terapias tienen mayor eficacia que los tratamientos citotóxicos estándar. Sin embargo, la mayoría de los ensayos de intervención que evalúan la eficacia de estos nuevos agentes han excluido a los receptores de trasplante renal. Se desconocen los perfiles de seguridad y eficacia de estos agentes en poblaciones inmunodeprimidas. En particular, hay información de casos y series de casos que sugieren que el uso de anti-PD1, de anticuerpos frente al antígeno 4 asociado al linfocito T citotóxico (CTLA-4) y otros inmunomoduladores en pacientes portadores de un trasplante renal pueden conducir a un rechazo agudo del injerto [80][81][82][83]. Esto sigue siendo un tema controvertido, porque hay otros casos clínicos en los que el uso de everolimus en el lugar de inhibidores de la calcineurina no previno el rechazo del injerto en pacientes que recibieron ipilimumab o pembrolizumab [84][85].
El desarrollo de un registro colaborativo global de cáncer podría permitir el intercambio de datos y oportunidades para las asociaciones de la industria y la participación de los pacientes en ensayos clínicos de nuevas terapias contra el cáncer.
CONCLUSIONES
Los participantes en la Conferencia enfatizaron en la importancia de la colaboración entre nefrología, hematología/oncología, y los especialistas en trasplante así como farmacéuticos implicados en el área clínica y de ensayos clínicos.
A pesar de que el daño renal agudo se presenta con una frecuencia elevada en el síndrome de lisis tumoral (SLT), las estrategias preventivas con rasburicasa e inhibidores de la xantina oxidasa no están bien definidas. La ausencia de evidencia en la dosificación y ajuste de los fármacos en la patología neoplásica onco y hematológica puede derivar en el desarrollo de daño renal agudo o crónico. La industria farmacéutica debería invertir es estudios poscomercialización orientados a reducir los posibles efectos renales adversos sin comprometer la eficacia terapéutica. El mieloma múltiple es una de las enfermedades hematológicas que con mayor frecuencia puede derivar en una enfermedad renal crónica con estadio avanzado, dependiente de terapia renal sustitutiva con diálisis. Las técnicas de depuración de CLL y los esquemas quimioterápicos, deberían ser optimizados para minimizar el daño renal y la necesidad de diálisis.
Aunque la transmisión de cáncer desde los donantes renales es una complicación infrecuente, resulta mandatorio realizar un screening adecuado en los posibles donantes renales de cadáver y de vivo. En los potenciales receptores de trasplante renal con historia previa de cáncer, se recomiendan períodos de contraindicación temporal según el tipo de tumor implicado. Asimismo, debe realizarse un screening de cáncer adecuado a la historia individual del paciente en el período postrasplante renal, con especial atención a los síndromes linfoproliferativos, cáncer de pulmón y tumores cutáneos. En los pacientes trasplantados renales diagnosticados de algún tipo de tumor, las terapias antineoplásicas pueden ser menos efectivas que en la población general. La evidencia actual deriva de estudios observacionales y de análisis de los registros disponibles, siendo necesario mejorar la calidad de los datos, con la puesta en marcha de ensayos clínicos prospectivos. Es necesario promover la investigación acerca de los mecanismos de la patogénesis del cáncer, la utilidad de los screening en la enfermedad tumoral y los posibles efectos de los distintos regímenes de inmunosupresión utilizados.
APÉNDICE
Otros participantes en la conferencia:
Ali K. Abu-Alfa, Lebanon; Hatem Amer, Estados Unidos; Gernot Beutel, Germany; Jeremy R. Chapman, Australia; Xiaohong Chen, China; Jerzy Chudek, Polonia; Laura Cosmai, Italia; Romano Danesi, Italia; Filippo De Stefano, Italia; Kunitoshi Iseki, Japón; Edgar A. Jaimes, Estados Unidos; Kenar D. Jhaveri, Estados Unidos; Artur Jurczyszyn, Polonia; Rümeyza Turan Kazancioglu, Turquía; Abhijat Kitchlu, Canadá; Christian Kollmannsberger, Canadá; Amit Lahoti, Estados Unidos; Yang Li, China; Manuel Macía, España; Takeshi Matsubara, Japón; Dionysios Mitropoulos, Grecia; Eisei Noiri, Japón; Mark A. Perazella, Estados Unidos; Pierre Ronco, Francia Mitchell H. Rosner, Estados Unidos; Maria José Soler Romeo, España; Ben Sprangers, Bélgica; Walter M. Stadler, Estados Unidos; Paul E. Stevens, Reino Unido; Vladimír Tesar, República Checa; Verônica Torres da Costa e Silva, Brasil; David H. Vesole, Estados Unidos; Anitha Vijayan, Estados Unidos; Ondrej Viklický, República Checa; Biruh T. Workeneh, Estados Unidos; Motoko Yanagita, Japón; Elena Zakharova, Federación Rusa.
DISCLOSURE
JM declared having consultancy fees from Fresenius Medical Care and Vifor Pharma. AB declared having received consultancy fees from BMS, Merck Sharp & Dohme (MSD), Pfizer, and Roche; speaker honoraria from Bristol Myers Squibb (BMS) and MSD; and research support from BMS and Pfizer. FRD declared having received research support from National Institutes of Health. MG declared having received speaker honoraria from General Electric. MAG declared having received consultancy fees from Abbvie, Alnylam, Amgen, Annexon, Appellis, Celgene, Janssen, Medscape, Physicians Education Resource, Prothena, Research to Practice, Sanofi, and Spectrum; stock options from Aurora Bio; speaker honoraria from Akcea, Johnson and Johnson, and Teva; and research support from National Institutes of Health and Spectrum. JTK declared having received consultancy fees from Amgen and Vifor Pharma; stock from Chemocentryx; speaker honoraria from ExThera Medical and Vifor Pharma; and grants from ExThera Medical; and JTK was an expert witness in vaccine injury cases trialed at the US Federal Court of Claims. PT declared having received consultancy fees from AstraZeneca, Eli Lilly, Novartis, Pfizer, Pierre Fabre, and Roche; and speaker honoraria from AstraZeneca, Eli Lilly, Novartis, Pfizer, Pierre Fabre, and Roche. GW declared having received research support from the National Health and Medical Research Council. DCW declared having received consultancy fees from Amgen, Astellas, AstraZeneca, Boehringer Ingelheim, GlaxoSmithKline, Janssen, Mundipharma, Napp, and Vifor Fresenius Medical Care Renal Pharma; and speaker's honoraria from Amgen, Astellas, AstraZeneca, Mundipharma, Napp, Pharmacosmos, and Vifor Fresenius Medical Care Renal Pharma. WCW declared having consultancy fees from Akebia, Amgen, AstraZeneca, Bayer, Daiichi Sankyo, Relypsa, and Vifor Fresenius Medical Care Renal Pharma. CP declared having consultancy fees from AstraZeneca, BMS, Eisai, EUSA, Ipsen, Merck Serono, MSD, Novartis, and Pfizer; stock from DNA; and research support from AstraZeneca, BMS, Eisai, EUSA, GE, Ipsen, Merck Serono, MSD, Novartis, and Pfizer; and CP was an expert witness for DNA. All the other authors declared no competing interests. ACKNOWLEDGMENTS The conference was sponsored by KDIGO and supported in part by unrestricted educational grants from Amgen, Akebia Therapeutics, Boehringer Ingelheim, Fresenius Medical Care, GE Healthcare, and MediBeacon. We thank Jennifer King, PhD, for assistance with manuscript preparation. The conference agenda, discussion questions, and plenary session presentations are available on the KDIGO website: https://kdigo.org/conferences/onco-nephrologyconference/.