Biopsia renal ecodirigida
La biopsia renal (BR) es una de las herramientas más importantes en Nefrología para definir el diagnóstico, guiar el tratamiento y emitir un pronóstico tanto en la patología de riñones nativos como en el trasplante renal [1][2][3]. Es un procedimiento invasivo sobre el órgano más vascularizado de nuestro cuerpo y, por tanto, puede presentar complicaciones, principalmente de tipo hemorrágico, como hematuria, hematomas peri e intrarrenales, sangrado activo post punción y obstrucción del tracto urinario debido a coágulos. La tasa de complicaciones es baja, habitualmente inferior al 5% y puede minimizarse con una adecuada preparación previa a la biopsia [4].
La BR es una técnica propia de la especialidad de Nefrología y, por múltiples razones que exceden el contenido de este capítulo, debe ser indicada y realizada por el nefrólogo dentro del campo de la Nefrología Diagnóstica e Intervencionista [5][6].
Existen diversas técnicas para la realización de la BR, como la biopsia percutánea ciega, la quirúrgica y la transyugular. Con el tiempo, la técnica de BR ha evolucionado desde la realización a ciegas empleando un Tru-Cut hasta el uso de ultrasonidos y las agujas semiautomáticas desechables en la actualidad. En este capítulo nos centraremos en la BR percutánea ecodirigida a tiempo real, que es la técnica de elección habitual debido a su perfil de seguridad [3][7][8][9][10] ya que permite la visualización continua de la posición de la aguja dentro del parénquima renal, su colocación y punción en la zona renal deseada.
Indicaciones de la biopsia renal
La primera premisa a tener en cuenta para indicar una BR es que se considere que la información que potencialmente proporcionará es importante en el manejo del paciente, bien para la introducción o control de una medida terapéutica o para definir el pronóstico del proceso. No olvidemos que la BR es la una técnica exclusivamente diagnóstica que conlleva morbi-mortalidad, por lo que ha de realizarse cuando se derive de su resultado una acción beneficiosa para el paciente.
Las indicaciones para la realización de la BR incluyen:
En riñones nativos:
- Síndrome nefrótico del adulto.
- Síndrome nefrítico agudo.
- Fracaso renal agudo (FRA):
- Sospecha de NTA de comportamiento atípico (duración más de 2 semanas)
- FRA con sospecha de patología distinta de la NTA (nefritis túbulointersticial aguda, glomerulonefritis, microangiopatía trombótica, vasculitis, ateroembolia, mieloma…) que constituyen una causa frecuente de BR en nuestro medio (representan el 20,6 % de los casos de FRA incluidos en el registro Español de Glomerulonefritis [11][12].
- Proteinuria aislada significativa no nefrótica: considerar la BR si > 1 gr/24 h habitualmente.
- Microhematuria aislada. El pronóstico renal suele ser excelente por lo que una vez descartada etiología urológica, la BR sólo estaría indicada en las siguientes situaciones [13]:
- Estudio de donante vivo.
- Realizar un diagnóstico de certeza (valorar beneficio-riesgo)
- Cuando se precisa consejo genético ya que los diagnósticos más frecuentes son enfermedad de Alport, membrana basal fina y glomerulonefritis IgA.
- Microhematuria + proteinuria con/sin alteraciones variables del filtrado glomerular. En general, estaría indicada la BR en todos los casos excepto si existe enfermedad crónica con niveles avanzados de insuficiencia renal (tamaño renal < 9cm; FG < 30 ml/min).
- Enfermedades sistémicas
- Lupus eritematoso sistémico: la indicación de BR va desde biopsiar a todos los pacientes con LES a sólo a aquéllos que presentan actividad a nivel renal manifestada como hematuria/proteinuria creciente y/o deterioro de función renal.
- Poliangeítis microscópica p y c ANCA.
- Diabetes en casos de evolución atípica [14]: recientemente se ha publicado un estudio en el que se valoran predictores de enfermedad renal no diabética, entre ellos la ausencia de retinopatía diabética asociada, presencia de microhematuria (>9-10 hematíes por campo) y/o sobrepeso.
En el trasplante renal [15]:
- Donante
- Donante con criterios expandidos para orientar la viabilidad del órgano y evaluar la evolución de las lesiones.
- Biopsias de protocolo.
- Receptor
- Pacientes con función retardada del injerto, en caso de empeoramiento en el renograma o si el retraso de función del injerto se prolonga más de 2-3 semanas.
- Pacientes con función renal inferior a la esperada según características del donante (a partir de los primeros meses de evolución del trasplante).
- Pacientes con deterioro brusco de la función del injerto atribuible a enfermedad renal parenquimatosa.
- Pacientes con un aumento progresivo en los niveles de creatinina (20% respecto a creatinina nadir) en un periodo de 3-6 meses.
- Pacientes con proteinuria > 1 g/24 horas.
- Pacientes con alteraciones del sedimento (hematuria, cilindros) sin causa urológica aparente.
- Aconsejable antes de cambios en el tratamiento inmunosupresor.
Aparataje para la biopsia renal ecodirigida
El aparataje necesario para la realización de la biopsia renal incluye:
- Ecógrafo con sonda convexa.
- Guía con adaptador para sonda convexa.
- Aguja automática.
- Pinza
- Gel estéril.
- Funda estéril (opcional).
- Campo estéril.
- Guantes estériles.
- Indumentaria quirúrgica completa (opcional).
ECÓGRAFO
Necesitaremos un ecógrafo convencional con una sonda de baja frecuencia o convexa (3-5 MHz) que nos permitirá observar estructuras profundas de hasta 20-30 cm según la gama del equipo. Este punto es especialmente importante a la hora de elegir un equipo de ultrasonidos para realizar biopsias de riñones nativos en obesos ya que hay algunos incluyen un software para trabajar a más de 30-40 cm de profundidad y otros no.
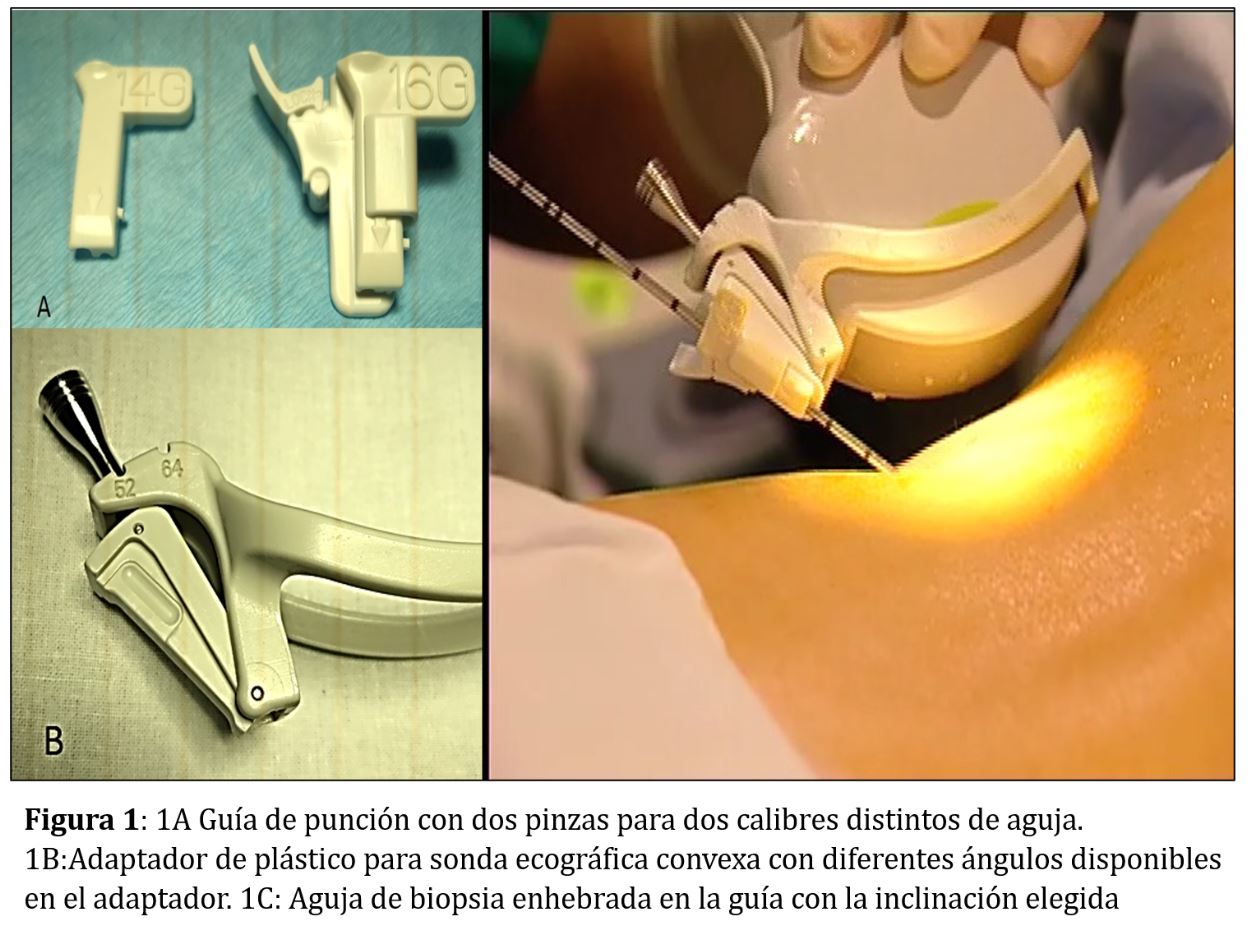
GUÍA O PINZA Y ADAPTADOR DE PUNCIÓN
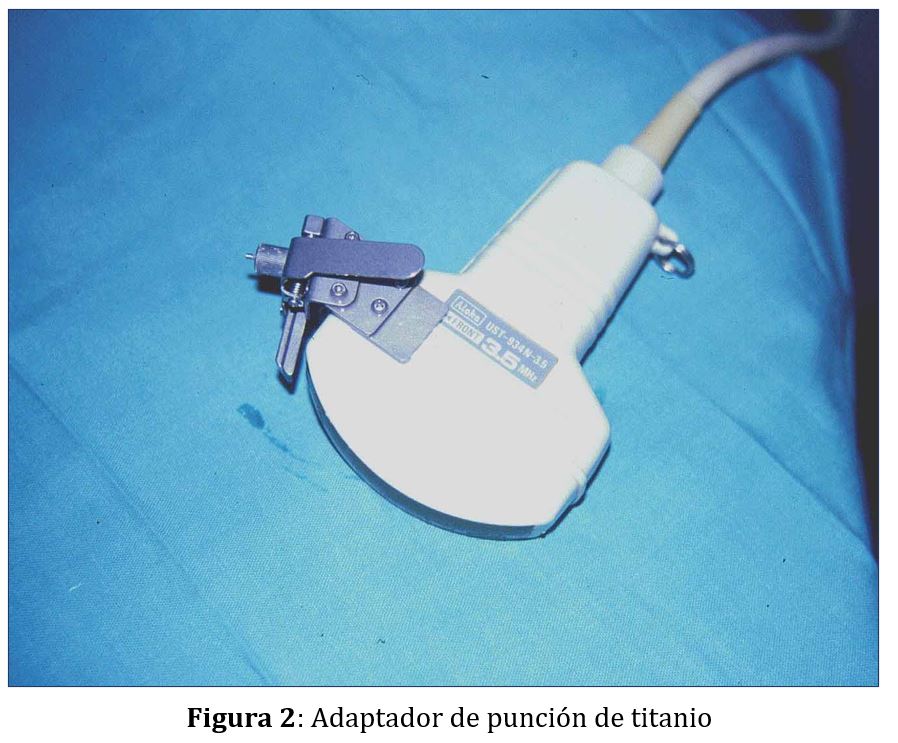
La guía o pinza de biopsia deberá montarse en el adaptador de punción del transductor que, además, es distinto para cada casa comercial (Figura 1) A y (Figura 1) B Las guías pueden ser de plástico o metálicas, a menudo de titanio, y suelen tener dos angulaciones, aunque siempre se puede emplear una angulación u otra según las características de cada paciente: una con una disposición más vertical apropiada para dirigir la biopsia hacia el polo inferior del riñón nativo y otra más tangencial orientada hacia el polo superior del trasplante renal . En general el ángulo de las guías de punción comercializadas se sitúa entre 50º y 70º permitiendo modificarlo en función de la disposición de la zona a biopsiar (Figura 1) A y (Figura 1) B. La angulación de la guía es la misma que la de la línea de puntos que aparece en la pantalla del ecógrafo y es la que llevará la aguja de biopsia (Figura 1) C. Algunas guías, sobre todo las metálicas, no permiten variar la angulación (Figura 2).
La pinza que nosotros utilizamos es de plástico, desechable y estéril y consta, a su vez, de dos piezas que se montan sobre la guía y que permiten acoplar la aguja a dicha guía (Figura 1). La pinza, acoplada al adaptador de punción, permite que la aguja no se desplace y tiene la posibilidad de ángulos múltiples para un acceso superficial (injerto) y profundo (riñón nativo).
AGUJA AUTOMÁTICA
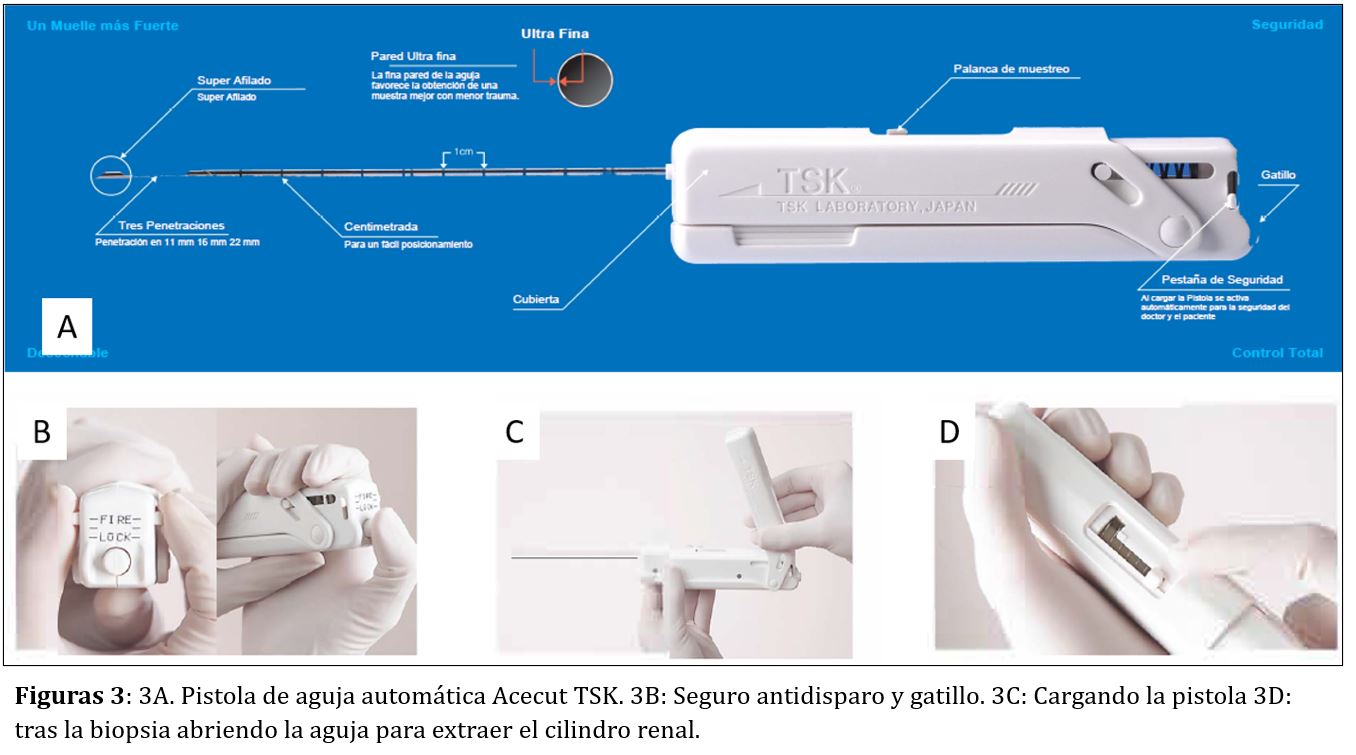
Las agujas más empleadas en la actualidad son estériles y desechables, unidas a pistolas con posibilidad de disparo automático. Todas se basan en el antiguo Tru-cut. Las agujas con dispositivo automático de punción ofrecen doble ventaja sobre el Tru-cut: por un lado la rentabilidad de la muestra es mayor y, por otro, permite que un solo facultativo realice el procedimiento en su totalidad.
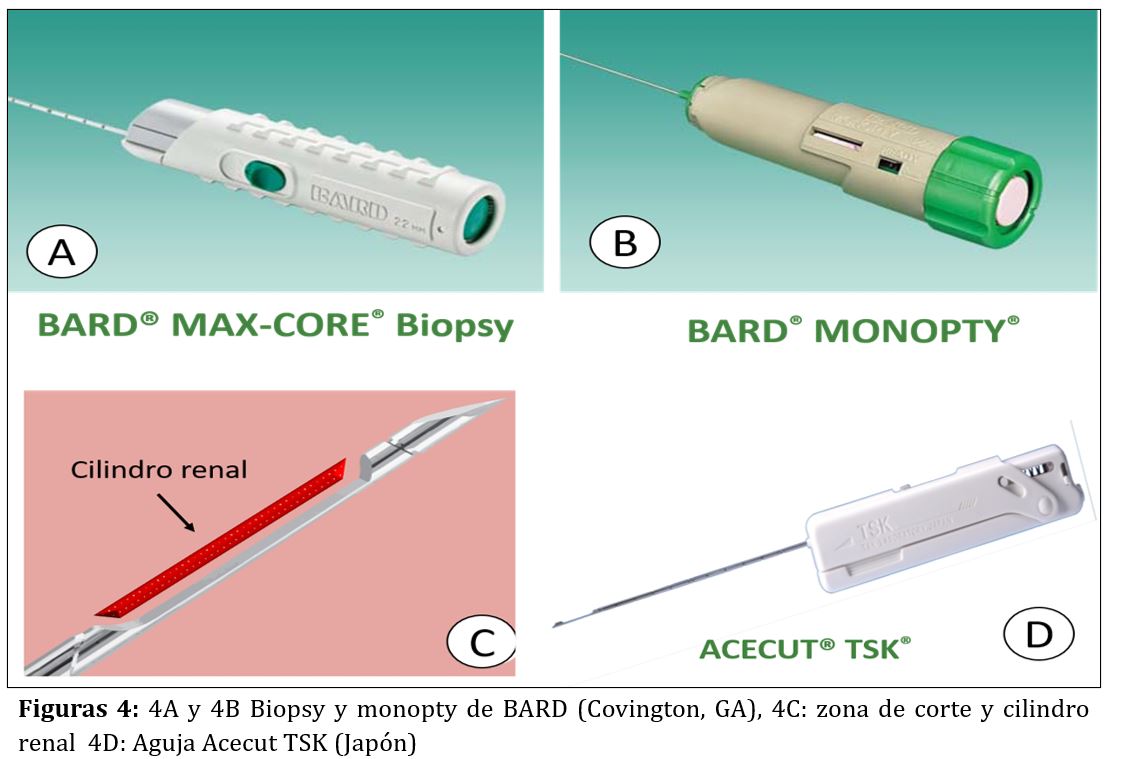
Las agujas automáticas o pistolas de BR disponen de una porción distal (la aguja de acero inoxidable) cuyo extremo realiza el corte cilíndrico del parénquima renal, y una porción proximal (la pistola o empuñadura) en la que se encuentra el muelle, el botón de disparo o gatillo y el seguro de la pistola (Figura 3). La empuñadura es de plástico y está libre de látex. En el mercado existen agujas de varias longitudes y las elegiremos según la biopsia sea de riñones propios o injerto. Aunque hay varios modelos comercializados por distintas casas comerciales (Acecut-TSK-Japón, Biopty-BARD, Monopty-BARD…) su estructura y funcionamiento es muy parecida (Figura 4). Algunas características de las agujas se describen a continuación:
- Longitud: en riñones propios las más utilizadas miden entre 150 y 200 mm (para biopsia de riñones profundos) y en injertos renales 115 mm (ya que estos se encuentran más superficiales).
- Grosor o calibre: Las agujas se denominan con un número que es menor cuanto mayor es el calibre de la aguja. Los calibres más utilizados son el 14G, 16G ó 18G (de mayor a menor diámetro) donde G se refiere a “gauge” en inglés y hace referencia al diámetro externo de la aguja. En la literatura, especialmente en aquellos metanálisis con mayor número de casos, la más utilizada de forma habitual es la de 16G por su excelente relación rentabilidad diagnóstica vs riesgo [16][17]. Las agujas 14G han caído en desuso por su mayor riesgo de sangrado y necesidad transfusional [18].
- Cilindros: la mayoría de las veces sólo es necesario enviar dos cilindros para estudio anatomopatológico completo. Con ello la rentabilidad de la biopsia es mayor del 90%. En caso de no haber muestra, o ser insuficiente para el diagnóstico por las características de la propia patología, podremos repetir la BR.
- Profundidad de penetración y corte: condiciona la longitud del cilindro renal extraído y viene dada por la porción de aguja que se introduce en el parénquima renal al disparar la aguja. Oscila entre 11, 16 y 22 mm. Para la BR las más usadas son las de 22 m.
- Punta de la aguja: Suele ser de tipo Quincke con triple bisel, súper afilada y con pared interna ultra fina, lo que permite obtener mejor muestra y separar el tejido renal sin desgarrar.
Preparación previa a la realización de la biopsia renal
Como es sabido, la BR es un procedimiento invasivo y, como tal, tiene complicaciones. El riñón es un órgano altamente vascularizado que recibe la cuarta parte del gasto cardíaco cada minuto, por lo que las complicaciones hemorrágicas son las más frecuentes y potencialmente graves de la BR. Por ello resulta prioritario realizar una serie de estudios preliminares que nos permitan determinar el riesgo de sangrado de cada paciente para minimizar complicaciones e, incluso, llegar a contraindicar la técnica si el riesgo es excesivo.
En general y, en nuestro centro en particular, la preparación de la BR incluye:
Pruebas analíticas
- Bioquímica con urea, creatinina y filtrado glomerular.
- Hemograma: Se requiere una hemoglobina >10 g/L, un hematocrito >30% [19] y una cifra de plaquetas >100.000 mm3 [20][21][22].
- Estudio completo de coagulación: cefalina, INR, Tiempo de protrombina y fibrinógeno.
- Tiempo de Ivy o de hemorragia (mediante análisis PFA-100 Platelet Function Assay): sirve para evaluar la hemostasia primaria que abarca la integridad de los vasos, la adhesión y agregación plaquetaria, y la formación del coágulo. Requiere la extracción de 5 ml de sangre del paciente que va a ser biopsiado y se realiza haciendo pasar la sangre total citratada del paciente por unas membranas recubiertas de varios agonistas plaquetarios como colágeno-epinefrina (col-EPI) y colágeno-adenosina (col-ADP). Los defectos en el col-EPI suelen ser generalmente secundarios a trastornos plaquetarios inducidos por fármacos y en el col-ADP a otras causas. Si la biopsia es necesaria con carácter urgente y la alteración del tiempo de hemorragia es leve premedicaremos con desmopresina (vía intravenosa a 0,3 mcgr/kg de peso 20-30 min previo al inicio de la BR) [23].
- Urocultivo estéril o infección controlada bajo tratamiento antibiótico dirigido.
Condiciones del paciente
- Cifras de tensión arterial < 160/90 mmHg.
- Indice de masa corporal (IMC) < 30.
-
Suspensión de anticoagulación con terapia puente si es preciso 3 días antes de la BR.
-
Ecografía renal previa (descartar riñón único o patología no biopsiable). Simulacro de BR previo al procedimiento (ver más adelante).
Documentación
- Consentimiento informado de biopsia renal: el facultativo que indica la biopsia debe proporcionárselo al paciente.
- Consentimiento informado de transfusión de hemoderivados, por si se diera una complicación hemorrágica con necesidad transfusional urgente.
Los consentimientos deberán estar firmados por el paciente y el médico informante con firma legible.
- Solicitud de estudio anatomopatológico: debe contener los datos analíticos y clínicos relevantes, así como el diagnóstico/s de presunción para orientar al patólogo.
- Checklist o lista de verificación de la BR: se trata de una herramienta de seguridad del paciente esencial en muchos ámbitos de la Medicina y que, aunque su empleo es generalmente infrecuente, nosotros usamos hace más de 25 años en nuestra Unidad. El checklist recogerá los datos analíticos y clínicos relevantes, las incidencias de la técnica, el resultado y las posibles complicaciones derivadas de la biopsia [26]. Su misión es detectar omisiones o parámetros clínicos y/o analíticos que contraindiquen la BR por riesgo para el paciente, así como permitir una auditoría posterior tanto de la técnica como de los resultados de la misma.
- Gráfica de cuidados y constantes del paciente.
Simulacro previo a la realización de la biopsia renal
Hay consenso y es de sentido común que, antes de indicar una biopsia renal conozcamos si el paciente tiene uno o dos riñones. En la mayoría de los centros basta con conocer este dato si el paciente tiene una prueba de imagen, aunque sea antigua, que lo acredite.
En nuestro centro, a todos los pacientes valorados para una posible BR les realizamos un simulacro de BR justo tras la indicación de la misma [27]. El simulacro consiste en realizar una ecografía renal (bilateral en caso de nativos) para descartar posibles contraindicaciones como riñón único, riñones pequeños (escasa rentabilidad diagnóstica), patologías no biopsiables (p.ej poliquistosis) o ciertas características anatómicas o patológicas (quistes, hidronefrosis, etc) que dificulten o contraindiquen la BR. A continuación, se coloca al paciente en posición de BR y se selecciona el riñón más accesible y el punto de punción. En este momento evaluaremos la tolerancia del paciente para la técnica y la capacidad para realizar apneas según se precise.
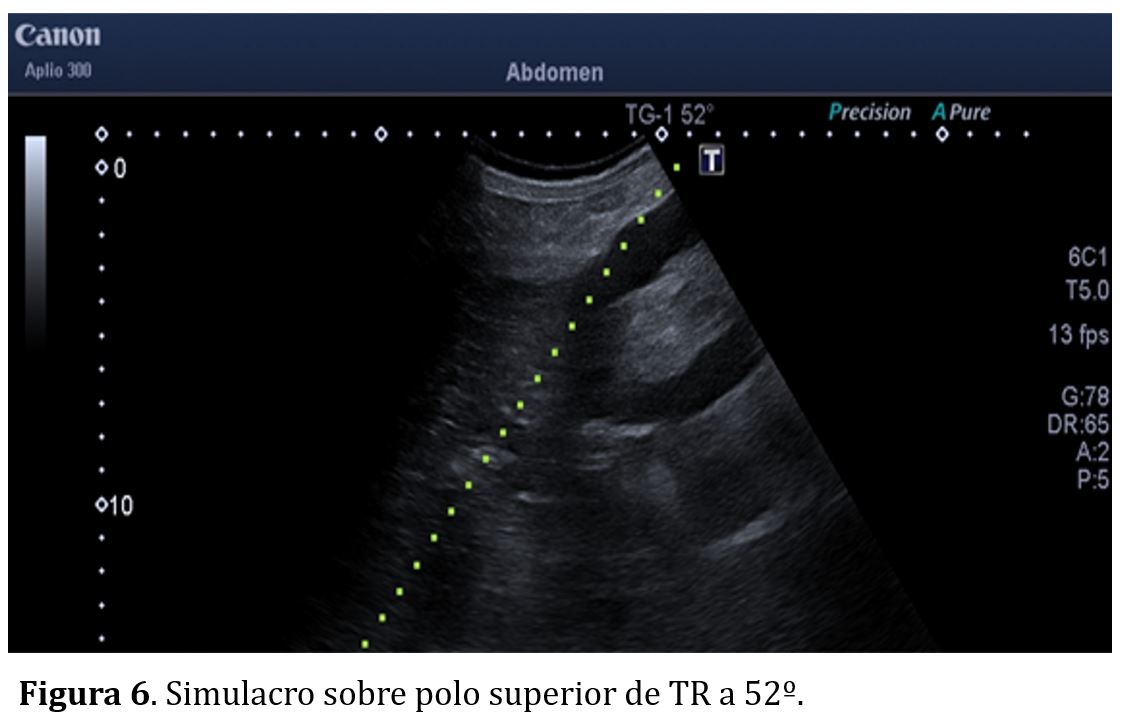
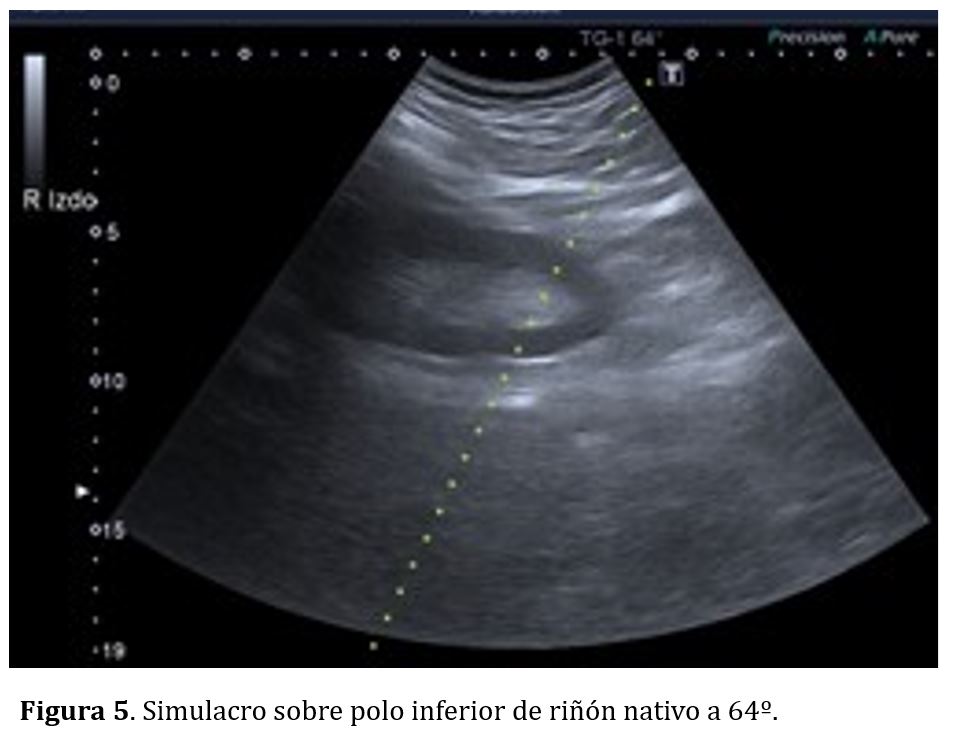
En el caso de riñones nativos el simulacro se realiza en decúbito prono, con objetivo de programar la punción el polo inferior con un ángulo de 64º (Figura 5), evitando así la vecindad de las vísceras aledañas a los polos superiores (hígado, bazo y pulmón). En caso de injertos renales el simulacro se realiza en decúbito supino, con la guía a 52º (Figura 6) con objetivo de puncionar el polo superior del injerto renal siempre que sea posible, para evitar los grandes los vasos iliacos que suelen encontrarse adyacentes al polo inferior renal.
Asimismo, mediremos la profundidad a la que está la zona teórica que hemos elegido para puncionar y así tener preparadas agujas de BR de la longitud adecuada.
Por último, realizaremos un informe oficial en la historia del paciente que incluya las medidas renales (diámetros longitudinales y transverso), estado del sistema colector, grosor cortical, ecogenicidad, profundidad desde la superficie cutánea del polo a puncionar y descripción del nivel de tolerancia para la técnica. Si existen anomalías o variantes anatómicas éstas también quedan reflejadas en el informe, así como si las mismas contraindican la punción en una determinada zona.
La realización de un simulacro previo a la BR proporciona información relevante no solo para la técnica en sí, sino que algunos hallazgos pueden contraindicarla o incluso proporcionar un diagnóstico que la haga innecesaria (como por ejemplo hidronefrosis). En algunos pacientes complejos, como con escoliosis severa, el simulacro permitió planear la postura en el momento de la biopsia, acortando el tiempo de la técnica. El simulacro de BR supuso un mejor manejo de los pacientes renales que van a ser biopsiados con un empleo más eficiente de los recursos y reducción de tiempo de la técnica de BR. Asimismo, el simulacro mejora la seguridad de la técnica, incrementa la confianza del paciente y reduce su ansiedad (el paciente se familiariza con la técnica y el equipo que le va a biopsiar), lo que se traduce en una mayor cooperación [27].
Otros abordajes de biopsia renal
Aunque la biopsia renal ecodirigida a tiempo real es la técnica de elección, existen otros abordajes para situaciones especiales y a la par excepcionales :
- Biopsia renal guiada por TAC: cuando existe mala visualización ecográfica o en pacientes con obesidad extrema [28].
- Biopsia quirúrgica abierta o laparoscópica: suele reservarse para casos con un elevado riesgo de sangrado o cuando el abordaje percutáneo ha sido fallido.
- Biopsia por vía transyugular: se realiza habitualmente por Radiología Intervencionista, con una rentabilidad y tasa de complicaciones similar a la vía percutánea una vez establecida la curva de aprendizaje. Estaría reservada para coagulopatías no corregibles y pacientes muy obesos. También se propugna para biopsia combinada hígado-riñón en sujetos con hepatopatía y afectación renal con coagulopatía severa [29] Si bien el sangrado perirrenal es menor al no perforar la cápsula renal, el hematoma intrarrenal es más frecuente y requiere la administración de dosis bajas de contraste. Esta técnica es sumamente costosa en recursos humanos y materiales. Además, hay pocos centros donde se realiza, por lo que su interés es más académico que real. A las complicaciones de la punción renal se deben sumar la de la canalización de la vía venosa [29].
Técnica de biopsia renal ecodirigida
Los pacientes deben estar ingresados para proceder a la BR, en ayunas al menos 6 horas previo a la técnica y hasta 2 horas tras la misma, en ausencia de complicaciones.
Para la realización de la BR colocaremos al paciente en decúbito prono en caso de riñones nativos (Figura 7), o en decúbito supino si se trata de un trasplante renal (Figura 8). Emplearemos la sonda convexa previamente limpia mediante una gasa con alcohol y la zona a puncionar se desinfecta con povidona yodada o clorhexidina 4%.
Existen fundas estériles para cubrir el transductor y el cable pero su uso no está generalizado probablemente porque resta visibilidad y la tasa de complicaciones infecciosas postbiopsia es prácticamente nula.
Realizaremos la BR con técnica completamente aséptica, para lo que prepararemos un campo estéril. A continuación infiltraremos la piel con anestesia local (mepivacaína 1% para trasplante renal y 2% para riñones propios).
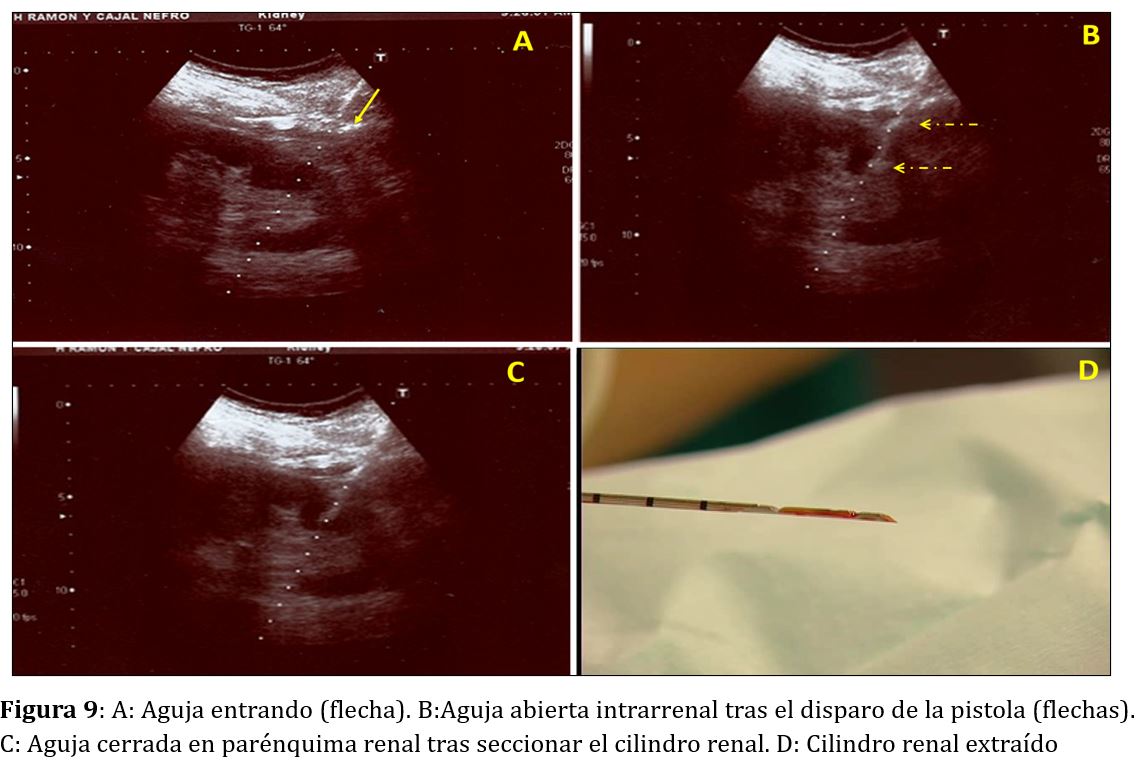
Una vez anestesiada la piel y comprobado el adecuado funcionamiento de la aguja de biopsia, elegiremos el sitio de punción mediante ecografía. Por último, y tras hacer una pequeña incisión de 2-3 mm en la piel con un bisturí estéril de punta fina, introduciremos la aguja en posición de disparo por la guía de punción adaptada al transductor y la progresaremos desde la piel y a través de subcutáneo y músculo hacia el riñón. Una vez en la cápsula renal, le pediremos al paciente que haga una pausa de apnea (unos segundos en caso de riñones propios) para evitar el movimiento oscilante renal que acompaña a la respiración y dispararemos la aguja de biopsia (Figura 9).
Cuidados tras la Biopsia Renal
Tras la BR el paciente debe permanecer en reposo, pudiendo prolongarse la observación desde 1 hora [30] hasta varios días [31] según los diferentes centros. Esta diferencia entre centros viene determinada por el momento de aparición de las complicaciones postbiopsia: se ha descrito que el 42%, 67%, 85% y 89% de complicaciones aparecen a las 4,8,12 y 24 h respectivamente [32]. Dado que un periodo de observación menor a 24 h supondría un elevado riesgo de obviar un alto porcentaje de complicaciones, múltiples autores recomiendan que el periodo de observación postBR sea de 24 h [33] [34] [35].
En nuestro centro mantenemos al paciente ingresado en reposo absoluto durante 24 horas con vigilancia de constantes y visualización de la orina para identificar la presencia de hematuria. La presión arterial, frecuencia cardíaca y estado general del paciente se comprueban cada 15 minutos durante la primera hora, cada hora las siguientes 3 horas y cada 6 horas posteriormente. A las 24 horas del procedimiento se realiza un hemograma de control y una ecografía Doppler renal para identificar posibles complicaciones asintomáticas, como hematomas de pequeño tamaño o fístulas arteriovenosas (FAV). En la mayoría de los casos se trata de complicaciones menores que desaparecen de forma espontánea a los pocos días del procedimiento, si bien en el caso de su detección recomendamos seguimiento ecográfico posterior para monitorizar su evolución [36].
Contraindicaciones de la biopsia renal
Existen contraindicaciones absolutas y relativas para la realización de la BR ecodirigida a tiempo real [25]:
- ABSOLUTAS
- Negativa del paciente o incapacidad: Consentimiento Informado.
- Diátesis hemorrágica no resuelta.
- Riñón único, excepto trasplante renal.
- RELATIVAS
- Panarteritis nodosa clásica debido a la existencia de microaneurismas.
- Hipertensión arterial mal controlada (>160/90 mmHg).
- Riñón pequeño (< 9 cm).
- Infección urinaria no tratada, infección del espacio perirrenal o de la zona de punción.
- Riñón en herradura.
- Quistes bilaterales múltiples.
- Incapacidad del paciente para guardar reposo.
-
Dificultad de acceso al riñón por las características del enfermo
- Pacientes poco colaboradores.
- Obesidad mórbida.
- Ascitis importante.
- Embarazo.
- Insuficiencia respiratoria / respiración mecánica.
CONCEPTOS CLAVE
- Disponer de un ecógrafo y personal cualificado en la realización de biopsias renales permite un manejo integral del paciente y reduce tiempos de espera.
- El simulacro de BR previo a la técnica optimiza la BR al detectar anomalías, elegir el mejor punto de punción, mejorar la seguridad del paciente, su confianza y cooperación.
- La realización de la BR ecodirigida en tiempo real no está exenta de complicaciones, pero éstas se minimizan con adecuada preparación y la ecografía permite un seguimiento continuo efectivo y de bajo coste.