Anticoagulación en Hemodiálisis
INTRODUCCIÓN
La anticoagulación en hemodiálisis (HD) está dirigida a prevenir la trombosis del circuito con los mínimos riesgos posibles, para lo cual habitualmente se emplea heparina. Los objetivos son utilizar la menor dosis posible para que el dializador y la cámara venosa queden limpios de restos hemáticos y que al finalizar la sesión se pueda hacer hemostasia de los sitios de punción del acceso vascular en un tiempo prudencial. Por otro lado, hay que tener en cuenta que una anticoagulación insuficiente produce pérdidas hemáticas y de hierro y condiciona una disminución del rendimiento depurativo de la diálisis. En general, la dosis que se emplea suele ser menor que la necesaria para la anticoagulación total del paciente, si bien, la necesidad de heparina es muy variable de unos pacientes a otros, dependiendo de factores propios del paciente y de la técnica de HD [1][2].
Desde la década de los 80, la heparina de bajo peso molecular (HBPM) se ha incorporado a la práctica rutinaria como alternativa a la heparina convencional o no fraccionada (HNF) con los propósitos de mejorar la eficacia y la seguridad, reducir los efectos secundarios y facilitar el manejo en cuanto a la pauta de administración y los métodos de ajuste de dosificación [3][4][5][6]. La comodidad de la administración, el precio más elevado, la persistencia de la acción anticoagulante varias horas después de finalizar la sesión de HD, el riesgo de acumulación con dosis altas y frecuentes, y la complejidad del ajuste de la dosificación mediante controles de laboratorio son también factores a tener en cuenta en la prescripción de la HBPM frente a la HNF. Así, mientras que las guías europeas recomiendan el empleo de HBPM como el anticoagulante de elección en HD [7], en la práctica real, no hay un acuerdo general para el empleo de uno u otro tipo de heparina.
Otros aspectos que hay que considerar son el modo de actuación en situaciones especiales, como es la alergia/trombopenia inducida por heparina y los pacientes con alto riesgo hemorrágico, así como la pauta de anticoagulación en aquellos pacientes que están recibiendo tratamiento con anticoagulantes orales.
ANTICOAGULACIÓN CON HEPARINA
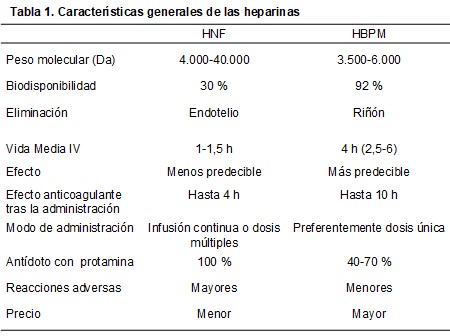
En la (Tabla 1) se expresan las características generales de la anticoagulación con HNF y HBPM con sus principales diferencias, las cuales determinan las ventajas e inconvenientes de cada una de ellas.
Heparina no fraccionada.
La HNF es una familia de polímeros de polisacáridos altamente sulfatados, cuyo peso molecular (PM) oscila entre los 4.000 y 40.000 Da, con una media de 12.000-15.000 Da. Los radicales sulfatados le confieren una carga negativa elevada, lo que hace que se una de manera no específica al endotelio, plaquetas, macrófagos, proteínas circulantes y superficies plásticas. Su acción es inmediata, que se inicia a los 3-5 minutos de la administración, con una vida media de 60-90 minutos. La metabolización se realiza principalmente en el endotelio.
Biológicamente, actúa como cofactor de la antitrombina III, la cual pasa a ser de un lento a un rápido inactivador de factores de la coagulación, inactivando no solamente la Trombina (factor IIa) sino otros factores como el XIIa, XIa, Xa, IXa, kalicreina y plasmina. Su actividad es diferente en función del preparado comercial, por lo que se dosifica en relación a su acción anticoagulante sobre un modelo animal estándar, que se cuantifica en unidades (100 U equivalen a 1 mg). Además existe una gran variabilidad interpaciente, por lo que es preciso individualizar la dosis y realizar métodos de control.
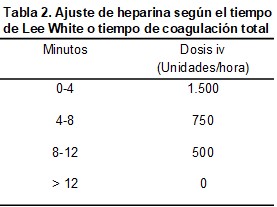
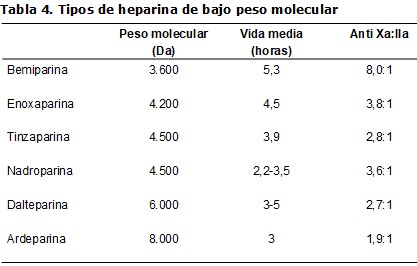
La pruebas que determinan el nivel de anticoagulación posibles son el tiempo activado de coagulación (TAC), el tiempo parcial de tromboplastina activada (TPTA) y el método de Lee White o tiempo de coagulación total (TCT). Este último es un método grosero, con escasa estandarización y reproductibilidad en comparación con los otros sistemas, pero fácil de realizar a pié de enfermo, sin demoras por el laboratorio y de bajo coste; puede orientar acerca de los requerimientos de heparina en las primeras diálisis y es útil en la técnica de dosis bajas de heparina con controles horarios. Se efectúa añadiendo 0,5 ml de sangre a un tubo de cristal seco que se mantiene empuñado, moviéndolo cada 30 segundos hasta que se coagula. Se contabiliza el tiempo transcurrido desde la extracción de la sangre hasta la formación del coágulo y se administra la dosis de heparina según se muestra en la (Tabla 2) [8]. Si se emplean los métodos de TAC o TPTA, se recomienda una prolongación del 150% respecto a los basales o al control. No obstante, en la práctica habitual estos métodos se emplean en una baja proporción y generalmente el ajuste de dosis se realiza por tanteo [9] (Tabla 3). La administración de la HNF puede ser continua o intermitente, siendo esta última modalidad la más empleada en la práctica habitual [9].
Heparina de bajo peso molecular.
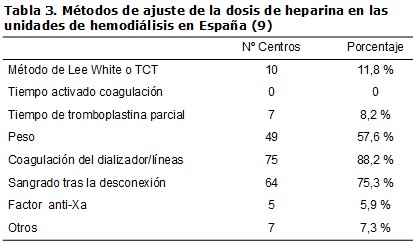
Las HBPM proceden de la fragmentación de la heparina convencional por métodos químicos o enzimáticos, con un PM que oscila entre los 3.600 y los 8.000 Da, y con algunas diferencias entre ellas en la estructura, vida media y propiedades farmacológicas (Tabla 4). Las HBPM están cargadas menos negativamente que la HNF, lo que da lugar a una menor unión inespecífica a las proteínas plasmáticas y mayor biodisponibilidad.
La heparina, en general, tiene una acción antitrombótica ligada a su capacidad de inhibición del factor Xa y una acción anticoagulante por su efecto antitrombina. Una característica que distingue las HBPM de la HNF es la mayor acción anti-Xa con un menor efecto antitrombina, lo que supone una mayor eficacia antitrombótica con un menor efecto anticoagulante. Un segundo aspecto que las diferencia es la vida media más larga, lo que unido a su mayor disponibilidad, permite usarlas en dosis únicas en forma de bolo al inicio de la diálisis, con lo que la manipulación se reduce respecto a la HNF (Tabla 1) y (Tabla 4). No obstante, también se ha descrito el empleo de HBPM administrada en dos dosis en el caso de diálisis prolongadas, y en infusión continua, aunque ambas no son prácticas de rutina en la mayoría de los casos [9]. La actividad de la HBPM se mide en unidades anti-factor Xa, aunque habitualmente no es precisa su monitorización debido a su poca variabilidad interindividual, como se muestra en la práctica habitual donde sólo un 5,9 % de los centros de HD de España emplea la determinación del factor anti-Xa para el ajuste de dosis [9] (Tabla 3).
Aunque la vida media más larga suponga una ventaja en el manejo durante la sesión de HD por su menor manipulación, tiene el inconveniente de prolongar el efecto anticoagulante tras finalizar la misma. Así, se ha comprobado que el efecto anticoagulante se puede alargar hasta 10 horas después de la administración intravenosa tanto con enoxaparina 75 U/kg [10] como con tinzaparina 60 U/kg [11]. A pesar de que la eliminación fundamentalmente renal de las HBPM supone un serio inconveniente en la administración diaria subcutánea para prevención de la enfermedad tromboembólica en los pacientes con insuficiencia renal, con la administración intravenosa en HD no existe riesgo de acumulación con la pauta de 3 días semanales, aunque este riesgo es notorio en diálisis más frecuentes [12]. La menor capacidad de revertir su acción mediante protamina en situaciones de sangrado es un inconveniente que hay que considerar en algunas circunstancias. En algún trabajo se ha descrito que el empleo de enoxaparina se asocia a menor incidencia de trombosis de las fístula arteriovenosa para HD [13].
Efectos secundarios de las heparinas.
La trombopenia inducida por heparina (TIH) es un efecto relativamente frecuente en la población general [14]. Se pueden distinguir 2 tipos. El Tipo I es un fenómeno farmacológico inofensivo que es observado en las primeras 24-48 horas del inicio del tratamiento, que se manifiesta con un descenso moderado y transitorio de la cifra de plaquetas periféricas, que nunca da lugar a fenómenos trombóticos, ni precisa suspender la heparina [14]. El tipo II es una forma mas intensa (plaquetas < 100.000/µl ó descenso >50 % del basal), retardada (5-10 días del inicio de la heparinización) y progresiva, que puede acompañarse de fenómenos trombóticos extensos tanto venosos como arteriales con coagulación intravascular diseminada, y que está mediado por anticuerpos contra el complejo heparina-factor 4 plaquetario (FP4) [14][15][16]. Un estudio multicéntrico en pacientes en HD en el Reino Unido arrojó una incidencia del 0,26 % [17], aunque otras series de pacientes dializados correspondientes a un sólo centro refieren una incidencia de hasta el 3,9 % [18]. En la población sin insuficiencia renal, se ha observado que la incidencia del tipo II es menor con HBPM que con HNF, lo que también ha sido descrito en HD [19][20]. Cuando aparece TIH tipo II suele existir reacción cruzada entre HNF y HBPM. En estos casos, las alternativas son inhibidores directos de la trombina especialmente argatroban, el pentasacárido fondaparinux sódico, diálisis sin anticoagulante (lavados con salino), danaparinoide, anticoagulación regional con citrato, prostaciclinas y maleato de nafamostat y [21][22][23][24][25]. En estos pacientes, los catéteres no deben estar sellados con heparina. Se puede realizar el sellado con citrato trisódico a distintas concentraciones, siendo la mas empleada actualmente al 4% [26]. También se puede hacer el sellado con Urokinasa aunque su precio y sobre todo su vida media corta, que redunda en una menor eficacia en el mantenimiento a largo plazo de los catéteres, la hacen ser de segunda elección [8].
Otro efecto adverso de la heparinización es la dislipemia. Ha sido comprobado que la heparina provoca una liberación de la lipoproteinlipasa tisular al seno del sistema circulatorio [27]. En condiciones normales, la lipoproteinlipasa cataliza la hidrólisis de los triglicéridos plasmáticos a nivel del endotelio capilar, de modo que los productos derivados de esta lipólisis son captados directamente por lo tejidos. Sin embargo, cuando la heparina ha desplazado las lipasas de su ubicación tisular normal, la hidrólisis lipídica se produce en el interior del torrente circulatorio. Así, la depleción repetida de la lipoproteinlipasa capilar por la heparina en los pacientes en HD, puede contribuir a la elevación sostenida de los niveles plasmáticos de triglicéridos [27]. Varios trabajos han demostrado que en HD la HBPM produce menor elevación plasmática de triglicéridos que la HNF [28][29][30], aunque esta superioridad no ha sido comprobada por otros [31][32][33].
La osteoporosis inducida por heparina constituye un problema clínico que se asocia a la administración continuada de heparina durante periodos prolongados de tiempo, que se observó principalmente en mujeres gestantes con episodios tromboembólicos tratados con heparina durante varios meses [34]. Algunos estudios en población sin insuficiencia renal han demostrado que el riesgo de desarrollo de osteoporosis es menor cuando se utiliza HBPM en lugar de HNF [34][35]. Ha sido referido también que el nuevo pentasacárido sintético, fondaparinux, tiene incluso menores efectos osteoclásticos que las HBPM [36]. En los pacientes en HD, se ha sugerido que la HBPM ocasionaría también menor osteoporosis que la HNF [37][38].
La heparina produce interferencias con la síntesis de aldosterona, lo que ocasiona un estado de hipoaldosteronismo que suele ser subclínico y de escasa relevancia. En los pacientes en HD la aldosterona puede tener un papel protector frente a la hiperpotasemia, al limitar la absorción neta de potasio de la dieta, facilitar su secreción por las glándulas sudoríparas y la captación muscular. Se ha sugerido que el efecto inhibidor de la aldosterona es menor con HBPM que con HNF [6].
¿HNF o HBPM?
Para la elección del anticoagulante en HD hay que partir de la base que varios trabajos, incluidos metaanálisis, indican que la eficacia (prevención de la coagulación del sistema) y la seguridad (aparición de complicaciones hemorrágicas), son similares con ambos tipos de heparina [39][40][41][42], por lo que serán los criterios anteriormente comentados los que se tengan en cuenta para la prescripción. En general el precio más elevado de las HBPM respecto a la HNF es por último otro dato a considerar.
Según el Estudio Español de Anticoagulación en Hemodiálisis publicado en el año 2012 [9], el empleo de HBPM y HNF en HD en España era de aproximadamente el 50 %, siendo los criterios médicos, seguidos de la comodidad de administración los que más se tienen en cuenta al prescribir las HBPM.
Influencia de la membrana.
Los factores que determinan la trombogenicidad de una membrana de HD incluyen la composición química, la carga eléctrica, la capacidad de adherir o activar elementos celulares circulantes, y otras características que pueden activar la cascada de la coagulación. Se sabe por tanto, que la activación plaquetaria y de la coagulación es diferente según la membrana, de tal manera que en una revisión se estableció la siguiente secuencia con una serie de membranas analizadas: membranas celulósicas no modificadas son más trombogénicas que poliacrilonitrilo (PAN) no modificado, el cual es más trombogénico que la polisulfona y el hemofán, y posiblemente, la poliamida era la que menos predisponía a las trombosis [12].
Algunas membranas han sido modificadas para mejorar su trombogenicidad. Así, la membrana de PAN AN69 fue modificada neutralizando la electronegatividad de su superficie (AN69-ST) mediante el recubrimiento con un polímero catiónico, la polietilenimina (PEI) que hace que la heparina se adhiera más fácilmente a la membrana [51][52]. Posteriormente, se ha logrado la adhesión estable de la HNF a la membrana AN69 (Evodial®), mediante un proceso de “funcionalización iónica de múltiples puntos” diseñada para pacientes con riesgo de sangrado. Chanard et al. observaron una reducción de la dosis de heparina con Evodial® en pacientes con riesgo hemorrágico [53]. En el estudio HepZero, multicéntrico, randomizado de 251 pacientes con riesgo de hemorragia, Evodial® demostró ser no inferior a la infusión de solución salina en la diálisis sin heparina con una tasa de éxito del 68.5 % frente al 50.4 % respectivamente [54]. Se había considerado tasa de éxito cuando no había oclusión completa del atrapaburbujas o del dializador o líneas de sangre, ni infusiones salinas adicionales, cambios de dializador o de líneas de sangre o terminación prematura de la sesión [54]. Islam et. al en otro estudio multicéntrico y randomizado demostraron la no inferioridad de un dializador de polisulfona con vitamina E adherida a su superficie frente a Evodial® en las sesiones de hemodiálisis sin heparina de 4 h [55]. En ese estudio, la tasa de coagulación del circuito que impedía finalizar la sesión de diálisis fue del 22 y 19% respectivamente, tasa que los propios autores califican de “inaceptable”, sugiriendo otros estudios para encontrar métodos de diálisis sin anticoagulante que mejoren estos resultados [55].
Mediante técnicas micrométricas de tomografía axial computarizada 3D (3D micro-CT) de los capilares, se ha comprobado que triacetato de celulosa asimétrico (Solacea®) requiere menos dosis de heparina que Evodial® y que una polisulfona convencional en un modelo de dosis mínimas de heparina [56]. Con el empleo de la técnica 3D micro-CT se ha observado también que triacetato de celulosa asimétrico mantiene la reducción de la dosis de heparina en la hemodiafiltración en línea (HDF-OL) [57]. Por último, se ha referido que membranas de polimetilmetracrilato (PMMA) de última generación tienen prácticamente nula adhesión de plaquetas a su superficie lo que podría redundar en una menor coagulación de los capilares, si bien son necesarios estudios clínicos que estudien este efecto [58].
Influencia de la técnica de hemodiálisis
La técnica de diálisis puede teóricamente influir en la coagulación del sistema por dos mecanismos; el primero por la mayor o menor activación de la cascada de la coagulación con cada una de las técnicas, y el segundo por la capacidad de eliminación de la HBPM por el dializado/ultrafiltrado. Klingel et al. [43] comprobaron que la Hemofiltración (HF) y la HDF-OL se asociaban a un incremento de la actividad procoagulante (aumento del complejo trombina-antitrombina III y de los D- dímeros), en comparación con la HD de alto flujo, lo que se ha puesto en relación con la hemoconcentración intracapilar por la elevada tasa de ultrafiltración.
Cuando se emplea HBPM, varios trabajos han constatado que la actividad anti–Xa se reduce significativamente tanto en HD de alto flujo como en técnicas convectivas, como consecuencia de la eliminación de HBPM a través del dializado/ultrafiltrado. McMahon et al. describen que la actividad anti-Xa en HD de alto flujo era menor que con la de bajo flujo cuando se administró una misma dosis de enoxaparina (44). En técnicas continuas, Isla et al. comprobaron pérdidas de enoxaparina por el ultrafiltrado/dializado, con un coeficiente de cribado en torno a 0,45 en los modelos in vivo [45]. En otros trabajos se ha observado que la actividad anti-Xa al final de la sesión de HD es significativamente menor en la HD de alto flujo y la HDF-OL frente a HD de bajo flujo [46][47).
En un estudio randomizado y cruzado se demostró que los niveles de Anti-Xa durante y al final de la sesión de HD eran significativamente mayores cuando se administraba Tinzaparina IV 5 minutos antes del inicio de la sesión o al inicio por la rama venosa, frente a la administración por la rama arterial al inicio de la sesión, sin diferencias significativas entre las dos primeras formas de administración [48]. En otro estudio comprobamos que la administración de la HBPM 2-3 minutos antes del inicio de la sesión de HD reducía un 25 % la dosis necesaria de enoxaparina administrada por la rama arterial al inicio de la sesión [49]. Por estas razones en la HD de alto flujo y en técnicas de HF y HDF-OL, se recomienda que la administración de HBPM se haga al inicio pero por la vía venosa del circuito extracorpóreo [12][20][48], o bien administrarla 2-5 minutos antes del comienzo de la diálisis [47][48][49][50]. En este sentido, en un trabajo reciente se comprueba que los niveles de anti Xa eran mayores en la HD de alto flujo que en la HDF-OL y sin claras diferencias con la HD extendida cuando la HBPM se administraba por la vía arterial [59], sin embargo, los mismos autores encuentran que no había diferencias entre las 3 técnicas en la dosificación de HBPM cuando se administrada por la vía venosa [60].
Se ha descrito también el recubrimiento con HBPM del circuito de diálisis del sistema Genius® con dializadores de polisulfona, que no precisan anticoagulante adicional [61].
ESTRETEGIAS EN PACIENTES CON ALTO RIESGO DE SANGRADO.
Hemodiálisis sin heparina.
Es un método efectivo y seguro en los pacientes con sangrado activo o que tienen un elevado riesgo de sangrado. Se debe seleccionar un dializador con membrana biocompatible de baja trombogenicidad. Es preciso evitar el contacto de la sangre con el aire, lo cual tiene efecto trombogénico, utilizando si es posible, líneas especiales sin cámara de expansión y con doble cámara venosa, y realizar un cebado muy cuidadoso del circuito para que no queden burbujas. Se utilizará el mayor flujo de sangre posible, se evitará la unipunción y las paradas de la bomba de sangre. Cada 30 minutos se realizará lavado del dializador y circuito mediante la infusión de 100-150 ml de suero salino a través de la línea arterial para minimizar la hemoconcentración y arrastrar los depósitos de fibrina [2][8].
Hemodiálisis con dosis bajas de heparina
Se puede realizar el cebado del circuito con 1.000 ó 2.000 unidades de heparina, y posteriormente de manera horaria medir el TCT, para administrar la heparina horariamente según se muestra en la (Tabla 2), o bien, para mantener el TAC ò TPTA a sólo 1,5 veces el valor normal [2][8]. Otra opción es realizar el cebado del circuito sin heparina y administrar un bolo inicial de 20 U/Kg, con pequeños suplementos horarios.
Anticoagulación regional con citrato
El efecto anticoagulante del citrato se basa en la quelación del calcio iónico, fundamental para la activación de la cascada de la coagulación. La técnica consiste en la perfusión continua de una solución que contiene citrato en la línea arterial, proporcional al flujo de sangre. El complejo citrato-calcio y citrato-magnesio son parcialmente eliminados por el dializador, y es necesaria la perfusión de calcio por la línea venosa, para lo que se emplean dos bombas volumétricas, y se precisa la monitorización estrecha de los niveles de calcio. Aunque se han empleado varias formulaciones, las más empleadas son las de citrato trisódico isoosmótico y citrato trisódico hipertónico con o sin calcio en el dializado [62][63][64], si bien, la utilización de calcio en el líquido de diálisis empeora los resultados. El citrato que entra al paciente es transformado en bicarbonato por lo que se requiere su monitorización, así como la de la natremia, y ajustar sus conductividades en el líquido de diálisis.
Se ha descrito que la anticoagulación regional con citrato mejora la biocompatibilidad con reducción de la degranulación de los polimorfonucleares y del estrés oxidativo durante la HD [65]. Está indicada en los pacientes en HD con riesgo de sangrado y/o TIH tipo II, en los que puede ser empleada de manera rutinaria [64][66][67], así como en técnicas continuas en el paciente crítico [68][69] incluso con disfunción hepática severa [70]. Los mayores inconvenientes estriban en el riesgo de hipo o hipercalcemia, hipernatremia y alcalosis metabólica. No obstante se trata de una técnica segura si se realiza adecuadamente [63][70].
Citrato en el líquido de diálisis
El empleo de citrato sustituyendo total o parcialmente al acetato en los líquidos de HD basados en el bicarbonato como agente alcalinizante, se ha empleado para reducir las dosis de heparina en los pacientes con riesgo de sangrado [71]. El citrato que pasa a la sangre quela el calcio reduciendo la coagulación del circuito. Se han descrito varias formulaciones que oscilan entre los 0.8 y los 4 mEq/l de citrato [71][74]. En España, hay comercialmente disponibles 2 formulaciones, una con citrato 1 mEq/l sin acetato (SelectBag Citrate®) y otra que contiene acetato 0.3 mEq/l y citrato 0,8 mEq/l (Citrasate®).
En un estudio retrospectivo en pacientes con alto riesgo hemorrágico en la Unidad de Cuidados Intensivos se observó una menor tasa de coagulación del dializador y del circuito durante la HD intermitente sin heparina con Evodial® más citrato en el líquido de diálisis frente al lavado con salino [75].
En el estudio multicéntrico español ABC-treat Study no se demostró una reducción de la coagulación del dializador ni de las cámaras del circuito de diálisis ni reducción de las dosis de heparina al comparar diálisis con SelectBag Citrate® frente a acetato 3 mEq/L y sin citrato en pacientes estables en HD [74]. No obstante, se observó que el tiempo de hemostasia de la fístula arterio-venosa tras la desconexión fue significativamente mayor en el grupo citrato lo que indica la influencia del mismo sobre la coagulación del paciente.
Cuando el citrato en el líquido de diálisis se emplea con las dosis habituales de heparina, han sido descritas algunas ventajas como sesiones de diálisis más eficaces con mejor Kt/V y mayor depuración de β2-microglobulina [72], así como mejor tolerancia hemodinámica [73][74], comparado con los líquidos de diálisis convencionales con acetato.
Anticoagulación regional con prostaciclina.
Ha sido descrita la anticoagulación del circuito de HD con la infusión de prostaciclina (Epoprostenol sódico), un potente vasodilatador e inhibidor de la agregación plaquetaria, en los pacientes con elevado riesgo de sangrado. Su vida media es muy corta (3-5 minutos). Sus principales efectos secundarios son la cefalea, la rubefacción y la hipotensión. El coste es elevado [12].
Mesilato de Nafamostat
Es un inhibidor sintético de la proteasa con una vida media corta, sin actividad hipotensora, que se ha utilizado como anticoagulante en los pacientes en HD con elevado riesgo de sangrado. Su empleo no se ha extendido por haberse observado una inaceptable alta incidencia de formación de coágulos (30 % y 36 % en la cámara arterial y en el dializador respectivamente) [76].
Heparinizacion regional con heparina-protamina
Es una técnica que ha caído en desuso por ser poco segura y no presentar ventajas sobre la HD con dosis bajas de heparina. El sulfato de protamina actúa formando un complejo con la heparina, pero horas después de finalizar la diálisis la heparina se libera, pudiendo producir un efecto rebote. Como efectos secundarios puede producir hipotensión, bradicardia o hipertermia [2][8].
OTROS METODOS DE ANTICOAGULACION
Pentasacáridos. Fondaparinux.
Fondaparinux (Aristra®), es un pentasacárido sintético de 1.713 Da, que tiene una alta afinidad para la antitrombina III, pero no para la trombina ni el FP4. Tiene una vida media prolongada que permite su utilización cada 24 horas. Su biodisponibilidad es del 100 % y su eliminación urinaria, por lo que de manera similar a las HBPM, existe riesgo de acumulación en los pacientes con insuficiencia renal. Puede ser administrada por vía subcutánea o intravenosa y para su monitorización se emplea la determinación de la actividad anti-Xa.
Fondaparinux no tiene los efectos metabólicos, sobre el hueso, ni inmunológicos de las heparinas [36], y se ha empleado en casos aislados de pacientes en HD con TIH tipo II [77][78][79]. Se ha descrito que es eficaz como anticoagulante de la sesión de HD, sin embargo el uso continuado en pauta de tres días/semana causa acumulación con aumento de la actividad anti-Xa en el periodo interdiálisis, lo que limita su empleo a los casos con TIH tipo II y que precisen anticoagulación mantenida [80].
Inhibidores directos de la Trombina
Para la anticoagulación del circuito de hemodiálisis se han empleado el grupo de las hirudinas y argatrobán que son de administración parenteral.
Las variantes de la hirudina incluyen la PEG-hirudina, y otras formas sintéticas recombinantes como son la Lepirudina (Refludin®), Bivalirudina (Bivalirudina®) y desirudina, que tienen un PM en torno a los 7.000 Da, y que inhiben la trombina mediante la formación de un complejo no covalente. Su eliminación es exclusivamente renal, y su acción se monitoriza mediante el TPTA.
La hirudinas no hacen reacción inmunológica cruzada con la heparina, por lo que pueden ser utilizadas en pacientes con TIH tipo II, sin embargo, tienen una elevada carga antigénica que ocasiona que más del 74 % de los pacientes que las reciben desarrollan anticuerpos anti hirudina [12]. PEG-hirudina, Lepirudina y Bivalirudina son las más estudiadas en HD, con buenos resultados, pero tienen el inconveniente de la elevada vida media en estos pacientes (48 horas), lo que limita su empleo [81][83]. Las membranas de bajo flujo son impermeables a las hirudinas, sin embargo, atraviesan con facilidad las membranas de alta permeabilidad, especialmente en técnicas convectivas donde el coeficiente de cribado es cercano a 1 [84]. No tienen antídoto específico. En el caso de complicaciones hemorrágicas, se puede recurrir al factor VIIa recombínate (Novoseven®) [85], transfusión de plaquetas y diálisis con técnicas convectivas.
Argatrobán es un derivado sintético de la L-arginina, que actúa como inhibidor directo de la trombina. Tiene un aclaramiento hepático, y al no eliminarse por riñón no precisa ajustes en los pacientes con insuficiencia renal. Su vida media es de 40-60 minutos y se monitoriza mediante el TPTA. Se ha descrito su utilización como anticoagulante en HD en pacientes con TIH tipo II administrado i.v. en forma de bolus seguido de perfusión, con buena eficacia y seguridad [86][87]. No hay antídoto disponible.
Danaparinoide
Es un heparinoide de PM 5.500 Da, constituido por una mezcla de heparan sulfato (83%), dermatan sulfato (12%) y condroitin sulfato (4%). Tiene actividad anti-Xa mucho más selectiva que las HBPM (relación anti Xa:trombina de 22-28:1), con mínimo impacto sobre las plaquetas y una baja afinidad por el FP4. Aunque leve (6,5-10%), tiene reacción cruzada con los anticuerpos de la TIH tipo II, por lo que es necesario realizar pruebas de sensibilidad antes de iniciar el tratamiento en estos casos. Tiene un 50 % de aclaramiento renal, y una vida media prolongada (25 h en los pacientes con función renal normal). Se ha descrito su empleo como anticoagulante en HD en pacientes con TIH tipo II [88]. No tiene antídoto específico.
ANTICOAGULACIÓN DEL CIRCUITO DE HEMODIÁLISIS EN PACIENTES CON ANTICOAGULANTES ORALES
La comorbilidad cardiovascular de los pacientes en HD condiciona que una proporción significativa de los mismos siga tratamiento con antiagregantes plaquetarios y/o anticoagulantes orales. En el Estudio Español de Anticoagulación en Hemodiálisis un 45,5% de los pacientes tomaban antiagregantes, un 18,4% tomaban anticoagulantes orales, y un 5% estaban con ambos tratamientos [9]. En otro análisis de un sólo centro, el 25% de los pacientes estaba en tratamiento con anticoagulación oral (89). Un estudio americano sobre 41.425 pacientes incidentes en HD mostró que el 8,3% recibía warfarina, el 10 % clopidrogel y el 30.4% aspirina en el momento del inicio de tratamiento sustitutivo renal, los cuales, tenían peor supervivencia que los que no recibían ninguno de estos tratamientos a los 5 años de seguimiento [90]. Cabría pensar que esta peor supervivencia podía ser debida a la mayor comorbilidad cardiovascular de los grupos tratados, sin embargo, hay dos datos que sugieren que la propia anticoagulación y /o antiagregación con clopidrogel pudieron influir en la misma. Por un lado, se observó que el riesgo de muerte y hospitalización por sangrado fue mayor en los pacientes que recibían warfarina y clopidrogel (aunque no aspirina). Por otro lado, un 69,6% de los pacientes con warfarina no tenían documentada una comorbilidad que justificara ese tratamiento, lo que sugería que un elevado porcentaje de pacientes recibían anticoagulación oral como profilaxis de la trombosis de los accesos vasculares, a pesar de que no han sido demostrados con claridad sus beneficios en la permeabilidad de los mismos [91][92][93]. Elliott y cols [94] tras un revisión sistemática de 28 publicaciones concluyeron que la warfarina dobla el riesgo de sangrado grave en los pacientes en HD. Varios estudios posteriores han confirmado el incremento del riesgo de sangrado asociado a mayor mortalidad del tratamiento con warfarina en la fibrilación auricular no valvular de los pacientes en hemodiálisis [95][96][97][98], lo que obliga a replantear sus indicaciones y buscar nuevas herramientas que ayuden en el manejo de estos pacientes [99][100][101][102][103]. En otro capítulo de Nefrología al Día (Ver Anticoagulantes Orales en la Enfermedad Renal Crónica) se tratan de manera pormenorizada las indicaciones de la anticoagulación oral en los pacientes en HD, el papel de los anticoagulantes orales de acción directa y de otras técnicas preventivas como el cierre de la orejuela de la aurícula izquierda [103][104][105][106][107][108][109][110][111]. En cualquier caso y respecto al procedimiento de la sesión de HD se sabe que la anticoagulación oral es insuficiente en la mayoría de los pacientes para prevenir la coagulación del sistema, por lo que en estos se precisa heparina aunque con menor dosificación [9][104][110][111].