Materiales para diálisis peritoneal
Palabras clave
Diálisis peritoneal, catéter de diálisis peritoneal, implantación, líquidos, cicladora
CATÉTERES
Una de las claves para el éxito de un programa crónico de diálisis peritoneal (DP) depende de tener un acceso seguro, bien posicionado y normofuncionante, a la cavidad peritoneal en el momento de iniciar la diálisis.
La principal función del catéter de diálisis peritoneal es facilitar el flujo bidireccional de la solución dializante de forma consistente, sin requerir gran esfuerzo y sin causar dolor o incomodidad [1].
Los catéteres son cilindros, de longitud variable, de silicona o poliuretano, con una porción interna intraperitoneal perforada en su extremo distal para mejorar el intercambio de soluciones, una porción subcutánea y una porción extra-abdominal que se engarza en un prolongador a través de una conexión de titanio o de plástico. La mayoría de los catéteres están dotados de una banda radiopaca en toda su longitud.
TIPOS DE CATÉTERES
a) Semirrígidos, que suelen ser para uso transitorio en diálisis peritoneal no programada o en pacientes con fracaso renal agudo (FRA). Los catéteres rígidos tienen diferente longitud en función de si son pediátricos o para adultos.
b) Flexibles, pero que tienen diferentes características:
a. Material:
i. La mayoría están fabricados con silicona
ii. Sólo el catéter Cruz es de poliuretano
b. Manguitos, cuffs o Dacron: Los catéteres flexibles rectos pueden tener uno o dos manguitos de Dacron para propiciar una respuesta fibrótica alrededor lo que permite una mejor sujeción del mismo y una menor incidencia de infecciones
c. Forma:
i. Rectos
ii. Catéteres curvos con cuello de cisne (Swan-Neck)
iii. Catéteres curvos con asa de caldero (Cruz) de poliuretano, punta en espiral, luz mayor que permite unos flujos más rápidos pero es termolábil y se daña con la mayoría de los antisépticos y dos cuffs
d. Extremo distal:
i. En espiral ( en forma de “pig-tail”)
ii. Extremo distal con punta de tungsteno de 12g (catéter autoposicionante o di Paolo) que reducen la disfunción del catéter por desplazamiento [1]
e. Con o sin discos intraperitoneales para reducir las complicaciones por desplazamiento
i. Toronto-Western con cuello recto, 2 cuffs (el profundo es un disco y una bola) y una punta recta con dos discos de silicona perpendiculares al catéter.
ii. Missouri (Swan-Neck Missouri con dos cuffs el interno con sistema de disco y bola)
No existe evidencia de la superioridad frente a los catéteres rectos vs pig-tail se implanta mediante incisión lateral o media [2], sin embargo, hay trabajos que refieren mejores resultados en el funcionamiento y mejorías en la supervivencia de la técnica de DP con los catéteres rectos [3]. La elección de un tipo u otro de catéter va a depender de la preferencia y experiencia del médico que realice la implantación, pero las guías de la Sociedad Internacional de Diálisis Peritoneal (ISPD) publicadas en 2019, recomiendan los catéteres de silicona y doble Dacron de poliéster [4]
¿CUÁNDO SE DEBEN IMPLANTAR LOS CATÉTERES PERITONEALES?
Las guías internacionales de diálisis peritoneal sugieren la inserción del catéter al menos dos semanas antes del inicio de la diálisis peritoneal. El empleo precoz del catéter debería hacerse con bajos volúmenes y en decúbito supino para evitar las fugas de líquido peritoneal [5].
Varios trabajos demuestran que los pacientes que reciben educación nefrológicas desde los estadios pre-diálisis, eligen con mayor frecuencia peritoneal que aquellos que no fueron referidos con tiempo a las consultas ERCA [6] [7]. Disponer de los medios para la implantación precoz del catéter nos ayuda a evitar la entrada no programada en tratamiento sustitutivo renal mediante catéteres de hemodiálisis con la posterior resistencia al cambio a peritoneal de los pacientes [8]. El momento que se elija para la implantación de los catéteres de DP va a depender de quién lleve a cabo la implantación. En la mayoría de los centros en los que se produce la implantación quirúrgica, se opta por indicar la misma a partir de unos valores de filtrado glomerular (GFR) mientras en aquellos en los que la implantación es llevado por el equipo de nefrología, la implantación se suele programar a la aparición de los primeros síntomas urémicos, para su posterior uso pasadas 2 semanas [9].
METODOLOGÍA DE LA IMPLANTACIÓN
Existen diferentes métodos de implantación del catéter: quirúrgica (mini laparotomía o laparoscópica) o percutánea (“a ciegas”, Seldinger, por fluoroscopia, por peritoneoscopia, preesternal…). La mayoría de los autores aceptan que el catéter debe ser implantado por un equipo experto conocedor de las funciones y complicaciones del catéter peritoneal [1] y en muchos casos dependerá de los antecedentes del paciente (obesidad mórbida, cirugías abdominales previas, contraindicación para anestesia general…) el hecho que se opte por una inserción quirúrgica o percutánea llevada a cabo por los nefrólogos o los radiólogos vasculares según los protocolos de cada centro [4].
La mayoría de los grupos eligen como punto de inserción ideal del catéter de diálisis, la intersección de una línea imaginaria que va desde la espina iliaca supero- anterior, por el borde de los músculos rectos y 2 cm por debajo del ombligo. La porción intraperitoneal, se alojará en la cavidad virtual que forman las dos capas peritoneales en dirección a la fosa iliaca contralateral para quedar alojado en la pelvis menor o el fondo de saco de Douglas. Para evitar la disfunción y el dolor ocasionado cuando el extremo distal del catéter de diálisis queda alojado en la contigüidad de estructuras pélvicas como el recto, la vejiga o el útero, se recomienda que el punto situado a 5 cm desde el extremo distal, se alinee con el borde superior de la sínfisis del pubis [4]. La colocación óptima del cuff interno será el vientre de los músculos rectos y del cuff externo el tejido celular subcutáneo, a más de 2- 3cm de la salida del orificio de salida. La porción subcutánea del catéter, donde estará alojado el cuff externo en los catéteres que lo tengan, deberá seguir una dirección lateral y hacia abajo, para minimizar el riesgo de infecciones a través del orificio de salida [5]. Algunos centros empleaban una técnica que mantiene integrado en el tejido celular subcutáneo los catéteres hasta su uso (buried technique), momento en cual se procedía a su exteriorización (método de Moncrief). Las últimas guías de la Sociedad Internacional de Diálisis Peritoneal (ISPD) descartan esta técnica de sus recomendaciones al no haber demostrado mejoría evidente en la reducción de las tasas de infecciones [10].
Las técnicas de implantación y el personal que las llevará a cabo pueden ser [11].
A ciegas: (Las técnicas elegidas por los nefrólogos)
Percutánea cerrada con trócar “pelable” (método Seldinger)
Ventajas: puede realizarse sin gran infraestructura, con o sin ayuda de ecógrafos, con empleo de anestesia local y es barato.
Desventajas: riesgo de perforación intestinal, riesgo de desplazamiento o mal alojamiento del Dacron interno.
Fluoroscopia (llevada a cabo por radiología vascular). Similares ventajas que la anterior con menor incidencia de perforaciones de vísceras.
Minilaparotomía con o sin trocar de Tenckhoff. En esta técnica se diseccionan los planos de la pared abdominal hasta verse el peritoneo. La introducción del catéter se hará a través de un trócar de tenckhoff.
Las ventajas son similares a la percutánea con trócar pelable
Las desventajas son el riesgo de perforaciones, que aunque menor que en el anterior, no logra diferenciar la presencia de adherencias
Con visión directa del peritoneo (llevadas a cabo por cirujanos expertos)
Laparoscopia:
Ventajas: se puede colocar el catéter exactamente en el lugar deseado, se puede reparar hernias o llevar a cabo adhesiolisis u omentopexia en el mismo procedimiento. Permite fijar el catéter al peritoneo reduciendo el riesgo de mal posiciones.
Desventajas: se necesita anestesia general, es más costoso, puede incrementarse el riesgo de complicaciones mecánicas.
Otras: minilaparotomía asistida con cistoscopio, técnicas combinadas: laparoscopia y trócar (peritoneoscopia)…
La (Tabla 1) muestra las características según los tipos de catéteres [9].
CUIDADOS PREIMPLANTACIÓN [1]
Tras haber sido correctamente informado y habiendo firmado el consentimiento, se realizará una analítica básica con función renal, hemograma y coagulación. El paciente debe estar en ayunas de 8-12 horas antes de la implantación, habiéndose administrado o bien laxantes osmóticos o enemas para garantizar un adecuado vaciado del túbulo intestinal que reduzca el riesgo de perforaciones intestinales. El paciente se deberá duchar con un jabón germicida, rasurado de la pared abdominal en los casos que sea necesario y deberá vaciar la vejiga antes de iniciar el procedimiento. La ISPD recomienda el despistaje y tratamiento de los portadores nasales de S. Aureus así como se recomienda el empleo de antibioterapia empírica a elección en función del espectro frecuente de infecciones siendo los esquemas más frecuentes los que asocian vancomicina o una cefalosporina de 1ª o 2ª generación con un aminoglucósido [9].
CUIDADOS POSTIMPLANTACIÓN Y CUIDADOS PARA EL MANTENIMIENTO DE LA FUNCIÓN DEL CATÉTER [11] [12]
Se realizará una radiografía de abdomen simple para comprobar la adecuada localización intraperitoneal del catéter. En los casos en los que los lavados sean hemáticos, se realizarán lavados intraperitoneales con heparina al 1% (1cc por litro) hasta que se vaya aclarando el líquido peritoneal, para evitar coagulación del catéter y posterior disfunción. Se recomienda, salvo en casos de complicaciones como el dolor o sangrado, no cambiar los apósitos de la implantación durante las primera 48-96h según los protocolos de cada Unidad y para garantizar la cicatrización se recomienda evitar el uso de los catéteres durante 2-3 semanas. En los casos en los que la situación clínica del paciente obligue a la utilización precoz o no programada, se recomienda el empleo de volúmenes de infusión pequeños (500-1000cc), con el paciente en decúbito supino y manteniendo al paciente en día seco [13].
La (Tabla 2) muestra algunas de las últimas recomendaciones de la ISPD relacionadas con la preparación e implantación del catéter peritoneal [14].
SISTEMAS Y CONECTOLOGÍA [12] [14]
Están formados por las línea de transferencia (prolongadores ) que son los tubos que conectan el catéter con el sistema de bolsas de diálisis; los conectores, piezas que unen el catéter con la línea de transferencia y pueden ser de titanio o de plástico; los tapones –de rosca o clampado- para cerrar la línea de transferencia mientras no sé está realizando un intercambio; los sistemas de diálisis, que en el caso de la diálisis peritoneal continua ambulatoria (DPCA), el más utilizado es el sistema en “Y” donde un extremo se dirige a la bolsa que contiene la solución de diálisis y el otro a una bolsa vacía para el drenaje. Este sistema ha permitido reducir la tasa de peritonitis respecto a los antiguos y en desuso sistemas simples. Los sistemas de conexión- desconexión permiten que dicha función sea llevada a cabo de forma sencilla y segura. El sistema Luer-lock es uno de los más utilizados y consiste en un orificio protegido en su interior y un tapón impregnado en yodo para reducir la incidencia de infecciones. Fresenius Medical Care, ha desarrollado el sistema de disco conocido como Stay-safe® (Andy-disc) para facilitar la conexión autónoma incluso para pacientes invidentes o con dificultades para la manipulación.
En la diálisis peritoneal automatizada (DPA), la conexión a las bolsas varía según los diferentes modelos de monitores de diálisis. Normalmente, se emplea un sistema sencillo de casete desechable que en algún tipo, incorpora sistemas de verificación de la prescripción de las concentraciones de las soluciones de diálisis.
SOLUCIONES
La Diálisis Peritoneal tiene como base principal la infusión de una “solución” en la cavidad abdominal, que tiende a conseguir el equilibrio con los solutos del plasma.
Las soluciones actuales han ido mejorando su composición, pero aún están lejos de ser ideales. En la (Tabla 3) se enumeran las características que requiere una solución para considerarla ideal [15].
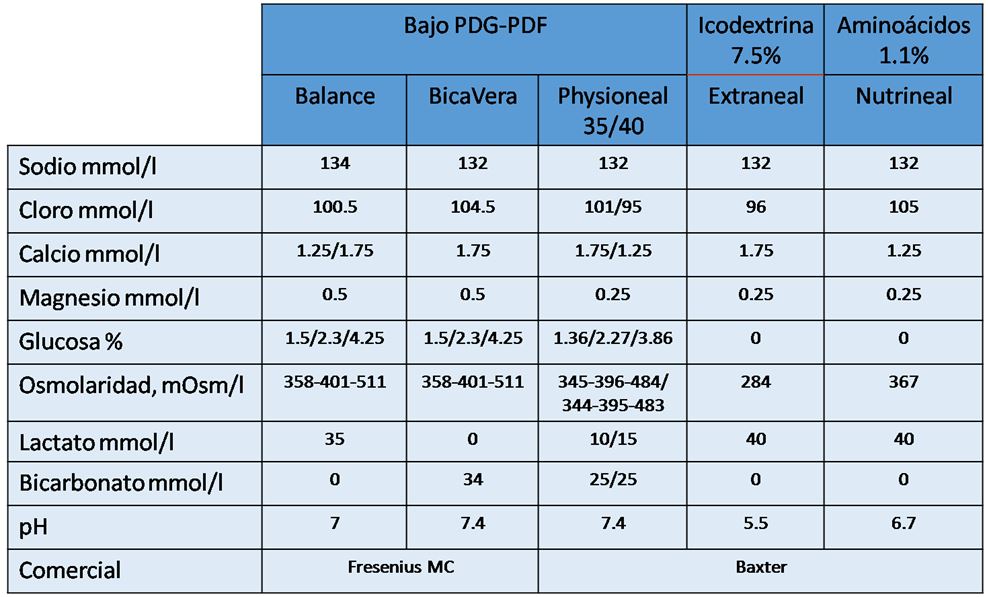
Las soluciones utilizadas en la diálisis peritoneal son preparaciones incoloras, transparentes y estériles de administración intraperitoneal y contienen agua, un agente osmótico y un tampón [16]. En la (Tabla 4) se describe la composición de las soluciones de diálisis peritoneal actualmente utilizadas.
Hasta los primeros años del siglo XXI, se utilizaron “soluciones bioincompatibles o convencionales” caracterizadas por su pH bajo, alta concentración de lactato (tampón), y la presencia de un alto contenido en Productos de Degradación de la Glucosa (PDGs) secundario a la esterilización por calor, que junto con la presencia de productos de Glicosilación Avanzada (AGEs) circulantes que a lo largo del tipo de utilización, tenían consecuencia local (daño estructural-morfológico y funcional) sobre la membrana peritoneal y consecuencias sistémicas. y funcional en la membrana peritoneal. En España, actualmente estas soluciones están en desuso.
La biocompatibilidad debe ser entendida como la capacidad de una solución para cumplir su función sin producir una respuesta adversa en el huésped. La búsqueda de una mejor preservación de la membrana peritoneal conllevó al desarrollo de las “soluciones biocompatibles”, con agentes osmóticos alternativos a la glucosa o soluciones glucosadas bicamerales con un pH fisiológico, mediante el uso de bicarbonato como tampón, y menor contenido de PDGs. Estas son las soluciones actualmente utilizadas.
SOLUCIONES BIOCOMPATIBLES
Soluciones Glucosadas bicamerales
La glucosa es el agente osmótico más comúnmente utilizado. La solución se presenta envasada en una bolsa de plástico libre de PVC con dos cámaras. Las dos cámaras se encuentran separadas por unos sellados no permanentes. Esta disposición permite esterilizar la glucosa a pH bajo y separar el bicarbonato del calcio evitando su precipitación. Sólo debe infundir en la cavidad abdominal cuando las soluciones de las dos cámaras se encuentren totalmente mezcladas tras romper el sellado no permanente.
Inconvenientes
• La glucosa no es un agente osmótico ideal. Es fácilmente absorbido determinando una ultrafiltración limitada en el tiempo.
• Su absorción da lugar a los efectos adversos propios de la glucosa: hiperinsulinemia, hiperglucemia, hiperlipidemia y ganancia ponderal [15].
Ventajas
• La mayor “biocompatibilidad” debido a su pH neutro y bajo nivel de PDGs.
• Económica, segura y disponible fácilmente para su uso diario.
• Preserva mejor el volumen urinario, en comparación con las soluciones convencionales, ya en desuso. Un estudio multicéntrico comparó ambas soluciones, objetivando un descenso de riesgo de anuria en el grupo con soluciones biocompatibles [17].
• Preserva la función renal residual (FRR). Se ha asociado las nuevas soluciones biocompatibles con una mejora en la preservación de la FRR, basándose en la hipótesis en la que los PDGs provocan apoptosis de la célula tubular renal, así como la inducción por los AGEs de glomeruloesclerosis. En estudio Euro-Balance y en otros estudios como Kim et al [18], demostraron dicha mejoría de la FRR acompañada de una disminución en la UF peritoneal. No diferencias en cuanto al transporte de solutos.
• Mayor supervivencia, sugerida principalmente en estudios retrospectivos [19]. Se requieren mayores ensayos prospectivos para poder determinar con más veracidad dicha asociación.
• Menor riesgo de peritonitis. Las soluciones biocompatibles se asocian con una mejoría en la función inmune del peritoneo [20]. Estudios contradictorios, en el estudio balANZ, un estudio randomizado multicéntrico, objetivaron diferencias en cuanto al ratio de peritonitis [21] [22]. En cambio, en otros estudios publicados no encuentran diferencia [23].
• Menor dolor a la infusión, basado en un metaanálisis de Cho et al [24]. Difícil valoración debido a la variabilidad y subjetividad.
• Menor concentración de AGEs y menor apoptosis mesotelial del efluente.
• Menor acidosis metabólica.
Soluciones con agentes osmóticos alternativos a la glucosa
Icodextrina (ICO)
Es un polímero de glucosa, un carbohidrato de alto peso molecular (16,200 Da) procedente de la hidrólisis del almidón de maíz. Es una mezcla de oligo-polisacáridos de tamaño variable.
Se introdujo en la práctica clínica, para permitir una disminución de absorción de glucosa y permitir una UF mayor a lo largo del tiempo (10-16hr). El 40% de la ICO administrada es absorbida por los vasos linfáticos después de 12hr de permanencia [25]. Se presenta con una concentración única del 7.5%.
Indicaciones
• Intercambio diurno largo en DP automatizada (“día húmedo”, como última infusión de la cicladora) o nocturno en DPCA. Manteniendo un perfil de ultrafiltración de forma más prolongada y aumentar eliminación de sodio.
• Limitar la exposición a altas concentraciones de glucosa, sobre todo en pacientes diabéticos. Contribuye a la conservación de la funcionalidad de la membrana.
• Pacientes con perfil de ultrafiltración alterado (fallo UF), principalmente altos transportadores.
• Capacidad de mantener ultrafiltración durante los episodios de peritonitis.
Inconvenientes
• Hipersensibilidad cutánea (aproximadamente de un 15%).
• Acumulación de maltosa y metabolitos, aún no bien determinado sus efectos tóxicos.
• Casos descritos de hiponatremia moderada y discreta elevación de la FA, sin repercusiones clínicas [26].
• “Falsa hiperglucemia” con determinados glucómetros por interacción con metabolitos.
• Reduce la actividad de la amilasa sérica. Precaución en el diagnóstico de pancreatitis en pacientes en programa de diálisis peritoneal
• Episodios de peritonitis estériles, debida a contaminación de algunas partidas con peptidoglicano. La incidencia ha bajado, con la mejora en los sistemas de control.
• Mayor riesgo de hipovolemia e hipotensión, aunque los datos en la literatura sobre el efecto sobre la presión arterial aún son contradictorios.
Ventajas
• Permite un perfil de ultrafiltración más sostenido y lineal, al absorberse de forma más lenta. Induce una ultrafiltración por presión oncótica.
• Reducir la carga de glucosa y por tanto mejor control glucémico, especialmente en diabéticos.
• Mejora en el perfil lipídico.
• Mejora la hipertrofia del ventrículo izquierdo (VI), al disminuir el grosor del VI [27] [28]. La hipertrofia del VI es un factor de riesgo de mortalidad cardiovascular. La etiología es multifactorial, pero es bien conocido que la sobrehidratación juega un papel fundamental principalmente en pacientes en diálisis.
• Se sugiere que preserva la funcionalidad de la membrana peritoneal. Los efectos sobre la misma aún son desconocidos. Enlentece el aumento de permeabilidad que se produce con el tiempo en DP, por ello beneficioso en el caso de altos transportadores [29].
• Aumenta la supervivencia en la técnica. Diferentes ensayos [30] [31] [32] han descrito un aumento de supervivencia de la técnica en los pacientes que utilizan ICO en su esquema de diálisis.
• Se ha asociado con una baja incidencia de Ictus [33]. Se ha observado que con la ICO se mejora el estado de sobrehidratación, se disminuye la presión arterial y se induce regresión de la HVI. Recientemente, se ha relacionado la inflamación y el estrés oxidativo con el ictus tanto isquémico como hemorrágico. Se ha observado que existe una relación entre el estado de sobrehidratación y la inflamación en los pacientes en DP. En un estudio retrospectivo [34], se observó que el uso de ICO mejoraba el estado nutricional e inflamatorio (descenso de la PCR). Se requieren más estudios para corroborar estos hallazgos.
• En otro estudio retrospectivo [35], se objetivó disminución del riesgo de fibrilación auricular en pacientes diabéticos con ICO. Se requieren estudios prospectivos para una mejor precisión en esta asociación.
Se ha descrito una nueva presentación de icodextrina, no comercializada en Europa, con pH neutro y bicameral que mejora la biocompatibildad respecto a la ICO convencional [36].
Formas de aplicación en la clínica:
• Soluciones combinadas: aumentado el perfil de UF con la combinación de soluciones glucosadas e ICO, y a su vez reduce la exposición a glucosa.
• Utilización de dos ICO diarias: opción válida en pacientes con fallo de UF.
• Único cambio diurno: en casos de ICC refractaria (síndrome cardiorrenal).
Aminoácidos (AA)
En el mercado sólo existe una solución con 1,1% de aminoácidos, que combina aminoácidos esenciales y no esenciales, con un peso molecular medio de 126 Da. El pH de la solución es de 6,7 y la osmolaridad de 365 mosmol/kg. El poder osmótico, aproximadamente, se corresponde con la concentración de glucosa de 1.36% (13.6 g/L).
Se estima que diariamente se pierden en torno a 15gr de proteínas y de 2-4 gr de AA [15]. Una bolsa de 2 litros contiene 22 gr de aminoácidos que corresponde a un aporte de 0,30 gr de proteínas/kg de peso/día, aproximadamente el 25% de los requisitos diarios de proteínas, para un paciente adulto de 70 kg de peso. Es un aporte de proteínas libres de fósforo.
Indicaciones
Se deberían tener en consideración los siguientes aspectos a la hora de prescribir la solución con aminoácidos:
• Especialmente indicados en desnutridos o diabéticos y en aquellos pacientes con peritonitis recurrentes.
• Se debe garantizar una ingesta calórica adecuada.
Inconvenientes
• Favorece la acidosis metabólica, pero se puede solucionar con aportes orales de bases o más alto contenido de tampón en las soluciones.
• Aumento de la Urea.
Estos efectos adversos, se han documentado especialmente cuando se usan dos soluciones de aminoácidos al día.
Ventajas
• Limitar el uso de glucosa, especialmente en pacientes diabéticos y obesos. Se ha objetivado mejoría del perfil lipídico y descenso de la masa grasa [37].
• El beneficio nutricional es de eficacia cuestionada. Se ha observado mejoría de los parámetros nutricionales, tales como proteínas séricas, aumento balance nitrogenado y ganancia ponderal a corto plazo, sin objetivarse una sustancial mejoría en el estado nutricional a largo plazo ni en la supervivencia del paciente [3 [38] [39].
SOLUCIONES EN COMBINACIÓN
Un esquema dialítico donde se combine soluciones glucosadas y no glucosadas es la forma más eficaz para disminuir la exposición a la glucosa, junto con las ventajas descritas anteriormente. Un reciente meta-análisis [40] muestra que la icodextrina proporciona un adecuado manejo de los fluidos en los pacientes en DP, especialmente aquellos con déficit de ultrafiltración, sin cambios significativos en la diuresis y función renal residual o en el transporte peritoneal de solutos, y sin que se traduzca en una mejor supervivencia del paciente o de la técnica.
En los pacientes de DPA, la combinación de soluciones de glucosa y aminoácidos durante el periodo nocturno, ocasiona mínimos cambios en el equilibrio ácido base, reduce la exposición y la carga de glucosa manteniendo el perfil de osmolaridad [41] y de ultrafiltración. La combinación de glucosa, AA e icodextrina, produce los mismos efectos, manteniendo la eliminación de sodio [42].
Para el periodo diurno se investigó una posible combinación “bimodal” [43], de las soluciones glucosadas con la ICO, mostrando un mejor perfil de ultrafiltración y de eliminación de sodio con un único intercambio que, no obstante, no se tradujo en una opción para la práctica clínica diaria.
AGENTES OSMÓTICOS FUTUROS
Han transcurrido más de dos décadas desde la introducción de las soluciones con ICO o AA. Estas sólo pueden remplazar en un 30-50% la glucosa diaria utilizada en los esquemas de diálisis debido a las limitaciones de su uso diario.
Se han investigado nuevos agentes osmóticos como son el glicerol [44], L-carnitina [45], xylitol [46] o taurina [47], pero ninguno se ha consolidado en la práctica clínica. Hoy por hoy, se sigue a la espera de que se encuentre el agente osmótico que sustituya a la glucosa con las mismas garantías y con los mínimos efectos sobre la membrana peritoneal y sistémicos,
CICLADORAS
La introducción de las cicladoras, equipos electro-médicos, capaces de realizar un periodo del tratamiento de diálisis peritoneal de manera automática (Diálisis Peritoneal Automatizada, DPA), fundamentalmente durante las horas nocturnas, ha permitido que muchos pacientes puedan iniciar o continuar su tratamiento en la modalidad de Diálisis Peritoneal, con menos esfuerzo diario, con una mejor eficiencia de la dosis de diálisis administrada, favoreciendo su inclusión social, facilitando una vida laboral activa y la posibilidad de viajar, en definitiva mejorando su calidad de vida.
NORMATIVAS Y SEGURIDAD
De acuerdo con las normas que regulan la seguridad de los equipos utilizados en el campo biomédico, la cicladora puede definirse como un dispositivo electro-médico activo diseñado para ser usado en los seres humanos con fines de tratamiento, en este caso la Diálisis Peritoneal. Esta característica hace que la cicladora encaje en una categoría de dispositivos sujetos a regulaciones y normativas, en este caso la UNE-EN 60601-2-39:2009, modificada por UNE-EN 60601-2-39:2009/A11:2012, que define y regula los requisitos particulares para la seguridad básica y funcionamiento esencial de los equipos de diálisis peritoneal. Esta norma es la versión oficial, en español, de la Norma Europea EN 60601-2-39:2008, que a su vez adopta la Norma Internacional IEC 60601-2-39:2007. En España actualmente está en tramitación, pendiente de resolución y publicación, una modificación de la norma con el código PNE-prEN 60601-2-39:2016 [48].
Esta norma, específicamente, determina la definición de equipo electro-médico de diálisis peritoneal y dicta las características y requisitos particulares de identificación industrial, de las condiciones ambientales de operatividad, de temperatura, de los riesgos eléctricos, mecánicos, de radiación electromagnética, de fuego, temperatura o de eventuales errores en la dispensación de líquido de diálisis durante el tratamiento. Estos requisitos particulares no se aplican a la soluciones de diálisis o al circuito de la solución de diálisis.
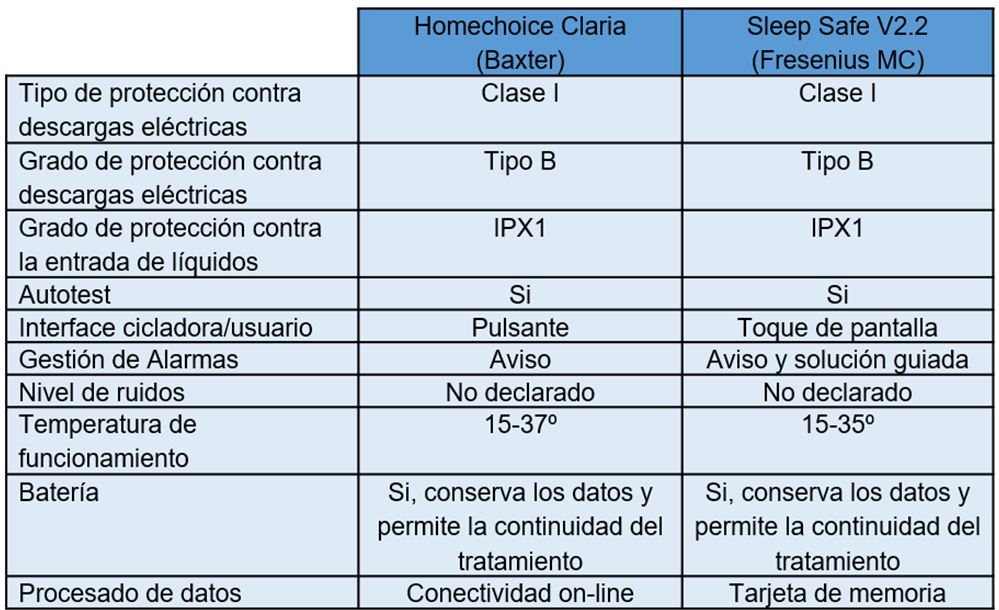
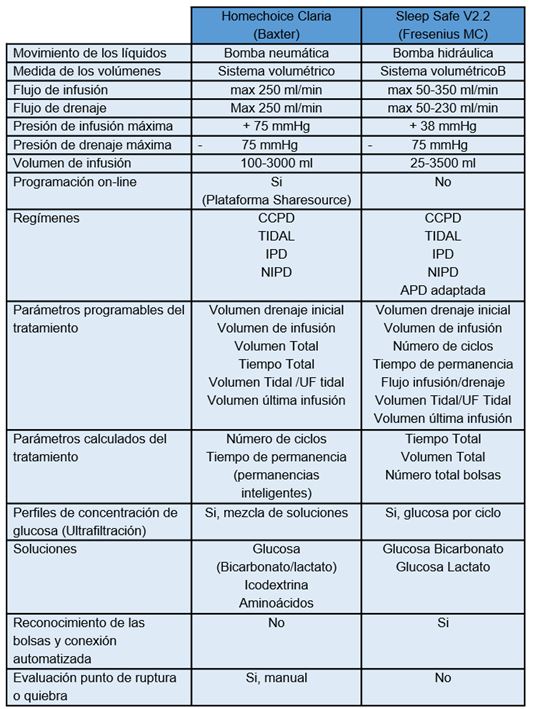
Las cicladoras actuales disponibles en el mercado español son, la Homechoice Claria, basada en la Homechoice Pro, (Baxter) [49] y la Sleep Safe V2.2 (Fresenius Medical Care) [50]:
1.- Para el grado y tipo de protección contra descargas eléctricas caen dentro del equipamiento clase I tipo B, respectivamente,
2.- Para el grado de protección contra la entrada de agua o líquidos, están incluidos en la clase IPX1.El grado de protección IP hace referencia a la norma europea EN 60529, equivalente a la norma internacional de la Comisión Electrotécnica Internacional CEI 60529 "Grados de Protección" (en inglés, IEC - International Electrotechnical Comisión - 60529 Degrees of Protection), y es un sistema de codificación para indicar los grados de protección proporcionado por la envolvente de los aparatos contra el acceso o penetración a las partes peligrosas. Dicho código está formado por las letras "IP" (del inglés: IngressProtection) seguidas de dos cifras numéricas características que son independientes una de otra, la primera hace referencia a la protección contra la penetración de cuerpos sólidos, y la segunda contra los efectos perjudiciales debido a la entrada de líquidos, normalmente agua, en su interior. Esta segunda cifra puede tomar valores de 0 hasta 8, y a medida que su valor aumenta, la cantidad de agua que intenta penetrar en el interior de la evolvente del equipo es mayor, y también se proyecta en más direcciones. La cifra 1, indica que está protegida contra la caída vertical de gotas de agua.
El cumplimiento de estas normas por las empresas fabricantes determina que las garantías de seguridad ofrecidas por las cicladoras disponibles en el mercado sean las adecuadas para equipos electro-médicos.
El objetivo de la cicladora es proporcionar diálisis segura y eficaz de manera automatizada principalmente mientras el paciente duerme, permitiendo al paciente adaptar la diálisis a su modo y estilo de vida.
CARACTERÍSTICAS
Se pueden diferencias dos tipos de características que deben incorporar las cicladoras:
Fundamentales o funcionales
- Precisión volumétrica, para coordinar los volúmenes de llenado (o infusión) y drenaje, así como la cantidad de ultrafiltración en cada ciclo (diferencia entre volumen infundido y drenado)
- Control del termostato para calentar la solución que se infunde.
- Control del tiempo total de tratamiento, y de los tiempos de infusión, permanencia y drenaje
- Control sobre el último volumen de llenado (igual o diferente solución) antes de finalizar el tratamiento.
- Capacidad de evaluar el caudal y la velocidad de drenaje del efluente
- Capacidad de monitorización con alarmas de seguridad que alerten sobre cualquier problema
- Autonomía funcional en ausencia de suministro de la red eléctrica.
Generales
- Ser transportable, facilitando al paciente moverse de su lugar de residencia habitual, bien sea por negocios o vacaciones.
- Bajo nivel de ruidos: que no perturbe el sueño del paciente o de su familia.
- Disponer de una conectología simple y utilizable incluso por pacientes con dificultades manuales o visuales, así como segura para evitar el riesgo de “contaminación táctil”.
- Software de gestión de esquemas de terapia
- Capacidad de registro de los esquemas de terapia en soporte magnético o conectividad para la transmisión on-line
- Capacidad de registro de los datos de la sesión en soporte magnético o conectividad para la transmisión on-line de los datos
- Menús de ajuste de tratamiento específicos para el personal sanitario con bloqueo para el acceso al paciente
FUNCIONALIDAD
Publicaciones previas han revisado diferentes aspectos de uso práctico, técnicos y de funcionalidad de las cicladoras [54] [55]. No obstante, la evaluación de las actuaciones específicas en la funcionalidad de la cicladora corresponde al personal sanitario, médicos y enferme&s.
Cada vez que un paciente se conecte a la cicladora para iniciar la terapia, esta debe comenzar con un drenaje inicial para vaciar la cavidad abdominal. La cicladora coordina las tres fases principales del proceso, infusión, permanencia y drenaje, que en su conjunto constituyen “un ciclo”.
Los parámetros críticos para la correcta prescripción, son el tiempo de duración del periodo nocturno (8-10 horas), el volumen total de la solución infundida en este periodo, y el volumen de infusión por ciclo. Estos parámetros obligan a una prescripción diferenciada por el médico ya que son gestionados de diferente manera por las dos cicladoras, Claria y Sleep Safe V2.2. La cicladora calcula el tiempo de llenado, el tiempo de drenaje y la tasa mínima de flujo en función de las especificaciones de la misma, de modo que la primera estima el número de ciclos y el tiempo de permanencia (permanencias inteligentes), mientras que en la segunda estos son parámetros de la propia prescripción. Con la duración del periodo nocturno especificada previamente, las fases de infusión y drenaje (puede considerarse como tiempo no útil de tratamiento) pueden representar entre el 20-25% de toda la duración de la sesión. Si se considera que en estas fases el volumen de solución en contacto con la membrana peritoneal no es el programado, se puede entender que la capacidad de transporte de solutos y de agua se ve reducida. La prolongación del tiempo de drenaje es el que más repercute en la eficacia del proceso.
La optimización de los tiempos de infusión y de drenaje se puede considerar es un factor crítico, tanto que las cicladoras actuales llevan a cabo estas fases utilizando bombas, en comparación con las cicladoras antiguas que tenían como única fuerza la gravedad. Aunque en ambas cicladoras el sistema de medición es volumétrico, la infusión o el drenaje de la solución de diálisis, a o desde la cavidad peritoneal, se realiza mediante bombas neumáticas (Baxter) o hidráulicas (Fresenius), generando presiones positivas o negativas mediante sensores calibrados capaces de verificar las presiones de infusión y drenaje. La integración y monitorización constante de estas presiones permiten un manejo preciso de los volúmenes en ambas direcciones. Si en este juego de presión-volumen se superan los límites de seguridad, presión máxima de 113.8 mmHg aplicada durante un periodo máximo de 10 segundos, en términos clínicos el paciente puede referirlo como” dolor” al final del drenaje o al comienzo de la infusión [56]. Por lo tanto, la cicladora debe tener sensores de presión capaces de estimar pequeñas variaciones, incluso inferiores al rango de calibración, para evitar daños en la membrana peritoneal, disminuir o evitar los síntomas y sobre todo que ayuden a mejorar el cumplimiento del tratamiento por el paciente.
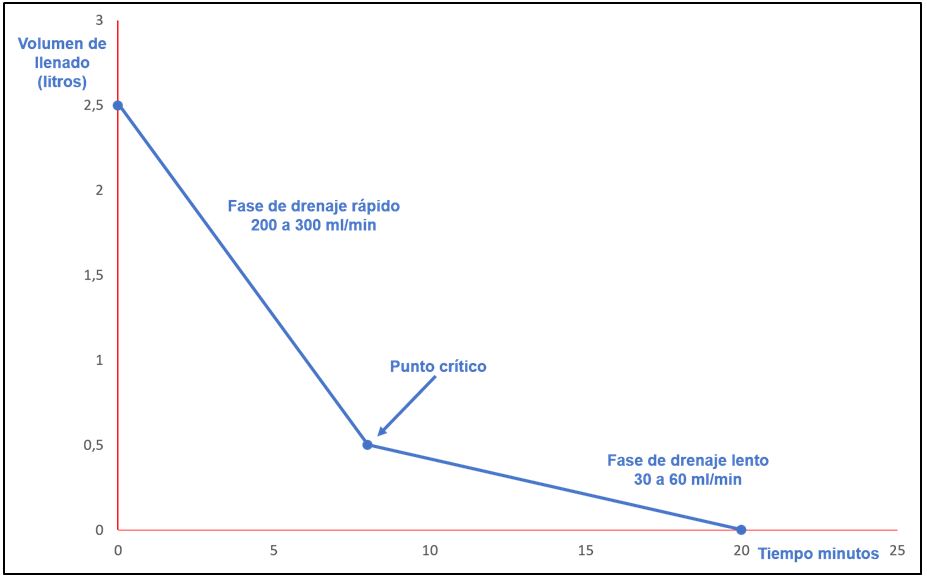
Para optimizar la eficiencia de la diálisis actuando sobre los tiempos de drenaje, hace algunos años se introdujo la evaluación de los denominados “puntos de ruptura o punto crítico”, que es el momento donde se produce un cambio en la velocidad del flujo de drenaje desde un alto caudal inicial (200-300 ml/min) a una velocidad mucho más lenta (30-60 ml/min), de modo que en los primeros 5-8 minutos de esta fase se drena el 75-85% del volumen contenido en la cavidad abdominal, mientras que para descargar el 15-25% restante el tiempo se prolonga más de 10 minutos (Figura 1). Basados en las características anatómicas del paciente y en la función del propio catéter, cada paciente tiene su propio “punto crítico”, que puede variar de 65% a 95% del volumen presente en la cavidad abdominal. El reconocimiento de esta situación, la idea de optimizar los tiempos de drenaje y permanencia, junto con el volumen óptimo de contacto de la solución con la membrana peritoneal, dio origen al esquema de terapia “Tidal o Marea”, en el que el volumen infundido se corresponde con el volumen drenado a flujo alto, manteniendo un volumen residual constante dentro de la cavidad abdominal. Se puede conseguir un aumento del número de ciclos y, por tanto, del volumen total infundido por sesión [57] [58]. Para evitar el sobrellenado debe programarse un mínimo de ultrafiltración (drenaje extra) por ciclo, en función del número total de ciclos. Hoy por hoy este esquema es útil para reducir la aparición de alarmas que se activan cuando, durante la fase de drenaje, el flujo de dializado se reduce, para aliviar el disconfort y la clínica de dolor que refieren los pacientes.
Deseable sería que las cicladoras pudieran detectar en cada sesión el punto de ruptura, cuando se reduce el caudal del volumen drenado, y dentro de ciertos rangos aplicar los datos como ajuste para la sesión sin que se produzca incremento del máximo volumen intraperitoneal tolerable con el consiguiente incremento no deseado de la presión intraabdominal.
SIMPLICIDAD DE USO Y FIABILIDAD
La cicladora es un equipo electro-médico que se utiliza predominantemente en la casa del paciente por lo tanto debe ser un dispositivo sencillo y fiable, de modo que el paciente pueda gestionar las maniobras vinculadas al tratamiento de cada sesión de diálisis con seguridad.
El concepto de simplicidad de uso se aplica a la fase de aprendizaje por el paciente, como utilizar y gestionar el tratamiento en sí. Los botones de interacción para la gestión del montaje deben ser pocos y los mensajes que muestre la pantalla deben ser claros, fáciles de leer, que asistan y guíen al paciente en la preparación de la cicladora, facilitando al personal sanitario de enfermería la enseñanza. La sencillez del equipo permite tiempos de entrenamiento más cortos, con reducción de los costes expresados en los días dedicados a la formación, y una mejor preparación del paciente, aumentado su autocontrol y confianza.
La fiabilidad determina la importancia de reducir los riesgos de fallo de la cicladora, y está garantizada por los controles internos de las funciones antes del inicio del tratamiento con los procedimientos de verificación de auto prueba del sistema en su conjunto, alarmas, termostato, control de los volúmenes de infusión y drenaje.
Así mismo, esta fiabilidad debe garantizar la disponibilidad de sistemas de continuidad de suministro de energía en caso de fallo de la red eléctrica domiciliaria, a través de una batería que entre automáticamente en funcionamiento para mantener los datos de la sesión actual en la memoria de la cicladora por un periodo de tiempo suficientemente largo (al menos 2 horas) para darle continuidad al tratamiento. El reinicio del suministro por la red eléctrica domiciliaria, también automáticamente debe cesar el funcionamiento de la batería. Si el periodo de interrupción es más prolongado, debe generarse una alarma que advierta al paciente que debe realizar un drenaje manual de la cavidad abdominal
La evaluación de la simplicidad y fiabilidad corresponde a los usuarios, personal sanitario y paciente.
SISTEMAS DE REGISTRO DE DATOS E INFORMATIZACIÓN
El primer nivel es la introducción de la “tarjeta de paciente” en la que se graban los datos relativos al esquema de diálisis que se ha programado y se almacenan los resultados de cada una de las sesiones de tratamiento. Requiere disponer, en el hospital, de un ordenador con el software capaz de realizar ambos procesos: grabar el esquema programado y descargar la información de la tarjeta para guardarla en el ordenador. A su vez la cicladora debe ser capaz de reconocer el esquema programado y ejecutarlo. Actualmente la cicladora Sleep Safe V2.2 corresponde a este nivel.
El segundo nivel, permite establecer una conexión remota con la cicladora en casa del paciente, La transmisión de datos se realiza vía modem y a través una plataforma en la “nube” se enlaza con el hospital. La comunicación es bidireccional, permite la monitorización remota de las sesiones de diálisis y la modificación del esquema de diálisis programado que es reconocido por la cicladora y aceptado por el paciente en su domicilio. Este protocolo requiere del consentimiento del paciente y de la aprobación por el servicio de informática del hospital que es garante junto al equipo sanitario de la unidad de terapias domiciliarias del cumplimiento de los estándares de seguridad, confidencialidad, y fiabilidad de la transmisión de los datos en cumplimiento de las normativas reguladoras legales de salvaguarda de la privacidad. Este nivel corresponde a la cicladora Homechoice Claria.
Las empresas fabricantes de cicladoras facilitan softwares de los que son “propietarios” y protocolos de transmisión de datos adaptados a sus sistemas, lo que imposibilita gestionar de forma centralizada los datos de todos los pacientes. Es deseable que estos softwares convirtieran y transfirieran a estándares abiertos los datos de modo que se puedan leer, integrar y gestionar por los sistemas de gestión informatizada de los servicios públicos.
SOBRELLENADO Y DOLOR EN EL DRENAJE
El sobrellenado o aumento del volumen intraperitoneal (VIP), más allá del volumen de infusión prescrito, puede ser una complicación inherente al procedimiento. No obstante, ambas cicladoras están programadas para detectar el sobrellenado, evitarlo, drenando al paciente por completo antes de pasar a la fase de infusión, y emitir una alarma de aviso si se detectan riesgos de aumento del VIP. Los factores que pueden favorecerlo pueden ser mecánicos o depender de los procedimientos realizados por el propio paciente. Se debe tener en cuenta que la modalidad Tidal si bien puede disminuir el “dolor” durante el drenaje también puede contribuir al riesgo de sobrellenado.
Debido a que la cicladora utiliza fuerzas neumáticas para extraer la solución de diálisis de la cavidad abdominal, puede ocasionar “dolor” por tracción (presión negativa), cuando la cavidad está vacía o el catéter hace válvula con efecto sifón sobre las estructuras y tejidos intraabdominales sensibles que lo rodean (pared intestinal, omento, pared vesical, trompas de Falopio, pared uterina, etc.) [52] [56] [57].
PROGRAMACIÓN
Un régimen es un plan terapéutico sistemático. La estratega del régimen a prescribir y la elaboración del programa de tratamiento de la cicladora no entra dentro del desarrollo de este apartado, no obstante, siempre se debe tener en consideración que el objetivo de una prescripción adecuada se basa en la individualización de la terapia, para ello se deben seguir las recomendaciones de la bibliografía específica [58] [59].
En la (Tabla 5) y (Tabla 6) se resumen las características técnicas y de funcionamiento, respectivamente, de las cicladoras Claria y Sleep Safe V2.2,
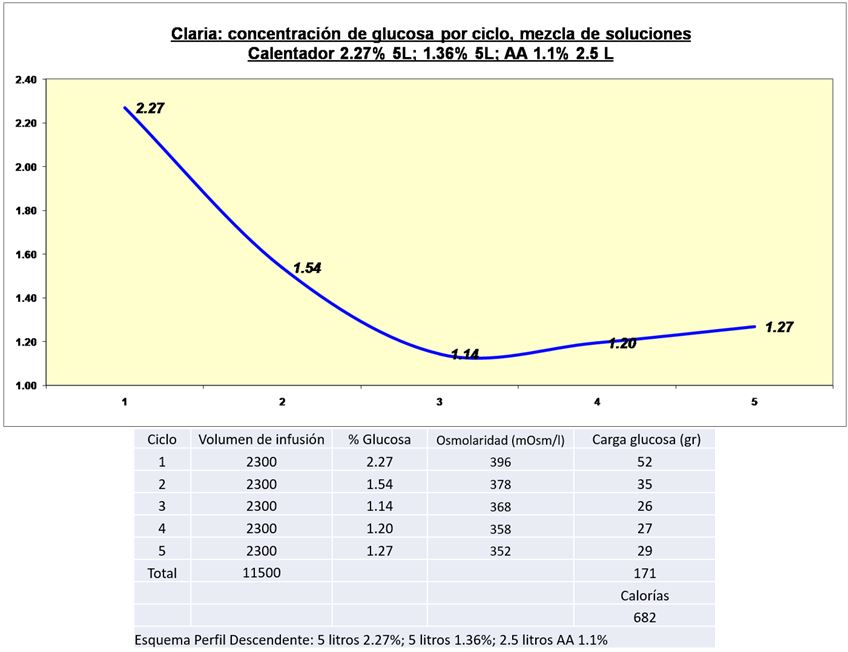
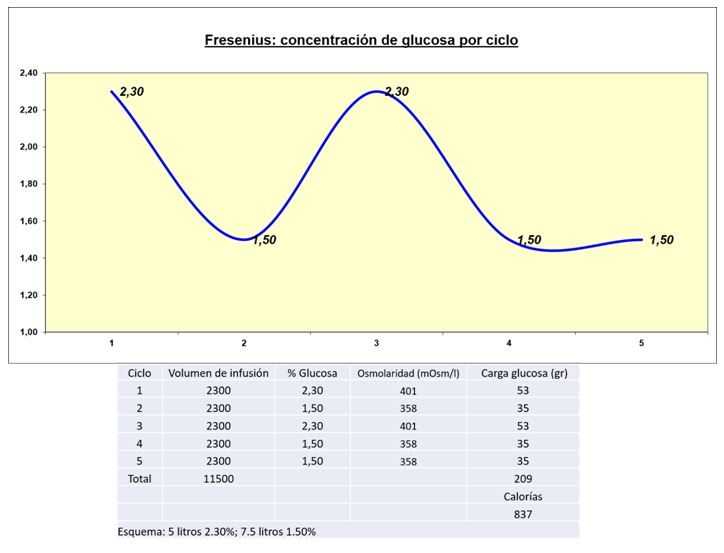
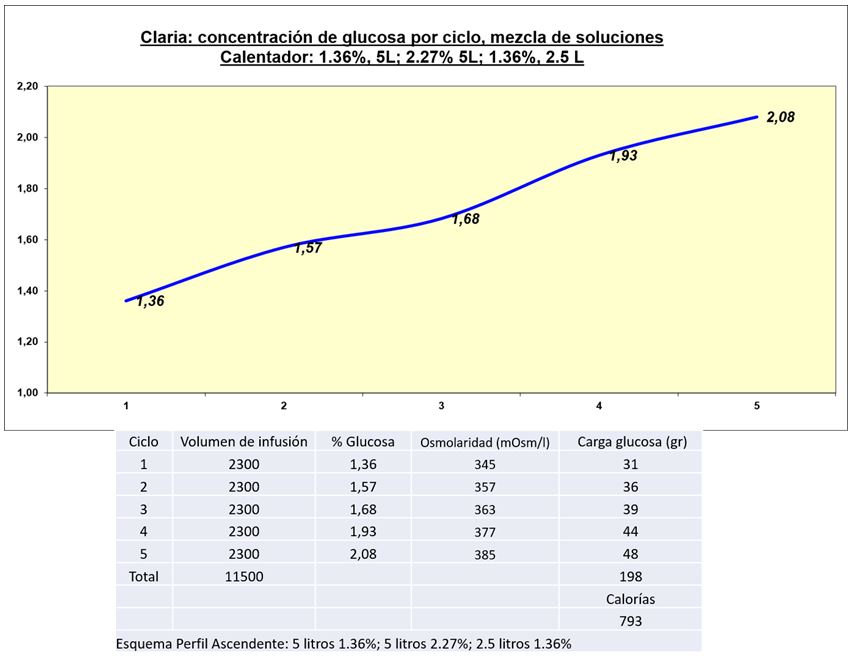
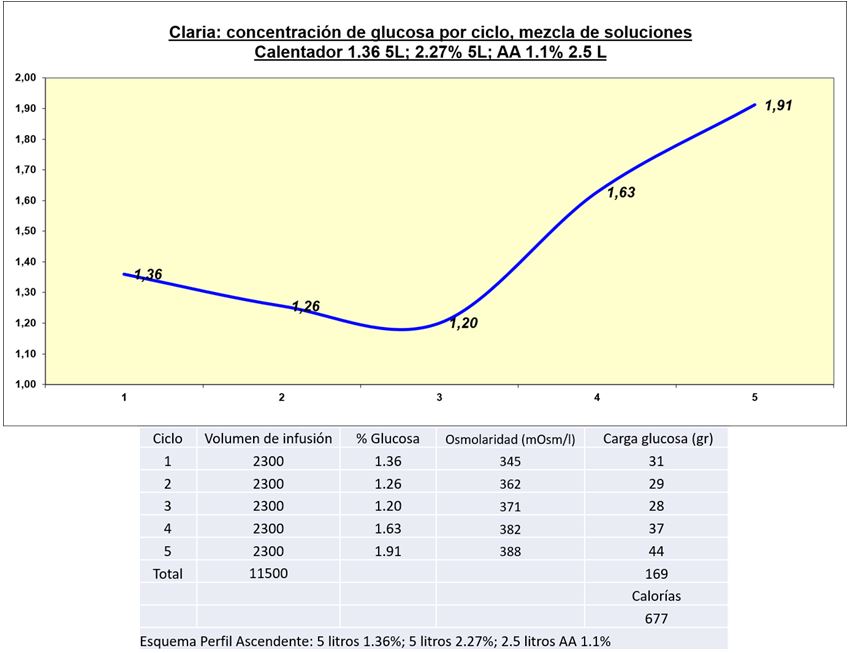
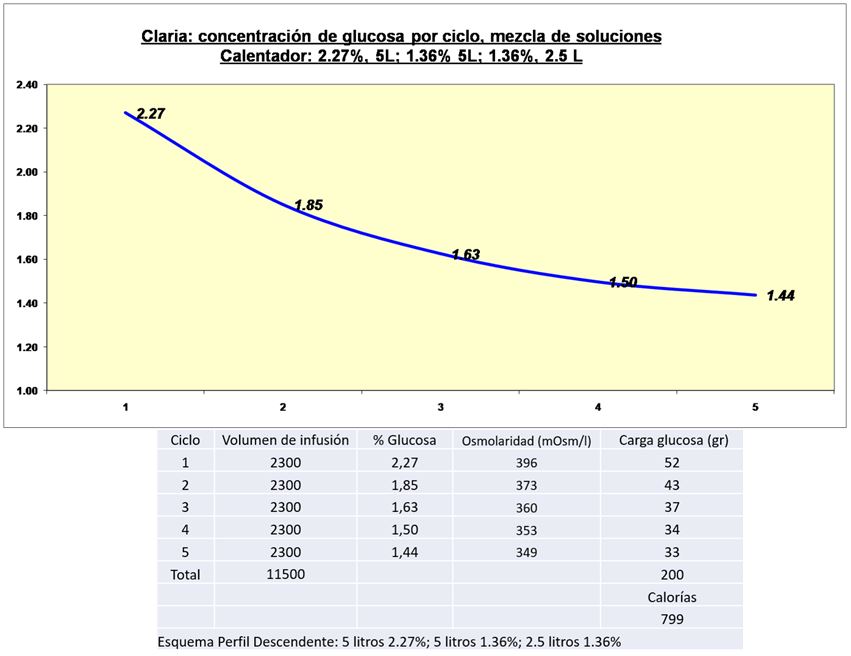
Se debe tener en cuenta que el uso de soluciones en combinación disminuye la carga de glucosa procesada y absorbida, contribuyendo a preservar la integridad y funcionalidad de la membrana peritoneal. En la (Figura 2) (Figura 3) (Figura 4) (Figura 5) (Figura 6) se visualizan distintos perfiles de concentración de glucosa por ciclo (perfiles de ultrafiltración [60]), la carga de glucosa procesada, y el correspondiente aporte calórico. Claria: mezcla de soluciones en combinación, perfil descendente (Figura 2) y Figura 3); perfil ascendente (Figura 4) y (Figura 5); y Sleep Safe: concentraciones programadas de glucosa por ciclo (Figura 6).
Tablas
![Tabla 1. Tipos de Catéteres (Adaptado de tabla de la Dra. Maite Rivera). Curso de Fundamentos de la Diálisis Peritoneal. Tema Materiales para la Diálisis Peritoneal, organizado por la SEN [9]. Tabla 1. Tipos de Catéteres (Adaptado de tabla de la Dra. Maite Rivera). Curso de Fundamentos de la Diálisis Peritoneal. Tema Materiales para la Diálisis Peritoneal, organizado por la SEN [9].](https://static.elsevier.es/nefro/monografias/1/227/1224.jpg)




![Tabla 2. Recomendaciones de las guías ISPD para la preparación e implantación del catéter peritoneal [4] Tabla 2. Recomendaciones de las guías ISPD para la preparación e implantación del catéter peritoneal [4]](https://static.elsevier.es/nefro/monografias/1/227/1225.jpg)