La ecografía es una de las exploraciones más útiles y rentables en el trasplante renal, aportando importantes datos que ayudan en su manejo en todos sus estadios evolutivos. Algunas de sus ventajas incluyen facilidad de acceso ecográfico al riñón por su peculiar posición anatómica y la comodidad de poder realizar la prueba tanto en hospitalización como en consultas, con mínimo trastorno para paciente y médico.
Es conveniente realizar ecografías seriadas para valorar la evolución del trasplante renal: en nuestra Unidad se realiza una ecografía en las primeras 24 horas postrasplante (basal) y cada 48 horas durante la primera semana. Después, si no hay incidencias clínicas, se realiza semanal hasta el alta. Esto nos permite analizar la evolución del tamaño y ecogenicidad renales, la aparición y evolución de colecciones perirrenales y la evolución de la perfusión renal e índices de resistencia mediante Doppler.
Para obtener el máximo de información en la ecografía e interpretar adecuadamente los hallazgos ecográficos han de conocerse datos anatómicos de receptor y donante, así como la fecha de realización del trasplante, el tipo de anastomosis vascular y la realización o no de biopsia del donante. También son de interés los datos obtenidos en ecografías previas, la situación anatómica de los órganos periinjerto (vejiga, próstata, útero, anejos) y el tipo de diálisis recibida pretrasplante. No hay que olvidar que al realizar la ecografía renal, no se puede hacer abstracción de la situación general del paciente y en ocasiones se pueden encontrar datos patológicos extrarrenales que pueden ser explicables por la historia previa del paciente.
Toda ecografía del trasplante debe incluir evaluación morfológica (modo B) donde evaluaremos tamaño, localización, posición, ecogenicidad renal y de las posibles colecciones perirrenales, así como la situación de la vía excretora y la vejiga. Además, la valoración hemodinámica con Doppler en sus diferentes modalidades (color, pulsado y power) es de gran utilidad en la valoración de la vascularización intra y extra renal [1][2][3][4]. En determinadas condiciones, puede ser de utilidad una ecografía con contraste o ecopotenciadores del injerto, la cual se está utilizando con frecuencia creciente.
Ecografía en modo BEl injerto renal se suele colocar en la fosa iliaca derecha (si es primer injerto), con anastomosis término lateral a la iliaca externa y suele observarse con facilidad debido a que su posición es cercana a la superficie cutánea. Cada vez es más frecuente la realización de trasplantes renales en pacientes con ateromatosis, por lo que se pueden realizar anastomosis vasculares con distintas variantes anatómicas: el parche de aorta suele emplearse especialmente en caso de que existan varias arterias renales independientes, ya que reduce el número de anastomosis y, por tanto, el riesgo asociado a las mismas (como estenosis o sangrado). Si no se dispone de parche, la arteria renal puede espatularse en su extremo y unirse en término-lateral a la iliaca externa o bien término-terminal a la arteria hipogástrica.
Si hay varias arterias de distinto calibre, las más finas se anastomosan en término-lateral sobre las más gruesas o sobre un ojal del parche aórtico.
Para realizar la ecografía del trasplante renal colocaremos al paciente en decúbito supino con el transductor paralelo a la cicatriz y por fuera de ella para evitar interposición de gas abdominal, sobre todo en el postrasplante inmediato (Figura. 1).
A partir de ahí iremos cambiando lentamente la posición del transductor hasta obtener la mejor imagen. Estos cambios lentos de posición del transductor son necesarios y se deben a que la colocación del injerto no siempre es paralela a la cicatriz. El transductor que usaremos será convexo y de baja frecuencia (igual que para riñones nativos).
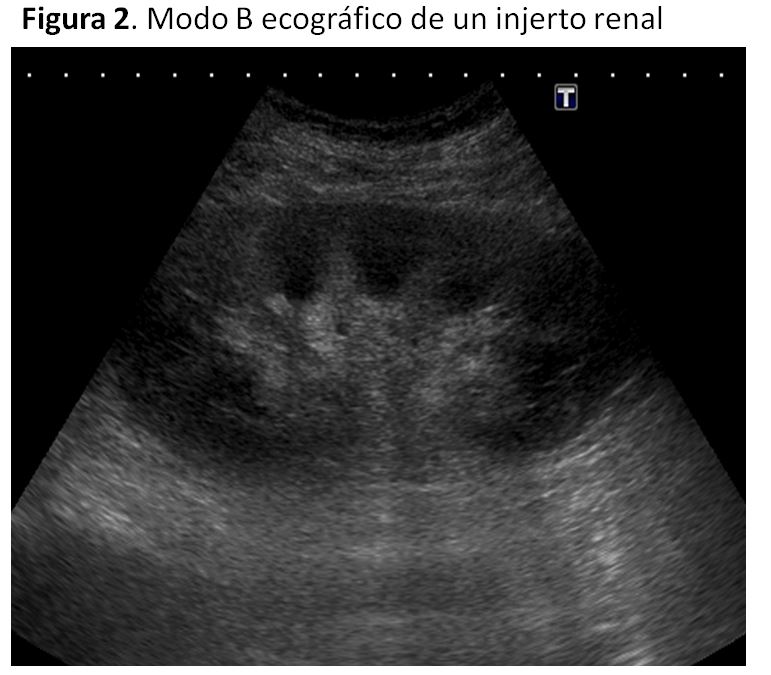
En la ecografía modo B procederemos igual que con los riñones nativos: la cápsula suele ser blanca, con un parénquima muy bien definido en negro y seno blanco. En el riñón trasplantado las pirámides son más visibles que en el riñón nativo, siendo relativamente hipoecoicas con relación al parénquima adyacente y no se asocian necesariamente a patología (Figura 2).
Mediremos tamaño longitudinal y transverso. Para calcular el volumen renal se multiplica el valor de las tres dimensiones por 0.49 (factor de corrección). El tamaño renal es de utilidad en el diagnóstico de rechazo agudo (en el que generalmente aumenta, debido a edema e infiltración intersticial) y también tiene interés en el seguimiento a largo plazo, ya que los cambios fibróticos de la disfunción crónica del injerto pueden inducir disminución en el tamaño renal. Toda la exploración será sistematizada por áreas: polo superior, tercio medio y polo inferior, en longitudinal y transverso, y se hará valoración del espacio periinjerto y vejiga. Adaptarse y seguir rutinariamente esta sistemática de estudio es de vital importancia porque evita omisiones, descuidos y minimiza las diferencias interobservador.
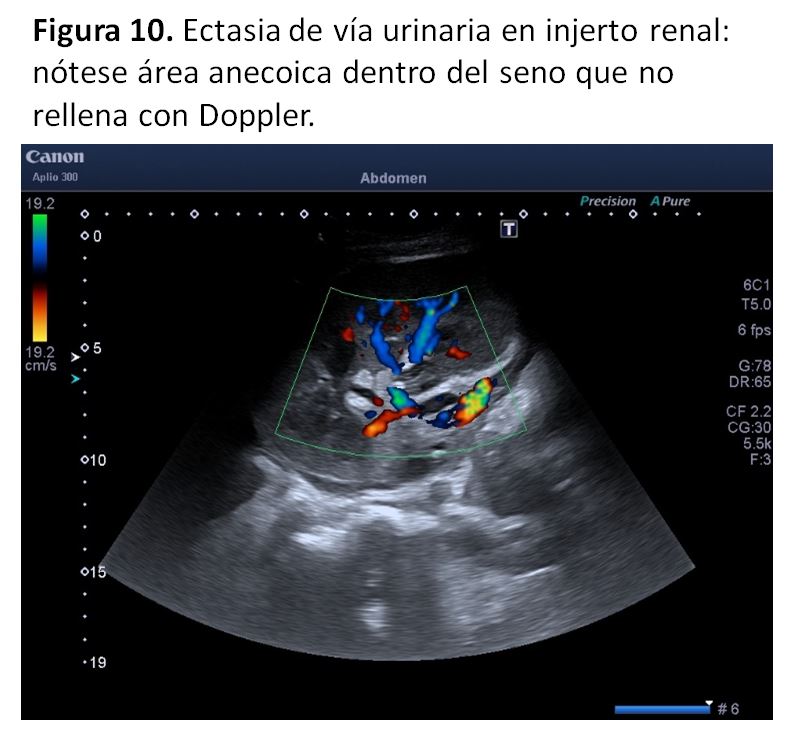
Otra peculiaridad anatómica del riñón trasplantado es la fácil visualización de la pelvis y el uréter, en relación con ectasia de la vía urinaria. En el postrasplante inmediato puede ser normal y se debe a edema de la anastomosis ureterovesical. En periodos más tardíos del trasplante no hay que olvidar que el uréter trasplantado está denervado, por lo que en los pacientes con vejiga llena puede verse cierta patencia de la vía urinaria, ya que no todos los equipos quirúrgicos eligen técnicas antirreflujo en el momento de realizar el trasplante, por lo que es posible que la ectasia de la vía urinaria se deba a cierto grado de reflujo vésicoureteral.
Ecografía DopplerLa ecografía Doppler es un procedimiento de rutina que es de gran ayuda en el postrasplante inmediato y en el seguimiento de trasplante tardío, sobre todo para el diagnóstico precoz de las complicaciones vasculares arteriales y venosas. Además, el seguimiento ecográfico rutinario en los primeros días postrasplante es de gran ayuda en la evolución pronóstica. Aunque hay un capítulo dedicado al Doppler renal, comentaremos brevemente los tres tipos de modos Doppler con los que contamos en la práctica clínica.
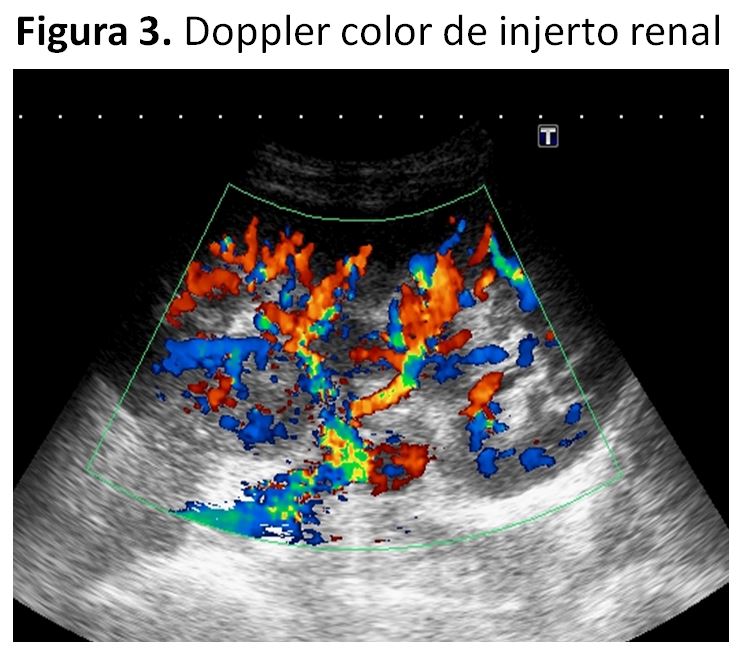
1) Doppler color:Prueba cualitativa. Muestra la vascularización renal y los vasos adyacentes (Figura. 3). Indica el grado de vascularización renal y ayuda a distinguir estructuras hipoecoicas (uréter) de los vasos renales o periinjerto. También es de gran utilidad para diferenciar quistes (no vascularizados) de masas renales vascularizadas.
En la (Figura 3) se observa un injerto renal con buena vascularización. Se representa en rojo el flujo que se acerca a la sonda (arterias) y en azul el que se aleja de la misma (venas). A simple vista la vascularización renal en este injerto es excelente en polo superior, medio e inferior y se distingue la anastomosis arterial en la que hay distintos colores (mezcla de rojo y azul) como corresponde a una zona de cambio en la dirección del flujo.
2) Doppler pulsado:Registro espectral, cuantitativo. Es una representación del flujo renal a lo largo del ciclo cardiaco. El riñón es un órgano de baja resistencia, por lo que los flujos arteriales sistólicos y diastólicos quedan claramente definidos en una imagen en onda bifásica. En cambio, el flujo venoso es fijo, mantenido y se representa con una onda monofásica continua. De nuevo insistimos en la metódica de realización de la ecografía, puesto que la vascularización renal puede no ser homogénea en todo el parénquima y puede ayudar al diagnóstico de infartos renales en caso de arterias múltiples. La evaluación de los flujos arteriales ha generado una gran cantidad de estudios en los que se han definido diversos índices: Índice de resistencia, índice de pulsatilidad, velocidad del pico sistólico y área máxima fraccional. De todos ellos los más utilizados son la velocidad de pico sistólico (VPS) y el índice de resistencia (IR):
a. IR: es un cociente que relaciona la diferencia entre la velocidad de pico sistólico y la velocidad diastólica con la velocidad de pico sistólico. Evidentemente la ausencia de diástole supone un índice de resistencia de uno. Sin duda este índice es un excelente marcador de la capacidad de distensión de las arterias y del flujo arterial y puede ser un buen marcador de la evolución renal. Tiene utilidad clínica demostrada, pero su sensibilidad/especificidad pronóstica a largo plazo es controvertida. Los estudios más recientes prueban que, si bien existen resultados contradictorios con respecto a la relevancia del IR como factor pronóstico dependiendo del intervalo de tiempo post trasplante en el que se obtenga, el IR es un parámetro hemodinámico semicuantitativo que ofrece información valiosa especialmente cuando se mide de forma repetida en el mismo paciente, ayudando a identificar aquellos pacientes con alto riesgo de complicaciones para solventarlas, mejorando así el pronóstico de injerto y paciente a largo plazo [5][6][7]. La (Tabla 1) resume múltiples estudios del IR.
b. VPS: su elevación precoz tiene una relevancia cuestionable en el diagnóstico de la estenosis de arteria renal, ya que se ha demostrado que en un alto porcentaje de pacientes con VPS elevada ésta disminuye a los dos meses post trasplante, por lo que el momento idóneo de mayor sensibilidad de este índice está aún por determinar [8].
El IR depende de ciertos factores, como por ejemplo una presión elevada del transductor por parte del operador puede aumentar los IR. También se ha descrito una disminución de la VPS e IR de hasta un 17% en posición de bipedestación, por lo que la postura del paciente también podría ser un factor modificador de estos índices [9].
A pesar de la evidencia clínica de la utilidad de la ecografía Doppler como marcador pronóstico de evolución renal, faltan estudios prospectivos realizados con ecografías seriadas que establezcan cual es el mejor índice pronóstico y cuál es el momento idóneo de realización de la ecografía como marcador pronóstico.
La ecografía basal (realizada en las primeras 24 horas postrasplante) es dificultosa por diversos motivos:
1) Dolor en el paciente.
2) Edema periinjerto.
3) Edema de anastomosis arteriales y de la unión uréterovesical.
Su principal utilidad es establecer si la perfusión renal es adecuada en todos los polos y si hay colecciones periinjerto importantes (generalmente en relación con sangrado posquirúrgico).
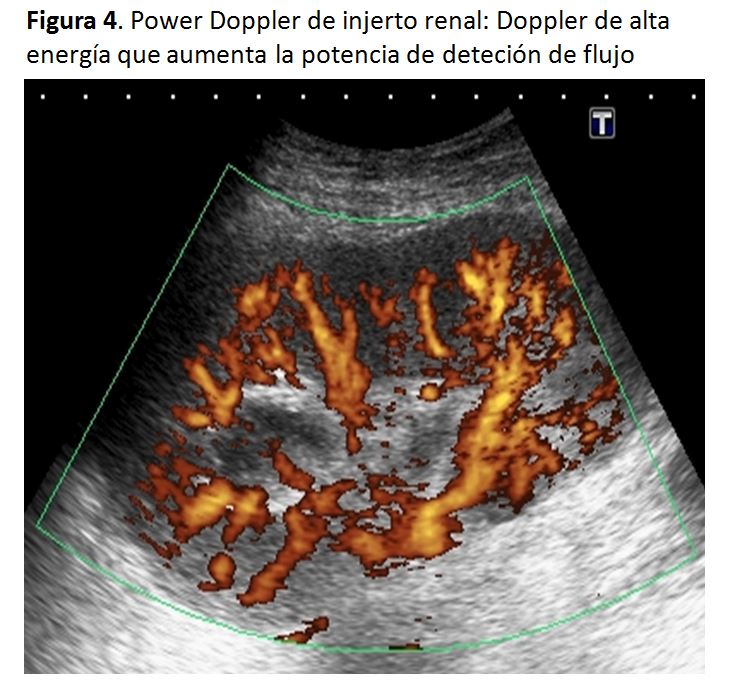
3) Doppler powerEl Doppler Power es un Doppler de alta energía que aumenta la potencia de detección de flujo en relación al Doppler standard. En nuestra experiencia es de gran utilidad, sobre todo en el primer día postrasplante en el que el edema perinjerto y el dolor del paciente impiden una detallada evaluación con Doppler pulsado (Figura. 4).
Valoración de flujos intraoperatoriosLa aplicación más novedosa de la ecografía consiste en la implantación de una sonda intrainjerto en el acto quirúrgico para monitorizar el flujo arterial. La primera referencia en la literatura data de 2011 [11]. En ese mismo año se publicó un artículo en el que la diferenciación por terciles de los índices de resistencia con este tipo de sonda ayuda a discriminar a pacientes que tendrán función renal inmediata [12].
Ecografía con contraste en el trasplante renal (CEUS)Los contrastes potenciadores en la ecografía renal son compuestos con microburbujas (< 7 µm) con un centro gaseoso (hexafluoruro de azufre) recubiertas por lípidos o sacáridos que se inyectan por vía intravenosa. A nivel renal generan un aumento del contraste entre la sangre y los tejidos circundantes cuando se produce el choque con las ondas ultrasónicas de alta energía. No es nefrotóxico y su eliminación tiene lugar por vía respiratoria.
El empleo de este tipo de contraste proporciona información acerca del flujo y perfusión renal que es cuantificable, incluso a nivel muy distal (subcapsular). Existen varios estudios respecto a su empleo en el trasplante renal [13][14]: en el primero, en 14 de 171 trasplantes se detectaron IR elevados en el estudio de Doppler renal y se realizó una ecografía con contraste, que permitió diagnosticar de forma precoz 3 trombosis venosas con ausencia de flujo de contraste en córtex renal y pirámides. De los 11 pacientes restantes, los autores no describen ninguna diferencia entre rechazo agudo o necrosis tubular aguda con flujo lento de contraste al córtex renal y pirámides, sin poder diferenciar entre estas dos patologías. El último artículo publicado en 2017 [15] incluía a 15 pacientes trasplantados renales recientes. La ecografía con contraste excluyó complicaciones vasculares y necrosis cortical en el 74% de los mismos.
Sin duda, el incremento de sensibilidad ayuda a distinguir mejor la perfusión renal en casos de problemas vasculares.
En pacientes con episodios de rechazo agudo (RA), se ha observado una perfusión parenquimatosa retardada en la corteza renal [16]. Se ha comparado la precisión diagnóstica de CEUS en el diagnóstico de rechazo vascular del trasplante renal con la biopsia renal como patrón oro. En un trabajo desarrollado por Mueller-Peltzer CEUS mostró una sensibilidad del 85,7%, una especificidad del 100%, con alto valor predictivo positivo y negativo [17].
Otro prometedor trabajo alemán, investigó la utilización de ecografía con contraste mediada por anticuerpos mediante el uso de microburbujas dirigidas a las células T CD3 (+), CD4 (+) o CD8 (+) en diferentes modelos de enfermedad renal. En el caso del trasplante renal el ultrasonido mediado por CD3 permite la detección del rechazo agudo celular de forma temprana (día +2 postrasplante). Las intensidades de la señal del ultrasonido aumentan con la gravedad de la inflamación, se correlacionó significativamente con el número de células T infiltrantes obtenidas por histología y con los niveles de ARNm relacionados con CD3 y determinadas quimiocinas que representan la gravedad de inflamación del injerto, aunque no el grado de lesión renal [18].
Ecografía de las complicaciones parenquimatosas del trasplante renal. Necrosis tubular aguda (NTA)La lesión del epitelio tubular se manifiesta clínicamente como la ausencia de función renal en el inmediato postrasplante, constituyendo la causa más frecuente de esta disfunción. Su incidencia es muy variable, oscila entre el 10 y el 50% atendiendo a la heterogeneidad de las distintas series, con mayor incidencia en aquellas en las que se incluyen riñones procedentes de donantes en asistolia o donantes con criterios expandidos.
En la (Tabla 2) se detallan factores de riesgo relacionados con el desarrollo de NTA, algunos de los cuales no son modificables, pero a la luz de un estudio publicado en 2020, acortar la duración de la isquemia y evitar la hipotensión durante la cirugía es esencial para prevenir la NTA postrasplante [19].
Aunque se trata de un diagnóstico histológico, en situaciones de función retardada del injerto, la ecografía modo B y la ecografía Doppler nos permiten realizar el diagnóstico diferencial con otras entidades y el seguimiento evolutivo que nos guiará en la toma de decisiones diagnósticas y terapéuticas.
Ecografía modo BLos injertos con NTA pueden visualizarse con una morfología completamente normal ya que, si bien la escala de grises puede detectar anomalías anatómicas, es mucho menos útil en la evaluación de anomalías funcionales. En otras ocasiones puede evidenciarse un aumento de tamaño del injerto, hiperecogenicidad cortical o incluso prominencia de pirámides medulares. Algunos trabajos han señalado que los injertos con NTA presentan una relación grosor de parénquima/longitud del injerto incrementada, aunque realmente esta observación no es específica de NTA, ya que se da también en pacientes con rechazo agudo (RA) [20].
Ecografía DopplerEl hallazgo en Doppler pulsado de flujo sanguíneo diastólico ausente o disminuido con IR elevados (por encima de 0,7) es un hallazgo característico, pero no específico porque también puede verse en el RA [21].
Clásicamente se ha relacionado el aumento de IR con episodios de RA (aunque este hallazgo sigue siendo motivo de controversia [20]). En nuestra experiencia, un alto porcentaje de pacientes con NTA presentan IR por encima de 0,7. En este sentido, cobra especial importancia la correlación clínica; la elevación del IR desde el inmediato postrasplante es sugestivo de NTA y cuando este incremento se evidencia de forma progresiva en sucesivos controles ecográficos, acompañándose de deterioro funcional de un injerto previamente funcionante, puede ser sugestivo de un RA. Por tanto, la realización de estudios secuenciales constituye una valiosa herramienta diagnóstica en las primeras semanas postrasplante, pudiendo visualizarse mejoría progresiva desde el punto de vista ecográfico en consonancia con la recuperación funcional y la resolución de la situación de NTA [22][23][24].
Se han descrito otros cambios en el Doppler como la inversión de flujo diastólico como hallazgo de NTA severa, pero dado que este hallazgo puede estar presente en otras entidades como la trombosis de la vena renal, a priori no debería considerarse como diagnóstico de NTA [25].
Rechazo agudo (RA)El RA ha constituido históricamente, una de las complicaciones más importantes por su potencial impacto en el funcionamiento y pronóstico del injerto renal. Sin embargo, el mejor conocimiento de los mecanismos fisiopatológicos implicados en el desarrollo del mismo, la reclasificación en función de ello y la disponibilidad de fármacos inmunosupresores más potentes, han condicionado que en las últimas décadas el RA mediado por células T se perciba como una entidad benigna [26].
La ecografía renal es una herramienta muy útil en la valoración de cambios morfológicos en el rechazo agudo y en el seguimiento de estos cambios tras la instauración del tratamiento, pero también se ha convertido en el instrumento fundamental para la realización de la biopsia renal.
Ecografía Modo BEl rechazo celular se caracteriza histológicamente por varios grados de tubulitis e infiltración intersticial con linfocitos y edema intersticial en el parénquima renal. La inflamación del parénquima se refleja en un aumento de la proporción corteza- pelvis en la ecografía en escala de grises (calculado como el cociente de la suma de los diámetros de la corteza opuesta en la sección transversal en la región hiliar entre el diámetro de la pelvis renal), mientras que la infiltración celular aumenta la ecogenicidad del parénquima renal y hace más evidentes las pirámides renales hipoecoicas [21][27].
En la ecografía, el riñón trasplantado con RA puede parecer edematoso inicialmente con una corteza engrosada, pero a medida que el rechazo evoluciona, la corteza aparece más delgada.
Aunque el aumento de volumen del injerto renal se considera normal en el periodo postrasplante (con incrementos de hasta el 22% tras la tercera semana), un aumento repentino en el volumen renal puede ser un signo de RA. Asimismo, se han encontrado diferencias en el volumen entre los injertos entre los que presentaban rechazo mediado por anticuerpos y rechazo mediado por células T (no encontrando diferencias entre el volumen medido en este último grupo y los controles sin rechazo) [28].
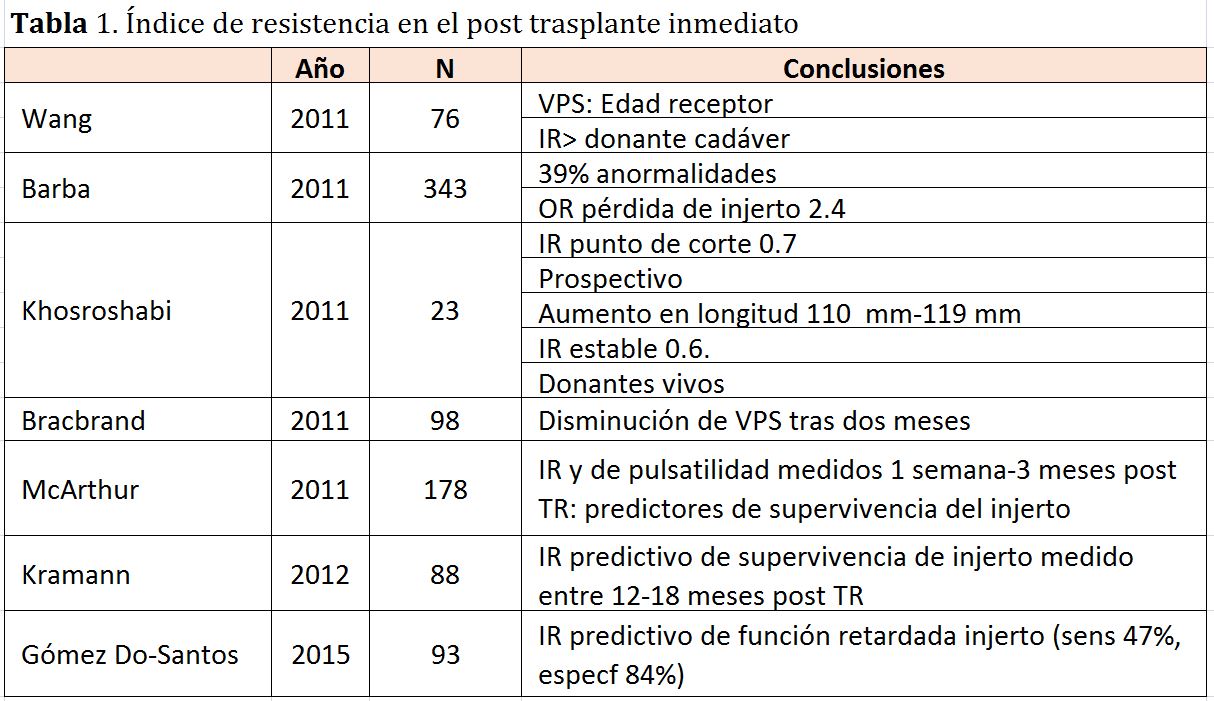
En resumen, los signos ecográficos clásicos de RA son: aumento del tamaño del injerto, la hipertrofia de pirámides, borramiento de unión cortico-medular y la compresión del complejo de ecos del seno, aunque todos ellos son muy poco sensibles y específicos (Figura 5).
Ecografía DopplerEn los episodios de RA puede observarse la disminución del flujo sanguíneo diastólico en el Doppler pulsado, que provocan una elevación de los IR superiores a 0,8. También se pueden observar IR elevados con NTA, rechazo crónico, nefrotoxicidad secundaria a niveles tóxicos de tacrolimus o ciclosporina, obstrucción y compresión extrínseca, por lo que es importante considerar los hallazgos clínicos al interpretar la ecografía [21].
El aumento de IR puede producirse en otras causas de disfunción del injerto renal [20][29][30][31][32]. En este sentido, algunos trabajos, han encontrado que un incremento superior al 10% sobre los mejores valores previos tanto del índice pulsátil como del IR pueden alcanzar una sensibilidad de hasta 78 y 60% y una especificidad de 78% y 90% respectivamente; valores mucho mejores que la determinación aislada de estos parámetros. Asimismo, en este trabajo se describe la inversión de flujo diastólico en pacientes con RA severo (también en algunos con NTA), poniéndose una vez más de manifiesto el solapamiento entre estos índices en ambas entidades [33].
Meier y col. desarrollaron un índice Doppler seriado (SDI), para distinguir entre NTA, rechazo celular agudo y rechazo vascular agudo. El SDI se calculó como el producto de las relaciones IR e IP dividido por la relación de proporción corteza- pelvis: (relación IR x relación IP) / relación PCP. En este trabajo en que se analizaron retrospectivamente 121 trasplantes renales, el SDI fue capaz de detectar el rechazo agudo de trasplante renal con mayor sensibilidad y especificidad que los ratios IR e IP, y fue capaz de discriminar las diferentes causas de disfunción del injerto, por lo que podría ser una interesante herramienta de apoyo a la hora de indicar una biopsia renal [29].
Nefrotoxicidad por anticalcineurínicos.Los inhibidores de la calcineurina, ciclosporina y tacrolimus, son la base de los esquemas de inmunosupresión actual. Sin embargo, ambos presentan nefrotoxicidad en relación a la reducción del flujo plasmático renal y del filtrado glomerular. Los mecanismos implicados son múltiples: aumento de la actividad simpática, activación del sistema renina-angiotensina, activación de la endotelina o inhibición de la síntesis de óxido nítrico [8].
La nefrotoxicidad por anticalcineurínicos puede manifestarse:
De forma aguda, especialmente en las primeras semanas postrasplante, momento en que suele ser preciso realizar ajustes de dosis constantes para mantener los niveles plasmáticos objetivo. Suele manifestarse como un fracaso renal agudo en el contexto de niveles elevados de los fármacos y, en ocasiones, se presenta con hiperpotasemia e hipertensión. Se trata de un fenómeno reversible con el ajuste de la dosis.
Como disfunción crónica con evolución a la pérdida del injerto, debido a daño vascular y glomerular, anomalías en la función tubular y aumento de la presión arterial [34].
Ecografía Modo BLa nefrotoxicidad por anticalcineurínicos no se asocia a alteraciones específicas en la ecografía renal en modo B.
Ecografía DopplerNo existe consenso en la literatura acerca de si la nefrotoxicidad por anticalcineurínicos induce cambios en Doppler renal. La lógica nos llevaría a pensar que efectivamente las alteraciones hemodinámicas inducidas por estos fármacos deberían conllevar patrones Doppler alterados, pero este hecho no ha sido probado en los trabajos que se han publicado, en su mayor parte series aisladas y casos clínicos. La mayoría de los estudios se han llevado a cabo en pacientes en tratamiento con ciclosporina. Sin embargo, existe mucha controversia y son varios los autores que señalan que no existe aumento del IR en relación al pico de nivel plasmático como cabría esperar por la vasoconstricción, que sí se ha demostrado tanto in vivo como in vitro [35][36].
En nuestra experiencia consideramos que existe al menos una tendencia a presentar mayor índice de resistencia en pacientes con nefrotoxicidad por tacrolimus, aunque se trata de un dato meramente observacional.
Disfunción crónica del trasplante.El término nefropatía crónica del trasplante está en la actualidad en desuso y se ha sustituido por el de disfunción crónica del trasplante o del injerto (DCI). La DCI es una entidad clínico-patológica, de origen multifactorial, caracterizada por un progresivo descenso del filtrado glomerular, en general asociado a proteinuria e HTA. A nivel histológico se expresa por fibrosis intersticial y atrofia tubular, pero pueden verse otros tipos de lesiones, ninguna específica. Es un diagnóstico de exclusión [36].
Las imágenes obtenidas por ultrasonografía corresponden a aquellas de una nefropatía crónica: disminución del tamaño, adelgazamiento de la cortical, aumento de su ecogenicidad y disminución de la relación grosor del parénquima- longitud del injerto [20], es decir, datos son inespecíficos.
El Doppler color puede ser normal o presentar una disminución del flujo sanguíneo con el consiguiente aumento del IR y de una reducción del flujo intraparenquimatoso. En ocasiones es necesario usar el Power Doppler si con el color no vemos con claridad a vascularización (Power Doppler para flujos muy lentos).
Se han desarrollado dos técnicas ecográficas para aumentar la sensibilidad para el estudio de la disfunción crónica del injerto. Para mejorar la rentabilidad del Doppler convencional, también se han desarrollado software específicos que cuantifican la perfusión en la corteza renal, calculando el flujo y la velocidad de flujo cortical mediante la medición en las áreas seleccionadas por el observador de los píxeles de color de una secuencia de vídeo. Por tanto el software calcula parámetros que describen la perfusión renal en términos numéricos [37]. Con la ecografía con contraste, también con un software específico, se puede cuantificar el realce del parénquima y, por tanto, su perfusión.
Complicaciones urológicas del trasplante renalLas complicaciones urológicas después del trasplante renal varían en la literatura entre el 6.5 y 20%, generando una importante morbilidad que afecta tanto a la supervivencia del paciente como del injerto [38]. Múltiples factores intervienen en este tipo de complicaciones, como la longitud del uréter o la edad del donante, siendo los más importantes la extracción del órgano y técnica quirúrgica adecuada.
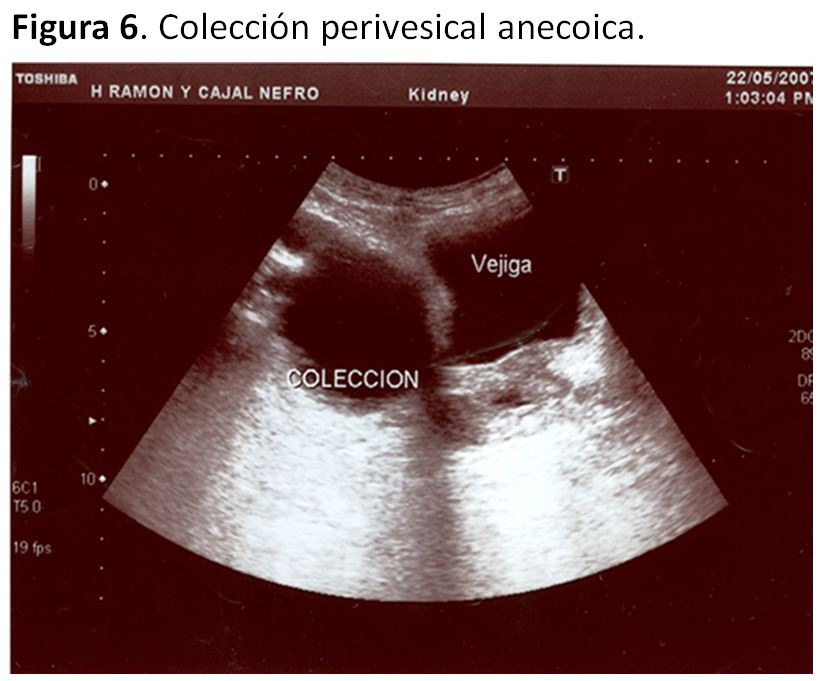
Colecciones perirrenales 1. UrinomaLas fístulas urinarias son la complicación precoz más frecuente. Aparecen en el 3-5 % de los casos en los que no se ha utilizado un catéter doble J [39][40]. Pueden producirse en el uréter, la vejiga, la pelvis o cálices y la causa más frecuente es una necrosis isquémica del uréter [41].
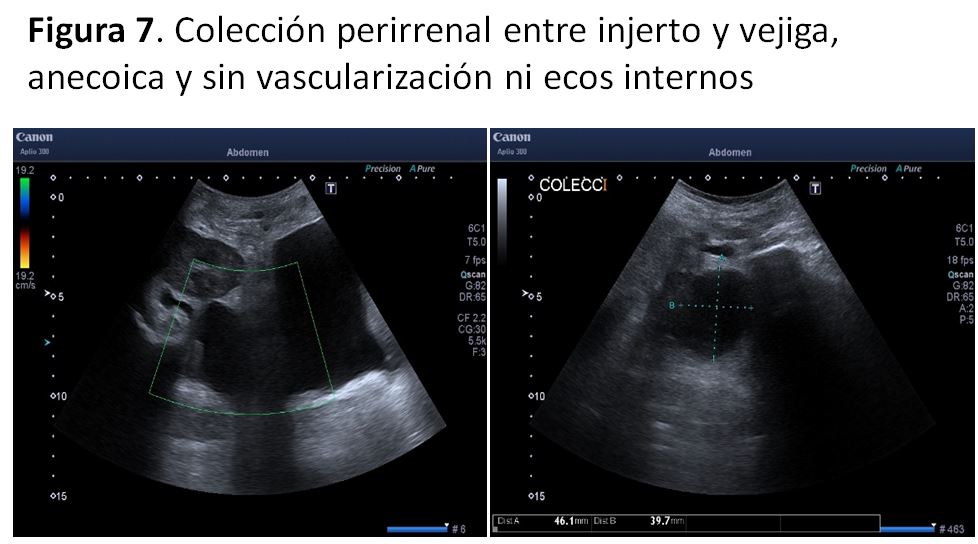
Ecográficamente se evidencia una colección anecoica, de contorno bien definido y que habitualmente se sitúa entre el polo inferior del injerto y la vejiga (Figura 6), aunque en caso de fístula calicial la situación puede ser variable. A diferencia del linfocele puede generar dolor y el diagnóstico definitivo viene dado por el análisis del líquido contenido en dicha colección.
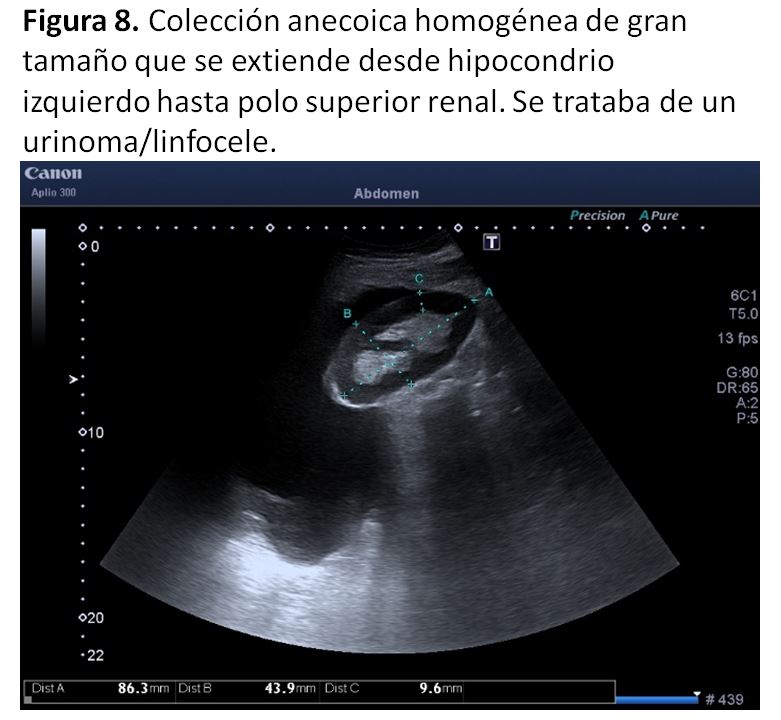
2. LinfoceleEs la colección peritrasplante más frecuente (2-20%) y generalmente aparece entre 4 y 8 semanas después de la cirugía [42]. Entre los factores de riesgo que lo favorecen se encuentran la obesidad y el empleo de inhibidores de M-TOR [43]. La presentación clínica más frecuente es asintomática, aunque puede ocasionar disfunción del injerto por compresión del uréter o edema de miembros inferiores y/o genitales. Ecográficamente es indistinguible de un urinoma: una colección anecoica, de contorno bien definido y localización variable que puede contener septos finos (Figura 7) (Figura 8).
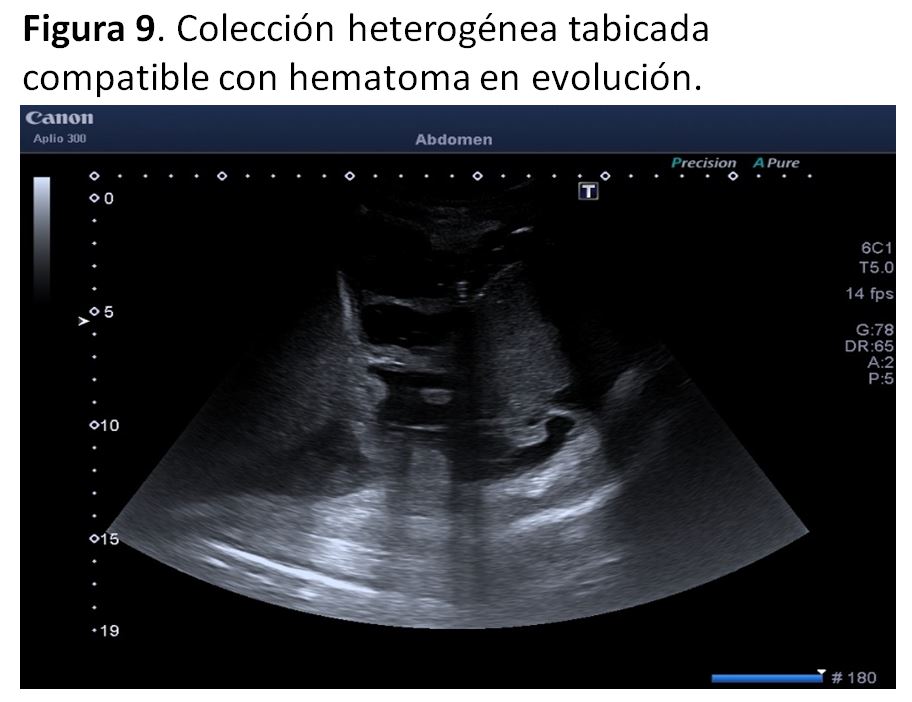
3. Hematoma periinjertoLos hematomas suelen ser pequeñas colecciones localizadas de preferencia en subcutáneo o perirrenales, de pequeño tamaño, heterogéneas debido a su densidad cambiante con el transcurso de los días. Inicialmente se observa una colección isoecoica, licuándose con el tiempo, aunque en general mantienen ecos internos. Son frecuentes tras la cirugía y es importante el seguimiento ecográfico evolutivo para comprobar que no crecen en tamaño ni comprimen áreas relevantes. Los quirúrgicos sueles ser extracapsulares, mientras que los secundarios a biopsia renal pueden ser además subcapsulares. En el estudio Doppler carecen de señal salvo que exista sangrado activo (Figura 9).
4. Vía urinaria dilatada. HidronefrosisLa obstrucción precoz puede deberse a un problema técnico, un túnel submucoso estrecho, edema ureteral o coágulos en la vía o en la vejiga. Desde la inserción en el momento del trasplante de los catéteres doble J no suele darse de manera inmediata, evidenciándose tras la retirada de dicho catéter, ya sea por una estenosis del uréter distal o compresión externa (por ejemplo por ureterocele). En cualquier caso no debe olvidarse que inicialmente una leve ectasia puede considerarse normal debido a la poliuria, la denervación del uréter y el edema a nivel de la reinserción por lo que la imagen ecográfica debe valorarse con los datos clínicos de función e imagen ecográfica evolutiva [44].
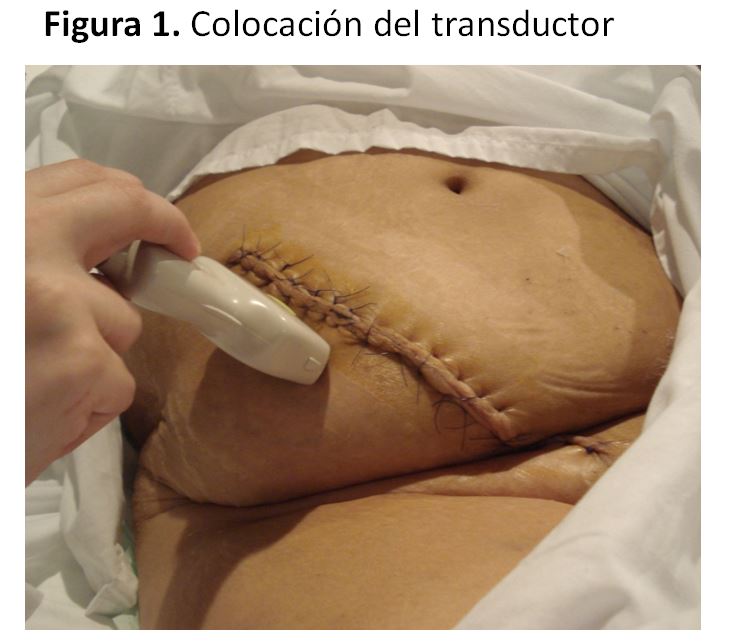
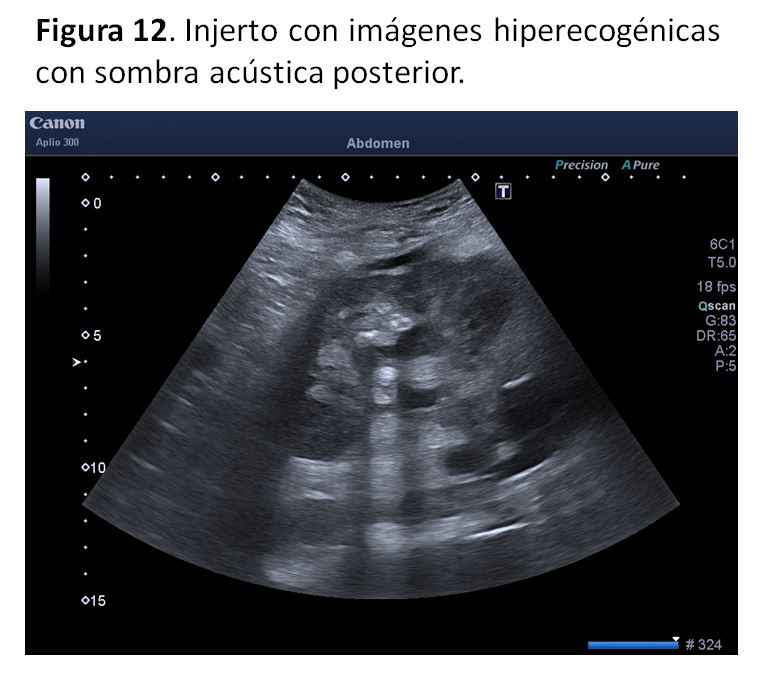
5. Litiasis:La incidencia de cálculos renales en el trasplante renal es baja, rondando el 0.2 - 1.7%, y pueden generarse tras el trasplante o transferirse con el órgano. La ecografía renal permite identificar las litiasis y calcificaciones fácilmente, igual que en riñón nativo: un área hiperecogénica que genera una sombra acústica posterior. Hay que recordar que no todas las imágenes calcificadas corresponden a litiasis y hay que valorar la presencia de catéteres doble J, ya que se pueden calcificar [45].
Otras complicaciones: Patología tumoral.La inmunosupresión incrementa el riesgo de neoplasias de novo en el paciente trasplantado y supone una de las principales causas de muerte. Aunque la mayoría de tumores afecta a la piel o al sistema linfático, también se han descrito carcinomas renales y los tumores transicionales de la vía excretora con una frecuencia de 10-100 y 3 veces mayor a la población general respectivamente [46]. La imagen ecográfica es variable dependiendo del tumor y debe sospecharse ante la presencia de hematuria u obstrucción tardía del injerto.
Las guías clínicas de la European Association of Urology recomiendan la realización de ecografía anual en pacientes trasplantados ante el incremento de neoplasias del injerto [47].