El término ultrasonidos significa vibraciones de un medio material, similares a las ondas sonoras audibles, pero cuya frecuencia es demasiado elevada para su percepción por el oído humano medio. La frecuencia utilizada actualmente para la obtención de imágenes ecocardiográficas está en el rango de 1 a 10 millones de ciclos por segundo (MHz). En el caso de los estudios Doppler, el rango viene a ser el mismo. Para la generación de los ultrasonidos, que servirán para la obtención de imágenes ecocardiográficas o para la exploración Doppler, se utilizan cristales piezoeléctricos a los que se someterá a un campo eléctrico que, deformando las caras de cristal, generarán ondas ultrasónicas. A su vez, al verse sometidos a una onda de presión, estos cristales piezoeléctricos generarán entre sus caras un campo eléctrico que se utilizará para detectar la recepción de una onda ultrasónica.
A esta transformación de energía mecánica en eléctrica se la llama transducción y a los elementos piezoeléctricos, transductores. La ecocardiografía Doppler es una técnica básica de diagnóstico en cardiología que utiliza como método físico de exploración la emisión de ultrasonidos dirigida hacia el corazón, los cuales se reflejan en las estructuras cardiacas produciendo ecos de retorno, de cuyo análisis se puede obtener información fisiopatológica, tanto de las características anatómicas de las válvulas como de los flujos cardiacos. Durante los últimos cuarenta años, se ha producido un espectacular desarrollo de la técnica, existiendo diversas modalidades de estudio: ecocardiografía en modo M, ecocardiografía bidimensional y Doppler cardiaco [1] [2] [3] [4].
ECOCARDIOGRAFÍA CON TÉCNICA EN MODO MEs la primera modalidad de estudio introducida a finales de la década de los sesenta, y ha sido superada por la ecocardiografía bidimensional y el Doppler, pero es un procedimiento que puede proporcionar información adicional, en ocasiones única. Básicamente, consiste en la emisión de un haz de ultrasonidos único que atraviesa las distintas estructuras cardiacas, las cuales generan ecos reflejados, cuyo movimiento en el espacio se registra en papel o en pantalla de manera continua, obteniendo las características de movilidad de las diferentes zonas del corazón atravesadas por el haz de ultrasonidos.
Para el registro de la ecocardiografía en modo M, el transductor de ultrasonidos se sitúa en la pared torácica sobre el tercero, cuarto o quinto espacio intercostal. El cambio de incidencia del haz permite registrar las diferentes estructuras cardiacas cuyas características ecocardiográficas normales se detallan a continuación.
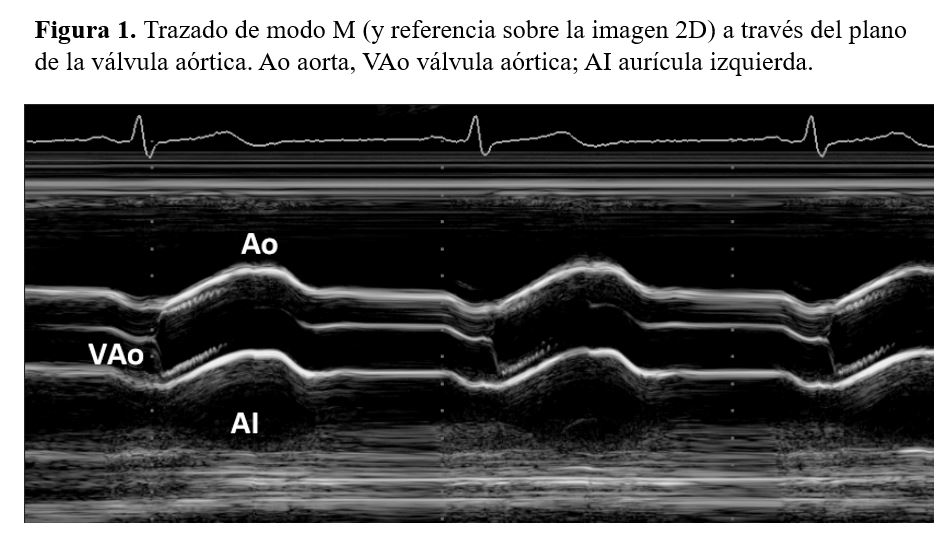
- Raíz aórtica. Se visualiza como una estructura formada por un eco anterior que corresponde a la pared anterior aórtica, y un eco posterior que corresponde a la pared posterior; entre estas dos estructuras se registra el movimiento de los velos sigmoideos aórticos. Durante la diástole el eco permanece situado en medio de la luz del vaso; durante la sístole se registra el movimiento de apertura de los velos sigmoideos aórticos. Por detrás de la raíz aórtica se localiza la cavidad auricular izquierda, y por delante el ventrículo derecho (Figura 1).
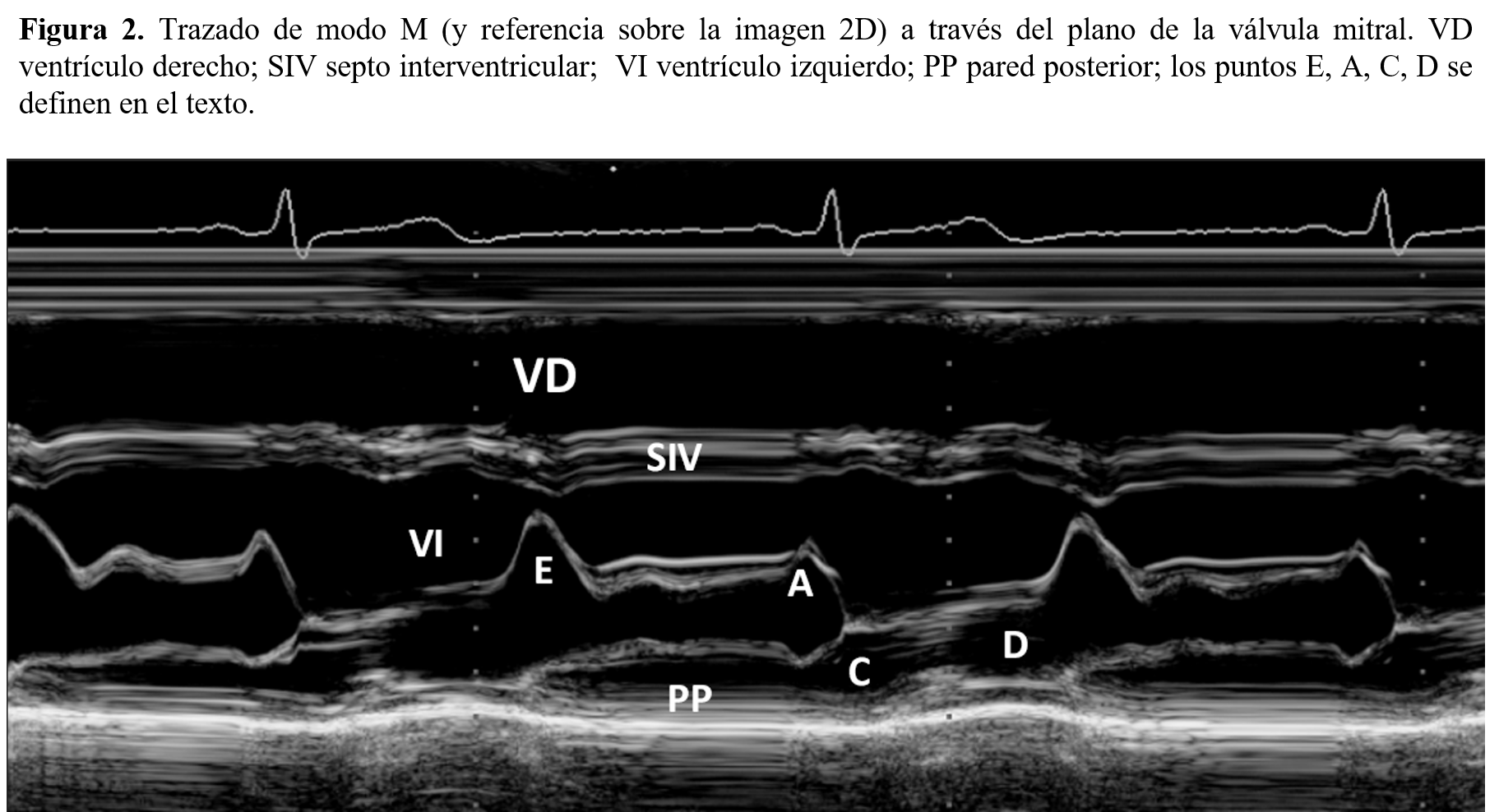
- Válvula mitral. El velo anterior mitral se caracteriza por presentar, en protodiástole, un rápido movimiento de apertura (punto E), para luego iniciar un cierre mesodiastólico; la contracción auricular producirá una reapertura de la válvula (punto A), tras la cual aparece el cierre por la oposición de los velos anterior y posterior. El velo posterior presenta durante la diástole un movimiento especular opuesto al del velo anterior, que desaparece en caso de afectación reumática mitral (Figura 2).
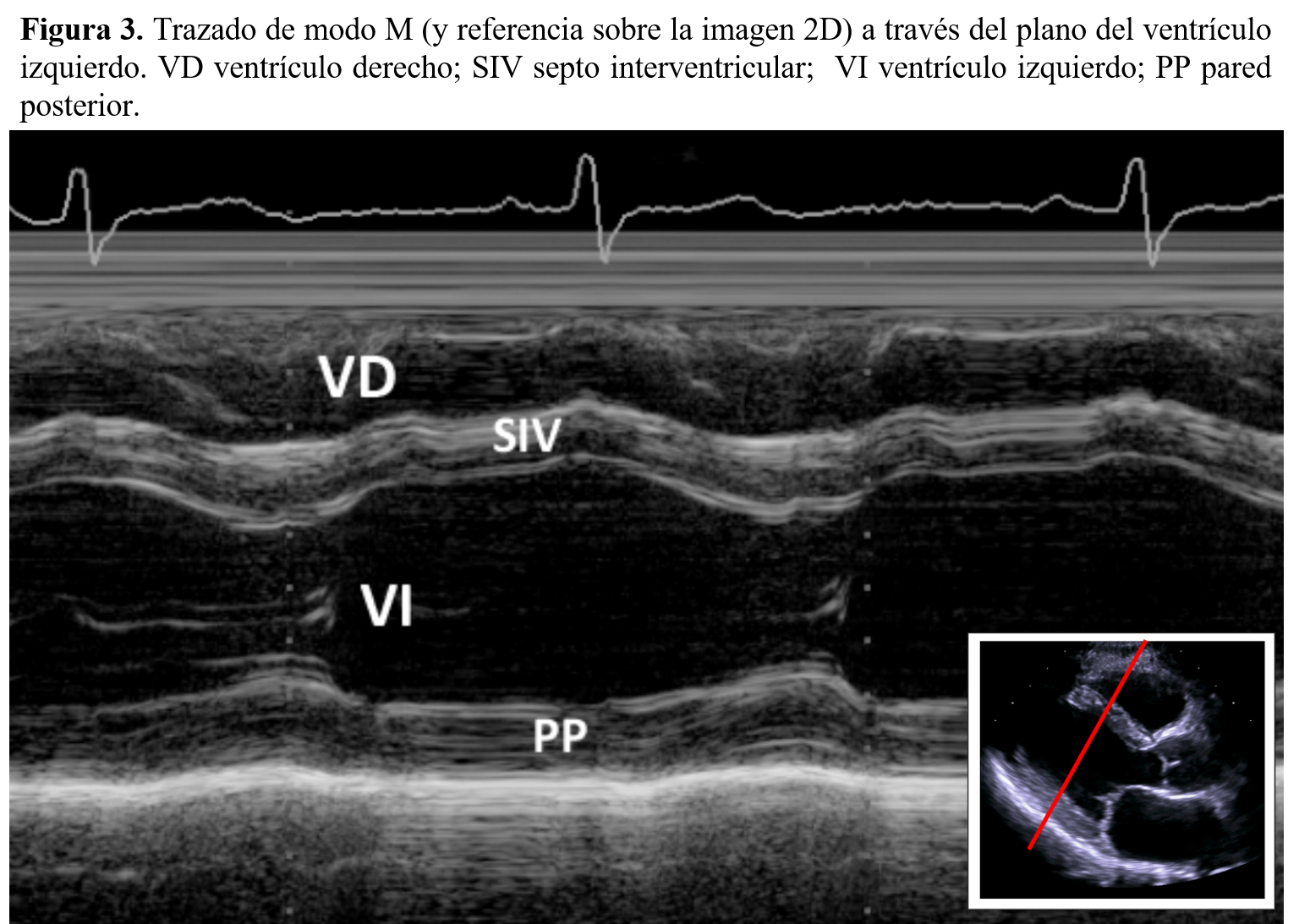
- Ventrículo izquierdo. La cavidad ventricular aparece entre el tabique interventricular y la pared posterior del ventrículo izquierdo. Durante la sístole, se registra el engrosamiento del miocardio septal y de la pared posterior del ventrículo izquierdo, con disminución del diámetro ventricular (diámetro sistólico). Durante el llenado ventricular se produce un aumento progresivo del tamaño ventricular hasta alcanzar el diámetro diastólico. A partir de estas dos mediciones pueden inferirse patrones básicos de la dinámica cardiaca, como son los volúmenes telediastólico y telesistólico, la fracción de eyección y la fracción de acortamiento (Figura 3).
ECOCARDIOGRAFÍA BIDIMENSIONALAl contrario que el modo M, el análisis se realiza no con un solo cristal, sino con sondas que utilizan numerosos cristales alineados que permiten obtener grandes sectores de corte del corazón, con lo que se consigue una integración espacial de las estructuras cardiacas (Habitualmente se utilizan sondas con frecuencias que varían de 2 a 10 MHz).
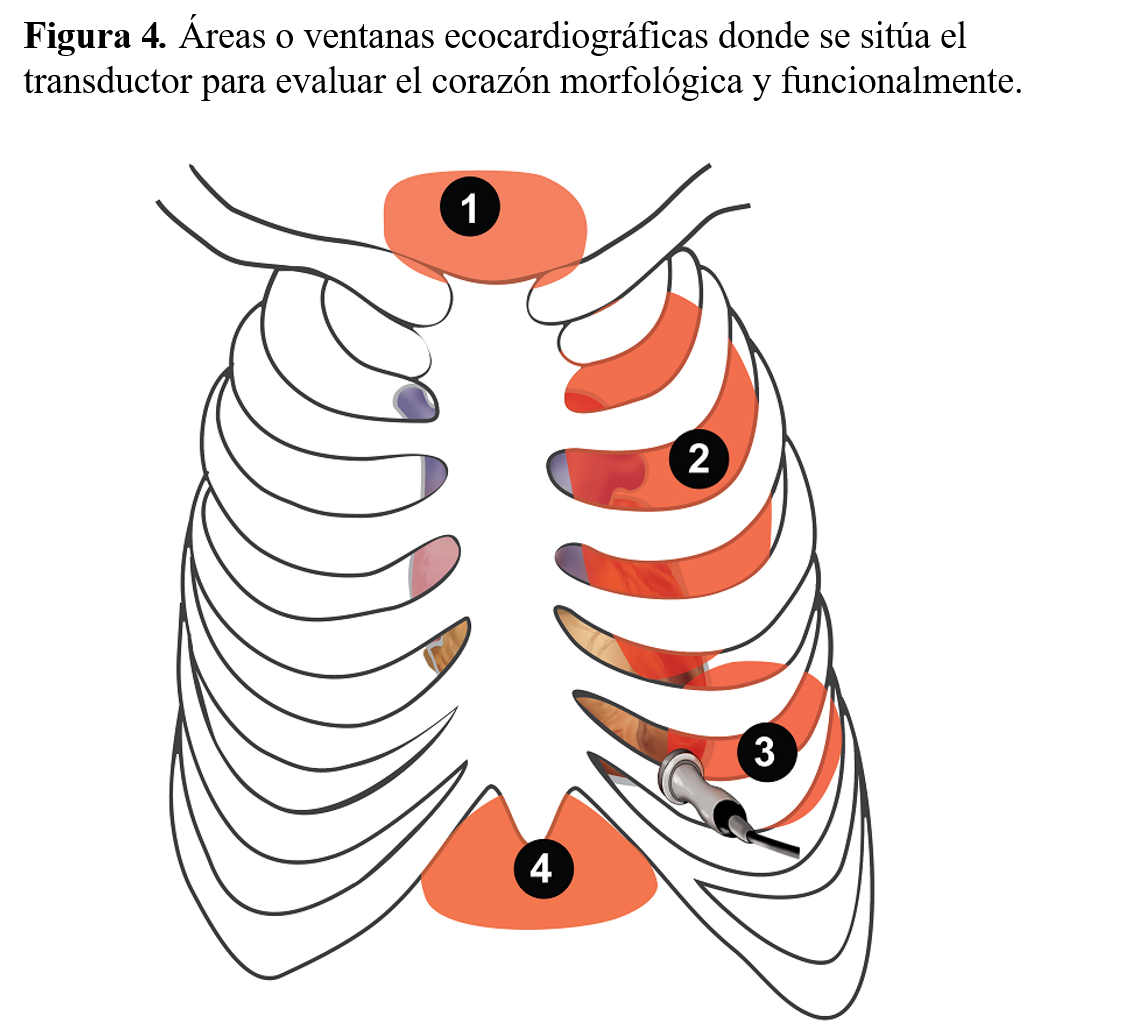
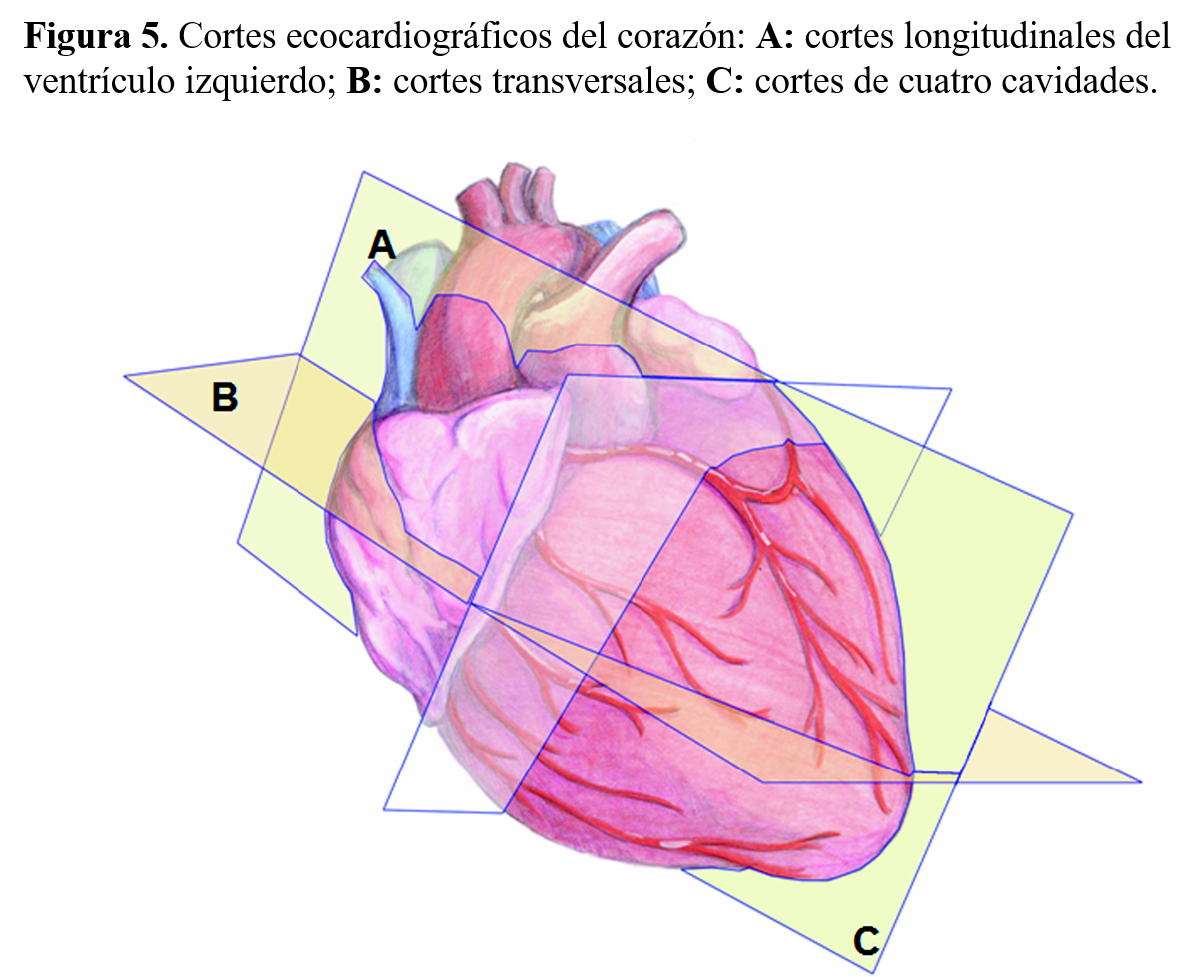
La exploración estándar con ecocardiografía bidimensional se realiza situando el transductor sobre cuatro áreas básicas de estudio: paraesternal, apical, subcostal y supraesternal (Figura 4). Desde cada una de estas áreas de análisis, las modificaciones en la angulación del transductor permiten obtener múltiples secciones tomográficas del corazón que, en líneas generales, se agrupan en tres tipos de cortes: longitudinales, horizontales y transversales (Figura 5).
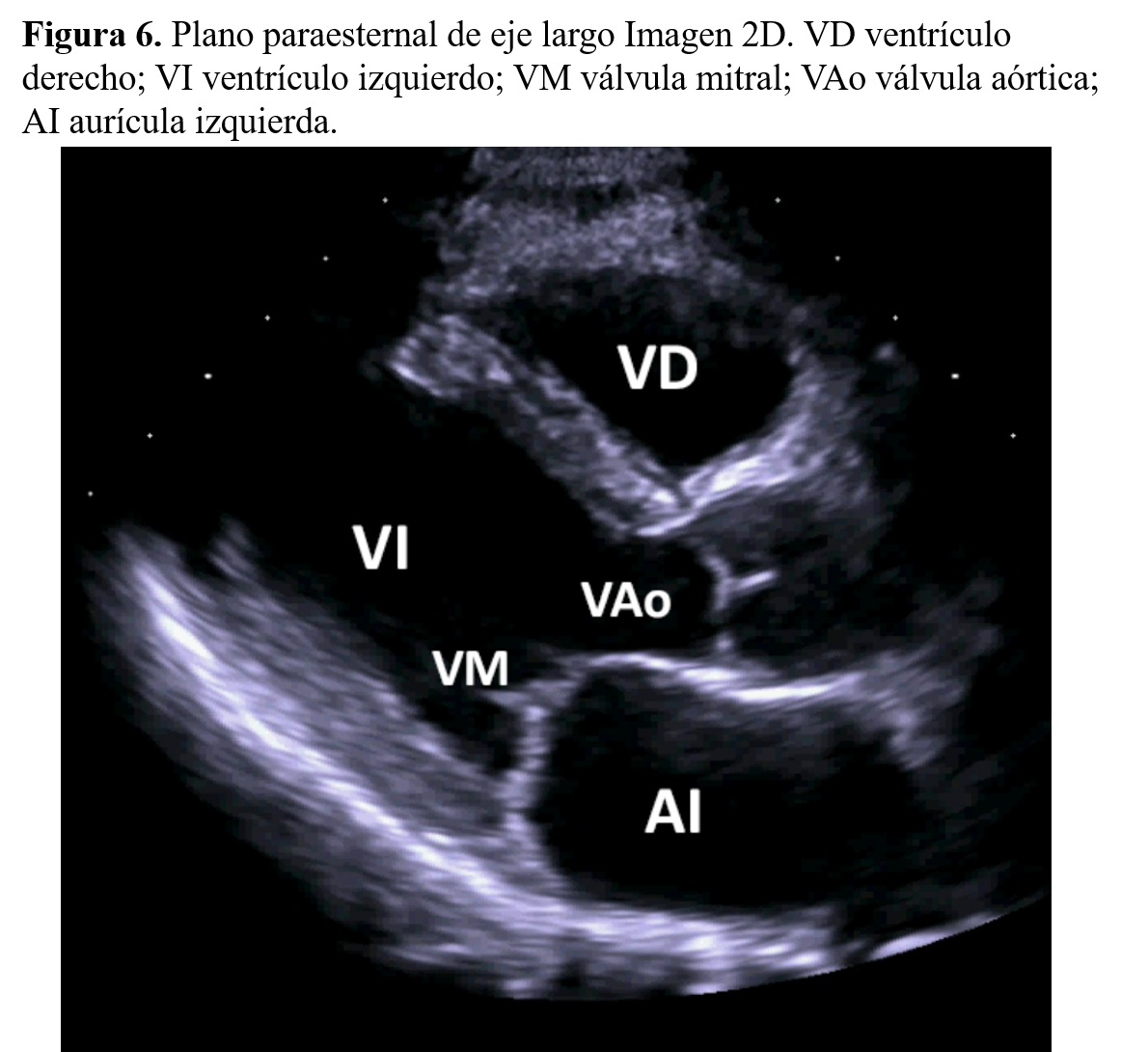
Cortes longitudinalesEl corte longitudinal del ventrículo izquierdo secciona el corazón desde la aorta hasta el vértice cardiaco, siguiendo el diámetro mayor. En él, se registran la raíz aórtica y las válvulas sigmoideas aórticas, así como la continuidad anatómica de la pared anterior aórtica, con el tabique interventricular, y de la pared posterior aórtica con el velo anterior mitral (Figura 6).
Asimismo, se detecta gran parte de la cavidad ventricular izquierda enmarcada por el movimiento del tabique interventricular y la pared posterior del ventrículo izquierdo. De igual forma, pueden realizarse cortes longitudinales de las cavidades derechas.
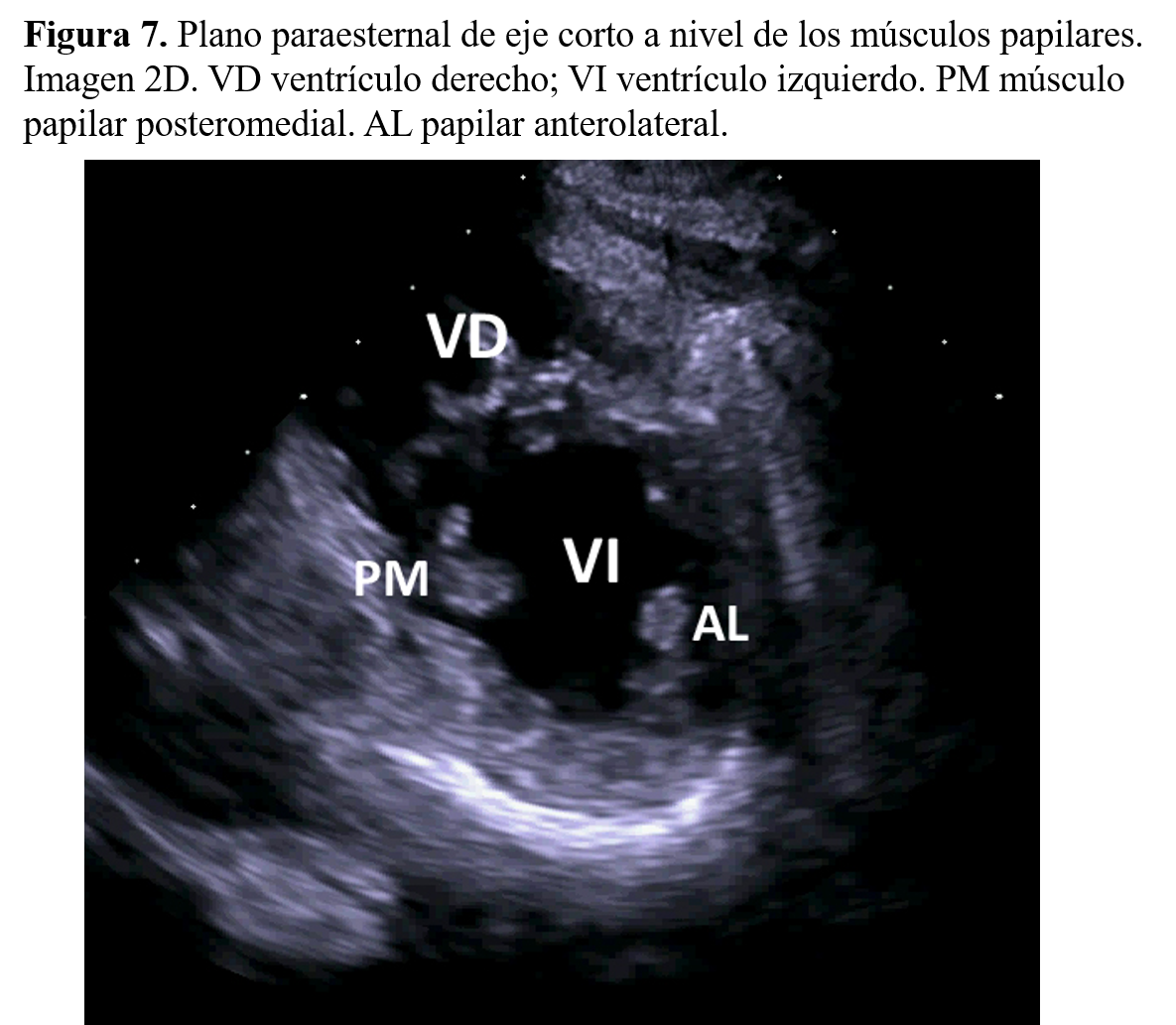
Cortes transversalesLos cortes transversales siguen una dirección perpendicular al eje mayor del ventrículo izquierdo. El corte efectuado sobre el ventrículo izquierdo registrará la forma circular del miocardio ventricular y sus variaciones en las contracciones sistólica y diastólica. El análisis de los planos transversales permite realizar una evaluación correcta de todos los segmentos ventriculares. Una incidencia discretamente superior muestra el movimiento de apertura de la válvula mitral con su área máxima, que se enmarca entre los límites de los velos anterior y posterior mitrales. Un corte dirigido más superiormente registrará, en una posición central, la imagen de la aorta con sus válvulas sigmoideas y los tres senos valvulares sigmoideos aórticos. A la izquierda de la imagen, se detectan la aurícula derecha, la válvula tricúspide y la cámara de entrada y de salida del ventrículo derecho, que rodea la raíz aórtica para dar paso al tronco pulmonar y la válvula pulmonar (Figura 7).
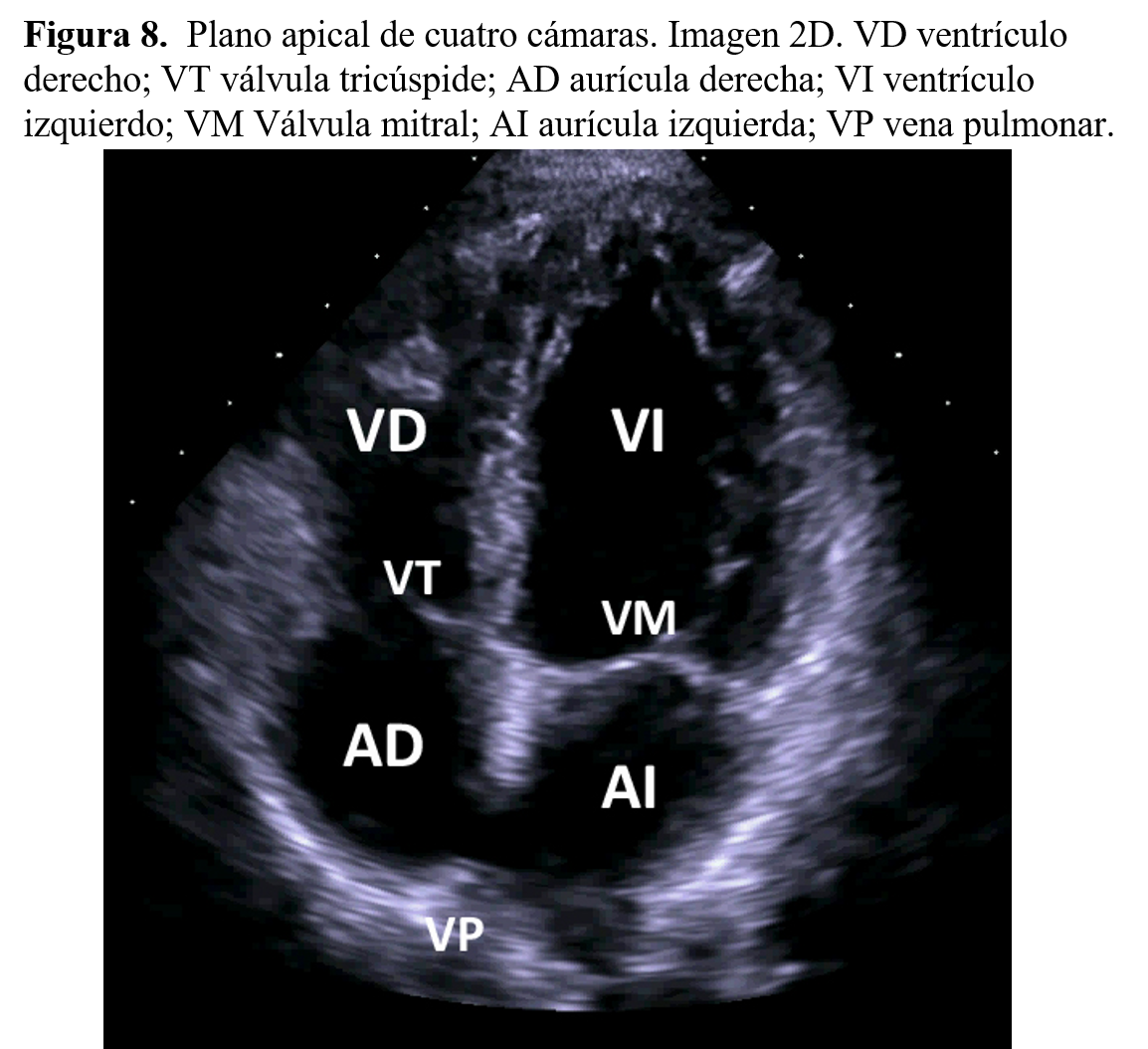
Cortes apicalesSe obtienen situando el transductor en el ápex cardiaco y permiten obtener una información conjunta de las cuatro cámaras cardiacas. En la situación más anterior de la imagen se localizan las cavidades ventriculares izquierda y derecha y, en situación más posterior, las cavidades auriculares derecha e izquierda. Separa ambas cavidades el movimiento típico de las válvulas mitral y tricúspide (Figura 8).
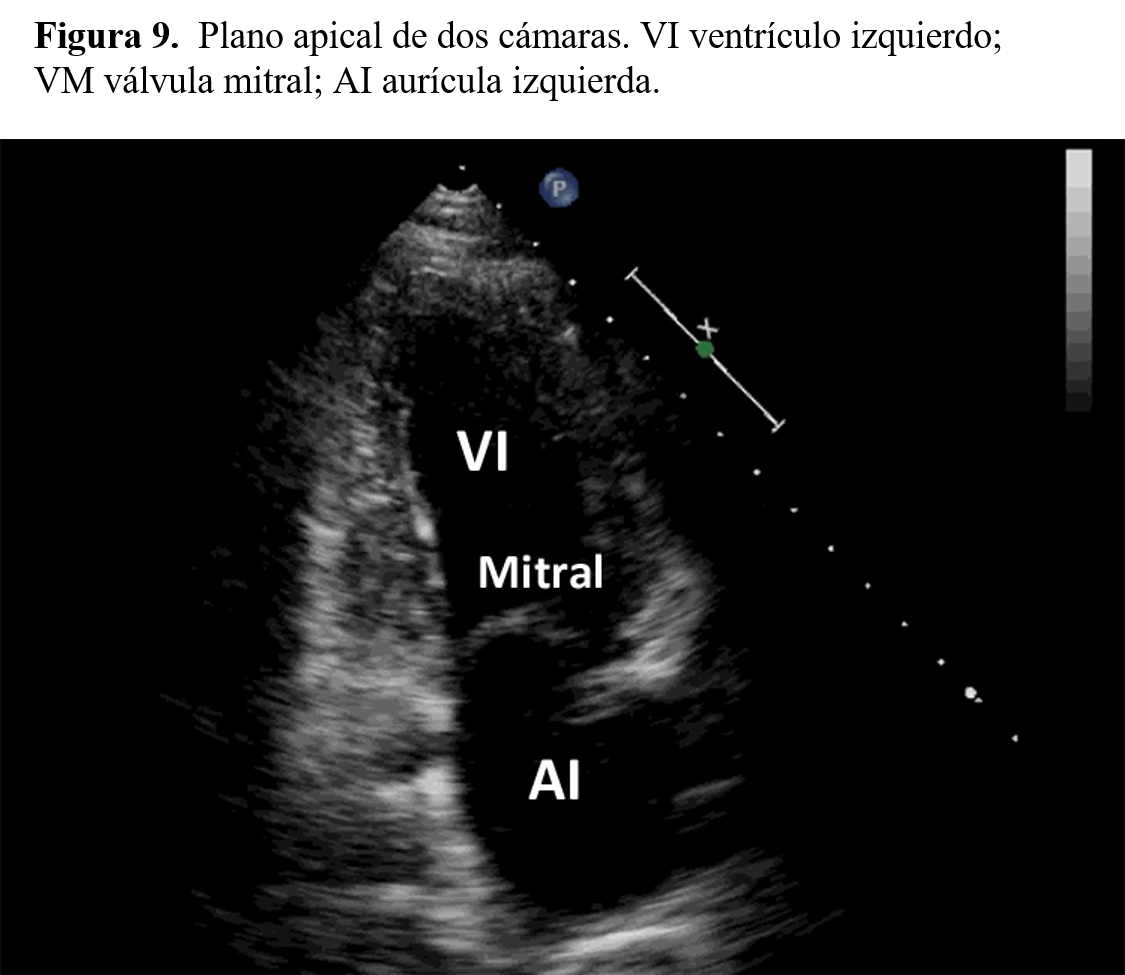
El plano de cuatro cavidades permite analizar de forma adecuada los tabiques interauricular e interventricular, que separan las cavidades auriculares y ventriculares. Rotando 90º el transductor desde la posición anterior se registrará el plano de dos cámaras, donde aparecerán las paredes anterior y posterior del ventrículo izquierdo.
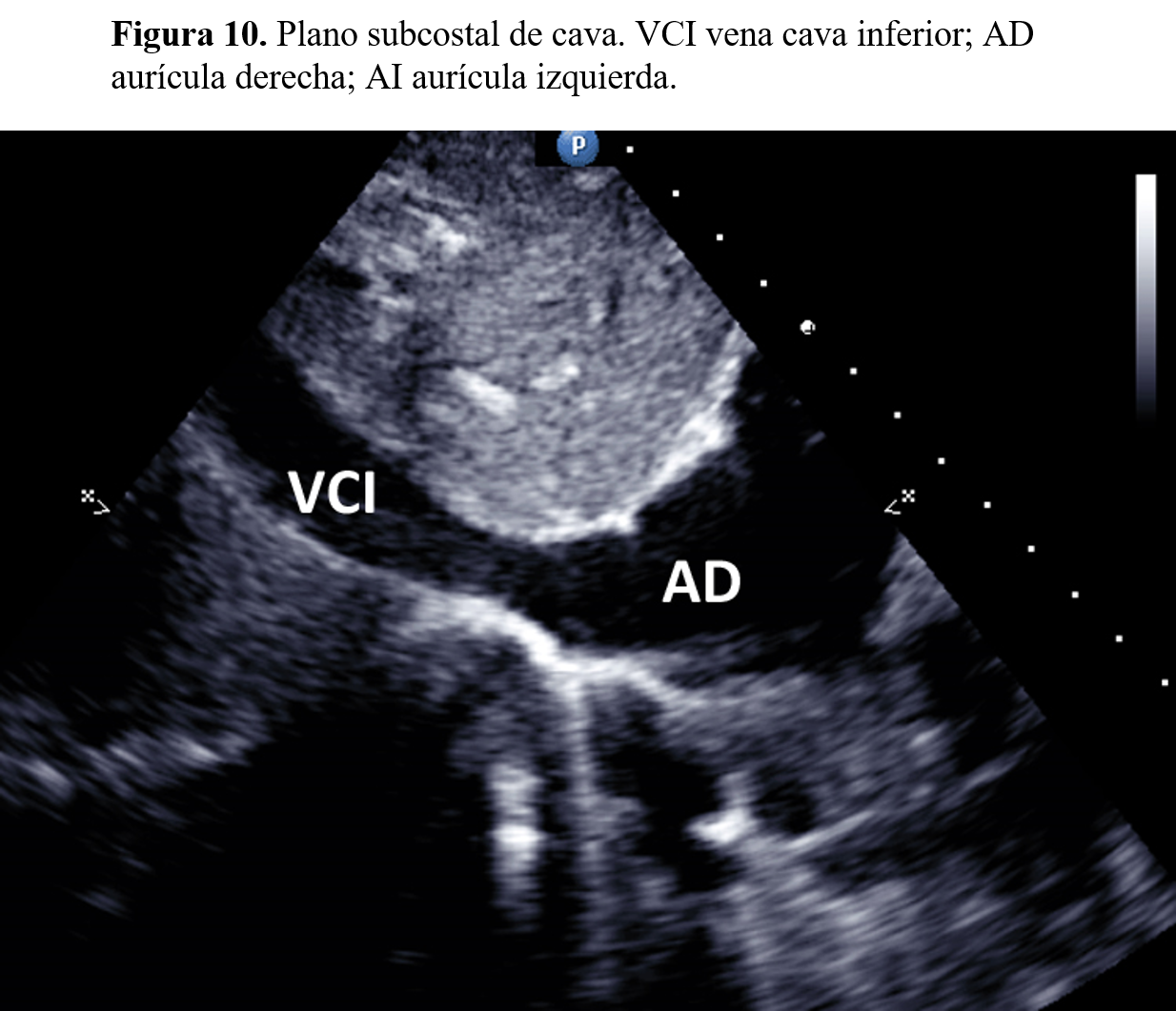
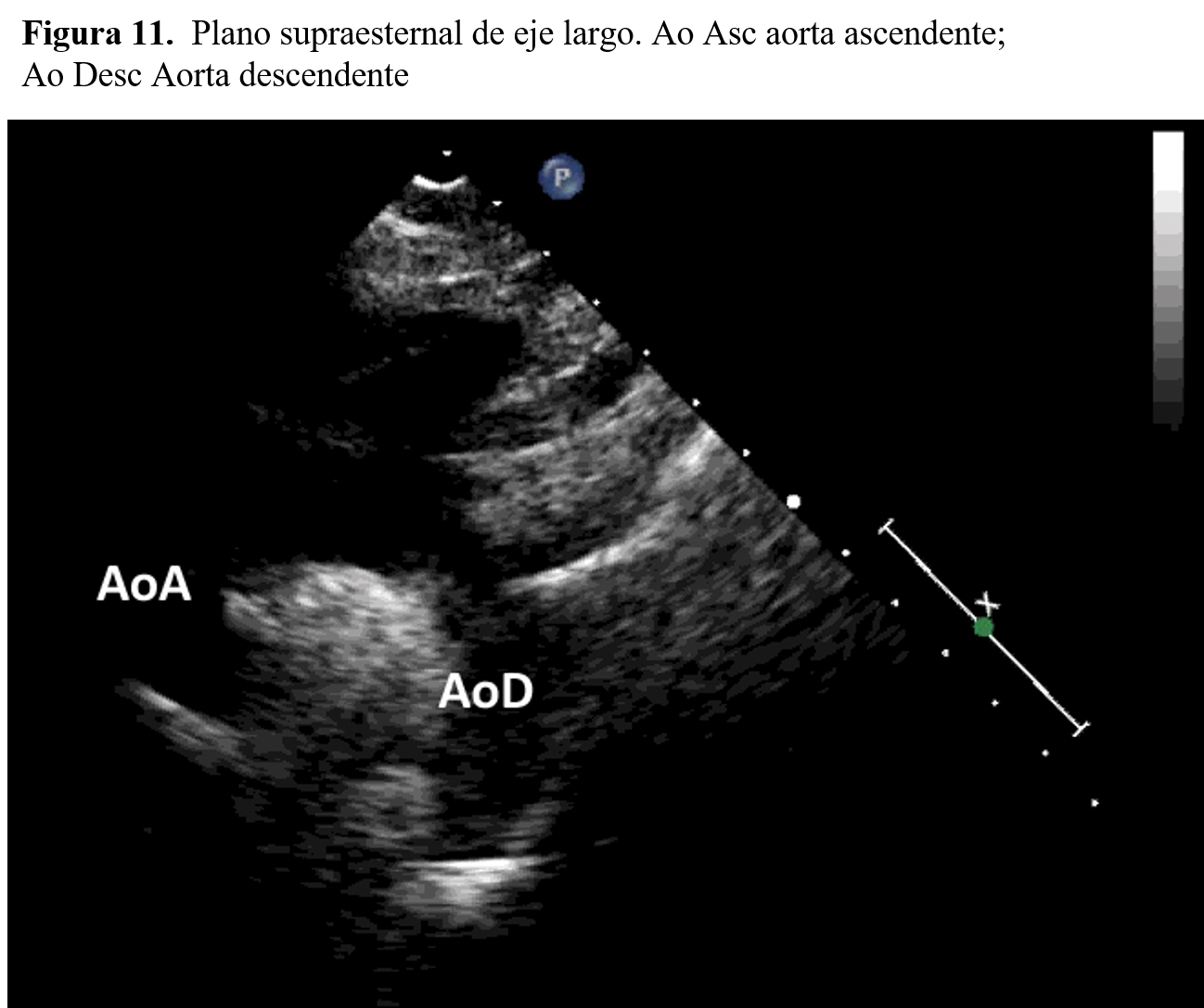
Cortes subcostalesSituando el transductor en el área subcostal se obtiene otra familia de planos, entre los que destacan el de cuatro cámaras subcostal, muy útil para descartar la entrada de la cava en la aurícula derecha (Figura 10). Igualmente, el estudio del área supraesternal permitirá analizar las características del cayado aórtico (Figura 11).
TÉCNICAS DE ESTUDIO DOPPLERJohann Christian Doppler enunció el efecto que lleva su nombre para describir el cambio de frecuencia que se produce en la recepción de las ondas emitidas por una fuente generadora de sonido, cuando el objeto productor de dichas ondas y el receptor de las mismas se mueven uno con respecto al otro. Los ejemplos de este fenómeno se reproducen numerosas veces en la vida diaria, siendo el más típico el cambio de tonalidad en el silbato del tren, que se escucha con tono agudo cuando se acerca al punto del observador y con tono grave cuando se aleja del mismo. Cuando se emiten ultrasonidos con un transductor ultrasónico hacia el torrente sanguíneo, los eritrocitos actuarán como elementos reflectores del ultrasonido. Las variaciones encontradas en la frecuencia con la que emitió el transductor (FE), con respecto a la frecuencia con que el hematíe reflejó el sonido (FR), vienen relacionadas por la ecuación Doppler:
V = (FE-FR) x K /2FE x cos ø
En donde V es la velocidad de los hematíes en un instante determinado en cm/seg; FE es la frecuencia de emisión del transductor de ultrasonidos, habitualmente entre 2 y 5 MHz; FR es la frecuencia de recepción del sonido en Hz; K es la velocidad del ultrasonido en la sangre (1,54 x 105 cm/seg); y cos Ø es el coseno del ángulo formado por el haz de sonido y la dirección del flujo. El parámetro de velocidad sanguínea se va a ver alterado fundamentalmente en las obstrucciones valvulares y es la base del desarrollo teórico del Doppler cuantitativo. Holen y Hatle utilizaron el teorema de Bernoulli simplificado:
P1 - P2 = 4V2
Mediante el cual, con el único conocimiento de la velocidad del flujo a través de una obstrucción (V), se puede conocer el gradiente transvalvular (P1 - P2).
De la ecuación Doppler se puede deducir, además, un parámetro elemental como es la dirección de la velocidad que en un momento determinado lleva el hematíe. Si la FE del sonido es superior a la FR, se deduce que el hematíe se aleja del transductor y, por convención, este cambio de frecuencia se expresará, en el análisis del espectro de frecuencias Doppler, como una deflexión negativa. Si, por el contrario, la FE es inferior a la FR, será porque el hematíe se acerca al transductor y, por convención, al cambio de frecuencia Doppler, o lo que es igual de velocidad, se indicará como una deflexión positiva.
El conocer la dirección del flujo sanguíneo es básico para determinar sus distintos patrones normales, así como para detectar direcciones anormales halladas en presencia de regurgitaciones y cortocircuitos. Básicamente, existen tres modalidades de estudio Doppler de los flujos intracardiacos: pulsado, continuo y color.
Doppler pulsado. El análisis del Doppler pulsado permite estudiar las características del flujo sanguíneo selectivamente en un punto determinado de las cámaras cardiacas. El principal inconveniente es que no pueden registrarse altas velocidades sanguíneas, y si se recuerda que las velocidades de flujo son sinónimo de gradiente de flujo, se comprende que el método no sea útil para valorar altos gradientes de presión como los que suelen encontrarse en las estenosis valvulares.
Doppler continuo. Con esta modalidad, se emite hacia el corazón un haz de ultrasonidos que irá recogiendo la suma de las velocidades que encuentre a su paso. No es por lo tanto selectivo en un punto, pero permite analizar el registro de altas velocidades, al contrario que con Doppler pulsado. Es el método ideal para analizar altas velocidades que indican la presencia de altos gradientes de presión.
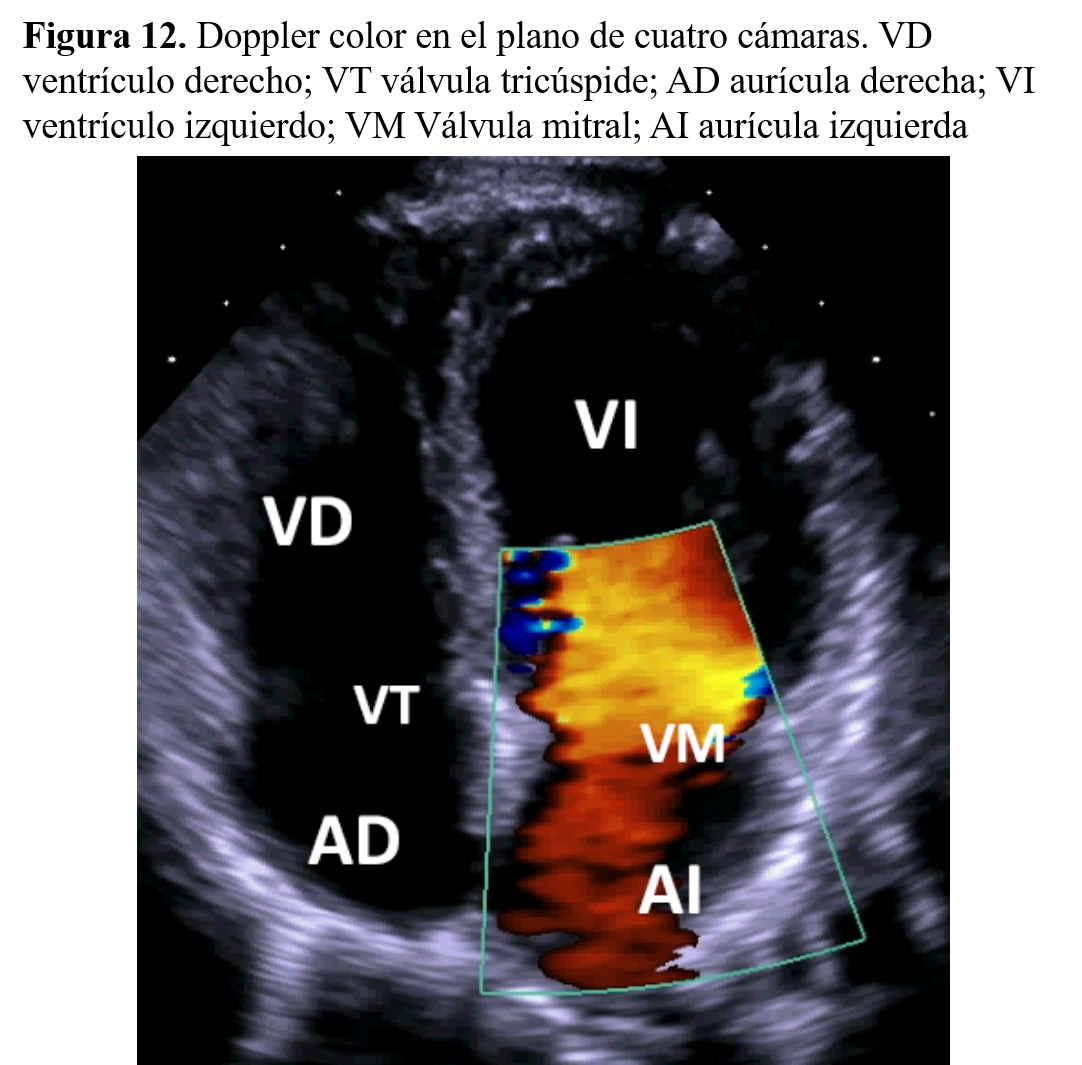
Doppler color. Con este estudio se analizan simultáneamente cientos de muestras del flujo de las cámaras cardiacas, lo que ayuda a efectuar una reconstrucción bidimensional instantánea de la distribución, la relación y las velocidades del flujo en todas las cámaras cardiacas (Figura 12).
Patrones normales de los flujos cardiacosAnalizamos los flujos de interés para el nefrólogo
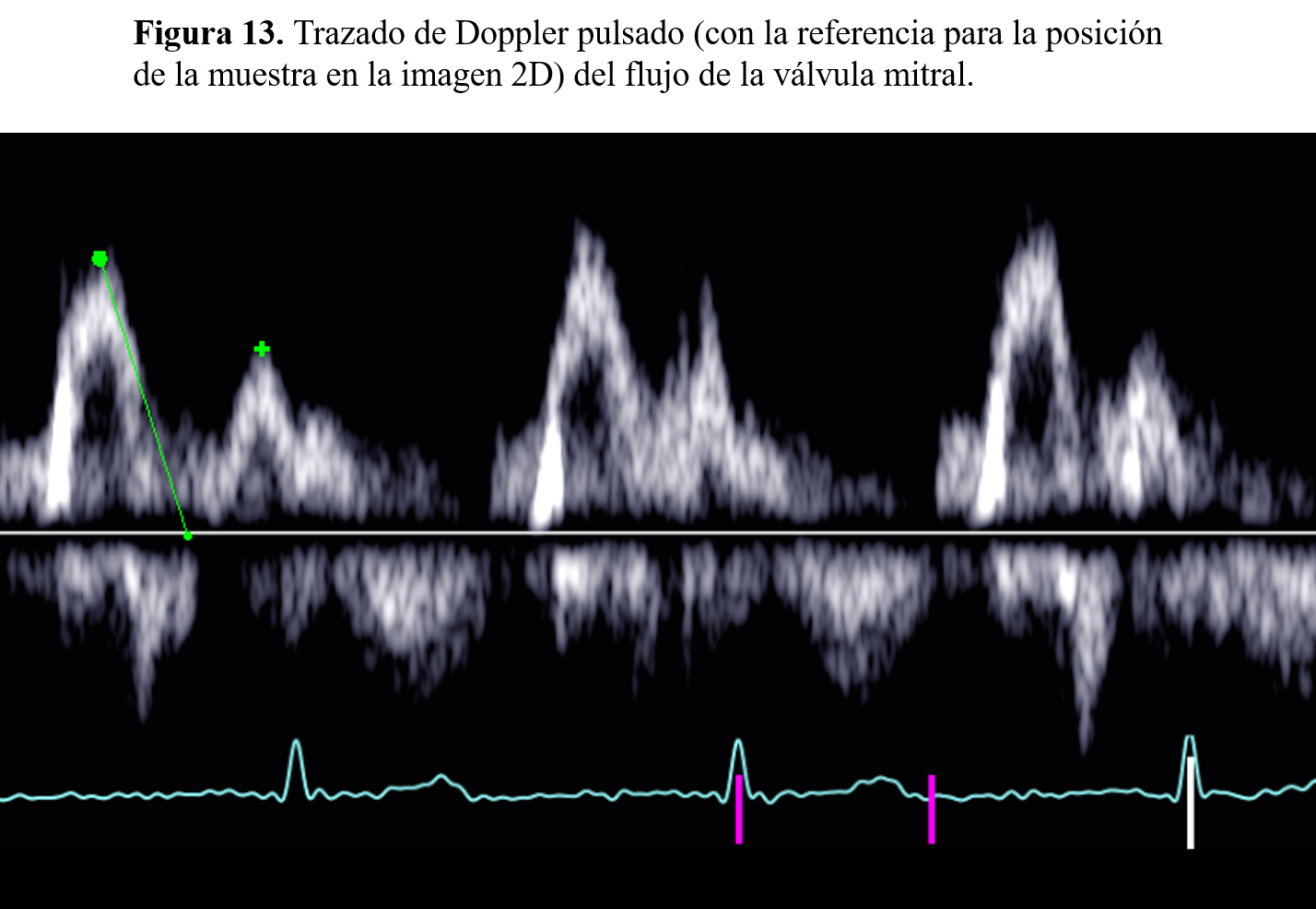
Flujo mitral. El patrón Doppler característico del flujo aurículoventricular izquierdo se asemeja a la morfología del registro en modo M de la válvula mitral. Existe un pico inicial de llenado rápido pasivo, seguido de otro segundo más pequeño, telediastólico, y que es consecuencia directa de la contracción auricular, desapareciendo en la fibrilación auricular y siendo especialmente prominente en los casos en que está disminuida la distensibilidad del ventrículo izquierdo (Figura 13).
Flujo tricuspídeo. Las características morfológicas del flujo aurículoventricular son similares a las del flujo mitral, con un primer pico que corresponde al llenado rápido y otro segundo, de menor velocidad, producido por la contracción de la aurícula. Las velocidades registradas en condiciones normales serán menores que las obtenidas en el flujo de la válvula mitral, debido al régimen de presiones inferior con el que trabajan las cavidades derechas.
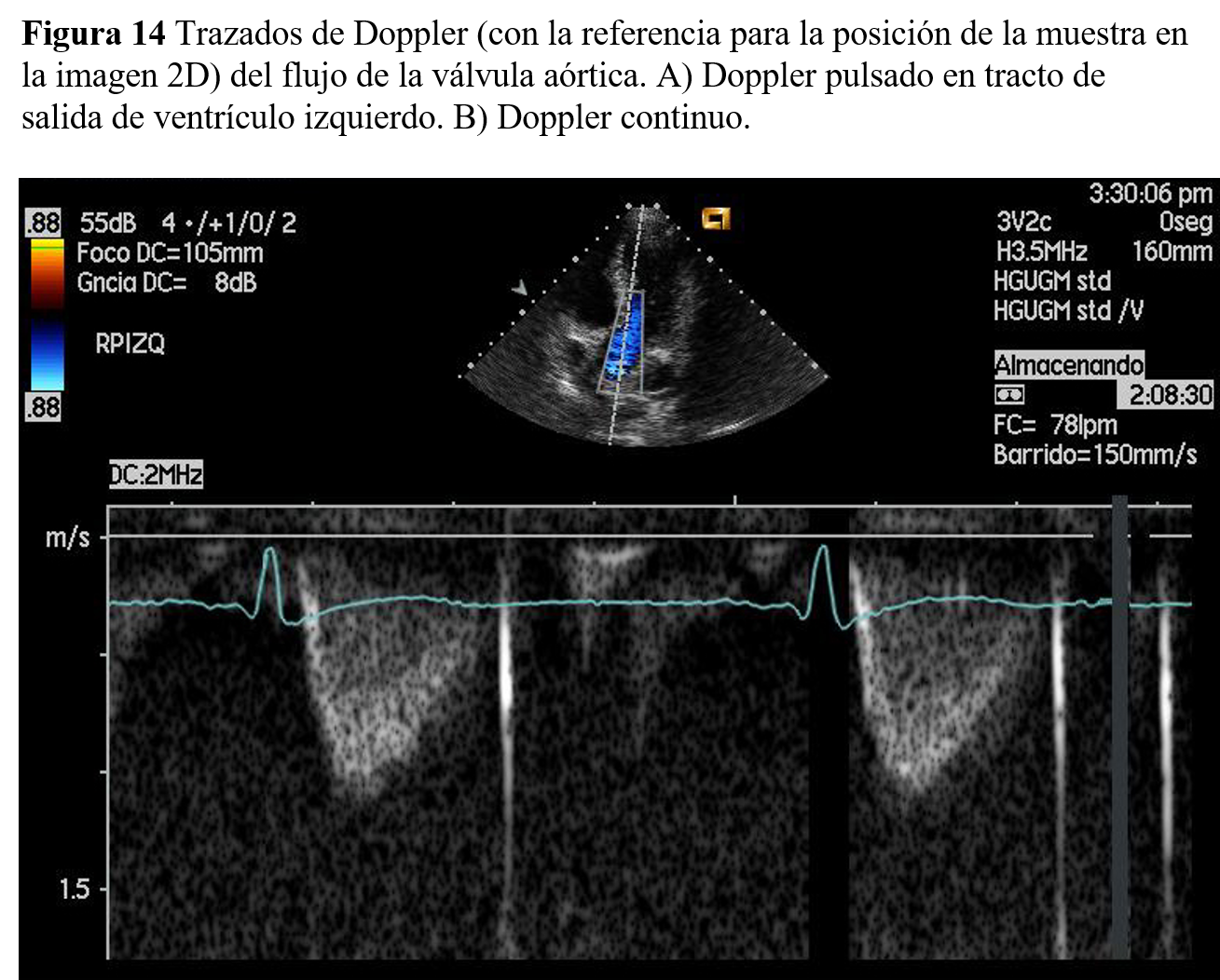
Flujo de aorta. El flujo aórtico se caracteriza, cuando se analiza desde la vía apical, por presentar una deflexión negativa de rápido descenso, correspondiente al flujo que se aleja del transductor. En la parte ascendente de la curva, correspondiente a la deceleración, existe un ensanchamiento del espectro provocado por una mayor dispersión de velocidades (Figura 14).
MEDICIONES BÁSICAS EN ECOCARDIOGRAFÍA PARA EL NEFRÓLOGOLa medición del tamaño de las cámaras cardíacas es una de las tareas más importantes a realizar en el ecocardiograma ya que la mayor parte de los diagnósticos que aparecen en el informe final (y que luego van a influenciar el manejo de los pacientes) nace en realidad de la interpretación de las medidas que se han realizado a lo largo del estudio. Por tanto, uno de los factores más importantes que va a definir la calidad final del estudio es la atención y la minuciosidad que el ecocardiografista pone en hacer unas medidas correctas.
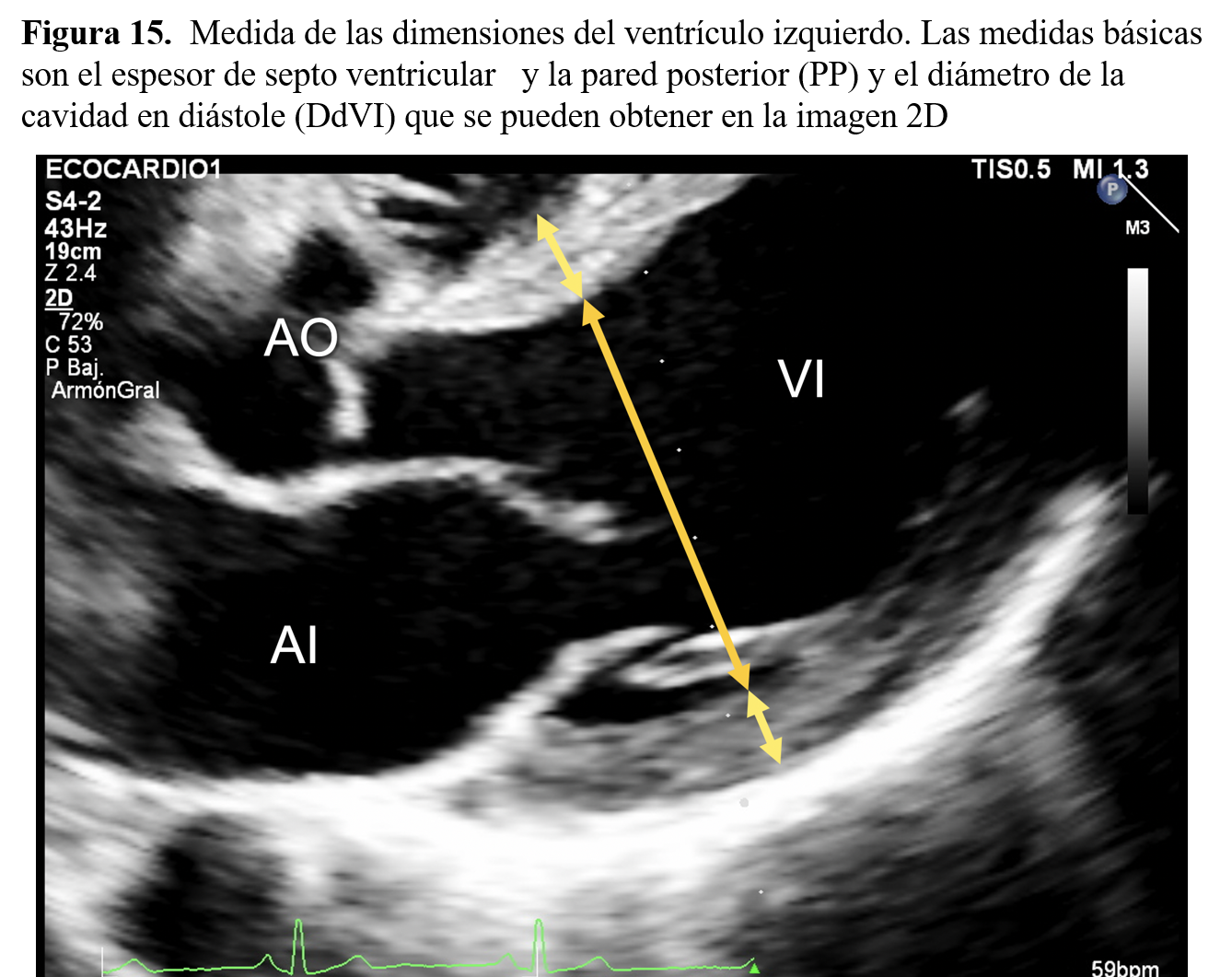
Medida del ventrículo izquierdoLas medidas básicas de ventrículo izquierdo son el espesor del septo interventricular (SIV) y el de la pared posterior (PP) y el diámetro de la cavidad en diástole (DdVI) y en sístole (DsVI) . Se recomienda utilizar la ventana paraesternal de eje largo, ya que es con la que se tiene mayor experiencia en la literatura (Figura 15).
El modo M es el preferido en muchos laboratorios debido a su alta resolución espacial. Las mediciones deben realizarse sobre el eje menor del ventrículo izquierdo a nivel de la punta de los velos de la válvula mitral. El punto en concreto para hacer las medidas de SIV, PP y DdVI en el trazado es justo al inicio del complejo QRS del ECG, o de forma más sencilla, en el momento en el que el septo y la pared lateral están más separadas, mientras que el DsVI se mide en el momento en el que las paredes del ventrículo izquierdo están más próximas. La principal limitación de las medidas con modo M es que en una proporción importante de los pacientes es muy difícil o imposible conseguir una orientación perpendicular correcta incluso con la ayuda de la imagen 2D. Toda orientación oblicua se asocia a sobreestimación de las medidas con lo que se pueden hacer falsos diagnósticos de dilatación o hipertrofia ventricular.
Existen diferentes métodos para calcular los volúmenes ventriculares. Todos ellos se basan en el hecho de que el ventrículo izquierdo tiene una forma regular que puede ser trabajada utilizando algún tipo de modelo matemático.
Los modelos lineales, como los propuestos por Teichholz o Quiñones, utilizan las medidas ecocardiográficas básicas para calcular los volúmenes. Estos sistemas tienen la ventaja de que son muy rápidos y sencillos, ya que el equipo hace los cálculos automáticamente mientras se están obteniendo las medidas. El inconveniente es que los resultados pueden ser imprecisos ya que dependen de que la forma real del ventrículo se ajuste al modelo matemático. Por esta razón, estos métodos no son los más recomendables cuando se necesita una valoración precisa o el ventrículo tiene una forma irregular.
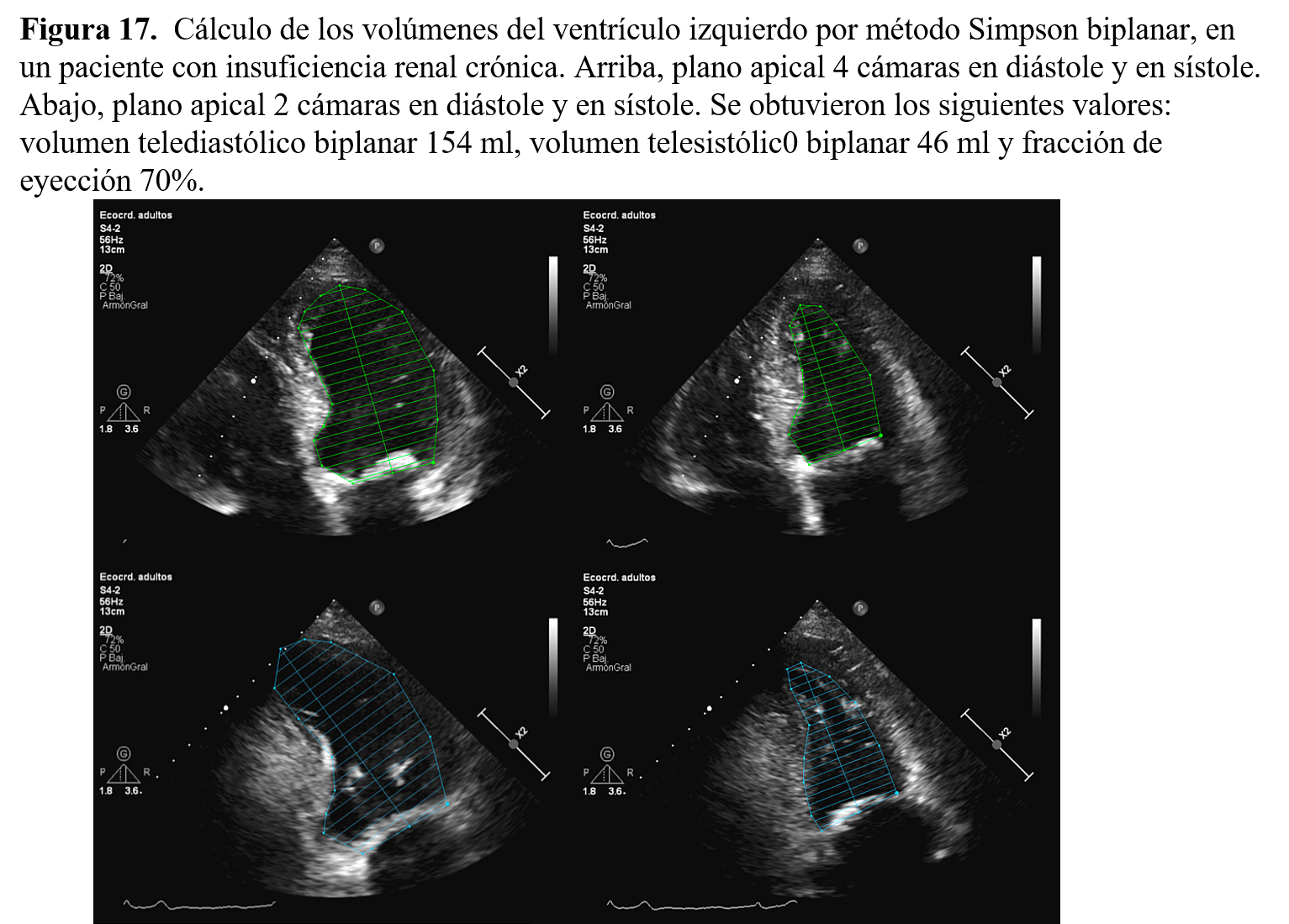
El método bidimensional más frecuentemente utilizado para hacer una medida de los volúmenes del ventrículo izquierdo es el método de Simpson modificado. Con este método el ventrículo se divide en una serie de discos cuyo volumen se calcula por separado y se suma para tener el volumen ventricular. Su uso en la práctica real es mucho más fácil de explicar, ya que únicamente hay que dibujar el endocardio ventricular desde el anillo mitral al ápex en las imágenes telesistólica y telediastólica y el equipo se encarga de hacer los cálculos. El método de Simpson se puede utilizar con una imagen en un único plano sabiendo que el equipo va a asumir que las dimensiones en el plano perpendicular son iguales; cuando existe alteraciones en la morfología o en la contracción segmentaria las medidas deben hacerse empleando el método de Simpson biplano El método de Simpson es el método que se debe utilizar cuando se necesita una medida precisa del volumen ventricular o cuando el ventrículo tiene patología evidente, como dilatación, deformaciones o alteraciones de la contracción segmentaria.
La masa ventricular izquierda habitualmente se calcula a partir de las medidas básicas del ventrículo izquierdo utilizando un modelo matemático que ha sido validado en múltiples estudios frente a datos de autopsia. Este modelo se basa en la fórmula:
Masa de VI (gr) = 0.8 x [1.04 (SIV+PP+DdVI)3 - DdVI3] + 0.6
Afortunadamente, en la práctica clínica real no hay que trabajar con esta fórmula tan compleja, ya que el equipo hace automáticamente todos los cálculos. Sin embargo, si hay que tener en cuenta que en la fórmula las dimensiones obtenidas se elevan al cubo, lo cual implica que cualquier pequeño error en las medidas se magnífica de forma importante y puede producir resultados muy incorrectos. También es posible calcular la masa del ventrículo izquierdo con métodos volumétricos multiplicando el volumen de la capa de miocardio por la densidad. Sin embargo, este método es más laborioso y está prácticamente reservado para la investigación.
El grosor parietal relativo (GPR) calculado con la fórmula (2 x PP)/DdVI) permite clasificar el aumento de masa ventricular en los patrones de hipertrofia concéntrica (GPR > 0,45) e hipertrofia excéntrica (GPR < 0,45).
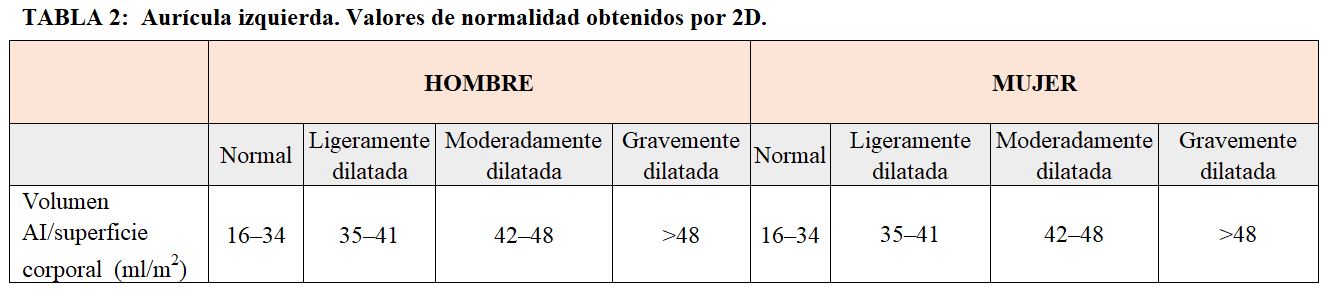
Medida de la aurícula izquierdaLa aurícula izquierda se mide en la telesístole ventricular, que corresponde al momento en el que la aurícula tiene un mayor tamaño. La forma más utilizada es medir la dimensión lineal anteroposterior con modo M o eco 2D el plano paraesternal de eje largo. Como ocurre en el caso de la medición del tamaño del ventrículo izquierdo, si no se posible orientar de forma correcta en el modo M el haz de ultrasonidos, se va a obtener una medida incorrecta y la imagen 2D será la mejor opción. Las medidas tomadas en una única dimensión son únicamente orientativas, ya que no representan la morfología compleja de la aurícula cuando existen alteraciones.
La medida del área de la aurícula en la imagen 2D añade una segunda dimensión y una mayor precisión en el resultado. Se obtiene simplemente dibujando el contorno de la aurícula sobre la imagen obtenida en el plano A4C. Por convención, el borde se dibuja directamente de un lado al otro de la válvula mitral, excluyendo la zona entre el plano del anillo y el cierre de las válvulas.
Medición de la vena cava inferiorLa medida de la vena cava inferior es una de las medidas básicas en el ecocardiograma, ya que forma parte de los criterios que se utilizan para estimar la presión en el lado derecho del corazón. La medida se hace en el plano subcostal a 1-2 cm de la unión de la cava con la aurícula derecha. El diámetro normal de la cava inferior es 1,5 cm. Tan importante como el diámetro es valorar los cambios del tamaño que se producen con el ciclo respiratorio.
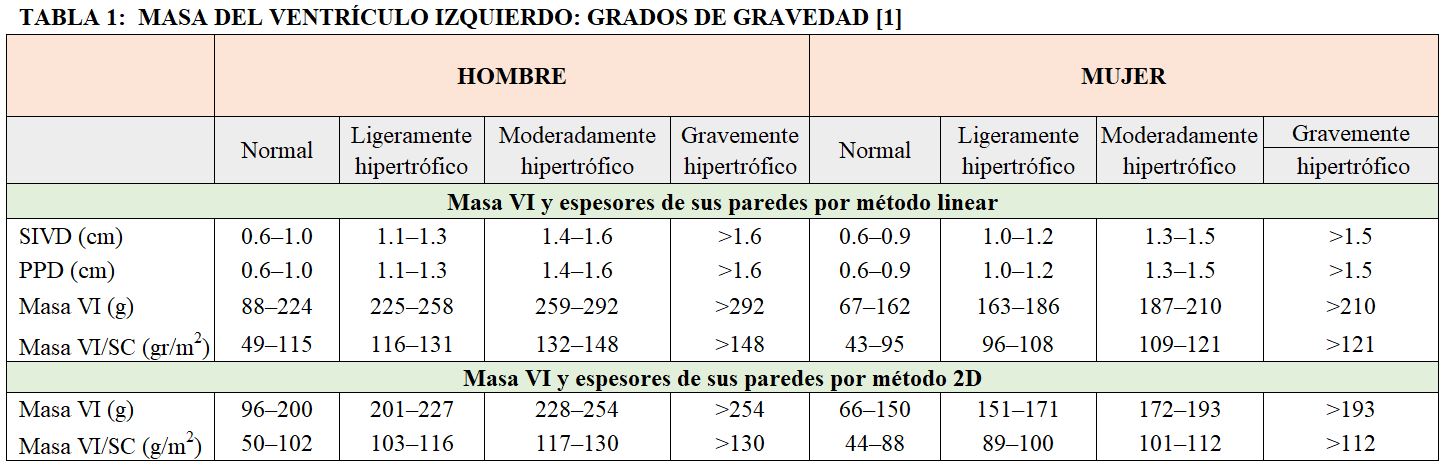
ECOCARDIOGRAFÍA EN EL PACIENTE RENALComo hemos visto, mediante ecocardiografía podemos evaluar la masa, el volumen del ventrículo izquierdo y su fracción de eyección (un parámetro subrogado de la función sistólica). Está técnica no invasiva permite también medir la presencia de hipertrofia ventricular izquierda (Tabla 1). Además podemos evaluar el tipo de hipertrofia del ventrículo izquierdo, es decir su patrón "geométrico", que puede ser concéntrica o excéntrica. Otras mediciones ecocardiográficas que son de especial de interés en este grupo de pacientes son: la evaluación de la función diastólica, la anatomía y función de las válvulas cardiacas y la presencia de patología pericárdica..
1-Implicaciones clínicas de la hipertrofia del ventrículo izquierdo en el paciente con ERCLa presencia de hipertrofia ventricular izquierda (HVI) se puede evaluar calculando la masa del ventrículo izquierdo. Es importante hacer el cálculo de la misma ajustando los valores obtenidos por la superficie corporal del paciente: si utilizamos el modelo lineal (comentado anteriormente, un ventrículo izquierdo es hipertrófico cuando la masa es mayor de 95 g/m2 en mujeres y mayor de 115 g/m2 en hombres. Los límites superiores de normalidad de la masa ventricular izquierda del ventrículo por mediciones 2D son: 88 g/m2 en mujeres y 102 g/m2 en hombres. Hay que tener en cuenta que ambos métodos presentan limitaciones como ya se ha comentado, por este motivo una aproximación sencilla puede ser obtener solo el grosor del septo interventricular del ventrículo izquierdo en diástole. Aunque esta aproximación es muy sensible pero poco específica cuando los grosores están levemente aumentados.
La HVI es muy prevalente en la ERC y se asocia a un pronóstico claramente desfavorable [5]. En los pacientes con ERC, la HVI se desarrolla precozmente y está presente en alrededor de un 20% de los pacientes en estadios 1, 2 y 3 de ERC [1], además la incidencia de HVI aumenta con el empeoramiento progresivo de la función renal. Así entre un 70 y un 90% de los pacientes en diálisis presentan HVI [6] .
Es importante saber que la geometría del VI en pacientes con ERC puede variar en función del momento en el que hagamos la exploración ecocardiográfica en pacientes en hemodiálisis. Así por ejemplo si realizamos un ecocardiograma antes de una sesión de hemodiálisis, los diámetros del VI pueden estar aumentados debido a que el paciente puede presentar un estado hipervolémico. Por este motivo es importante realizar esta exploración cuando el paciente se encuentra en un periodo de euvolemia.
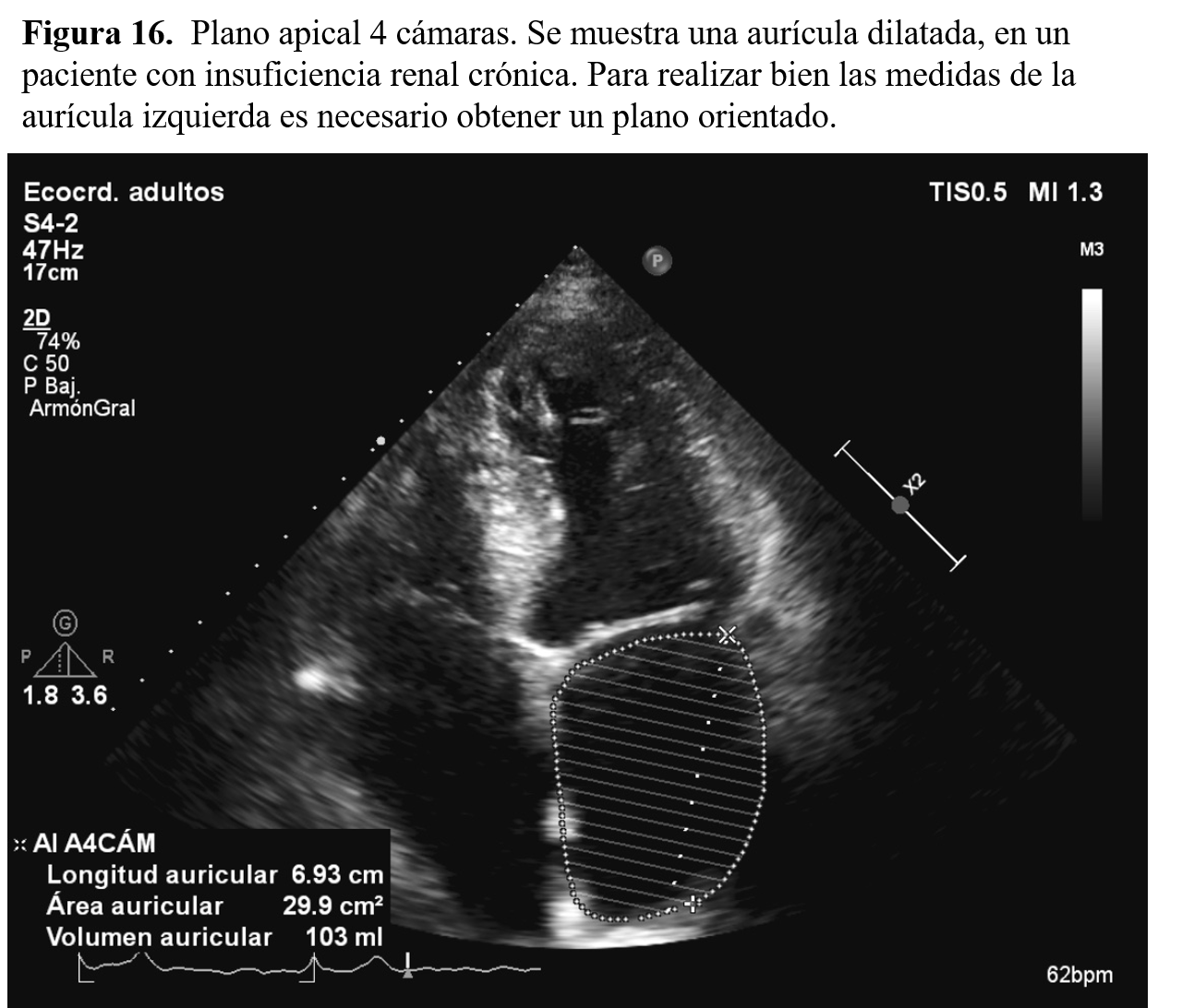
2- Disfunción diastólica en el paciente con ERCLa presencia de anomalías del llenado ventricular (disfunción diastólica, grados I a IV): distensibilidad disminuida del VI y anomalía de la relajación de este, son alteraciones que se encuentran frecuentemente en los paciente con ERC [7]. La medición precisa del grado de disfunción diastólica tiene implicaciones pronósticas en estos pacientes. Así, en un estudio observacional prospectivo en el que incluyeron 153 pacientes con ERC, se demostró en el análisis multivariante que la presencia de un grado de disfunción diastólica > 1 fue un predictor independiente de mortalidad (HR: 3,42, 95% IC: 1,66 - 7,08; p = 0,001; seguimiento medio 30 meses) [8]. Una de las características de los pacientes que tienen alteraciones significativas del llenado ventricular es la presencia de dilatación de la aurícula izquierda (AI) (Figura 16). La dilatación de la aurícula izquierda (Tabla 2) en este contexto es un valor predictivo de mortalidad en pacientes con ERC [9].
3- Función sistólica en el paciente con ERCEn los pacientes con ERC, la presencia de HVI, dilatación del VI o disfunción sistólica puede aumentar significativamente el riesgo de desarrollar insuficiencia cardiaca independientemente de la edad, de la presencia de diabetes o de enfermedad coronaria [10].
Alrededor de un 20% de los pacientes con ERC en diálisis presentan disfunción sistólica del VI y tiene tienen un pronóstico peor que los que no tienen disfunción [11].
La función ventricular se suele calcular mediante el método Simpson biplanar (Figura 17). Para realizar una medición precisa es necesario delimitar bien el borde endocárdico y que la cavidad ventricular sea simétrica. En los pacientes con ERC la presencia de HVI es frecuente y por tanto es posible que este método de estimación de la fracción de eyección sobreestime la medidas de contractilidad.
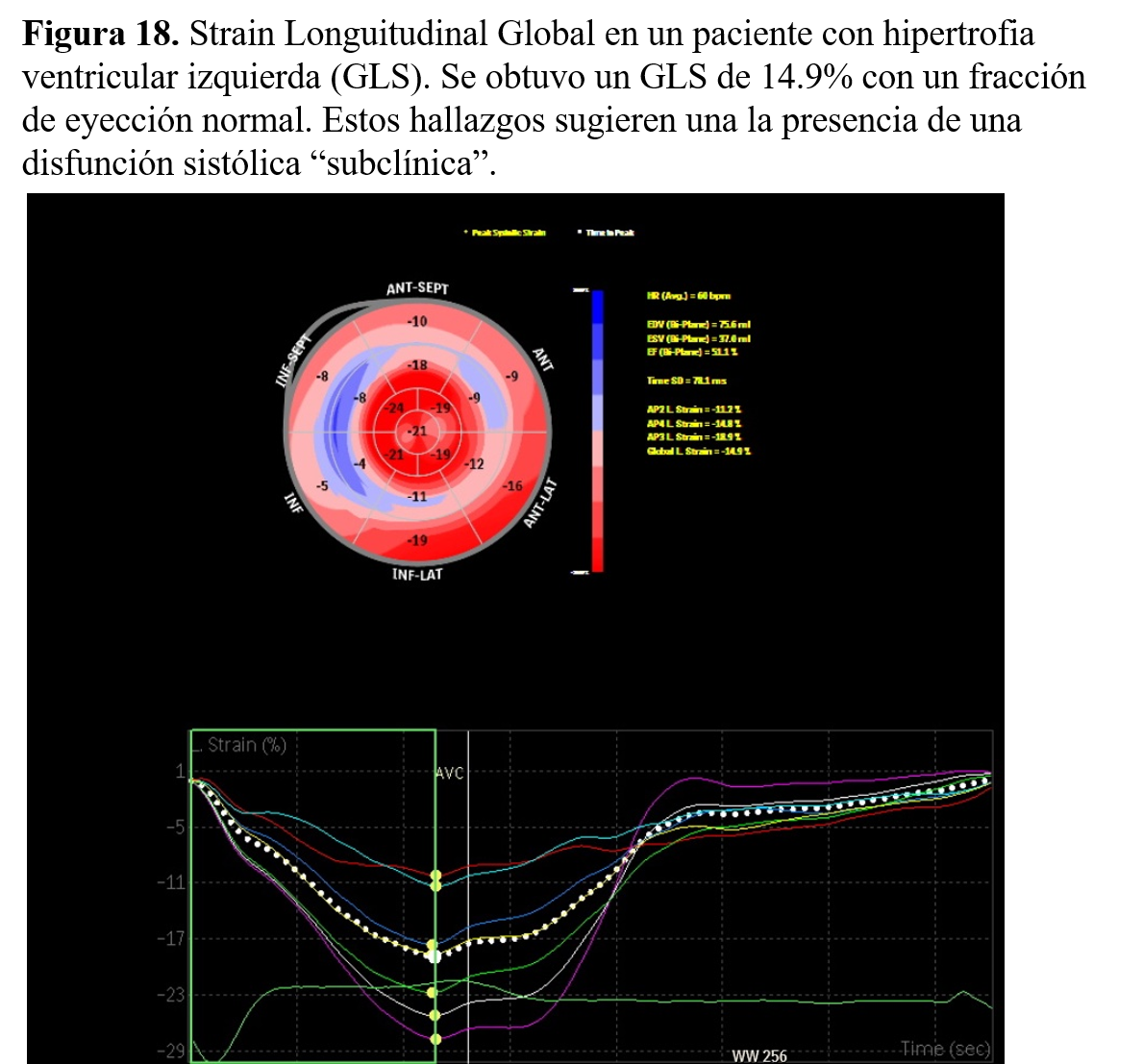
Por tanto, aunque la FEVI es uno de los parámetros ecocardiográficos más potentes para predecir la morbimortalidad, en la población con ERC su uso puede estar limitado al ser un parámetro que depende de la precarga (volemia del paciente). Además es bien conocido que la FEVI no es suficientemente sensible para detectar estadios precoces de alteraciones de la función ventricular, algo que puede ser frecuente en los estadios precoces de ERC [12]. En este contexto, las técnicas ecocardiográficas capaces de evaluar la deformación del miocardio (strain miocárdico longitudinal) pueden ser de utilidad. En la práctica, las medidas obtenidas mediante imágenes de deformación miocárdiaca pueden superar algunos de las limitaciones de las medidas ecocardiográficas convencionales y ayudar a detectar alteraciones "precoces" de la función sistólica. Diversos estudios sugieren que los pacientes con ERC comienzan a desarrollar disfunción sistólica subclínica antes de que la enfermedad clínica sea relevante. Sin embargo, todavía sigue siendo necesario validar estos hallazgos en la práctica clínica habitual y conocer si de verdad estas medidas pueden mejorar el control terapéutico de esta población (Figura 18) [13].
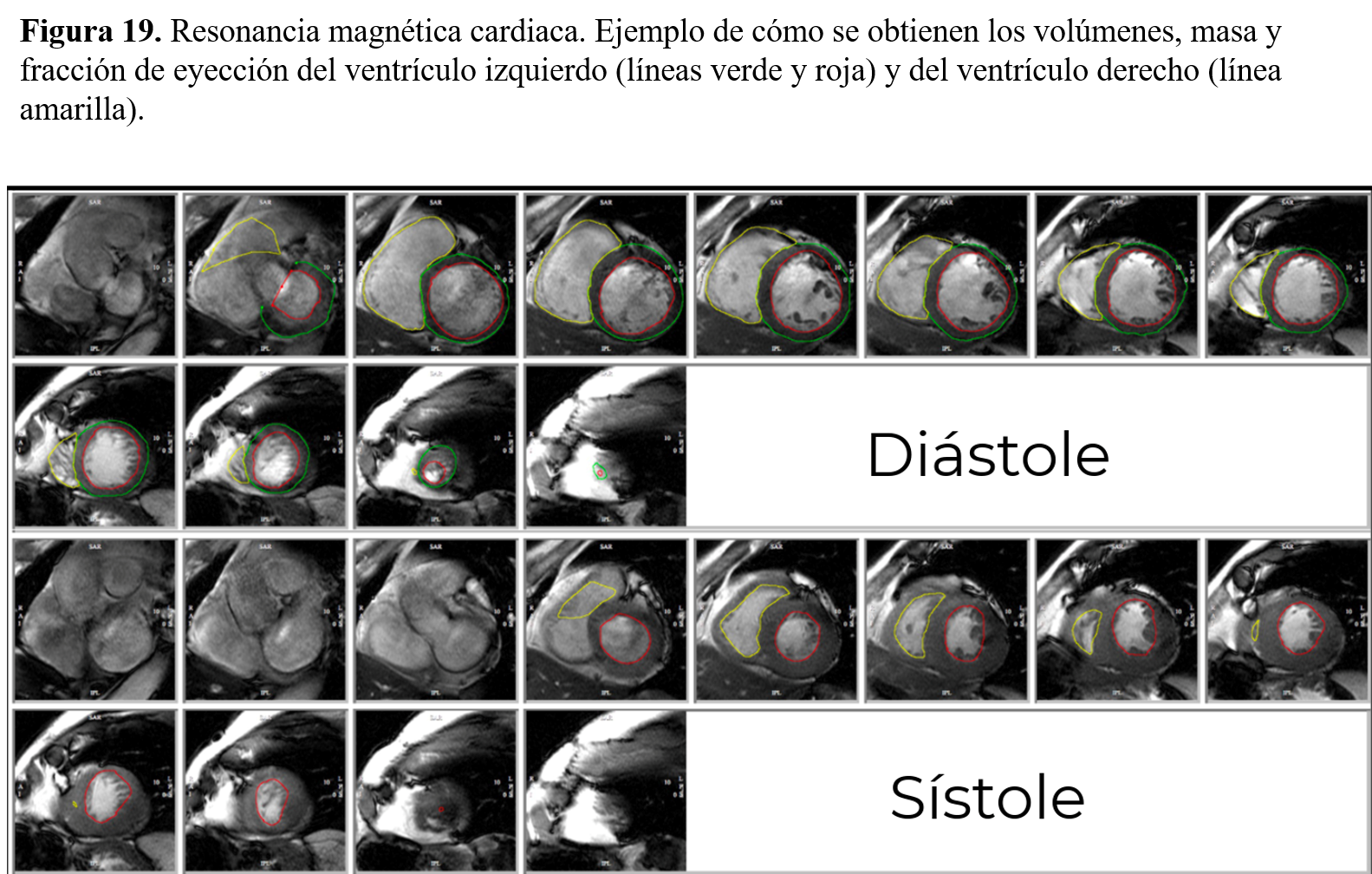
En resumen, en los pacientes con ERC hay que intentar ser precisos de la hora de evaluar los volúmenes y la FEVI. Probablemente, los datos más consistentes se pueden obtener mediante ecocardiografía tridimensional. En comparación con la ecocardiografía 2D, esta técnica (3D) reduce significativamente la variabilidad interobservador y permite obtener mediciones de volumen y masa ventriculares comparables a la resonancia magnética cardíaca (RMC) sin contraste [técnica de referencia, (Figura 19)]. Sin embargo, 3D es una técnica que sigue dependiendo de la calidad de la imagen, de la regularidad del ritmo cardiaco y además, requiere experiencia y un tiempo de postprocesado mayor.
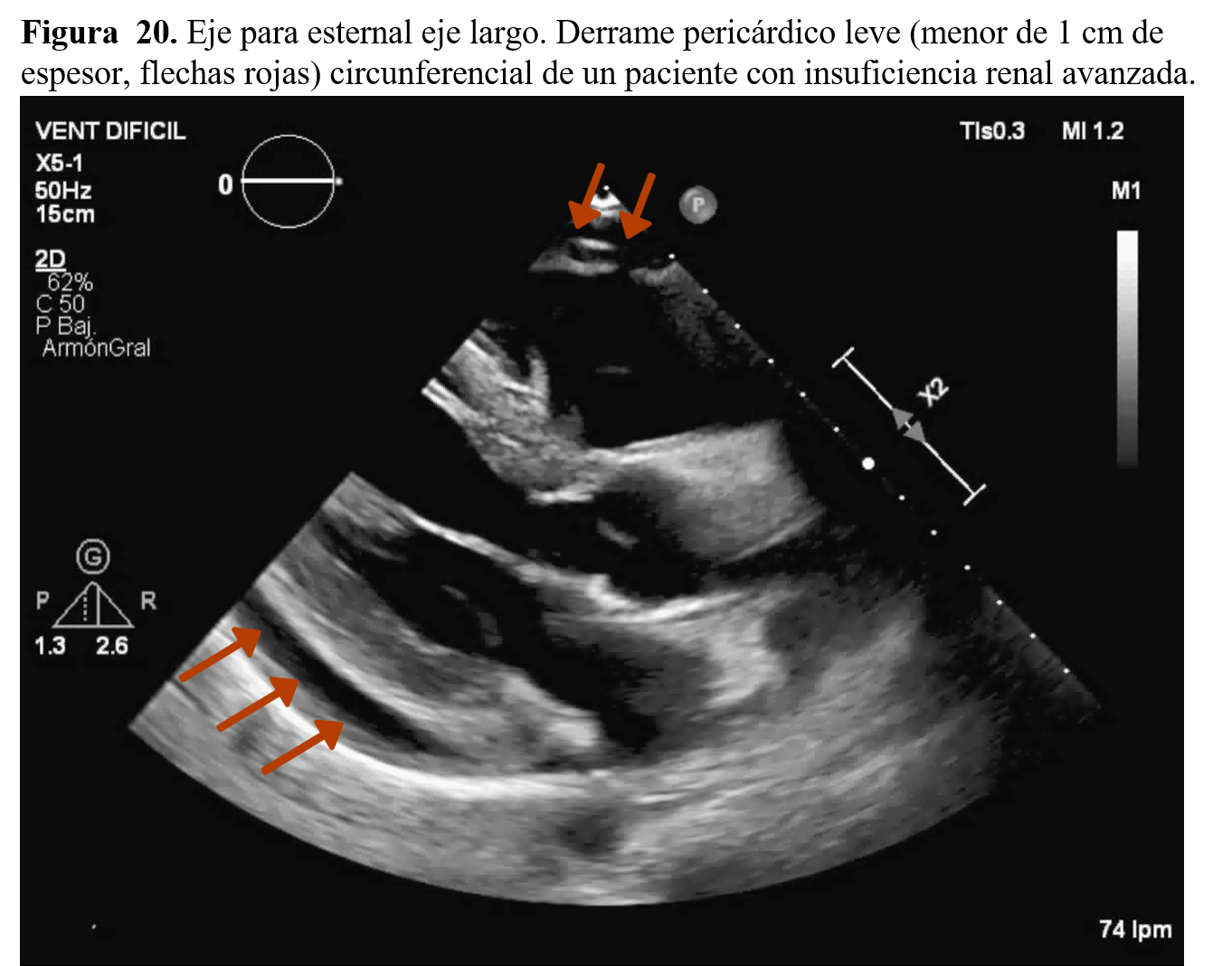
4-Patología pericárdica y ERCLa afectación pericárdica en la ERC se manifiesta infrecuentemente como pericarditis constrictiva. La forma más frecuente de enfermedad pericárdica en estos pacientes es la pericarditis aguda urémica (antes de que el paciente entre en programa de diálisis o en las primeras 8 semanas desde el inicio de la diálisis) y la pericarditis por "diálisis" o de diálisis (Figura 20). La prevalencia de pericarditis en esta población es de un 5% [14].
El mecanismo fisiopatológico de la pericarditis urémica o de diálisis sigue sin estar claramente establecido. Hay que destacar que los pacientes con ERC y pericarditis suelen tener menos síntomas que la población general, es decir presentan un dolor torácico menos característico y menos intenso con ausencia de alteraciones electrocardiográficas, probablemente porque no se trata de un proceso inflamatorio. El tratamiento de la pericarditis urémica incluye la hemodiálisis intensiva [15].
5- Catéteres y complicaciones en paciente con ERC. EndocarditisLa principal ventaja de la ecocardiografía es que puede evaluar si un catéter permanente está localizado en la vena cava superior. Los catéteres se ven como líneas blancas "moteadas" y la punta está localizada en las cavidades cardiacas derechas. En estos casos hay que retirar el catéter hasta colocarlo en la vena cava superior.
La endocarditis producida por infecciones asociadas a los catéteres para hemodiálisis es una causa de morbimortalidad importante [16]. Los microrganismos implicados en la endocarditis son la Pseudomona y el Staphylococcus aureus, si bien es cierto que el manejo adecuado del orificio de salida y el sellado de los catéteres han condicionado una disminución de las infecciones.
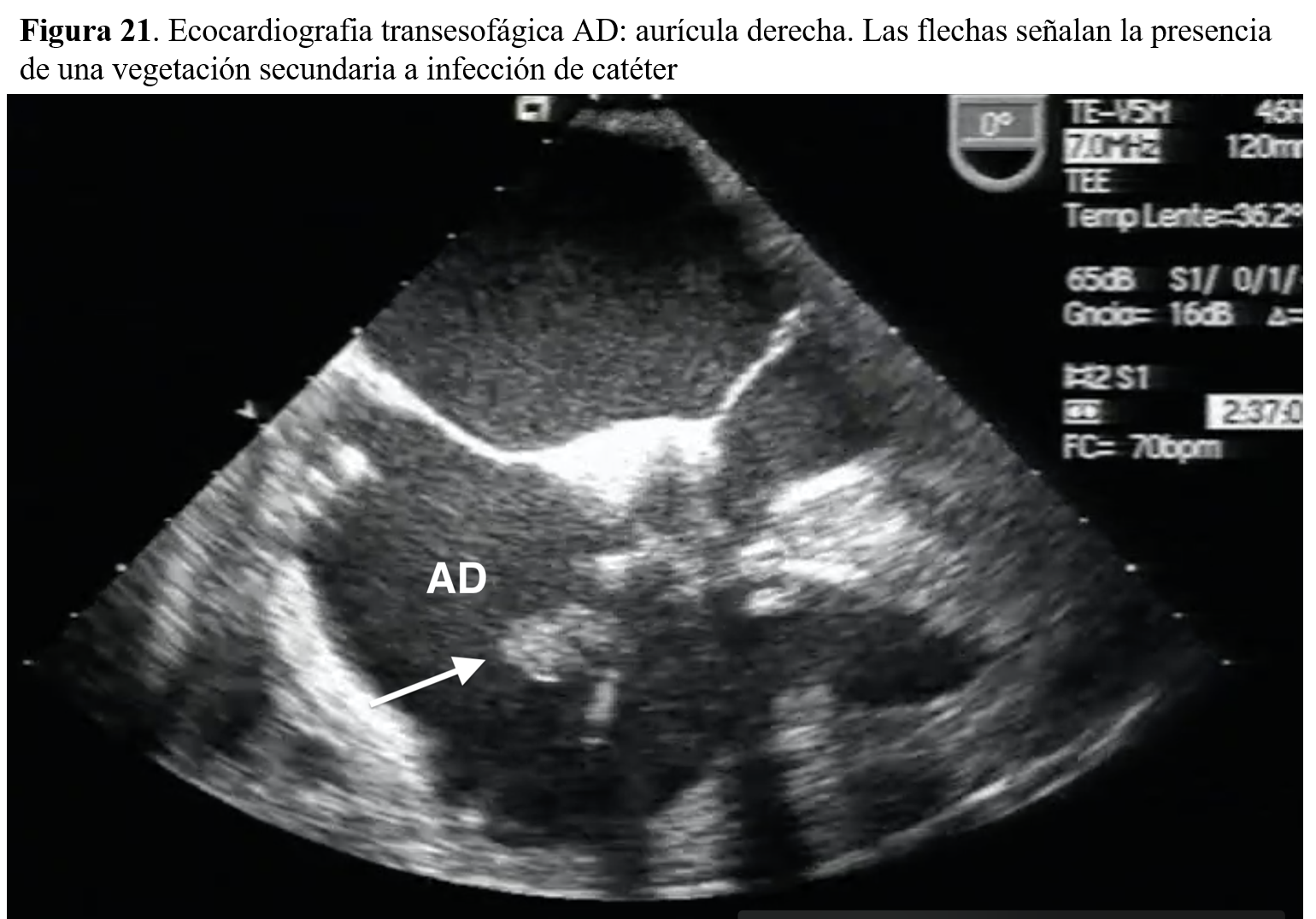
El eco transtorácico puede poner de manifiesto la verruga y su localización, detectada como una masa con movimiento anárquico en las cavidades derechas o en continuidad con los catéteres, siendo el eco transesofágico más sensible para su detección de las vegetaciones, así como de sus complicaciones (Figura 21).
6-Calcificaciones valvularesEstas calcificaciones son un hallazgo frecuente en el enfermo tratado con diálisis. Así, uno de cada 3 pacientes en diálisis peritoneal muestra calificaciones en válvula aórtica o mitral. La incidencia de mortalidad cardiovascular es más frecuente en estos pacientes. También tras el trasplante renal, la presencia de calcificación del anillo mitral se ha considerado como predictor independiente de mortalidad junto a la edad, la HVI y el tamaño ventricular, sin embargo, es preciso que se realicen más trabajos que demuestren el valor pronóstico independiente de la calcificación valvular.
Sin duda la ecocardiografía es la técnica de rutina para la valoración de la calcificación del anillo mitral así como la afectación de los velos valvulares aórticos.
PUNTOS CLAVE1. La ecocardiografía puede identificar cambios estructurales asociados con un mal pronóstico, pero puede ser propensa a la inexactitud, ya que algunas mediciones se basan en asunciones geométricas.
2. Las técnicas de ecocardiografía tridimensional pueden ser de utilidad para realizar una medición precisa de los volúmenes y fracción de eyección del ventrículo izquierdo.
3. La disfunción diastólica mayor de un grado I tiene implicaciones pronósticas.
4. La pericarditis tiene un curso y tratamiento distinto al de la población general.
5. El ecocardiograma transtorácico puede ayudar a detectar complicaciones precoces de los accesos venosos permanentes.