Los síndromes renales son las diferentes formas clínicas y analíticas por las que se manifiestan las enfermedades del riñón y se agrupan en 9 apartados (Tabla 1). Mientras que algunos de ellos son reflejo inequívoco de enfermedades renales, como síndrome nefrótico, síndrome nefrítico, insuficiencia renal y tubulopatías, otros pueden ser también producidos por enfermedades extrarrenales, como ocurre con la hipertensión o la hematuria. Por estos motivos, cada uno de los diferentes síndromes requiere un cuidadoso y exhaustivo diagnóstico diferencial. En la evaluación de un paciente con una enfermedad renal es clave conocer el síndrome clínico que padece para, a continuación, iniciar estudios complementarios, diagnosticar la enfermedad subyacente y planificar el tratamiento. Estos síndromes no son excluyentes entre sí puesto que varios de ellos pueden coincidir simultáneamente o bien se pueden ir añadiendo a lo largo de la evolución de la enfermedad subyacente [1].
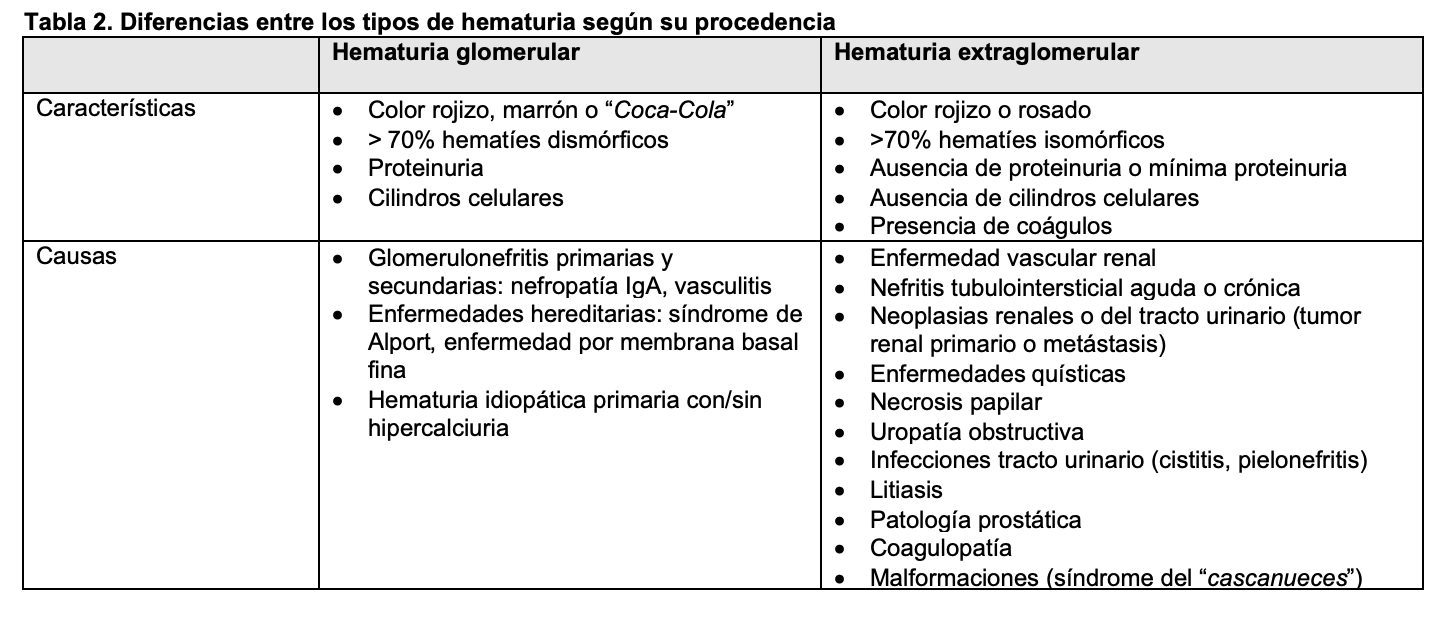
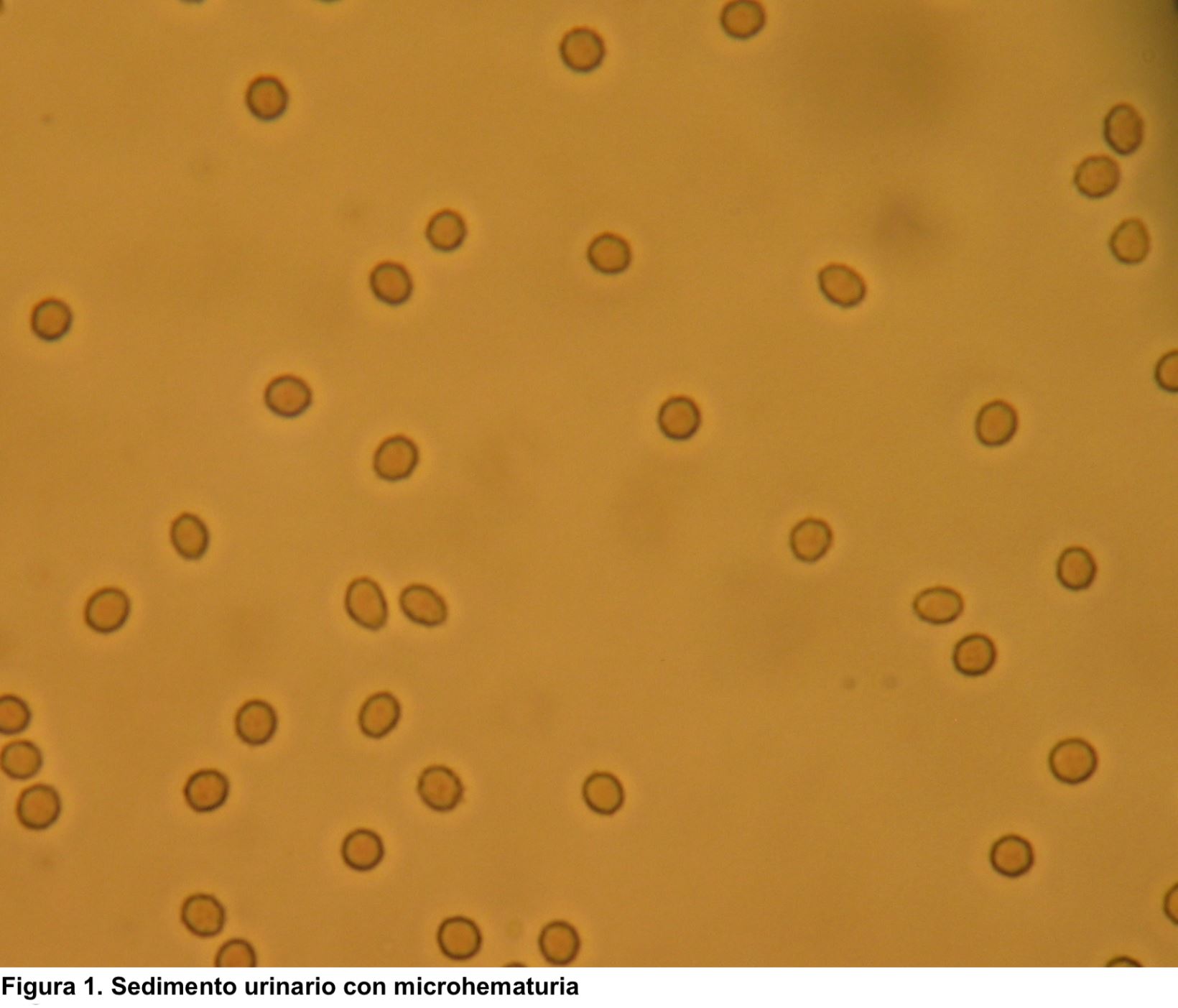
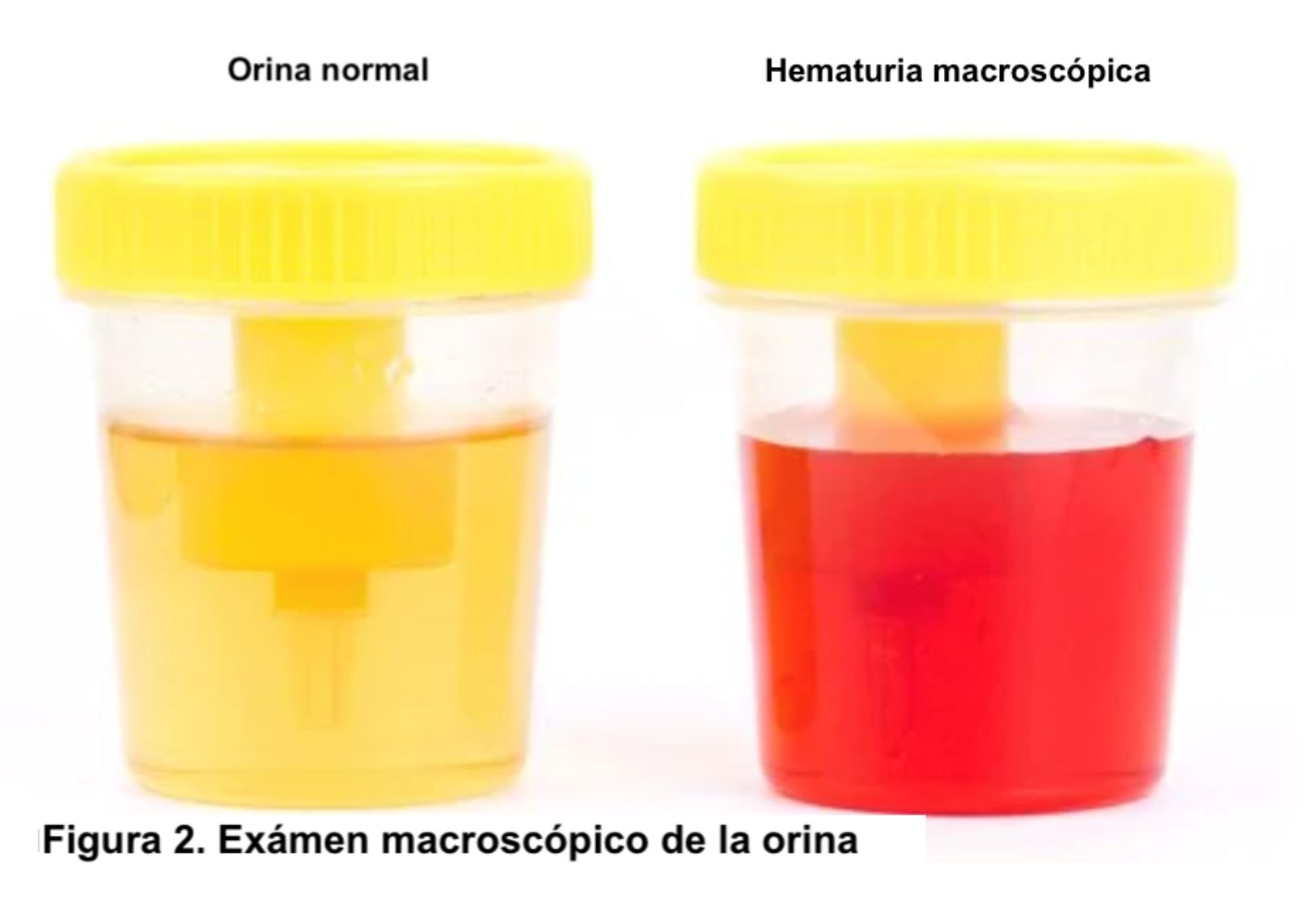
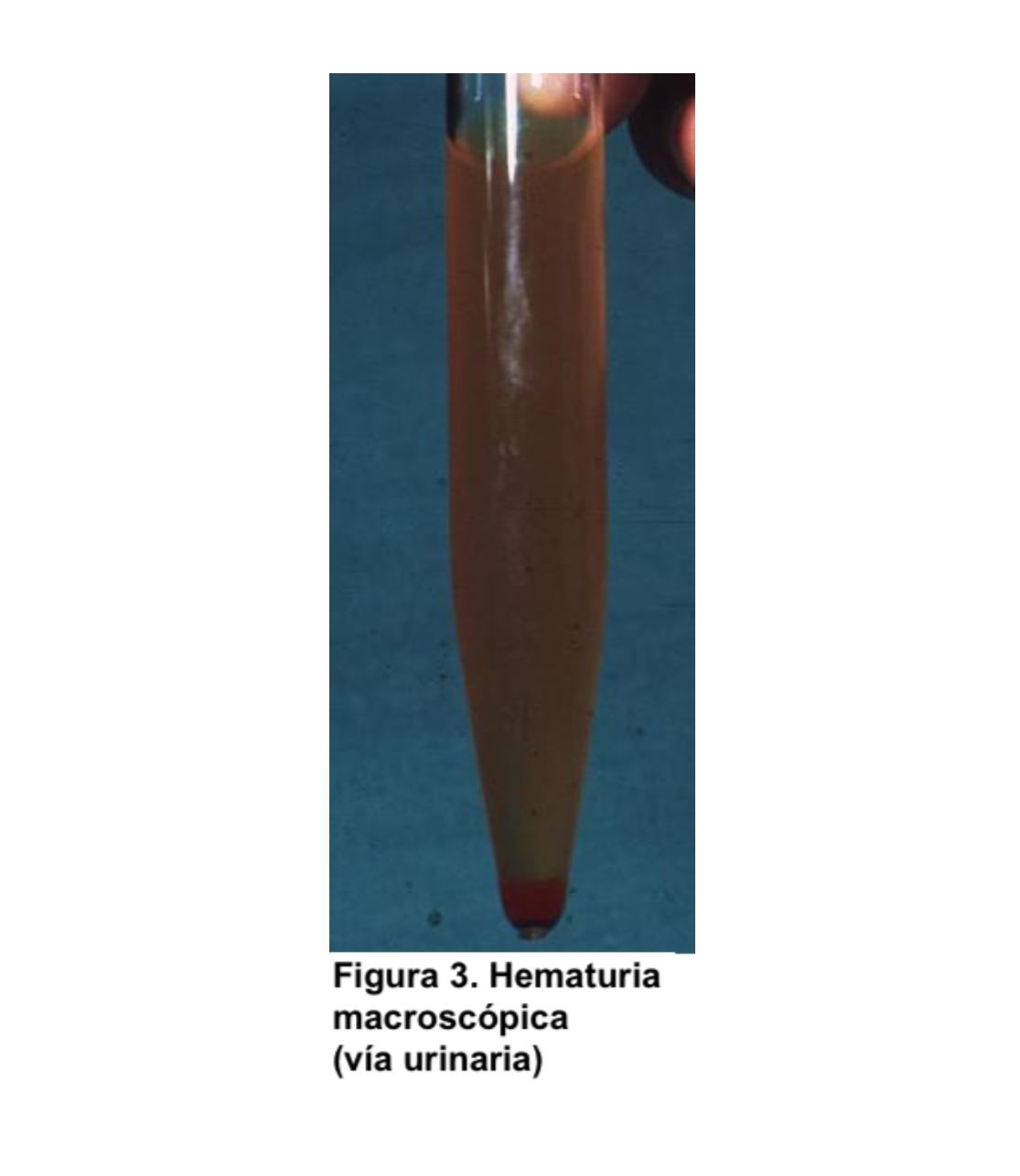
HEMATURIA Definición y tipos.La hematuria es la presencia de un número anormalmente elevado de hematíes en orina. En condiciones normales apenas hay hematíes en la orina, por lo que se define como la presencia de más de 2 hematíes/campo en el sedimento urinario. Para el análisis microscópico se debe observar inicialmente la preparación con un aumento final de 100× para obtener una visión general. Todos los elementos identificados deberán confirmarse en un aumento de 400x (empleando ocular de 10x y objetivo de 40x) [2]. Otros valores son más de 8.000 hematíes/ml en orina centrifugada o más de 13.000 hematíes/ml en orina no centrifugada. En la hematuria microscópica el color de la orina es normal, pero en el estudio del sedimento se visualiza un número anormalmente elevado de hematíes (Figura 1). Sin embargo, en la hematuria macroscópica el color es rojo (Figura 2) o marrón oscuro; incluso pueden aparecer coágulos de sangre si procede de vías urinarias o tumores (Figura 3). Se debe distinguir la hematuria de la pigmenturia (presencia en orina de sustancias como la mioglobina que aportan coloración similar).
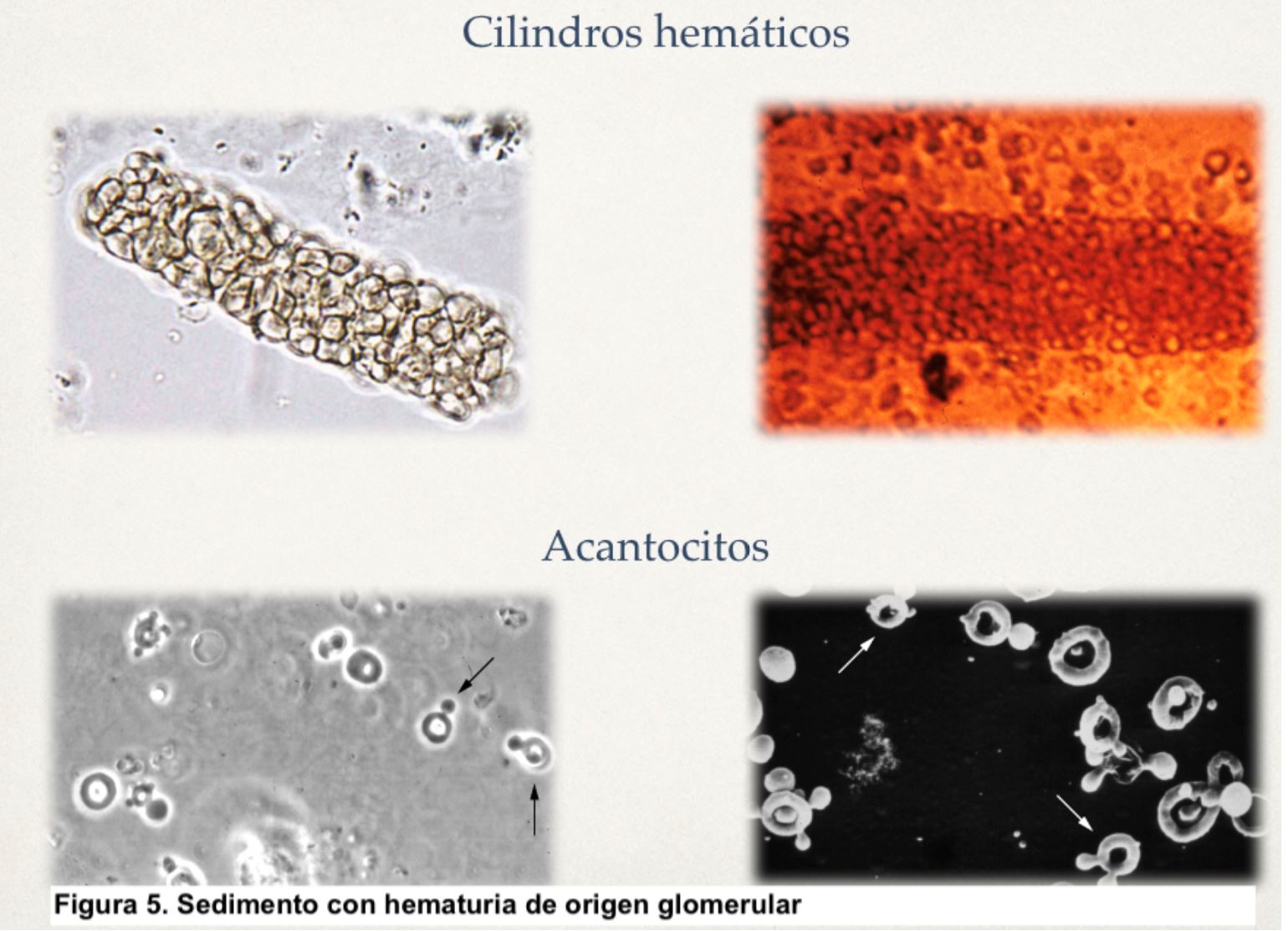
Métodos de detección.La hematuria se puede detectar mediante tira reactiva tipo Combur10Test u otra similar (Figura 4), o por examen directo al microscopio. Estas tiras son altamente sensibles para detectar hematíes (positivas en presencia de 1-2 hematíes/campo) y también son útiles para detectar otros parámetros como pH, albúmina, glucosa, nitritos y leucocitos. De hecho, son el procedimiento inicial más utilizado en el denominado análisis sistemático de orina. Puede haber falsos positivos para hematuria si hay hemoglobina o mioglobina en orina, pH alcalino o por uso de agentes oxidantes y, por otro lado, hay falsos negativos tras ingesta de grandes cantidades de vitamina C. La presencia de un resultado positivo en la tira reactiva debe ir seguido siempre de un examen microscópico del sedimento urinario que permitirá el diagnóstico de certeza, así como cuantificar los hematíes y describir su tamaño y morfología [3]. La presencia simultánea de cilindros hemáticos, hematíes dismórficos, acantocitos o proteinuria orientan hacia un origen glomerular (Figura 5), especialmente si se acompañan de proteinuria patológica. Sin embargo, cuando los hematíes son de aspecto y tamaño normal, lo más probable es que su origen sea extraglomerular, habitualmente desde algún tramo de la vía urinaria. En la (Tabla 2) se indican las características diferenciales de los tipos de hematuria.
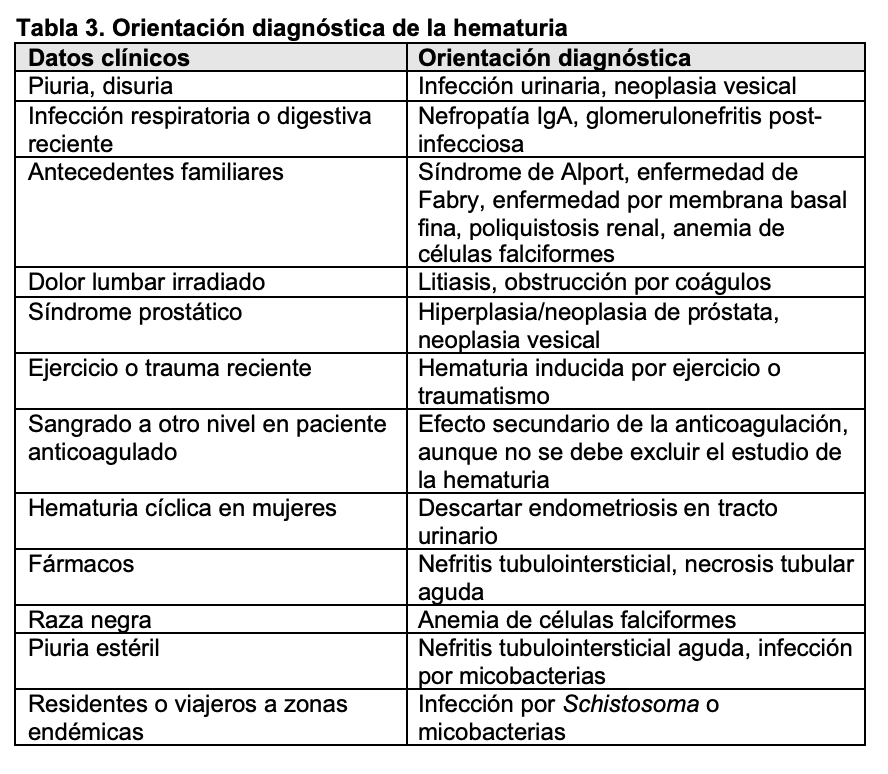
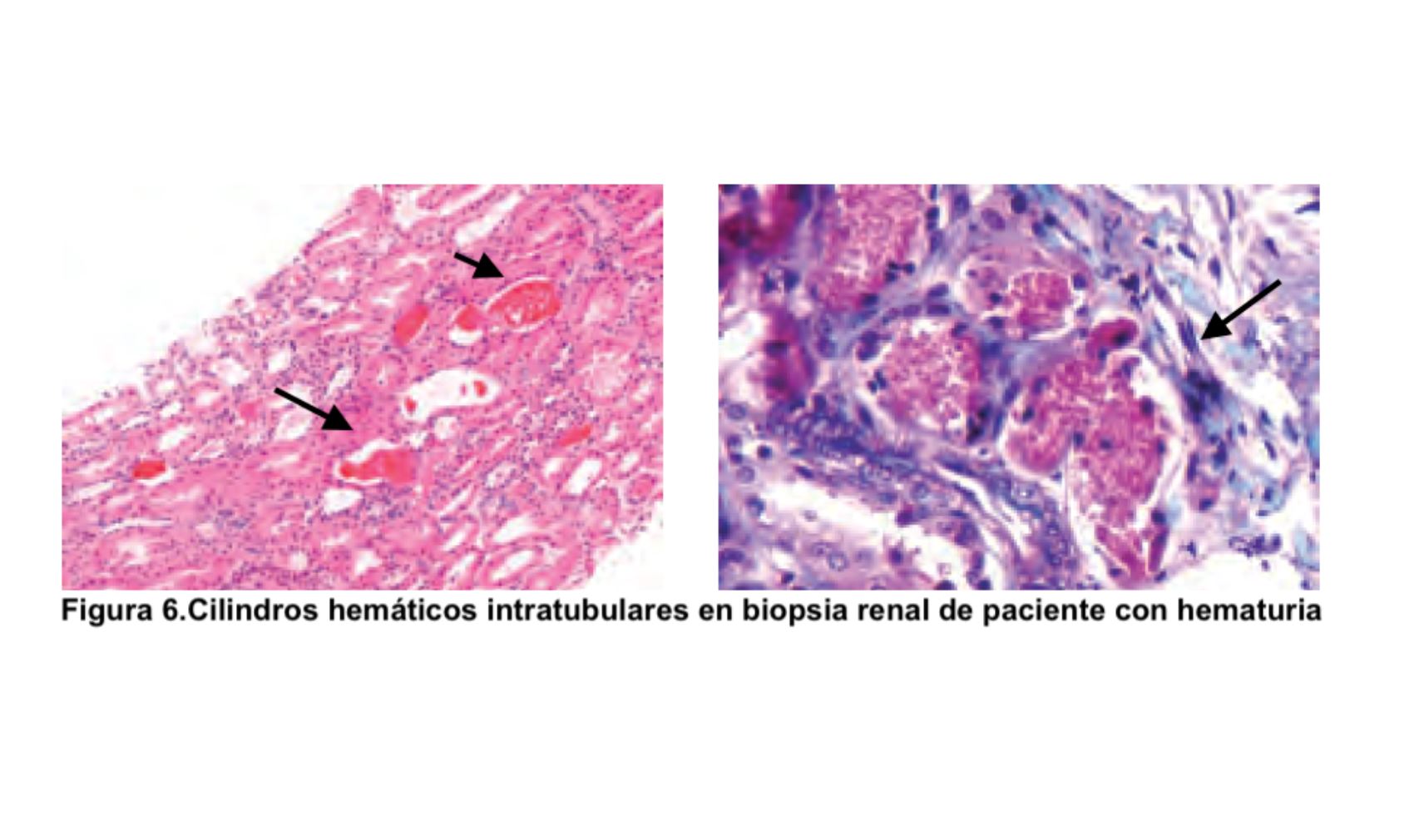
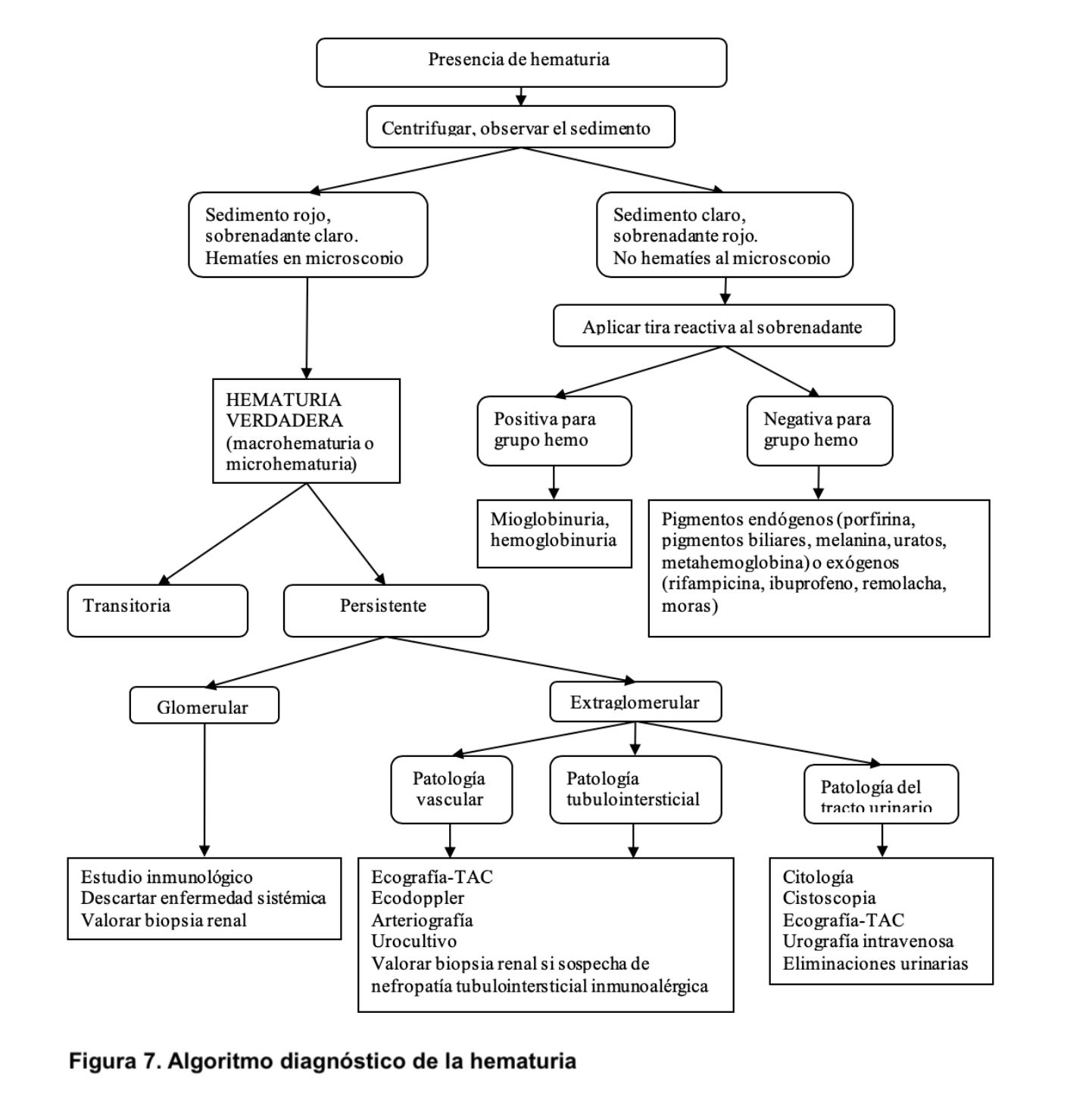
Evaluación del paciente con hematuria.El primer punto por determinar es si la hematuria es transitoria o persistente (más de 3 meses, aproximadamente). Las causas más comunes de hematuria transitoria son: fiebre elevada de cualquier origen, infecciones, litiasis y neoplasias del sistema urinario. Si la hematuria es persistente hay que determinar si es de origen glomerular o extraglomerular. Para ello es fundamental realizar una historia clínica y una exploración física completa que orienten acerca de la etiología (Tabla 3). Se debe investigar la presencia de fiebre, síndrome constitucional, ingesta de fármacos, exposición a sustancias tóxicas, síndrome miccional y lesiones cutáneas. El estudio de la patología glomerular requiere la realización de estudio inmunológico (autoanticuerpos, complemento, inmunoglobulinas) y en muchas ocasiones, biopsia renal [4] [5]. De forma característica, la biopsia renal en los casos de hematuria de origen glomerular suele mostrar cilindros hemáticos intratubulares (Figura 6). Aunque se ha demostrado que la hematuria no es un factor de riesgo para complicaciones renales, recientemente se ha destacado que la presencia de hematuria de forma persistente puede ser tóxica para el parénquima renal y favorecer el desarrollo de insuficiencia renal [6] [7]. Si se trata de hematuria extraglomerular se debe hacer un estudio minucioso mediante citología urinaria, cultivos, eliminación urinaria de calcio y ácido úrico, ecografía abdominal y en ocasiones cistoscopia y otras pruebas de imagen (TAC, resonancia magnética nuclear) (Figura 7) [8] [9]. A veces, la hematuria aislada no se asocia con ninguna enfermedad renal o extrarrenal por lo que se la denomina hematuria esencial benigna, siendo éste un diagnóstico de exclusión.
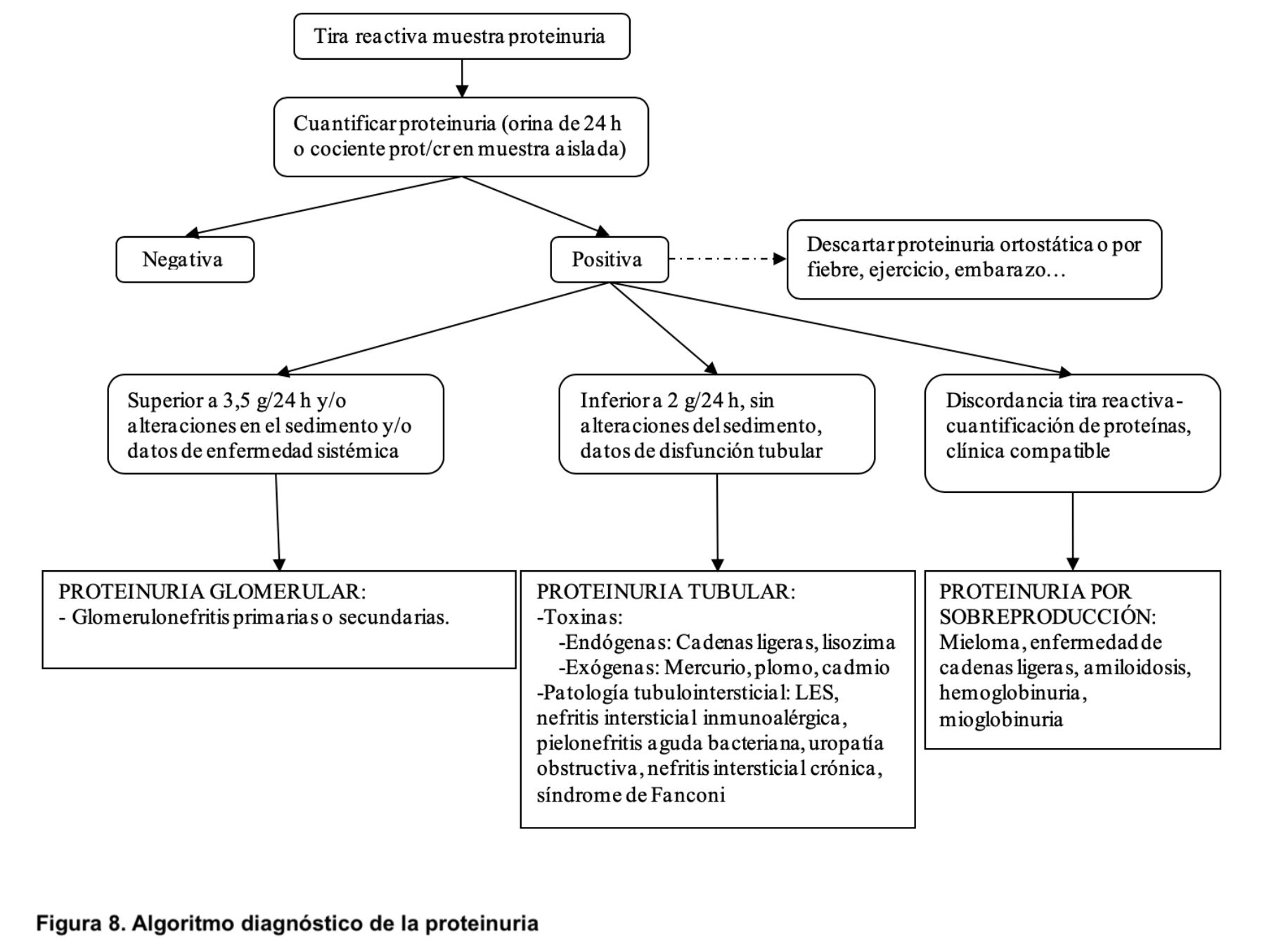
PROTEINURIA.En condiciones normales se filtran en el glomérulo proteínas de bajo peso molecular y pequeñas cantidades de albúmina. La mayoría de las proteínas filtradas son reabsorbidas y catabolizadas en el túbulo proximal y sólo una mínima cantidad es excretada en orina. También se eliminan en orina proteínas excretadas por las células tubulares. La excreción normal de proteínas totales en orina es 150 mg/24h y se considera la presencia de albuminuria si su eliminación es > 30 mg/24h. Cuando la proteinuria es > 3,5 g/24 o la albuminuria es > 2200 mg/24h se las califica como de rango nefrótico.
Véase Documento de Consenso Proteinuria NEFROLOGIA 2011
Métodos de detección.Las tiras reactivas como Combur10Test también son el procedimiento inicial de evaluación de la proteinuria (Figura 4). Estas tiras son muy sensibles a la presencia de albúmina mientras que no lo son tanto para otro tipo de proteínas. Cuando hay albuminuria la tira adopta un color verde, relacionado con su concentración y se suele expresar con cruces según la intensidad del color. Puede dar falsos negativos o valores bajos si las proteínas presentes en orina son distintas de la albúmina. De esta manera, la disociación entre la proteinuria negativa detectada mediante tira reactiva y la presencia de proteinuria realizada en el laboratorio, basada en la precipitación de proteínas totales con ácido sulfosalicílico, orientan hacia la presencia de proteinuria de origen tubular, como ¿-globulinas y proteínas de bajo peso molecular, como ocurre en el mieloma múltiple, la hemoglobinuria y la mioglobinuria. Las orinas alcalinas, con presencia de hematuria, así como la administración de contrastes yodados y de algunos fármacos (ciprofloxacino, quinina y cloroquina), ocasionan falsos positivos. Además, puede variar según el volumen y la concentración urinaria. No obstante, por la sencillez, bajo coste y accesibilidad, supone un método de primera elección para el despistaje de la proteinuria.
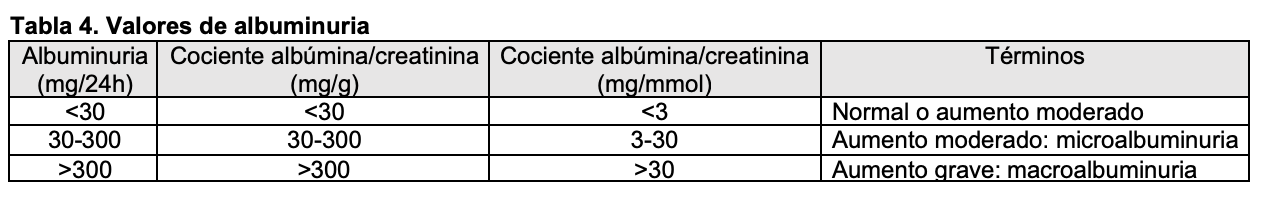
La cuantificación de proteínas en orina de 24 horas es el procedimiento estándar, pero tropieza con el problema de la recogida de orina, que no siempre se hace de forma correcta. Por este motivo, se han ideado varios procedimientos para valorar adecuadamente la eliminación urinaria de proteínas. Uno de ellos es cuantificar la proteinuria (mg/dl) en orina minutada. Pero el método más aceptado es cuantificar la proteinuria en una muestra de orina recogida preferentemente a primera hora de la mañana, desechando la primera micción. En esta muestra, el cociente entre la concentración de proteínas (en mg/dl) y la concentración de creatinina (también en mg/dl) ofrece unos valores paralelos al cálculo de proteinuria en orina de 24 horas [11]. Aunque el cociente urinario proteínas/creatinina (pro/crea) tiene algunas limitaciones (especialmente según la intensidad de la proteinuria, la masa muscular, la postura o el ejercicio físico previo) se ha adoptado como procedimiento útil para evaluar la intensidad y evolución de la proteinuria [12] [13]. Además, mediante la recogida de una muestra de orina se puede determinar la eliminación de albúmina, que es especialmente útil en pacientes diabéticos y/o en presencia de enfermedad renal crónica. Si el cociente obtenido al dividir la albúmina urinaria (cuantificada en mg) entre la creatinina en orina (cuantificada en g) es 300 mg/g se define como macroalbuminuria (Tabla 4).
Tipos de proteinuria.Según su causa, la proteinuria se clasifica como:
a) Proteinuria transitoria: el ejercicio intenso, la gestación, la fiebre, las convulsiones, las infecciones, la insuficiencia cardíaca y el empleo de fármacos vasoactivos pueden aumentar la proteinuria de forma transitoria.
b) Proteinuria por ortostatismo: aparece en sujetos jóvenes en los que la proteinuria suele ser < 2 g/24h, normalizándose en decúbito; puede ser transitoria o persistente y no supone riesgo de progresión a insuficiencia renal. Tanto la proteinuria transitoria como por ortostatismo son diagnósticos de exclusión.
c) Proteinuria glomerular, que es debida a alteraciones en la barrera de filtración glomerular que conlleva una filtración anormalmente alta de proteínas plasmáticas; puede ser selectiva o no selectiva, según esté compuesta por albúmina u otras proteínas de bajo peso molecular.
d) Proteinuria tubular, que aparece por déficit en la reabsorción de las proteínas filtradas por el glomérulo, debido a alteraciones hereditarias o adquiridas del túbulo contorneado proximal. Están compuestas por proteínas de bajo peso molecular, cadenas ligeras de inmunoglobulinas y ß2-microglobulinas, que no son reabsorbidas adecuadamente a nivel tubular proximal.
e) Proteinuria por sobrecarga filtrada (overflow proteinuria): consiste en la eliminación aumentada de proteínas de bajo peso molecular debido a un aumento de su síntesis. Casi siempre es debido a mieloma múltiple con aumento de la producción de cadenas ligeras, aunque también puede esta originada por aumento de la producción de lisozima (leucemias), mioglobina (rabdomiolisis) o hemoglobina (hemólisis intravascular).
f) Proteinuria post-renal: aparece en procesos inflamatorios del tracto urinario y se suele asociar a leucocituria.
Evaluación del paciente con proteinuria.La primera aproximación es la realización de una tira reactiva. Si la tira es positiva para proteinuria, se debe cuantificar por alguno de los métodos descritos anteriormente. Confirmada la presencia de proteinuria persistente, se debe continuar el estudio. Se debe evaluar filtrado glomerular, hemograma, bioquímica, exploración física y anamnesis completa (buscando datos de enfermedades sistémicas), estudio del complemento, inmunoglobulinas, serologías virales (para investigar infección por virus B, C o VIH), así como determinación de autoanticuerpos si hay datos de enfermedad sistémica. También es necesario estudiar la morfología renal, para lo cual una ecografía suele ser suficiente. En ocasiones será necesaria la realización de biopsia renal [4]. Si se trata de aumento de la síntesis de proteínas, como ocurre en las gammapatías monoclonales, nos encontraremos una tira reactiva negativa para proteínas, pero la cuantificación de proteínas totales será positiva dado que la proteinuria no está compuesta mayoritariamente por albúmina. Además, podemos encontrar otros datos que acompañan a las gammapatías monoclonales como anemia, hipercalcemia, insuficiencia renal, anión gap reducido, proteína monoclonal en sangre y cadenas ligeras en orina. Cuando la proteinuria es > 3,5 g/24h se la define como de rango nefrótico [14]. La proteinuria 0,5 g/24h en pacientes con patología renal es un factor de riesgo para complicaciones cardiovasculares y/o progresión de la enfermedad renal y es un marcador de primer orden para evaluar la respuesta a los tratamientos empleados para frenar la progresión hacia la insuficiencia renal. En pacientes diabéticos la presencia de microalbuminuria es indicativo de nefropatía diabética incipiente [15] [16].
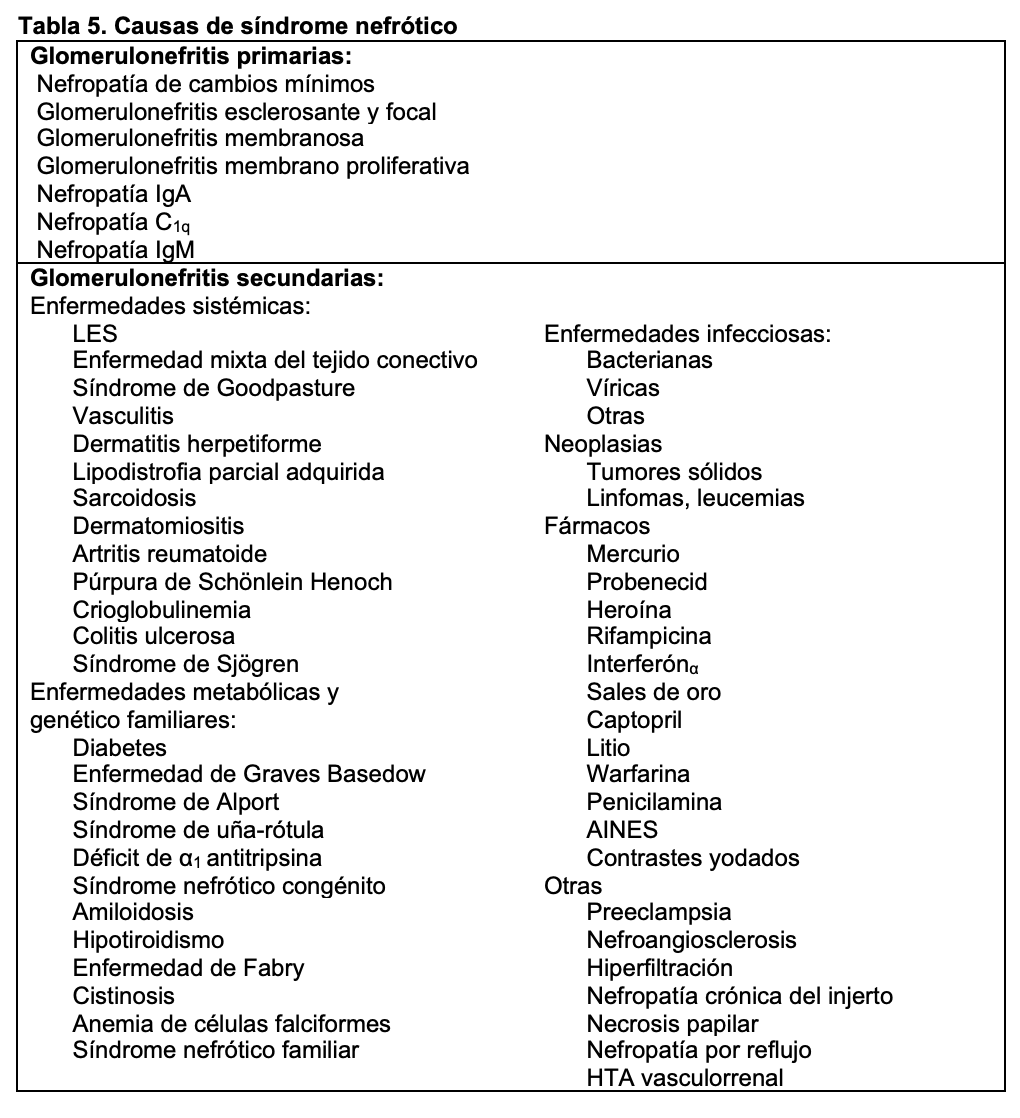
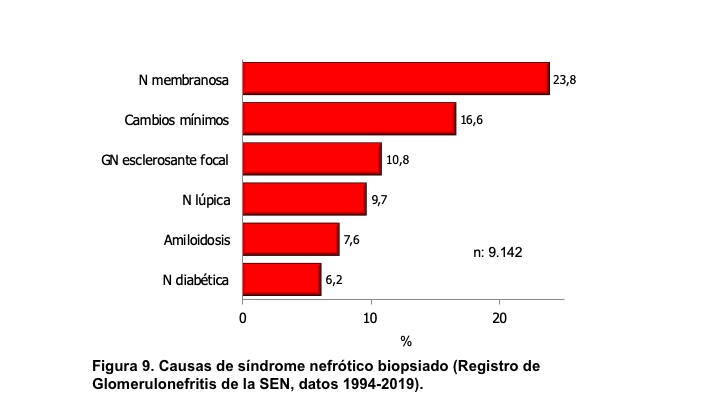
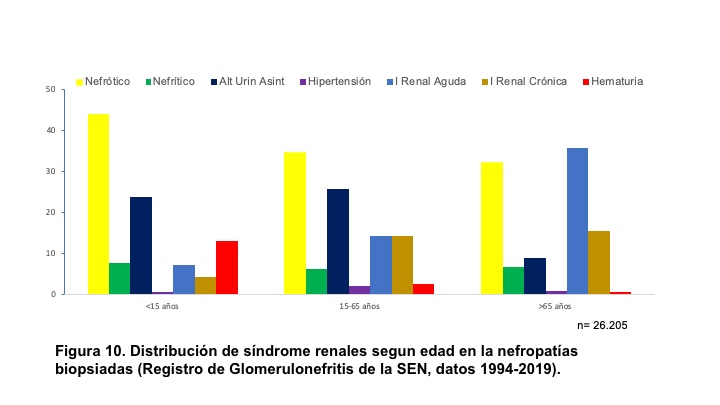
SÍNDROME NEFRÓTICO.El síndrome nefrótico se define como la presencia de proteinuria > 3,5 g/24h/1,73 m2 de superficie corporal (sc) en adultos o bien cociente en orina proteínas/creatinina generalmente > 3; en niños se define como > 40 mg/hora/m2 sc. Se acompaña de hipoalbuminemia, edemas e hiperlipemia. Si se ha determinado microalbuminuria el valor para considerar síndrome nefrótico es > 2200 mg/24h o el cociente albúmina/creatinina en muestra aislada de orina es > 2220 mg/g (>220 mg/mmol) [17]. El síndrome nefrótico está producido por un aumento de la permeabilidad renal para las proteínas y es expresión de una alteración de la barrera de filtración glomerular. Aunque puede aparecer tras lesiones funcionales o estructurales de las células endoteliales y de la membrana basal, en la mayoría de las ocasiones existen lesiones de los podocitos que forman parte de la capa visceral de la cápsula de Bowman [18]. Las causas del síndrome nefrótico, en general, se indican en la (Tabla 5) y en la (Figura 9) se representan sus causas cuando se realiza biopsia renal, según los datos del Registro Español de Glomerulonefritis [19]. De hecho, es el síndrome clínico mas frecuente que indica la realización de biopsia renal en edad infantil y adulta, como se indica en la (Figura 10).
Manifestaciones clínicas del síndrome nefrótico.Son las siguientes:
a) Hipoalbuminemia: aparece cuando la capacidad de síntesis hepática se ve superada por las pérdidas urinarias de albúmina y el catabolismo renal.
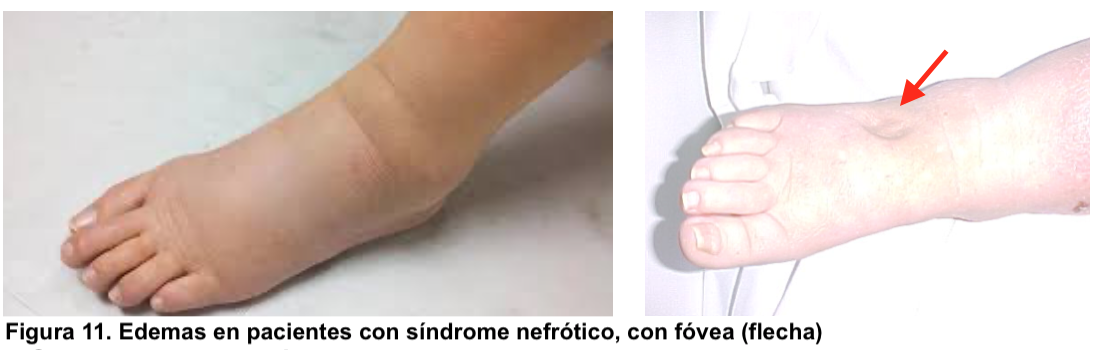
b) Edemas: suelen ser la primera manifestación, aparece en partes blandas (Figura 11) y en los casos graves puede haber ascitis, derrame pleural y anasarca. Es debido a la reabsorción de sodio y agua secundaria a la disminución de la presión oncótica capilar o por aumento de la reabsorción tubular de sodio y agua, posiblemente mediado por el efecto tóxico de la proteinuria sobre las células tubulares.
c) Hiperlipemia como resultado del estímulo de la síntesis hepática de lipoproteínas por el descenso de la presión oncótica capilar, lo que provoca el aumento de los niveles plasmáticos de colesterol total, LDL, VLDL, IDL, lipoproteína A y, menos frecuentemente, hipertrigliceridemia y descenso de HDL. La lipiduria se manifiesta con aparición de cilindros grasos en el sedimento urinario.
d) Pérdida de inmunoglobulinas y de factores del complemento, que conlleva una tendencia especial a la aparición de infecciones (peritonitis bacteriana espontánea, celulitis, infecciones pulmonares, meníngeas y digestivas).
e) Trombosis, con una incidencia entre el 10 y el 40%, que suele aparecer en las venas renales y en los miembros inferiores, provocando trombosis venosa profunda, aunque también pueden afectarse territorios arteriales. Se debe a una situación de hipercoagulabilidad, entre otros factores por la pérdida urinaria de antitrombina III.
f) Hipertensión arterial que aparece en el 42% de los pacientes.
g) Fracaso renal agudo que aparece con más frecuencia en pacientes de edad avanzada, con hipoalbuminemia severa, tratados con IECA, ARA II o tras dosis elevadas de diuréticos [20]. No obstante, la mayoría de los síndromes nefróticos no tienen en su inicio disminución del filtrado glomerular.
Evaluación.Una vez confirmada la existencia de síndrome nefrótico es fundamental la realización de una historia clínica y una exploración física completa. Hay que determinar la posible existencia de diabetes mellitus, enfermedades sistémicas, lupus eritematoso sistémico, enfermedades víricas (hepatopatías, infección por VIH) o toma de fármacos como antiinflamatorios no esteroideos. Se debe realizar estudio serológico completo que incluya ANA, anti-DNA, complemento, crioglobulinas, hormonas tiroideas, proteinograma y serología de virus B, C y VIH. La biopsia renal está indicada en el paciente adulto, excepto en diabéticos en los que no se sospeche otra enfermedad distinta de nefropatía diabética o en pacientes con amiloidosis confirmada en otros tejidos como grasa subcutánea o en el recto [4]. En niños con síndrome nefrótico, en principio no está indicada la realización de biopsia renal (el 90% de los casos se debe a nefropatía de cambios mínimos), salvo casos de síndrome nefrótico corticorresistente o con recidivas frecuentes [21]. Cuando la proteinuria es claramente nefrótica pero no se acompaña de hipoalbuminemia ni edemas, lo más probable es la denominada nefropatía por hiperfiltración, secundaria a varias situaciones de daño glomerular no inmunológico: obesidad, disminución de masa renal y reflujo vesicoureteral, entre las más importantes [22].
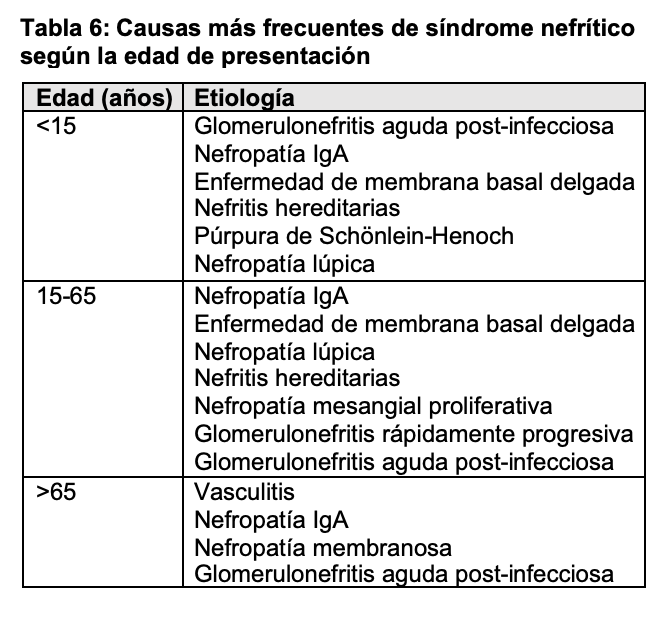
SÍNDROME NEFRÍTICO.El síndrome nefrítico se caracteriza por edemas, oliguria, proteinuria en grado variable en general no nefrótica, hematuria (con cilindros hemáticos y/o hematíes dismórficos en el sedimento urinario), disminución del filtrado glomerular e hipertensión arterial, normalmente de instauración rápida (en pocos días). Típicamente se ha asociado a la forma de presentación de la glomerulonefritis aguda post infecciosa, sobre todo asociada a infecciones estreptocócicas, pero también puede aparecer en otras entidades (Tabla 6).
Clínica.Aparece como macrohematuria en el 30-50% de los casos, con datos de hematuria de origen glomerular. En la glomerulonefritis aguda post-estreptocócica (el germen suele ser el estreptococo ß-hemolítico de grupo A) el síndrome nefrítico más o menos completo aparece a las 2-3 semanas de una faringoamigdalitis o 4-6 semanas después de una infección cutánea. La hipertensión arterial suele ser moderada y los edemas aparecen en párpados y extremidades inferiores. En algunos casos puede producirse insuficiencia cardiaca congestiva por retención hidrosalina. La proteinuria suele oscilar entre 1 y 2 g/24h.
Evaluación.Es fundamental la realización de una historia clínica completa, interrogando sobre antecedentes familiares, clínica sistémica, infección reciente o empleo de fármacos. En la exploración física valoraremos la presencia de edemas, hipertensión arterial o datos de insuficiencia cardiaca. La ausencia de clínica sistémica, el antecedente de infección, la hipocomplementemia por activación de la vía alterna del complemento y títulos elevados de anticuerpos antiestreptolisina O (ASLO), establecen el diagnóstico de glomerulonefritis aguda postinfecciosa. La biopsia renal estaría indicada si existiera algún dato que planteara dudas diagnósticas o si existe insuficiencia renal progresiva. Si se sospecha otro tipo de infecciones o existe clínica sistémica, estaría justificado el estudio serológico, realización de cultivos, pruebas de imagen, estudio de autoanticuerpos o inmunoglobulinas para intentar determinar la etiología del síndrome nefrítico [21].
HIPERTENSIÓN ARTERIAL.Véase Hipertensión Arterial esencial
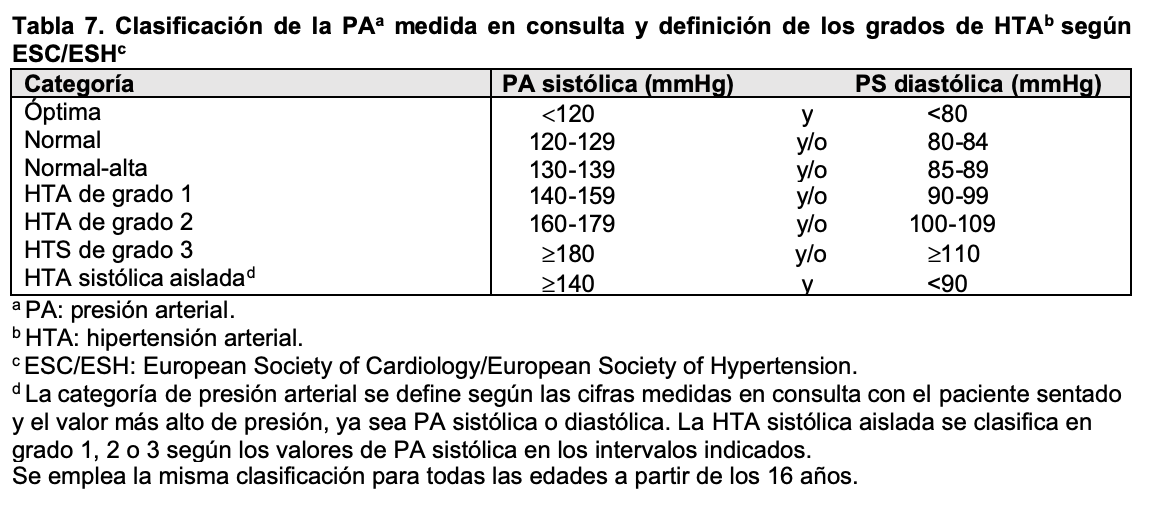
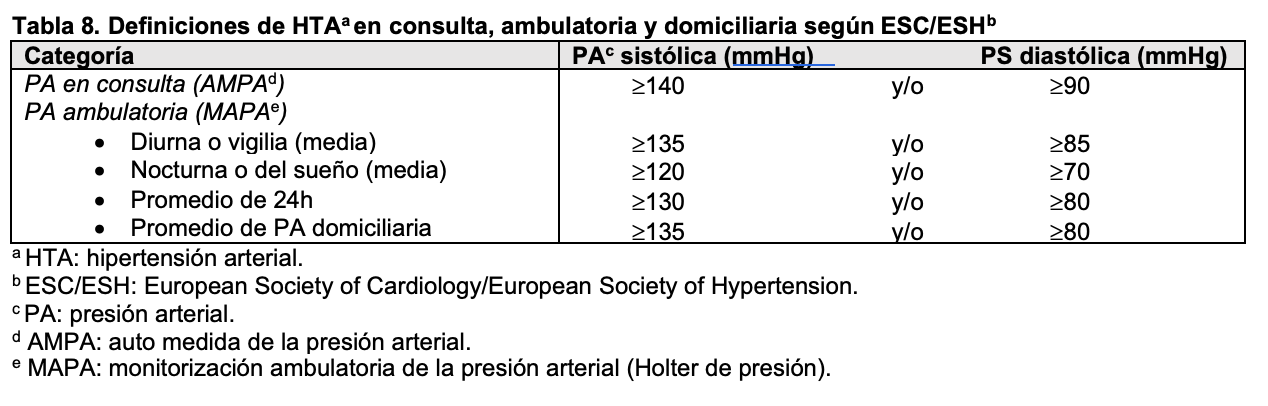
Aunque la principal causa de hipertensión arterial en pacientes adultos y ancianos es de origen esencial, muchas nefropatías, especialmente las de origen glomerular o vascular, cursan con cifras de presión arterial elevadas. En estos casos se suele acompañar de proteinuria, alteraciones en el sedimento urinario y en casos graves disminución del filtrado glomerular. Según las guías más recientes, elaboradas en 2018 por el Grupo de Trabajo de la European Society of Cardiology (ESC) y la European Society of Hypertension (ESH), la hipertensión se define como una presión sistólica ¿140 mmHg o una presión diastólica > 90 mmHg medidas en la consulta médica, tanto para jóvenes, adultos de mediana edad y ancianos [23] [24] mientras que se adoptan otros criterios basados en percentiles para niños y adolescentes [25]. Las Guías americanas, aunque con algunas diferencias, coinciden en la mayoría de los objetivos del control tensional [26]. En las (Tabla 7) y (Tabla 8) se indican los valores establecidos en estas recomendaciones, tanto en consulta como en registros ambulatorios. En pacientes diabéticos o con enfermedad renal crónica las cifras deben ser inferiores a 130/80 mmHg para prevenir complicaciones cardiovasculares y retrasar la necesidad de tratamiento renal sustitutivo [26] [27] [28].
FRACASO RENAL AGUDO.Véase Insuficiencia Renal Aguda
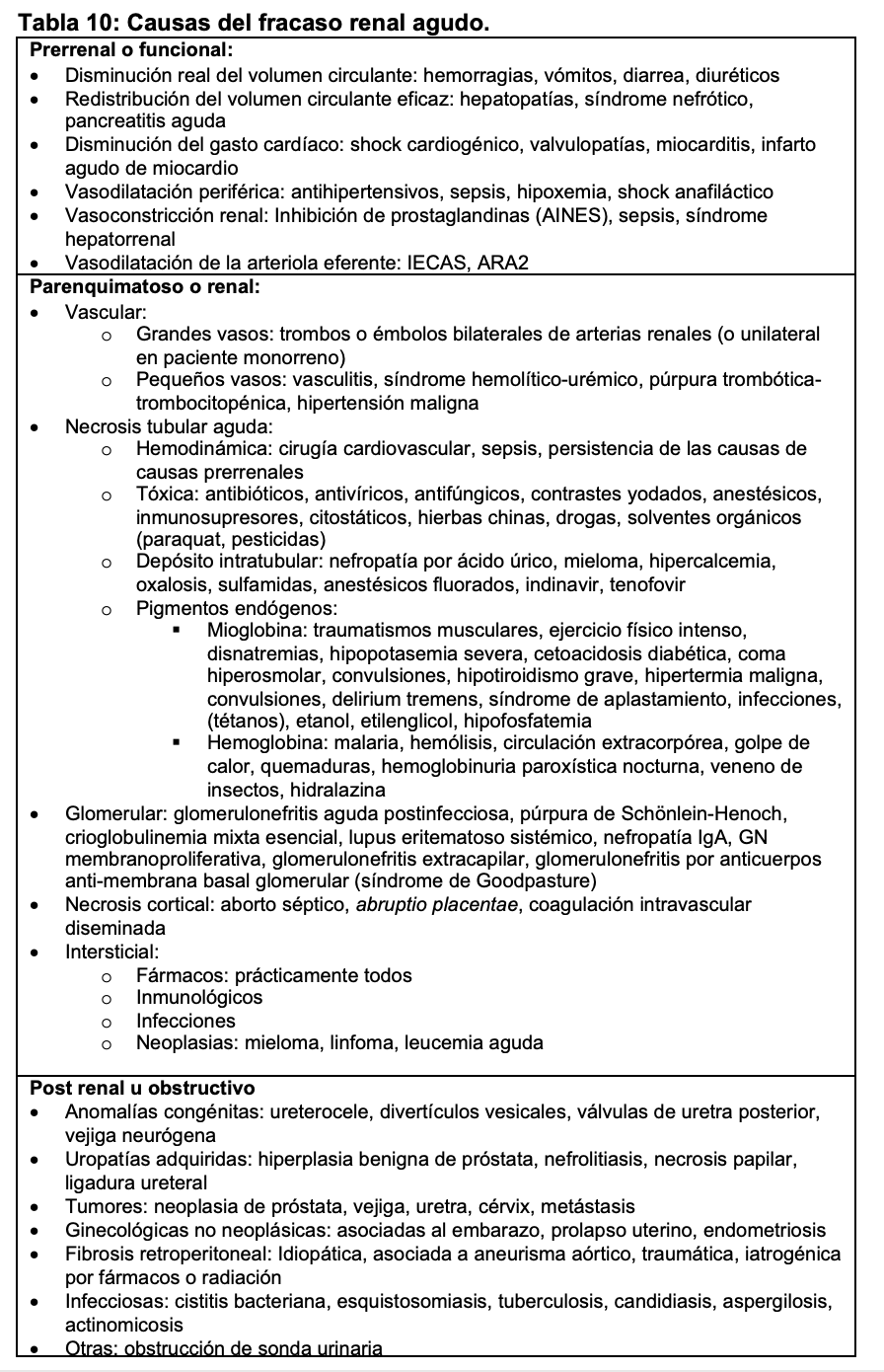
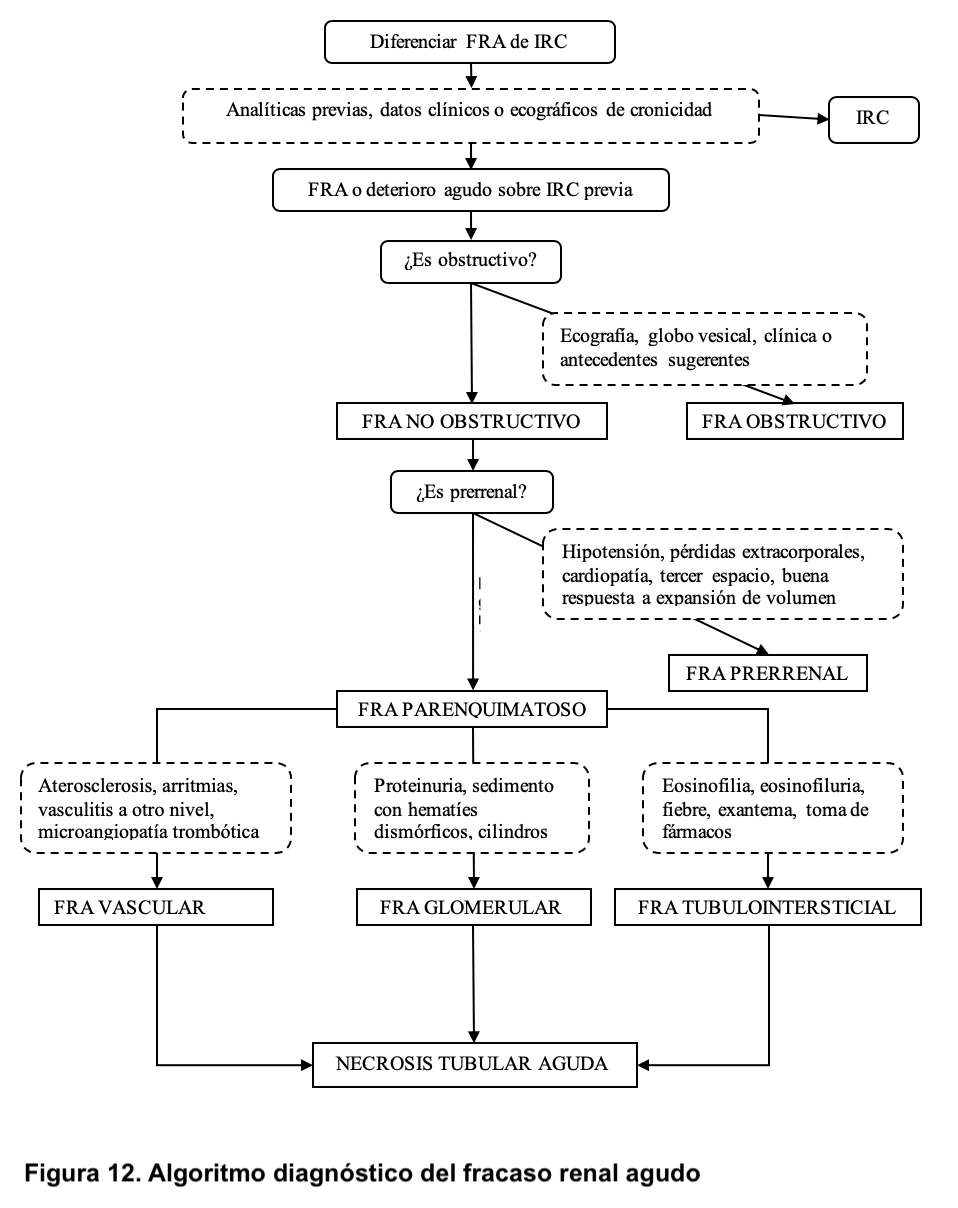
El fracaso renal agudo o insuficiencia renal aguda es un síndrome clínico secundario a múltiples etiologías, en el que aparece deterioro brusco de las funciones renales basales que, a su vez, alteran la homeostasis del organismo. La definición más aceptada y reciente es la establecida por las guías Kidney Disease Improving Global Outcomes (KDIGO) como se indica en la (Tabla 9) basada en la disminución aguda del filtrado glomerular [29]. No todos los pacientes tienen disminución de la diuresis, ya que, dependiendo de la causa se puede mantener o incluso estar aumentada. Se considera oliguria cuando la diuresis es inferior a 400 ml/24h y oligoanuria si fuera inferior a 100 ml/24h. Desde el punto de vista fisiopatológico, el fracaso renal agudo puede ser prerrenal (alteración en la perfusión renal), renal o parenquimatoso (cuando se alteran estructuras renales) o postrenal u obstructivo (si existe una obstrucción en el flujo urinario) (Tabla 10). Además, existe una variante denominada insuficiencia renal subaguda cuando el deterioro se produce en un periodo de tiempo más largo, días o semanas, habitualmente provocado por procesos inflamatorios parenquimatosos como glomerulonefritis proliferativas extracapilares y vasculitis renales, entre las causas más frecuentes (Figura 12).
ENFERMEDAD RENAL CRÓNICA.Véase Enfermedad Renal Crónica
La enfermedad renal crónica se define como las alteraciones funcionales y/o estructurales del riñón, persistentes durante más de 3 meses, que pueden acompañarse o no de descenso en el filtrado glomerular. Hay que diferenciar los términos ¿enfermedad renal¿ e ¿insuficiencia renal¿. El primero indica que existe alguna alteración clínica o analítica y el segundo define la disminución del filtrado glomerular en valores < 60 ml/min/1,73 m2sc en adultos. Es decir, se puede tener una enfermedad renal sin insuficiencia renal. Las causas más frecuentes son la nefropatía diabética, la nefroangiosclerosis asociada a hipertensión arterial y las enfermedades glomerulares. Los criterios diagnósticos de enfermedad renal crónica, también establecidos por la KDIGO, se indican en la (Tabla 11). Se clasifica en 5 categorías basadas en la medida del filtrado glomerular y la intensidad de la microalbuminuria (Tabla 12) y (Tabla 4) [17]. En el año 2014 se publicaron dos actualizaciones en nuestro país: la primera es un documento de la Sociedad Española de Nefrología sobre las guías KDIGO para la evaluación y tratamiento de la enfermedad renal crónica [30] y la segunda es un consenso de varias sociedades científicas para la optimización del manejo de los pacientes con enfermedades renales sobre la evaluación y el tratamiento de la enfermedad renal crónica [31].
TUBULOPATÍASVéase Tubulopatías
Las tubulopatías son una serie de alteraciones clínicas en las que existe una disfunción tubular específica. La afectación glomerular suele ser nula o escasa al inicio, aunque puede aparecer en estadios avanzados. Las presentaciones clínicas aparecen en la infancia o en edades jóvenes y son inespecíficas como astenia, anorexia, alteraciones digestivas o irritabilidad. Se diagnostican mediante una exhaustiva anamnesis, exploración física y análisis de sangre y orina. Se dividen en: simples o complejas, según se afecte uno o varios parámetros, y en primarias o secundarias según su origen. Las primeras suelen ser hereditarias, mientras que las segundas son adquiridas y aparecen en el transcurso de otras enfermedades o por la administración de tóxicos [32] [33]. Suelen manifestarse por alteraciones electrolíticas (Na, K, Cl, Ca, P y Mg entre los mas importantes), alteraciones de los niveles de ácido úrico, PTH y vitamina D y trastornos del equilibrio ácido-base (acidosis o alcalosis metabólicas), la mayoría de ellas son hereditarias y se manifiestan en la infancia o edad juvenil [34]. En la (Tabla 13) se indica la clasificación de las tubulopatías según su origen [35].
INFECCIONES URINARIAS.Véase Infecciones del tracto urinario
Se define infección del tracto urinario como la combinación de manifestaciones clínicas (disuria, polaquiuria, tenesmo entre las más frecuentes) y la presencia de bacteriuria. Nuevamente las tiras reactivas (Figura 4) son muy útiles pues en presencia de infección urinaria se detectan nitritos y leucocitos en la mayoría de los casos. Se debe diferenciar de la bacteriuria asintomática donde no hay clínica miccional. Afectan a los hombres y mujeres de todas las edades, son una causa común de morbilidad y pueden conducir a una mortalidad significativa. La mayoría de las infecciones urinarias están causadas por bacterias anaerobias facultativas que, generalmente, proceden de la flora intestinal. La bacteria E. Coli, es la causa más frecuente de infección del tracto urinario, estando involucrada hasta en el 85% de las infecciones adquiridas en la comunidad y en el 50% de las hospitalarias [36]. Suelen cursar con disuria, tenesmo, hematuria, polaquiuria (clínica típica de las cistitis) y en casos más graves fiebre, escalofríos, dolor lumbar e incluso sepsis de origen urinario (pielonefritis) [37] [38] [39] [40] [41].