Nutrición en el Trasplante Renal
INTRODUCCIÓN
El trasplante renal continúa siendo la mejor opción de terapia renal sustitutiva (TSR) para la mayoría de los pacientes, ya que ofrece una calidad de vida superior y disminuye los riesgos de morbimortalidad en comparación con la diálisis [1]. Los procesos inflamatorios que experimentan estos pacientes provocan modificaciones en su estado nutricional, agravando la situación funcional y alimentaria previa al trasplante. Así, aunque la condición nutricional no constituye una contraindicación absoluta, su impacto en la morbimortalidad la convierte en un objetivo médico fundamental para optimizar la evolución de los pacientes. El propio procedimiento quirúrgico y las posibles complicaciones del postrasplante inmediato intensifican el estado hipercatabólico característico de la Enfermedad Renal Crónica (ERC).
Desde el punto de vista nutricional, el trasplante vuelve a presentar ventajas sobre la diálisis al mejorar el apetito y mejoría del sabor de los alimentos, así como otros síntomas asociados a la uremia que afectan la ingesta, lo que proporciona mayor libertad en las elecciones alimentarias. Sin embargo, estos beneficios suelen verse acompañados de nuevos desafíos, por lo que la planificación, el control y la reevaluación del estado nutricional constituyen aspectos esenciales y con frecuencia, subestimados en la atención del paciente [2].
La presencia de malnutrición previa al trasplante renal puede llevar a una disminución en la supervivencia del trasplante y una mejor funcionalidad del paciente previo al trasplante puede mejorar la supervivencia del injerto [3]. No obstante, pese a que se reconoce la malnutrición como un factor de riesgo para la morbimortalidad, la ausencia de criterios diagnósticos consensuados dificulta su identificación en la práctica clínica diaria. Del mismo modo, comprender los cambios nutricionales permite llevar a cabo estrategias dieto-terapéuticas enfocadas a prolongar la supervivencia y mejorar la calidad de vida de los pacientes. La individualización de la dieta durante el postrasplante renal inmediato, sumada a estrategias de suplementación nutricional, promueve la recuperación de los pacientes.
Las principales guías de nefrología Kidney Disease Improving Global Outcomes (KDIGO) [4] y Kidney Disease Outcomes Quality Initiative (KDOQI) [5] presentan, de forma distinta y poco pormenorizada, las estrategias generales relacionadas con el manejo nutricional en los trasplantados renales. Aun así, coinciden en varios puntos esenciales, como la necesidad de una evaluación nutricional continua, la prevención de la obesidad y la gestión integral, multidisciplinar e individualizada del proceso específico de cada trasplante.
A diferencia de KDIGO y KDOQI, la European Society for Organ Transplantation (ESOT) [6], ofrece pautas nutricionales más detalladas y actualizadas, enfatizando patrones de alimentación saludables, un riguroso control de micronutrientes, la distribución de macronutrientes y las recomendaciones de sodio. Además, integra la visión de la atención nutricional como un factor decisivo para prolongar la supervivencia del injerto y la salud global del paciente a largo plazo, incidiendo en la prevención del síndrome metabólico, la diabetes postrasplante (NODAT) y las complicaciones cardiovasculares. También refuerza la necesidad de un abordaje multidisciplinario, en el que se incluyan dietistas que realicen intervenciones individualizadas y adaptadas a cada paciente.
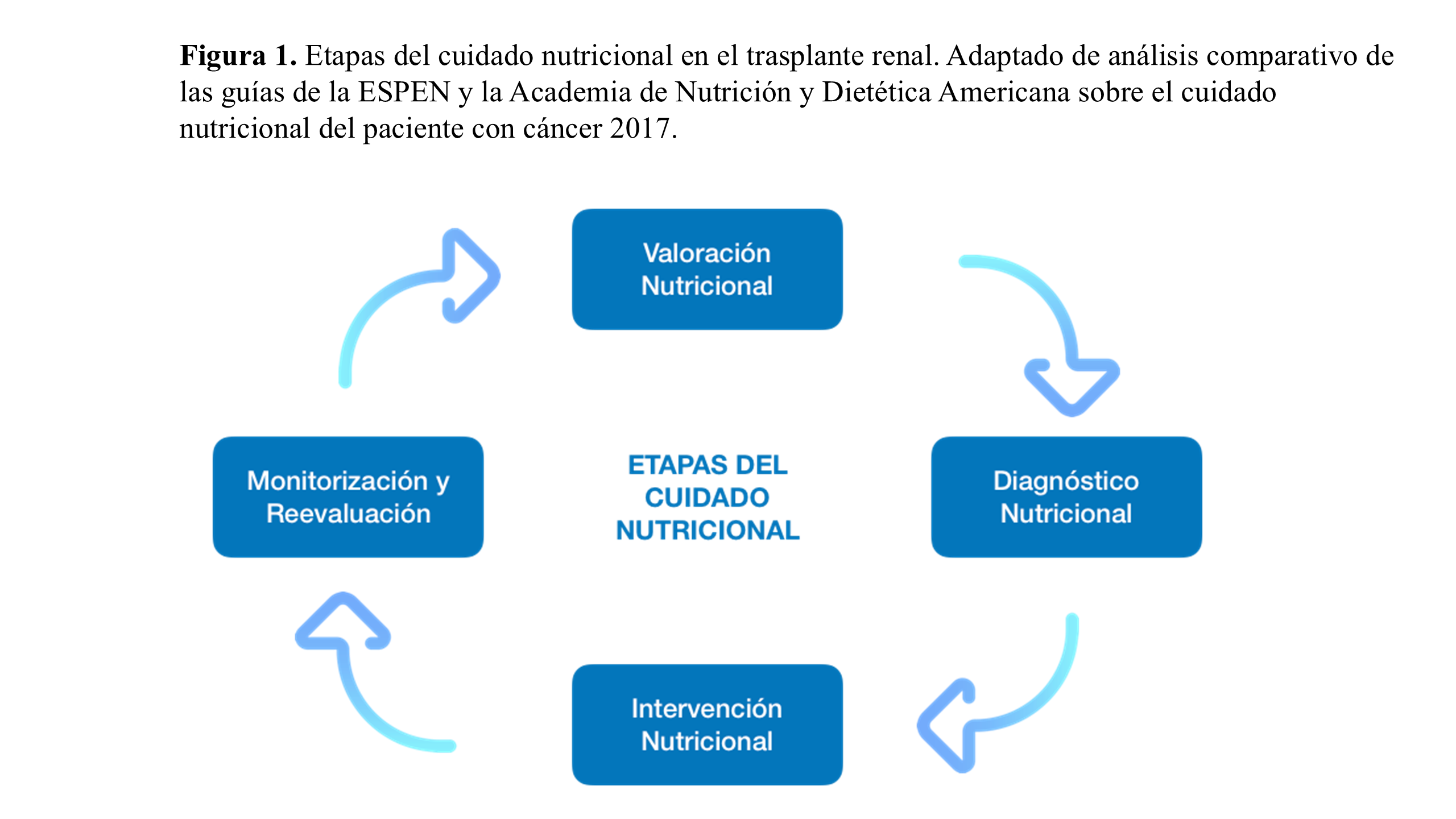
Por lo tanto, resulta vital el desarrollo de estrategias de valoración, diagnóstico, intervención y reevaluación en etapas específicas del proceso de trasplante (Figura 1): peritrasplante, fase de mantenimiento y durante la fase final de vuelta a diálisis. Más aún, se recomienda implementar estas mismas estrategias en el periodo pretrasplante, vinculadas a la prehabilitación global del paciente, de modo que acceda al trasplante en las condiciones más favorables posibles para asegurar mejores resultados.
Por último, existen dos áreas emergentes en las que la nutrición puede repercutir en la atención y el pronóstico del receptor de trasplante. Por un lado, se investiga cómo la dieta influye en la disglucemia posterior al trasplante; por otro, se explora de qué manera la dieta puede modular la microbiota intestinal, afectando las respuestas inmunitarias, el metabolismo, la obesidad y el riesgo metabólico.
EVALUACIÓN
La evaluación del estado nutricional es un componente importante, aunque frecuentemente pasado por alto, de la evaluación del candidato a trasplante [4]. La evaluación del estado nutricional actual y la predicción del riesgo metabólico postrasplante son elementos clave que ayudan a informar sobre la aptitud para la cirugía y la recuperación de la cirugía bajo la influencia de la inmunosupresión y el riesgo cardio-metabólico a largo plazo.
Las estrategias de valoración, diagnóstico y reevaluación se desarrollan en los capítulos previos de forma conjunta para la ERC, por lo que en este capítulo nos centraremos en los aspectos relacionados con la intervención. Sin embargo, hay que continuar avanzando en el uso de nuevas herramientas como la ecografía que se está posicionando en los últimos años como un elemento clave en la valoración de nuestros pacientes [7].
INTERVENCION
La malnutrición abarca los problemas derivados tanto del déficit de nutrientes como aquellos derivados de una ingesta excesiva. Por un lado, la desnutrición aumenta el riesgo de fragilidad y sarcopenia de los pacientes y empeora su evolución ante las diferentes complicaciones. El síndrome metabólico y la obesidad, relacionadas con el uso de la medicación inmunosupresora, predisponen a aumentar las complicaciones cardiovasculares. Controlar el estado nutricional de nuestros pacientes exige una valoración integral de estos diferentes aspectos de malnutrición.
Sin embargo, en este sentido es importante diferenciar las diferentes etapas del trasplante. A continuación, se desarrollarán las diferentes estrategias individualizadas para cada etapa del trasplante en cuanto a la intervención nutricional.
ETAPA PRETRASPLANTE
El apoyo nutricional, junto con las terapias médicas, se recomienda para intentar corregir la desnutrición antes del trasplante. Si bien esta práctica se basa más en consideraciones intuitivas que en evidencia científica, sería difícil generar evidencia sólida dado que un ensayo aleatorio en candidatos desnutridos plantearía objeciones éticas. Además, los pacientes con enfermedades renales vinculadas a la desnutrición, como el síndrome nefrótico, y aquellos con comorbilidades asociadas, como la malabsorción intestinal, requieren una evaluación y un manejo nutricional específicos tanto antes como después del trasplante.
La obesidad es bastante más frecuente que la desnutrición en la mayoría de los programas de trasplante y se asocia con resultados posquirúrgicos negativos [8]. Es habitual que los candidatos obesos presenten características del síndrome metabólico que pueden aumentar su riesgo después del trasplante, lo que exige tanto investigación como intervenciones nutricionales [9]. Además de medir el índice de masa corporal, la determinación de la circunferencia de la cintura puede brindar un indicador más preciso de la adiposidad central. De acuerdo con las directrices de KDIGO sobre la evaluación de los candidatos, la obesidad por sí sola no debería considerarse una contraindicación absoluta para el trasplante de riñón (Grado 2B); sin embargo, se recomienda identificar a los candidatos con obesidad y ofrecerles estrategias de pérdida de peso antes del trasplante (Grado 2D) [4]. Esta recomendación refleja la escasez de datos concluyentes sobre los beneficios y posibles perjuicios de intentar perder peso antes del trasplante. Actualmente, existen estudios en curso que analizan dieta, ejercicio, cirugía bariátrica y combinaciones de estos enfoques. En nuestra opinión, todos los candidatos obesos deben someterse a una valoración dietética exhaustiva y a asesoramiento nutricional para restringir la ingesta calórica, junto con ejercicio. En caso de practicar cirugía bariátrica, se aconseja que sea coordinada con un nutricionista antes y después de la operación, y también tras el trasplante, para asegurar una reducción de peso segura y sostenida.
La determinación de lípidos en ayunas podría ayudar a estimar el riesgo cardiovascular postrasplante, si bien la evidencia sobre esta práctica es limitada. El uso de una prueba de tolerancia oral a la glucosa de 75 g antes del trasplante, conforme a las recomendaciones de la Asociación Estadounidense de Diabetes (ADA) y de KDIGO, constituye una herramienta más confiable para predecir el riesgo de desarrollar diabetes postrasplante [10] y a su vez facilita la implementación de estrategias preventivas de dieta, ejercicio y medicación, tal como sugieren las pautas de KDIGO [4].
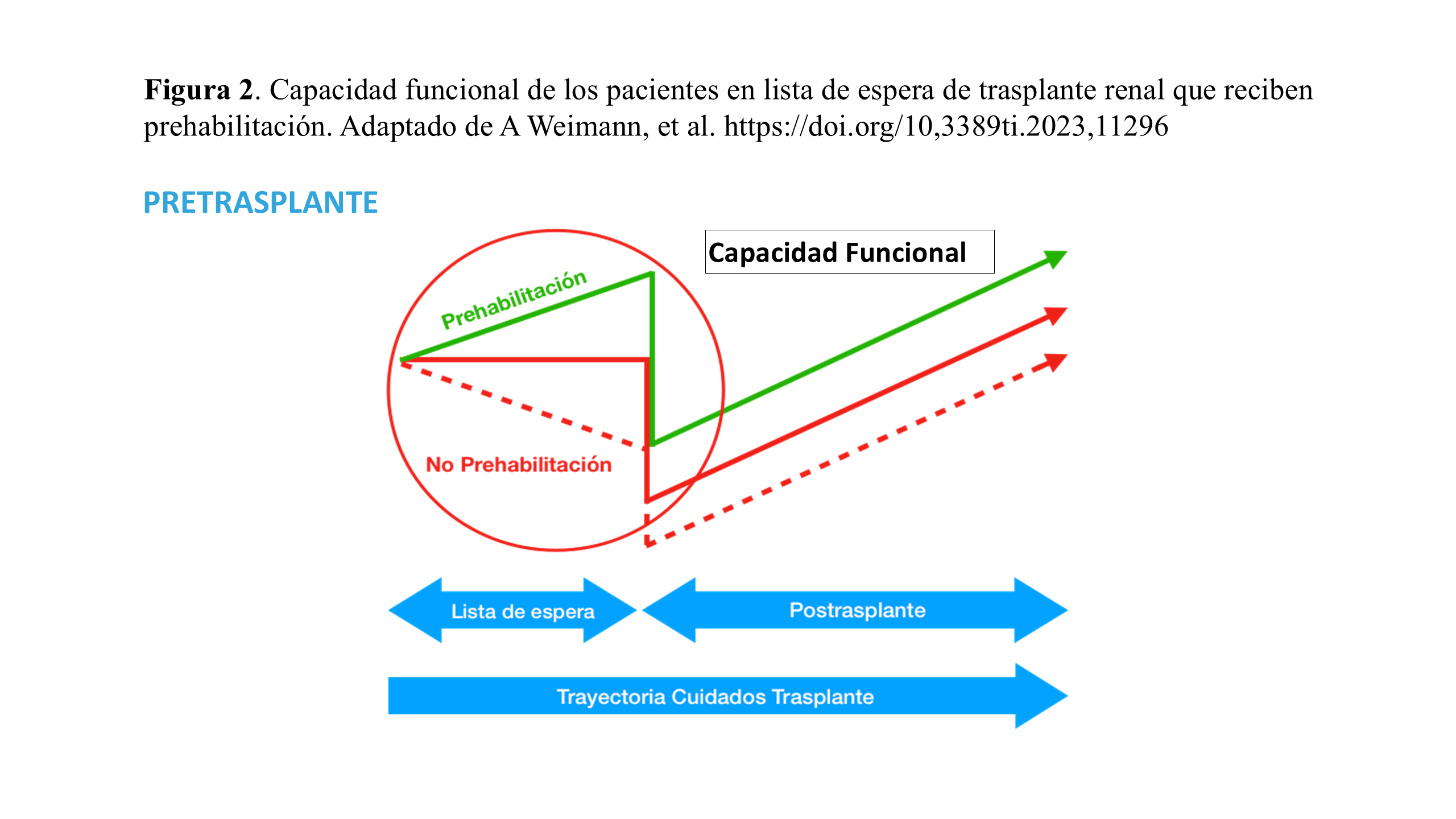
La prehabilitación debe implementarse como una nueva estrategia para el acondicionamiento preoperatorio de los pacientes de mayor riesgo (Figura 2). Las estrategias de prehabilitación están enfocadas a la mejoría del estado físico, psíquico y nutricional de los pacientes que están en lista de espera de trasplante renal. Para evaluar el estado nutricional, se pueden utilizar breves formularios de evaluación global subjetiva generada por el paciente (PG-SGA SF) y recoger un diario de alimentos durante 3 días. Además, se puede medir la relación cintura-cadera y el índice de masa corporal (IMC) del participante. Otra herramienta útil en este tipo de valoración es el uso de la bioimpedancia (BIA) [11]. Las intervenciones nutricionales se centrarán en mejorar el estado nutricional y la composición corporal ayudando a los participantes a adoptar hábitos alimentarios saludables y sostenibles. La intervención se adaptará para optimizar y prevenir la escasez o los desequilibrios de energía, proteínas u otros nutrientes para todos los participantes.
POSTRASPLANTE INMEDIATO
Durante los primeros 1 a 2 meses posteriores al trasplante, la atención nutricional se orienta a facilitar la recuperación quirúrgica, la cicatrización de heridas, la movilización, la corrección de la anemia y el manejo de complicaciones agudas, como infecciones y diarrea, además de las reacciones adversas asociadas a los fármacos inmunosupresores. Los enfoques dietéticos para hacer frente a las mayores necesidades de nutrientes derivadas del estrés quirúrgico, la infección y el proceso de cicatrización se centran en asegurar una ingesta adecuada de proteínas a través de lácteos bajos en grasa, carnes magras, pescados, legumbres o frutos secos. Se procura evitar el balance de nitrógeno negativo, ya que puede ocasionar retrasos en la cicatrización, pérdida de masa muscular, desacondicionamiento y un deterioro de la función inmunológica. A menudo se recomienda una dieta rica en proteínas (1,2-1,4 g/kg/día) y con un alto aporte energético (35 kcal/kg/día) para lograr un balance de nitrógeno neutro o positivo, sobre todo en pacientes que evidencian desnutrición o fragilidad antes del trasplante [12]. Con frecuencia, se requiere complementar la dieta con fosfato y magnesio para compensar las pérdidas inducidas por los inmunosupresores [13]. Aumentar la ingesta de alimentos ricos en fosfato y magnesio, como los productos lácteos, suele ser preferible a la incorporación de más comprimidos, los cuales son costosos, suelen tolerarse mal y aumentan el riesgo de incumplimiento.
La disglucemia, es casi universal en las semanas iniciales tras el trasplante. El proceso inflamatorio posquirúrgico y las altas dosis de inmunosupresores promueven la resistencia a la insulina y en particular con tacrolimus, la disminución de su producción [14]. Además, la presencia de un injerto renal funcional mejora la depuración de insulina [15]. Equilibrar el incremento de requerimientos calóricos para favorecer la recuperación quirúrgica, con la necesidad de restringir los azúcares simples exige, por lo general, el consejo dietético debe ir enfocado hacia el consumo de carbohidratos de bajo índice glucémico y ricos en fibra como cereales integrales, legumbres, frutas, y verduras sin almidón, asegurar consumo de proteínas a través de carnes magras, pescado, legumbres y lácteos bajos en grasa; también es conveniente que las grasas provengan de fuentes mono o poliinsaturadas a través de aceite de oliva, aguacate, pescados azules y frutos secos. Dada la frecuencia con que se requiere insulina, es fundamental la estrecha coordinación entre médicos y nutricionistas. Entender las oscilaciones glucémicas, que suelen alcanzar su máximo posprandial por la tarde, resulta esencial para orientar el momento de la ingesta de alimentos y la administración de hipoglucemiantes. Para ello, se recomienda un control frecuente de la glucemia o, cada vez más, el uso de sistemas de monitorización continua, que contribuyen a guiar el manejo de manera más precisa [16].
Los aminoácidos esenciales podrían ser beneficiosos en pacientes trasplantados renales, favoreciendo la cicatrización de heridas, la recuperación nutricional y la respuesta inmunológica. En nuestro grupo hemos apostado desde hace algunos años por la introducción de los aminoácidos esenciales en el protocolo del postrasplante inmediato, observando resultados prometedores en cuanto a recuperación nutricional y funcional al compararse con el grupo de trasplantados previos (datos no publicados). De hecho, existen ensayos clínicos como el ESSENTIAL trial donde se intenta demostrar la potencial protección en cuanto a fracaso renal agudo en pacientes no trasplantados, pero con riesgo elevado [17]. Existen estudios en ERC donde se demuestra la posibilidad de retrasar la entrada en diálisis con dietas bajas en proteínas y suplementadas con cetoanálogos [18]. Además, algunos autores destacan sus mejoras en la masa muscular con este tipo de suplementos [19]. No obstante, otros estudios reportan resultados contradictorios, señalando que la eficacia depende de factores individuales como el estado nutricional y las comorbilidades, por lo que se requiere personalización en el tratamiento y más estudios para obtener conclusiones definitivas.
La información actual disponible no verifica el uso de dietas hipoproteicas suplementadas en pacientes trasplantados, pero nuestros resultados preliminares sugieren profundizar en esta línea de investigación.
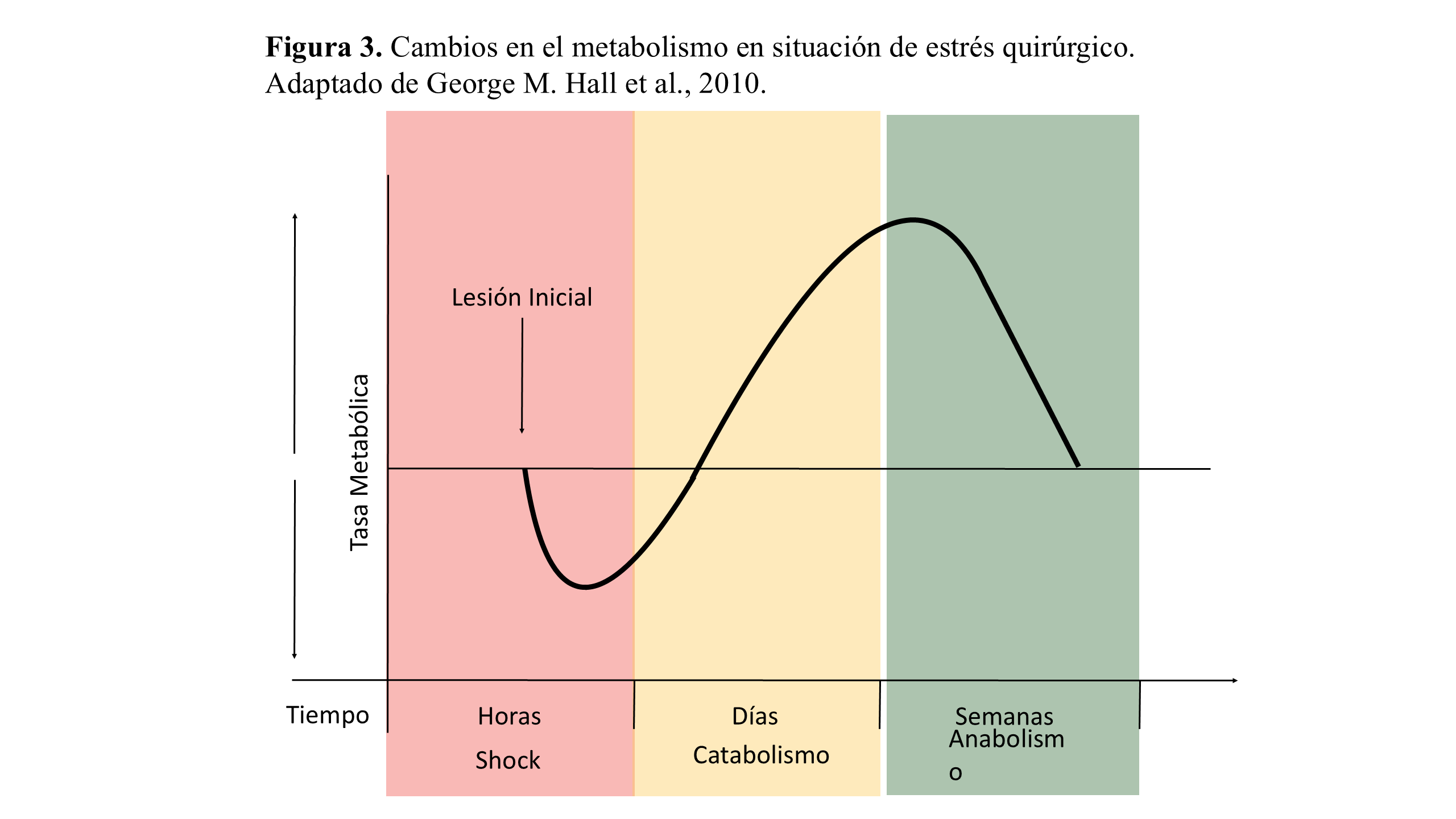
El conjunto de alteraciones hormonales y metabólicas inducidas por el estrés quirúrgico, que condicionan el aumento de los requerimientos nutricionales en el postrasplante inmediato, se representan de forma esquemática en la (Figura 3)
ETAPA DE MANTENIMIENTO
La fase de mantenimiento comienza cuando la función del injerto se estabiliza y la inmunosupresión se reduce gradualmente, en este momento entre un 10-40% de los pacientes presentan diabetes de nueva aparición tras el trasplante también referida en la literatura con su acrónimo en inglés NODAT (New Onset Diabetes After Trasplantation) [20]. Si se consideran también aquellos con diabetes preexistente, la prevalencia de diabetes postrasplante puede superar el 50% en algunos centros. Aunque los factores de riesgo de NODAT están bien establecidos [14], existe escasa evidencia sobre las intervenciones para prevenirla. Se ha observado que el empleo de ciclosporina en lugar de tacrolimus [21] y la disminución en la exposición total a esteroides reducen la incidencia de NODAT y la necesidad de insulina tras el trasplante; asimismo, se ha identificado que la retirada temprana de esteroides disminuye el requerimiento de insulina, aunque no la prevalencia global de diabetes [22]. Entre los factores de riesgo de NODAT se cuentan los tradicionales de la diabetes tipo 2 (edad avanzada, sexo masculino, etnia, obesidad y antecedentes familiares), junto con otros específicos del trasplante, como los efectos adversos de los inmunosupresores, las infecciones virales posquirúrgicas y la hipomagnesemia. También existen factores de riesgo no modificables, por ejemplo, el desajuste de antígenos leucocitarios humanos, el rechazo agudo, el donante masculino, el donante fallecido y la enfermedad renal poliquística autosómica dominante como causa de ERC [23]. Se ha documentado que una prueba estándar de tolerancia oral a la glucosa, realizada durante la evaluación pretrasplante, predice el riesgo de NODAT [10], lo cual está alineado con lo sugerido por KDIGO [4].
El tipo y la concentración de inmunosupresores varían mucho en la práctica, y se ha estimado que esta variabilidad podría explicar hasta el 74% de la diferencia en la incidencia de NODAT [24]. Diversos estudios respaldan el uso de dosis más bajas de glucocorticosteroides [22], la sustitución de tacrolimus por ciclosporina [21] [24] o la reducción de la exposición a tacrolimus [24] para disminuir la incidencia de NODAT.
La diabetes postrasplante y la intolerancia a la glucosa posterior al trasplante se asocian con un incremento significativo del riesgo de eventos cardiovasculares adversos mayores y de mortalidad de causa cardiovascular [25]. Sin embargo, los datos que muestren si controlar o manejar la disglucemia postrasplante impacta de manera decisiva sobre estos riesgos son muy limitados; dado que se requeriría un ensayo amplio con seguimiento prolongado.
El aumento de peso es un problema frecuente tras el trasplante: se ha registrado un incremento medio de entre el 10% y el 20% durante el primer año postquirúrgico [26]. La obesidad pretrasplante suele agravarse en esta etapa, ya que la mejoría del apetito y la ausencia de las restricciones alimentarias habituales en diálisis suelen traducirse en un incremento del peso. Si bien la obesidad previa al trasplante ha mostrado una fuerte asociación con resultados adversos posteriores [8], la obesidad desarrollada tras el trasplante también conlleva mayores riesgos de complicaciones a corto y largo plazo, incluyendo mayor morbilidad y mortalidad cardiovasculares [27].
Las estrategias para prevenir o controlar la obesidad postrasplante no han sido validadas mediante ensayos clínicos con un sólido nivel de evidencia. Algunos estudios de pequeña escala que combinan dieta y ejercicio han reportado resultados dispares en cuanto a la reducción de peso [28]. La cirugía bariátrica va ganando popularidad, principalmente apoyada en evidencia anecdótica y en la facilidad de acceso a esta opción terapéutica [29]. Aún se desconoce la mejor forma de controlar la obesidad postrasplante, ni qué porcentaje de pérdida de peso puede alcanzarse con miras a la mejora de resultados clínicamente relevantes (supervivencia del injerto y del paciente), lo cual representa una necesidad urgente de investigación multicéntrica.
Respecto a la salud cardiovascular, la evidencia que respalda el papel de la dieta después del trasplante renal, se enmarca principalmente en estudios de nivel III y IV. Las directrices propuestas por KDOQI [5] y CARI guidelines (Caring for Australian and New Zealanders with Kidney Impairment) [30] recomiendan abordajes exhaustivos que incluyan cambios en el estilo de vida y medidas farmacológicas dirigidas a la hipertensión y la dislipidemia. En este sentido, promueven la alimentación saludable, especialmente rica en cereales integrales, de bajo índice glucémico y con un alto contenido de fibra (25 g/día para mujeres y 30 g/día para hombres). Asimismo, se recomienda una dieta de tipo mediterráneo con alto contenido en alimentos de origen vegetal (verduras, hortalizas, frutas, cereales integrales, legumbres y frutos secos), moderado contenido en alimentos de origen animal (carnes magras, pescados, huevos y lácteos) y evitar todo tipo de alimentos ultraprocesados y bebidas alcohólicas. La ingesta de sodio debe restringirse a menos de 100 mmol/día (<2,3 g/día), a través de la reducción de la sal en el cocinado de los alimentos y la limitación de ahumados y salazones, embutidos y fiambres, quesos curados o semicurados, mariscos y crustáceos, encurtidos vegetales, conservas en lata, cubitos de carne o pescado concentrados y alimentos ultraprocesados. Además, el sobrepeso y la obesidad en receptores de trasplante renal exigen medidas orientadas a la reducción de peso.
En los últimos años, ha cobrado importancia el eje intestino-riñón en la ERC, la diabetes y el trasplante renal. La microbiota intestinal que involucra la diversidad, riqueza y composición de bacterias cumple una función esencial en la salud inmunológica, metabólica, renal y cardiovascular. Tras un trasplante de riñón, se registra disbiosis (menor diversidad microbiana y proliferación de patógenos, incluso cepas resistentes a múltiples fármacos), generada principalmente por la polifarmacia, las comorbilidades, el procedimiento quirúrgico y la inmunosupresión, factores que minan la capacidad del receptor para sostener una microbiota equilibrada. Esta disbiosis puede elevar la probabilidad de padecer problemas cardiovasculares, infecciones, alteraciones en el metabolismo de fármacos y una modulación inadecuada de la aloinmunidad [30].
Un estudio realizado en los Países Bajos [31], que incluyó a 594 receptores de trasplante renal, corroboró dichas alteraciones en la microbiota, identificando un incremento de bacterias patógenas como Ruminococcacea, Clostridium y E. coli, junto a una reducción de especies protectoras como Alistipes senegalensis y Bacteroidales sp. Este desequilibrio microbiano favorece procesos proinflamatorios y aumenta la presencia de genes resistentes a antibióticos, hechos relacionados con mayor mortalidad en estos pacientes.
Desde la perspectiva nutricional, la dieta actúa como factor determinante de la microbiota. Un consumo abundante de fibra, prebióticos o probióticos puede reorientar la flora intestinal de manera positiva, con el potencial de mejorar los resultados del trasplante. En modelos de trasplante renal, las dietas basadas en vegetales enriquecidas en fibra han demostrado capacidad para contrarrestar respuestas inmunitarias patológicas y atenuar la aloinmunidad [32].
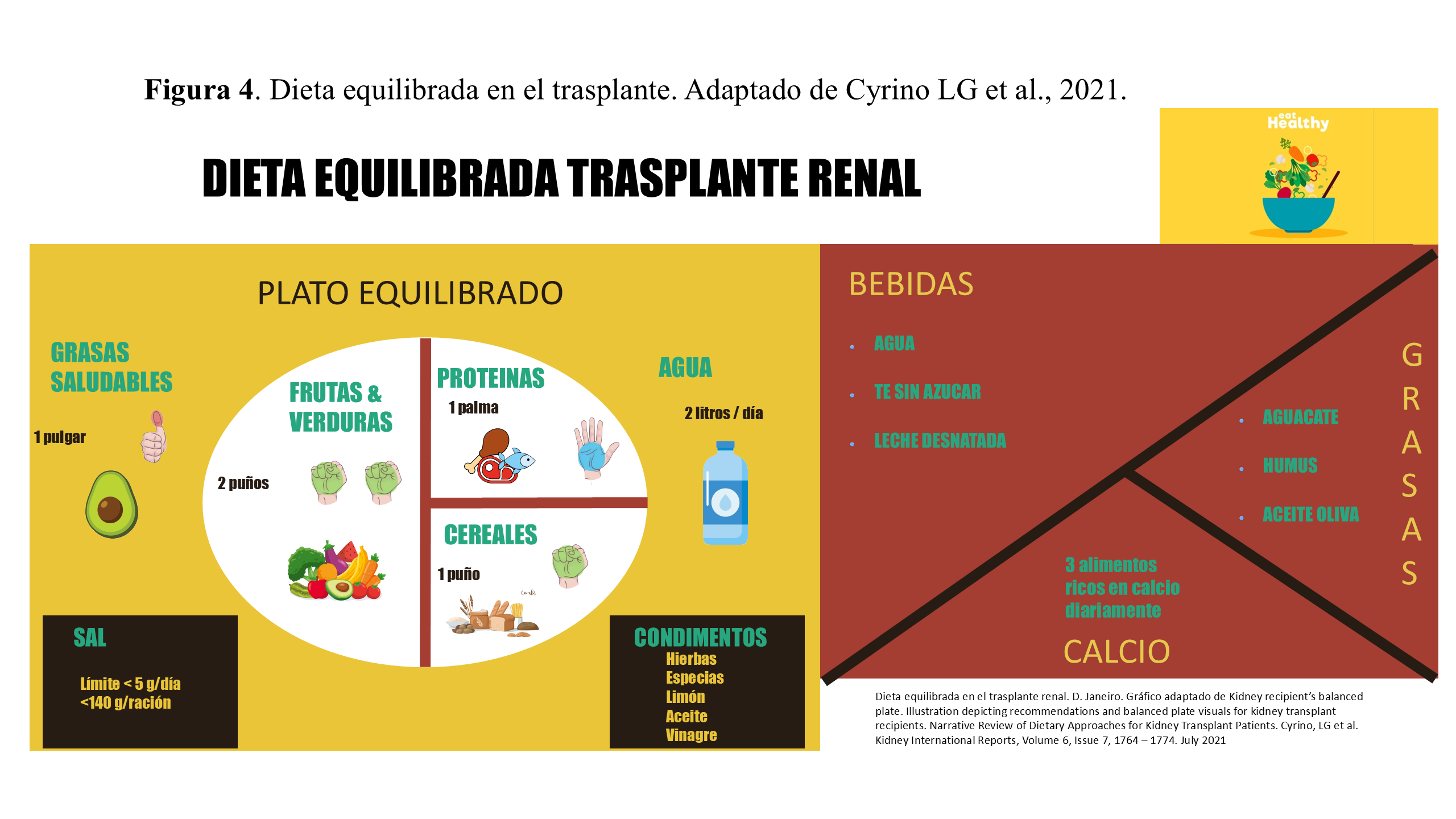
En humanos, las dietas Mediterránea y DASH (Dietary Approaches to Stop Hypertension) [33], son los patrones dietéticos más beneficiosos para los receptores de trasplantes renales debido a su enfoque equilibrado y sus efectos positivos en la salud general y la función del injerto. En lugar de centrarse únicamente en restricciones nutricionales, es crucial adoptar un enfoque holístico que fomente patrones alimenticios sostenibles y adapte las recomendaciones a las necesidades individuales de cada paciente como podemos observar en la (Figura 4).
Por su parte, la ingesta excesiva de carne roja, a causa del metabolismo de la carnitina, genera óxido de trimetilamina, un compuesto relacionado con inflamación, aterosclerosis y fibrosis, factores que exacerban la nefropatía crónica del aloinjerto [34].
Finalmente, se considera el efecto de la creatina, habitual en carnes, pescados y como suplemento. Mientras que la forma de creatina monohidrato no altera de manera significativa los niveles séricos de creatinina, la variante éster etílico sí los eleva debido a su rápida descomposición, lo que podría causar confusiones en la valoración de la función renal. Se aconseja informar a los pacientes sobre estos efectos para evitar diagnósticos erróneos y biopsias innecesarias.
ENFERMEDAD RENAL CRÓNICA AVANZADA EN TRASPLANTE RENAL
Entre el 1% y el 2% de los pacientes con trasplante renal experimentan cada año un fracaso tardío del injerto, habitualmente causado por rechazo crónico. Estos pacientes requieren estrategias dietéticas similares a las indicadas en la enfermedad renal crónica avanzada, lo cual implica moderar la ingesta de proteínas, limitar el consumo de sal y, en casos específicos, evitar el exceso de potasio y fósforo. Otras consideraciones incluyen el apoyo nutricional para tratar la anemia, el control dietético de la diabetes, una ingesta calórica adecuada para quienes pudieran estar desnutridos, así como la atención de la enfermedad ósea renal y la acidosis [4] [5].
CONCLUSIÓN
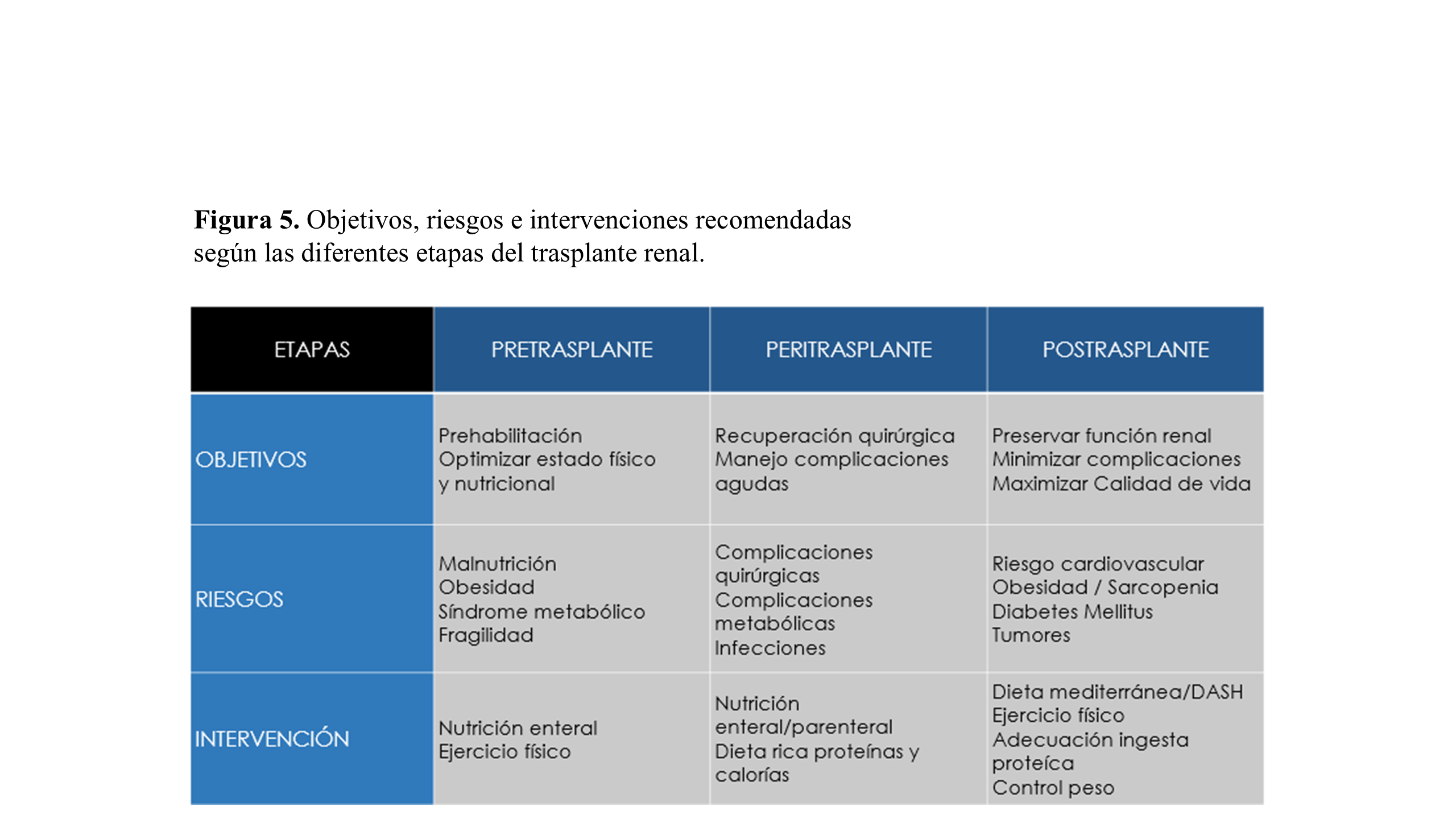
La atención dietética es fundamental durante toda la vida de los pacientes trasplantados, pues sus necesidades varían en cada fase (Figura 5). Se inicia desde la etapa en lista de espera con la optimización previa al trasplante, pasando por el periodo perioperatorio de recuperación quirúrgica y manejo de la disglucemia. Posteriormente hay que enfocar la intervención de la fase de mantenimiento hacia el control del peso y la reducción del riesgo cardiovascular. Por último, el deterioro funcional del injerto y el posible retorno a la diálisis nos lleva a estrategias similares a los pacientes con enfermedad renal crónica avanzada. Los recientes avances en la comprensión del eje intestino-riñón y la forma en que la dieta o los suplementos nutricionales pueden modificarlo para mejorar los resultados han reavivado el interés en la terapéutica dietética de los receptores de trasplantes renales.