Los fundamentos, bases biofísicas y eléctricas, de la “Bioimpedancia”, así como sus aplicaciones clínicas, ya han sido descritas en un capítulo correspondiente de Nefrología al día [1], en un comentario editorial de Nefrología [2], y en bibliografía específica al respecto [3]. También se han descrito las aplicaciones clínicas futuras de la Bioimpedancia Vectorial (BIVA) en la especialidad [4], el valor del ángulo de fase en la bioimpedancia como predictor de supervivencia a largo plazo en los pacientes en diálisis [5], y en la valoración de lo que aporta la BIA en el balance de agua y sodio [6].
La impedancia (Z) es el término que describe la oposición al flujo de corriente alterna por cualquier conductor biológico, y es el resultado de dos componentes: 1) la resistencia (Rz), que viene dada principalmente por el contenido de agua (un excelente conductor), de tal modo que cuanto mayor es su contenido, menor es la R y viceversa; y 2) la reactancia (Xc), que determina la capacidad de las células para almacenar energía, ya que se comportan como condensadores eléctricos, donde las membranas celulares actúan como conductores y el contenido celular actúa como dieléctrico, que es donde se almacena la carga eléctrica. Los dos componentes tienen una representación vectorial, que se expresan en Ohmios (), y su resultante vectorial es la impedancia (Z) que se expresa en la misma unidad.
La bioimpedancia es un método sencillo y reproducible, que en la práctica clínica va a permitir evaluar la composición corporal, el Estado de Hidratación (EH) y el Estado Nutricional (EN) de un paciente en cualquier situación clínica, en la Enfermedad Renal Crónica en cada estadio, en la Enfermedad Renal Crónica Avanzada en prediálisis, al inicio de la Terapia Renal Sustitutiva, ya sea Diálisis Peritoneal, Hemodiálisis o el Trasplante Renal. Permite monitorizar la evolución en el tiempo, proporcionando medidas sensibles de los cambios en la composición corporal. La BIA fundamentalmente estima el agua corporal, es decir el EH, y a partir de fórmulas que varían con cada equipo y proveedor, derivan las estimaciones de los parámetros que permiten evaluar el EN.
Mentras que la Rz es proporcional y determina preferentemente el estado de hidratación, la Xc es proporcional y determina la masa celular y su relación con el estado nutricional, pero su medida puede verse modificada por el EH de modo que cuanto más alto es el contenido en agua, R baja, Xc también es baja y viceversa [1] [2] [3]. De modo que para que las estimaciones del EN sean fiables y creíbles, el paciente debe estar en Estado de Euhidratación o lo más próximo posible a éste, ya que la sobrecarga o la deshidratación pueden modificar los parámetros que permiten evaluar el EN.
BIA en Diálisis PeritonealNuestro objetivo es revisar los últimos conceptos en el abordaje de la BIA aplicada a la diálisis peritoneal (DP). En la mayoría de los artículos revisados utilizan, para las mediciones, equipos de Bioimpedancia Multifrecuencia (MF-BIS).
Una reciente revisión [7], pone de manifiesto la necesidad clínica de definir el Estado de Hidratación (EH) ideal y que quizás este sea prioritario y de suma importancia en DP, ya que algunos estudios han sugerido que estos pacientes podrían estar más sobrehidratados, aumentando así la precarga cardíaca y presión arterial (PA), y se ha asociado con insuficiencia cardíaca, hipertrofia ventricular izquierda y mortalidad [8][9]. La Sociedad Internacional de Diálisis Peritoneal sugiere “que el estado de hidratación debe evaluarse clínicamente de forma regular durante cada visita de seguimiento y con mayor frecuencia si está clínicamente indicado” [10].
Además, evalúan diferentes métodos de determinar el EH de los pacientes en DP y argumentan que las técnicas basadas en la BIA son las herramientas más estudiadas para evaluar el EH, y que se han asociado con el fracaso de la técnica y el aumento de la mortalidad, pero los resultados de los ensayos aleatorizados son en gran parte contradictorios, de modo que concluyen que ningún método ha demostrado su valor como herramienta de intervención que modifique los eventos cardiovasculares, la supervivencia de la técnica y la supervivencia del paciente en DP [7].
También describen las limitaciones técnicas del uso de BIA en pacientes en DP, haciendo referencia a estudios observacionales realizados con abdomen lleno y vacío, sugiriendo que la presencia o ausencia del líquido de diálisis en la cavidad peritoneal puede tener una importante influencia en la evaluación del EH [7]. En estos estudios encontraron diferencias significativas antes y después del drenaje de la cavidad abdominal [11] [12] [13] [14]. En base a estos hallazgos, es probable que las mediciones BIA ideales se deban realizar con el abdomen vacío. Sin embargo, esto es clínicamente poco práctico y las diferencias en las mediciones probablemente no sean clínicamente significativas. Las mediciones realizadas de forma estandarizada y en serie pueden documentar cambios en el EH, que es lo más importante [13].
BIA y Estado de Hidratación (EH) Clasificación del estado de Hidratación (EH)Aunque ampliamente se reconoce la necesidad de evaluar el estado de hidratación (EH), la valoración clínica y las pruebas de laboratorio, son poco prácticas y carecen de la sensibilidad precisa para considerarlas clínicamente significativas. El uso de la BIA, ya sea multifrecuencia (MF-BIS) o monofrecuencia (BIVA), puede ser una herramienta útil para superar algunas de estas limitaciones y ayudar en la clasificación del EH. De hecho, la BIA “per se” ofrece medidas directas y sencillas que facilitan un enfoque práctico y válido para monitorizar el EH. La comparación de un paciente dado, teniendo como norma de referencia la población sana de su mismo género y grupo de edad, permite que se clasifique su EH como, normal o euhidratado, por debajo o deshidratado, y por encima o sobrehidratado; así como el rango (cambio relativo al pretratamiento) independientemente del peso corporal. Al clasificar el EH, teniendo en consideración el porcentaje del valor normal del agua funcional (73.3%) (que define el estado de euhidratación) y las desviaciones por abajo (deshidratación) y por encima (sobrehidratación), en la escala “Hydragram” la BIA vectorial (BIVA) proporciona, al clínico, recomendaciones y orientaciones en la toma de decisiones de la práctica clínica que repercuten en la evolución y en el pronóstico del paciente [3].
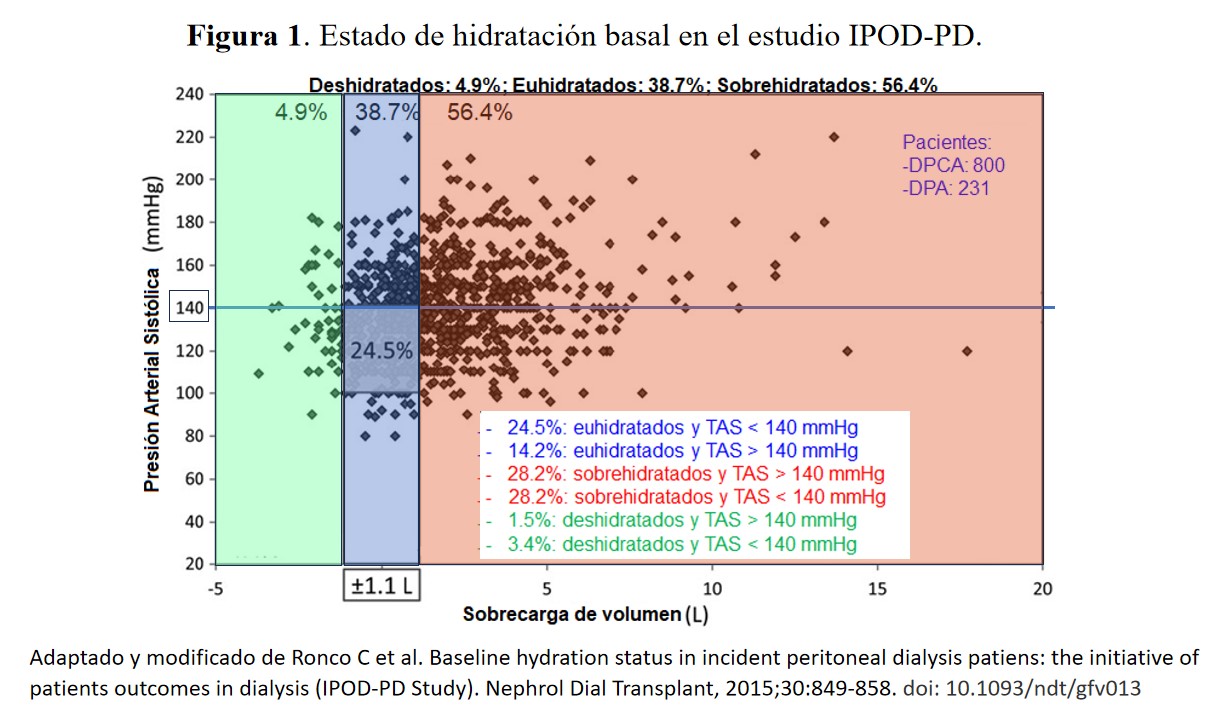
EH al inicio de la DPEl estudio IPOD-PD [15] realizado con MF-BIS en pacientes incidentes en DP, puso de manifiesto que la mayoría (56,4 %) de los pacientes ya están sobrehidratados antes del inicio de la terapia, el 38.7% estaban euhidratados y el 4.9% deshidratados (Figura 1). La sobrehidratación es más grave en hombres y diabéticos, representando el 66,8% y el 71,3% respectivamente. Así mismo la sobrehidratación afectaba más a los altos transportadores con respecto a otras categorías, y en hombres frente a mujeres, diabéticos frente a no diabéticos en todas las categorías de transporte peritoneal.
Solo el 24,5% del total de pacientes se encontraban tanto en el rango normal de presión arterial sistólica como euhidratados, mientras que el 28,2% de los pacientes estaban sobrehidratados y tenían una presión arterial sistólica superior a 140 mmHg. La presión arterial sistólica normal o baja a pesar de la sobrehidratación estaba presente en el 28,2 %, y el 1,5 % de los pacientes tenían una presión arterial sistólica alta a pesar de la deshidratación (Figura 1). La sobrehidratación era prevalente en estos pacientes incidentes a pesar de la sustancial diuresis residual, y probablemente se debía a que existía un desajuste entre la producción y la ingesta dietética de agua, probablemente debido a la ingesta de sal demasiado permisiva. Observaciones similares se han realizado en pacientes prevalentes [16].
EH en la evolución en DPEn los análisis de la evolución en el estudio IPOD-PD, observan, por un lado, que en un grupo de pacientes la sobrecarga de volumen mejora con el tiempo asociándose con una mejor supervivencia [17], y por otro, que cuando la sobrecarga de volumen inicial se prolonga en el tiempo, seis meses, convirtiéndose en “sobrecarga crónica” se asocia con mayor riesgo de fracaso de la técnica en el año siguiente [18].
Kim et al., en un estudio observacional prospectivo, en el que se incluyeron un total de 284 pacientes prevalentes, se determinó la composición corporal por MF-BIS repitiendo el estudio a los 12 meses, un año acumulativo. La sobrecarga crónica se utilizó para predecir la mortalidad por todas las causas y el riesgo de transferencia a hemodiálisis (HD) durante los siguientes meses. La prevalencia basal de sobrecarga hídrica fue de aproximadamente un 27%, y un número sustancial de estos pacientes continuaban sobrehidratados al año, determinando una sobrehidratación crónica en el 18.3% (n=52) de los mismos. La mayoría de estos eran diabéticos (86,5 %), y se acompañó de cambios concomitantes en las características de la membrana peritoneal, con una tasa de progresión más alta a transportador alto. En estos pacientes con sobrecarga hídrica cónica el riesgo de transferencia a HD aumenta en 2,8 (p=0.001), y el riesgo de mortalidad aumenta significativamente en 2.93 veces (p=0,038). En definitiva, la sobrehidratatación crónica durante al menos un año es un fuerte factor de riesgo independiente para la transferencia a HD y de muerte para los pacientes. Aunque el EH de la mayoría de los pacientes con DP no cambia fácilmente con el tiempo, se hace necesario revertir la situación y es muy importante mantener el estado de euhidratación durante todo el período de tratamiento de la DP [19].
EH, riesgo y mortalidad por causa cardiovascular (CVC)Inal et al., en un estudio en 31 pacientes prevalentes, el análisis de regresión lineal mostró que, entre otros factores, la ratio VEC/ACT (B 0.313, p=0.02) era un factor de riesgo independiente de progresión de la HVI [20].
Jotterand et at., en un estudio en 54 pacientes, concluyen que, tomando como referentes los euhidratados, en el análisis univariante, el aumento de la edad, la sobrehidratación, la presión arterial diastólica baja, la troponina T y el péptido NT-proBNP elevados, la hipoalbuminemia, la insuficiencia cardíaca, pero no la PCR, fueron predictivos de mortalidad. Después del ajuste por insuficiencia cardiaca, solo la sobrehidratación, el aumento de la edad y la presión arterial diastólica baja permanecieron estadísticamente significativos en el análisis multivariado [21].
Kang et al., en un estudio en el que incluyeron 631 pacientes, determinaron que el valor de corte del “índice de edema” (VEC/ACT) (relación entre el volumen de agua extracelular (VEC) y el volumen de agua corporal total (ACT)), para la mortalidad a 1 año fue > 0,371 en hombres y > 0,372 en mujeres. De modo que concluyeron que un índice de edema alto se asociaba con la mortalidad de los pacientes incidentes en DP al inicio de la terapia y durante el seguimiento [22].
O´Lone et al., en un estudio en el que incluyeron 529 pacientes, mostraron que el predictor independiente de mortalidad en el análisis multivariado fue el índice OH (OH y OH/VEC), mientras que la ratio VEC/ACT se comportaba como una variable continua que no se asociaba con un mayor riesgo de muerte. Por el contrario, los pacientes que estaban severamente sobrehidratados (el 33% más alto) tenían cocientes de riesgos que eran estadísticamente significativos independientemente del parámetro utilizado para definir la hidratación, así para la ratio VEC/ACT este era de 2,05 (IC 95 % 1,31–3,22, P < 0,005) [23].
Oei et al., en un estudio observacional en 336 pacientes en el que fallecieron 48, observaron que los pacientes que fallecieron por causas cardíacas o no cardíacas fueron similares en cuanto a edad, incidencia de diabetes mellitus, sexo, etnia y causa de insuficiencia renal. Sin embargo, los pacientes con causas cardíacas de muerte tuvieron una antigüedad de diálisis significativamente más corta (10,3 meses frente a 37,0 meses, p < 0,0001) y estaban significativamente más sobrehidratados (OH), 2,95 L frente a 1,35 L, p < 0,05). Observaron que los niveles séricos del logaritmo de Troponina T (TnT) (log TNT), tenían una correlación estadísticamente significativa con el valor de OH (r de Spearman 0,425, p <0,0001). Identificaron un subgrupo de pacientes que estaban gravemente sobrehidratados al inicio del estudio, mediana + 2.7 (IQR, 2.3 a 2.7), y en su seguimiento durante un mínimo de 6 meses, observaron que la reducción de los valores de OH se correlacionó con la reducción de los niveles de TnT (r de Spearman 0,29, p < 0,02). Concluyen que los pacientes sobrehidratados tienen TnT más alta y un más alto riesgo de muerte de causa CVC y que el control del EH reduce este riesgo [24].
Tian et al., en un estudio aleatorizado en 240 pacientes, mostraron que si bien los dispositivos de análisis MF-BIS, en referencia a la ratio VEC/ACT, pueden ayudar a evaluar el EH en los pacientes en DP facilitando y haciendo más eficaz el manejo de los fluidos, no se encontró un efecto significativo en términos de supervivencia del paciente, de la técnica y de la mortalidad por causa CVC a 1 año [25].
Una revisión sistemática y metaanálisis de estudios de cohortes, entre los que se incluyen algunos artículos de los mencionados previamente, tenía como objetivo investigar y determinar si la sobrehidratación evaluada por BIA es un predictor de mortalidad y fallo de la técnica en pacientes con DP. La sobrehidratación, definida por una proporción más alta del índice VEC/ACT (agua extracelular/agua corporal total), podría ser un predictor independiente tanto para la mortalidad por cualquier causa como para el fracaso de la técnica entre los pacientes con DP. No obstante, los autores concluyen que, son necesarios más estudios de cohortes prospectivos multicéntricos representativos de más áreas y países, con criterios idénticos para evaluar la sobrehidratación, dispositivos de BIA adecuados y con estrategias de medición unificadas, para confirmar aún más esta conclusión [26].
DiabetesDavenport et al [27], en un estudio en 386 pacientes de los que el 39.4% eran diabéticos, observaron que los pacientes diabéticos que iniciaban DP de manera electiva tenían mayores proporciones del VEC/ACT y exceso de VEC entre la 6-10 semanas después de comenzar la DP en comparación con los no diabéticos, a pesar de tener un Test de Equilibramiento Peritoneal similar. El incremento en el porcentaje del VEC (9.6% [6.3–12.3] vs. 4.9% [0.7–8.9]), determina que los pacientes diabéticos están predispuestos a un mayor riesgo de sobrecarga de volumen, y potencialmente a un incremento en el riesgo de fallo de la técnica. El mismo autor [28], en otro estudio de 100 pacientes consecutivos que inician DP, 25% de los cuales eran diabéticos, observan un incremento del VEC y de la ratio VEC/ACT, que relacionan con edad más avanzada, mayor comorbilidad, mayor inflamación y una menor función renal residual.
InflamaciónLa inflamación sistémica, definida por niveles elevados de IL-6 en sangre, es un fuerte predictor independiente de la supervivencia del paciente en diálisis peritoneal (DP). Este estudio, realizado en 57 pacientes, pretende analizar si existe relación entre la inflamación sistémica, el EH medido con MF-BIS, y el riesgo CVC evaluado mediante Ecocardiografía, concentraciones sérica de Troponina T y NY-proBNP . Los pacientes con IL-6 sérica alta eran de edad más avanzada, más a menudo diabéticos, tratados con DP por más tiempo y significativamente más sobrehidratados. Observaron que había una correlación significativa entre la IL-6 sérica, positiva entre el estado de hidratación evaluado por el índice VEC/ACT, (r = 0,51; p = 0,001), y negativa con el LTI (r=-0.36, p = 0,058) y la albúmina sérica (r =- 0,35; p = 0,009). El análisis de regresión multivariado confirmó una fuerte asociación de sobrehidratación, hipoalbuminemia y concentración sistémica de IL-6. Los pacientes con IL-6 alta tenían niveles significativamente elevados tanto de NT-proBNP (r = 0,36; p = 0,006) como de TnT (r = 0,50; p < 0,001) en ausencia de anomalías en la ecocardiografía. De forma que concluyen, que la inflamación sistémica, reflejada en los niveles elevados de IL-6 sistémica, se asocia con mayor riego CVC y que se relaciona significativamente con la sobrehidratación [29].
Marcadores de sobrecarga: SeCA125El antígeno sérico de cáncer 125 (SeCA125) aumenta en pacientes con insuficiencia cardíaca, se correlaciona con la sobrecarga de agua extracelular (VEC) y es un marcador de mal pronóstico [30]. El fallo de UF y la sobrecarga crónica de VEC son una de las principales causas de fracaso de la técnica de diálisis peritoneal (DP), pues resulta en hipertensión, edema subcutáneo y pulmonar, hipertrofia ventricular izquierda e hipertensión pulmonar [31]. En este estudio retrospectivo en 489 pacientes prevalentes en DP, simultáneamente se mide SeCA125, NTproBNP y VEC. Observan que el SeCA125 se asoció-correlacionó positivamente con la relación VEC/ACT (r = 0,29, p < 0,001), NTproBNP) (r = 0,18, p < 0,001) y la edad (r = 00,17, p = 0,001) y negativamente con el volumen de ultrafiltración de 24 h (r = −0,28, p < 0,001), albúmina sérica (r = −0,22, p < 0,001), fracción de eyección del ventrículo izquierdo estimada por ecocardiográfica (r = −0,20, p < 0,001), pero no con función renal residual ni proteína C reactiva. Concluyendo que en DP el SeCA125 cuando está muy elevado sugiere fallo de ultrafiltración, que también está asociado con el aumento del volumen VEC y por tanto con el pronóstico evolutivo de la técnica y del paciente [32].
BIA y Estado Nutricional (EN)La BIA puede proporcionar una evaluación reproducible del EN, estimando la masa muscular y la masa grasa. Parthasarathy et al., en este estudio retrospectivo en 824 pacientes incidentes y prevalentes en DP, en quienes se realizaron mediciones repetidas durante un periodo de seguimiento de 2 años, muestran que los cambios en la composición corporal son comunes y complejos. Las disminuciones de los índices de tejido magro (LTI) durante 2 años son significativas (media de -0,54 SD, SEM: 0,11) y es un predictor independiente importante de supervivencia. Sin embargo, no se pudieron predecir los cambios en la composición corporal, LTI o FTI (índice de tejido graso), de 206 pacientes durante el período de seguimiento de 2 años a partir de las mediciones basales, ni mediante las evaluaciones demográficas iniciales, como la edad, el sexo, el estado de diabetes mellitus, la puntuación de Karnofsky, ni las evaluaciones funcionales o bioquímicas de referencia. Aunque hubo una fuerte relación inversa entre los cambios en LTI y FTI, no pudieron demostrar que el aumento de FTI estuviera asociado con la mortalidad, no obstante, sugieren que las mediciones de rutina de LTI pueden ser una herramienta sensible y precisa para ayudar a los médicos a monitorizar los cambios [33].
BIA, Estado Nutricional y riesgo de mortalidadCruz-Jentoff et al., en un estudio en 131 pacientes incidentes y prevalentes en DP a quienes se realizó MF-BIS de seguimiento durante un periodo de 2 años, observaron pérdida de LTI en un 30.5% y ganancia de FTI en un 44.3%. Murieron 23 pacientes, y un LTI bajo al inicio del estudio era predictor significativo de mortalidad por todas las causas después de ajustar los parámetros demográficos y bioquímicos, pero no cuando los factores cardiovasculares se incluyeron en el análisis multivariado. Sin embargo, los cambios longitudinales, la pérdida de LTI y la ganancia de FTI, fueron factores de riesgo independientes para la mortalidad por todas las causas después de ajustar los parámetros demográficos, bioquímicos y cardiovasculares, que los valores únicos de LTI y FTI. Estos cambios en la composición corporal a lo largo del tiempo no pudieron predecirse mediante parámetros demográficos, bioquímicos o de composición corporal basales, por tanto, las mediciones seriadas de la composición corporal podrían proporcionar más información sobre el pronóstico de los pacientes en DP [34].
BIA y SarcopeniaEl Consenso del Grupo de Trabajo Europeo sobre Sarcopenia en Personas Mayores (EWGSOP) [35], establece la definición practica y los criterios diagnósticos de sarcopenia. Entre las herramientas diagnósticas se incluye la BIA, concretamente el índice de masa muscular esquelética o apendicular (masa muscular de las extremidades: Masa Muscular esquelética /talla2), estableciendo puntos de corte, para los hombres < 8.87 kg/m² y para las mujeres < 6.42 kg/m²., y utilizando el índice de la masa muscular absoluta (Masa Muscular Absoluta/talla²), se consideran músculo normal en hombres ≥ 10.76 kg/m², y en mujeres ≥ 6.76 kg/m²).
La masa muscular disminuye como parte de proceso fisiológico del envejecimiento, con estimaciones de pérdidas entre el 1,0 y el 1,5 %, a partir de los treinta años, y se asocia con un mayor riesgo de mortalidad en la población general [36].
Los pacientes con enfermedad renal crónica en TRS están sujetos a un mayor riesgo de pérdida de masa muscular debido a múltiples factores, incluyendo restricciones dietéticas, acidosis metabólica, inflamación, pérdidas urinarias de proteínas y reducción de la actividad física [37][38][39]. Además, en los pacientes de diálisis peritoneal (DP) se suma la pérdida de proteína en el dializado [40].
Davenport et al., en un estudio en 490 pacientes [41], utilizando la MF-BIA segmentaria, mostraron que la prevalencia de sarcopenia se asoció con el género masculino, la comorbilidad, la edad, el IMC y el origen étnico. Además, se asoció con la ingesta de proteínas en la dieta y el volumen de orina, lo que permitiría intervenciones dietéticas y estrategias para preservar la producción de orina y reducir la pérdida de masa muscular. No se asoció con el tiempo en DP, la prescripción de diálisis, la función renal residual o la depuración de solutos. La asociación con la etnia parece estar en relación con las diferencias en la masa muscular [42].
Abro et al., en un estudio en 155 pacientes [43], utilizando también la MF-BIA segmentaria, reportan unas tasas de prevalencia de sarcopenia en función de los criterios del Proyecto Sarcopenia de la Fundación para los Institutos Nacionales de Salud (FNIH) [44] [45], del EWGSOP [35], y del Grupo de trabajo asiático sobre sarcopenia (AWGS) [46], que oscilan entre 11.0% y 15.5%, variando según la guía utilizada.
Por otra parte, la Sarcopenia en DP se ha reportado como un factor de riesgo independiente para mortalidad [47].
Otros Asociación entre parámetros del análisis BIA de composición corporal, absorción peritoneal de glucosa e índice HOMA-IRLaw y Davenport, en un estudio observacional en 143 pacientes prevalentes en DP, 37,1 % diabéticos, y 62.1% en DPA, evitando el dializado con altas concentraciones de glucosa y una alta proporción en los que se prescribió icodextrina, observan que en los primeros doce meses aumenta el peso a expensas de una ganancia de la masa grasa (MF-BIA) que aumentó en 1,8 (–0,5 a 4,1) kg, mientras que la masa libre de grasa disminuyó en –1,3 (–2,9 a 1,0) kg, con una correlación-asociación negativa entre ambos parámetros (r –0·41, p < 0·001). El aumento de la masa grasa se asoció con la absorción de glucosa peritoneal medida (r 0,69, p < 0,001), y la absorción de glucosa se asoció con la cantidad de 22,7 g/l de glucosa en el dializado (OR 2,0, 95 % IC 1 ·5, 2,5, p < 0,001), y esta era mayor en el género masculino (OR 4,8, 95% IC 1·5, 14·9, P = 0·008). El aumento de la absorción de glucosa peritoneal se asoció con una reducción en la tasa de aparición de nitrógeno ureico, lo que sugiere una reducción en la ingesta proteica en la dieta [48].
Bernardo et al., en otro estudio observacional en 51 pacientes no diabéticos, y en el análisis de regresión lineal multivariado ajustado para la absorción peritoneal de glucosa, el transporte de solutos pequeños, el tiempo en DP y la inflamación (estimada por la Proteína C reactiva (PCR), observaron que el índice de tejido graso (FTI) (MF-BIS) se correlacionó independientemente con el HOMA-IR (r=0.82, P,0.001), y que éste era 0.16 unidades más alta por kg/m² de FTI (95% CI, 0.05 to 0.26, P=0.01). No se observó correlación ni asociación con el índice de masa magra (LTI) [49].
Determinación del Volumen Intraperitoneal durante el TEPEl conocimiento del volumen intraperitoneal (VPI) y el tiempo hasta el pico de VPI durante una permanencia permitiría una mejor prescripción de DP. Los autores concluyen que su estudio demuestra la viabilidad de la BIA segmentaria del tronco para monitorizar de forma casi continua el VIP e identificar el tiempo hasta el pico de UF durante un PET estándar. Argumentan que estos nuevos conocimientos sobre la dinámica del VIP durante el PET pueden mejorar nuestra comprensión de la fisiología del transporte subyacente y, finalmente, ayudar a mejorar las prescripciones de tratamiento de la DP [50].
Precisión en la estimación del Volumen de distribución (V) y sus implicaciones para estimar la dosis de diálisis (Kt/V)En este meta-análisis, en el que compararon los tres métodos principales para estimar el Volumen de distribución (V) (Total Body Water (ACT) o Agua Corporal Total), a saber, la dilución de isótopos (considerado el estándar o patrón oro), la bioimpedancia y las ecuaciones antropométricas (Watson), encontraron que en cada caso los límites de concordancia eran relativamente amplios, y que a pesar de ello la diferencia media entre todas las medidas era relativamente pequeña, incluso en un rango bastante amplio de V promediados. En otras palabras, los promedios de la población eran bastante confiables, y era la variación individual en la composición corporal lo que magnificaba la amplia variabilidad en los límites de concordancia. Observaron que había una tendencia a que estos límites de concordancia eran más amplios en la población en diálisis que en la de no diálisis, siendo estos últimos sujetos predominantemente sanos de diferente edad y condición física, en contraste con la salud más variada del grupo de diálisis y, en particular, en referencia al riesgo bien documentado de atrofia muscular que ocurre en la insuficiencia renal avanzada, especialmente con el tiempo en diálisis.
Los autores indican que las limitaciones en la precisión de la estimación de V cuestionan la validez de aplicar un único valor umbral de Kt/V como indicativo de una diálisis adecuada. Esto debe tenerse en cuenta en el desarrollo de las guías, de modo que si se considera apropiado un Kt/V objetivo, debe expresarse como un rango; como alternativa, deben evitarse objetivos únicos y la dosis de diálisis debe determinarse de acuerdo con las necesidades del paciente [51].
Comparación de la SF-BIA, MF-BIA, entre sí y con otros métodos DXA y SGA para evaluar el ENPopovich et al., en un estudio transversal en 72 pacientes, comparan la Absorciometría de Rayos X de Energía Dual (DXA), la Bioimpedancia (BIA) y la Evaluación Global Subjetiva (SGA). Los participantes fueron medidos dos veces por DXA, dos veces por BIA y una vez por SGA. Las mediciones incluyeron masa de tejido magro (LTM), masa de tejido graso (FT) y, para BIA, sobrehidratación (OH), agua intracelular (VIC) y agua extracelular (VEC). LTM y FT se indexaron a la superficie (índice de tejido magro [LTI] e índice de tejido graso [FTI], respectivamente) y el VIC a la altura (VIC/ht). En los resultados muestran que hubo una buena concordancia general entre BIA y DXA, pero con una variación intraindividual considerable (1 desviación estándar: FT 5,7 kg; LTM 5,6 kg). Los factores que afectaron las diferencias fueron FT, LTM e VIC. La obesidad (DXA 43%; BIA 54%) y el desgaste muscular (BIA 28%; SGA 53%) fueron comunes. La concordancia entre la BIA y la SGA fue pobre. 38% de los pacientes considerados desnutridos por SGA también tenían un LTI bajo; y el 23% con SGA normal tenía LTI bajo. La SGA se relacionó más con LTI (BIA) que con LTI (DXA). La comorbilidad se relacionó con OH, desnutrición clínica, FTI reducido, pero no con LTI. Concluyen que la concordancia general entre DXA y BIA fue buena a nivel poblacional pero no a nivel individual. Que la sobrehidratación (OH) aparentemente reduce la precisión de DXA. LTI y VIC/ht se correlacionaron con SGA y pueden ser métodos complementarios útiles para SGA en la evaluación de la nutrición. La obesidad y el desgaste muscular eran comunes en esta población. Un alto nivel de comorbilidad se asoció con aumento de OH, desnutrición clínica y reducción de FTI, pero no de LTI. Este estudio no puede dar una respuesta clara sobre cuál de los 3 métodos evaluados para la desnutrición del paciente en DP es mejor, aunque DXA podría ser el menos deseable debido a la falta de LTI estandarizado y la incapacidad inherente para compensar la OH. La experiencia con el uso de cualquiera de estos métodos es un factor determinante a la hora de elegir entre ellos [52].
Zhu et al., en otro estudio transversal en 50 pacientes, en los que en la misma visita realizan análisis con equipos Monofrecuencia (SF-BIA), Multifrecuencia (MF-BIA) y Absorciometría de Rayos X de Energía Dual (DXA), y comparan los valores de la BIA con los de la DXA. En los resultados observan que ambos métodos de BIA mostraron una fuerte correlación (r > 0,7) y una excelente reproducibilidad (ICC > 0,75) en comparación con la DXA. De acuerdo con el diagrama de Bland-Altman, la SF-BIA mostró concordancia en las medidas de los compartimentos corporales, sin sesgo de proporcionalidad (p > 0,05), sin sesgo sistemático para FFM (−0,5 ± 4,9, IC del 95 % −1,8 a 0,9, p = 0,506), y para FM (0,3 ± 4,6, p = 0,543). La MF-BIA no presentó un sesgo de proporcionalidad para el FFM, pero subestimó este compartimento corporal en 2,5 ± 5,4 kg (p = 0,002); y si presentó sesgo de proporcionalidad para FM. En sus conclusiones los autores concluyen que la SF-BIA fue un método de evaluación más preciso, mejor concordancia con la DXA, que MF-BIA para las mediciones de FFM y FM, en pacientes en DP [53].
Relación entre las características del transporte de la membrana peritoneal y la composición corporalLiu et al., en une estudio prospectivo unicéntrico, en el que se incluyen 283 pacientes incidentes en DPCA seguidos durante 12 meses, tienen como objetivo investigar la relación entre los tipos de transporte peritoneal basales y el estado nutricional, en pacientes con diálisis peritoneal ambulatoria continua (DPCA). Según los resultados de la prueba de equilibrio peritoneal inicial, los pacientes se dividieron en dos grupos, transportadores bajos y transportadores altos. El estado nutricional se evaluó mediante la evaluación global subjetiva (SGA), la puntuación de pérdida de energía y proteína (PEW), y la MF-BIA. En comparación con los transportadores bajos (n=92), los transportadores altos (n=181) tenían niveles más bajos de albúmina sérica (37.1 (SD 4.3) v. 39.6 (SD 4.3) g/l, P< 0. 001), prealbúmina sérica (356 (SD 99) v. 384 (SD 90) mg/l, p=0·035), ángulo de fase (6.15 (SD 0.39) v. 6.27 (SD 0.47), p<0.05), masa muscular esquelética (25.2 (SD 4.3) v. 26.9 (SD 5.1) kg, p<0.05); una mayor tasa de desnutrición definida por SGA (52.5 v. 25.0 %, p<0.001), y una puntuación PEW (37.0 v. 14.1 %, p<0.001) al año de seguimiento. El transporte peritoneal alto al inicio, en el análisis de regresión logística binaria multivariada, se asoció de forma independiente con la desnutrición (SGA, desnutrición leve a moderada y grave: OR 3.43 (IC 95 %, 1.69-6.96, p<0.01); PEW: OR 2.40 (IC 95 %, 1.08-5.31, p=0.03). Los autores concluyen que el transportador alto al inicio se asoció de forma independiente con un peor estado nutricional y tasas mayores de desnutrición, aunque el estado nutricional de los dos grupos mejoró durante los 12 meses de seguimiento [54].
Caron-Lienert et al., en una cohorte de 85 pacientes incidentes en DP durante el primer año de tratamiento, examinan la relación entre las características del transporte de la membrana peritoneal, que difiere entre los pacientes, y parámetros de composición corporal estimados por MF-BIA. Establecen un punto de corte del 5% para definir los cambios en el peso seco (DW), la masa de tejido magro (LTM) y la masa grasa (FM). Observan que, el 50,6% de los pacientes presentó ganancia de DW, el 41,2% presentó pérdida de LTM y el 65,9% presentó ganancia de FM. A lo largo del tiempo (T0 – T12), encontraron diferencias significativas en DW, índice de masa corporal (IMC), masa de tejido adiposo (ATM), FM e índice de tejido graso (FTI). Los pacientes con una tasa D/P de creatinina más baja mostraron una ganancia de DW y FM. Observaron un mayor porcentaje de transportadores bajos (no rápidos) en ganancia de DW en comparación con DW sin ganancia. En cuanto a la carga de exposición a la glucosa, no se observaron cambios en la composición corporal. Los autores concluyen que, la mayoría de los pacientes presentaron ganancia de DW, ganancia de FM y pérdida de LTM. De modo que los cambios en la composición corporal (especialmente FM) son diferentes según las características del transporte de la membrana peritoneal durante el primer año en DP. Tales diferencias son mayores en los transportadores bajo (no rápidos) que en los altos (rápidos) [55].
Li et al, en un estudio aleatorizado en 122 pacientes prevalentes, exploran la influencia de las características de la membrana peritoneal en el estado de hidratación en pacientes en DP y en su peso seco evaluado por MF-BIA segmentaria comparándolo con el del solo juicio clínico. Una alta relación de la tasa D/P de creatinina se asoció con la ratio VEC/ACT (r=0.256, p=0.007), pérdida de proteínas en el dializado (r=0.425, p=0.002) y estado nutricional deficiente. Después de una intervención de seis meses, los pacientes con medida mensual de análisis de bioimpedancia (BIA) tenían mejor control de los fluidos (-1.2± 0.4 vs 0.1± 0.4 kg, p = 0,014) y mejor control de la presión arterial (124.7± 2.7 vs 136.8±2,8 mmHg, p < 0,001); sin embargo, el estado de hidratación y la presión arterial volvieron a la línea de base después de que se alargara el intervalo de medidas de la BIA a 3 meses. El proceso de control y reducción de peso seco no tuvo efecto negativo sobre la función renal residual o la función de la membrana peritoneal. Los autores concluyen que las características de la membrana peritoneal afectan el estado nutricional y al estado de hidratación (ratio VEC/ACT); la BIA es una técnica objetiva útil para la evaluación e identificación de los pacientes que están sobrehidratados y como guía para lograr alcanzar el peso seco. Para los pacientes sobrehidratados e hipervolémicos , la corrección de la sobrecarga de líquidos mejora el control de la PA sin efectos adversos sobre la FRR [56].
Prescripción y composición corporalVerger et al., en un estudio observacional [57] de cohorte en 1054 pacientes incidentes en DP, evaluan la asociación de la prescripción de DP con la composición corporal y los resultados de los pacientes en la cohorte de pacientes prospectiva de la Iniciativa para los resultados de los pacientes en diálisis peritoneal (IPOD-PD). Se analizó la asociación de la prescripción de DP con la composición corporal mediante el uso de modelos mixtos lineales, y la asociación de composición corporal y riesgo de muerte y/o cambio a hemodiálisis (HD) mediante un análisis de riesgo competitivo combinado con un análisis spline. La composición corporal se evaluó regularmente con MF-BIA. La edad, el tiempo en DP y el uso de soluciones hipertónicas y de poliglucosa se asociaron significativamente con una disminución del índice de tejido magro (LTI) y un aumento del índice de tejido graso (FTI) con el tiempo. El análisis de riesgos competitivos reveló una asociación en forma de U del índice de masa corporal (IMC) con el cociente de riesgos instantáneos (HR) subdistribucional para el riesgo de muerte. Un LTI alto se asoció con una HR subdistribucional más baja, mientras que un LTI bajo se asoció con una HR subdistribucional aumentada en comparación con la mediana de LTI como referencia. Un FTI alto se asoció con una HR subdistribucional más alta cuando se comparó con la mediana como referencia. La HR subdistribucional de riesgo de cambio a HD no se asoció con ninguno de los parámetros de composición corporal. El uso de soluciones de poliglucosa o hipertónicas para DP fue predictivo de una mayor probabilidad de cambio a HD, y el uso de soluciones biocompatibles fue predictivo de una menor probabilidad de cambio a HD. La sobrehidratación se asoció en el límite con el riesgo de muerte o riesgo de cambio a HD en el modelo con ajuste por IMC, LTI o FTI. En un análisis donde se combinaron ambos resultados, se observó una asociación significativa de sobrehidratación con fallo de la técnica definida por muerte o cambio a HD, lo que confirma su análisis anterior [18] y los hallazgos de otros estudios [26]. Por lo tanto, las estrategias para el control del estado de líquidos y las intervenciones tempranas podrían respaldar la duración y la eficacia clínica de la DP. El uso de soluciones biocompatibles (es decir, pH neutro y bajo GDP) se asoció con un menor riesgo de cambio a HD, pero no con la muerte. El mantenimiento más prolongado en DP con líquidos biocompatibles también podría explicarse por una mejor preservación de la función renal residual, pero si otros parámetros también pueden contribuir, como la ultrafiltración, la aparición de peritonitis o la hospitalización, sigue siendo una pregunta abierta en la etapa actual de evidencia disponible. Los autores concluyen que la composición corporal está asociada con factores no modificables específicos del paciente y con factores modificables relacionados con el tratamiento. Este último sugiere ajustar las prescripciones en consecuencia y monitorizar la composición corporal regularmente para mejorar los marcadores nutricionales y, en última instancia, controlar el riesgo de fallo de la técnica y mejorar los resultados del paciente [57].
Concordancia entre SF-BIA y MF-BIAExisten diferencias significativas entre las mediciones de la BIA realizadas con diferentes analizadores, SF-BIA y MF-BIA, y generan datos que no son intercambiables. Si bien estos datos se correlacionan altamente tienen una muy pobre concordancia y los límites de concordancia entre dispositivos es muy amplia. De modo que los dispositivos no se pueden usar indistintamente, pero no hay inferioridad de los dispositivos de SF-BIA con respecto a los dispositivos MF-BIA, y viceversa. Las diferencias observadas en la concordancia entre los dispositivos, fue mayor a medida que aumentaba el índice de masa corporal, y era peor en los extremos de desequilibrio hídrico, sobrehidratación o deshidratación; estos son factores que interfieren en los resultados e influyen en las diferencias entre los métodos. Las diferencias en las estimaciones, entre ambos dispositivos, parecen estar relacionadas tanto con las mediciones directas de los datos de BIA, valores individuales de R, Xc, Z y PhA, como con factores biológicos y la metodología de cálculo, es decir, por las ecuaciones específicas de los dispositivos para la estimación de otros parámetros. Las limitaciones de estos dispositivos deben tenerse en cuenta al evaluar la composición corporal y el estado de hidratación, especialmente en individuos obesos y en aquellos con desequilibrio hídrico, como los pacientes renales. Probablemente el uso de software de código abierto puede y debería ser un importante paso adelante en el desarrollo de mediciones estandarizadas en diferentes poblaciones de pacientes [58][59][60].