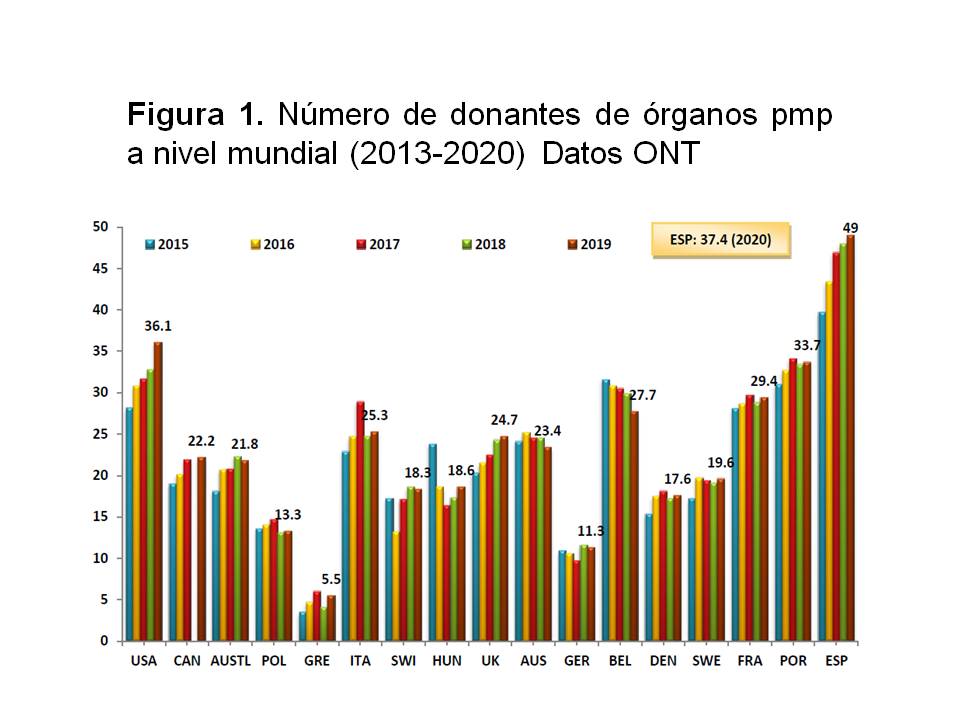
Uno de los temas más controvertidos en nuestro país durante los últimos años ha sido el definir si en nuestro entorno la donación de vivo era necesaria o no. Ello se debe a que España es, desde hace muchos años, el primer país en donaciones de cadáver por millón de población tal y como podemos ver en la (Figura 1).
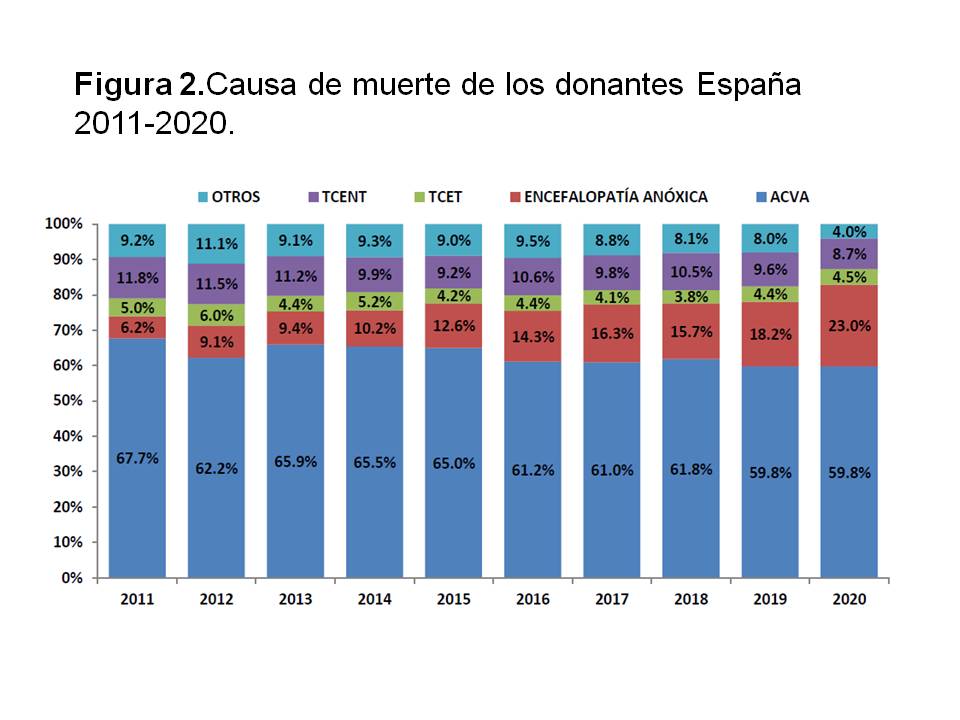
Sin embargo, y afortunadamente, el número de donantes por traumatismo craneoencefálico consecuencia de accidente de tráfico ha caído drásticamente en los últimos años en España, pasando de ser el 43 % en 1992 a ser el 4,5 % en 2020 (Figura 2). Ello ha conllevado la necesidad de aumentar los donantes cadáver por otras vías, siendo la más importante la de los donantes con criterios expandidos (DCE) (edad avanzada, antecedentes de hipertensión arterial o diabetes mellitus, anticuerpos positivos para el virus de la hepatitis C, asistolia, etc). Estos DCE permiten trasplantar a los receptores de mayor edad, pero los receptores más jóvenes lo tienen difícil para trasplantarse de forma temprana con un donante cadáver. Especialmente por este motivo, la Organización Nacional de Trasplantes (ONT), las organizaciones autonómicas y los centros de forma individualizada han apostado de forma abierta por la promoción de la donación de vivo.
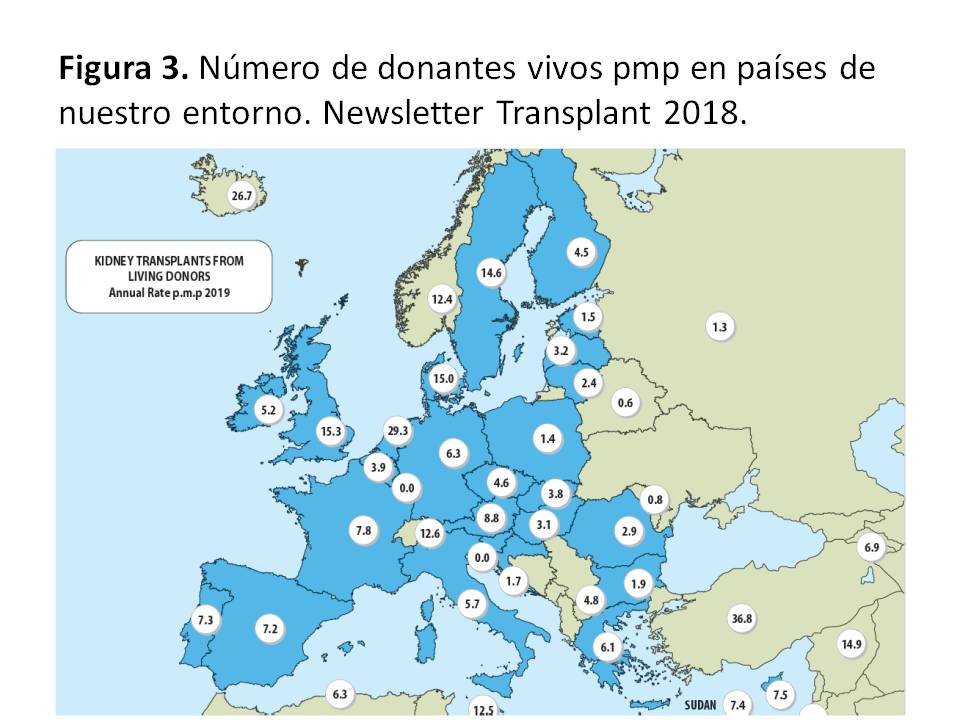
Situación mundial de la donación de vivoLa donación de vivo está contemplada de forma muy distinta según los distintos países de nuestro entorno (Figura 3). En Europa, presenta sus cotas más altas especialmente en los países nórdicos (13-20 pmp), Reino Unido (16 pmp) y Holanda (31 pmp), donde representa entre el 20 y el 45 % del total de donantes. Toda la zona del Sur de Europa presenta un bajo porcentaje de donación de vivo (1-10%). Otras zonas donde la donación de vivo ha sido intensamente promocionada son Estados Unidos (17 pmp), Australia (39 pmp) y Canadá (12 pmp) representando entre un 35-45 % de sus donantes. Tras el impulso dado a la donación de vivo en España, hemos pasado en la última década de un 1 % a un 14 % del total de donaciones (8,4 pmp en 2015), experimentando un cierto retroceso al 7,2 pmp en los últimos años posiblemente consecuencia de la gran expansión de la donación en asistolia tipo III.
Tipos de donante vivoLa donación de vivo puede dividirse en dos tipos principales:
1- Donación directa. Es aquélla en la que entre donante y receptor existe un vínculo afectivo y el donante sabe perfectamente a quién va dirigida su donación. A su vez, la podemos dividir en 3 grandes categorías:
a. Genéticamente relacionados: Donación de padres a hijos, entre hermanos, hijos a padres, etc.
b. Familiares genéticamente no relacionados: Matrimonios, parejas de hecho, padres adoptivos, cuñados, etc.
c. No familiares: Amistades.
2- Donación indirecta. En ella no existe vínculo afectivo entre donante y receptor y, en la mayoría de ocasiones, ambos no llegan a conocerse. También tiene distintas categorías o tipos:
a. Intercambio de donantes o trasplante cruzado. Se produce cuando entre donante y receptor iniciales no existe compatibilidad de grupo sanguíneo o existe una prueba cruzada positiva. Ello lleva a que se busque a otra pareja en condiciones similares y se haga el trasplante intercambiando donantes entre ambas parejas. Puede hacerse el intercambio múltiple entre más de dos parejas.
b. Intercambio con la lista de donante cadáver. Se realiza cuando existe incompatibilidad de grupo entre la pareja inicial y para solucionar el problema dicho donante realiza la donación al receptor más compatible de la lista de espera de donante cadáver. El receptor inicial recibe por ello prioridad total en la lista de espera de donante cadáver y accede al primer riñón compatible que se genere en la misma.
c. Donante altruista. Es una persona que por motivos totalmente altruistas cede uno de sus riñones a la sociedad sin conocer a la persona a la que le será implantado dicho riñón. La asignación del mismo viene dada por la Organización Nacional que designa al receptor más adecuado atendiendo a un sistema de puntuaciones.
d. Donante legalmente retribuido. Es aquel donante que por motivos de precariedad económica vende uno de sus riñones a un determinado receptor. Generalmente, el proceso viene organizado por mafias del trasplante que obtienen importantes beneficios económicos en detrimento del donante que suele ser muy mal retribuido. Es un proceso legal en determinados países y que está totalmente desaconsejado por la Organización Mundial de la Salud [1] [2].
e. Comercio ilegal de órganos. Supone la extracción forzada y no voluntaria de uno o más órganos de un donante. Tiene toda la condena moral y legal de la sociedad en su conjunto.
Ventajas y desventajas de la donación de vivoLa donación de vivo presenta numerosas ventajas. Entre las más importantes cabría citar a las siguientes:
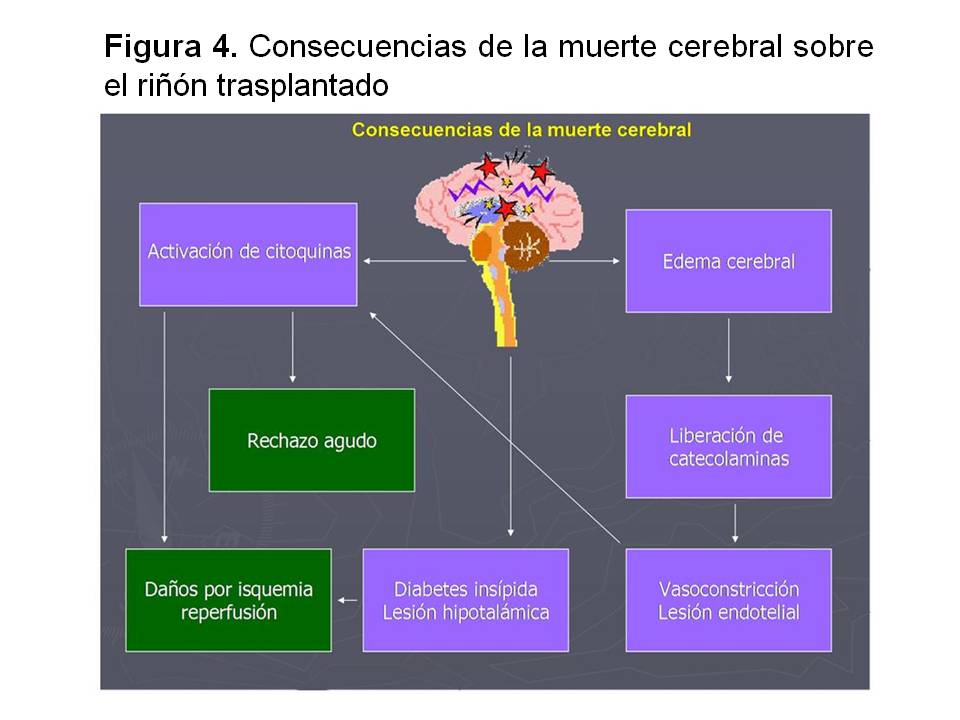
1- Ausencia de muerte cerebral y fenómenos intrínsecos a la misma. La muerte cerebral es un proceso que genera numerosos trastornos que pueden acarrear daños en el injerto, ya que activa citoquinas que incrementan la posibilidad de tener rechazo agudo y aumentan los daños de la isquemia reperfusión. Por otro lado, genera trastornos hipofisarios, hipotalámicos y de edema cerebral que van a desencadenar trastornos físicos e inmunológicos al injerto (Figura 4).
2- El estudio del potencial donante vivo se puede hacer tomándose todo el tiempo que se considere necesario para asegurar su total viabilidad. Asimismo, para poder llegar a ser donante vivo hay que tener muy poca patología asociada.
3- El tiempo de isquemia fría es mucho menor en el donante vivo que en el donante cadáver. Si tomamos como referencia los datos del Registro Catalán de Enfermos Renales, vemos que en donante vivo la media es de 1.5 horas y en donante cadáver de 18 horas.
4- El donante vivo puede ofrecer en ocasiones una muy buena compatibilidad HLA entre donante y receptor como es en el caso de hermanos idénticos, siendo también muy adecuada la que existe entre padres-hijos y hermanos haploidénticos.
5- La inmunosupresión puede iniciarse de forma anticipada al receptor ya que existe una fecha conocida y programada de trasplante. Generalmente suele ser de dos a tres días antes del mismo. El receptor estará, pues, inmunológicamente mejor adecuado para recibir el injerto del donante.
6- Posibilidad de trasplante anticipado. Dicho concepto se refiere al trasplante que se realiza sin mediar tratamiento sustitutivo previo con diálisis. Es, posiblemente, el factor más importante como ventaja de la donación de vivo. Existe numerosa literatura, incluyendo nuestra propia experiencia [3] [4], que certifica que los mejores resultados que ofrece la donación de vivo y el trasplante en general se producen cuando el receptor ha pasado menos de 6 meses en tratamiento sustitutivo con diálisis. A partir de aquí disminuye de forma significativa la supervivencia del paciente y del injerto.
7- El receptor que accede a un trasplante renal de donante vivo acorta su tiempo de espera hasta el trasplante y, al mismo tiempo, ejerce un beneficio indirecto para aquellos receptores que no disponen de un donante vivo.
8- La donación de vivo ha sido relacionada clásicamente como factor que aumenta la autoestima del donante y le proporciona claras ventajas de tipo psicológico. En muchas ocasiones estrecha la relación entre donante y receptor, aunque no en todos los casos.
9- El estudio del donante detecta patología que de otra forma habría podido permanecer encubierta hasta estadIos más avanzados. Esto es especialmente importante en patología neoplásica y en la detección de enfermedades renales que tienen carácter familiar.
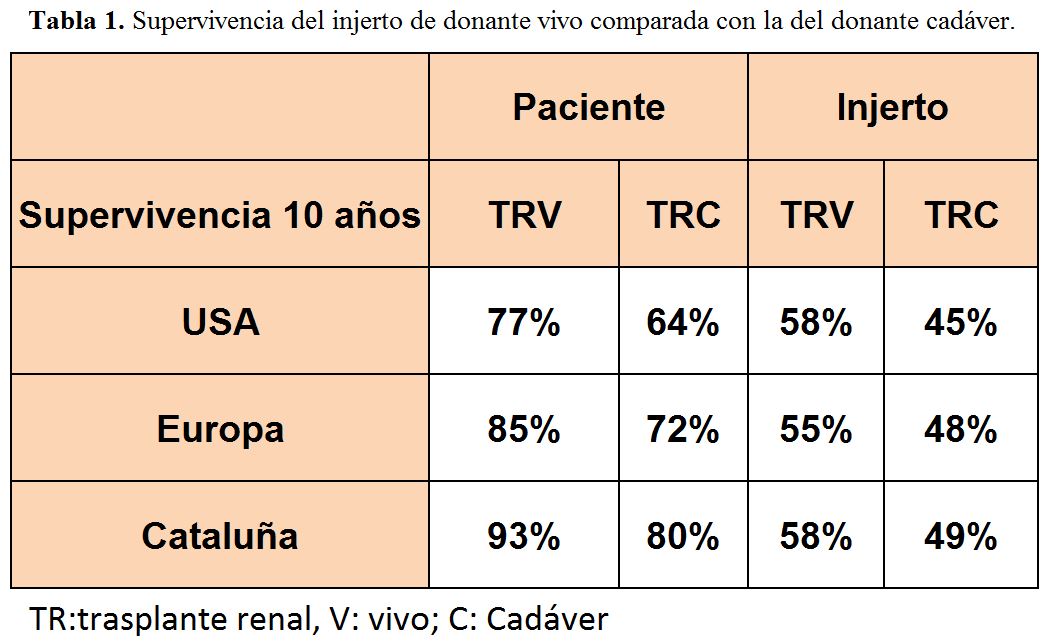
10- La donación de vivo da, en todas las series, mejores resultados que la de cadáver tanto en supervivencia de paciente como de injerto [5]. El estudio realizado en nuestra serie del Registro Catalán de Enfermos Renales objetiva que el factor más importante que condiciona esta diferencia es que el trasplante de vivo permite acortar de forma clara el tiempo previo en diálisis [4].
En cuanto a las desventajas de la donación vivo, las más importantes serían las siguientes:
1- El donante tiene un riesgo de mortalidad de aproximadamente 1/3.500, hecho que debe estar claramente advertido antes de realizar la donación.
2- El riesgo de morbilidad grave es cercano al 2% [6]. La principal morbilidad será de causa respiratoria, seguida de sangrados quirúrgicos, infecciones de herida quirúrgica y del tracto urinario. También se han descrito laceraciones esplénicas y trombosis venosas profundas que pueden ocasionar un tromboembolismo pulmonar.
3- El donante se expone a vivir con un solo riñón el resto de su vida. Aunque ello no debe ocasionarle ningún problema, el riñón residual está expuesto a traumatismos, tumores, etc.
4- El potencial donante está expuesto a una presión familiar inadecuada hacia la donación y el que rehúsa serlo se expone a trastornos psicológicos derivados de su negativa.
5- En determinados sistemas sanitarios el donante puede tener pérdidas de tipo económico durante el tiempo que dure su baja laboral.
6- No se ha demostrado que el donante tenga más riesgo que la población general de evolucionar hacia la insuficiencia renal crónica terminal ni que el hecho de la donación aumente de forma significativa sus cifras de tensión arterial [7]. Sin embargo, sí parece existir más riesgo de desarrollar insuficiencia renal crónica cuando se compara a los donantes con un grupo control de similar edad y patología previa asociada [8].
Resultados en grandes series de la donación de vivoLa donación de vivo, tal y cómo se comentó anteriormente, ofrece mejores resultados que la donación de cadáver. Esto se ha podido ver en todas las grandes series que han comparado ambos grupos de pacientes, de donante vivo y de donante cadáver. La (Tabla 1) nos da una perspectiva de las más importantes y las de nuestro entorno [4] [5].
Nefrectomía del donanteLa clásica cirugía abierta que implicaba una incisión subcostal de 15 cm de longitud ha sido totalmente desplazada de los programas de donante vivo. Actualmente sólo vienen realizándose nefrectomías que se realicen mediante mini-lumbotomía o mediante laparoscopia, aunque recientemente se ha introducido la nefrectomía robotizada mediante da Vinci como método que permite la utilización de la laparoscopia en cirujanos que no habían sido entrenados para la misma, ya que la visión tridimensional del campo quirúrgico es muy similar a la que se tiene con la cirugía abierta, aunque con mayor aumento y precisión. Las nuevas técnicas de nefrectomía ofrecen menos sangrado, menos analgesia y menos tiempo de hospitalización. La insuflación abdominal no causa trastornos dignos de mención que alteren el futuro de los injertos, aunque pueden aumentar ligeramente el tiempo de recuperación del injerto [9] [10].
Contraindicaciones de la donación de vivo1- Contraindicaciones absolutas
a. Donante con proceso tumoral potencialmente transmisible
b. Donante HIV +
c. Donante con diabetes mellitus
d. Donante con obesidad importante (índice de masa corporal > 36 kg/m2)
e. Donante embarazada
f. Donante con enfermedad renal crónica
g. Donante con enfermedad sistémica que pueda alterar en el futuro la función renal
h. Donante menor de edad
i. Donante con incompetencia intelectual
j. Donante con evidencia de coerción
k. Donante con abuso de drogas intravenosas
l. Donante con enfermedad cardiorrespiratoria mayor
2- Contraindicaciones relativas
a. Síndrome metabólico
b. Índice de masa corporal > 32 y < 36 Kg/m2
c. Edad avanzada del donante (> 75 años)
d. Enfermedad psiquiátrica
e. Anomalías importantes de la vía urinaria o del árbol vascular del donante
f. Donante con HTA de difícil control y/o que requiere de más de un fármaco para su tratamiento
Donaciones ABO incompatiblesLa posibilidad de realizar trasplantes de órganos superando la incompatibilidad del grupo sanguíneo ABO es algo que se conoce desde los años 60 y 70 del siglo pasado, pero no cobra un impulso real hasta que varios grupos japoneses publican su experiencia a finales de los años 90. Actualmente se trata de un procedimiento plenamente establecido en Japón y en muchos centros trasplantadores de USA y Europa y Asia [11].
El trasplante ABO incompatible es posible siempre que el título de isoaglutininas frente al donante sean muy bajas. Al tratarse de anticuerpos naturales, la mayoría de los sujetos presentan títulos más o menos elevados, pero raramente lo suficientemente bajos para proceder al trasplante de forma inmediata. Es preciso establecer un tratamiento inmunomodulador que permita reducir la tasa de isoaglutininas hasta el nivel de seguridad y de forma paralela evitar que se resinteticen de forma inmediata. También habrá que administrar una inmunosupresión potente para evitar el rechazo mediado por anticuerpos.
Las experiencias iniciales, especialmente en Japón, utilizaban recambios plasmáticos (RP) y esplenectomía, además de inmunosupresión convencional. También se han venido utilizando técnicas de inmunoadsorción (IA), tanto específica como inespecífica. En Europa se ha desarrollado una técnica de inmunoadsorción específica (IAE) con columnas de policarbonato rellenas de sefarosa con los trisacáridos del grupo A o B ligados a su superficie (Glycosorb®) [12]. Esta técnica sustituye eficazmente a los RP. Por otra parte, también se ha demostrado que el empleo de rituximab puede sustituir eficazmente a la esplenectomía [13] y actualmente se emplea siempre este fármaco. El proceso de inmunomodulación se completa con la administración de inmunoglobulinas intravenosas y un esquema inmunosupresor convencional con ácido micofenólico, inhibidor de la calcineurina, corticosteroides e inducción con basiliximab o anticuerpos antilinfocitarios.
El tratamiento suele iniciarse con la administración de rituximab entre una y cuatro semanas antes de la fecha prevista del trasplante. Las sesiones de RP o IA se inician unos días antes del trasplante. La antelación dependerá de la magnitud del título de isoaglutininas que haga previsible la necesidad de más o menos sesiones. Sólo se realizará el trasplante si se alcanza un título de isoaglutininas (IgG e IgM) por debajo de 1/8. Será necesario determinar isoaglutininas en las tres semanas siguientes al trasplante y realizar RP o IA si fuera necesario. Cuando los títulos de isoaglutininas son muy elevados, es muy probable que la desensibilización, independientemente de si se realiza con plasmaféresis o IAE, sea inefectiva. Como norma orientativa, títulos superiores a 1/256 o 1/512 son predictivos de mala respuesta al tratamiento y aconsejan descartar el trasplante ABO incompatible.
El rechazo agudo mediado por isoaglutininas puede aparecer en las primeras semanas de evolución, aunque es poco frecuente. Transcurridas dos o tres semanas, muchos pacientes presentan elevación de títulos de forma espontánea, sin sufrir rechazo humoral. Este hecho, parecido a un fenómeno de acomodación, se acompaña también con otra característica de este tipo de trasplantes, que es la detección casi sistemática de C4d en las biopsias de protocolo de estos pacientes, en ausencia de rechazo agudo [14].
A largo plazo, los resultados de supervivencia del paciente y del injerto en receptores de trasplantes de donante vivo ABO incompatible son similares a los de los receptores ABO compatibles [11].
Donaciones con Cross-match positivoEl fracaso precoz del trasplante por la presencia de un rechazo agudo mediado por anticuerpos es un fenómeno poco frecuente desde que se instauró la prueba cruzada (XM) de forma sistemática. No obstante, pacientes con XM por citotoxicidad (CDC) negativa frente a su donante (ya sea vivo o cadáver) presentan ocasionalmente un rechazo hiperagudo. Las técnicas para la detección de anticuerpos anti-HLA donante-específicos (DSA) se han ido refinando y sofisticando, especialmente con la introducción de la citometría de flujo (CF) y los ensayos de fase sólida. Estas pruebas han incrementado la sensibilidad y especificidad en la detección de anticuerpos anti-HLA, tanto de clase I como de clase II.
La interpretación de la prueba cruzada es cada vez más compleja. Se considera una contraindicación para el trasplante la presencia de cross-match positivo actual por CDC. La presencia de XM negativo para CDC y positivo para CF dificulta la toma de decisiones. En función de su intensidad el riesgo de rechazo humoral agudo y de pérdida por causa inmunológica puede ser muy alto. La investigación de DSA por fase sólida permite determinar mejor si hay antígenos específicos contra el donante y cuantificarlos (single antigen). También para esta situación, el riesgo de rechazo agudo es mayor cuanto más elevada sea la concentración de DSA.
Actualmente es posible realizar trasplantes a pacientes con DSA y cross-match positivo utilizando técnicas de desensibilización. Existen diversos protocolos de desensibilización, que generalmente suelen emplear recambios RP o IA en combinación con inmunoglobulinas intravenosas, en diversas dosis y frecuencias [15]. También se suele incluir rituximab como parte de los esquemas de desensibilización.
Programa de trasplante cruzado en EspañaEl trasplante renal de donante vivo cruzado consiste en intercambiar recíproca y simultáneamente los donantes de distintas parejas que por motivos inmunológicos o de otro tipo no pueden utilizarse directamente entre la pareja inicialmente estudiada. El motivo habitual suele ser la incompatibilidad ABO o la aparición de una prueba cruzada positiva.
Este tipo de procedimiento se inició en Corea y posteriormente se extendió a Estados Unidos y Holanda [16] [17] [18]. En España se estableció el programa en el año 2009. Habitualmente se envía el riñón extraído al centro implantador, en lugar de tener que desplazarse el donante. Para ello se emplea transporte terrestre o avión de líneas aéreas regulares según sea necesario.
La normativa que establece el procedimiento para realizar trasplantes cruzados se publicó en 2009 y contempla la creación en la Organización Nacional de Trasplantes de un registro único de parejas, designación de centros de referencia para llevar a cabo los trasplantes y requisitos que deben cumplir los centros para ser considerados como tales, procedimiento para inscribir las parejas en el programa y finalmente también establece el sistema de selección de parejas para proceder al intercambio. El programa permite realizar el intercambio de forma simultánea entre tres o más parejas En el año 2011 se incluyó por primera vez un donante altruista en la cadena de donación cruzada. El donante altruista facilita la realización de cadenas cruzadas no simultáneas.
Selección del donanteLos candidatos a donación renal de vivo deben cumplir ciertos requisitos:
- mayoría de edad legal
- estado de salud excelente
- conformidad para la donación tras recibir información adecuada sobre los riesgos y beneficios de esta
- ausencia de coerción o de compensación económica
Cuando existe más de un donante potencial y alguno de ellos es hermano del receptor, el tipaje HLA es especialmente importante, puesto que la mejor opción sería el hermano HLA-idéntico. De no haber ningún hermano HLA-idéntico (o más de uno) deberán tenerse en cuenta también otros factores como la edad, parentesco y grado de motivación. En general se prefiere a los donantes no demasiado jóvenes (mayores de 30 años) o demasiado ancianos (menores de 65 años). Cuando el trasplante es entre cónyuges, los resultados de supervivencia son similares a los de los donantes genéticamente relacionados (excepto en el caso de los hermanos HLA-idénticos) por lo que debe dárseles la misma consideración que a los padres o hermanos.
Es obligatorio realizar alguna de las entrevistas con el candidato a donante de forma individual y con la máxima confidencialidad, para que pueda expresar de forma libre su verdadera disposición a la donación y en el caso de que se detecten dudas sobre su motivación o excesiva presión familiar, se le debe ayudar a reconsiderar su decisión.
Protocolo de estudio del posible donanteEl procedimiento inicial contempla la valoración inmunológica (Grupo ABO, compatibilidad HLA y en pacientes de riesgo inmunológico una prueba cruzada inicial), historia clínica, exploración física y analítica general de sangre y orina. Algunos centros incluyen en esta primera etapa una ecografía abdominal y un test de tolerancia oral a la glucosa. Con esta evaluación inicial se suelen descartar muchos posibles donantes, tanto por problemas inmunológicos como médicos. Una vez superada satisfactoriamente esta etapa inicial se procederá a completar la evaluación del donante. En la (Tabla 2) se resume un esquema habitual empleado en la valoración clínica del donante.
El estudio nefrourológico es un aspecto esencial. Nos debemos asegurar que el donante goza de una función renal normal, ausencia de proteinuria, sedimento de orina sin anomalías, carece de historia de infecciones urinarias de repetición o litiasis renal.
La función renal debe determinarse simultáneamente por varias técnicas: filtrado glomerular estimado (MDRD o CKD-EPI)) y aclaramiento de creatinina en orina de 24 horas. En donantes con filtrado glomerular en el límite bajo deberá realizarse un filtrado glomerular por métodos isotópicos. Deberá rechazarse los donantes con filtrado glomerular inferior a 70-80 ml/min.
Otro aspecto esencial es el estudio de imagen de los riñones. Actualmente la técnica de preferencia es la angioTC, en combinación con RX abdomen, que permite, en una sola exploración, estudiar la morfología de los riñones, arterias y venas y finalmente la vía excretora.
Estudio inmunológico de la pareja donante-receptorEl estudio inmunológico comprende, además del grupo sanguíneo ABO, el tipaje HLA, la determinación de anticuerpos antilinfocitarios y la prueba cruzada.
En caso de haber varios candidatos, es preferible realizar en primer lugar el tipaje HLA y una vez descartados los menos compatibles se procederá con el resto del estudio inmunológico.
Se deberá tener en cuenta diversos factores de riesgo inmunológico:
- Presencia de anticuerpos antilinfocitarios, en especial si son donante-específicos
- Antecedentes de trasplante renal con pérdida de origen inmunológico
- Mujer con antecedentes de gestaciones que va a recibir un riñón de su esposo o de un hijo
Una evaluación inmunológica completa debe comprender el tipaje HLA de donante y receptor, la determinación de anticuerpos anti-HLA mediante técnicas de fase sólida para detectar anticuerpos donante-específicos y prueba cruzada (tanto por técnicas de citotoxicidad como por citometría de flujo). La prueba cruzada deberá repetirse en los días previos al trasplante.
El estudio inmunológico, en especial cuando el paciente esté hipersensibilizado, no debería descartar a los potenciales donantes ABO-incompatibles, puesto que se podría dar el caso de que fueran los más compatibles desde el punto de vista del sistema HLA.
Inmunosupresión del receptor de donante vivoNo existe un protocolo de inmunosupresión específico para el trasplante de donante vivo, pero teniendo en cuenta la compatibilidad inmunológica, la edad, el mínimo daño isquémico y la ausencia de patología nefrológica en el donante, deberá diseñarse un régimen inmunosupresor que permita optimizar al máximo la función renal.
En pacientes sin factores de riesgo inmunológico se aconseja utilizar un esquema inmunosupresor cuádruple con un inhibidor de la calcineurina, ácido micofenólico, prednisona e inducción con anticuerpos anti-CD25. El régimen más frecuentemente utilizado en España combina tacrolimus, mofetil-micofenolato/micofenolato sódico, prednisona y basiliximab. El tratamiento se suele iniciar tres días antes del trasplante (tacrolimus y ácido micofenólico). Los corticosteroides deberían retirarse antes de finalizar el primer año, aunque no existe una estrategia más efectiva que otra.
También se está utilizando inhibidores de mTOR (sirolimus/everolimus) en sustitución del ácido micofenólico, con resultados similares.
En pacientes con factores de riesgo inmunológico debería administrarse inducción con anticuerpos antitimocíticos en lugar de basiliximab. Muchos centros también emplean rituximab, aunque no hay datos que permitan afirmar de forma concluyente su eficacia en este tipo de pacientes.
En receptores de riñón de hermano HLA-idéntico se puede prescindir de los corticosteroides de forma rápida (una semana) y retirar gradualmente el inhibidor de la calcineurina a partir de los seis meses del trasplante.
Legislación española sobre el trasplante con donante vivoLa regulación legal de las donaciones y trasplantes renales procedentes de donantes vivos se establece en la Ley 30/1979, de 27 de octubre de 1979 y en el Real Decreto 2070/1999, de 4 de enero de 2000. Este marco legal establece los requisitos esenciales que deben concurrir en el donante y en el centro donde se vaya a realizar el trasplante.
Algunos aspectos esenciales son:
Sólo se podrán llevar a cabo en centros específicamente acreditados para ello.
El donante debe ser mayor de edad, gozar de plenas facultades mentales y de un estado de salud adecuado
El donante habrá de ser informado previamente de las consecuencias de su decisión, debiendo otorgar su consentimiento de forma expresa, libre, consciente y desinteresada
No podrá realizarse la extracción de órganos de personas que, por deficiencias psíquicas, enfermedad mental o cualquier otra causa, no puedan otorgar su consentimiento en la forma indicada. Tampoco podrá realizarse la extracción de órganos a menores de edad, aun con el consentimiento de los padres o tutores
En ningún caso se extraerán ni se utilizarán órganos de donantes vivos cuando por cualquier circunstancia pudiera considerarse que media condicionamiento económico o de otro tipo, social o psicológico
Presentación ante el Comité de Ética Asistencial del hospital.
Para proceder a la extracción de órganos de donante vivo, el interesado deberá otorgar por escrito su consentimiento expreso ante el juez encargado del Registro Civil.
Seguimiento del donante vivo a corto, medio y largo plazoLa nefrectomía supone un escaso riesgo para la salud del donante pero es recomendable establecer un seguimiento periódico para asegurarnos que la función renal se recupera de forma adecuada y se mantiene normal a largo plazo. Por otra parte, es especialmente recomendable detectar precozmente los factores de riesgo (HTA, hiperlipidemia, Diabetes mellitus, etc.) que pudieran aparecer en el futuro, para prevenir complicaciones de la función renal.
Se recomienda una primera visita dentro de las primeras semanas tras el alta hospitalaria, seguidas de otros controles clínicos y de la función renal a los 3 y 6 meses y posteriormente de forma anual.
Habitualmente la función renal se recupera de forma rápida (días o semanas) pero en algunos casos se necesita meses hasta alcanzar el nivel basal. En general el riñón remanente crece en tamaño y en función (hiperplasia vicariante) y compensa hasta un 70-80% el valor de función renal previo a la extracción.
La incidencia de insuficiencia renal en donantes de vivo es muy baja, aunque se estima que hay más casos de los públicamente reportados. Aunque un estudio publicado por la Universidad de Minnesota [7], ampliamente referenciado, demostraba que la incidencia de insuficiencia renal crónica en los donantes era inferior a la de la población general, otros estudios más recientes, en los que el comparador no es la población general sino una cohorte de sujetos con un grado de salud que sería comparable a los donantes, observan un riesgo relativo estadísticamente más elevado de insuficiencia renal en los donantes. A pesar de ello, en términos absolutos el riesgo es tan bajo que los autores concluyen que no hay razones para desaconsejar la donación de vivo [7] [8] [19].
Se acepta que los donantes tienen una incidencia algo mayor de HTA que la población general y una incidencia también algo mayor de episodios de preeclampsia en mujeres uninéfricas posdonación.