La ecografía clínica en manos del nefrólogo es hoy por hoy un concepto novedoso para algunos, entendiéndose esta como la ecografía aplicada a los diferentes problemas clínicos con los que nos podemos encontrar en nuestra práctica habitual, muy diferente a la que todos conocemos o hacemos en nuestras unidades como la ecografía renal o la ecografía del acceso vascular.
Es una herramienta que nos ofrece muchas utilidades y con un conocimiento mínimo nos ayudará a mejorar nuestras capacidades y habilidades como nefrólogos.
En los pacientes con ERC que desarrollan hiperparatiroidismo secundario (HPTS), el diagnóstico fundamentalmente se hace por la determinación de los niveles de la hormona paratiroidea (PTH) en sangre. Sin embargo, algunas técnicas de imagen como la ecografía cervical, los estudios gammagra´ficos (talio, 99mTc-MIBI y 99mTc-tetrofosmina), la tomografía por emisión de positrones (PET) y la resonancia magnética (RM), pueden ser útiles, especialmente para identificar la ubicación de las glándulas, determinar el tamaño, valorar el estado funcional de las mismas y como complemento de cara a la planificación de la intervención quirúrgica [1] [2] [3].
Es importante destacar que el empleo y la realización de estas pruebas no es imprescindible para el diagnóstico, pero son de gran importancia si se piensa emplear una técnica mínimamente invasiva o si se sospecha la presencia de glándulas paratiroideas ectópicas- Además, en caso de un resultado negativo de los estudios de localización, no debería modificar el planteamiento quirúrgico si estuviera indicado, ya que aun con la mejoría de la sensibilidad de las técnicas de imagen, son inferiores a las habilidades del cirujano.
Anatomía de las glándulas paratiroideasEl 85% por ciento de los individuos tienen 4 glándulas paratiroides, dos superiores y dos inferiores, que por lo general están situadas por detrás del tercio medio-superior y del polo inferior, respectivamente, de cada uno de los lóbulos tiroideos. De 1 a 7% de los individuos tienen sólo 3 glándulas paratiroides y del 3 al 13% tienen glándulas paratiroideas supernumerarias. En este último caso, las glándulas son generalmente ectópicas. Esta variación en el número y la ubicación es debido a diferencias en el desarrollo embriológico. Las glándulas paratiroides superiores se originan en la cuarta bolsa faríngea de la glándula tiroides y se requiere poco desplazamiento para que adopten su posición definitiva, mientras que las glándulas inferiores se desarrollan a partir de la tercera bolsa faríngea y migran hacia el polo. Como resultado de esta mayor migración embriológica, las glándulas paratiroides inferiores pueden ser más propensas a adoptar una posición ectópica que las glándulas paratiroides superiores [2] [4].
En promedio las glándulas paratiroides miden de 2-7mm de longitud, 2-4 mm de ancho, y 0,5 a 2 mm de espesor y un peso aproximado de 40mg (volumen de 0,04 cm3).
Ecografía cervicalLa ecografía cervical fue la primera técnica de imagen usada para estudiar las glándulas paratiroides y a día de hoy sigue siendo un método muy recomendable por su simplicidad y fácil acceso en prácticamente todos los centros hospitalarios, su bajo coste y sobretodo la garantía de ser una herramienta no invasiva, que en manos de un operador con un mínimo de experiencia, puede llegar a alcanzar suficiente especificidad en la evaluación no solo de la localización, sino también del tamaño, la forma y el tipo de hiperplasia de la glándula paratiroidea.
Consideraciones técnicas.Del equipo. Para la exploración ecográfica de las glándulas paratiroides, el estudio debe ser realizado con un transductor lineal de una frecuencia entre 7,5 a 12 MHz para la detección y medición, aunque en pacientes obesos o con un bocio multinodular, podría ser necesaria la utilización de un transductor de baja frecuencia (5-7,5MHz). Adicionalmente la disponibilidad de ultrasonografía Doppler color y "power" Doppler pueden aportar datos adicionales a la evaluación de las características de un nódulo paratiroideo.
Del procedimiento. El examen debe ser realizado con el paciente en decúbito dorsal, con el cuello en ligera hiperextensión. Se deben obtener imágenes de ambos lados del cuello en al menos dos proyecciones: Transversal y longitudinal.
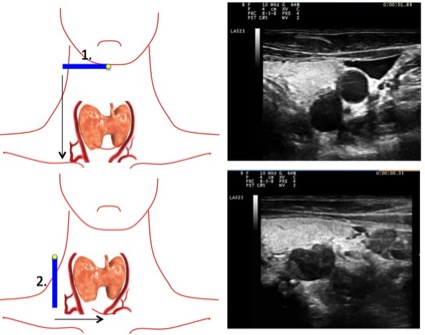
La exploración se lleva a cabo situando el transductor en posición trasversal, con el marcador a la derecha del paciente, ubicándolo por debajo de la glándula submandibular, deslizando caudalmente hasta la vena subclavia, utilizando como referencia la arteria carótida, el musculo largo del cuello y la glándula tiroides, dado que la mayoría de las glándulas paratiroideas se encontrarán posterior e inferior a la glándula tiroides. Luego situaremos el transductor en posición longitudinal a nivel de la arteria carótida deslizándolo hacia dentro hasta la línea media traqueal, el marcador del transductor siempre apuntará hacia la cabeza del paciente (orientación cefálica) (Figura 1).
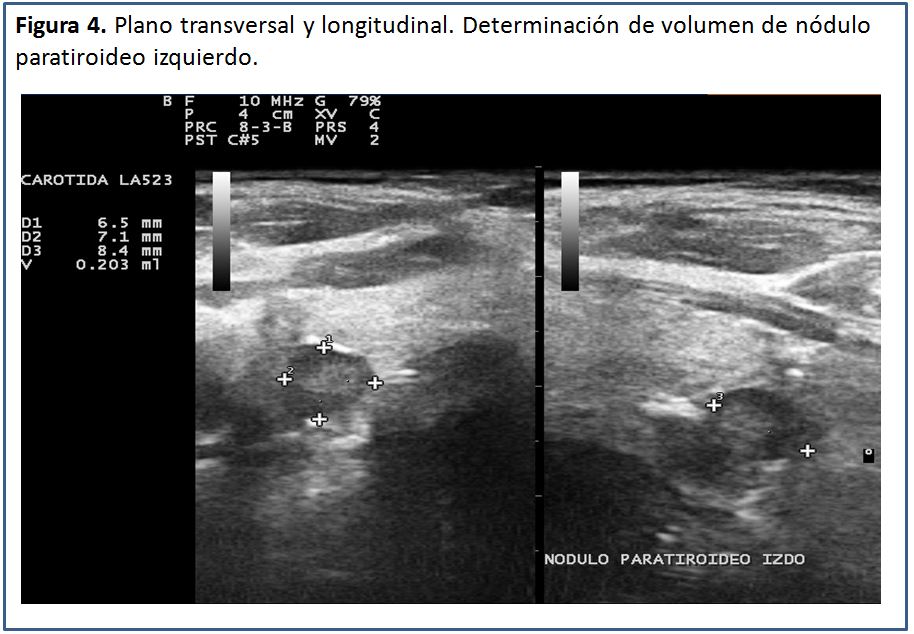
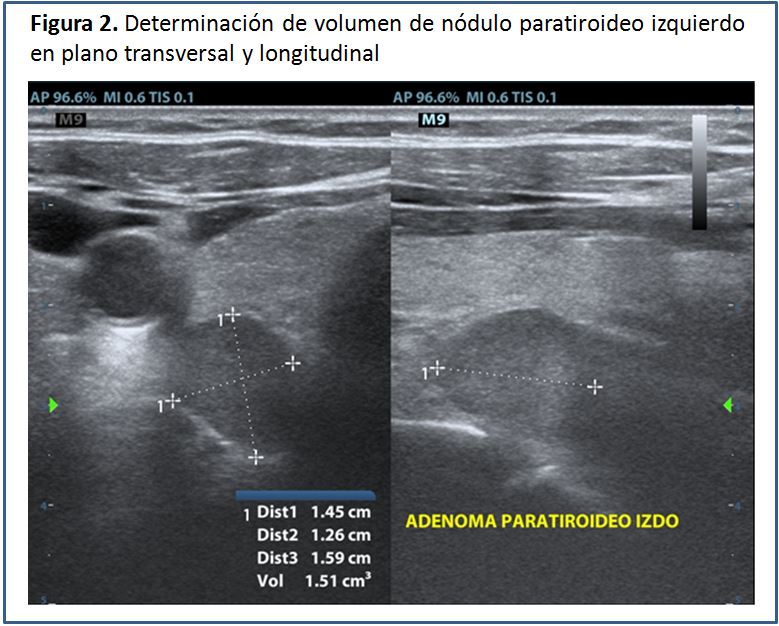
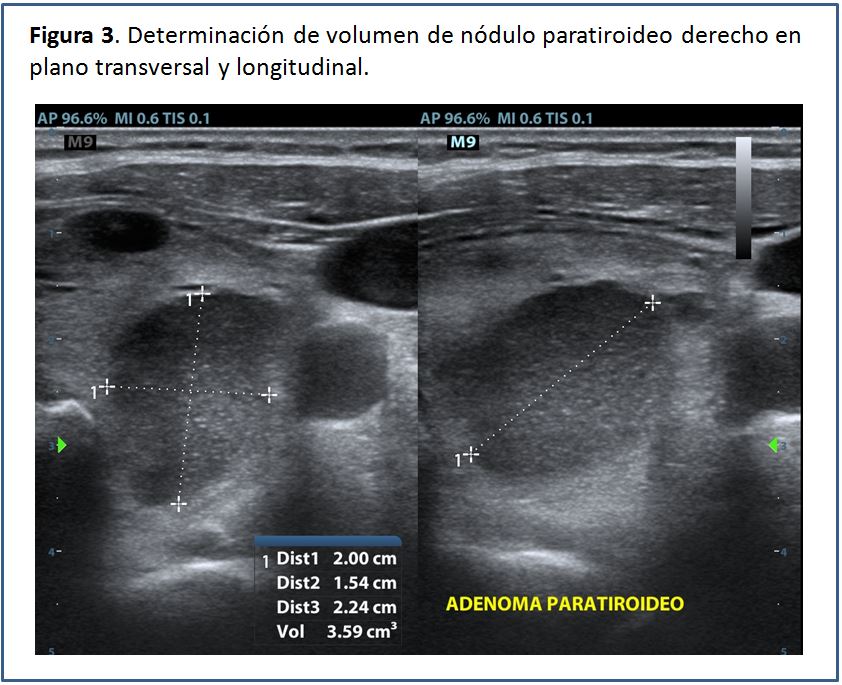
Una vez identificada la glándula paratiroides aumentada de tamaño, el volumen se puede calcular mediante el software que incluyen la mayoría de los equipos o bien manualmente empleando la fórmula para volumen de las formas elipsoides:
Volumen= diámetro anteroposterior x diámetro transverso x diámetro longitudinal x factor de conversión.
Los diámetros son expresados en mm. El factor de conversión es 0,529. El resultado sale en mm3, el cual hay que dividir entre 1.000, para obtener el resultado en cm3 (cc), que contiene menos cifras. El volumen total resulta de la sumatoria del volumen de todos los nódulos paratiroideos encontrados (Figura 2) (Figura 3) (Figura 4).
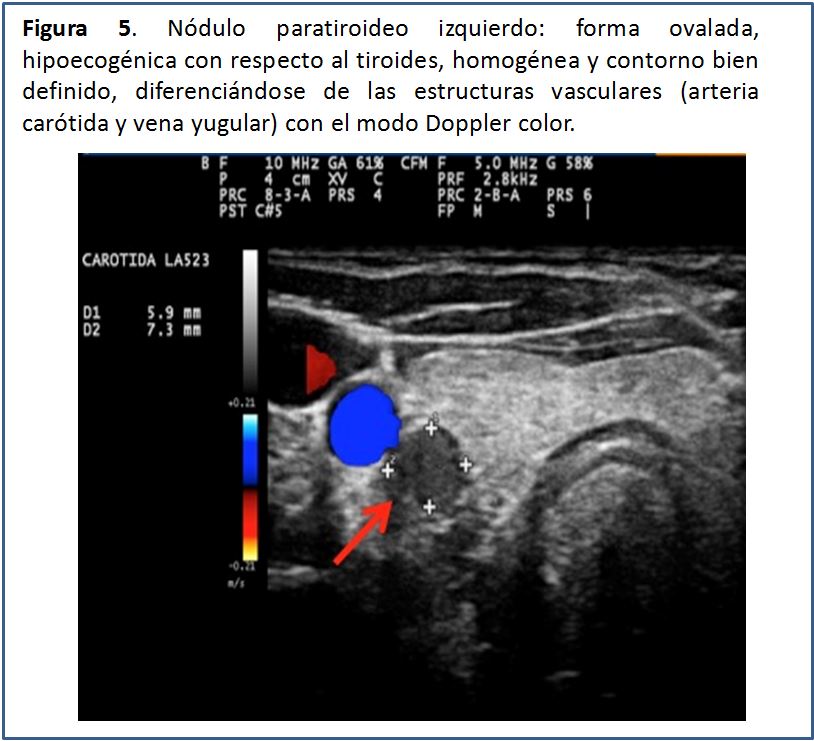
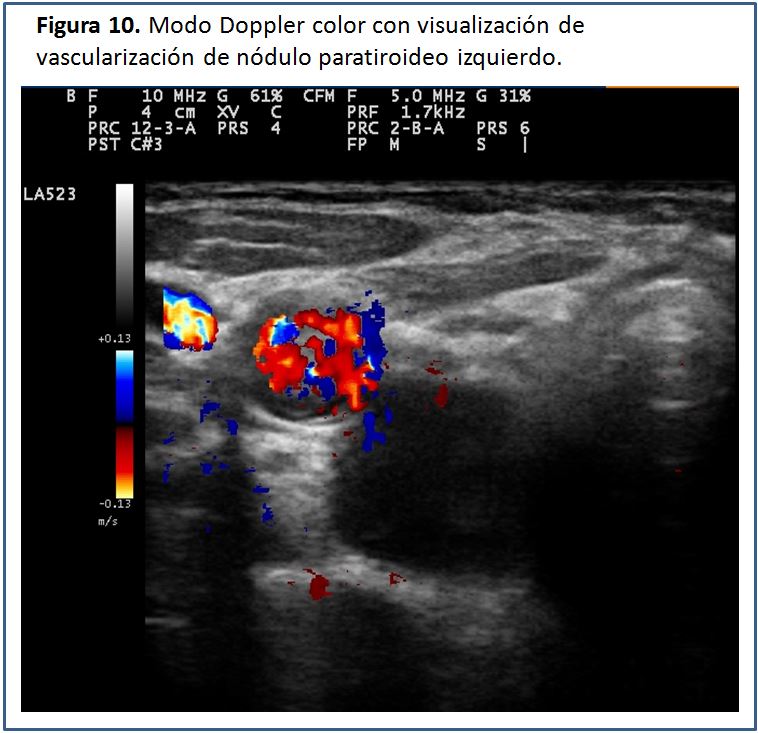
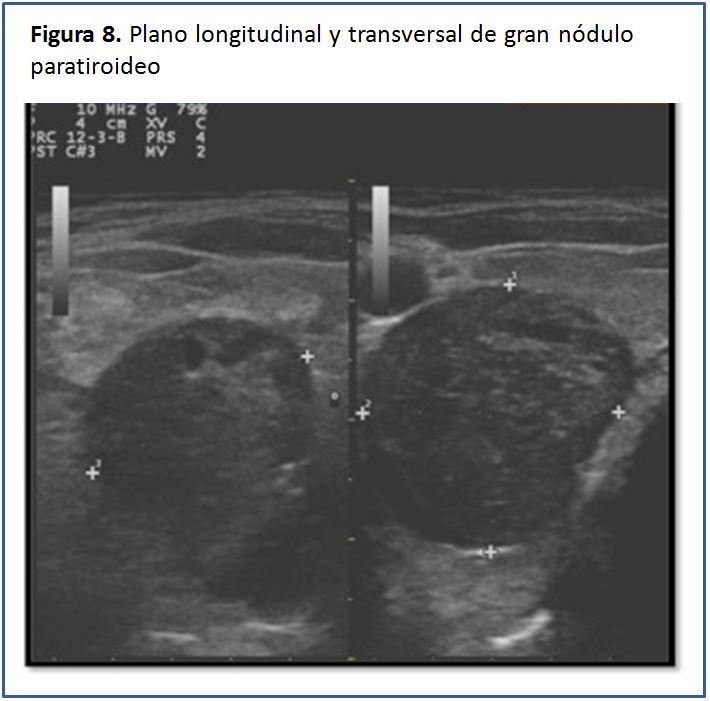
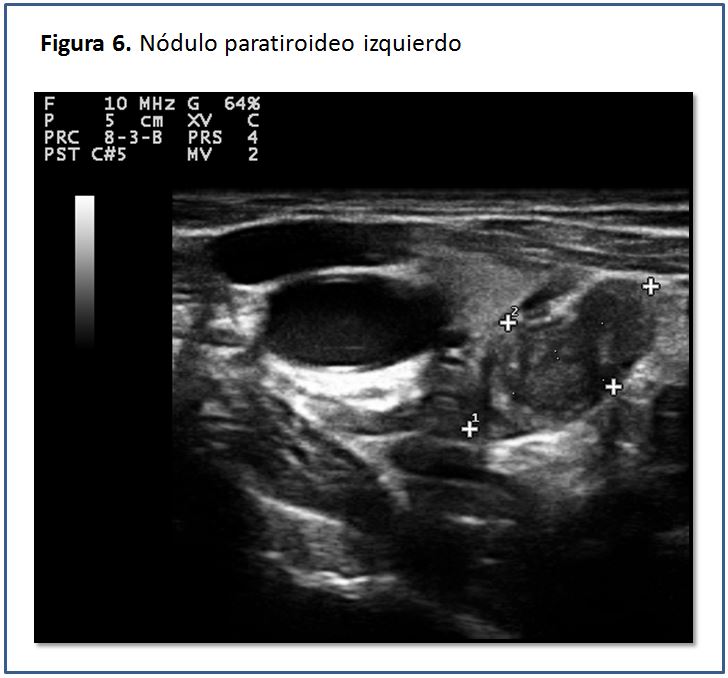
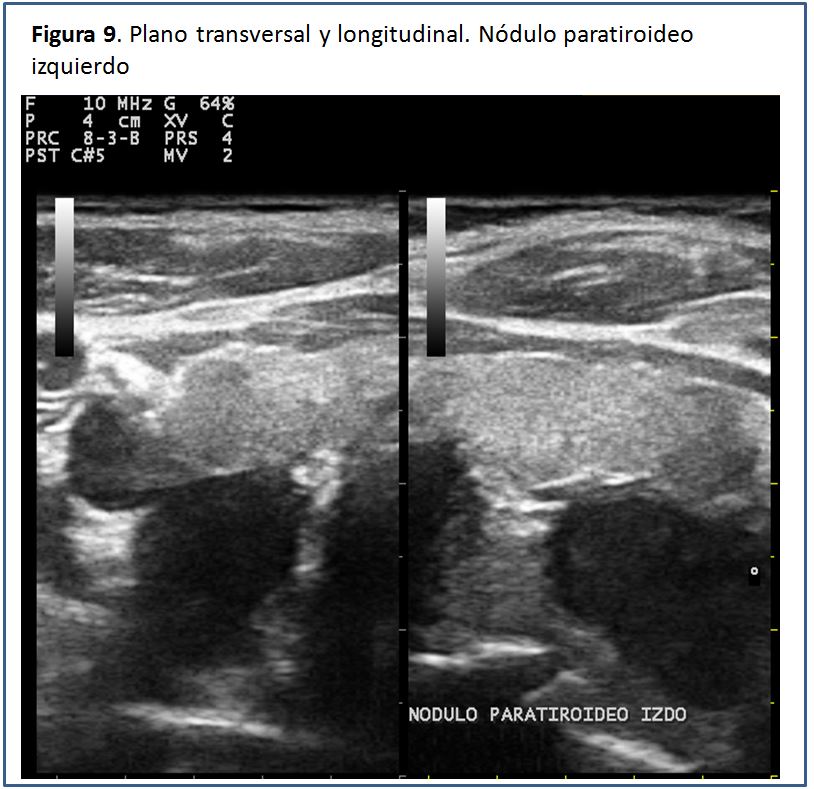
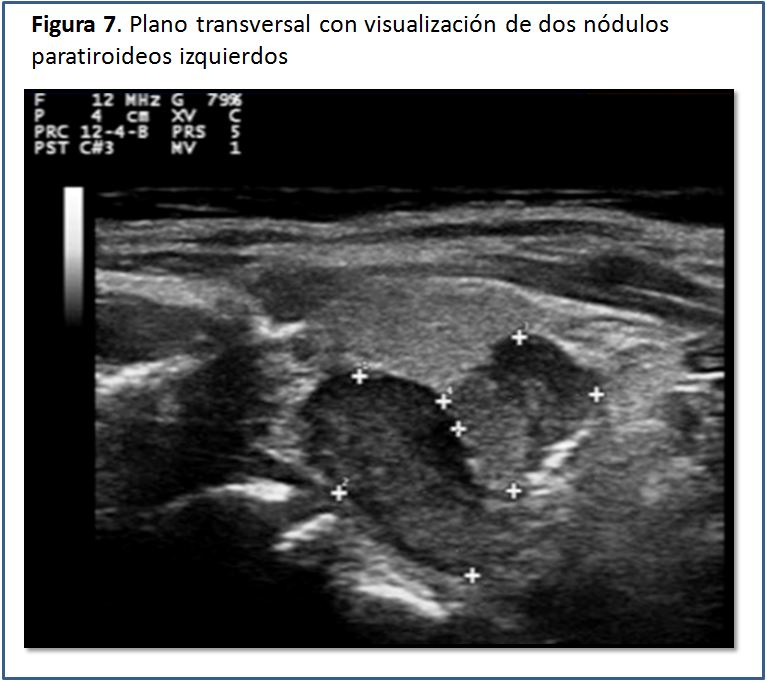
Características ecográficas de la glándula paratiroides.Las glándulas paratiroides en condiciones normales no pueden ser visualizadas mediante el estudio ecográfico. Esto es debido a su pequeño tamaño y el hecho de que su ecogenicidad es muy homogénea y similar a la de la glándula tiroides, por lo que es casi imposible identificarlas [5], pero cuando están aumentadas de tamaño, las glándulas paratiroides se pueden percibir como una masa sólida ovalada, hipoecogénica con respecto a la glándula tiroides, con una densidad homogénea y contornos bien delimitados por una línea ecogénica que corresponde a la cápsula glandular (Figura 5) (Figura 6) (Figura 7) (Figura 8) (Figura 9). A la evaluación con el Doppler color se aprecia captación de flujo a nivel del contorno de la glándula por escasos vasos dispersos (Figura 10).
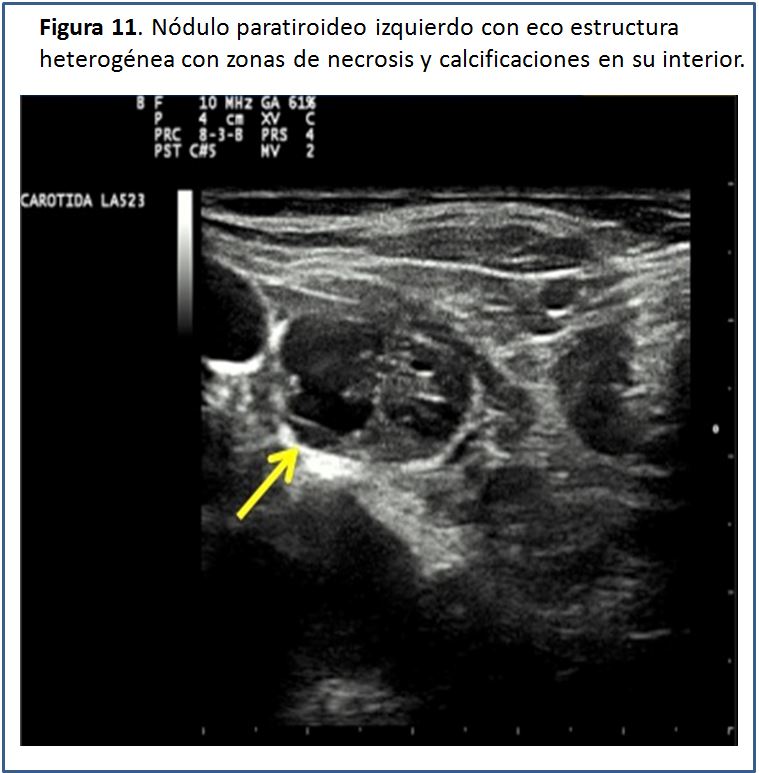
En aproximadamente el 15-20% de los casos, la ecoestructura glandular puede ser heterogénea, debido a la presencia de necrosis y/o hemorragia o incluso a la presencia de calcificaciones en su interior, especialmente en las glándulas paratiroides de gran tamaño [2] (Figura 11).
Varios estudios han demostrado una excelente correlación entre las mediciones ecográficas y el peso de las glándulas resecadas y algunos han demostrado una correlación entre el tamaño glandular, la gravedad y el pronóstico para el hiperparatiroidismo secundario y su respuesta al tratamiento [6] [7] [8] [9] [10].
Indicaciones de la ecografía paratiroideaSe recomienda la ecografía paratiroidea como método diagnóstico para las siguientes finalidades:
Confirmar la presencia de un nódulo o varios nódulos paratiroideos en pacientes con HPTS.
Evaluación, localización y caracterización de los nódulos.
Seguimiento evolutivo de los nódulos paratiroideos.
Servir como examen complementario y confirmatorio de nódulos detectados por otros métodos diagnósticos como gammagrafía, tomografía computarizada, resonancia magnética nuclear o tomografía por emisión de positrones.
Evaluación del volumen paratiroideo con miras a plantear paratiroidectomía.
Realización de procedimientos o tratamientos guiados por ultrasonido, especialmente en pacientes con contraindicación para la cirugía. Requiere un tamaño mínimo de 5-10 mm, se puede realizar punción aspiración con aguja fina (PAF) o ablación de nódulos paratiroideos con inyección percutánea de alcohol o calcitriol [11] [12]. No hay demasiada experiencia y no se hace de manera generalizada.
Sensibilidad y especificidad de la ecografía paratiroideaEn general, tanto la sensibilidad y la especificidad de la ecografía en el estudio de las glándulas paratiroideas pueden estar condicionadas por diversos factores, lo que refleja una gran variabilidad en la literatura, encontrándose descrita una sensibilidad que oscila entre el 53% y el 93% [2] [13] [14]. Existe discusión sobre los factores que pueden influir en la localización glandular con esta técnica, como son el tamaño de los adenomas, la localización ectópica de las glándulas, la coexistencia de enfermedad tiroidea e incluso los niveles de calcio y PTH [6] [13] [14].
En cuanto a la especificidad, la detección de glándulas paratiroideas patológicas va a depender de la experiencia y formación del explorador, además de los problemas de diagnóstico diferencial que pueden plantearse con las adenopatías de la cadena cervical y los nódulos tiroideos, existen dos que están relacionados con las estructuras anatómicas: la vena tiroidea (puede cruzar el tercio inferior del lóbulo tiroideo y confundirse con una glándula paratiroides agrandada) y el músculo largo del cuello [2].
En el estudio de Schneider et al., publicado en 2019, localizan correctamente 225 de 232 adenomas en ecografías realizadas por un endocrinólogo o cirujano endocrino con experiencia, concluyendo que podría ser suficiente como única prueba de imagen en pacientes con HPTP cuando es realizada por personal experto [15] [16]. Sus resultados son excelentes debido a la elevada experiencia de los profesionales que la realizan.
Pero el interés de la ecografía paratiroidea en manos del nefrólogo, va más allá de la detección y localización de la glándula, ya que su hallazgo aparte de tener un valor pronóstico, puede ser un factor predictivo de la respuesta al tratamiento, encontrándose en numerosos estudios asociación entre el aumento del volumen glandular > 0,5cc3 y menor tasa de respuesta al tratamiento con fármacos antiparatiroideos [7] [8] [9] [10].
Con base en lo anterior, es claro que el enfoque terapéutico del hiperparatiroidismo secundario debe de ser modificado, idealmente según los hallazgos en la ultrasonografía: en ausencia de respuesta a análogos de vitamina D (seis meses de tratamiento) o cuando estos últimos generen efectos colaterales (hipercalcemia o hiperfosfatemia) en pacientes con hiperparatiroidismo secundario con PTH intacta mayor a 500 pg/ml e hiperplasia glandular (volumen mayor a 0,3cc3), se debe recurrir a otras alternativas terapéuticas como calcimiméticos, inyecciones intraglandulares de alcohol o calcitriol o paratiroidectomía quirúrgica [11][12]
ConclusiónLa ecografía paratiroidea realizada a la cabecera del paciente, es una técnica útil y de fácil realización por parte del nefrólogo, que podría incorporarse de forma rutinaria al estudio de los pacientes con HPTS, contribuyendo al seguimiento de los mismos. Podría además ser una técnica complementaria para establecer la conducta terapéutica de nuestros pacientes y para valorar la respuesta al tratamiento con fármacos antiparatiroideos, de cara a la planificación oportuna de paratiroidectomía o de técnicas mínimamente invasivas.