1. Tipos membrana
- Membranas celulósicas
- Membranas sintéticas
2. Espesor de la membrana
3. Definiciones y propiedades de las membranas
- Hidrofilia
- Hidrofobia
- Polaridad
- Membranas simétricas y asimétricas
4. Biocompatibilidad
- Activación del complemento
- Leucopenia-neutropenia
- Moléculas de adhesión
- Activación Celular. Liberación de citoquinas
- Sistema de coagulación
- Fibrinolisis
- Reacciones a la membrana de AN69
- Reacciones a la membrana
5. Permeabilidad
- Permeabilidad al agua
- Permeabilidad a los solutos
6. Beneficios de la alta permeabilidad
- Dislipemia
- Amiloidosis asociada a la diálisis
- Anemia
- Mayor conservación de la función renal residual
- Respuesta inflamatoria crónica
- Morbilidad y mortalidad
7. Adsorción
8. Otros factores relacionados con las propiedades de las membranas
- Esterilización
- Temperatura del líquido de diálisis
- Reuso
- Contaminación del líquido de diálisis
9. Nuevos dializadores
- Membranas de medio y alto cut-off
10. Resumen
DIALIZADORESEl dializador, es la parte fundamental del sistema de depuración extracorpórea con hemodiálisis, siendo el compartimento donde se produce la eliminación de las toxinas urémicas retenidas y generadas por la enfermedad renal crónica. Además, la diálisis juega un papel crucial en la restauración de la homeostasis del medio interno corrigiendo la acidosis y las alteraciones hidro-electrolíticas [1]. El dializador, se compone de una carcasa de recubrimiento, que contiene una membrana semipermeable que separa dos compartimentos bien diferenciados, por donde circulan la sangre y el líquido de diálisis respectivamente.
Los dializadores, se pueden clasificar de acuerdo con su diseño geométrico, según la composición de la membrana y de acuerdo con su capacidad de eliminar solutos de la sangre [2]. En lo que respecta al diseño geométrico, se pueden dividir en dos tipos placa y fibra hueca o capilar. La placa prácticamente ya no se utiliza y casi todos los dializadores son del tipo capilar. En el modelo capilar, la sangre circula por el interior de las fibras, que están colocadas en un haz a lo largo del filtro, que permanece fijado a los extremos de la carcasa mediante unos anclajes. Las fibras tienen un diámetro interno de entre 180-210 micras, con un grosor de la pared de la fibra que oscila entre las 30-40 micras y entre 0,9 y 2,5 m2 de superficie. El manojo de fibras está ubicado en un espacio encapsulado, herméticamente cerrado que impide el contacto entre el líquido de diálisis y la sangre. El líquido de diálisis circula en sentido opuesto, por la parte exterior de las fibras. La mayoría de los dializadores están diseñados para reducir al máximo las zonas de espacio muerto o de bajo flujo y evitar en lo posible la coagulación de la sangre o el acúmulo de aire que puede condicionar un descenso de la eficacia depuradora. Las principales ventajas que presenta el dializador capilar sobre las placas, es el menor volumen sanguíneo de cebado. Además, no se modifica su capacidad de almacenamiento de sangre, al incrementar la presión transmembrana durante la diálisis, ya que su distensibilidad es mínima. Las principales desventajas del dializador capilar son que tiene un mayor volumen de sangre residual al finalizar la sesión de diálisis y la necesidad de anclajes para fijar el haz de fibras a la carcasa. Recientemente, se han introducido algunas modificaciones estructurales, tanto en la entrada de sangre como del líquido de diálisis, para incrementar su eficiencia depuradora [3].
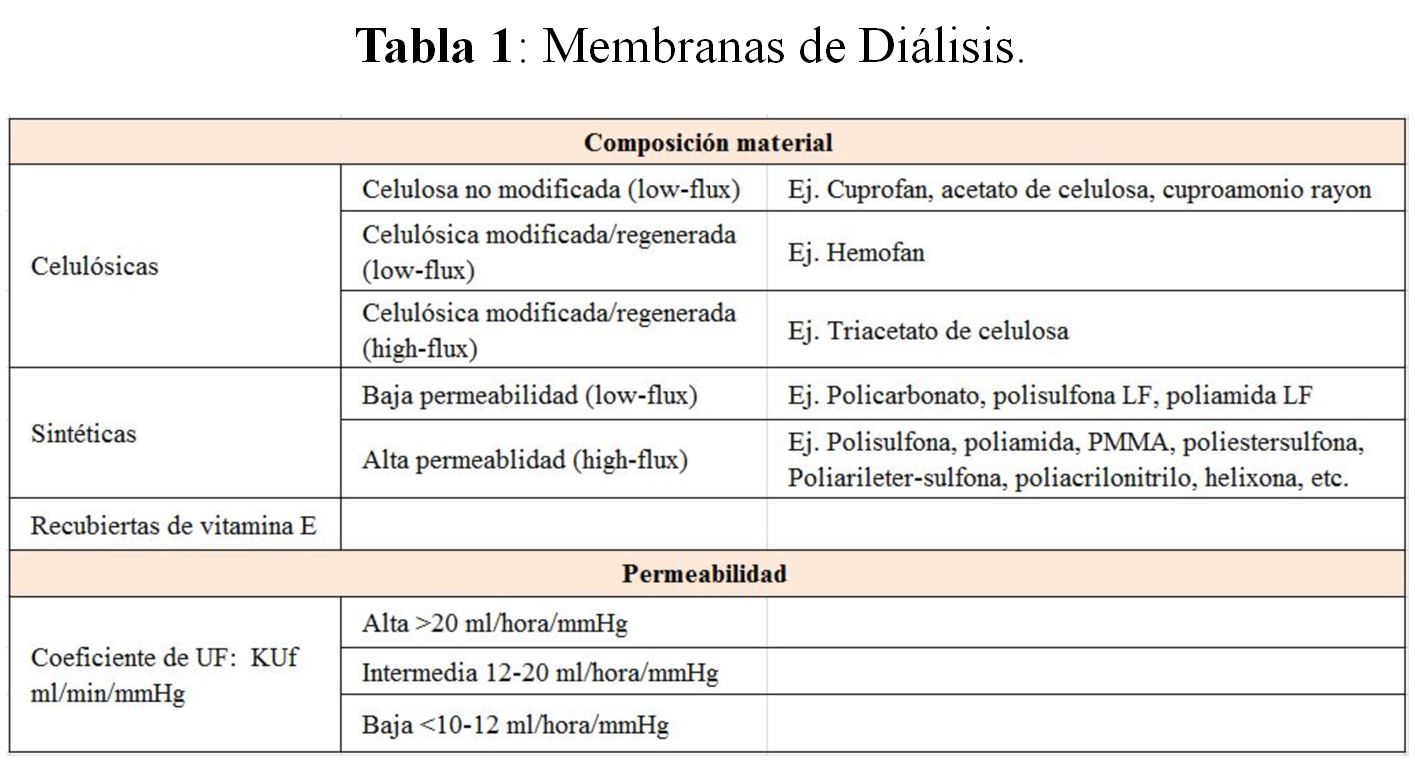
Tipos de MembranaLa parte fundamental del dializador es la membrana de diálisis. La composición química y la capacidad de depuración son las dos características que se utilizan actualmente para su clasificación [2]. Las membranas son generalmente polímeros (repetición de monómeros idénticos). En lo que se refiere al tipo de membrana se pueden dividir, teniendo en cuenta su composición, en celulósicas, celulósicas modificadas y sintéticas, aunque la tendencia actual es a definirlas en relación con sus características y propiedades. En este sentido, se han agrupado de acuerdo con su grado de biocompatibilidad, permeabilidad, eficacia depuradora, distribución simétrica o asimétrica (según la distribución y el tamaño de los poros), polaridad, y sus propiedades hidrofílicas e hidrofóbicas [4]. La clasificación más utilizada en la clínica es según su composición y grado de permeabilidad (Tabla 1).
Membranas celulósicasEstán compuestas de cadenas de polisacáridos con grupos hidroxilo libres, que contribuyen a su capacidad hidrofílica y bioincompatibilidad. La substitución de los grupos hidroxilo mejora su biocompatibilidad. En el acetato de celulosa se sustituye el 75-80% de los grupos hidroxilo por radicales de acetato. El triacetato de celulosa tiene casi completamente sustituidos todos los grupos hidroxilo y es la única membrana celulósica que puede tener alta permeabilidad. Recientemente, se han introducido modificaciones en la composición del triacetato de celulosa, el triacetato de celulosa asimétrico, estos dializadores de nueva generación presentan una mayor permeabilidad con una elevada eficacia depuradora, lo que permite su adecuada utilización en la hemodiafiltración en línea [5].
Membranas sintéticasEste tipo de membranas posee una matriz esponjosa central, que les confiere resistencia, recubierta por dos películas porosas. Las propiedades del transporte difusivo vienen determinadas por esta matriz esponjosa, mientras que las del transporte convectivo se corresponden con las películas que la recubren, que pueden ser hidrofílicas o hidrofóbicas. Dentro del grupo de las hidrofóbicas hay algunas (polisulfona, polimetilmetacrilato, poliacrilonitrilo) que pueden ser de alta y baja permeabilidad. Las membranas sintéticas hidrofílicas, policarbonato y etilen-vinil-alcohol (EVAL), tienen baja trombogenicidad por lo que teóricamente requieren menos heparina, actualmente, están en desuso.
Espesor de la membranaEs un aspecto fundamental en el transporte difusivo. La difusión es el mecanismo fundamental de transporte de masas en la hemodiálisis (HD), y diferentes variables afectan este proceso, incluido el gradiente de concentración, coeficiente de difusión de solutos (dependiendo de su peso molecular y radio), temperatura de las fases fluidas, superficie de la membrana y distancia para la difusión (espesor de la membrana). En la hemodiálisis, aunque la resistencia al transporte de pequeñas moléculas puede ser significativo en el compartimento de sangre y dializado debido a las capas de fluido, la principal barrera para el transporte de solutos se encuentra en la membrana. Además de la densidad, el tamaño y la distribución de los poros, el grosor de la membrana es uno de los parámetros más importantes. Una ventaja particular para las membranas celulósicas es su estructura de pared delgada, con un espesor de membrana que varía generalmente de 5 a 15 ¿m. Las versiones originales de las membranas sintéticas no eran muy adecuadas para la transferencia de masa difusiva, ya que el grosor de su pared variaba de 70 a 100 ¿m. Posteriormente, el espesor de las membranas sintéticas modernas se redujo a 30 ¿m o menos. Sin embargo, el aspecto más importante fue la reducción del espesor de la capa interna a 1-2 ¿m. Esto facilitó la reducción de la resistencia de la membrana para el transporte y permitió la utilización de modalidades de difusión/convección combinadas como la diálisis de alto flujo y la hemodiafiltración [6] [7].
Definiciones y propiedades de las membranasLas membranas tienen una serie de características estructurales que les confieren unas propiedades concretas en lo que respecta a su eficacia depuradora.
HidrofiliaQue absorbe agua. Pueden interaccionar con las células y proteínas activando el complemento. En general, cuanto más hidrofílica es una membrana mayor trasporte difusivo y menor biocompatibilidad.
HidrofobiaNo interaccionan con el agua. Adsorben proteínas, son más porosas, tienen un elevado coeficiente de UF y son más biocompatibles.
PolaridadSon polares las que tienen carga eléctrica de superficie. La polaridad es en parte responsable del fenómeno difusivo. La carga eléctrica o potencial de superficie de todas las membranas es negativa, con variaciones: AN 69 con potencial de superficie de -100mV o Polisulfona de 20 mV. Las membranas con fuerte carga eléctrica negativa en su superficie (PAN, y especificamente el AN69) aumentan la generación de bradikinina, pudiendo inducir severas reacciones anafilactoides en pacientes que toman IECA. La modificación de la membrana ha permitido disponer de dializadores similares (AN68ST) que reducen marcadamente la generación de bradiquinina.
Membrana simétrica y homogéneaDe espesor homogéneo, presentan una densidad y tamaño de poro uniforme, siendo la permeabilidad inversamente proporcional al espesor. Son membranas simétricas: todas las celulósicas y las membranas EVAL y AN69.
Membrana asimétricaPresentan diferentes distribuciones de densidad y tamaño de poro entre las dos películas de recubrimiento y la matriz esponjosa. Son membranas asimétricas la poliamida, polifenileno, PMMA, polisulfona, poliestersulfona y el policarbonato.
La composición y las propiedades anteriormente mencionadas hacen que las membranas se pueden clasificar de acuerdo a su biocompatibilidad, permeabilidad y capacidad de adsorción.
BiocompatibilidadEl proceso de polimerización y la composición química junto con la mezcla de polímeros puede contribuir a un potencial Z específico de la membrana.
Desde un punto de vista práctico, el potencial Z es el potencial eléctrico en la interfase sangre/membrana debido a la presencia de cargas electronegativas ubicado en la capa interna (skin layer) de la membrana. La magnitud del potencial Z indica el grado de repulsión electrostática (o atracción de cargas opuestas) entre la membrana y las partículas cargadas en una dispersión. Esta característica potencialmente influye en las interacciones con diferentes patrones moleculares de la sangre que fluye a través del capilar y puede facilitar o interferir con la capacidad de adsorción de sustancias específicas. De esta forma, la electronegatividad superficial puede influir en la biocompatibilidad de la membrana.
El contacto de la sangre con los componentes del circuito extracorporeo de diálisis produce una respuesta inflamatoria organizada. Un producto es más biocompatible cuanto menor es la magnitud de estas reacciones adversas.
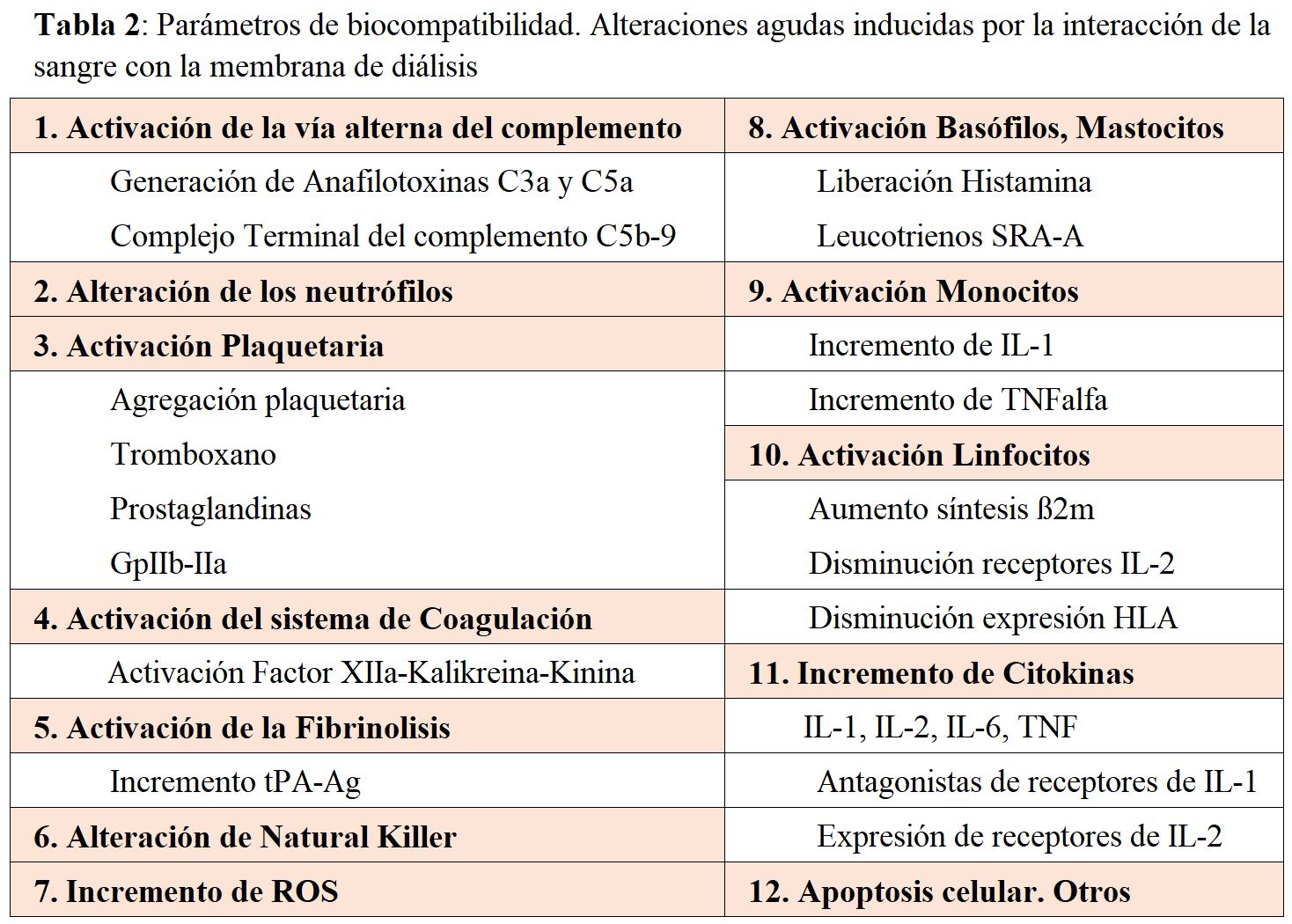
Las alteraciones agudas inducidas por la interacción de la sangre con la membrana de diálisis se describen en la (Tabla 2). Los dos principales mecanismos que modulan la biocompatibilidad son la transformación de las proteínas plasmáticas y la activación de las células sanguíneas.
Activación del complementoLa activación de la vía alterna del complemento se relaciona con la estructura polisacárida de la membrana y en concreto a los grupos hidroxilo. Como resultado de esta activación, se induce la liberación de anafilatoxinas (C3a, C5a) y de otros productos biológicamente activos (C3b, iC3b, C5b-C9). El pico máximo de C5a ocurre a los 15 minutos de iniciada la HD, con un descenso paulatino de sus niveles hasta los 90 minutos. El C3a y C5a son inmediatamente convertidos a C3adesArg y C5adesArg por la N-carboxipeptidasa sérica, por lo que son raras las reacciones anafilactoides agudas inducidas por la activación del complemento intradiálisis. Sin embargo, la C3adesArg y C5adesArg mantienen su capacidad de activación y modulación de los leucocitos periféricos, liberación de ß2-microglobulina (ß2m) por las células mononucleares de sangre periférica, producción de IL-1 por los monocitos y liberación de las especies reactivas de oxígeno.
Leucopenia-NeutropeniaAl inicio de la diálisis se produce una leucopenia transitoria debida a una leucoagregación pulmonar, que se correlaciona temporalmente con la activación del complemento. El número de neutrófilos disminuye a los 2-5 minutos, alcanza un mínimo a los 15-30 y revierte a los 60 minutos, llegando al final de la diálisis a observarse un rebote, alcanzando aproximadamente un 130% de los que tenía prediálisis. El grado de leucopenia, preferentemente neutropenia, está íntimamente relacionado con el tipo de membrana. Cuando los pacientes se dializan con membranas celulósicas modificadas y polímeros sintéticos la leucopenia es menor que con el cuprofán, siendo mínima con las membranas sintéticas de alta permeabilidad.
Moléculas de AdhesiónLa leucopenia se ha relacionado con alteraciones de los receptores de superficie de los neutrófilos. Cuando se utilizan membranas biocompatibles no se producen cambios en los receptores de superficie granulocitarios, no se activa el complemento y no se produce la neutropenia.
Activación Celular. Liberación de citokinasDurante el procedimiento de la diálisis se ha observado una importante activación de leucocitos, monocitos, natural killer y linfocitos T. La activación de monocitos induce liberación de citokinas (IL-1, IL-2, IL-6 y TNF-¿), que son agentes con una potente actividad proinflamatoria, catabólica e inmunoreguladora. Se ha observado en pacientes dializados niveles aumentados de IL-1, IL-6 y TNF-¿.
Sistema de la coagulaciónLa activación de la vía intrínseca de la coagulación, representada fundamentalmente por el factor XII (Hageman), kininógeno de alto PM (HWMK), prekalicreina, kalicreína y factor XI, se produce durante la interacción de la sangre con la membrana de diálisis. La kalicreina actúa sobre el HWMK e induce la generación de la bradikinina, un péptido vasoactivo. Además, se ha descrito una mayor activación plaquetaria durante la HD, que es de menor intensidad con membranas biocompatibles de alta permeabilidad.
FibrinolisisLas membranas celulósicas incrementan más la actividad fibrinolítica que las sintéticas, por la liberación del activador tisular del plasminógeno. En el momento presente la definición de la biocompatibilidad de los dializadores viene determinada por un gran número de factores, incluyendo además de la composición de la membrana de diálisis, el modo de esterilización y las condiciones de su utilización. Actualmente, se está prestando mayor atención al grado de permeabilidad que al de biocompatibilidad, aunque son factores difíciles de analizar por separado, ya que generalmente las membranas sintéticas de alta permeabilidad son simultáneamente las más biocompatibles.
Reacciones a la membrana de AN69Se ha demostrado que las membranas PAN (AN69) sulfonadas están asociadas con concentraciones más bajas de anafilatoxinas C3a y C5a en la circulación durante la hemodiálisis en comparación con las membranas celulósicas. Sin embargo, la biocompatibilidad de las membranas AN69 parece ser dependiente de su capacidad para adsorber los productos de complemento activado generados después de su activación en la superficie y no necesariamente porque la membrana sea completamente inerte.
Las versiones no modificadas de membranas AN69 demostraron una mayor capacidad para activar el factor Hageman y generar calicreína y bradiquinina. Estas propiedades pueden estar relacionadas con la carga negativa en la membrana AN69 no modificada. Debido a la capacidad bien conocida de los inhibidores de la ECA para inhibir la enzima quinasa II, se ha formulado la hipótesis de que las reacciones anafilácticas observadas con AN69 no modificado durante la diálisis en pacientes que toman inhibidores de la ECA depende de la reducción en la inactivación de las bradiquininas generadas en la interfaz sangre/membrana [8]. Sin embargo, en las membranas AN69 utilizadas actualmente tales reacciones se han eliminado esencialmente por modificación de la superficie con una menor electronegatividad.
Reacciones a la membrana de PolisulfonaDesde hace tiempo se describen reacciones agudas con membranas pertenecientes a la familia de las poliarilsulfonas (polisulfona/ polietersulfona, PSu/PESu). Las manifestaciones, por lo general ocurren dentro de los primeros 30 minutos de diálisis, e incluyen disnea (69%), hipotensión (66%), hipoxia (44%), broncoespasmo (25%), dolor torácico (22%), prurito y/o urticaria (22%) y síntomas abdominales (22%). Solo pudieron tratarse de una manera segura con dializadores de celulosa sustituida, poliacrilonitrilo o polimetilmetacrilato. En todos los casos la reexposición repitió el cuadro incluso con mayor severidad [9]. La polisulfona, en comparación con el triacetato de celulosa, produce una mayor activación del receptor de membrana de las plaquetas GPIIb/IIIa. Esta glicoproteína es el receptor para el fibrinógeno que media en la agregación y la adhesión plaquetaria y podría ser un marcador de biocompatibilidad. Además, se ha demostrado que ambas membranas permiten la adsorción de diferentes proteínas plasmáticas. Por otra parte, el triacetato de celulosa, membrana que en estos pacientes está ausente de reacción es capaz de adsorber una gran cantidad de albúmina y apolipoproteínas, lo que incrementaría su biocompatibilidad y reduciría la agregación plaquetaria. Por otra parte, la PVP que llevan la mayoría de las membranas de polisulfona (y no la de triacetato de celulosa) podría desempeñar un papel. La PVP es un conocido alérgeno que se utiliza para hidrolizar la membrana e inhibir su interacción con las proteínas plasmáticas y las plaquetas. Su liberación al torrente circulatorio durante la HD puede dar lugar a una reacción anafiláctica grave. Los dializadores PSu / PESu que provocaron reacciones agudas no diferían en permeabilidad hidráulica, método de esterilización y material de la carcasa. Lo que apunta al material de la membrana como el único factor común reconocible [10] [11].
PermeabilidadLa permeabilidad al agua y solutos es una de las principales características que permiten la clasificación de las membranas.
Permeabilidad al aguaLa permeabilidad viene determinada por el coeficiente de ultrafiltración (KUf), considerándose de baja permeabilidad (bajo-flujo) cuando el KUf es 0,7. Es frecuente encontrar en el mercado membranas con la misma composición y diferente grado de permeabilidad. Se están desarrollando dializadores con una elevada permeabilidad denominados super-flux, para intentar la eliminación de moléculas de alto peso molecular [6]. El principal inconveniente de esta alta permeabilidad es la posibilidad de eliminar solutos no deseados como la albúmina, En la actualidad, tienen aplicaciones clínicas concretas como es la eliminación de cadenas ligeras. La tendencia actual es usar dializadores con un KUf > 40 ml/hora/mmHg.
Permeabilidad a los solutosOtra forma de clasificar los dializadores es según su eficacia depuradora (KoA), considerándose de baja eficacia (KoA < 700). El KoA está modulado por la porosidad y el espesor de la membrana y es dependiente del tamaño del soluto, del flujo de sangre y del líquido de diálisis. Las pequeñas moléculas (hasta 500 daltons) se depuran con facilidad por mecanismo difusivo, y en general, con cualquier tipo de membrana. La eficacia convectiva de las membranas sintéticas es muy superior a la de las celulósicas, motivo por el que logran una mejor depuración de las medianas moléculas (PM 500-5.000 daltons) y de ß2m (11.900 daltons). Para incrementar la eficacia depuradora de la diálisis se puede incrementar el flujo de sangre y líquido de diálisis, aumentar la superficie de la membrana, incrementar la duración y/o la frecuencia de la sesión. Para conseguir una mayor eficacia se ha reducido el espesor de las fibras y su disposición para mejorar el intercambio.
Los sistemas de clasificación actuales incorporan varios parámetros de eliminación. Ward el al [12] definieron membranas de alto flujo basándose en una combinación de permeabilidad al agua, parámetros de eliminación de ß2-microglobulina (coeficiente de tamizado / aclaramiento) y parámetros de pérdida de albúmina (coeficiente de tamizado / cantidad eliminada). Las membranas de alto flujo se definieron por una permeabilidad al agua de 20-40 ml/h/mm Hg/m2 (actualmente se tiende a >40 ml/h/mm Hg/m2), coeficiente de cribado de ß2-microglobulina de 0.7-0.8 y pérdida de albúmina (basado en un tratamiento HD de 4 h) < 3.5 g por sesión.
Ocasionalmente, algunas membranas se han denominado "super-flux" pero esta clase también incluyen el concepto de coeficiente de cribado de ß2m > 0.6. En algunos otros casos, las membranas con muy alta permeabilidad al agua han sido definidas en base a sus características de tamizado. Por ejemplo, membranas de alto cut-off han sido definidas no solo por su alta permeabilidad hidráulica sino también por pérdida de albúmina.
Beneficios de la alta permeabilidad DislipemiaTrabajos recientes sugieren una mejoría del perfil de lipoproteínas empleando membranas de alta permeabilidad. En un estudio prospectivo randomizado cruzado, se ha demostrado el efecto tanto de la permeabilidad como de la composición de la membrana sobre la dislipemia, observándose también una reducción de la LDL oxidada, un indicador de estrés oxidativo.
Amiloidosis asociada a la diálisisSe ha observado una menor prevalencia de síndrome del túnel carpiano y mejoría de dolores articulares en pacientes dializados con membranas de alta permeabilidad. Se considera que las membranas celulósicas de baja permeabilidad, además de presentar una depuración casi nula de ß2m, incrementan su síntesis y liberación, favoreciendo la polimerización de la ß2m en fibrilla amiloide. Independientemente, del papel jugado por la permeabilidad de la membrana, un factor determinante ha sido la utilización de líquido de diálisis ultrapuro.
AnemiaNo se ha demostrado de forma contundente que usando diferentes tipos de membranas mejore la función de los hematíes, ni que los requerimientos de EPO sean menores.
Mayor conservación de la función renal residualSe ha postulado que el empleo de membranas biocompatibles de alta permeabilidad puede retrasar la perdida de función renal residual en enfermedades glomerulares no diabéticas. Sin embargo, el nivel de evidencia es muy bajo.
Respuesta inflamatoria crónicaHay un nexo entre la permeabilidad/biocompatibilidad de la membrana y la respuesta de fase aguda, con incremento de producción de citoquinas (IL-1, IL-6, IL-8 y TNF) y apoptosis celular [8]. Este proceso inflamatorio es un conocido mediador de daño tisular y vascular, y en parte podría explicar la aceleración del proceso arteriosclerótico descrito en el enfermo en diálisis. Aunque esta respuesta inflamatoria es menor empleando membranas de alta permeabilidad, no está demostrado que prevengan la rápida progresión del daño vascular en estos enfermos.
Morbilidad y mortalidadEn lo referente a la mortalidad, hay múltiples estudios que sugieren una mayor tasa de supervivencia cuando se utilizan membranas de alta permeabilidad [13] [14] [15] [16] [17], Un estudio controlado y randomizado realizado en USA, el estudio HEMO [18], no observó ninguna superioridad del alto versus el bajo flujo. Sin embargo, este trabajo ha sido muy criticado por haberse incluido pacientes prevalentes, previamente dializados en más de un 60% con alto flujo, por la reutilización de los dializadores (hasta 20 veces), limitación en la duración de la sesión de diálisis y por la potencial selección de los pacientes en lo que respecta a la edad y el índice de masa corporal. En los análisis secundarios de este estudio, se ha objetivado un potencial beneficio del alto flujo, en relación con los eventos cardiovasculares y una mayor supervivencia para los pacientes que llevan más de 3,7 años en diálisis. Curiosamente, los pacientes dializados con membranas de alto flujo presentaban una menor tasa de mortalidad cardiovascular, de desarrollo de accidentes cerebrovasculares y de hospitalización [19]. Un subanálisis del estudio HEMO [20] describe que la ß2m es un marcador indirecto de mortalidad global y de mortalidad secundaria a infecciones, lo que representa una auténtica paradoja ya que esta sustancia, con un peso molecular de aproximadamente 11.900 daltons, no se puede eliminar con una membrana de baja permeabilidad. Un estudio europeo, el MPO study (Membrane Permeability Outcome study), realizado en pacientes incidentes, sin reutilización de los dializadores, con un amplio número de sujetos evaluados durante un largo período de tiempo, ha demostrado que el uso de membranas con alta permeabilidad puede reducir la mortalidad en los pacientes con una albúmina inferior a 4 g/dl y en los diabéticos independientemente de los niveles séricos de albúmina [21]. Sin embargo, no se han observado efectos beneficiosos en los pacientes incidentes con una albúmina superior a 4 g/dl, lo que parece indicar que en una población de bajo riesgo el efecto de la membrana no parece muy relevante. Los resultados de ambos estudios, el HEMO y el MPO, sugieren que las membranas de alta permeabilidad tienen un efecto beneficioso sobre la supervivencia de algunos subgrupos de pacientes, probablemente relacionada con una mayor depuración de solutos de alto peso molecular [22] [23].
Existe un tercer estudio, que merece también ser mencionado, se trata de un análisis prospectivo randomizado bifactorial 2x2, comparando membranas de alta vs. baja permeabilidad y líquido de diálisis ultrapuro vs. convencional. En un análisis inicial no se observaron diferencias estadísticamente significativas en la mortalidad. Sin embargo, un análisis post- hoc, sugiere que existe una mejoría en la mortalidad de los pacientes que se dializaban con membranas de alta permeabilidad cuando el acceso vascular era una fístula arterio-venosa (FAVI) y en los diabéticos. Otro hallazgo interesante, es que la HD con líquido ultrapuro se asoció con una mejor supervivencia en pacientes con un tiempo de estancia en diálisis > 3 años. En el subgrupo de pacientes con FAVI, la supervivencia global más alta se observó en pacientes tratados con la combinación de dializador de alto flujo y dializado ultrapuro. Este resultado sugiere un efecto sinérgico de estas dos intervenciones. Estos hallazgos del análisis post-hoc deben ser interpretados con cautela y requieren investigación adicional para su confirmación, ya que este estudio tiene algunas limitaciones importantes [24].
Recientemente, se han publicado nuevas guías de las KDOQI sobre membranas. En sus conclusiones, se recomienda el uso de membranas de alta permeabilidad y biocompatibilidad y que, en caso, de restricciones económicas, indican su uso en pacientes con diabetes, hipoalbuminemia y un largo período de estancia en diálisis. [25]. En un análisis reciente de la Cochrane se ha descrito que la utilización de membranas de alta permeabilidad puede reducir la mortalidad cardiovascular en un 15% [17].
Actualmente, hay una tendencia a nivel mundial a utilizar membranas de alta permeabilidad [26]. Su eficacia depuradora puede ser incrementada cuando se utilizan en modalidades de diálisis con alto trasporte convectivo como es la hemodiafiltración on-line post-dilución [27] [28].
AdsorciónUna propiedad poco estudiada, pero muy interesante, es la capacidad de adsorción intrínseca de cada membrana, que permite la eliminación adicional de algunas toxinas urémicas. Generalmente, las membranas sintéticas son las que tienen una mayor capacidad de adsorción, destacando entre estas el polimetilmetacrilato, la polisulfona, la helixona, la poliamida y el poliacrilonitrilo. Sin embargo, el grado de adsorción de los dializadores tiene poca repercusión clínica, debido a la reducida superficie de la membrana y su alta capacidad de saturación, en los primeros minutos de la diálisis. Se ha descrito una alta tasa de adsorción para algunos péptidos, endotoxinas, citocinas y ß2m [2].
Otros factores relacionados con las propiedades de las membranas EsterilizaciónOtro aspecto a tener en cuenta es el modo de esterilización de los dializadores, que puede ser de tres tipos, óxido de etileno (ETO), radiación gamma y vapor. Hasta hace muy poco tiempo, la esterilización por ETO era la más utilizada ya que es la más económica y la más sencilla de realizar, prácticamente aplicable a todo tipo de membranas, con mínima alteración de la estructura del material utilizado. Su principal inconveniente es que exige un cebado más cuidadoso antes de su utilización y la posibilidad de presentar reacciones anafilactoides severas que, aunque poco frecuentes, ocasionalmente pueden ser letales, lo que está restringiendo su uso, que actualmente es casi anecdótico.
La radiación gamma es muy poco utilizada, por la potencial capacidad de alterar la estructura de la membrana y su alto coste. La esterilización por vapor se está extendiendo cada vez más para evitar las posibles complicaciones del ETO, por ser un proceso relativamente sencillo y tener un coste económico menor que el de la radiación gamma. Su único inconveniente es que, debido a las altas temperaturas requeridas para realizar la esterilización, no se puede utilizar en todos los tipos de membranas, ya que en algunos casos puede modificar su permeabilidad [1] [2].
Temperatura del líquido de diálisisSe ha descrito una menor activación del complemento al descender la temperatura del líquido de diálisis.
ReusoCuando se reutilizan los dializadores se observa menor activación del complemento y neutropenia. Este fenómeno se atribuye a la capa proteica que se deposita sobre la superficie del dializador haciéndolo más biocompatible.
Contaminación del líquido de diálisisUno de los más conocidos estimulantes de la IL-1 son las endotoxinas, que pueden estar presentes en el líquido de diálisis contaminado [2]. Esta puede ser una consecuencia negativa del uso de las membranas de alta permeabilidad, que favorecen la posibilidad de retrofiltración, por lo que es recomendable utilizar siempre líquido de diálisis ultrapuro.
Nuevos dializadoresSe han diseñado nuevos dializadores, que ha sido modificados para optimizar la eliminación de toxinas urémicas, con un amplio espectro de tamaño molecular [20][30][31]. Entre estos se encuentran los que permiten realizar la hemodiafiltración on-line intermedia, dentro de un simple dializador capilar, con un asequible coste económico. Se han modificado las cabeceras del dializador para permitir la infusión de gran cantidad de líquido de reposición después de una primera fase de post-dilución y antes de una segunda fase de pre-dilución. Los resultados son interesantes, peo no se acaba de posicionar en el mercado y es muy poco utilizado [30].
Se han realizado estudios con dializadores recubiertos con vitamina E, para valorar si su potencial efecto antioxidante, puede jugar un papel en la reducción de la ateroesclerosis y las complicaciones cardiovasculares. Los resultados preliminares obtenidos son muy interesantes, con una reducción en el estrés oxidativo, en la liberación de IL-6 por los monocitos, una mejoría de la disfunción endotelial y de la reología de los hematíes circulantes, un descenso en los requerimientos de eritropoyetina y lo que es más importante una reducción del engrosamiento de la íntima-media de las carótidas y del índice de calcificación aórtico. Persiste aún la controversia, sobre los potenciales efectos beneficiosos de estos dializadores y no se han implementado aún en la práctica clínica [33]. Se requieren estudios prospectivos controlados randomizados con un elevado número de pacientes seguidos a largo plazo, para establecer qué papel pueden realmente jugar sobre la morbi-mortalidad.
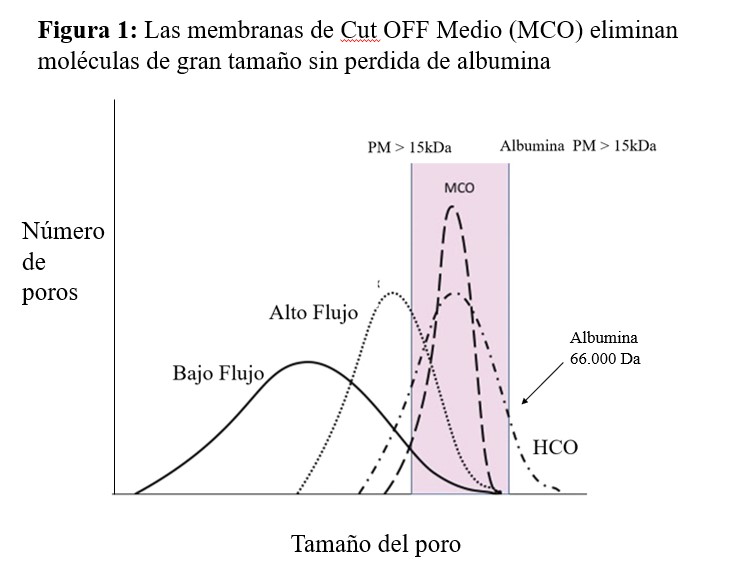
Membranas de medio y alto cut-offComo se ha mencionado previamente, los métodos convectivos podrían reducir la incidencia de las complicaciones asociadas a la retención de moléculas de peso molecular de rango medio. La hemodiafiltración en línea que es el método más utilizado en este sentido necesita máquinas específicas, los costos con líneas de diálisis son mayores y el consumo de agua aumenta. Más recientemente, se han desarrollado nuevas membranas para hemodiálisis que eliminan toxinas urémicas de rango medio y alto. Así, permiten la eliminación de una amplia gama de toxinas urémicas, sin cambiar el monitor de diálisis ni aumentar el consumo de agua. Esta terapia se conoce como hemodiálisis expandida (HDx y se logra con membranas de medio (MCO) y alto cut off (HCO)
Las membranas de medio cut-off se caracterizan por un coeficiente de cribado entre 0,1 y 0,9. Esto se ha logrado mediante una distribución ajustada del tamaño de los poros, y permite la eliminación eficaz de moléculas de peso medio a alto con poca pérdida de albúmina. [34]. Para aprovechar el potencial de las membranas MCO se desarrolló la HDx, esta nueva terapia permite incrementar el aclaramiento (K) de moléculas grandes (35). Sin embargo, debido al bajo coeficiente de difusión de las membranas MCO, también requieren convección. Esto se puede lograr de 2 maneras. Una es aumentar la ultrafiltración (KUf) que requiere reponer una gran cantidad de líquidos preparados comercialmente y utilizar dispositivos especiales para preparación de fluidos. Y otro aumentar el tamizado de la membrana con HDx, y manteniendo un KUf más bajo. Esta técnica puede realizarse utilizando equipo estándar para HD y no se necesitan líquidos especiales debido a un equilibrio con la filtración inversa [36]. El uso de las membranas MCO se está incrementando recientemente, se ha descrito que tiene una capacidad de depuración de toxinas urémicas superior a la hemodiálisis de alto flujo (Figura 1), aproximándose a la observada con la hemodiafiltración en línea postdilucional [37][38][39]. Por tanto, podría ser una alternativa en pacientes en los que no es posible realizar hemodiafiltración en línea. Estas membranas por su alto cut-off no están recomendadas para ser utilizadas en hemodiafiltración por su pérdida de albúmina. Actualmente, se está realizando un estudio español prospectivo randomizado, para evaluar sus efectos a largo plazo.
Las membranas de alto cut-off (HCO) se caracterizan por un diámetro medio de poro aumentado y una eliminación eficaz de sustancias en el rango de 20-50 kDa. Esta modificación permite el paso de proteínas más grandes y aclaramiento más eficaz de moléculas de peso molecular medio, lo que permite la eliminación del exceso de mioglobina en pacientes traumatizados, moléculas inflamatorias en sepsis o proteínas de cadena ligera en el mieloma múltiple. El principal inconveniente de este tratamiento es la pérdida de albúmina, que limita su uso en HD crónica.
Recientemente, se ha desarrollado una nueva técnica de diálisis, la hemodiafiltración con reinfusión endógena del ultrafiltrado (HFR), para lo que es necesario utilizar un dializador especialmente diseñado para esta modalidad de diálisis. Esta técnica combina la convección, la adsorción y la difusión. La HFR emplea un dializador de doble cámara con un cartucho de resina adsorbente entre ambas cámaras. La primera cámara, contiene una membrana de alto flujo donde se realiza la convección. El ultrafiltrado resultante atraviesa el cartucho de resina y es re-infundido en la segunda cámara, que contiene una membrana de bajo flujo, donde se realiza la difusión. Se ha observado, que la HFR, puede mejorar la eliminación de las toxinas urémicas unidas a proteínas, el estado inflamatorio, el daño endotelial y el estrés oxidativo en comparación con la hemodiafiltración on line [40]. Estos hallazgos, sugieren que pueden tener un efecto positivo sobre el estado clínico y la enfermedad cardiovascular. Esta técnica también se ha utilizado para optimizar la eficacia depuradora de las cadenas ligeras kappa y lambda, con excelentes resultados en el tratamiento depurativo del fracaso renal agudo en el mieloma múltiple.
ResumenAunque se ha acumulado abundante información científica sobre los efectos inducidos por el contacto de la sangre con el material de diálisis, sus consecuencias a largo plazo aún no están definitivamente establecidas. Con la información disponible, es recomendable utilizar membranas de alta permeabilidad y biocompatibilidad esterilizadas por vapor o radiación gamma, y el uso de agua ultrapura. Aunque este tema aún permanece controvertido, la principal razón para no utilizar este tipo de membranas es la económica. Actualmente, se está incrementando el uso de las membranas de MCO, por presentar mayor eficacia depuradora que las membranas de alto flujo.